Escalas clínicas aplicables en personas con VIH
Julio 2020
Notas de la Versión:
Comité de redacción
COORDINADORA
Mar Masiá
REDACTORES
José I. Bernardino
Inés Pérez Camacho
Miguel Cervero
María José Galindo
Robert Guerri
José Antonio Iribarren
Luz Martín Carbonero
José A. Muñoz-Moreno
Julián Olalla
Inés Suárez-García
María Velasco
REVISORES
José Ramón Blanco
Vicente Estrada
Hernando Knobel
Eugenia Negredo
1. INTRODUCCIÓN
Los profesionales que atendemos a personas con VIH hemos sido testigos de los cambios que se han producido en los últimos años en el curso clínico de esta infección. Después de que los eventos SIDA se hayan convertido en un hecho excepcional, la morbilidad y mortalidad están hoy día dominadas por los eventos no-SIDA, que incluyen enfermedades cardiovasculares, renales, neoplásicas, óseas, psiquiátricas o neurológicas. Hemos tenido por ello que adaptar nuestra práctica clínica y nuestra investigación a esta nueva cara de la infección. Aunque no perdamos de vista los aspectos inmunológicos y virológicos, la atención médica de las personas con VIH está en la actualidad protagonizada principalmente por sus comorbilidades. Además de compartir los factores de riesgo de la población seronegativa, las personas con VIH tienen factores propios asociados a la infección vírica y, en ocasiones, al estilo de vida, que están probablemente también implicados en la patogénesis de muchas de sus comorbilidades y que motivan una incidencia mayor de la esperable para muchas de ellas. Con el fin de preservar y/o restaurar la salud de los pacientes, nuestros esfuerzos deberían centrarse idealmente en prevenir o, al menos, en detectar precozmente estos eventos no-SIDA. Para ello disponemos de algunas herramientas que podrían ser útiles para predecir el riesgo de desarrollar determinadas comorbilidades y guiar las decisiones respecto a las medidas de prevención y de manejo.
Objetivos y alcance
En los próximos capítulos se describen las principales escalas disponibles para la predicción o el diagnóstico precoz de las comorbilidades más importantes. La mayoría de ellas se han desarrollado y validado fundamentalmente en población general, aunque existen algunas específicas para población con VIH, como las escalas de mortalidad, riesgo cardiovascular o de enfermedad renal crónica, que se presentarán a continuación y una escala española para evaluar el deterioro cognitivo, a las que se ha dedicado mayor extensión en este documento respecto a la información sobre su desarrollo y validación. Es probable que en el futuro se genere más conocimiento sobre la utilidad de estas escalas. Mientras tanto, a pesar de que existe poca evidencia sobre su influencia en el pronóstico de los pacientes, tanto del uso de las escalas como de las medidas de prevención en caso de que la escala indique riesgo elevado, los resultados pueden ser un punto de partida sobre los aspectos a los que se podría prestar una mayor atención. Por otra parte, su utilización como marcador pronóstico subrogado podría tener utilidad en el desarrollo de la investigación clínica.
Para la mayoría de las escalas existen calculadoras online del riesgo o un link que permite el acceso directo a la escala. La finalidad sería tenerlas fácilmente disponibles en el móvil o el ordenador, con el objetivo de que se pudieran aplicar in situ a los pacientes que atendemos a diario en la consulta para ayudarnos a guiar las decisiones clínicas.
Metodología
El documento se ha realizado a propuesta de la Junta Directiva de GeSIDA. Cada capítulo ha sido elaborado por uno o dos redactores y algunos de ellos han sido supervisados por un revisor. Los redactores han sido elegidos por la Junta Directiva entre todos los socios que voluntariamente han deseado participar. Uno de los miembros de GeSIDA ha actuado como coordinador, cuyo cometido ha sido ensamblar los distintos apartados y encargarse de homogeneizar la redacción y la edición final del mismo. Todos los capítulos tienen un esquema similar, que incluye las principales escalas evaluadas en población con VIH con sus ventajas y limitaciones, las escalas recomendadas por los redactores del documento, el link de acceso y los criterios de aplicación e interpretación de cada una. Los redactores han jerarquizado la recomendación sobre el uso de la escala escogida, que es habitualmente moderada por la escasez, hasta el momento, de evidencia científica de alta calidad. En esta guía la fuerza de la recomendación y gradación de la evidencia que la sustentan se basan en una modificación de los criterios de la Infectious Diseases Society of America (IDSA). Según estos criterios cada recomendación debe ofrecerse siempre (A), en general (B) u opcionalmente (C) y ello basado en la calidad de los datos obtenidos a partir de uno o más ensayos clínicos aleatorizados con resultados clínicos o de laboratorio (I), de uno o más ensayos no aleatorizados o datos observacionales de cohortes (II) o de la opinión de expertos (III).
La Tabla 1 a continuación contiene las escalas incluidas en el documento y la población susceptible de la aplicación de cada una de ellas.
Tablas:
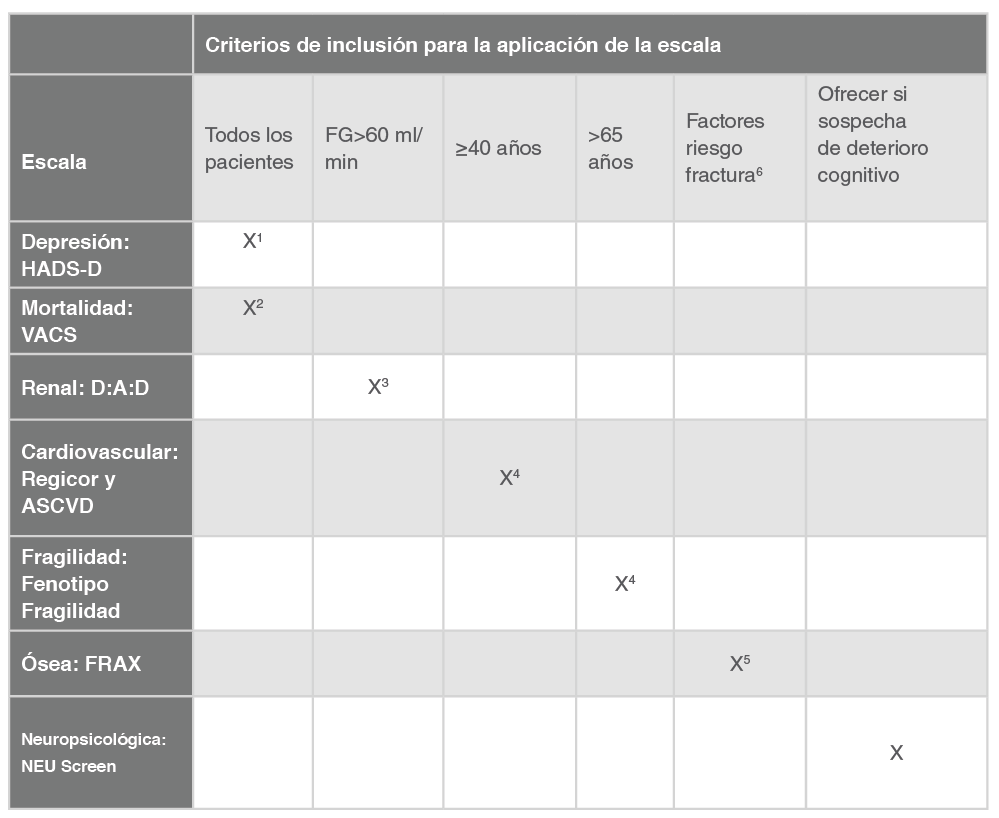
1: Cada 1-2 años
2: Periodicidad no definida
3: Al inicio o cambio del TAR y periódicamente (no definida frecuencia)
4: Anualmente
5: Repetir entre 1 y 10 años, según riesgo de fractura
6: Edad avanzada, sexo femenino, hipogonadismo, historia familiar de fractura de cadera, IMC≤19 kg/m², déficit de vitamina D, tabaquismo, ingesta de alcohol de > 3 unidades diarias, inactividad física, historia de fractura por fragilidad, exposición a corticoides (dosis mínima de 5mg de prednisona o equivalente durante > 3 meses).
5: La escala ASCVD permite calcular el riesgo vital (lifetime risk) en sujetos entre 20 y 59 años con riesgo cardiovascular bajo. Algunas guías de riesgo cardiovascular emiten recomendaciones en función de este riesgo vital para sujetos con riesgo absoluto bajo.
2. Escalas de riesgo de mortalidad
2.1. INTRODUCCIÓN
2.2. POBLACIÓN O GRUPOS DIANA DE LA ESCALA Y OBJETIVOS
2.3. ESCALAS EVALUADAS
2.4. ESCALA RECOMENDADA
INTRODUCCIÓN
Aunque se ha producido un notable incremento en la esperanza de vida de las personas que viven con VIH, aún sigue siendo menor que la de la población no infectada y este exceso de mortalidad no puede ser explicado sólo por factores directamente asociados al VIH 12. Por todo ello, han surgido diversas iniciativas para el desarrollo de indicadores pronósticos que tengan en cuenta otros factores además de los inmunológicos y virológicos, como las comorbilidades y/o la calidad en la atención de los pacientes. Algunos de estos indicadores o escalas han sido validados en diferentes poblaciones, demostrando su utilidad como predictores de mortalidad por todas las causas o de ingreso hospitalario o en unidades de cuidados intensivos 34567. El objetivo de este capítulo será revisar las distintas escalas de riesgo de mortalidad existentes en población con VIH, así como los diversos factores que han demostrado influencia en la mortalidad de los pacientes, con el fin de sugerir una escala de riesgo aplicable a la población de pacientes infectados por el VIH.
POBLACIÓN O GRUPOS DIANA DE LA ESCALA Y OBJETIVOS
Las escalas que se van a exponer a continuación se han desarrollado y validado en población con VIH de diversa índole, que incluye desde pacientes naive a tratamiento antirretroviral (TAR) mayores de 19 años a pacientes de más de 60 años con o sin TAR. El objetivo del desarrollo de estos índices de mortalidad ha sido disponer de un marcador surrogado que podría ser útil tanto para el manejo clínico de los pacientes, para conocer mejor su pronóstico y para evaluar el potencial efecto a largo plazo en el desenlace de los pacientes de determinadas actuaciones preventivas, como con fines de investigación.
ESCALAS EVALUADAS
Índice VACs (veterans Aging Cohort Study)
Programmatic Compliance Score (PCS)
Población de desarrollo: El índice VACS (Veterans Aging Cohort Study) se desarrolló y validó utilizando una muestra de 9.784 pacientes infectados por el VIH con una mediana de edad de 45 años, 98% hombres y 51% negros de la cohorte VACS 3. Los pacientes fueron incluidos de forma prospectiva al inicio de su primer régimen de TAR entre 1997 y 2002 y fueron seguidos durante 8 años. El índice VACS Tabla 1 incluye marcadores relacionados con el VIH (recuento de células CD4+, carga viral del VIH) y marcadores de daño orgánico no relacionados con el VIH (grado de fibrosis medido por “Fibrosis Index 4” [FIB4], función renal, medida por “Modified Diet in Renal Disease” (MDRD), anemia y presencia de hepatitis crónica C), todos ellos previamente asociados con mortalidad. El modelo se ajustó por edad e historia de uso de drogas intravenosas (UDI). Tanto los marcadores relacionados con el VIH como los no relacionados se asociaron individualmente con mortalidad en la cohorte, pero la capacidad de discriminación aumentó al combinarlos todos. Aunque en la actualidad se considera a las personas que alguna vez han sido diagnosticadas de infección por virus C como coinfectadas, independientemente de si han recibido o no tratamiento, esta definición podría cambiar cuando se disponga de información a largo plazo sobre mortalidad en personas tratadas para el virus C con antivirales de acción directa. La capacidad discriminativa para la predicción de mortalidad fue mejor para periodos más cortos de supervivencia, aunque fue adecuada para intervalos de hasta 8 años (estadístico C de 0.81 para predicción de mortalidad al año y de 0.73 para mortalidad a los 8 años). La explicación sobre el uso de la escala se describe más adelante y a pie de Tabla 1.
Población de validación: El índice VACS fue validado en una muestra de 10.835 personas (78% < 50 años y 72% hombres) pertenecientes a 13 cohortes de “North American AIDS Cohort Collaboration” (NA-ACCORD) en TAR durante al menos 1 año, desde el año 2000 al 2007 4 y que fueron seguidos durante 5 años tras el inicio de TAR. Se comparó la capacidad de predicción de mortalidad entre el índice VACS y un índice restrictivo compuesto por edad, recuento de células CD4+ y carga viral del VIH tanto en la cohorte NA-ACCORD como en la VACS. La capacidad discriminativa del índice VACS fue superior a la del índice restrictivo tanto en la cohorte NA-ACCORD como en la cohorte VACS; estadístico C para índice VACS de 0,78 (IC 95% 0,75-0,79) y para índice restrictivo de 0,74 (IC 95% 0,72-0,77) en la cohorte NA-ACCORD y estadístico C de 0,78 (IC 95% 0,77-0,80) para índice VACS y para índice restrictivo de 0,72 (0,70-0,74) en la cohorte VACS. Asimismo fue validado en cohortes procedentes de Europa y Estados Unidos, “Antiretroviral Therapy Cohort Collaboration“ (ART-CC) que incluyeron a 3.146 pacientes tratados durante 1 año 5. Se evaluó la mortalidad hasta 6 años tras el inicio de TAR. Al igual que en la cohorte NA-ACCORD en la predicción de mortalidad a los 5 años de TAR, la capacidad discriminativa del índice VACS fue superior a la del índice restrictivo (estadístico C de 0,78 versus 0,72, p<0,001).
El índice VACS ha sido evaluado también en diversos escenarios, como el de los pacientes de la cohorte OPTIMA 6, que habían sido intensamente pretratados y tenían enfermedad avanzada y multirresistencia, y en quienes demostró buena capacidad discriminativa (AUC de 0,74) y, lo que es importante, capacidad para predecir el cambio en el pronóstico con una intervención sobre el TAR; o en pacientes de la cohorte de militares norteamericana HNS 7, que incluyó a 1.569 personas con VIH, mayoritariamente hombres jóvenes (edad mediana 34 años) y sanos, en quienes el estadístico C de Harrell para predecir mortalidad al año fue de 0,78. Además, en mujeres infectadas por VIH trabajadoras del sexo que iniciaban TAR y que presentaban síntomas depresivos, demostró predecir de forma adecuada la mortalidad a los 5 años del inicio 8. Del mismo modo, el índice VACS fue un factor independiente asociado a mortalidad a los 3 años en mujeres de edad media infectadas por VIH de la cohorte “Women’s Interagency HIV Study” (WIHS) en TAR con una hazard ratio de 2,20 (IC 95% 1,83, 2,65) 9.
La adición de ciertos parámetros al índice VACS ha demostrado que mejora la capacidad de predicción de la mortalidad 1011. El índice VACS sumado a los niveles de albúmina, recuento de leucocitos e índice de masa corporal mejora el estadístico C, tanto en la cohorte VACS (de 0,77 a 0,80) como en la cohorte ART-CC (de 0,80 a 0,83) 10. El dímero D unido al índice VACS supuso un índice de mejora neta de reclasificación (NRI) del 7% y la suma del biomarcador de activación de monocitos resultó en un NRI del 4% 11. Por otra parte, cuando se utilizaron variables actualizadas en el tiempo, la capacidad predictiva del modelo mejoró en relación con las variables basales, lo que implica que puede ser útil para evaluar la eficacia de las intervenciones en el riesgo de mortalidad 12.
Ventajas: ha sido ampliamente validado y ha demostrado su utilidad para predecir mortalidad en distintas cohortes y distintos escenarios. Es útil para predecir mortalidad no sólo en el primer año tras inicio de TAR, sino también en años posteriores, y es la de más largo seguimiento de los pacientes.
Limitaciones: Su estadístico C está por debajo de 0,8 y no recoge tampoco algunas variables que se han asociado con mortalidad como tabaquismo, pérdida de seguimiento, depresión, nivel de estudios o UDI. Con esta escala, además, no se miden tampoco algunos indicadores de la calidad de la atención a los pacientes que pueden influir en su pronóstico (periodicidad de visitas, adecuación del TAR a las guías, etc), aunque algunos de los parámetros del VACS (fundamentalmente CV y CD4+ y, en mejor medida, la anemia) pueden actuar como marcadores subrogados de estos indicadores.
b. Programmatic Compliance Score (PCS)
Población de desarrollo: Lima y cols 13 desarrollaron un modelo denominado “Programmatic Compliance Score (PCS)” que incluyó 6 indicadores de calidad para evaluar el impacto en mortalidad por cualquier causa de la no adherencia a las guías de la IAS-USA de tratamiento antirretroviral. Incluye indicadores de proceso y resultados recogidos durante el primer año de TAR Tabla 2. Cada uno de ellos puntúa con 1 punto si no existe adherencia adecuada a las guías. Estos indicadores se aplicaron de manera prospectiva a una cohorte de 3.543 pacientes naïve ≥ 19 años que iniciaron TAR entre 2000 y 2009. Se incluyeron pacientes de British Columbia Centre for Excellence in HIV/ AIDS (Canadá), que fueron seguidos durante una mediana de 44 (22–77) meses hasta 2010.
Todos los indicadores se asociaron con mortalidad por todas las causas y una puntuación PCS ≥ 4 se asoció de forma significativa con una mayor probabilidad de muerte (38% versus 20%, 12%, 7% y 2% para puntaciones de 3, 2, 1 y 0, respectivamente; p=0,0001). La odds ratio (OR) de mortalidad para PCS de 1, 2, 3, 4 o más versus 0 fueron respectivamente 3,81 (IC 95% 1,73–8,42), 7,97 (IC 95% 3,70–17,18), 11,51 (IC 95% 5,28–25,08), y 22,37 (IC 95% 10,46–47,84). El análisis de sensibilidad realizado en los individuos que iniciaron TAR entre 2006 y 2009 confirmó estos resultados.
Población de validación: Kesselring y Cols validaron la escala PCS en la cohorte prospectiva “Canadian Observational Cohort Collaboration (CANOC)”, que incluyó a 7.460 participantes que iniciaron TAR entre los años 2000 y 2011 14. Todos los indicadores de PCS se asociaron con mortalidad, excepto el inicio de TAR con un régimen diferente a los recomendados por las guías. Al igual que en la cohorte de British Columbia, las puntuaciones más elevadas en la escala PCS se asociaron a una mayor probabilidad de muerte; los individuos con una puntuación ≥ 4 tuvieron un cociente de riesgo ajustado (HRa) por edad, sexo, región, año inicio TAR, carga viral basal y hepatitis C, de 2,15 (IC 95% 1,43–3,22) para mortalidad. Además, observaron que las mujeres, los infectados por VHC, los individuos más jóvenes y aquellos que iniciaron TAR en una etapa más temprana tuvieron significativamente puntuaciones más elevadas, aumentando el riesgo de mal pronóstico.
Ventajas: es una escala de fácil uso y tiene buena capacidad predictora, especialmente en el periodo 2006-2009.
Limitaciones: la principal es la ausencia de validación, ya que se ha evaluado únicamente en una población muy concreta de Canadá y esto puede no ser extrapolable a otras cohortes. El segundo aspecto a tener en cuenta es que analiza el riesgo de muerte durante todo el período de seguimiento pero utilizando parámetros recogidos basalmente o durante el primer año de TAR. Aunque es cierto que se trata de un punto crítico que tiene una gran influencia en el pronóstico a medio y largo plazo, este modelo no puede ser aplicable a personas que se encuentren en otro punto evolutivo del seguimiento. Otro aspecto que no debe pasar desapercibido es el hecho de que el análisis se haya realizado con individuos infectados por el VIH que recibieron TAR entre los años 2000 y 2011, siendo la mortalidad en la cohorte de 33/1000 pacientes-año, claramente superior a la actual. El TAR ha cambiado en los últimos años, en que la familia de los INI es la de elección como tercer fármaco, con una tasa de mutaciones basales de resistencia prácticamente nula. Sería por tanto necesario evaluar si todos estos indicadores continúan en el momento actual asociándose con mayor probabilidad de muerte. La explicación sobre el uso de la escala se describe a pie de la Tabla 2.
c. Dat´AIDS score
Población de desarrollo: Esta escala se desarrolló en 1.415 pacientes ≥60 años de la cohorte multicéntrica francesa Dat’AIDS entre 2008 y 2013 con un seguimiento de 5 años 15. La escala se elaboró incluyendo 8 variables: edad, recuento de CD4, existencia de neoplasia no SIDA, enfermedad cardiovascular, filtrado glomerular estimado, cirrosis, bajo índice de masa corporal y anemia. Cada una de ellas puntúa entre 0 y 16 puntos. Se definieron 4 categorías de riesgo de mortalidad por cualquier causa a 5 años: riesgo bajo (≤3 puntos), moderado (4-13 puntos), alto (14-20 puntos) y muy alto (>20 puntos), cuya probabilidad de supervivencia a 5 años era de 0.95 (IC 95% 0,93-0,97), 0,90 (IC95% 0,87-0,92), 0,77 (IC 95% 0,68-0,84) y 0,54 (IC 95% 0,43- 0,63), respectivamente. La escala mostró una buena discriminación (estadístico C de 0,76) y buena calibración.
Ventajas: es una escala específica para población anciana, incluye diversas comorbilidades, la muestra incluida es representativa de la era tardía del TAR y tiene una adecuada capacidad de discriminación.
Limitaciones: no validada, no incluye demencia y deterioro cognitivo entre las comorbilidades, no incluye hepatitis C, la ecuación no es adecuada para puntuaciones por encima de 30 puntos y no es útil para realizar una predicción superior a 5 años.
d. Indicadores de calidad GeSIDA
En el año 2010 el Grupo Español de Estudio de SIDA (GeSIDA) elaboró, por consenso de sus autores, un listado de 66 indicadores, de los que 22 fueron considerados como más relevantes 16 y fueron validados en 7 centros hospitalarios, donde demostraron que eran fiables y factibles, aunque el cumplimiento fue muy variable entre los diferentes indicadores y centros 17.
Población de desarrollo: Delgado-Mejía et al 18 propusieron determinar cuáles de estos indicadores se relacionaban con mortalidad e ingreso hospitalario. Para ello, los evaluaron en el seno de una cohorte retrospectiva que incluyó a 1.944 pacientes con mediana de edad de 37 años y 78.8% hombres que acudieron a su primera visita en el Hospital Universitario Son Espases de Palma de Mallorca entre 2000 y 2012. El tiempo medio de seguimiento fue de 9,1 años, durante los cuáles 197 pacientes (10%) murieron. Los indicadores asociados a mortalidad en individuos que iniciaron el seguimiento fueron: el diagnóstico tardío en asistencia especializada, con una OR de 1.78 (IC 95% 1.09-2,89) y como indicadores protectores, periodicidad de las visitas (seguimiento regular), con OR de 0,39 (IC 95% 0.23-0.66) y detección de infección latente tuberculosa, con OR de 0.60
(IC 95% 0,36-0,98) ajustando por historia de adicción a drogas por vía intravenosa y edad. En relación a las personas que iniciaron TAR, los indicadores asociados a mortalidad fueron: el diagnóstico tardío en asistencia especializada, con una OR de 1,70 (IC 95% 0,96-3,02) y los siguientes indicadores protectores: periodicidad de las visitas, con OR de 0,54 (IC 95% 0,29-1,02), detección de infección latente tuberculosa, con OR de 0,58 (IC 95% 0,32-1,06), adecuación del TAR de inicio a las guías de GeSIDA, con OR de 0,06 (IC 95% 0,02-0,26) y carga viral de VIH indetectable en semana 48 de tratamiento, con OR de 0,24 (IC 95% 0,13-0,44) ajustando igualmente por UDI y edad. El área bajo la curva ROC para la tasa de mortalidad de individuos en seguimiento fue de 0,78 y para los que iniciaron TAR de 0,85.
Ventajas: fácil aplicación, desarrollada en una cohorte española.
Limitaciones: se trata de una cohorte retrospectiva con lo que es posible que cierta información no haya podido recogerse y los datos se obtuvieron en 2010. Del mismo modo, este modelo necesitaría aplicarse a una cohorte de mayor tamaño para ser validado. Existe una actualización en marcha. En la Tabla 3 se decriben algunas de las características de las principales escalas predictoras de mortalidad en población con VIH.
ESCALA RECOMENDADA
La única escala de mortalidad validada es el índice VACS Tabla 1 y por tanto es la escala elegida por los redactores del documento (BII).
Calculadora: https://vacs.med.yale.edu/calculator/IC
- Criterios de inclusión:Aunque se desarrolló en una población concreta 3, se ha validado en pacientes de muy diversas características, por lo que podría aplicarse a un amplio espectro de población con VIH.
- Explicación sobre su uso e interpretación de los valores: A cada variable se le asigna una puntuación. En función de la puntuación obtenida, a través de una calculadora se estima la probabilidad de mortalidad. Por ejemplo, con 0 puntos la probabilidad de muerte a los 5 años es de 1,8%; con 6 es de 2,8%; y con 83 puntos de 59,3%. Las explicaciones se incluyen también a pie de la Tabla 1.
- Recomendaciones en función de los valores obtenidos: Aunque no existe todavía suficiente evidencia científica que lo apoye, la utilización de una escala pronóstica puede ser útil para evaluar la utilidad de determinadas medidas relacionadas con el estilo de vida o terapéuticas sobre la salud y el pronóstico. El hecho de que se haya observado que mejora la capacidad predictiva con la escala VACS cuando se utilizan variables actualizadas en el tiempo podría implicar que el pronóstico de los pacientes es susceptible de modificarse con la actuación clínica. La validación de los indicadores de calidad de GeSIDA en una cohorte más amplia, podría complementar la información obtenida por el índice VACS y potencialmente mejorar su capacidad predictora pronóstica.
Tablas:
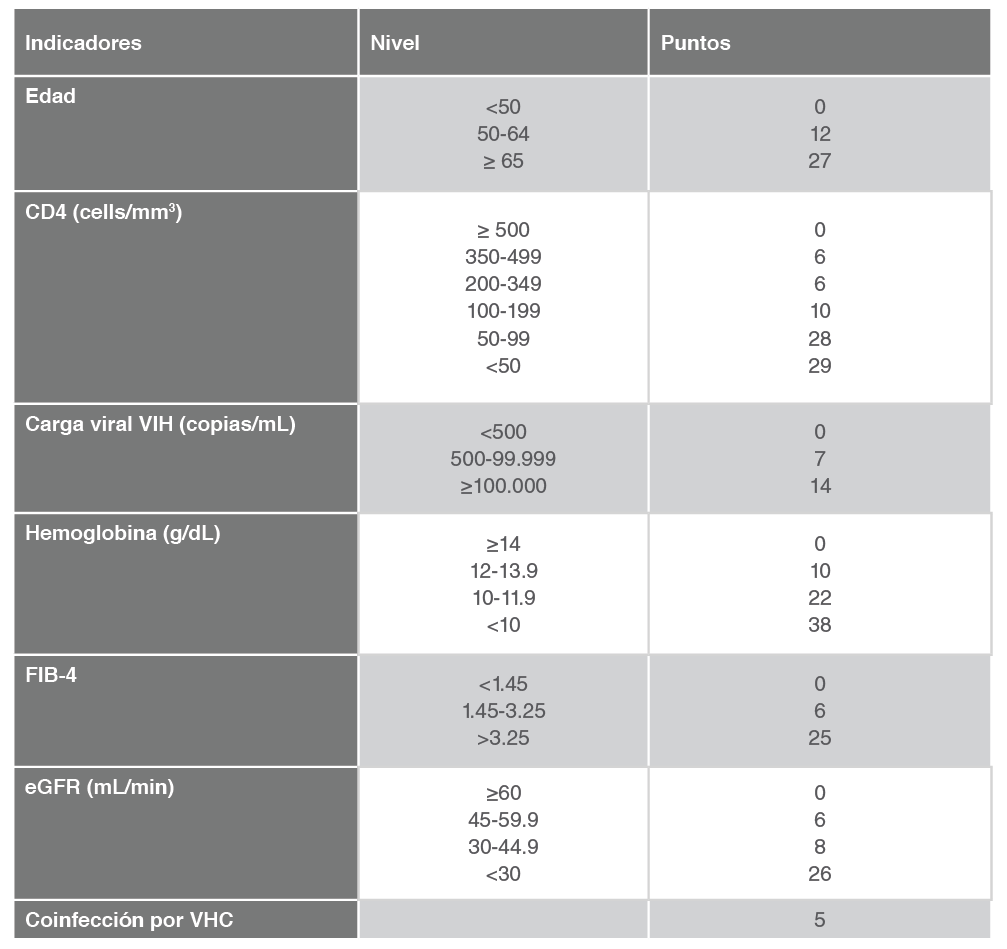
En función de la puntuación obtenida, a través de una calculadora se estima la probabilidad de mortalidad. Por ejemplo, con 0 puntos la probabilidad de muerte a los 5 años es 1.8%; con 6 es 2.8%; y con 83 puntos del 59.3%
Calculadora: https://vacs.med.yale.edu/calculator/IC

Interpretación: En el estudio original, tras un seguimiento de 44 meses, la probabilidad de muerte fue:
- ≥4 puntos: 38%
- 3 puntos: 20%
- 2 puntos; 12%
- 1 punto: 7%
- 0 puntos: 2%

PVVIH, personas que viven con VIH; IMC, índice de masa corporal; AUC, área bajo la curva; TAR, tratamiento antirretroviral.
Bibliografía:
Farahani M, Mulinder H, Farahani A, Marlink R. Prevalence and distribution of non-AIDS causes of death among HIV-infected individuals receiving antiretroviral therapy: a systematic review and meta- Int J STD AIDS 2017;28:636-50.
Alejos B, Hernando V, Iribarren J, González-García J, Hernando A, Santos J, et al. Overall and cause- specific excess mortality in HIV-positive persons compared with the general population: Role of HCV Medicine (Baltimore) 2016;95:e4727.
Justice AC, McGinnis KA, Skanderson M, Chang CC, Gibert CL, Goetz MB, et al. Towards a combined prognostic index for survival in HIV infection: the role of non-HIV HIV Med 2010;11:143–51.
Justice AC1, Modur SP, Tate JP, Althoff KN, Jacobson LP, Gebo KA, et al. Predictive accuracy of the Veterans Aging Cohort Study index for mortality with HIV infection: a North American cross cohort J Acquir Immune Defic Syndr 2013;62:149-63.
Tate JP, Justice AC, Hughes MD, Bonnet F, Reiss P, Mocroft A, et An internationally generalizable risk index for mortality after one year of antiretroviral therapy. AIDS 2013;27:563-72.
Brown ST, Tate JP, Kyriakides TC, Kirkwood KA, Holodniy M, Goulet JL, et The VACS index accurately predicts mortality and treatment response among multi-drug resistant HIV infected patients participating in the options in management with antiretrovirals (OPTIMA) study. PLoS One 2014;9(3):e92606.
Bebu I, Tate J, Rimland D, Macalino GE, Ganesan A, Okulicz JF, et The VACS index predicts mortality in a young, healthy HIV population starting highly active antiretroviral therapy. J Acquir Immune Defic Syndr 2014;65:226-30.
Cohen MH, Hotton AL, Hershow RC, Levine A, Bacchetti P, Golub ET, et Gender-Related Risk Factors Improve Mortality Predictive Ability of VACS Index Among HIV-Infected Women. J Acquir Immune Defic Syndr 2015;70:538-44.
Gustafson DR, Shi Q, Holman S, Minkoff H, Cohen MH, Plankey MW, et al. Predicting death over 8 years in a prospective cohort of HIV-infected women: the Women’s Interagency HIV Study. BMJ Open 2017;7:e013993.
Tate JP, Sterne JAC, Justice AC; Veterans Aging Cohort Study (VACS) and the Antiretroviral Therapy Cohort Collaboration (ART-CC). Albumin, white blood cell count, and body mass index improve discrimination of mortality in HIV-positive AIDS 2019;33:903-12.
Justice AC, Freiberg MS, Tracy R, Kuller L, Tate JP, Goetz MB, et Does an index composed of clinical data reflect effects of inflammation, coagulation, and monocyte activation on mortality among those aging with HIV? Clin Infect Dis 2012;54:984-94.
Salinas JL, Rentsch C, Marconi VC, Tate J, Budoff M, Butt AA, et al. Baseline, Time-Updated, and Cumulative HIV Care Metrics for Predicting Acute Myocardial Infarction and All-Cause Mortality.Clin Infect Dis 2016; 63:1423-30
Lima VD, Le A, Nosyk B, Barrios R, Yip B, Hogg RS, et al. Development and validation of a composite programmatic assessment tool for HIV PLoS ONE 2012;7:e47859.
Kesselring S, Cescon A, Colley G, Osborne C, Zhang W, Raboud JM, et Quality of initial HIV care in Canada: extension of a composite programmatic assessment tool for HIV therapy. HIV Med 2017;18:151-60.
Hentzien M, Delpierre C, Pugliese P, Allavena C, Jacomet C, Valantin MA, et al. Derivation and internal validation of a mortality risk index for aged people living with HIV: The Dat’AIDS PLoS One 2018; 13:e0195725
Von Wichmann MÁ, Locutura J, Blanco JR, Riera M, Suárez-Lozano I, Saura RM, et al. Indicadores de calidad asistencial de GeSIDA para la atención de personas infectadas por el VIH/SIDA. Enferm Infecc Microbiol Clin 2010;28 5:6–88.2
Riera M, Esteban H, Suarez I, Palacios R, Lozano F, Blanco JR, et al. Validación y cumplimentación de los indicadores de calidad GeSIDA en pacientes con infección por el VIH. Enferm Infecc Microbiol Clin 2016;34:346–52.
Delgado-Mejía E, Frontera-Juan G, Murillas-Angoiti J, Campins-Roselló AA, Gil-Alonso L, Peñaranda- Vera M, et al. GeSIDA quality care indicators associated with mortality and hospital admission for the care of persons infected by HIV/AIDS. Enferm Infecc Microbiol Clin 2017;35:67-75.
Helleberg M, Afzal S, Kronborg G, Larsen CS, Pedersen G, Pedersen C, et al. Mortality attributable to smoking among HIV-1-infected individuals: a nationwide, population-based cohort Clin Infect Dis 2013;56:727-34.
Helleberg M, May MT, Ingle SM, Dabis F, Reiss P, Fätkenheuer G, et al. Smoking and life expectancy among HIV-infected individuals on antiretroviral therapy in Europe and North AIDS 2015;29:221- 9.
Justice AC, McGinnis KA, Tate JP, Braithwaite RS, Bryant KJ, Cook RL, et al. Risk of mortality and physiologic injury evident with lower alcohol exposure among HIV infected compared with uninfected Drug Alcohol Depend 2016;161:95-103.
Suárez-García I, Sobrino-Vegas P, Dalmau D, Rubio R, Iribarren JA, Blanco JR, et al. Clinical outcomes of patients infected with HIV through use of injected drugs compared to patients infected through sexual transmission: late presentation, delayed anti-retroviral treatment and higher Addiction 2016;111:1235-45.
Greene M, Covinsky K, Astemborski J, Piggott DA, Brown T, Leng S, et al. The relationship of physical performance with HIV disease and AIDS 2014;28:2711-9.
Berenguer J, Rodríguez E, Miralles P, Von Wichmann MA, López-Aldeguer J, Mallolas J, et Sustained virological response to interferon plus ribavirin reduces non-liver-related mortality in patients coinfected with HIV and Hepatitis C virus. Clin Infect Dis 2012;55:728-36.
Pence BW, Mills JC, Bengtson AM, Gaynes BN, Breger TL, Cook RL, et al. Association of Increased Chronicity of Depression With HIV Appointment Attendance, Treatment Failure, and Mortality Among HIV-Infected Adults in the United JAMA Psychiatry 2018;75:379-85.
Triplette M, Justice A, Attia EF, Tate J, Brown ST, Goetz MB, et al. Markers of chronic obstructive pulmonary disease are associated with mortality in people living with AIDS 2018;32:487-93.
Sobrino-Vegas P, Moreno S, Rubio R, Viciana P, Bernardino JI, Blanco JR, et al. Impact of late presentation of HIV infection on short-, mid- and long-term mortality and causes of death in a multicenter national cohort: 2004-2013. J 2016;72:587-96.
Ndiaye B, Ould-Kaci K, Salleron J, Bataille P, Bonnevie F, Cochonat K, et al. Characteristics of and outcomes in HIV-infected patients who return to care after loss to follow-up. AIDS 2009;23:1786-9.
3. Escalas de riesgo cardiovascular
3.1. INTRODUCCIÓN
3.2. POBLACIÓN O GRUPOS DIANA DE LA ESCALA Y OBJETIVOS
3.3. ESCALAS EVALUADAS
3.4. ESCALAS RECOMENDADAS
INTRODUCCIÓN
El éxito del tratamiento antirretroviral (TAR) en los últimos años ha supuesto una disminución en la mortalidad definitoria de SIDA y un aumento en la mortalidad por otras causas. Una revisión reciente realizada en Reino Unido que incluía datos de casi 90.000 personas infectadas por VIH sitúa a las enfermedades cardiovasculares y las neoplasias como las principales causas de muerte no relacionadas con eventos SIDA 1. Otros estudios en Europa y en Estados Unidos han encontrado que las muertes por enfermedad cardiovascular oscilan entre el 8% y el 15% 23. Debido a la mayor esperanza de vida en población infectada por VIH estamos asistiendo a un aumento de las enfermedades asociadasalenvejecimiento. Enconcreto,secalculaquelasenfermedadescardiovasculares en población infectada por VIH aumentarán un 55% entre los años 2015 y 2030 4.
Múltiples estudios de cohortes han demostrado que los pacientes con infección por VIH tienen un mayor riesgo de infarto de miocardio que la población general 56 y existen evidencias de que éstos tienen un 38% más de riesgo de morir tras sufrir un infarto de miocardio que controles no infectados 7. Un meta-análisis con más de 800.000 participantes y unos 3.5 millones de personas-año de seguimiento ha puesto de manifiesto que la enfermedad cardiovascular, no solo la enfermedad coronaria, sino también el ictus y la insuficiencia cardiaca, se ha triplicado en las dos últimas décadas en personas con VIH 8. Por todo ello, en la última actualización de las Guías de la Sociedad Americana de Cardiología para la prevención y tratamiento de las dislipemias, se reconoce por primera vez a la infección por VIH como un factor potenciador del riesgo cardiovascular 9.
Un meta-análisis reciente ha demostrado el impacto que tienen los factores de riesgo cardiovascular clásicos en el desarrollo de la enfermedad coronaria en la población con infección por VIH. Cada incremento porcentual en la prevalencia de hipertensión arterial, dislipemia y tabaquismo en esta población se asocia con un incremento en el riesgo de infarto agudo de miocardio del 20%, 9% y 9% respectivamente 10. Actualmente disponemos de evidencias sobre el beneficio clínico que podría tener en pacientes infectados por VIH el control de los factores de riesgo cardiovascular. Datos procedentes de la cohorte estadounidense NA-ACCORD demuestran que el abandono del hábito tabáquico evitaría el 37% de los infartos de miocardio, y la prevención de la hipertensión arterial y de la dislipemia contribuirían a evitar un 42% y un 44%, respectivamente 11. Desde la publicación original de la ecuación de riesgo de Framingham, varias ecuaciones han sido publicadas y validadas en poblaciones diversas (Framingham original 12, REGICOR 13, ATP-III risk calculator 14, Framingham global CVD 15, PROCAM 16, QRISK 17, Reynolds risk score 18, SCORE 19, ACSVD de la AHA/ACC 20, y DAD 21), y salvo la excepción de la ecuación de riesgo del DAD, ninguna incluye variables específicas de la infección VIH.
Como se discutirá en el siguiente apartado, por lo general, las ecuaciones de riesgo existentes infra-estiman el riesgo cardiovascular en la población con infección por VIH, incluso tras los ajustes pertinentes. La mayoría de las escalas tienen una buena discriminación, es decir, separan correctamente los sujetos con episodios cardiovasculares de los que no los tienen, pero suelen tener una calibración moderada, esto es, la capacidad de la escala para predecir los episodios cardiovasculares observados.
Varias razones pueden explicar que las ecuaciones de riesgo cardiovascular no se ajusten bien a la población con infección por VIH. Las ecuaciones se diseñaron y validaron en estratos de edad más avanzada que la edad de la población VIH en las que se han aplicado; no se tiene en cuenta el posible efecto del propio virus a través de la inflamación crónica persistente y la inmunoactivación; no se ha tenido en cuenta el posible papel de los diferentes fármacos antirretrovirales (excepto en la ecuación de la DAD) y, finalmente, se asume que el efecto de los factores de riesgo cardiovascular clásicos sobre el riesgo cardiovascular en población con infección VIH es el mismo que el que se observa en la población general, y esto podría no ser cierto.
En general cuanto mayor sea el riesgo de sufrir un evento cardiovascular, ya sea a 5, 10 años o de por vida, mayor es el beneficio en la reducción absoluta del riesgo. Por este motivo, es esencial identificar a aquellos individuos en riesgo de sufrir episodios cardiovasculares para intervenir en el control de los factores de riesgo con el objetivo de reducir la morbimortalidad cardiovascular. Las escalas de estratificación del riesgo cardiovascular son una herramienta esencial para este propósito.
POBLACIÓN O GRUPOS DIANA DE LA ESCALA Y OBJETIVOS
El objetivo de las escalas de riesgo cardiovascular es el cálculo del riesgo absoluto que un individuo tiene de padecer un evento cardiovascular en un horizonte temporal determinado. El escenario de aplicación es la prevención primaria y la mayoría de las escalas diseñadas se aplican en un rango de edad entre los 30 y los 80 años. La inmensa mayoría, excepto la ecuación de la DAD cuya predicción es a 5 años, utiliza un horizonte temporal de predicción de 10 años.
Una de las mayores dificultades a la hora de interpretar la información de las ecuaciones de riesgo es la falta de uniformidad en las variables/factores de riesgo que incluyen, en las variables resultado, y en el horizonte temporal de aplicación. A estas diferencias debemos añadir el hecho de que cada ecuación ha sido estudiada y validada en poblaciones diferentes, y para su aplicación y comparación entre sí deberían ser recalibradas.
Las principales ecuaciones de riesgo evaluadas y sus características diferenciales se presentan en la Tabla 1.
ESCALAS EVALUADAS
A pesar de las escasas evidencias al respecto, se asume que el riesgo relativo de los diferentes factores de riesgo cardiovascular sobre la aparición de enfermedad coronaria es similar entre la población infectada por VIH y la población general 22. Esta afirmación es en la que se ha apoyado hasta la fecha la utilización de las escalas de riesgo cardiovascular en individuos infectados por VIH.
Como regla general, todas las ecuaciones de riesgo cardiovascular, cuando se intentan aplicar a población infectada por VIH, conservan un grado de discriminación bastante bueno, aunque la calibración es moderada. Existen resultados dispares en los estudios que han evaluado la precisión de las ecuaciones de riesgo en población con VIH, unos sobre-estiman el riesgo y otros lo infra-estiman. Una posible explicación es la falta de estudios de validación metodológicamente rigurosos con re-calibración de las ecuaciones. La mayoría de los estudios han evaluado el grado de concordancia de las diferentes escalas en una población determinada. Los tres estudios más largos y con metodología más rigurosa que han validado las escalas de riesgo cardiovascular en población con VIH son los de la cohorte DAD 23, CNICS 24 y la Partners HIV cohort 25.
a) Escala DAD
La escala diseñada por la cohorte DAD se realizó con datos de 32.663 pacientes infectados por VIH sin episodios cardiovasculares y en los que tras un periodo de seguimiento de 186.364 personas-año, se registraron 1010 episodios cardiovasculares. Es la única escala de riesgo que incluye variables específicas de la infección VIH, como el recuento de CD4 y el uso de determinados fármacos antirretrovirales. Se presentan dos versiones: una reducida en la que no se incluyen variables de fármacos antirretrovirales y otra que incluye el uso de abacavir, tiempo de tratamiento con inhibidores de la proteasa y tiempo acumulado con inhibidores de la transcriptasa inversa análogos de nucleósidos. Está disponible una calculadora online en la siguiente dirección: (https://chip.dk/Tools- Standards/Clinical-risk-scores).
Las variables incluidas en el modelo y las variables resultado se muestran en la Tabla 1. En una primera comparación con la escala de Framingham en la cohorte DAD, se objetivó que la discriminación de ambas escalas era buena, con áreas bajo la curva (estadístico C) cercanas a 0,78; sin embargo, la calibración era moderada. La escala de Framingham infra-estimaba los episodios cardiovasculares en mujeres, ex fumadores y diabéticos y sobre-estimaba en los que nunca habían sido fumadores 21. Recientemente se ha realizado una actualización y una re-calibración de la escala de Framingham dentro de la cohorte DAD con un mayor número de episodios cardiovasculares y mayor tiempo de seguimiento. En este nuevo análisis, la ecuación DAD, tanto en su versión completa como reducida, mejoró la discriminación y la capacidad predictora de eventos fue superior a la ecuación de Framingham 23. La ecuación de la DAD también se ha evaluado en la cohorte Holandesa Athena y en la HIV Outpatient Cohort Study, donde han demostrado una moderada discriminación (estadístico C de 0,77 y 0,72, respectivamente) y una calibración moderada (cociente casos esperados/casos observados de 0,74 y 0,8, respectivamente) 2627.
La principal limitación que tiene la ecuación de la DAD es la ausencia de validación externa en una cohorte independiente de individuos con infección por VIH y que los fármacos incluidos en la ecuación apenas se utilizan en la actualidad. Las validaciones que se han realizado en los estudios publicados se han realizado en sub-cohortes de la cohorte DAD.
b) Escala Framingham
La última revisión de la escala de Framingham de eventos cardiovasculares global (coronarios, cerebrovasculares, enfermedad arterial periférica e insuficiencia cardiaca) incluyó 8.491 participantes y tras 12 años de seguimiento, se registraron 1.174 episodios cardiovasculares. Las variables incluidas en el modelo y las variables resultado se muestran en la Tabla 1.
La escala de Framingham se ha evaluado en diferentes cohortes de pacientes infectados por VIH comparándose entre sí con otras escalas. En la HIV Outpatient Study (HOPS), mostró una moderada discriminación (C-statistic 0,66) y una buena calibración, con un cociente casos esperados/casos observados de 1,01 26. En el Partners HIV cohort mostró una discriminación moderada con un estadístico C de 0,67 pero una mala calibración, que no mejoró tras la recalibración del modelo 25. En la cohorte Europea Athena mostró una buena discriminación (estadístico C de 0,75) con una aceptable calibración, con un cociente casos esperados/casos observados de 1,08 27.
La ventaja que tiene la escala de Framingham, aparte de ser la referencia sobre las que se comparan todas las que se han desarrollado posteriormente, es que es la única que tiene una adaptación a la población española, la escala REGICOR. Estudios realizados en nuestro país demuestran que REGICOR predice adecuadamente los episodios coronarios en población general española 28. En nuestro país se ha iniciado un estudio para adaptar la escala Framingham-REGICOR a la población con infección VIH española. En una cohorte de Barcelona se ha encontrado que la adaptación del REGICOR para población con VIH predecía correctamente los episodios isquémicos coronarios, pero infraestimó los episodios cardiovasculares, en los que la precisión fue mayor con la escala Framingham original 29. Esta adaptación de REGICOR para población con VIH española está pendiente de validación externa en otra cohorte multicéntrica de nuestro país.
Otros estudios en diferentes cohortes europeas han puesto de manifiesto que la escala de Framingham y SCORE (ver más abajo) sobrestiman el riesgo y que el grado de concordancia entre diferentes ecuaciones a la hora de clasificar el riesgo de los pacientes con infección VIH es moderado 3031.
c) Escala AHA/ACC ASCVD
Esta escala fue diseñada por la Asociación Americana del Corazón y el Colegio de Cardiólogos Americano y se seleccionaron cuatro cohortes poblacionales de Estados Unidos que registraban episodios cardiovasculares clínicamente significativos. Las variables incluidas en el modelo y las variables resultados se muestran en la Tabla 1.
Esta escala se ha evaluado en varias cohortes de pacientes con infección VIH europeas y norteamericanas. En la mayoría de estos estudios la discriminación fue aceptable o moderada (estadístico C de 0,65 en la Partners HIV cohort; 0,76 en la cohorte europea Athena y 0,75 en la cohorte norteamericana CNICS) y la calibración fue mala, con una infraestimación general, aunque en la cohorte CNICS, que es la más extensa en la que ha sido validada, la infraestimación sólo se produjo en personas de raza negra y en aquéllas con riesgo bajo-moderado (< 7,5%) 24252627. En el estudio de la cohorte CNICS se diseñó un modelo de validación de la escala incluyendo variables específicas de la infección VIH como el recuento de CD4+, la carga viral, el tratamiento antirretroviral y el uso de inhibidores de la proteasa y no consiguió mejorar la discriminación y calibración de la escala original 24.
Una de las ventajas que tiene esta escala es la posibilidad de calcular riesgos específicos para pacientes de raza afroamericana y la posibilidad de calcular el riesgo cardiovascular a lo largo de la vida. Esto último estaría especialmente indicado en aquellos pacientes jóvenes, entre 20 y 59 años, con un riesgo cardiovascular a 10 años bajo (<7,5%). Su principal limitación es la escasa validación en cohortes fuera de Estados Unidos y que cuando se ha evaluado en la población con infección por VIH infraestima el riesgo.
d) Escala SCORE
La escala SCORE se diseñó con datos acumulados de cohortes poblacionales de 12 países europeos y la variable principal, a diferencia de las otras escalas, es mortalidad cardiovascular. Los datos provenientes de la última actualización indican que el riesgo de un episodio cardiovascular global es 3 veces superior que el riesgo de un episodio cardiovascular fatal, por lo que para calcular el riesgo de un episodio cardiovascular en un individuo basta con multiplicar el riesgo de mortalidad que nos ofrece la Tabla por 3 32. Esta escala es la recomendada por la Sociedad Europea de Cardiología y la Sociedad Europea de Aterosclerosis. La ventaja que tiene es que se ha generado con datos poblacionales de diferentes países Europeos y en su última versión se ofrecen actualizadas versiones especificas y calibradas para cada país (ver la versión para población española en: http://www.heartscore.org/es_ES).
Entre sus limitaciones cabría decir que solo predice episodios cardiovasculares fatales, no sirve para pacientes de raza no blanca, es la escala que menos se ha evaluado en población con infección VIH y, en los casos en los que se ha evaluado, es la que peor se comporta. En la cohorte HIV Outpatient Study (HOPS), tanto la discriminación (estadístico C de 0,59) como la calibración (cociente esperados/observados 1,72) fueron malas 26. En la cohorte Athena Europea la discriminación (estadístico C de 0,74) y la calibración (cociente esperados/observados 1,74) tampoco fueron las esperadas y fue inferior a la escala ASCVD y Framingham, a pesar de ser una cohorte Europea 27.
ESCALAS RECOMENDADAS
La situación ideal sería utilizar escalas generadas en cohortes de los países en las que se aplican y validadas en cohortes diferentes del mismo país. Si bien no disponemos aún de la validación de la escala Framingham-Regicor en población con infección por VIH, el estudio está en marcha. Aunque la escala ASCVD no ha sido estudiada en cohortes de pacientes españoles con infección por VIH, es la que mejor se ha comportado en los diferentes estudios comentados en este documento. Las escalas recomendadas por los redactores del documento para su uso en la consulta diaria son, por este motivo, la escala de Framingham-Regicor adaptada a la población española (BIII) y la escala de la Sociedad Americana de Cardiología AHA/ACC ASCVD (BII).
Criterios de inclusión
Los pacientes entre 40 y 75 años de edad y que no hayan tenido un evento cardiovascular deberían ser evaluados para calcular el riesgo cardiovascular con el fin de intervenir e implementar estrategias preventivas. La última versión de la Guía Europea de la Sociedad Europea de Cardiología incide en que aquellos pacientes con diabetes mellitus tipo 1 o 2, niveles muy elevados de los factores de riesgo cardiovascular individuales o enfermedad renal crónica son considerados de alto riesgo y no necesitarían el cálculo del riesgo cardiovascular por las escalas. En todos los demás casos, se recomienda el cálculo del riesgo cardiovascular y en función del resultado diseñar estrategias preventivas que incluyan cambios en el estilo de vida y/o intervenciones farmacológicas. Como regla general, cuanto mayor sea el riesgo de un individuo, mayor debe ser la intenSIDAd en las estrategias preventivas.
Escala Framingham calibrada para población española (REGICOR)
Criterios de inclusión: Esta escala se debe utilizar en aquellos pacientes entre 35 y 74 años que no hayan tenido episodios cardiovasculares previos. El resultado obtenido es la probabilidad de sufrir un episodio coronario (infarto agudo de miocardio o angina de pecho) en los siguientes 10 años.
Explicación sobre su uso e interpretación: Se deben introducir en la calculadora las siguientes variables: edad, sexo, hábito tabáquico, diagnóstico de diabetes, presión arterial sistólica y diastólica y los últimos valores de colesterol total y HDL colesterol. La escala estratifica el riesgo a 10 años en 4 categorías:
- Bajo: <5%
- Moderado: 5% -9,9%
- Alto: 10% -14,9%
- Muy alto: ≥15%
Recomendaciones en relación con los valores: Las recomendaciones de tratamiento hipolipemiante en relación con la categoría de riesgo calculado con la escala incluyen el tratamiento con estatinas cuando el riesgo estimado es alto (≥10%) y comenzar con modificación del estilo de vida con riesgo <10% 33.
Escala ASCVD de la Sociedad Americana de Cardiología
Criterios de inclusión: Esta escala está dirigida a pacientes entre 40 y 79 años de raza blanca y afroamericanos, que no hayan tenido episodios cardiovasculares previos. El resultado obtenido de la ecuación es la probabilidad de sufrir un episodio cardiovascular fatal y no fatal (infarto de miocardio, enfermedad coronaria o ictus) en los siguientes 10 años. En pacientes de menos de 40 años calcula el riesgo cardiovascular a lo largo de la vida.
Explicación sobre su uso e interpretación: Las variables que incluye en su cálculo son la edad, sexo, raza, tabaquismo, colesterol total, HDL y LDL, diabetes y presión arterial sistólica y diastólica.
Según esta escala se identifican diferentes categorías de riesgo RCV a 10 años:
- Bajo riesgo: < 5%
- Riesgo leve: entre 5% y 7,4%
- Riesgo moderado: ≥ 7,5% y < 19,9%
- Riesgo alto: ≥20%
Recomendaciones en relación con los valores: las recomendaciones de tratamiento hipolipemiante en relación con la categoría de riesgo calculado con la escala han sido recientemente actualizadas, e incluyen recomendar con riesgo ≥7,5% tratamiento con estatinas y considerar tratamiento con estatinas a partir de un riesgo ≥5% cuando coexistan otros factores que potencien el riesgo cardiovascular 34.
Por último, conviene resaltar que no disponemos hasta la fecha de estudios de intervención en población con infección por VIH que demuestren el beneficio de la intervención de los diferentes factores de riesgo en el desarrollo de episodios cardiovasculares. El estudio REPRIEVE, actualmente en marcha, nos dará información sobre la utilidad de las estatinas en prevención primaria en pacientes con infección VIH y riesgo cardiovascular leve-moderado (< 7,5%) por la escala ASCVD.
Tablas:
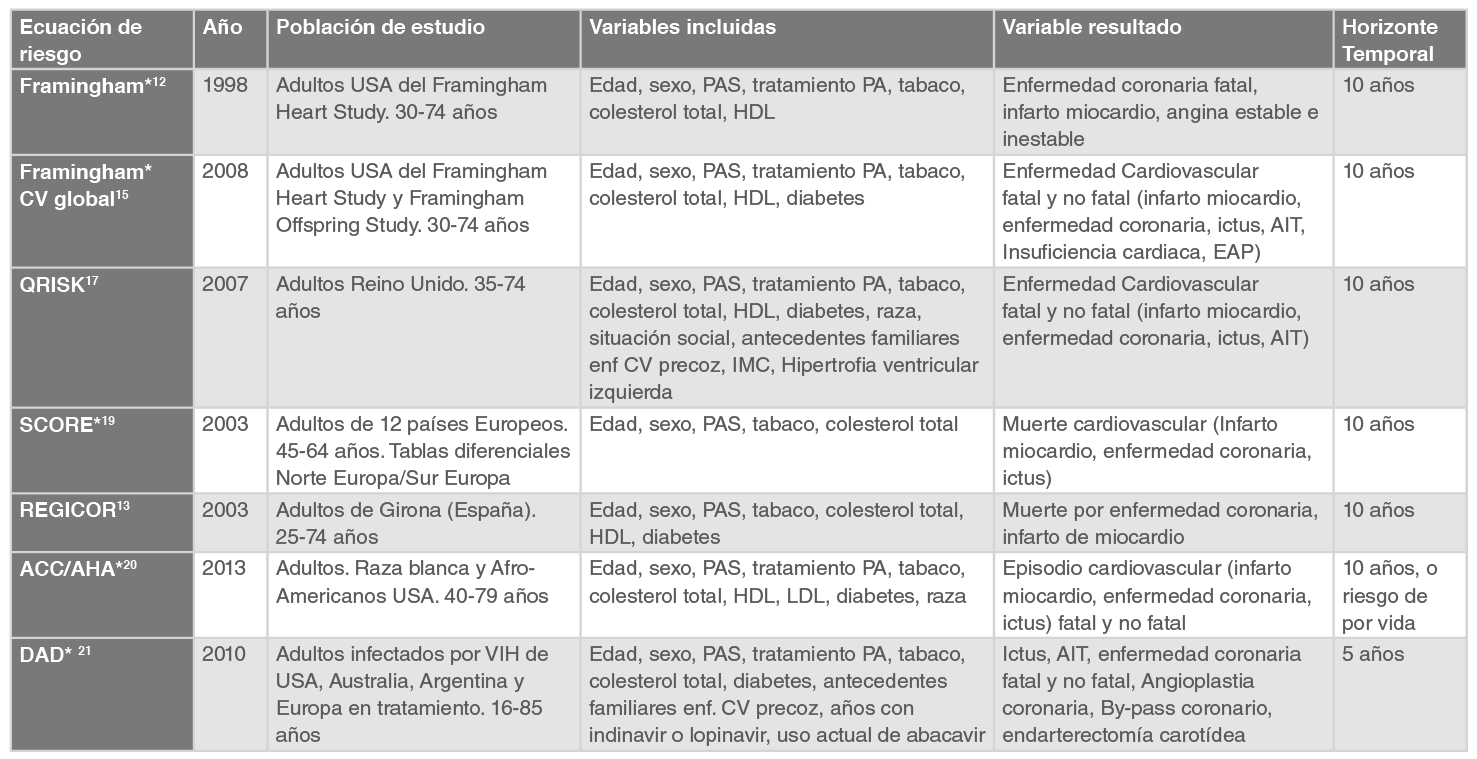
*Escala validada en población con VIH. Abreviaturas: PAS: presión arterial sistólica. PA: presión arterial. IMC: índice masa corporal. AIT: accidente isquémico transitorio. EAP: enfermedad arterial periférica
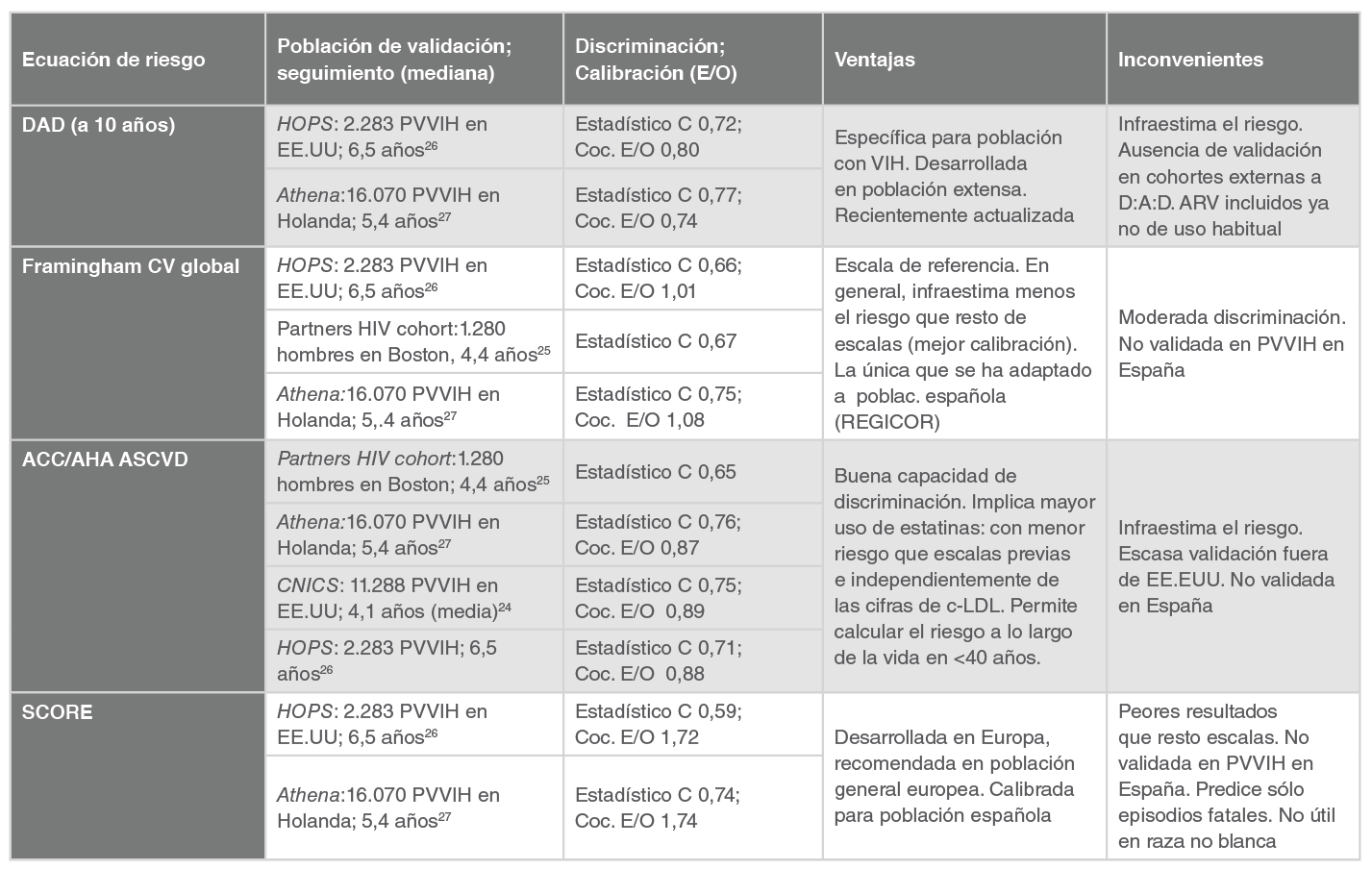
En cursiva, nombre de la cohorte de desarrollo. Coc. E/O, cociente eventos esperados/eventos observados; CV, cardiovascular; ARV, antirretrovirales; PVVIH, personas que viven con VIH; cLDL, colesterol LDL
Bibliografía:
Croxford S, Kitching A, Desai S, Kall M, Edelstein M, Skingsley A, et Mortality and causes of death in people diagnosed with HIV in the era of highly active antiretroviral therapy compared with the general population: an analysis of a national observational cohort. Lancet Public Health 2017;2: e35-46
Lewden C, May T, Rosenthal E, Burty C, Bonnet F, Costagliola D, et al. Chganges in causes of death among adults infected by HIV between 2000 and 2005: The Mortalité 2002 and 2005 surveys (ANRS EN19 and Mortavic). J Acquir Defic Syndr 2008; 48:590-598.
Palella J, Baker RK, Moorman AC, Chmiel JS, Wood KC, Brooks JT, et al. Mortality in the highly active antiretroviral therapy era: changing causes of death and disease in the HIV outpatient study. J Acquir Defic Syndr 2006; 43:27-34.
Smit M, van Zoest RA, Nichols BE, Vaartjes I, Smit C; van der Valk M, et al. Cardiovascular disease prevention policy in human immunodeficiency virus: recommendations from a modelling study. Clin Infec Dis 2018; 66: 743-750.
Freiberg MS, Chang CC, Kuller LH, Skanderson M, Lowy E, Kraemer KL, et HIV infection and the risk of acute myocardial infarction. JAMA Intern Med 2013; 172:614-622
Rao SG, Galaviz KI, Gay HC, Wei J, Armstrong WS, del Rio C, et al. Factors associated with excess myocardial infarction risk in HIV-infected adults: a systematic review and meta-analysis. J Acquir Immune Defic Syndr 2019; 81:224-230.
Pearce D, Ani C, Espinosa-Silva Y, Clark R, Fatima K, Rahman M, et al. Comparison of in-hospital mortality from acute myocardial infarction in HIV sero-positive versus sero-negative individuals. Am J Cardiol 2012; 110:1078-1084
Shah A, Stelzle D, Lee K, Beck E, Alam S, Clifford S, et Global burden of atherosclerotic cardiovascular disease in people living with HIV. Sistematic review and Meta-analysis. Circulation 2018; 138:1100-1112.
Grundy SM, Stone NJ, Bailey AL, Beam C, Birtcher KK, Blumenthal RS, et al. 2018 AHA/ACC/ AACVPR/AAPA/ABC/ACPM/ADA/AGS/APhA/ASPC/NLA/PCNA guideline on the management of blood cholesterol: a report of the American College of Cardiology/American Heart Association Task Force on
Rao SG, Galaviz KI, Gay HC, Wei J, Armstrong WS, del Rio C, et al. Factors associated with excess myocardial infarction risk in HIV-infected adults: a systematic review and meta-analysis. J Acquir Immune Defic Syndr 2019; 81:224-230
Althoff KN, Gebo KA, Moore RD, Boyd CM, Justice AC, Wong C; et al. Contributions of traditional and HIV-related risk factor son non-AIDS-defining cáncer, myocardial infarction, and end-stage liver and renal diseases in adults with HIV in the USA and Canada: a collaboration of cohort studies. Lancet HIV 2019;6:e93-104.
Wilson PW, D’Agostino RB, Levy D, Belanger AM, Silbershatz H, Kannel WB. Prediction of coronary heart disease using risk factor Circulation 1998; 97:1837-47
Marrugat J, D’Agostino RB, Sullivan L, Elosua R, Wilson P, Ordovas J, et al. An adaptation of the Framingham coronary heart disease risk function to European Mediterranean áreas. J Epidemiol Community Health 2003; 57: 634-638
Third report of the National Cholesterol Education Program (NCEP) Expert Panel on detection, evaluation, and treatment of high blood colesterol in adults (Adult Treatment Panel III) Final Report. Circulation 2002; 106:3143-3421.
D’Agostino RB Sr, Vasan RS, Pencina MJ, Wolf PA, Cobain M, Massaro JM, et General cardiovascular
Assmann G, Cullen P, Schulte H. Simple scoring scheme for calculating the risk of acute coronary events based on the 10-year follow-up of the Prospective Cardiovascular Munster (PROCAM) Circulation 2002; 105: 310–315.
Hippisley-Cox J, Coupland C, Vinogradova Y, Robson J, May M, Brindle P. Derivation and validation of QRISK, a new cardiovascular disease risk score for the United Kingdom: prospective open cohort BMJ 2007; 335: 136 –147.
Ridker PM, Buring JE, Rifai N, Cook Development and validation of improved algorithms for the assessment of global cardiovascular risk in women: the Reynolds risk score. JAMA. 2007;297:611– 619.
Conroy RM, Pyorala K, Fitzgerald AP, Sans S, Menotti A, De Backer G, et al. Estimation of ten-year risk of fatal cardiovascular disease in Europe: the SCORE Eur H J 2003; 24: 987–10.
Goff DC Jr, Lloyd-Jones DM, Bennett G, Coady S, D’Agostino RB, Gibbons R, et al. 2013ACC/AHA guideline on the assessment of cardiovascular risk: a report of the American College of Cardiology/ American Heart Association Task Force on Practice Guidelines [published correction appears in 2014;129(suppl 2):S74–S75]. Circulation. 2014;129(suppl 2):S49–S73
Friis-Møller N, Thiébaut R, Reiss P, Weber R, Monforte AD, De Wit S, El-Sadr W, Fontas E, Worm S, Kirk O, Phillips A, Sabin CA, Lundgren JD, Law MG; DAD Study Group. Predicting the risk of cardiovascular disease in HIV-infected patients: the data collection on adverse effects of anti- HIV drugs study. Eur J Cardiovasc Prev 2010;17:491–50122.
Schambelan M, Wilson PW, Yarasheski KE, Cade T, Dávila-Román VG, D’Agostino RB, et Development of apropiate coronary heart disease risk prediction models in HIV-infected patients. Circulation 2008; 118:e48-e53.
Friss-Møller N, Ryom L, Smith C, Weber R, Reiss P, Dabis F, et An updated prediction model of the global risk of cardiovascular disease in HIV-positive persons: the Data-collection on Adverse Effects of Anti-HIV Drugs (D:A:D) study. Eur J Prev Cardiol 2016; 23:214-223
Feinstein MJ, Nance RM, Drozd DR, Ning H, Delaney JA, Heckbert SR, et al. Assesing and refining myocardial infacrtion risk estimation among patients with human immunodeficiency virus: a study by the Centers for AIDS Research Network of Integrated Clinical JAMA Cardiol 2017; 2:155-162
Triant V, Perez J, Regan S, Massaro JM, Meigs JB, Grinspoon SK, D’Agostino RB Sr. Cardiovascular risk prediction functions understimate risk in HIV Circulation 2018;137:2203-2214.
Thompson-Paul AM, Lichtenstein KA, Armon C, Palella FJ Je, Skarbinski J, Chmiel JS et Cardiovascular disease risk prediction in the HIV Outpatient Study. Clin Infect Dis 2016; 63:1508-1516.
Van Zoest RA, Law M, Sabin C, Vaartjes I, van der Valk M, Arends J, et al. Predictive performance of cardiovascular disease risk prediction algorithms in people living with J Acquir Immune Defic Syndr 2019; 81:562-571.
Marrugat J, Vila J, Baena-Díez JM, Grau M, Sala J, Ramos R, Subirana I, Fitó M, Elosua R. Relative validity of the 10-year cardiovascular risk estimate in a population cohort of the REGICOR study. Rev Esp 2011;64(5):385-9.
Herrera S, Guelar A, Sorli L, Vila J, Molas E, Grau M, et The Framingham function overestimates the risk of ischemic heart disease in HIV-infected patients from Barcelona. HIV Clin Trials 2016; 17:131-139.
Dhillon S, Sabin C, Alagaratnam J, Bagkeris E, Post FA, Boffito M, et al. Level of agreement between frequently used cardiovascular risk calculators in people living with HIV. HIV Medicine 2019; 20:347-
Krikke M, Hoogeveen RC, Hoepelman AIM, Visseren FLJ, Arends Cardiovascular risk prediction in HIV-infected patients: comparing the Framingham, atherosclerotic cardiovascular disease risk score (ASCVD), systematic coronary risk evaluation for the Netherlands (SCORE-NL) and data collection on adverse events of anti-HIV drugs (DAD) risk prediction models HIV Med 2016; 17:289-297.
Mach F, Baigent C, Catapano AL, Koskinas KC, Casula M, Badimon L, et 2019 ESC/EAS Guidelines for the management of dyslidaemias: lipid modification to reduce cardiovascular risk. The taskforce for the management of dyslipidaemias of the European Society of Cardiology (ESC) and European Atherosclerosis Society (EAS). European Heart Journal 2019; 00:1-78.
https://regicor.cat/en/clinical-practice-guidelines/ (ultimo acceso 10 de Enero 2020).
Arnett DK, Blumenthal RS, Albert MA, Buroker AB, Goldberger ZD, Hahn EJ, et al. 2019 ACC/AHA Guideline on the Primary Prevention of Cardiovascular Disease: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice J Am Coll Cardiol 2019; 74:e177-e232
4. Escalas de riesgo de daño renal crónico
4.1. INTRODUCCIÓN
4.2. POBLACIÓN O GRUPOS DE LAS ESCALAS Y OBJETIVOS
4.3. ESCALAS EVALUADAS
4.4. ESCALAS RECOMENDADAS
INTRODUCCIÓN
La enfermedad renal crónica (ERC) se define como la presencia de daño renal o función renal disminuida durante al menos 3 meses, para diferenciarla del daño renal agudo. Se puede definir el daño renal como descenso del filtrado glomerular (FG) <60 ml/min, existencia de microalbuminuria o proteinuria o de alteraciones tubulares/sedimento. Todo ello se asocia con una mayor mortalidad y aparición de eventos cardiovasculares 12.
Los pacientes con infección por VIH tienen más riesgo de enfermedad renal y de ERC. El aumento de la longevidad gracias al tratamiento antirretroviral (TAR) ha ocasionado un incremento de las comorbilidades, especialmente aquéllas que son factores de riesgo para la ERC. A los factores predisponentes clásicos de ERC como la hipertensión arterial (HTA) y la diabetes mellitus (DM), hay que añadir los relacionados con el VIH, como el grado de inmunodeficiencia y determinados fármacos antirretrovirales, entre ellos el atazanavir/ritonavir (ATV/r), el lopinavir/ritonavir (LPV/r) o el tenofovir disoproxil fumarato (TDF) 123.
La prevalencia de ERC observada en pacientes con VIH es muy variable según la población analizada, su procedencia geográfica, los criterios utilizados para definir ERC y el TAR. Así, se objetivó proteinuria persistente en un 33% de mujeres de la cohorte WIHS 4 que iniciaban TAR, mientras que en la cohorte de veteranos sólo un 1% de pacientes tenía proteinuria >300 mg/día 5. Los estudios que utilizan la medida del FG <60 ml/ min/1,73m² para valorar la ERC, han encontrado una prevalencia del 1,6% (cohorte de veteranos) 5, al 3,6% (cohorte D:A:D) 6 o el 5%-7% (cohorte MACS) 7. En población africana, en la que es más frecuente la ERC, se ha descrito entre un 2% y un 38% de pacientes con disminución del FG o proteinuria 89. En Europa se ha evidenciado que la prevalencia de infección por VIH en los pacientes que están en diálisis es poco frecuente y se aproxima al 0,5% 2. En España se ha descrito una prevalencia de FG <60 ml/min del 5,1% (cohorte VACH) 10.
Dada la magnitud del problema, sería útil disponer de estimaciones del riesgo individual de desarrollo de ERC de los pacientes con el fin de optimizar su manejo clínico. La implementación de dichas escalas en la práctica diaria podría ser útil para:
- Identificar aquellos pacientes con posibilidad de desarrollar ERC y de presentar enfermedad más grave y estratificar el riesgo de progresión y de complicaciones de la ERC y de presentar enfermedad más grave y estratificar el riesgo de progresión y de complicaciones de la ERC.
- Seleccionar el tratamiento antirretroviral más adecuado para cada paciente, la intenSIDAd de la monitorización necesaria y valorar la seguridad renal de los distintos fármacos antirretrovirales en el momento de inicio y en los cambios de tratamiento.
- Identificar a las personas que pueden beneficiarse, por su mayor riesgo, de un manejo más agresivo de los factores de riesgo cardiovascular y de otros factores de riesgo.
POBLACIÓN O GRUPOS DE LAS ESCALAS Y OBJETIVOS
La población incluida en las escalas ha sido personas con VIH con FG conservado (>60 ml/min) y naive a TAR o a antirretrovirales nefrotóxicos.
El objetivo de las escalas es determinar el riesgo de desarrollar ERC a medio-largo plazo (ver más adelante los objetivos específicos de cada escala).
ESCALAS EVALUADAS
Se han diseñado escalas de riesgo de desarrollo de ERC en personas con y sin VIH, pero su uso no está generalizado 161112. En población no VIH, una clasificación pronóstica ampliamente implantada es la de la organización internacional KDIGO 1 y en población VIH disponemos de dos escalas desarrolladas en dos cohortes de pacientes: D:A:D 6 y cohorte de veteranos 11.
La evaluación global de la función renal debería realizarse en todos los individuos con infección por VIH, tanto al diagnóstico e inicio de TAR como durante el seguimiento. En la población con infección por VIH, además de los factores de riesgo clásicos para ERC (edad avanzada, HTA y diabetes), hay que valorar los propios de la infección por VIH, como la inmunosupresión, el TAR y las coinfecciones (hepatitis B o C) 2313.
a) Kidney Disease Outcomes Quality Initiative (KDOQI) and Kidney Disease: Improving Global Outcomes (KDIGO)
Los datos generados con estas escalas proceden fundamentalmente de población general Tabla 1 1. No se ha validado su capacidad predictiva en pacientes con infección por VIH
Ventajas: gran capacidad predictora en múltiples circunstancias. Incluye valor de proteinuria. Fácil de usar, contiene parámetros sencillos.
Limitaciones: no validación en población con VIH, ausencia de variables específicas relacionadas con el VIH.
b) Cohorte D:A:D
El objetivo de esta escala es determinar el riesgo de desarrollar ERC a largo plazo en pacientes con VIH, con el fin de sopesar los riesgos o beneficios del inicio o cambio de TAR que incluya fármacos potencialmente nefrotóxicos y para identificar a los candidatos para una monitorización más intensiva 6.
Población en la que se ha desarrollado: Se incluyeron 17.954 personas con VIH de la cohorte D:A:D con un valor de filtrado glomerular estimado (FGe)>60 ml/min/1.73 m² entre 2004 y 2013. El endpoint primario fue el desarrollo de ERC, definido como un FG ≤60 ml/min. No se incluyeron pacientes que hubieran tomado antirretrovirales nefrotóxicos como TDF, ATV, ATV/r, LPV/r u otros inhibidores de proteasa potenciados con ritonavir previamente al momento basal. La mediana de seguimiento fue de 6,1 años (rango, 0,3- 9,1).
Los factores predictores de riesgo de ERC fueron una mayor edad, consumo de drogas iv, coinfección por VHC, niveles basales más bajos de FGe, ser mujer, nadir de CD4 más bajo, hipertensión, diabetes y enfermedad cardiovascular previa, que fueron incluidos en la escala Tabla 2. Se elaboró además una escala corta sin los factores de riesgo cardiovascular (RCV), para calcular el riesgo en personas en las que sólo se disponía de información básica relacionada con el VIH. En ambas versiones de la escala se categorizó el riesgo en los siguientes grupos: riesgo predictivo bajo: <0 puntos; riesgo medio: 0-4 puntos; y riesgo alto: >5 puntos Tabla 2 Tabla 3.
Durante el seguimiento, 641 individuos desarrollaron ERC. La incidencia de ERC en pacientes con riesgo bajo, medio y alto fue de 0.8 (IC 95% 0,6-1), 5,6 (IC 95% 4,5-6,7) y 37,4 (IC 95% 34,0-40,7)/1000 personas-año, respectivamente. La escala de riesgo tuvo una buena capacidad de discriminación (estadístico C de Harrell de 0,92 [IC 95% 0,9- 0,92]) 6. Para la escala abreviada, el estadístico C de Harrell fue de 0,91 (IC 95% 0,90–0,92).
Se agregó el inicio de un antirretroviral potencialmente nefrotóxico a la escala de riesgo como una covariable tiempo-dependiente para estimar la contribución de estos fármacos al desarrollo de ERC y para calcular el número de tratamientos administrados necesarios para que aparezca un caso de daño renal o “number needed to harm” (NNH) para aquéllos con riesgo bajo, medio y alto de ERC. Las personas que comenzaron con TDF, ATV/r o cualquier otro inhibidor de la proteasa potenciado (excluyendo LPV/r) tuvieron un mayor riesgo de ERC, equivalente a un aumento de 2 puntos en la escala de riesgo o un aumento del riesgo del 74% (aIRR 1,74, 95% CI 1,69-1,78) en la incidencia de ERC. Aquéllos que comenzaron ATV/r o LPV/r tuvieron un mayor riesgo de ERC equivalente a un aumento de 1 punto en la escala de riesgo, o un 32% (razón de tasas de incidencia justada [aIRR] 1,32, IC 95% 1,30–1,34) más de incidencia de ERC en comparación con aquellos que no comenzaron estos fármacos pero con factores de riesgo similares para la ERC.
Población en la que se ha validado: Esta escala de riesgo fue validada en 2.548 personas de la cohorte del Royal Free Hospital 6 (94 eventos (3,7%), incidencia 5,1/1000 personas-año; IC 95% 4,1-6,1); con una mediana de seguimiento de 7,4 años (rango 0,3- 12,7 años). En esta cohorte no se recoge de rutina la información sobre los factores de RCV, por lo que se validó la escala de riesgo corta.
También se validó en 2.013 personas de los brazos controles de los estudios SMART/ ESPRIT 6 (32 eventos [1,6%], incidencia 4,1/1000 personas-año; IC 95% 2,5-5,1); con una mediana de seguimiento de 4,1 años (rango 0,6-8,1). En este caso sí se recogían los datos de DM, HTA y enfermedad cardiovascular (ECV) previa, por lo que se validó el score completo.
La validación externa en ambas cohortes, aunque el número de eventos fue bajo, mostró tasas de incidencia de ERC consistentes con las encontradas en la cohorte de derivación en los distintos grupos de riesgo, con un estadístico C de Harrell de 0,86, (IC 95% 0,78– 0,90) y 0,87 (IC 95% 0,80–0,94) en las cohortes del Royal Free Hospital y SMART/ ESPRIT, respectivamente.
La escala ha sido también recientemente valorada en la cohorte multicéntrica estadounidense Observational Pharmaco-Epidemiology Research and Analysis (OPERA) 14, analizando por separado las 3 ecuaciones más frecuentes para la estimación del FG: Cockcroft–Gault (C-G), Modification of Diet in Renal Disease (MDRD) y Chronic Kidney Disease Epidemiology Collaboration (CKD-EPI). Se evaluaron entre 19.444 y 22.748 PVVIH con datos disponibles para cada una de las ecuaciones de cálculo de FGe, con una mediana de seguimiento de 6.1 años. El estadístico C de Harrell osciló entre 0.87 a 0.92.
Ventajas: Proporciona una herramienta útil desde el punto de vista clínico, sencilla y fácil de implementar. Permite estimar el riesgo de ERC a 5 años con o sin la adición de fármacos antirretrovirales potencialmente nefrotóxicos e identificar los pacientes de riesgo alto Tabla 2 6. Se ha desarrollado una calculadora. La validación con dos cohortes externas muestra que una puntuación de riesgo aumentada se correlaciona con un incremento de incidencia similar en las cohortes de derivación y validación. Además, su uso junto a la escala de RCV de la misma cohorte D:A:D permitió observar que cuando el RCV y de ERC son altos de forma simultánea, el riesgo de desarrollar eventos es superior al que se observa en cualquier escenario por separado 15.
Limitaciones: se excluye la mitad de la población de la D:A:D por los criterios de elección, en la recogida de datos no se pudo ajustar por raza, por lo que se necesita validación en otros escenarios. Se trata de un estudio observacional. Solo se incluyen para el cálculo del riesgo los fármacos ya considerados nefrotóxicos previamente, no se puede excluir que otros sean considerados como tales más adelante. No se incluye la proteinuria. No se recogieron en todos los pacientes los factores de RCV.
c) Cohorte veteranos
El objetivo fue elaborar una escala para predecir el riesgo de desarrollar ERC en los siguientes 5 años en pacientes con VIH que inician un tratamiento con TDF, es decir, determinar el riesgo adicional de desarrollar una enfermedad renal relacionada con el uso de TDF 11.
Población en la que se ha desarrollado: Incluyó a 21.590 hombres naïve de la cohorte de veteranos que iniciaron tratamiento entre 1997 y 2010 y que no tenían ERC o tasa de FGe ≤ 60 m/min por 1.73 m² en la visita basal 11. El endpoint primario fue el tiempo hasta la primera vez que el FGe era inferior a 60 ml/min por 1.73 m² (calculado por CKD- EPI y confirmado por 2 determinaciones separadas 3 meses). La mediana de seguimiento fue de 6,3 años.
Se elaboró un score de puntos utilizando un modelo de regresión de Cox. En el análisis se encontró que la mayor edad, glucosa elevada (>140 mg/dl), tensión arterial sistólica elevada (>140 mmHg), HTA, triglicéridos elevados (>200 mg/dl), proteinuria y CD4 bajos se asociaron con mayor riesgo de ERC Tabla 2. La puntuación de la escala de riesgo oscila de 0 a 15 puntos, que corresponden al menor y mayor riesgo Tabla 2. Además de calcular el riesgo de desarrollar ERC, el modelo también calcula el NNH.
Durante el seguimiento se produjeron 2.059 eventos renales. Se objetivó un incremento progresivo en el riesgo de ERC con la puntuación creciente de la escala de riesgo, que oscilaba desde un riesgo menor de un 1% a los 5 años en aquéllos con 0 puntos, hasta 16.4% en aquéllos con 9 puntos o más entre los que no tomaban TDF; y desde 1.4% a 21.4%, respectivamente, entre los que tomaban TDF. Como resultado, se estimó que el NNH para TDF era de 108 con 0 puntos y 20 con 9 o más puntos. En un análisis limitado a los 5 últimos años, el TDF siguió manteniéndose como predictor de ERC. El modelo tuvo una buena capacidad de discriminación, con un estadístico C de 0,73 y buena calibración, con una bondad de ajuste de 0,99 11.
Se observó una asociación no lineal de la duración de exposición a TDF con riesgo de ERC, con un punto de inflexión cercano a 1 año de tratamiento. Por tanto, un incremento en la duración de tratamiento con TDF (≥1 año vs < 1 año) se asoció con un riesgo de eventos mayor (10,9% en aquellos con >1 año vs 4,9% en aquellos con <1 año). Este incremento de riesgo se observó en todo el rango de puntuaciones de la escala de riesgo.
Población en la que se ha validado: Esta escala se ha validado en una pequeña cohorte de 748 pacientes con VIH con FGe basal >60 ml/min en el Alfred Hospital de Melbourne, donde se comparó con la escala corta de la D:A:D Tabla 3. Los scores D:A:D y Scherzer demostraron buena calibración, aunque el score corto de la D:A:D demostró una discriminación superior (área bajo la curva D:A:D 0,85; Scherzer 0m78, p=0.02) 16.
Ventajas: gran número de participantes, elevado número de eventos tanto en personas que tomaban TDF como en las que no. Además, la población estudiada incluye pacientes que suelen ser excluidos de los ensayos clínicos y que podrían no ser adecuados para estudios epidemiológicos de cohortes 11.
Limitaciones: Escasamente validada hasta la actualidad. Incluye sólo a hombres. No se puede generalizar a otras poblaciones (no veteranos, mujeres, niños) o a pacientes que no reciben un cuidado clínico regular. Aunque el perfil basal de los pacientes con y sin TDF es similar en cuanto al riesgo, puede haber un control inadecuado o incompleto de otros factores que puedan actuar como confusores en la asociación entre TDF y enfermedad renal. No se dispone de ARN viral para confirmar infección por VHC.
ESCALAS RECOMENDADAS
En general, podemos decir que la escala D:A:D ha sido más ampliamente validada, incluye una población más amplia que la de veteranos y dispone de una versión corta que ha demostrado utilidad cuando no se dispone de los factores de riesgo cardiovascular, por lo que es la escala recomendada por los redactores del documento (BII). En la última actualización de las guías de la European AIDS Clinical Society (EACS) 13 se recomienda evaluar los factores de riesgo de ERC con cualquiera de las dos escalas, sin definir preferencias.
D:A:D: https://chip.dk/Tools-Standards/Clinical-risk-scores Veteranos: http://hivinsite.ucsf.edu/InSite?page=md-calculator
1. Criterios de inclusión para la aplicación de la escala
Dado que los pacientes con VIH tienen un riesgo aumentado de enfermedad renal es recomendable utilizar las escalas de riesgo disponibles, sobre todo la D:A:D, para valorar el riesgo de desarrollar ERC en el inicio o cambio de tratamiento antirretroviral para elegir el tratamiento más adecuado. También puede ser especialmente útil para identificar pacientes con FGe intermedios (60-89 ml/min) con mayor riesgo de progresar a ERC, en quienes hay que indicar modificaciones en el estilo de vida y un adecuado tratamiento de los factores de riesgo cardiovascular 13.
Ambas escalas se pueden aplicar a todos los pacientes con VIH con FGe >60 ml/min teniendo en cuenta las limitaciones expresadas Tabla 3, incluido que ninguna de las dos incluye los fármacos antirretrovirales que se usan con mayor frecuencia en la actualidad (dolutegravir, cobicistat o rilpivirina), que también tienen un impacto sobre el FGe, y por tanto estas escalas reflejan la realidad del TAR y el riesgo de nefropatía de hace una década. Recientemente se han publicado datos de la cohorte OPERA en los que se han obtenido factores de corrección del FGe en función del fármaco utilizado 17.
2. Explicación sobre su uso e interpretación
Disponemos de calculadoras para las escalas D:A:D y de veteranos cuyos links también se incluyen en la Tabla 3.
Ambas estiman el riesgo de desarrollo de ERC a 5 años. Además, en el caso de la D:A:D, también estima el incremento del riesgo cuando se inicia tratamiento con TDF o un IP potenciado o ATV sin potenciar y, en el caso de la escala de veteranos, el incremento del riesgo con el inicio de TDF.
Con la puntuación obtenida en la escala D:A:D, el riesgo se estratifica en 4 categorías:
-
- Riesgo predictivo bajo: <0 puntos
- Riesgo medio: 0-4 puntos
- Riesgo alto: >5 puntos
Si no tenemos conexión a Internet, en la Tabla aparecen los distintos factores que hay que evaluar y la puntuación correspondiente (ver ejemplos al final de documento) 611.
3. Recomendaciones de actuación en función de los valores obtenidos
Aunque hasta la actualidad no se dispone de evidencia científica sobre la eficacia de las medidas de prevención en caso de que la puntuación con la escala indique un riesgo intermedio o alto, se recomienda actuar sobre los factores de riesgo cardiovascular modificables, considerar tratamiento con inhibidores de la enzima convertidora de angiotensina o antagonistas de los receptores de angiotensina-II si indicado y, sobre todo, evitar los fármacos y sustancias nefrotóxicas 13.
Ejemplos de aplicación de las escalas:
Escala D:A:D
Utilizando la (Tabla 4), una persona que es mujer (+1), no UDI (+0) sin coinfección por VHC (+0) de 38 años (+4) con un FGe de 68 ml/min/ 1.73 m² (+6) con un nadir de CD4 de 250 cel/mcl (-1), sin HTA (+0) o ECV previa (+0) pero con diabetes (+2), tiene un score de riesgo de 12, alto riesgo 6.
Utilizando los coeficientes exactos: mujer (+0.3982) no usuaria de drogas intravenosas (UDI) (+0), sin VHC (+0), de 38 años (+1,0813) con FGe de 68 (+1,6475) con nadir de CD4=250 cel/mcl (-0,2848) sin HTA (+0) o ECV previa (+0) pero con DM (+0,5764) tendría un riesgo exacto de 3,4186, añadido a la constante del modelo de -6,2406 daría un riesgo total de -2,822 correspondiente a un 25,7% de riesgo a los 5 años; pautar TDF incrementaría el riesgo a un 44,7%, añadiendo TDF y LPV/r un 58,9% 6.
Por el contrario si es un varón (+0) de 28 años (+0) no UDI (+0), sin VHC (+0), con nadir de CD4= 250 cel/mcl (-0,2848), sin HTA (+0), ni ECV previo (+0) o DM (+0), el score de riesgo exacto sería de -0,2848, al añadir la constante de -6,2406 daría un score total de -6,5254 correspondiente a un riesgo de 0,7%, que se incrementa a un 1,2% si se administra TDF y a 1,6% si inicia TDF+LPV/r 6.
Escala de la cohorte de veteranos
Utilizando también la (Tabla 4) : varón de 55 años con niveles de glucosa normal, HTA, hipertrigliceridemia, no proteinuria y nivel normal de CD4. En este ejemplo el cálculo de riesgo asignaría 4 puntos por la edad, 1 por PAS elevada, 2 puntos por HTA y 1 por TG elevados, llegando a un score de 8. Un paciente con este score tendría una probabilidad de un 11% de desarrollar IRC a los 5 años si no toma TDF y un 19% si toma TDF 11.
Tablas:
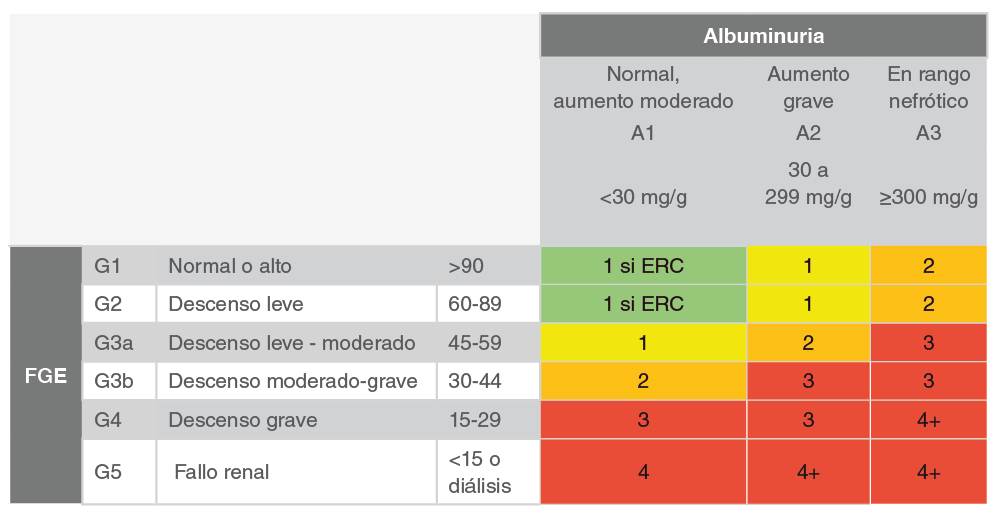
Tomado de KDIGO. Summary of recommendation statements. Kidney Int 2013; 3 (Suppl):5.
FGE: Filtrado Glomerular Estimado (mL/min por 1.73 m²)
Mapa de riesgo de desarrollar complicaciones renales y cardiovasculares:
- Bajo: (verde)
- Moderado: (amarillo)
- Alto: (naranja)
- Muy alto: (rojo)
Los números en las celdas de color indican la sugerencia de frecuencia anual de monitorización de los pacientes.

FRCV, factores de riesgo cardiovascular; FGe, filtrado glomerular estimado; ERC, enfermedad renal crónica; AUC, área bajo la curva; ECV, enfermedad cardiovascular; TDF, tenofovir disoproxil fumarato; ATV/r, atazanavir/ ritonavir; LPV/r, lopinavir/ritonavir, IP/r, inhibidor de la proteasa potenciado con ritonavir; VHC, virus hepatitis C.
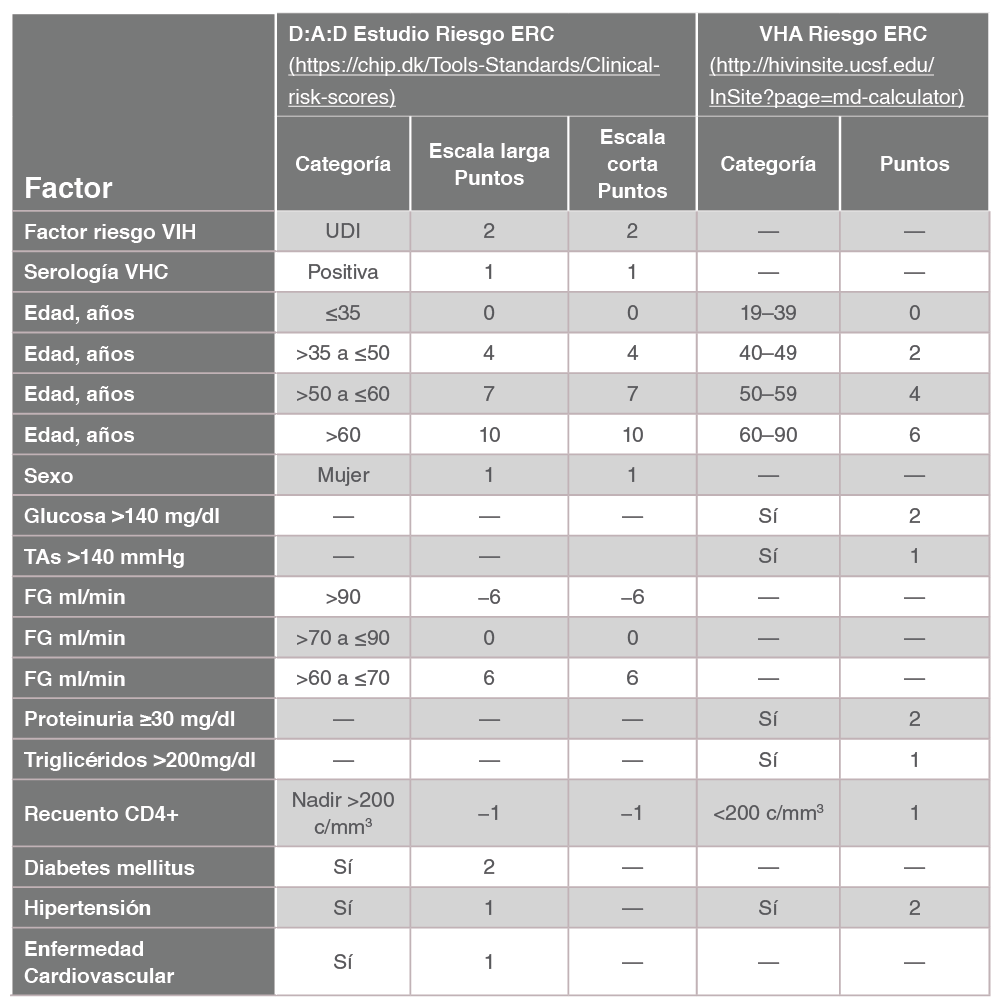
D:A:D Study, Data Collection on Adverse Events of Anti-HIV Drugs Study VHA, Veterans Health Affairs; ERC, enfermedad renal crónica; FG, filtrado glomerular; VHC, virus hepatitis C; UDI, usuario drogas intravenosas
Bibliografía:
Swanepoel CR, Atta MG, D’Agati VD, Estrella MM, Fogo AB, Naicker S, et al. Kidney disease in the setting of HIV infection: conclusions from a Kidney Disease: Improving Global Outcomes (KDIGO) Controversies Kidney International 2018; 93: 545-59.
Górriz JL, Gutiérrez F, Trullas JC, Arazo P, Arribas JR, Barril G, et al. Consensus document on the management of renal disease in HIV-infected Nefrologia 2014;34 Suppl 2:1-81
Jotwani V, Atta MG, Estrella MM. Kidney Disease in HIV: Moving beyond HIV-Associated Nephropathy. JASN 2017; 28: 3142-54.
Szczech LA, Gange SJ, van der Horst C, Bartlett JA, Young M, Cohen MH, et Predictors of proteinuria and renal failure among women with HIV infection. Kidney Int 2002; 61:195-202
Jotwani V, Li Y, Grunfeld C, Choi AI, Shlipak MG. Risk factors for ESRD in HIV-infected individuals: traditional and HIV-related Am J Kidney Dis 2012; 59:628-35
Mocroft A, Lundgren J, Ross M, Law M, Reiss P, Kirk O, et al. Development and validations of a risk score for chronic kidney disease in HIV infection using prospective cohort data from the D:A:D study. Plos Med 2015; 12:e1001809
Estrella MM, Parekh RS, Astor BC, Bolan R, Evans RW, Palella FJ Jr, et al. Chronic kidney disease and estimates of kidney function in HIV infection: a cross-sectional study in the multicenter AIDS cohort J Acquir Immune Defic Syndr 2011; 57:380-6.
Cailhol J, Nkurunziza B, Izzedine H, Nindagiye E, Munyana L, Baramperanye E, et Prevalence of chronic kidney disease among 4people living with HIV/AIDS in Burundi: a cross-sectional study. BMC Nephrol 2011; 12:40.
Emem CP, Arogundade F, Sanusi A, Adelusola K, Wokoma F, Akinsola A. Renal disease in HIV- seropositive patients in Nigeria: an assessment of prevalence, clinical features and risk Nephrol Dial Transplant 2008; 23:741-6.
Domingo P, Suarez-Lozano I, Gutierrez F, Estrada V, Knobel H, Palacios R, et al Predictive factors of renal impairment in HIV-infected patients on antiretroviral therapy: Results from the VACH longitudinal cohort Nefrología 2019; 39:497-505.
Scherzer R, Gandhi M, Estrella MM, Tien PC, Deeks SG, Grunfeld C, et al. A chronic kidney disease risk score to determine tenofovir safety in a prospective cohort of HIV-positive male veterans. AIDS 2014; 28:1289-1295.
Ramspek CL, de Jong Y, Dekker FW, van Diepen M. Towards the best kidney failure prediction tool: a systematic review and selection Nephrol Dial Transplant. 2019 Mar 4. pii: gfz018. doi: 10.1093/ndt/ gfz018. [Epub ahead of print]
EACS Guidelines version 10.0 (nov 2019) http://www.eacs.sandforguide.com. (última entrada el 11 de noviembre de 2019)
Mills AM, Schulman KL, Fusco JS, Brunet L, Hsu R, Beyer A, et al. Validation of the Data Collection on Adverse Events of Anti-HIV Drugs (D:A:D) chronic kidney disease risk score in HIV-infected patients in the HIV Med. 2020 Jan 27 [Epub ahead of print].
Boyd Mocroft A. Ryom L, d´Arminio Monforte A. Sabin C, El-Sadr WM, et al. Cardiovascular disease (CVD) and chronic kidney disease (CKD) event rates in HIV-positive persons at high predicted CVD and CKD risk: a prospective analysis of the D:A:D observational study. Plos Medicine 2017; 14(11):e1002424.
Woolnough EL, Hoy JF, Cheng AC, Walker RG, Chrysostomou A, Woolley I et al. Predictors of chronic disease and utility of risk prediction scores in HIV –positive AIDS 2018, 32:1829-35.
Hsu R, Brunet L, Fusco J, Mounzer K, Lackey P, Vannappagari V, et Renal function with Dolutegravir, Elvitegravir/Cobicistat, Raltegravir or Darunavir. 10th IAS. Mexico city, Mexico 21-24 july 2019. TUPEB207.
Hsu R, Brunet L, Fusco J, Beyer A, Prajapati G, Wyatt C, et Incidence of CKD with TDF and Non-TDF containing antiretroviral regimens by baseline D:A:D risk in people living with HIV. 17th EACS 2019. Basel 6-9 november
5. Escalas para la valoración del deterioro neurocognitivo
5.1. INTRODUCCIÓN
5.2. POBLACIÓN Y OBJETIVOS
5.3. ESCALAS VALIDADAS EN POBLACIÓN VIH
5.4. ESCALAS RECOMENDADAS
INTRODUCCIÓN
El deterioro neurocognitivo ha sido ampliamente estudiado en la infección por VIH. Desde los primeros trabajos publicados a finales de los años 80 12, anualmente se han ido reportando estudios que han investigado esta dimensión de salud. El deterioro neurocognitivo en la infección por VIH se ha definido como la alteración de un mínimo de 2 funciones cognitivas de entre un máximo de 7, que incluyen la concentración y memoria de trabajo, la memoria verbal, el aprendizaje, la velocidad del procesamiento de la información, la fluencia verbal, el funcionamiento ejecutivo y la función motriz 3. Existen otras definiciones, aunque ésta es la más utilizada y la que mantiene un mayor consenso aún en la actualidad. Cuando existe deterioro neurocognitivo y se sospecha que puede estar asociado con un efecto del VIH, se habla de la presencia de un trastorno neurocognitivo asociado al VIH (HAND) 3. Esta situación a veces es difícil de acotar, ya que pueden existir otras causas que provoquen el deterioro, como el consumo de drogas, los factores de riesgo cardiovascular, o la patología psiquiátrica, entre otras. En cualquiera de los dos casos, lo importante es poder identificar el deterioro, cuantificarlo, y conocer con detalle el perfil de alteración cognitiva que existe.
Se considera que el deterioro neurocognitivo es una complicación frecuente en las personas que viven con el VIH (PVVIH), con una prevalencia descrita entre el 30% y el 50% 45. En la actualidad se cree que esta prevalencia podría ser inferior a la reportada durante años, aunque aún no se ha publicado ningún estudio concluyente en este sentido. Se han alegado discrepancias en las poblaciones de estudio en los trabajos llevados a cabo, así como otras diferencias metodológicas en la definición del deterioro neurocognitivo. Una explicación muy plausible es también que esta reducción podría estar relacionada con los avances en el manejo terapéutico del VIH, considerando especialmente el inicio más temprano del tratamiento antirretroviral, la detección más reciente de la infección, o la utilización de combinaciones antirretrovirales más seguras y efectivas. En cualquiera de los casos, nos seguimos refiriendo a una complicación que incluye síntomas que son aún en la actualidad muy frecuentemente notificados por las personas que conviven con la infección por VIH, y que están relacionados con una peor calidad de vida, con limitación en el desarrollo de las actividades de la vida diaria, y con un peor pronóstico de salud en general.
Las escalas que valoran el deterioro neurocognitivo asociado al VIH son las mismas escalas que valoran el deterioro neurocognitivo en la población general o en otras enfermedades: las escalas neuropsicológicas.
POBLACIÓN Y OBJETIVOS
La población diana para utilizar estas escalas son las personas con VIH con sospecha de alteración cognitiva, ya sea asociada al VIH o no asociada. En el caso de utilizar las escalas neuropsicológicas en personas con sospecha de afectación neurológica relacionada con el virus, es decir, con un trastorno neurocognitivo asociado al VIH, el uso de las escalas permitirá cuantificar el nivel de deterioro, determinar el perfil de funciones cognitivas alteradas, y ayudará a establecer el trastorno neurocognitivo concreto. En el caso de existir sospecha de deterioro por otras posibles causas, el uso de las escalas igualmente permitirá cuantificar el nivel de deterioro, y establecer el perfil de alteración. La información obtenida por las pruebas neuropsicológicas también será útil con fines de investigación, para evaluar asociaciones con las causas que subyacen al deterioro y para la valoración de posibles variables predictoras. En las personas con VIH se ha reportado un gran número de factores de riesgo para el desarrollo de deterioro neurocognitivo 6. Éstos son ciertamente numerosos, por lo que es de gran ayuda poder identificarlos en categorías diferentes, por ejemplo, según tipología, origen, evolución, etc. Entre ellos encontramos factores demográficos, como una mayor edad; psicosociales, como niveles más bajos de escolarización; inmunológicos, como bajo nadir de linfocitos CD4; relacionados con otras comorbilidades, como los factores de riesgo cardiovascular; o relacionados con la terapia antirretroviral, como el uso de efavirenz.
ESCALAS VALIDADAS EN POBLACIÓN VIH
Aunque algunas escalas neuropsicológicas han sido específicamente desarrolladas en población con VIH, la mayoría han sido desarrolladas y validadas en otras enfermedades con afectación del sistema nervioso central (SNC) y después han sido aplicadas en PVVIH. Algunas de ellas han sido realmente utilizadas y estudiadas con detalle. La Tabla 1 muestra las escalas neuropsicológicas más comúnmente utilizadas en población con VIH.
Las baterías neuropsicológicas aplicadas en PVVIH no siempre han incluido exactamente las mismas escalas para evaluar la función neurocognitiva. Una propuesta concreta y recomendada en población española se muestra en la Tabla 2. Esta batería ha sido utilizada en diversas ocasiones, a diferencia de otras que han sido menos estudiadas en población española (7–11). De todos modos, otras propuestas han sido parecidas. Como se puede comprobar en la Tabla, se propone el uso de 12 escalas, utilizando 2 de ellas por cada función neurocognitiva (un total de 6 dominios). La recomendación propuesta por guías clínicas internacionales y documentos de consenso 31213, incluyendo también las guías españolas 14, ha sido la de valorar entre 5-7 áreas cognitivas, con un mínimo de 2 medidas por cada área (AII).
Existen 2 limitaciones principales de este tipo de pruebas. La primera es la recomendación clara de que son pruebas que deben ser administradas por profesionales expertos en neuropsicología clínica. Esto implica que el evaluador de las escalas debe estar correctamente formado en neuropsicología y, además, es recomendable que tenga experiencia o formación en infección por VIH (AII). La segunda limitación hace referencia al uso repetido de estas escalas, ya que pueden provocar un efecto aprendizaje que hace que las puntuaciones mejoren en el tiempo. No todas las escalas presentan la misma predisposición a provocar este efecto de aprendizaje, por ejemplo, las pruebas para valorar la fluencia verbal presentan un bajo efecto y las pruebas de memoria un elevado efecto, pero en general siempre existe esa posibilidad 15.
Como alternativa a las escalas neuropsicológicas extensas se ha propuesto el uso de escalas más breves 1617. Esta decisión tiene la limitación de obtener una información menor sobre el deterioro, pero se plantea como una alternativa accesible y aplicable en la clínica diaria del VIH. Han sido diversas las opciones que se han propuesto. La Tabla 3 describe algunas de las escalas breves que han sido sugeridas para población con VIH, todas ellas comparadas con una larga batería neuropsicológica considerada como el “gold standard”.
En población española, la escala breve que ha sido más estudiada es NEU Screen 9, una escala desarrollada específicamente en personas con VIH españolas. Se han presentado diferentes resultados sobre este test. Destacan los ofrecidos en el estudio original, donde se desarrolló la escala 9 y se comparó con una extensa batería de pruebas neuropsicológicas estandarizadas consideradas como gold standard, y los resultados más recientes donde se ha evaluado en población mayor con VIH con los criterios de valoración antes referidos 18. La Tabla 4 muestra resultados adicionales donde fue comparada con otras 2 propuestas de escalas breves en población española 19.
ESCALAS RECOMENDADAS
La decisión sobre la utilización de escalas concretas puede basarse en los recursos disponibles de cada centro. La recomendación de mayor grado es usar las escalas extensas, ya que han sido ampliamente utilizadas en población con VIH previamente y permiten obtener información clínica completa sobre el estado neurocognitivo (AII). No obstante, la alternativa de utilizar baterías más breves puede ser planteada, ya que han demostrado unos adecuados niveles de precisión, tal y como se presenta en la Tabla 3 (BII). Entre ellas, la escala recomendada es NEU Screen, tanto por su más extensa validación en población con VIH española, como por su buena sensibilidad y especificidad (BII).
Acceso a la escala NEU Screen: www.flSIDA.org/NEU
a) Criterios de inclusión:
Se recomienda utilizar estas escalas en personas con VIH con sospecha de deterioro neurocognitivo, ya sea asociado o no al VIH.
El uso de NEU Screen puede ser recomendado a cualquier persona con infección por VIH, con excepción de aquellas que no puedan escribir o dibujar, o que no se muestren en disposición de realizar una prueba manipulativa, lo que también afecta a muchas otras pruebas de valoración del funcionamiento neurocognitivo. Para el resto de perfiles de población con VIH, la escala puede ser aplicada sin problema.
b) Interpretación:
El tiempo de administración es inferior a 10 minutos y debe ser aplicada por un profesional sanitario, que no requiere que sea estrictamente experto en neuropsicología, sino que puede ser cualquier profesional clínico con un breve entrenamiento (médico, enfermero/a, trabajador/a de la comunidad, etc.). La disponibilidad de la prueba es gratuita y puede descargarse en el enlace detallado. El test consta de 3 pruebas neuropsicológicas y se recomienda su uso junto con la evaluación de comorbilidades potencialmente confusoras y del funcionamiento en las actividades de la vida diaria. El link también incluye una Tabla de corrección, que indica para la realización de cada prueba el tiempo máximo (en segundos) a partir del cual se considera que existe sospecha de deterioro neurocognitivo, o el número mínimo de palabras que deben ser capaces de enumerar, con una sensibilidad del 74% y especificidad del 81% para población de entre 20 y 65 años de edad, y del 91% y 92%, respectivamente, para personas mayores de 60 años. Si alguna de las puntuaciones obtenidas en cualquiera de las 3 pruebas supera el punto de corte indicado en la Tabla de corrección, la prueba es positiva y por lo tanto indica la existencia de sospecha de alteración neurocognitiva. Si bien es cierto que esta prueba podría obtener información cuantitativa de 3 funciones cognitivas, metodológicamente ha sido diseñada para ofrecer información cualitativa en su conjunto sobre la existencia de deterioro neurocognitivo en personas con VIH de forma rápida y accesible. Esto implica, por tanto, que la información resultante es categórica: existencia o no de posible alteración.
c) Recomendaciones en función de los valores obtenidos
En caso de que el resultado de la escala sea positivo, se recomienda firmemente una evaluación más completa del estado neurocognitivo con la aplicación de una batería neuropsicológica extensa Tabla 2, de acuerdo con las guías internacionales y nacionales del manejo terapéutico de los trastornos neurocognitivos asociados al VIH 121314. Esto aportará las ventajas mencionadas anteriormente, es decir, son pruebas que han sido utilizadas ampliamente en la infección por VIH y que permiten obtener información exhaustiva sobre las funciones cognitivas concretas. En cualquiera de los casos, considerando la notable precisión de NEU Screen, un positivo ya en el resultado podría considerarse como existencia probable de deterioro cognitivo. Esto puede ser útil, por ejemplo, en aquellos entornos en los que no se disponga de recursos suficientes para la evaluación del funcionamiento neurocognitivo (equipo de neuropsicología, tiempo por parte de los profesionales, equipo médico reducido, etc.). Las recomendaciones de actuación si se diagnostica deterioro neurocognitivo sobrepasan los objetivos de este capítulo; podrían incluir, entre otras, la revisión del tratamiento antirretroviral, el inicio de un tratamiento farmacológico coadyuvante con efectividad demostrada en VIH, o el inicio de intervenciones neurocognitivas no farmacológicas, como son las actuaciones sobre la alimentación, el ejercicio físico o la rehabilitación cognitiva 20.
En caso de que el resultado del test sea negativo y exista sospecha de deterioro neurocognitivo, se recomienda descartar alteraciones del estado emocional, o de otros factores confusores (ver Algoritmo 1 del Documento Nacional de Manejo Terapéutico de los Trastornos Neurocognitivos) 14.
Tablas:

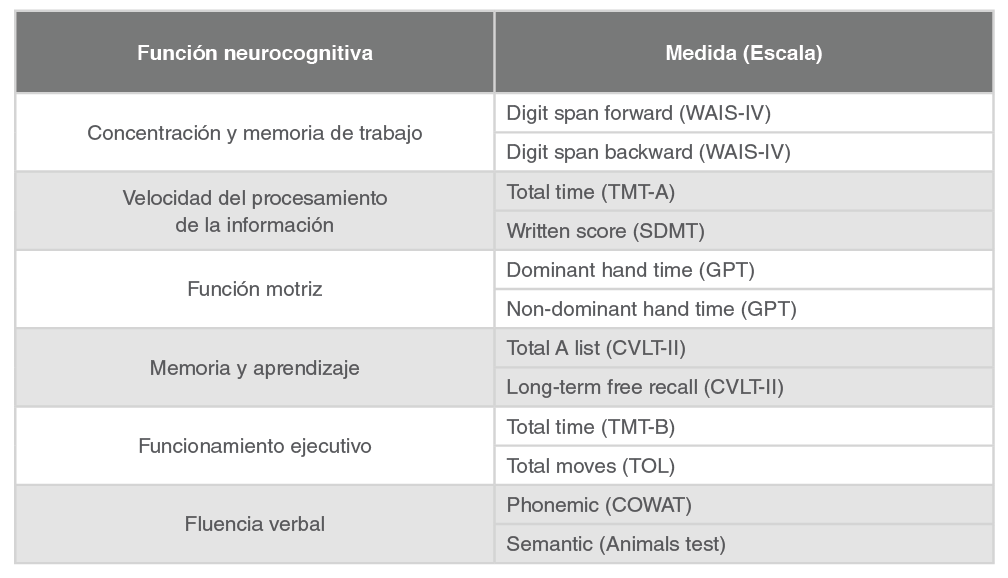
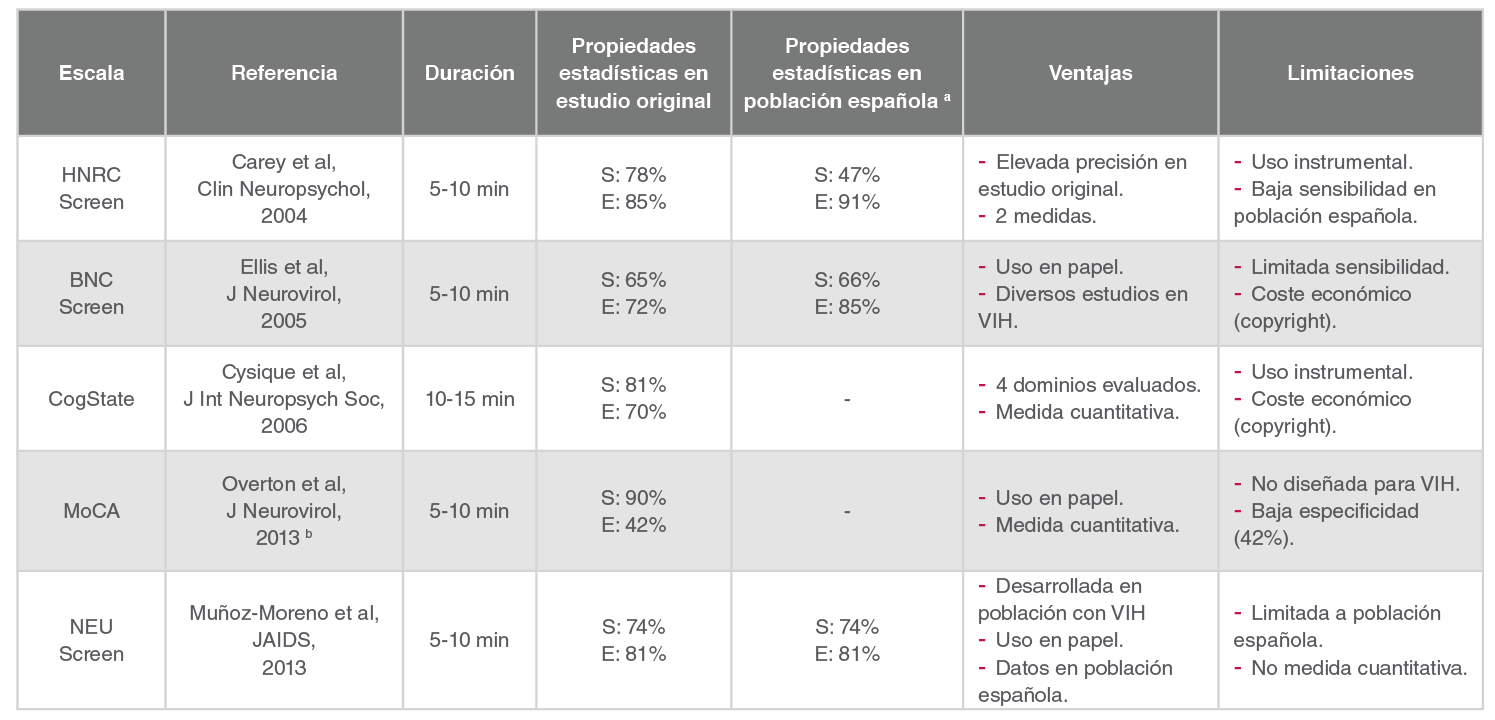
a Referencia: Muñoz-Moreno JA et al, 11th Int Symp Neurovirology 29 May - 2 June 2012, New York, NY (Abstract P155).
bEl estudio original no ofreció la sensibilidad y especificidad (Koski et al, HIV Medicine, 2011).
BNC, Brief Neurocognitive; HNRC, E, Especificidad; HIV Neurobehavioral Research Center; MoCA, Montreal Cognitive Assessment; NEU, Neurocognitive;
S, Sensibilidad.
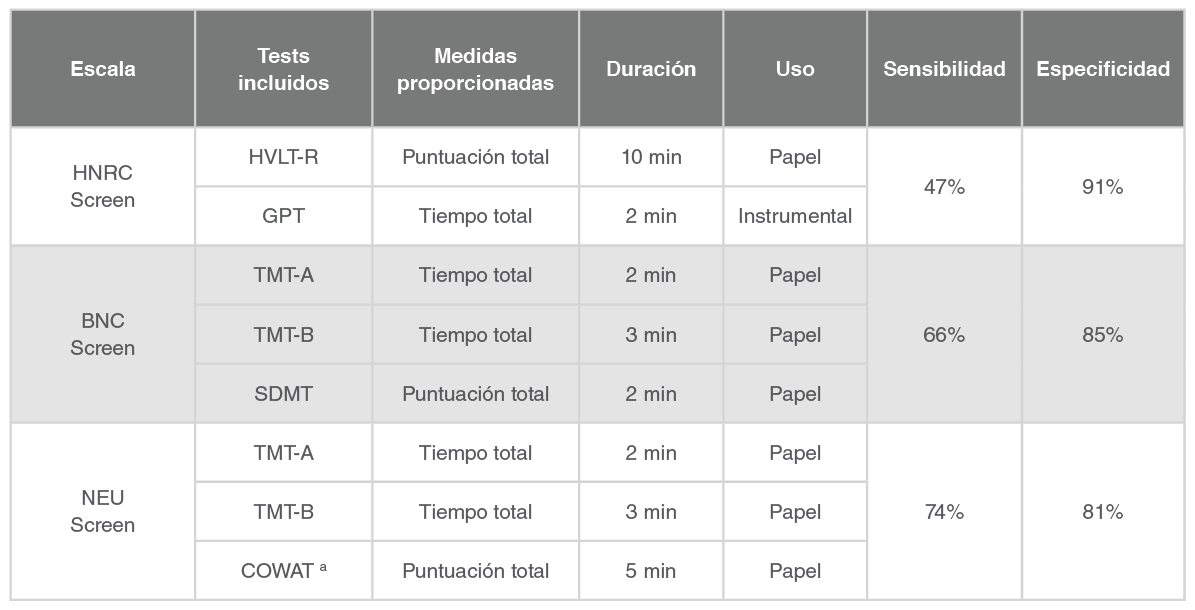
a En España denominado Test FAS.
BNC, Brief Neurocognitive; COWAT, Controlled Oral Word Test; GPT, Grooved Pegboard Test; HNRC, HIV Neurobehavioral Research Center; HVLT-R, Hopkins Verbal Learning Test-Revised; NEU, Neurocognitive; SDMT, Symbol Digit Modalities Test; TMT-A, Trail Making Test - Part A; TMT-B, Trail Making Test - Part B.
Bibliografía:
Grant I, Atkinson JH, Hesselink JR, Kennedy CJ, Richman DD, Spector SA, et al. Evidence for early central nervous system involvement in the acquired immunodeficiency syndrome (AIDS) and other human immunodeficiency virus (HIV) infections. Studies with neuropsychologic testing and magnetic resonance Ann Intern Med 1987;107:828–36.
Price R, Brew B, Sidtis J, Rosenblum M, Scheck A, Cleary P. The brain in AIDS: central nervous system HIV-1 infection and AIDS dementia Science 1988; 239:586–92.
Antinori A, Arendt G, Becker JT, Brew BJ, Byrd DA, Cherner M, et al. Updated research nosology for HIV-associated neurocognitive Neurology 2007; 69:1789–99.
Schouten J, Cinque P, Gisslen M, Reiss P, Portegies P. HIV-1 infection and cognitive impairment in the cART era: a AIDS 2011; 25:561–75.
Eggers C, Arendt G, Hahn K, Husstedt IW, Maschke M, Neuen-Jacob E, et al. HIV-1-associated neurocognitive disorder: epidemiology, pathogenesis, diagnosis, and J Neurol 2017; 264:1715–27.
Schouten J, Su T, Wit FW, Kootstra NA, Caan MWA, Geurtsen GJ, et al. Determinants of reduced cognitive performance in HIV-1-infected middle-aged men on combination antiretroviral therapy. AIDS 2016;30:1027-38.
Muñoz-Moreno JA, Fumaz CR, Ferrer MJ, Prats A, Negredo E, Garolera M, et al. Nadir CD4 cell count predicts neurocognitive impairment in HIV-infected AIDS Res Hum Retroviruses 2008;24:1301– 7.
Muñoz-Moreno JA, Fumaz CR, Prats A, Ferrer MJ, Negredo E, Pérez-Alvarez N, et al. Interruptions of antiretroviral therapy in human immunodeficiency virus infection: are they detrimental to neurocognitive functioning? J Neurovirol 2010;16:208-18.
Muñoz-Moreno JA, Prats A, Pérez-Álvarez N, Fumaz CR, Garolera M, Doval E, et al. A brief and feasible paper-based method to screen for neurocognitive impairment in HIV-infected patients: the NEU J Acquir Immune Defic Syndr 2013; 63:585–92.
Muñoz-Moreno JA, Pérez-Álvarez N, Muñoz-Murillo A, Prats A, Garolera M, Jurado MA, et al. Classification models for neurocognitive impairment in HIV infection based on demographic and clinical PLoS One 2014; 9:e107625.
Muñoz-Moreno JA, Prats A, Moltó J, Garolera M, Pérez-Álvarez N, Díez-Quevedo C, et al. Transdermal rivastigmine for HIV-associated cognitive impairment: A randomized pilot study. PLoS One 2017;12:
Antinori A, Arendt G, Grant I, Letendre S, Muñoz-Moreno Assessment, diagnosis and treatment of Human Immunodeficiency Virus (HIV)-associated neurocognitive disorders (HAND): A consensus report of the mind exchange program. Clin Infect Dis 2013;56:1004–17.
EACS Society. European Guidelines for treatment of HIV-infected adults in Europe. Eur AIDS Clin Soc [Internet]. 2017;(October):102. Available from: http://www.eacsociety.org/files/guidelines_9.0-english. pdf%0Ahttp://www.eacsociety.org/guidelines/eacs-guidelines/eacs-guidelines.html
Podzamczer D, Muñoz-Moreno JA, Polo Documento de Consenso sobre el Manejo Clínico de los Trastornos Neurocognitivos Asociados a la Infección por el VIH . Enero 2013. 2013;32(1):1–
Available from: https://www.msssi.gob.es/ciudadanos/enfLesiones/enfTransmisibles/SIDA/ publicaciones/profSanitarios/docTARGeSIDAPNS2013Def.pdf
Cysique L, Franklin D, Abramson I, Ellis RJ, Letendre S, Collier A, et al. Normative data and validation of a regression based summary score for assessing meaningful neuropsychological change. J Clin Exp Neuropsychol 2011; 33:505–22.
Valcour V, Paul R, Chiao S, Wendelken LA, Miller B. Screening for cognitive impairment in human immunodeficiency Clin Infect Dis. 2011; 53:836–42.
Kamminga J, Lal L, Wright EJ, Bloch M, Brew BJ, Cysique Monitoring HIV-Associated Neurocognitive Disorder Using Screenings: a Critical Review Including Guidelines for Clinical and Research Use. Curr HIV/AIDS Rep. 2017; 14:83–92.
Prats A, López-Masramon E, Pérez-Álvarez N, Garolera M, Fumaz CR, Ferrer MJ, et NEU Screen Shows High Accuracy in Detecting Cognitive Impairment in Older Persons Living With HIV. J Assoc Nurses AIDS Care 2019; 30:35-41.
Muñoz-Moreno JA, Prats A, Pérez-Álvarez N, Fumaz CR, Ferrer MJ, Negredo E, et al. Differences in North American and West European Study Populations When Detecting Neurocognitive Impairment in HIV Infection : A Comparison of Three Screening Methods. 11th Int Symp Neurovirology 29 May - 2 June 2012, New York, NY Abstr P155 (Oral Commun).
Montoya J, Henry B, Moore Behavioral and Physical Activity Interventions for HAND. Curr Top Behav Neurosci. 2019;Jan 30
6. Escalas de riesgo de osteoporosis y fractura ósea
6.1. INTRODUCCIÓN
6.2. POBLACIÓN O GRUPOS DIANA DE LA ESCALA Y OBJETIVOS
6.3. ESCALAS EVALUADAS EN POBLACIÓN CON VIH
6.4. ESCALAS RECOMENDADAS
INTRODUCCIÓN
Existe una asociación entre la infección por VIH y las fracturas de fragilidad. La concurrencia de factores de riesgo clásicos y factores dependientes de la propia infección hace que esta comorbilidad adquiera gran importancia a medida que la población que vive con VIH (PVVIH) envejece 12. Entre ellos, el inicio de la terapia antirretroviral (TAR) se asocia con una pérdida de entre el 2% y el 6% de la denSIDAd mineral ósea (DMO) en la región de cadera y columna vertebral, estabilizándose a los 24 meses con un plateau posterior o incluso un aumento después de este período 3. En la actualidad, los fármacos implicados en el mayor riesgo de fractura han sido el tenofovir disoproxilo fumarato (TDF) y los inhibidores de la proteasa (IP) 24. Sin embargo, es importante señalar que la mayoría de los estudios que han evaluado la incidencia de fracturas en PVVIH no tenían suficiente potencia para evaluar la asociación entre antirretrovirales específicos y fracturas.
La incidencia de fracturas descrita entre las PVVIH en cualquier localización oscila entre 0,1 y 8,4 por 1000 personas-año 12. Sin embargo, esta incidencia podría estar infra- estimada debido a que la mayoría de los estudios fueron realizados en hombres con edades medias comprendidas entre 36 y 56 años. Así, en el estudio realizado por Guerri- Fernández et al. 5, el aumento en el riesgo fue sólo significativo en pacientes mayores de 59 años, siendo más del doble que el de la población general. Existen diversos meta- análisis que han analizado la incidencia de fracturas en esta población. En uno de los más rigurosos, en el que se evaluaron 10 estudios de cohortes, la ratio de la incidencia de fracturas de cualquier localización fue de 1,58 (IC 95% 1,25-2) en relación con población no infectada por el VIH 6. Respecto al riesgo de fracturas vertebrales, en una revisión sistemática se observó que la prevalencia de estas fracturas en las PVVIH fue del 11,1% (IC 95% 4,5-25), siendo mayor la prevalencia de las fracturas morfométricas (20,2% [IC 95% 15,7-25,6]) que las clínicas (3,9% [IC 95% 0,9-15,8] y el riesgo fue 2,30 veces mayor que el de la población general [IC 95% 1,37-3,85] 7.
Debido a que las fracturas son poco comunes, habitualmente se utiliza la medida de la denSIDAd mineral ósea por densitometría ó absorciometría de rayos X de energía dual (DXA) como marcador subrogado del riesgo de fractura. La densitometría correlaciona la cantidad de calcio por unidad de superficie y el riesgo de fractura y es el patrón oro para el diagnóstico de osteoporosis. Sin embargo, esta técnica corre el riesgo de ser imprecisa para estratificar el riesgo de fractura. Por este motivo se han desarrollado diferentes técnicas que evalúan otros parámetros además de la denSIDAd de la masa ósea, como la microarquitectura ósea a través, por ejemplo, de la denSIDAd de las trabéculas, así como otras que directamente evalúan la calidad del material, como la microindentación. Por último, la tomografía computerizada cuantitativa o la biopsia ósea permiten realizar un análisis más preciso del hueso, pero su uso está actualmente relegado a la investigación. Con respecto a los datos sobre la microestructura del hueso, diferentes estudios han comunicado que en PVVIH existe una disminución en el grosor cortical y trabecular de tibia y peroné tanto en hombres como en mujeres de diferentes edades y etnias con respecto a controles no infectados por el VIH 8. En los últimos años se ha incorporado el score óseo trabecular (TBS) como escala para evaluar la microestructura y ha resultado de utilidad en la predicción de fracturas vertebrales 9. La calidad ósea es difícil de evaluar en los estudios clínicos y los datos disponibles son escasos. Guerri-Fernández et al 10, utilizando la técnica de microindentación, y Yin et al 11, el análisis de elementos finitos, demostraron una disminución en la rigidez ósea de PVVIH.
Existen diferentes escalas que estiman el riesgo de osteoporosis densitométrica, identificando así a aquellos pacientes que deberían realizarse una densitometría, y también escalas que estiman el riesgo de fractura, que tienen como objetivo detectar a aquellos pacientes de alto riesgo de sufrir fractura ósea por fragilidad. La más utilizada es la escala FRAX®, que se ha adaptado a cada país.
POBLACIÓN O GRUPOS DIANA DE LA ESCALA Y OBJETIVOS
Las PVVIH son un grupo específico en el que existe un riesgo aumentado de fractura ósea, que no sólo depende de los factores de riesgo clínicos tradicionales 51213. Además de estos factores, existen otros relacionados con el VIH que también se asocian a un mayor riesgo de fractura. Entre ellos destacan la inflamación sistémica crónica, el síndrome de reconstitución inmune, el inicio del TAR, el uso de TDF y/o de algunos IP, la coinfección con hepatitis B o C, los niveles bajos de CD4 o una enfermedad que defina el SIDA.
El objetivo de las escalas que evalúan el riesgo de osteoporosis es la identificación de aquellos pacientes que más se beneficiarían de realizar una densitometría.
El objetivo de las escalas que evalúan el riesgo de fractura es el de disponer de una herramienta para la toma de decisiones terapéuticas. Dado que el evento a evitar es la fractura, aquellos pacientes con mayor riesgo de fractura será a los que habrá que tratar de forma más agresiva.
ESCALAS EVALUADAS EN POBLACIÓN CON VIH
Existen múltiples escalas que combinan diferentes parámetros demográficos y clínicos y estiman, o bien el riesgo de osteoporosis densitométrica, o bien el riesgo de fractura de fragilidad.
- Las escalas que han evaluado riesgo de osteoporosis (entendido como masa ósea baja) han sido, por orden de complejidad, las herramientas OST, ORAI OSIRIS y SCORE, cuyas principales características se recogen en la Tabla 1. Ninguna de ellas ha sido validada en población con VIH.
- Por otro lado, las escalas que mejor han evaluado el riesgo de fractura son Garvan Medical Research Institute®, QFracture Index® y FRAX Tabla 1. Sólo FRAX ha sido validada en PVVIH. Esta escala puede también utilizarse sin DMO para evaluar el riesgo de osteoporosis.
- De los algoritmos previamente expuestos, FRAX® es el de uso más generalizado, está auspiciado por la OMS y ha sido ampliamente divulgado y adaptado a múltiples países. La validez del FRAX® ha sido analizada en población española no-VIH y en población VIH no española, y en ambas infra-estima el riesgo de fractura osteoporótica mayor 141516, especialmente en población VIH, aunque la predicción mejora parcialmente al incluir la infección por el VIH como causa de osteoporosis secundaria 15.
ESCALAS RECOMENDADAS
a) Escalas para la detección de osteoporosis
-
- La escala recomendada en población VIH, por universalidad de aplicación y por su validación en PVVIH, sería la escala FRAX sin DXA, que calcula a través de la combinación de factores de riesgo clínicos la probabilidad de presentar una fractura principal (incluye cadera, vertebral clínica, húmero y antebrazo) o una fractura de cadera en los siguientes 10 años 141516 (BIII).
- Calculadora de riesgo: https://www.sheffield.ac.uk/FRAX/tool.1aspx?country=9
- Los criterios de aplicación del FRAX sin DXA serían: PVVIH >40 años, con ≥1 factores de riesgo clásicos para fractura.
-
- Interpretación: A partir de un determinado riesgo de fractura (para fractura de cadera > 3% o fractura osteoporótica mayor >5%), se debería considerar realizar la DXA para complementar la información clínica.
b) Escalas para valorar el riesgo de fractura
La escala recomendada en población VIH es la escala FRAX con DXA, ya que la DXA aumenta la exactitud y fiabilidad de la predicción del riesgo de fractura por FRAX (BII).
-
- Calculadora de riesgo: https://www.sheffield.ac.uk/FRAX/tool.aspx?country=9
- Los criterios de aplicación del FRAX con DXA serían:
- PVVIH >40 años en presencia de factores de riesgo clásicos 1718.
- También se debe calcular en presencia de una DMO reducida, cuando se plantee comenzar tratamiento específico para la
-
- Interpretación: umbrales de riesgo a considerar:
- Riesgo elevado de fractura: FRAX® para cadera ≥ 3% o para fractura principal ≥ 10% sin DXA o ≥ 7,5% con Un estudio realizado en España (en población no VIH, y en el ámbito territorial de Cataluña) consideró umbral de alto riesgo de fractura osteoporótica mayor si FRAX®, con o sin DXA, ≥7,5% y riesgo intermedio, entre el 5 y el 7,5%; sin embargo, este estudio tenía como limitación la poca representación de la población de riesgo medio 16.
- Interpretación: umbrales de riesgo a considerar:
El grupo redactor, basándose en panel de expertos de la Sociedad Española de Reumatología (SER) de 2018 (grado de acuerdo 55%) 19, considera también como alto riesgo de fractura, la asociación de dos o más factores de riesgo elevados, que puede servir como punto de partida para evaluar la DMO en el caso de no utilizar la herramienta FRAX.
Las medidas terapéuticas específicas en personas con VIH con riesgo elevado de fractura o con osteoporosis no son objetivo de este capítulo y se detallan en otras guías 17. No existe hasta el momento evidencia sobre la eficacia de estas medidas en la reducción de la incidencia de fracturas.
Tablas:
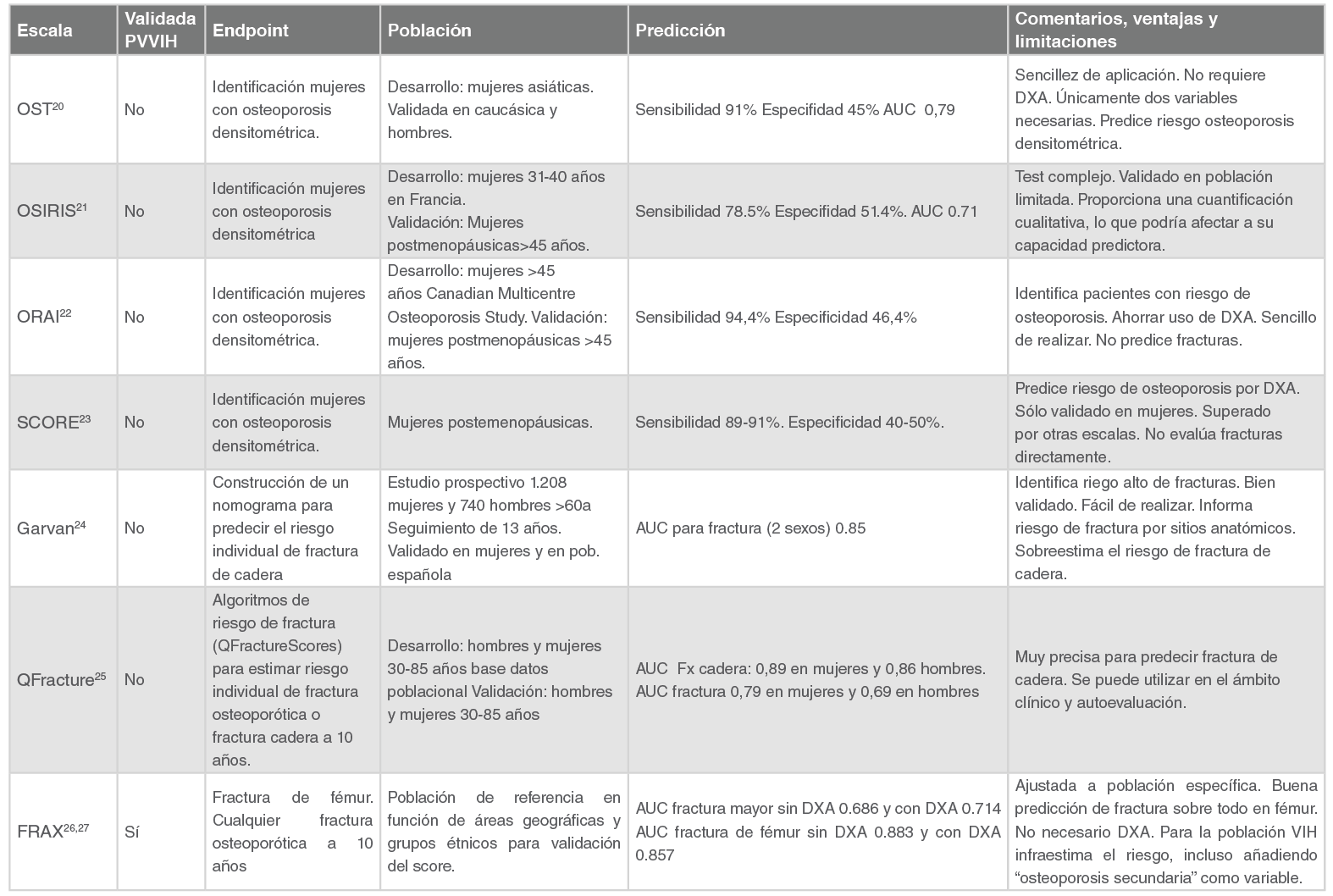
PVVIV, personas que viven con VIH; AUC, área bajo la curva; DXA, densitometría ósea o absorciometría de rayos X de energía dual.
Bibliografía:
Battalora L, Buchacz K, Armon C, Overton ET, Hammer J, Patel P, et al. Low bone mineral density and risk of incident fracture in HIV-infected adults. Antivir Ther 2016; 21: 45–54.
Borges AH, Hoy J, Florence E, Sedlacek D, Stellbrin H-J, Uzdaviniene V, et al. Antiretrovirals, fractures and osteonecrosis in a large international HIV Clin Infec Dis 2017; 64: 1413–21.
Assoumou L, Katlama C, Viard J-P, Bentata M, Simon A, Roux C, et Changes in bone mineral density over a 2-year period in HIV-1-infected men under combined antiretroviral therapy with osteopenia. AIDS 2013; 27:2425–30.
Bedimo R, Maalouf NM, Zhang S, Drechsler H, Tebas P. Osteoporotic fracture risk associated with cumulative exposure to tenofovir and other antiretroviral AIDS 2012; 26: 825–31.
Güerri-Fernández R, Vestergaard P, Carbonell C, Knobel H, Avilés FF, Soria A, et al. HIV Infection Is Strongly Associated With Hip Fracture Risk, Independently of Age, Gender, and Comorbidities:A Population‐Based Cohort J Bone Miner Res 2013; 28: 1259–63.
Shiau S, Broun EC, Arpadi SM, Yin MT. Incident fractures in HIV-infected individuals. AIDS 2013l; 27:1949–57.
Ilha TASH, Comim FV, Copes RM, Compston JE, Premaor MO. HIV and Vertebral Fractures: a Systematic Review and Sci Report 2018; 8: 7838
Tan DHS, Raboud J, Szadkowski L, Szabo E, Hu H, Wong Q, et al. Novel imaging modalities for the comparison of bone microarchitecture among HIV+ patients with and without fractures: a pilot study. HIV Clinical Trials 2017; 18: 28–38.
Ciullini L, Pennica A, Argento G, Novarini D, Teti E, Pugliese G, et al. Trabecular bone score (TBS) is associated with sub-clinical vertebral fractures in HIV-infected patients. J Bon Miner Metab 2018; 36: 111–8.
Güerri-Fernández R, Molina D, Judit Villar-Garcia, Prieto-Alhambra D, Mellibovsky L, Nogues X, et HIV Infection Is Associated With Worse Bone Material Properties, Independently of Bone Mineral Density. J Acquir Immune Defic Syndr 2016; 72:314–8.
Yin MT, Lund E, Shah J, Zhang CA, Foca M, Neu N, et al. Lower peak bone mass and abnormal trabecular and cortical microarchitecture in young men infected with HIV early in life. AIDS 2014; 28: 345–53.
Prieto-Alhambra D, Güerri-Fernández R, De Vries F, Lalmohamed A, Bazelier M, Starup-Linde J, et al. HIV Infection and Its Association With an Excess Risk of Clinical Fractures: A Nationwide Case–Control J Acquir Immune Defic Syndr 2014; 66: 90–5.
Edo LP, Ruiz AA, Vilaseca DR, Vadillo AG, Gay NG, Peris P, et Actualizaciación 2011 del consenso Sociedad Española de Reumatología de osteoporosis. Reumatol Clin 2011; 7: 357–79.
Azagra R, Roca G, Zwart M, Encabo G. Diferencias en los valores predictivos de la herramienta FRAX™ entre población española y del Reino Unido y consideraciones sobre el umbral de intervención. Med Clin (Barc.) 2011; 137: 713–4.
Yin MT, Shiau S, Rimland D, Gibert CL, Bedimo RJ, Rodriguez-Barradas MC, et al. Fracture prediction with modified-FRAX in older HIV-infected and uninfected J Acquir Immune Defic Syndr 2016; 72: 532-20.
Azagra R, Roca G, Encabo G, Aguyé A, Zwart M, Güell S, et al. FRAX tool, the WHO algorithm to predict osteoporotic fractures: the first analysis of its discriminative and predictive ability in the Spanish
EACS Guidelines version 10.0 (nov 2019) http://www.eacs.sandforguide.com (último acceso el 11 de enero de 2020)
Grupo de expertos de Documento de consenso sobre la osteoporosis en la infección por el VIH Mayo 2016.
Hernández AN, del Campo Fontecha PD, Acín MPA, Rodríguez LA, Burgos EC, Castañeda S, et al. Recomendaciones de la Sociedad Española de Reumatología sobre osteoporosis. Reumatol Clin 2019; 15: 188–210.
K. Koh, W.B. Sedrine, T.P. Torralba, A. Kung, S. Fujiwara, S.P. Chan, et al. A simple tool to identify Asian women at increased risk of osteoporosis. Osteoporos Int 2001; 12:699-705
Reginster JY1, Ben Sedrine W, Viethel P, Micheletti MC, Chevallier T, Audran Validation of OSIRIS, a prescreening tool for the identification of women with an increased risk of osteoporosis. Gynecol Endocrinol 2004; 18:3-8.
Cadarette SM, Jaglal SB, Kreiger N, McIsaac WJ, Darlington GA, Tu JV. Development and validation of the Osteoporosis Risk Assessment Instrument to facilitate selection of women for bone densitometry. CMAJ 2000;162:1289–94.
Lydick, K. Cook, J. Turpin, M. Melton, R. Stine, C. Byrnes Development and validation of a simple questionnaire to facilitate identification of women likely to have low bone density Am J Manag Care 1998; 4: 37-48
Sandhu SK, Nguyen ND, Center JR, Pocock NA, Eisman JA, et al. Prognosis of fracture: evaluation of predictive accuracy of the FRAX algorithm and Garvan nomogram. Osteoporosis International 2010; 21: 863–71
Hippisley-Cox J1, Coupland C. Derivation and validation of updated QFracture algorithm to predict risk of osteoporotic fracture in primary care in the United Kingdom: prospective open cohort study. BMJ 2012; 344:e3427
Kanis JA, Johnell O, Oden A, Johansson H, McCloskey E. FRAX and the assessment of fracture probability in men and women from the UK. Osteoporosis international: a journal established as result of cooperation between the European Foundation for Osteoporosis and the National Osteoporosis Foundation of the USA 2008; 19:385–97.
Mao‐Song Tsai, Jun‐Yu Zhang, Hsin‐Yun Sun, Wen‐Chun Liu, Pei‐Ying Wu, Chia‐Jui Yang, Chien‐Ching Hung Performance of fracture risk assessment tool in HIV‐positive male individuals aged ≥45 years on suppressive antiretroviral therapy. J Int AIDS Soc 2019; 22: e25383.
7. Escalas para valorar fragilidad en pacientes ancianos
7.1. INTRODUCCIÓN
7.2. POBLACIÓN O GRUPOS DIANA DE ESCALA Y OBJETIVOS
7.3. ESCALAS EVALUADAS EN POBLACIÓN CON VIH
7.4. ESCALAS RECOMENDADAS
INTRODUCCIÓN
La edad biológica per se puede ofrecer una información limitada sobre el proceso de envejecimiento, ya que existen muy diferentes fenotipos de envejecimiento para una misma edad 1. Por este motivo surge el concepto de fragilidad, que se suele definir como un “síndrome biológico de disminución de la reserva funcional y resistencia a los estresores, debido al declive acumulado de múltiples sistemas fisiológicos que originan pérdida de la capacidad para compensar el equilibrio homeostático, causando vulnerabilidad y asociándose a eventos adversos” 123. En una revisión sistemática y un meta-análisis sobre prevalencia de fragilidad en 22 países europeos, la prevalencia global fue del 18%, aumentando con la edad, el sexo femenino, el bajo nivel socioeconómico y la presencia de comorbilidades 4.
De acuerdo a este concepto de fragilidad, los individuos se pueden clasifican en robustos, pre-frágiles y frágiles. Es importante identificar y cuantificar la fragilidad del paciente, dado que el manejo y la atención clínica deben ser diferentes según el grado de ésta. Existe una posible “ventana terapéutica” en la que el paciente pre-frágil y frágil se puede beneficiar de medidas preventivas encaminadas a preservar sus reservas funcionales y cognitivas. Aquellos estados en los que se considera que la situación de dependencia es irreversible, los esfuerzos se centrarían en aplicar medidas de máximo confort y limitar las intervenciones terapéuticas agresivas.
La población con VIH está envejeciendo y, cuando se compara con otras poblaciones de edades similares 56, lo hace con una mayor prevalencia de comorbilidades, lo que aumenta el riesgo de fragilidad en esta población (mayor riesgo de caídas, de hospitalizaciones, etc.) 7. De hecho, este síndrome es más frecuente de lo esperable en personas con VIH en comparación con sus controles pareados seronegativos 8. Por este motivo, es recomendable considerar la introducción de escalas para medir la fragilidad en esta población.
POBLACIÓN O GRUPOS DIANA DE ESCALA Y OBJETIVOS
La población incluida en los estudios de desarrollo de las escalas han sido personas de ≥ 65 años. Las sociedades de geriatría recomiendan evaluar la presencia de fragilidad a todos los pacientes mayores de 65 años. Por el contrario, las únicas guías de VIH que recomiendan la valoración de fragilidad en pacientes ancianos son las guías italianas que establecen que, debido a la aceleración del proceso de envejecimiento en la población VIH, se debería hacer a partir de los 50 años 9.
El objetivo de las escalas de fragilidad es identificar a los pacientes con alto riesgo de desarrollar complicaciones relacionadas con el envejecimiento, lo que tendría implicaciones tanto en el manejo clínico (ver más adelante), como para el desarrollo de futuras investigaciones sobre la etiología y las intervenciones para prevenir o retrasar la progresión de la fragilidad.
ESCALAS EVALUADAS EN POBLACIÓN CON VIH
En la literatura existen más de cincuenta escalas diferentes para medir la fragilidad en las personas mayores 10. Sin embargo, tan sólo dos de ellas han sido validadas en población con VIH. Estas son el fenotipo de fragilidad (FF) y el índice de fragilidad (IF). Por otro lado, y desde un punto de vista práctico, el “Veterans Aging Cohort Study Index” (índice de VACs) es un índice desarrollado para estimar supervivencia que también se ha correlacionado con el síndrome de fragilidad 11.
a) Fenotipo de fragilidad (FF)
Se basa en la presencia de determinados signos y síntomas. Elaborado por Fried et al 2, mide 5 dominios: pérdida de peso no intencionada, debilidad o disminución de la fuerza de presión manual, cansancio, disminución en la velocidad de la marcha, y baja actividad física Tabla 1. La presencia de uno o dos de estos criterios clasifica al individuo como pre-frágil, y tres o más como frágil.
El FF ha demostrado asociarse, en población ambulatoria no infectada por VIH y mayor de 65 años, con un mayor riesgo de caídas, empeoramiento de la movilidad, del desempeño de las actividades de la vida diaria, y de hospitalizaciones y muerte tanto a los tres como a los siete años de seguimiento 2. La presencia de pre-fragilidad también se asocia con una mayor incidencia de estos eventos, aunque de menor intenSIDAd.
Como ejemplo, el riesgo de muerte a tres años de los individuos frágiles frente a los no frágiles es de 2,24, siendo para los pre-frágiles de 1,49. Por otro lado, diversos estudios de cohortes (MACS, AGEhIV, WIHS) han demostrado que el FF se observa a edades más tempranas en los pacientes infectados por VIH frente a sus controles seronegativos 1112131415.
Esta escala ha ayudado a estimar en diferentes cohortes que incluyen pacientes con VIH con edades medias que oscilan de los 41 a los 49 años, que la prevalencia de pre-fragilidad es de hasta a un 39%, y la de fragilidad del 2-9% 111617. Este índice también ha demostrado asociarse con una mayor mortalidad entre los individuos con VIH, en los que el riesgo de muerte se duplica en los pacientes frágiles respecto a los no frágiles 18. Así mismo, se asocia, entre otros, con un mayor riesgo de hospitalización y de caídas en esta población 161718192021.
b) Indice de Fragilidad (IF)
Es otra herramienta para establecer el diagnóstico de fragilidad, en este caso midiéndolo como la presencia de enfermedades o el acúmulo de déficits 22. El IF incluye una lista de síntomas y signos, enfermedades, discapacidades y determinaciones analíticas, que miden la fragilidad de acuerdo a la proporción de déficits que acumula el paciente, no según la naturaleza y severidad de los En población mayor seronegativa se ha asociado con un mayor riesgo de hospitalización y de muerte 23. Una de las ventajas del IF es su fácil aplicación en la práctica clínica diaria. En población con VIH, casi todos los estudios que evalúan el IF han sido llevados a cabo por el grupo de Guaraldi et al. 24. En este caso, los autores seleccionaron un conjunto de 37 variables Tabla 2. Para que el índice sea fiable, se recomienda tener recogidas al menos 30 variables. Según los datos publicados por estos autores, el IF calculado por este método se asoció al desarrollo de pluripatología y de mortalidad. Aunque se trata de una variable continua que oscila desde “nada frágil” a “totalmente frágil” 1, los autores clasifican a los pacientes como “pre-frágiles” (0,10-0,21), “frágiles” (0,21-0,45), y “muy frágiles” (>0,45) 25. Otros grupos consideran frágiles a los individuos con VIH con un IF >0,25, y como pre-frágiles a aquellos con un IF de 0,08-0,25 20. Este IF también se ha asociado en población VIH con un mayor riesgo de morbi-mortalidad, de caídas, y de discapacidad, entre otros 2627.
c) Escala de Fragilidad de Edmonton (EFE)
Evalúa 10 dominios que incluyen: estado anímico, independencia funcional, medicación, apoyo social, nutrición, hábitos saludables, continencia, enfermedades, calidad de vida, deterioro cognitivo, equilibrio y motilidad Tabla 3 20. Esta escala puntúa cada dominio. Si la puntuación global es de 0-4 se define al individuo como robusto, de 5-6 pre-frágil y de 7 o más como frágil. La EFE se ha estudiado y correlacionado con otros índices de fragilidad tan sólo en una cohorte de 93 pacientes con VIH australianos con un diseño transversal 20. En este estudio, la EFE se asoció con un mayor riesgo de osteoporosis y de eventos SIDA y no SIDA. Es un índice fácil de usar que no precisa personal entrenado ni de un equipamiento especial. Sin embargo, es más difícil de interpretar y no está adecuadamente validado en población con
d) Índice de VACS
Se desarrolló como un índice pronóstico más que como un índice de Incluye variables relacionadas y no relacionadas con el VIH (edad, sexo, raza, CD4, RNA-VIH, hemoglobina, GOT, GPT, Fib4, creatinina sérica, aclaramiento de creatinina, infección por VHC) 11. Se ha asociado con un mayor riesgo de morbi- mortalidad y fracturas. En un estudio que incluyó 303 pacientes se observaron, de un modo significativo, índices VACS mayores en los pacientes pre-frágiles o frágiles, por lo que los autores sugieren que podría emplearse como una herramienta para medir la fragilidad 14. Hasta la fecha, no existen puntos de corte ni ha sido adecuadamente validado como para utilizarlo en la medición de la fragilidad. Comparado con los índices anteriores, predice algo mejor mortalidad que el FF y de manera similar al IF 20. En un estudio español, el índice VACS predijo, de forma independiente, el riesgo de pre- fragilidad y fragilidad medidos por el FF 17.
Comparación entre las escalas:
El IF y el FF han sido comparados en pacientes infectados por VIH en un estudio transversal 28. En este estudio se observó una correlación modesta entre las categorías de fragilidad medidas por ambas escalas. Ambas se asociaban con tener un mayor número de comorbilidades. El IF se relacionaba con haber presentado más caídas y discapacidad. Los autores concluyeron que ambos índices representan diferentes dominios de la enfermedad por VIH y que, por tanto, serían complementarios. El FF es más fácil de aplicar, sin embargo, utiliza pruebas que normalmente no se usan en la práctica clínica habitual (neceSIDAd de un dinamómetro, de un cronómetro…). Para facilitar la implementación del FF algunos autores realizan tan sólo cuatro pruebas, excluyendo el dinamómetro, que normalmente no está disponible en las consultas 21. Sin embargo, en población general se ha podido comprobar que la medición de la fuerza muscular, una prueba objetiva, tiene valor pronóstico 29.
La Tabla 4 resume la asociación entre diferentes eventos e índices de fragilidad en población con VIH. En la Tabla 5 se describen las ventajas e inconvenientes de las principales escalas que evalúan la fragilidad.
ESCALAS RECOMENDADAS
A pesar de la mayor facilidad de aplicación del IF, por la mayor experiencia acumulada y su mayor uso en personas infectadas por VIH, se recomienda el empleo de la escala Fenotipo de fragilidad de Fried (BII).
a) Criterios de inclusión para la aplicación de la escala
-
- Se recomienda medir la fragilidad, al menos con una periodicidad anual, en aquellos pacientes VIH mayores de 65 años, especialmente si presentan algún tipo de déficit (BIII).
- Se podría considerar medir la fragilidad independientemente de la edad en aquellos pacientes VIH que presenten alguna de las siguientes características (CIII) 30:
- Hospitalización por cualquier causa en el último año
- Caídas que haya precisado atención socio-sanitaria en el último año o que presentaran al menos dos caídas aunque no precisaran de atención socio- sanitaria).
- Diagnóstico de al menos dos
-
- Polifarmacia crónica (>6 meses).
- Entorno socio-económico
b) Interpretación:
-
- La Tabla 1 del Fenotipo de fragilidad de Fried 2 incluye una breve explicación sobre las categorías que definen prefragilidad y fragilidad en relación con la presencia de los 5 criterios Se define al paciente como:
- Prefrágil: si presenta uno o dos
- Frágil: si presenta tres o más
- La Tabla 1 del Fenotipo de fragilidad de Fried 2 incluye una breve explicación sobre las categorías que definen prefragilidad y fragilidad en relación con la presencia de los 5 criterios Se define al paciente como:
b) Recomendaciones en función de los valores obtenidos:
De acuerdo a las guías de la EACS 31, en caso de que la escala detecte fragilidad, se podría plantear una evaluación geriátrica extensa que identifique las limitaciones existentes con el fin de personalizar las intervenciones para mejorar la salud y la ca- lidad de vida. Aunque no existe evidencia para ninguna de estas medidas, algunas recomendaciones en población con VIH podrían incluir:
-
- Ejercicio físico
- Medidas para reducir la polifarmacia
- Identificar causas modificables de fatigabilidad física
- Valorar causas de pérdida no deseada de peso y suplementar la dieta
- Tratar con vitamina D si déficit
Tablas:
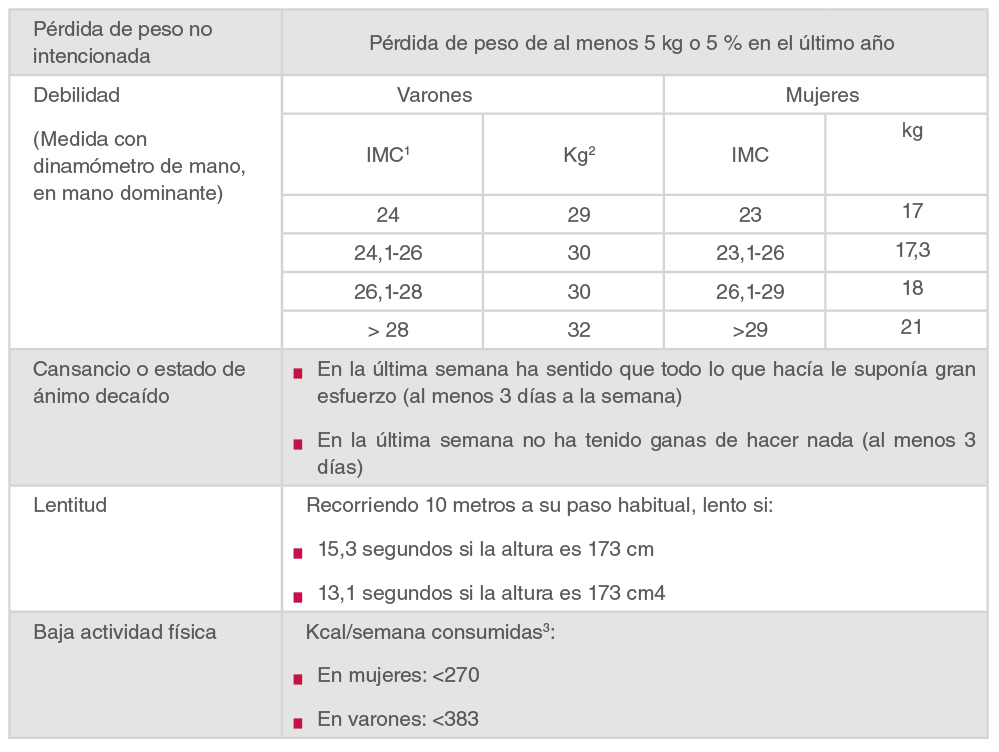
1 IMC, medido como Kg/m²; 2 Fuerza en Kg medida con el dinamómetro;
3Equivale a moverse menos de 30 min/día o 2,5 horas por semana
Nota explicativa: Se define al paciente como[2]:
- Prefrágil: si presenta uno o dos
- Frágil: si presenta tres o más
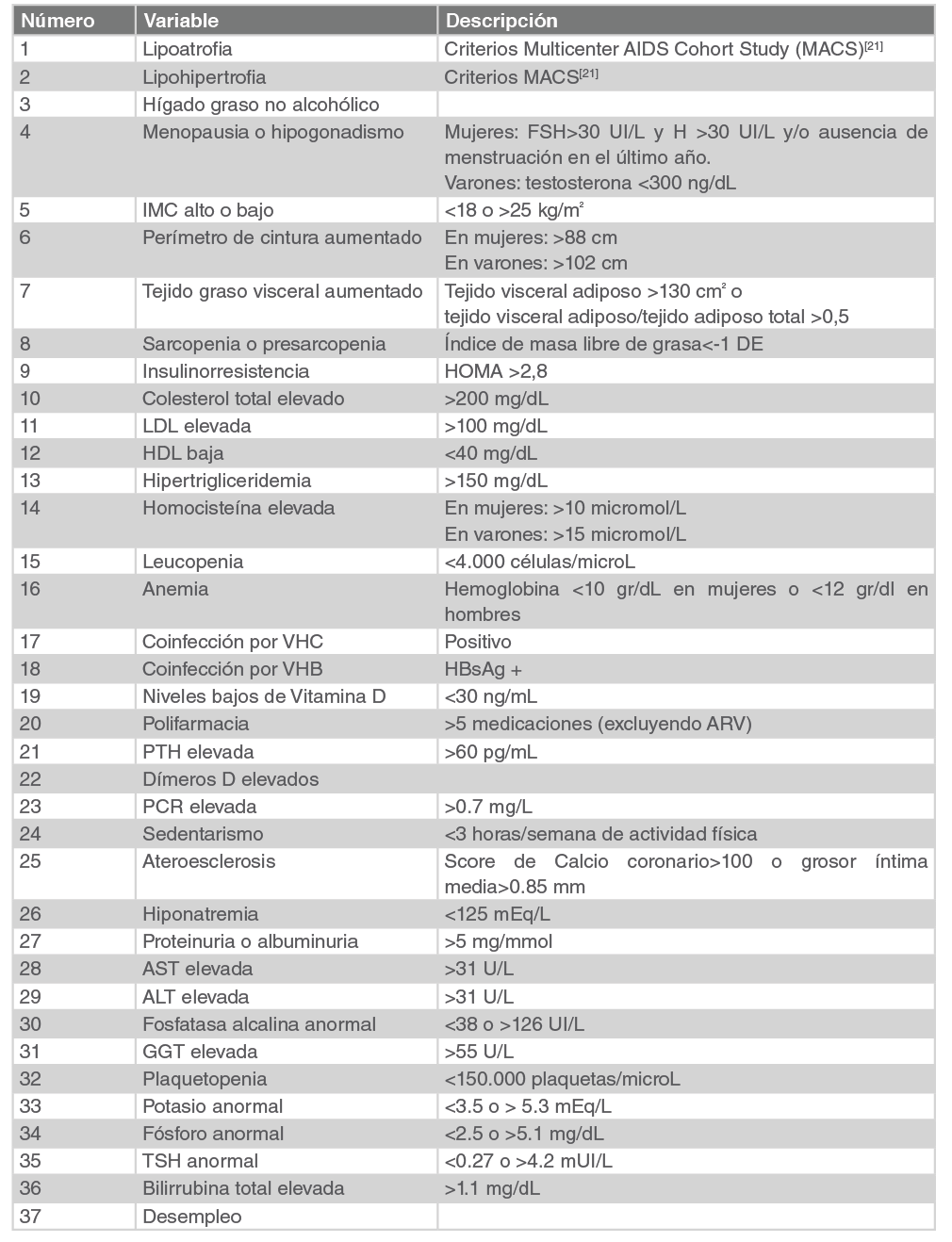
Nota explicativa: Cada ítem se puntúa como 0 (no presente) o 1 (presente). IF= suma de puntos dividida por el número de variables evaluadas. Se trata de una variable continua que oscila desde “nada frágil” a “totalmente frágil” 125:
Prefrágil; 0,1-0,20
Frágil: 0,21-0,45 Muy frágil; > 0,45

Nota explicativa:
- Normal o robusto: 0-4
- Pre-frágil: 5-6
- Frágil: 7 o más
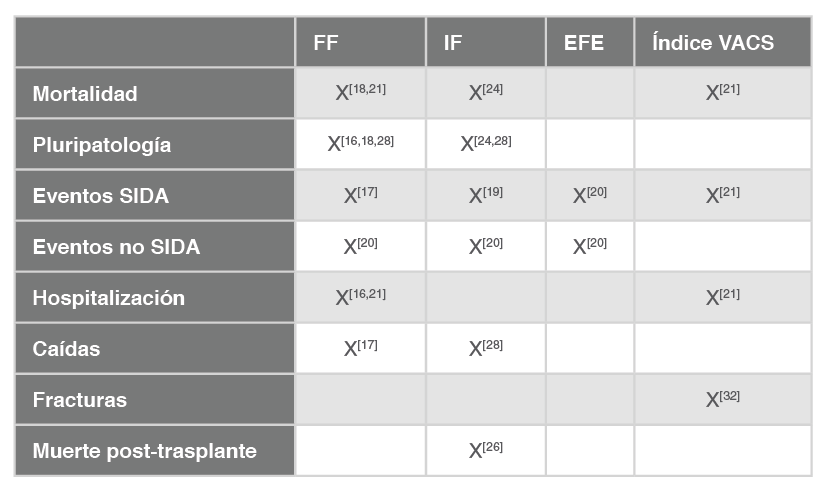
FF: fenotipo de fragilidad de Fried; IF: Índice de fragilidad; EFE: Escala de Fragilidad de Edmonton.
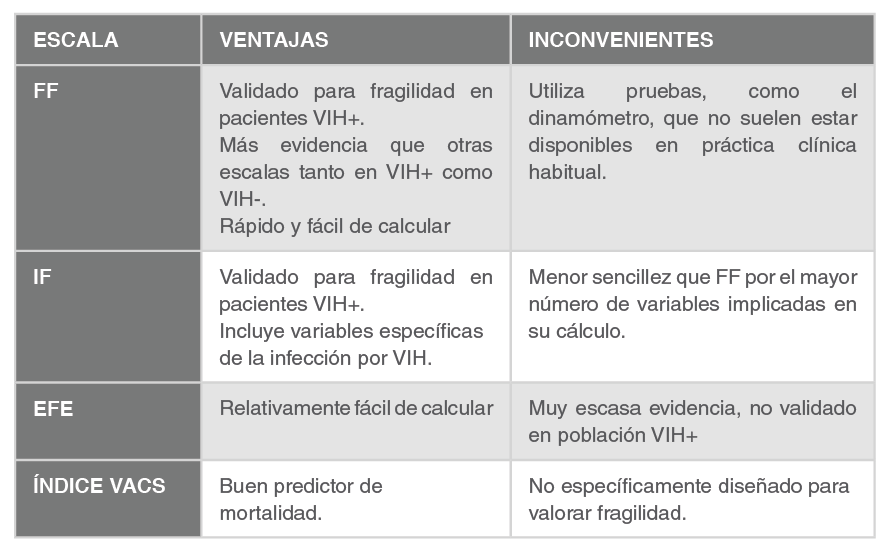
FF: fenotipo de fragilidad de Fried; IF: Índice de fragilidad; EFE: Escala de Fragilidad de Edmonton.
Bibliografía:
Stoff DM, Goodkin K, Jeste D, Marquine M. Redefining Aging in HIV Infection Using Phenotypes. Curr HIV/AIDS Rep 2017; 14:184-99.
Fried LP, Tangen CM, Walston J, Newman AB, Hirsch C, Gottdiener J, et al. Frailty in older adults: evidence for a J Gerontol A Biol Sci Med Sci 2001; 56:M146-156.
Clegg A, Young J, Iliffe S, Rikkert MO, Rockwood Frailty in elderly people. Lancet 2013; 381(9868):752- 62.
O’Caoimh R, Galluzzo L, Rodríguez-Laso Á, Van der Heyden J, Ranhoff AH, Lamprini-Koula M, et al. Work Package 5 of the Joint Action ADVANTAGE. Prevalence of frailty at population level in European ADVANTAGE Joint Action Member States: a systematic review and meta-analysis. Ann Ist Super Sanita 2018;54:226-38.
Sabin C, Reiss Epidemiology of ageing with HIV: what can we learn from cohorts? AIDS 2017;31:S121- 8.
Guaraldi G, Orlando G, Zona S, Menozzi M, Carli F, Garlassi F, et Premature age-related comorbidities among HIV-infected persons compared with the general population. Clin Infec Dis 2011;53:1120-6.
Negredo E, Back D, Blanco JR, Blanco J, Erlandson KM, Garolera M, et al. Aging in HIV-Infected Subjects: A New Scenario and a New Biomed Res Int 2017;2017:5897298.
Kooij KW, Wit FW, Schouten J, van der Valk M, Godfried MH, Stolte IG, et al. HIV infection is independently associated with frailty in middle-aged HIV type 1-infected individuals compared with similar but uninfected AIDS 2016;30:241-50
New italian guidelines on the use of antiretroviral therapy and the clinical diagnostic and management of HIV-1 infected En: http://www.salute.gov.it/imgs/C_17_pubblicazioni_2696_allegato.pdf
Wilke Faller J, do Nascimento Pereira D, de Souza S, Kenji Nampo F, de Souza Orlandi F, Matumoto S. Instruments for the detection of frailty síndrome in older adults: A systematic review. PLoS One 2019; 14:e0216166.
Escota GV, Patel P, Brooks JT, Bush T, Conley L, Baker J, et al. Short communication: The Veterans Aging Cohort Study Index is an effective tool to assess baseline frailty status in a contemporary cohort of HIV-infected AIDS Res Hum Retroviruses 2015; 31:313-7.
Althoff KN, Jacobson LP, Cranston RD, Detels R, Phair JP, Li X, et al. Age, comorbidities, and AIDS predict a frailty phenotype in men who have sex with J Gerontol A Biol Sci Med Sci 2014; 69:189- 98.
Desquilbet L, Jacobson LP, Fried LP, Phair JP, Jamieson BD, Holloway M, et al. HIV-1 infection is associated with an earlier occurrence of a phenotype related to J Gerontol A Biol Sci Med Sci 2007; 62:1279-86.
Kooij KW, Wit FW, Schouten J, van der Valk M, Godfried MH, Stolte IG, et al. HIV infection is independently associated with frailty in middle-aged HIV type 1-infected individuals compared with similar but uninfected AIDS 2016; 30:241-50.
Thurn M and Gustafson Faces of frailty in aging with HIV infection. Curr HIV/AIDS Rep 2017;14:31-7.
Onen NF, Agbebi A, Shacham E, Stamm KE, Onen AR, Overton Frailty among HIV-infected persons in an urban outpatient care setting. J Infect 2009; 59:346-52.
Blanco JR, Barrio I, Ramalle-Gómara E, Beltrán MI, Ibarra V, Metola L, et al. Gender differences for frailty in HIV-infected patients on stable antiretroviral therapy and with undetectable viral load. PLoS One 2019;14:e0215764.
Piggott DA, Muzaale AD, Mehta SH, Brown TT, Patel KV, Leng SX, et al. Frailty, HIV infection, and mortality in an aging cohort of injection drug PLoS One 2013; 8:e54910.
Rees HC, Ianas V, McCracken P, Smith S, Georgescu A, Zangeneh T, et al. Measuring frailty in HIV- infected Identification of frail patients is the first step to amelioration and reversal of frailty. J Vis Exp 2013; (77).
Yeoh HL, Cheng A, Palmer C, Crowe SM, Hoy JF. Frailty in men living with HIV: a cross-sectional comparison of three frailty Antivir Ther 2018; 23:117-27.
Akgün K, Tate J, Crothers K, Criystal S, Leaf D, Womanck J, et An adapted frailty-related phenotype and the VACS Index as predictors of hospitalization and mortality in HIV-infected and uninfected individuals. J Adquir Immune Defic Syndr 2014;67:397-404.
Mitnitski AB, Mogilner AJ, Rockwood Accumulation of deficits as a proxy measure of aging. ScientificWorldJournal 2001; 1:323-36.
Mitnitski A, Song X, Skoog I, Broe GA, Cox JL, Grunfeld E, et al. Relative fitness and frailty of elderly men and women in developed countries and their relationship with mortality. J Am Geriatr Soc 2005; 53:2184-9.
Guaraldi G, Brothers TD, Zona S, Stentarelli C, Carli F, Malagoli A, et al. A frailty index predicts survival and incident multimorbidity independent of markers of HIV disease AIDS 2015; 29:1633-41.
Hoover M, Rotermann M, Sanmartin C, Bernier J. Validation of an index to estimate the prevalence of frailty among community-dwelling Health Rep 2013; 24:10-7.
Guaraldi G, Dolci G, Zona S, Tarantino G, Serra V, Ballarin R, et al. A frailty index predicts post-liver transplant morbidity and mortality in HIV-positive AIDS Res Ther 2017; 14:37.
Guaraldi G, Zona S, Silva AR, Menozzi M, Dolci G, Milic J, et al. The dynamic association between Frailty, CD4 and CD4/CD8 ratio in people aging with PLoS One 2019; 14:e0212283.
Guaraldi G, Malagoli A, Theou O, Brothers TD, Wallace L, Torelli R, et Correlates of frailty phenotype and frailty index and their associations with clinical outcomes. HIV Medicine 2017;18:764-71.
Rijk JM, Roos PR, Deckx L, van den Akker M, Buntinx Prognostic value of handgrip strength in people aged 60 years and older: A systematic review and meta-analysis. Geriatr Gerontol Int 2016;16:5-20.
Bloch, Frailty in people living with HIV. AIDS Res Ther 2018; 15:19
EACS Guidelines version 0 (nov 2019) http://www.eacs.sandforguide.com (último acceso el 11 de enero de 2020)
Womack H, Goulet J, Gibert C, Brandkt C, Skanderson M, Gulanski B, et Physiologic frailty and fragility fractures in HIV male veterans. Clin Infect Dis 2013;56:1498-504.
8. Escalas para evaluar depresión
8.1. INTRODUCCIÓN
8.2. POBLACIÓN O GRUPOS DIANA DE LA ESCALA Y OBJETIVOS
8.3. ESCALAS DE CRIBADO DE DEPRESIÓN EVALUADAS EN POBLACIÓN CON INFECCIÓN POR VIH
8.4. ESCALAS RECOMENDADAS
INTRODUCCIÓN
La depresión es el trastorno mental más frecuente en pacientes con infección por VIH, siendo su prevalencia mayor que la de la población general (30%-61% en personas que viven con VIH comparada con un 4%-40% en la población general) 1. En nuestro país, Bayón-Pérez et al 2 describieron una prevalencia de depresión del 21% en una cohorte hospitalaria de pacientes con infección por VIH. La depresión se asocia con peor calidad de vida 3, peor situación inmunológica 4, peor adherencia al tratamiento antirretroviral 5 y mayor mortalidad 6.
Frecuentemente, la depresión es infradiagnosticada en pacientes con infección por VIH. Un estudio en EEUU encontró que el 45% de los pacientes con depresión no habían sido diagnosticados previamente 7, y un estudio italiano confirmó que el 87% de los pacientes con depresión severa no habían sido diagnosticados por sus médicos 8. Dada su alta prevalencia, estaría justificado el cribado sistemático a todos los pacientes con VIH 12, lo que podría además contribuir a reducir el infradiagnóstico.
POBLACIÓN O GRUPOS DIANA DE LA ESCALA Y OBJETIVOS
Dada su alta prevalencia en población con VIH y las conseuencias negativas sobre el pronóstico, se recomienda realizar cribado de depresión a todos los pacientes. El objetivo es conseguir un diagnótico precoz que pueda ser confirmado con los test específicos por un psiquiatra.
ESCALAS DE CRIBADO DE DEPRESIÓN EVALUADAS EN POBLACIÓN CON INFECCIÓN POR VIH
El gold standard para el diagnóstico de la depresión es la entrevista estructurada basada en los criterios del Manual Diagnóstico y Estadístico de los Trastornos Mentales (Diagnostical and Statistical Manual of Mental Disorders, DSM) o la Clasificación Internacional de Enfermedades (International Classification of Diseases, ICD). Sin embargo, esta entrevista suele requerir mucho tiempo (alrededor de 45 minutos) y precisa de un psiquiatra o psicólogo con formación adecuada9. Para disminuir el tiempo de la entrevista y que ésta pueda ser realizada por otros profesionales de la salud (con un entrenamiento específico), se desarrolló una entrevista estructurada de 15 minutos, el Mini-International Neuropsychiatric Interview (MINI) 9. Esta entrevista está diseñada para ser utilizada en estudios de investigación y en la práctica clínica, y es el gold standard con el que se comparan las escalas de cribado en la mayoría de los estudios citados en este capítulo. Para detectar la depresión en la práctica clínica diaria, se han desarrollado varias escalas destinadas a realizar el cribado de depresión que no precisan mucho tiempo de consulta e incluso pueden ser autocompletadas por el paciente. Estas escalas están destinadas a detectar pacientes con probable depresión para poder remitirles a un especialista en psiquiatría que confirme el diagnóstico con una entrevista estructurada con los criterios del DSM o ICD 10.
A continuación, se describen las principales escalas de cribado de depresión y su evidencia en población con VIH. Todas ellas fueron desarrolladas primero en población general y después se han evaluado en pacientes con infección por VIH. Se comentarán preferentemente los estudios realizados en nuestro país o, en su defecto, en países de características socioeconómicas similares.
Dos preguntas de la European AIDS Clinical Society (EACS-2)
La EACS recomienda en sus guías cribar la depresión en pacientes con VIH realizando en consulta estas dos preguntas:
- ¿Te has sentido con frecuencia deprimido, triste o sin esperanza en los últimos meses?, y
- ¿Has perdido interés en actividades de las que antes solías disfrutar?
Si el paciente responde “sí” a alguna de las dos opciones, se recomienda evaluar los criterios diagnósticos del DSM-IV para depresión mayor 12.
Estas dos preguntas han sido evaluadas en población con VIH en Dinamarca y en España. En Dinamarca, se encontró buena correlación de las preguntas de la EACS con los síntomas de depresión medidos por el inventario de depresión de Beck (BDI-II, que se detalla más adelante). Comparadas con el BDI-II, la respuesta afirmativa a una de las dos preguntas mostró una sensibilidad del 81% y especificidad del 46%, con un valor predictivo positivo del 40%; y la respuesta afirmativa a ambas mostró los valores de 95%, 68% y 40%, respectivamente 11.
Las dos preguntas de la EACS han sido evaluadas por Bayón-Pérez et al en 113 pacientes españoles con edades entre 18 y 60 años y comparadas con el MINI 2. Comparada con el MINI, la respuesta afirmativa a una de las dos preguntas mostró una sensibilidad del 96%, una especificidad de 71%, un valor predictivo positivo (VPP) 47%, un valor predictivo negativo (VPN) 98% y un área bajo la curva ROC de 83% (IC 95% 75%-91%). La respuesta afirmativa a las dos preguntas mostró unos valores de 83%, 87%, 63%, 95% y 85% (IC 95% 75%-95%), respectivamente. Los autores recomendaron un abordaje diagnóstico en dos pasos: primero usar las dos preguntas de EACS durante la entrevista clínica, que muestran una alta sensibilidad y, para aquellos pacientes que responden afirmativamente a ambas, continuar con la escala HADS-D (descrita más adelante) con un punto de corte ≥8, con el fin de aumentar la especificidad y el VPP.
Hospital anxiety and depression scale (HADS)
La escala HADS 13 fue desarrollada para ser utilizada en el medio hospitalario no psiquiátrico. Posteriormente, se ha demostrado su utilidad para el diagnóstico de depresión y ansiedad también en atención primaria y en la población general sin infección por VIH 14. La versión española de la escala se ha validado también en nuestro país 15 y puede obtenerse en el Documento de consenso sobre las alteraciones psiquiátricas y psicológicas en adultos y niños con infección por el VIH de GeSIDA 16 (Figura 1). Se completa en 2-5 minutos por el propio paciente y consiste en 7 preguntas para depresión (HADS-D) y 7 para ansiedad (HADS-A); la suma de las dos subescalas de depresión (HADS-D) y ansiedad (HADS-A) se denomina HADS-T. Cada pregunta se evalúa en una escala de Likert de 0 a 3 puntos, con un rango de 0 a 21 para depresión o ansiedad, o un rango total de 42 para ambas combinadas. Un punto de corte >=8 en la escala HADS-D tiene la mejor sensibilidad y especificidad en varios estudios de población general. Una importante ventaja de la escala HADS es que está diseñada evitando preguntas sobre síntomas somáticos que pueden generar confusión con los síntomas de otras enfermedades crónicas (como la infección por VIH avanzada).
En población con VIH, la escala ha sido validada en pacientes canadienses, en quienes ha demostrado su fiabilidad y validez y se ha encontrado que, al contrario que el BDI-II, no se veía afectada por la presencia de síntomas de la infección por VIH 17. Las escalas HADS-D y HADS-T han sido evaluadas por Bayón-Pérez et al en el estudio previamente mencionado 2. Comparada con el MINI, la puntuación de HADS-D ≥8 mostró una sensibilidad del 63%, especificidad del 94%, VPP 75%, VPN 90% y área bajo la curva ROC de 78% (IC 95% 66%-91%). La puntuación de HADS-T≥12 mostró los valores de 96%, 78%, 53%, 99% y 87% (IC 95% 79%-94%), respectivamente. Se recomienda utilizar HADS-T cuando se pretenda evaluar la presencia de depresión y ansiedad, y HADS-D si sólo se pretende evaluar la depresión.
Inventario para la Depresión de Beck-II (BDI-II)
Esta escala está diseñada para ser aplicada en la población general mayor de 13 años y puede ser completada por el paciente 18. Está formada por 21 respuestas de selección múltiple que incluyen síntomas de depresión, alteraciones cognitivas y síntomas somáticos (a diferencia del HADS), como fatiga, pérdida de apetito o pérdida de peso. La escala puede dar un valor de 0 a 63. Fue diseñada para valorar la gravedad de la depresión y no su diagnóstico; sin embargo, se ha usado extensamente en estudios de investigación en VIH para el cribado de depresión, utilizando un punto de corte de ≥14 puntos para identificar la depresión leve y ≥20 puntos para la depresión moderada-grave. Como inconveniente, los síntomas somáticos pueden no ser debidos a depresión, sino a otra enfermedad orgánica, como podría ocurrir en el caso de la infección por VIH, lo que puede aumentar falsamente la puntuación. Para evitar esto, se desarrolló una versión corta con 7 items (Beck’s Depression Inventory for Primary Care, BDI-PC) que evita los síntomas somáticos y no evalúa la gravedad, con un resultado binario (deprimido o no deprimido, a partir de un punto de corte de 4) y con una sensibilidad y especificidad del 82% en pacientes hospitalizados de la población general 19. Esta versión no se ha validado en población con VIH.
La escala BDI-II se ha validado en población general española 20 y ha sido ampliamente utilizada para estudios de investigación sobre depresión en pacientes con VIH fuera de España. El principal inconveniente de la BDI-II y BDI-PC es que ambas están sujetas a copyright y por tanto se debe pagar una licencia por cada uso, lo que las hace poco utilizables en la práctica clínica diaria 21.
Patient Health Questionnaire (PHQ-9)
Esta escala está diseñada para el cribado de depresión y para valorar su severidad en atención primaria. Además, es útil para evaluar la respuesta al tratamiento antidepresivo. Consiste en 9 preguntas autoadministradas sobre síntomas depresivos en las 2 últimas semanas, que se responden en una escala de Likert del 0 al 3. De ellas se obtiene un score de 0 a 27: una puntuación ≥10 indica un posible trastorno depresivo, con una sensibilidad y especificidad del 88% en la población general. También incluye una pregunta adicional para determinar si los síntomas depresivos producen repercusión funcional en la vida diaria del paciente. La encuesta se completa en 2 a 4 minutos 22. En algunos estudios se han establecido otros puntos de corte diferentes con mejor sensibilidad y especificidad (entre 8 y 11) 24. La versión española de esta escala está disponible en la página web del National Immigrant Women’s Advocacy Project 25.
En nuestro país, esta escala se ha evaluado sólo en la población general 26, con una sensibilidad del 84% (IC 95% 75%-94%) y especificidad del 92% (IC 95% 91%-92%) para el diagnóstico de depresión mayor, comparada con una entrevista con un psiquiatra. En población con infección por VIH, se ha evaluado ampliamente en varios países de África subsahariana con buenos resultados. En EEUU, se ha evaluado en pacientes con VIH demostrando su aceptabilidad, consistencia en los resultados en grupos de diferentes características clínicas y demográficas, y utilidad para el cribado de depresión en pacientes con infección por VIH 27. En Canadá, la escala mostró un mejor rendimiento diagnóstico con un punto de corte ≥8 en pacientes con VIH comparada con el MINI, obteniendo una sensibilidad del 86% y especificidad del 92%; la sensibilidad para el punto de corte habitual de ≥10 fue del 76% 22.
PHQ-2
La versión abreviada del PHQ-9 está formada por las dos primeras preguntas de esta escala, puntuándose también cada una de ellas de 0 a 3 y obteniéndose una puntuación de 0 a 6: una puntuación ≥3 indica un posible trastorno depresivo. Las preguntas son similares a las de EACS-2, pero hacen referencia a un periodo más corto de tiempo. En población general, PHQ-2 tiene una sensibilidad similar a PHQ-9, pero menor especificidad (78-92% de PHQ-2 comparada con 91-94% de PHQ-9) 10. Por este motivo, se suele administrar primero la escala PHQ-2 y si se alcanza el punto de corte ≥3, está indicado proseguir con la escala PHQ-9. En pacientes con infección por VIH en Kenia, se ha encontrado una sensibilidad del 85% y especificidad del 95% de PHQ-2 comparada con PHQ-9 28. Sin embargo, un estudio realizado en Canadá encontró una baja sensibilidad (55%) comparada con el MINI en pacientes con VIH, con una especificidad de 94% 22.
Center for Epidemiologic Studies Depression Scale (CES-D20)
Esta escala está diseñada para evaluar la gravedad de la depresión en población general y está formada por 20 preguntas que se completan por el paciente en menos de 5 minutos y puntúan de 0 a 3, con lo que se obtiene una puntuación final de 0 a 60 29. A pesar de tener una versión en español, no hemos encontrado ningún estudio que evalúe esta escala en nuestro país. Existe una versión abreviada de la misma con 10 preguntas (CES-D10). En pacientes con infección por VIH, ha sido utilizada en diferentes estudios de investigación y evaluada en diferentes países de África y Asia. Un estudio canadiense mostró buenos resultados de ambas escalas comparadas con el MINI: el CES-D20 mostró una sensibilidad del 100% y especificidad del 87% para un punto de corte de ≥23, y el CES-D10 mostró unos valores de 97% y 81%, respectivamente, para un punto de corte ≥12 22.
En resumen, las escalas de cribado para infección por VIH presentadas en este capítulo pueden dividirse en escalas completas (HADS-D, BDI-II y BDI-PC, PHQ-9, CES-D20) y escalas abreviadas (2 preguntas de EACS y PHQ-2). Las principales características de ambos tipos de escalas se resumen en la Tabla 1.
En cuanto a las escalas completas:
- Todas pueden autoadministrarse por parte del paciente y completarse en un tiempo corto.
- Todas han sido validadas con buenos resultados en población general, incluyendo población española y traducidas al español (excepto CES-D20).
- Todas han sido evaluadas en población con infección por VIH (excepto BDI-PC) con buenos resultados. Sin embargo, la única evaluada en pacientes con VIH españoles es la HADS-D.
- Excepto la HADS-D y BDI-PC, las demás escalas incluyen síntomas somáticos, que podrían dar lugar a solapamiento con los síntomas de la infección por VIH avanzada u otras enfermedades crónicas.
- Todas son de acceso libre, sin coste alguno, excepto BDI-II y BDI-PC. Estas dos últimas escalas son por tanto de aplicabilidad limitada en la práctica clínica.
- Los estudios revisados indican que el diagnóstico de depresión mediante las escalas de cribado debe confirmarse con una entrevista estructurada basada en los criterios del DSM o ICD. Por tanto, según la evidencia disponible, un resultado positivo sería una indicación de derivar al paciente a un clínico especializado para confirmar el diagnóstico.
- En general presentan sensibilidad elevada y especificidad algo Esto es lo deseable ya que se pretende detectar el mayor número posible de casos, y posteriormente el paciente será evaluado con una entrevista estructurada para confirmar el diagnóstico.
En cuanto a las escalas abreviadas (EACS-2 y PHQ-2):
- Se recomienda usar una de ellas como un método rápido en consulta y proseguir con una de las escalas completas en caso de resultar positiva.
- Ambas han sido evaluadas en pacientes con infección por VIH, pero EACS-2 ha sido además evaluada en España con buenos resultados.
ESCALAS RECOMENDADAS
Para optimizar el tiempo en consulta y los recursos, una estrategia adecuada puede ser comenzar con una de las dos escalas abreviadas (EACS-2 o PHQ-2) y, en caso de que la escala abreviada sea positiva, proseguir con una escala completa.
La primera opción, por haber sido evaluada en nuestro país, sería comenzar con EACS-2 y proseguir con HADS-D 2 (BII).
- Acceso a HADS-D y HADS-A (en inglés): http://www.svri.org/sites/default/files/ attachments/2016-01-13/HADS.pdf (también disponible en español en Apéndice 1 16).
- Otra opción aceptable puede ser comenzar con PHQ-2 y proseguir con PHQ-9 (BIII): http://niwaplibrary.wcl.american.edu/wp-content/uploads/2015/pdf/TRAUM-Temp- PHQ9QuestionnaireSpanish.pdf 25
Las principales estalas para el cribado de depresión en pacientes con VIH se muestran en la Tabla 1:
a) Criterios de inclusión para la aplicación de la escala
Las guías de la EACS recomiendan hacer cribado de depresión a todas las personas que viven con VIH cada 1-2 años 12.
b) Interpretación
La escala de HADS 16 está formada por catorce ítems, siete de los cuales miden ansiedad y los otros siete la depresión (los ítems que miden la depresión están marcados con un asterisco). Cada ítem puntúa de 0 a 3 (de menos a más patología). Las respuestas de las preguntas 1, 3, 5, 6, 8, 10, 11, y 13 se puntúan de la siguiente forma: 3 puntos la primera respuesta, 2 puntos la segunda, 1 punto la tercera y 0 puntos la cuarta. Las respuestas de las preguntas 2, 4, 7, 9, 12, y 14 se puntúan de la siguiente forma: 0 puntos la primera respuesta, 1 punto la segunda, 2 puntos la tercera y 3 puntos la cuarta. Un punto de corte ≥8 definiría depresión (ver escala en Apéndice 1).
c) Recomendaciones en función de los valores obtenidos
En caso de que el cribado sea positivo por una escala completa, se debe excluir una enfermedad orgánica como causa de los síntomas (como hipotiroidismo, fármacos, enfermedad de Addison, déficit de vitamina B12, etc) 12 y el diagnóstico debe confirmarse mediante entrevista estructurada con los criterios del DSM o ICD.
Tablas:
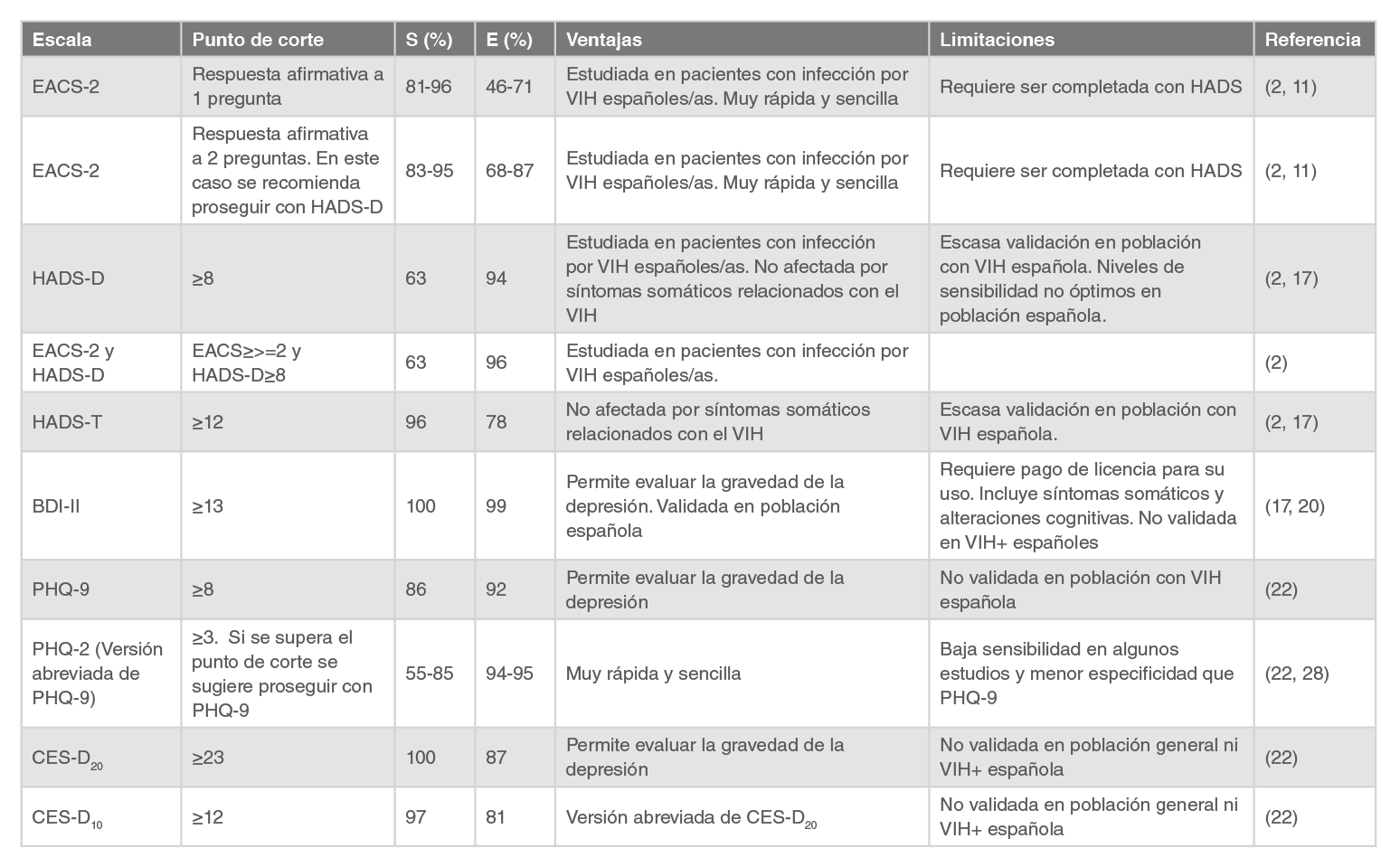
S, sensibilidad; E, especificidad
Bibliografía:
Gallego L, Barreiro P, Lopez-Ibor Diagnosis and clinical features of major neuropsychiatric disorders in HIV infection. AIDS reviews 2011;13:171-9.
Bayon-Perez C, Hernando A, Alvarez-Comino MJ, Cebolla S, Serrano L, Gutierrez F, et al. Toward a comprehensive care of HIV patients: finding a strategy to detect depression in a Spanish HIV cohort. AIDS care 2016; 28: 834-41.
Jia H, Uphold CR, Wu S, Reid K, Findley K, Duncan Health-related quality of life among men with HIV infection: effects of social support, coping, and depression. AIDS patient care and STDs 2004;18:594-603.
Cruess DG, Douglas SD, Petitto JM, Leserman J, Ten Have T, Gettes D, et Association of depression, CD8+ T lymphocytes, and natural killer cell activity: implications for morbidity and mortality in Human immunodeficiency virus disease. Current psychiatry reports 2003;5:445-50.
Gordillo V, del Amo J, Soriano V, González-Lahoz Sociodemographic and psychological variables influencing adherence to antiretroviral therapy. AIDS 1999;13:1763-9.
Cook JA, Grey D, Burke J, Cohen MH, Gurtman AC, Richardson JL, et al. Depressive symptoms and AIDS-related mortality among a multisite cohort of HIV-positive women. American journal of public health 2004; 94:1133-40.
Asch SM, Kilbourne AM, Gifford AL, Burnam MA, Turner B, Shapiro MF, et al. Underdiagnosis of depression in HIV: who are we missing? Journal of general internal medicine 2003;18:450-60.
Marando F, Gualberti G, Costanzo AM, di Luzio Paparatti U, Franzetti M, Ammassari A, et Discrepancies between physician’s perception of depression in HIV patients and self-reported CES-D-20 assessment: the DHIVA study. AIDS care 2016; 28:147-59.
Sheehan DV, Lecrubier Y, Sheehan KH, Amorim P, Janavs J, Weiller E, et al. The Mini-International Neuropsychiatric Interview (M.I.N.I.): the development and validation of a structured diagnostic psychiatric interview for DSM-IV and ICD-10. The Journal of clinical psychiatry 1998; 59 Suppl 20:22- 33;quiz 4-57.
Maurer DM, Raymond TJ, Davis BN. Depression: Screening and Diagnosis. American family physician. 2018; 98:508-15.
Rodkjaer L, Gabel C, Laursen T, Slot M, Leutscher P, Christensen N, et Simple and practical screening approach to identify HIV-infected individuals with depression or at risk of developing depression. HIV medicine 2016; 17:749-57.
European AIDS Clinical EACS Guidelines. Version 10.0. November 2019. 2019.
Zigmond AS, Snaith The hospital anxiety and depression scale. Acta psychiatrica Scandinavica. 1983; 67:361-70.
Snaith RP, Zigmond AS. The hospital anxiety and depression scale. British medical journal (Clinical research ed) 1986;292(6516):344.
Quintana JM, Padierna A, Esteban C, Arostegui I, Bilbao A, Ruiz I. Evaluation of the psychometric characteristics of the Spanish version of the Hospital Anxiety and Depression Scale. Acta psychiatrica Scandinavica 2003; 107:216-21.
Grupo de expertos de la secretaría del Plan Nacional Sobre el SIDA (SPNS) SEdPS, Grupo de estudio de SIDA (GeSIDA) y Sociedad Española de Infectología Pediátrica (SEIP). Documento de consenso sobre las alteraciones psiquiátricas y psicológicas en adultos y niños con infección por el VIH (actualización febrero 2015).
Savard J, Laberge B, Gauthier JG, Ivers H, Bergeron MG. Evaluating anxiety and depression in HIV- infected Journal of personality assessment 1998; 71:349-67.
Beck AT, Ward CH, Mendelson M, Mock J, Erbaugh J. An inventory for measuring depression. Archives of general psychiatry 1961; 4:561-71.
Beck AT, Guth D, Steer RA, Ball R. Screening for major depression disorders in medical inpatients with the Beck Depression Inventory for Primary Behaviour research and therapy 1997; 35:785-91.
Lasa L, Ayuso-Mateos JL, Vazquez-Barquero JL, Diez-Manrique FJ, Dowrick CF. The use of the Beck Depression Inventory to screen for depression in the general population: a preliminary Journal of affective disorders. 2000;57(1-3):261-5.
Williams J, Nieuwsma Screening for depression in adults. In: UpToDate, editor.
Choi SK, Boyle E, Burchell AN, Gardner S, Collins E, Grootendorst P, et al. Validation of Six Short and Ultra-short Screening Instruments for Depression for People Living with HIV in Ontario: Results from the Ontario HIV Treatment Network Cohort PloS one 2015; 10:e0142706.
Kroenke K, Spitzer RL, Williams The PHQ-9: validity of a brief depression severity measure. Journal of general internal medicine. 2001; 16:606-13.
Manea L, Gilbody S, McMillan Optimal cut-off score for diagnosing depression with the Patient Health Questionnaire (PHQ-9): a meta-analysis. CMAJ : Canadian Medical Association journal = journal de l’Association medicale canadienne 2012; 184:E191-6.
National Immigrant Women’s Advocacy Project. Patient Health Qustionnaire PHQ-9 [July 22, 2019]. Available from: http://niwaplibrary.wcl.american.edu/wp-content/uploads/2015/pdf/TRAUM-Temp- pdf.
Diez-Quevedo C, Rangil T, Sanchez-Planell L, Kroenke K, Spitzer RL. Validation and utility of the patient health questionnaire in diagnosing mental disorders in 1003 general hospital Spanish Psychosomatic medicine 2001; 63:679-86.
Crane PK, Gibbons LE, Willig JH, Mugavero MJ, Lawrence ST, Schumacher JE, et al. Measuring depression levels in HIV-infected patients as part of routine clinical care using the nine-item Patient Health Questionnaire (PHQ-9). AIDS care 2010; 22:874-85.
Monahan PO, Shacham E, Reece M, Kroenke K, Ong’or WO, Omollo O, et al. Validity/reliability of PHQ- 9 and PHQ-2 depression scales among adults living with HIV/AIDS in western Journal of general internal medicine 2009; 24:189-97.
Radloff LS. The CES-D Scale: A Self-Report Depression Scale for Research in the General Population. Applied Psychological Measurement 1977; 1:385-401.