Recomendaciones sobre la profilaxis pre-exposición para la prevención de la infección por VIH en España
Enero 2023
Notas de la Versión:
Comité de redacción
Comité de redacción
Coordinadores
Redactores/as
Revisores/as
Conflicto de interés
Agradecimientos
LISTADO DE ABREVIATURAS
Comité de redacción
Coordinadores
| Oskar Ayerdi Aguirrebengoa | Centro Sanitario Sandoval, IdISSC, Hospital Clínico San Carlos, Madrid |
| Pep Coll Verd | Hospital Germans Trias i Pujol, Badalona. BCN Checkpoint/ PrEP·Point |
Redactores/as
| Aguas Robustillo Corté | Servicio de Farmacia hospitalaria. Hospital de Valme. AGS |
| Anaïs Corma Gómez | Unidad de Enfermedades Infecciosas y Microbiología. |
| Ángel Rivero Calaf |
BCN Checkpoint / PrEP·Point, Servicio de Enfermedades |
| Ángela Gutiérrez Liarte | Medicina Interna y Enfermedades Infecciosas. Hospital |
| César Sotomayor de la Piedra | Unidad de Enfermedades Infecciosas, Microbiología y |
| Claudia Fortuny | Hospital Universitario Materno Infantil Sant Joan de |
| Cristina Agustí Benito | Departamento de Salud, Centro de Estudios |
| David García Hernández | Unidad de VIH. Servicio de enfermedades infecciosas. |
| Eva Orviz García | Centro Sanitario Sandoval, IdISSC, Hospital Clínico San |
| Ferran Pujol Roca | BCN Checkpoint / PrEP·Point, Barcelona |
| Jesica Abadía Otero | Servicio de Medicina Interna/Consulta Enfermedades |
| Jesús Santos González | UGC Enfermedades Infecciosas, Microbiología y Medicina |
| Jorge Néstor García Pérez | Unidad de VIH e ITS "Drassanes - Vall d'Hebron", |
| Jorge Valencia la Rosa | Fundación para la Investigación e Innovación Biomédica. |
| Lucio J. García-Fraile Fraile | Medicina Interna y Enfermedades Infecciosas. Hospital |
| Matilde Sánchez-Conde | Servicio de Enfermedades Infecciosas, Hospital Ramón y |
| Marta Herrero Romero | Unidad de Enfermedades Infecciosas, Microbiología y |
| Michael Meulbroek | BCN Checkpoint / PrEP·Point, Barcelona |
| Nicolás de Loredo | Unidad de VIH. Servicio de enfermedades infecciosas. Hospital Clínic. Barcelona |
Pilar Taberner Bonastre |
Servicio de Farmacia. Hospital Universitario Arnau de Vilanova, Lleida |
Revisores/as
Antonio Antela López |
Unidad de Enfermedades Infecciosas. Hospital Clínico Universitario de Santiago de Compostela |
| Juan Emilio Losa García | Unidad de Enfermedades Infecciosas.Hospital Universitario Fundación Alcorcón. Madrid |
Montserrat Laguno Centeno
|
Unidad de VIH. Servicio de enfermedades infecciosas. Hospital Clínic. Barcelona |
Federico García García |
Servicio de Microbiología, Hospital Clinico Universitario San Cecilio, Granada. Instituto de Investigación Ibs. Granada. Ciber de Enfermedades Infecciosas, CIBERINFEC |
Conflicto de interés
Con el fin de evitar y/o minimizar los posibles conflictos de intereses, los coordinadores, autores y revisores que forman parte de este panel de expertos han realizado una declaración formal de intereses en la que queda constancia explícita de que ninguno de ellos tiene ningún conflicto de intereses en la realización de este documento.
Agradecimientos
La Junta Directiva de GeSIDA y el Panel de Expertos de GeSIDA agradecen las aportaciones y opiniones de Juanjo Mascort Roca y Ricard Carrillo Muñoz (Sociedad Española de Medicina de Familia y Comunitaria- SemFYC), Jara Llenas García, Julio Manuel Morais Martín y el GRUPO ENFERMERAS VIH (GEVIH), Beatriz Hernández Novoa, Jose E. Martín Herrero.
GeSIDA. Recomendaciones sobre la Profilaxis Pre-Exposición para la Prevención de la Infección por VIH en España. Marzo 2023. Disponible en [http://.gesida-seimc.org/ category/guias-clinicas/otras-guias-vigentes/]
LISTADO DE ABREVIATURAS
ART |
Antirretrovirales |
CAB |
Cabotegravir |
cis |
Cisgénero |
EMA |
Agencia Europea de Medicamentos/ European Medicines Agency |
ECDC |
European Centre for Disease Prevention and Control |
FGe |
Función Glomerular estimada |
FTC |
Emtricitabina |
GBHSH |
Gays, bisexuales y otros hombres que tienen sexo con hombres |
HSH |
Hombres que tienen sexo con hombres |
ITS |
Infecciones de transmisión sexual |
LEN |
Lenacapavir |
MVC |
Maraviroc |
NNT |
Número de personas que es necesario tratar |
ONUSIDA |
Programa conjunto de las Naciones Unidas sobre el VIH/ SIDA |
p-a |
Personas-año |
PID |
Personas que se inyectan drogas |
PPE |
Profilaxis post-exposición |
PrEP |
Profilaxis pre-exposición |
PVVIH |
Personas que viven con infección por VIH |
RR |
Riesgo relativo |
RRR |
Reducción del riesgo relativo |
SINIVIH |
Sistema de información sobre nuevos diagnósticos de VIH |
TAF |
Tenofovir alafenamida fumarato |
TAR |
Tratamiento antirretroviral |
TDF |
Tenofovir disoproxil fumarato |
LISTADO DE ABREVIATURAS
ART |
Antirretrovirales |
CAB |
Cabotegravir |
cis |
Cisgénero |
EMA |
Agencia Europea de Medicamentos/ European Medicines Agency |
ECDC |
European Centre for Disease Prevention and Control |
FGe |
Función Glomerular estimada |
FTC |
Emtricitabina |
GBHSH |
Gays, bisexuales y otros hombres que tienen sexo con hombres |
HSH |
Hombres que tienen sexo con hombres |
ITS |
Infecciones de transmisión sexual |
LEN |
Lenacapavir |
MVC |
Maraviroc |
NNT |
Número de personas que es necesario tratar |
ONUSIDA |
Programa conjunto de las Naciones Unidas sobre el VIH/SIDA |
p-a |
Personas-año |
PID |
Personas que se inyectan drogas |
PPE |
Profilaxis post-exposición |
PrEP |
Profilaxis pre-exposición |
PVVIH |
Personas que viven con infección por VIH |
RR |
Riesgo relativo |
RRR |
Reducción del riesgo relativo |
SINIVIH |
Sistema de información sobre nuevos diagnósticos de VIH |
TAF |
Tenofovir alafenamida fumarato |
TAR |
Tratamiento antirretroviral |
TDF |
Tenofovir disoproxil fumarato |
1. RESUMEN
Justificación
En los últimos años se ha observado una reducción del número de nuevas infecciones por el VIH, especialmente entre los HSH, favorecida por la implementación de la profilaxis pre- exposición (PrEP). No obstante, todavía se produce un significativo número de infecciones, que se podrían evitar con una óptima implementación de la PrEP.
La PrEP, basada en el uso de fármacos antirretrovirales para prevenir la infección por VIH, ha mostrado su gran eficacia preventiva, seguridad y coste-efectividad en distintos grupos de población, siempre relacionada con la adherencia.
En España, esta medida preventiva se incluyó en la cartera de servicios del Sistema Nacional de Salud en noviembre del 2019, con la combinación de FTC (200 mg) y TDF (300 mg) en un único comprimido administrado de forma diaria. También, se ha demostrado la eficacia de otras alternativas, como la pauta a demanda, u otros fármacos como TAF/FTC o Cabotegravir (CAB), aunque éstos no están disponibles actualmente en nuestro medio. Existen numerosos ensayos clínicos en marcha que exploran nuevos fármacos o vías de administración, que podrían favorecer la adherencia y reducir los posibles efectos adversos.
La indicación de PrEP, que en España inicialmente se dirigía a HSH, mujeres transgénero y mujeres trabajadoras del sexo, se ha ampliado a adolescentes desde los 16 años, personas que se inyectan drogas, y hombres y mujeres cis con riesgo para la adquisición del VIH.
La PrEP no consiste únicamente en la administración del fármaco, sino que debe formar parte de un programa que incluye el consejo preventivo individualizado, la evaluación de posibles efectos adversos, cribado de infecciones de transmisión sexual (ITS), detección de consumo de sustancias y actualización de la vacunación. Los estudios de cohortes y la práctica clínica refuerzan los datos de seguridad de esta medida preventiva, ya observados en los ensayos clínicos.
En el presente documento se actualiza la guía de las recomendaciones sobre PrEP publicada por GeSIDA en el año 2016, proponiendo un seguimiento más flexible y adaptado a las características del usuario.
Conclusión
La evidencia sobre la efectividad de la PrEP es cada vez mayor, siendo imprescindible facilitar el acceso a la PrEP a todas aquellas personas que puedan beneficiarse de esta medida preventiva.
2. INTRODUCCIÓN
2.1. Estado actual de la infección por VIH en España
2.2. Profilaxis pre-exposición al VIH (PrEP)
Estado actual de la infección por VIH en España
En 2020 se notificaron en España 1.925 nuevos diagnósticos de VIH, lo que supone una tasa de 4,07 por 100.000 habitantes, muy similar a la media europea que es de 5,4 por 100.000 habitantes12. El 84,3% de los nuevos diagnósticos fueron hombres, con una tasa de 7 por 100.000 habitantes mientras que en mujeres la tasa fue de 1,3 por 100.000 habitantes.
La mediana de edad de los nuevos diagnósticos fue de 36 años (rango intercuartílico: 29-46). No se observaron diferencias significativas en la edad de hombres y mujeres recién diagnosticados con VIH1. La transmisión entre gays, bisexuales y otros hombres que tienen sexo con hombres (GBHSH) fue la más frecuente, 55,2%, seguida de la heterosexual, 27,5%, y la que se produce entre personas que se inyectan drogas (PID), 2,4%. Por tanto, el 82,7% de los nuevos diagnósticos de VIH en 2020 fueron de transmisión sexual. Entre los hombres, la vía de transmisión mayoritaria fue la vía GBHSH, 65,5% de los nuevos diagnósticos de VIH; y entre las mujeres fue la vía heterosexual, 80,5%. El 33,9% de los nuevos diagnósticos de infección por el VIH se realizaron en personas nacidas fuera de España1.
A pesar de que en España la prueba del VIH se ofrece de forma gratuita en todos los niveles del sistema sanitario, el 46,8% de los nuevos diagnósticos notificados en 2020 presentaron un diagnóstico tardío (presentando menos de 350 linfocitos CD4/µl)1, Este fue superior en mujeres que en hombres (58,3% frente a 44,7%) y aumentó conforme se incrementaba la edad, siendo del 35,4% en los menores de 25 años y del 58,9% en los de 50 años o más. Los GBHSH, fueron los que presentaron un menor diagnóstico tardío, con un 41,3%; sin embargo, dado el peso que tienen en las cifras globales, fueron el grupo más numeroso entre los casos de VIH con retraso diagnóstico (52,3% del total)1. El diagnóstico tardío se asocia a una mayor morbilidad, mortalidad y costes económicos, así como a un mayor período de transmisibilidad y, por tanto, a una mayor contribución a la incidencia del VIH3456.
Se estima que hay 146.500 (IC 95% 134.417-160.908) personas que viven con VIH (PVVIH) en España, lo que representa una prevalencia de VIH del 0,37%(7. De ellos, el 13,7% (IC95% 11,1%-17,9%) no saben que tienen la infección por el VIH. Se estima que 93,4% (IC95% 91,0%-95,3%) de las personas que viven con VIH y conocen su diagnóstico reciben tratamiento antirretroviral (TAR). De éstas, el 90,4% (IC95% 87,5%-92,8 %) tendrían la carga viral suprimida. Por tanto, se estima que el 72,8 % de las PVVIH en España tienen la carga viral indetectable7.
Es necesario centrar los esfuerzos en incrementar el porcentaje de personas que conocen su diagnóstico y mantener el porcentaje alcanzado de personas que reciben tratamiento antirretroviral y con carga viral suprimida. Esto último es de vital importancia dado que se ha demostrado que las personas que viven con el VIH con una carga viral indetectable no pueden transmitir el VIH por la vía sexual89
Profilaxis pre-exposición al VIH (PrEP)
A pesar de los avances realizados en los últimos años en el campo de la infección por el VIH y, consecuentemente, de la reducción en las tasas de nuevos diagnósticos, su eliminación sigue sin ser efectiva. La promoción del uso del preservativo, el consejo asistido, el diagnóstico y tratamientos precoces o la profilaxis post-exposición (PPE) resultan insuficientes para lograr el control real de la epidemia. En este contexto, la PrEP ha emergido como una herramienta adicional a las medidas en uso. Se trata de una estrategia que forma parte de la prevención combinada de la infección por el VIH, recomendada por ONUSIDA para lograr los objetivos 95-95-95 propuestos y alcanzar las metas del objetivo 3 de los Objetivos de Desarrollo Sostenible en 203010. Igualmente, se enmarca desde la Secretaría del Plan Nacional sobre el Sida dentro del Plan de Prevención y Control de la Infección por el VIH y las ITS para el año 2030 en España11.
La PrEP se basa en la administración de ART a personas que no viven con el VIH con el objetivo de prevenir la infección por este patógeno. Más concretamente, una pauta basada en TDF/FTC diario por vía oral ha demostrado ser, no sólo muy eficaz en la reducción del riesgo de transmisión del VIH en HSH, mujeres transgénero y en hombres y mujeres cis-género heterosexuales, sino también muy segura en términos de efectos adversos, además de coste-efectiva1213141516. Por este motivo, en 2016, la Agencia Europea del Medicamento y la Agencia Española del Medicamento y Productos Sanitarios autorizaron la indicación de TDF/FTC diario, como tratamiento preventivo de la infección por el VIH. En España, no fue hasta 2019 que la PrEP fue incluida en la prestación farmacéutica financiada por el Sistema Nacional de Salud. Desde entonces, se han ido progresivamente implementado los programas PrEP en todas las Comunidades Autonómicas, aunque el grado de implementación es todavía bastante menor que en otros países vecinos. En este sentido, la sobrecarga de los sistemas sanitarios que ha infligido la pandemia por SARS-CoV-2 ha impactado negativamente en la agilidad de su puesta en marcha, aunque también ha impulsado el desarrollo de nuevas estrategias de cribado de VIH e ITS como por ejemplo aquellas basadas en la auto-toma de muestras.
La PrEP forma parte de un programa que incluye además una combinación de medidas como la promoción del uso del preservativo, la educación sexual y el consejo asistido, la evaluación del consumo de sustancias, la detección y tratamiento precoces de las ITS y la actualización del estado vacunal. En otros países como por ejemplo en Reino Unido, su implementación ha redundado en una notable disminución de la incidencia del VIH en HSH. Además, se ha puesto de manifiesto que el conjunto de intervenciones tiene un efecto sinérgico, de forma que interactúan para producir un impacto combinado mayor que la suma de sus efectos por separado. En este contexto se ha modelizado que sería posible alcanzar la “eliminación virtual” de la transmisión del VIH en HSH en las próximas 2 décadas, de persistir las medidas actuales17.
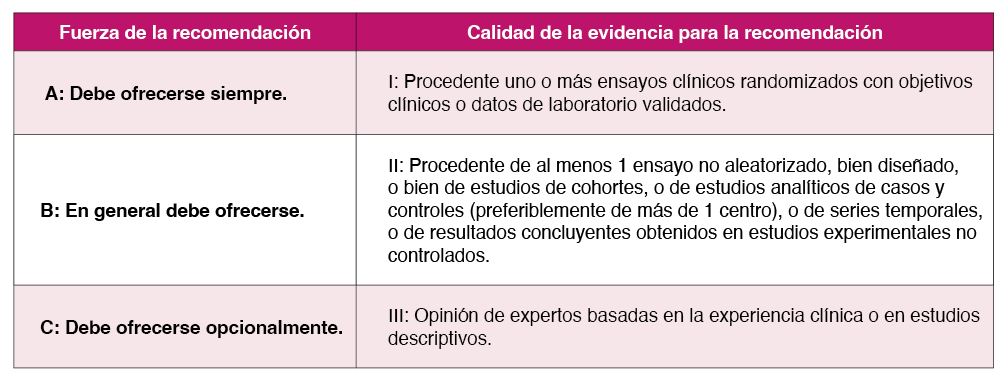
En este documento la fuerza de cada recomendación y la calidad de la evidencia, se basa en una modificación de los criterios de la Infectious Diseases Society of America (IDSA). La siguiente Tabla 1 resume los criterios.
En España, la entrada de la PrEP en la cartera de servicios se ha acompañado del desarrollo de un sistema de información y monitorización de los programas, el SiPrEP. Con fecha de mayo de 2022, había 13.652 personas en PrEP, la práctica totalidad eran HSH, lo que constituye una cifra menor a la estimación de candidatos18. Por lo tanto, el principal reto actual es eliminar las barreras de acceso a los programas PrEP y ampliar su implementación en todo el territorio.
Tablas:
Bibliografía:
Unidad de vigilancia de VIH I y hepatitis. Vigilancia Epidemiológica del VIH y sida en España 2020: Sistema de Información sobre Nuevos Diagnósticos de VIH y Registro Nacional de Casos de Sida. Plan Nacional sobre el Sida-DG de Salud Pública-Centro Nacional de Epidemiología - ISCIII. Madrid; 2021.
European Centre for Disease Prevention and Control (ECDC). World Health Organization (WHO). HIV/AIDS surveillance in Europe 2021. 2020 data. Stocholm; 2021.
Waters L, Fisher M, Anderson J, et Responses to highly active antiretroviral therapy and clinical events in patients with a low CD4 cell count: Late presenters vs. late starters. HIV Med. 2011;12(5):289–98.
Skarbinski J, Rosenberg E, Paz-Bailey G, et al. Human Immunodeficiency Virus Transmission at Each Step of the Care Continuum in the United States. JAMA Intern Med [Internet]. 2015 Apr 1 [cited 2018 Oct 18];175(4):588. http://www.ncbi.nlm.nih.gov/ pubmed/25706928
Kasaie P, Radford M, Kapoor S, et Economic and epidemiologic impact of guidelines for early ART initiation irrespective of CD4 count in Spain. PLoS One. 2018;13(11):1–15.
The INSIGHT START Study Group*. Initiation of Antiretroviral Therapy in Early Asymptomatic HIV Infection. N Engl J Med. 2015;August 27(373(9)):795–807.
Unidad de vigilancia del VIH y conductas de Centro Nacional de Epidemiología – Instituto de Salud Carlos III – Plan Nacional sobre el SIDA – Dirección General de Salud Pública Calidad e Innovación. Estimación del continuo de atención del VIH en España, 2016. Madrid; 2019. https://www.mscbs.gob.es/ciudadanos/enfLesiones/enfTransmisibles/sida/ docs/ESTIMACION_DEL_CONTINUO_DE_ATENCION_DEL_VIH_EN_ESPANA.pdf
Rodger AJ, Cambiano V, Bruun T, et Sexual Activity Without Condoms and Risk of HIV Transmission in Serodifferent Couples When the HIV-Positive Partner Is Using Suppressive Antiretroviral Therapy. JAMA [Internet]. 2016 Jul 12 [cited 2022 Aug 23];316(2):171–81. https://pubmed.ncbi.nlm.nih.gov/27404185/
Rodger, V. Cambiano, T. Bruun,et al. Risk of HIV transmission through condomless sex in MSM couples with suppressive ART: The PARTNER2 Study extended results in gay men. In: 22nd International AIDS Conference, Amsterdam. 2018.
Joint United Nations Programme on HIV/AIDS (UNAIDS). Fast-Track Ending the AIDS Epidemic by 2030. G; 2021.
División de Control de VIH, ITS HV y T (DCVIHT) M de S. PLAN DE PREVENCIÓN Y CONTROL DE LA INFECCIÓN POR EL VIH Y LAS ITS 2021-2030 en España. Madrid;
Grant RM, Lama JR, Anderson PL, et al. Preexposure Chemoprophylaxis for HIV Prevention in Men Who Have Sex with Men. N Engl J Med [Internet]. 2010 Dec 30 [cited 2021 Feb 18];363(27):2587–99. https://pubmed.ncbi.nlm.nih.gov/21091279/
Grant RM, Anderson PL, McMahan V, et al. Uptake of pre-exposure prophylaxis, sexual practices, and HIV incidence in men and transgender women who have sex with men: a cohort study. Lancet Infect Dis [Internet]. 2014 [cited 2022 Aug 23];14(9):820–9. https://pubmed.ncbi.nlm.nih.gov/25065857/
Baeten JM, Donnell D, Ndase P, et al. Antiretroviral Prophylaxis for HIV Prevention in Heterosexual Men and Women. N Engl J Med [Internet]. 2012 Aug 2 [cited 2021 Feb 18];367(5):399–410. https://pubmed.ncbi.nlm.nih.gov/22784037/
Drak D, Mcmanus H, Vickers T, et al. Renal impairment in a large-scale HIV preexposure prophylaxis implementation AIDS [Internet]. 2021 Nov 15 [cited 2022 Aug 23];35(14):2319–26. https://pubmed.ncbi.nlm.nih.gov/34310371/
Coll P, Laguna L, Andreu A, et Análisis Coste-Efectividad de la PrEP. XII Congreso Nacional del Grupo Estudio del SIDA SEIMC (GeSIDA) Málaga. 2021;Abstract: CO-07.
Cambiano V, Lampe F, Miners A, et al. Contributions to the decline in HIV incidence among GBM in the UK: a modelling ses Opportunistic Infect (CROI) Chicago; 2022. 2022;Abstract 898.
División de Control de VIH, ITS, Hepatitis virales y Sistema de información de programas de Profilaxis Pre-exposición al VIH en España (SIPrEP). Informe de resultados noviembre 2019-mayo 2022. Ministerio de Sanidad, julio 2022.
3. EFICACIA Y EFECTIVIDAD DE LA PrEP
3.1. Ensayos clínicos en hombres que tienen sexo con hombres y en mujeres transgénero
3.2. Ensayos clínicos en hombres y mujeres cis con relaciones heterosexuales
3.3. Ensayos clínicos en mujeres cis con relaciones heterosexuales
3.4. Ensayos clínicos en personas que se inyectan drogas (PID)
3.5. Estudios observacionales: efectividad de la PrEP en la vida real
Ensayos clínicos en hombres que tienen sexo con hombres y en mujeres transgénero
La PrEP oral con TDF/FTC diaria o a demanda ha demostrado ser eficaz para prevenir la adquisición de VIH, siendo la adherencia un factor fundamental.
Publicado en 2010, el iPREX fue el primer gran ensayo clínico en demostrar la eficacia de la PrEP en HSH 12. Se comparaba TDF/FTC oral diaria con placebo y se encontró una reducción del riesgo relativo (RRR) de infección por VIH del 44%. La eficacia se asoció con la adherencia al tratamiento. En los sujetos con niveles detectables de fármacos la RRR fue del 92%34. Se describieron algunos efectos adversos, como un pequeño descenso del aclaramiento de creatinina estimado y de la densidad mineral ósea 56.
Hubo otros dos ensayos clínicos de gran importancia realizados Europa. El PROUD, que comparaba TDF/FTC en pauta oral diaria con inicio inmediato o diferido pasado un año, y el IPERGAY, que analizaba el uso de TDF/FTC o placebo en cada exposición sexual con el siguiente esquema: 2 comprimidos juntos entre 24 y 2 horas antes del contacto sexual, 1 comprimido 24 horas después de los primeros, y un cuarto comprimido 24 horas después del tercero78. Ambos estudios coincidieron en el resultado, el uso de TDF/FTC en pauta diaria o a demanda supuso una RRR del 86%.
El uso de TDF ha demostrado ser una medida eficaz y segura 9. También, se han estudiado otras alternativas farmacológicas, como el uso de Tenofovir Alafenamida/ Emtricitabina (TAF/FTC) oral diaria. El ensayo clínico DISCOVER demostró la no inferioridad de TAF/FTC frente a TDF/FTC para prevenir la infección por el VIH 1011. La existencia de otras estrategias eficaces como TAF/FTC o CAB (que se comenta en detalle en el apartado 8), podrían ser especialmente útiles en usuarios con afectación de la función renal o disminución de la densidad mineral ósea, si bien no se encuentran disponibles actualmente en nuestro medio.
Ensayos clínicos en hombres y mujeres cis con relaciones heterosexuales
Dos ensayos clínicos (Partner-PrEP y TDF2) incluyeron hombres y mujeres cis heterosexuales. Ambos demostraron evidencia sobre la eficacia de la PrEP oral diaria1213.
Ensayos clínicos en mujeres cis con relaciones heterosexuales
Otros dos ensayos clínicos incluyeron sólo mujeres cis heterosexuales. Comparaban el uso de PrEP oral diaria con TDF/FTC (FEM-PrEP) o TDF (West African) frente a placebo1415. Otro ensayo comparó la PrEP oral diaria, con la profilaxis tópica vaginal y el placebo (VOICE)16. En ninguno de los ensayos se obtuvieron conclusiones significativas, dada la baja adherencia y problemas de diseño.
Hasta la fecha no se ha evaluado la eficacia de la pauta de PrEP a demanda en estas personas17. Otro ensayo que planteó el uso de Maraviroc (MVC), no demostró eficacia18.
La profilaxis tópica vaginal (tenofovir gel, anillos de Dapivirina) ha demostrado resultados dispares. En el ensayo VOICE el tenofovir no demostró efecto protector16. En los demás (CAPRISA 004, FACTS-001 con Tenofivir, y ASPIRE, Ring Study Team con Dapivirina) la reducción del riesgo de adquisición de VIH se demostró en aquellos casos donde la adherencia era elevada19202122.
Ensayos clínicos en personas que se inyectan drogas (PID)
Las personas que consumen drogas endovenosas tienen un alto riesgo para adquirir el VIH23 Sin embargo, los datos referidos a la eficacia de la PrEP en este grupo de personas se limitan a un único estudio: el estudio Bangkok Tenofovir, en el que se observa una eficacia del 49%2425. La monoterapia con TDF no está indicada como PrEP en la actualidad por su menor eficacia frente a los tratamientos vigentes.
Los datos indirectos obtenidos de diferentes cohortes en vida real en PID y la opinión de expertos apoya el desarrollo de estrategias combinadas preventivas dirigidas a este grupo de personas262728.
Estudios observacionales: efectividad de la PrEP en la vida real
Los buenos resultados de algunos de los ensayos clínicos han llevado a establecer cohortes de seguimiento observacional como continuación de estos, en las que se siguen observando resultados favorables: iPrEx-OLE (iPrEx Open Label Expansion), Demonstration Project, Cohorte “Kaiser Permanent Medical Center”, PIC-NSW prospective cohort study, ATN 110, (usuarios de 18-22 años), ATN 113 (15-17 años), L’actuel Pre-Exposure Prophylaxis (PrEP) Cohort study in Montreal, Canada y otras experiencias publicadas293031323334353637. En todas ellas, la eficacia preventiva se ha asociado estrechamente con la adherencia.
Bibliografía:
Grant RM, Lama JR, Anderson PL, et al. Preexposure chemoprophylaxis for HIV prevention in men who have sex with men. N Engl J Med 2010; 363:2587-99.
Buchbinder SP, Glidden DV, Liu AY, et al. HIV pre- exposure prophylaxis in men who have sex with men and transgender women: a secondary analysis of a phase 3 randomised controlled efficacy trial. Lancet Infect Dis 2014; 14:468-75.
Liu A, Glidden DV, Anderson PL, et al. Patterns and correlates of PrEP drug detection among MSM and transgender women in the Global iPrEx Study. J Acquir Immune Defic Syndr 2014; 67:528-37.
Deutsch MB, Glidden DV, Sevelius J, et HIV pre- exposure prophylaxis in transgender women: a subgroup analysis of the iPrEx trial. The lancet HIV 2015; 2:e512-9.
Solomon MM, Lama JR, Glidden DV, et al. Changes in renal function associated with oral emtricitabine/tenofovir disoproxil fumarate use for HIV pre-exposure prophylaxis. AIDS 2014; 28:851-859.
Mulligan K, Glidden DV, Anderson PL, et Effects of Emtricitabine/Tenofovir on Bone Mineral Density in HIV-Negative Persons in a Randomized, Double-Blind, Placebo- Controlled Trial. Clin Infect Dis 2015; 61:572-80.
McCormack S, Dunn DT, Desai M et al. Pre-exposure prophylaxis to prevent the acquisition of HIV-1 infection (PROUD): effectiveness results from the pilot phase of a pragmatic open-label randomised trial. Lancet 2015.
Molina JM, Capitant C, Spire B, et al. On-Demand Preexposure Prophylaxis in Men at High Risk for HIV-1 Infection. N Engl J Med 2015; 373:2237-46.
Grohskopf LA, Chillag KL, Gvetadze R, et Randomized trial of clinical safety of daily oral tenofovir disoproxil fumarate among HIV-uninfected men who have sex with men in the United States. J Acquir Immune Defic Syndr 2013; 64: 79–86.
Food and Drug Administration. FDA Briefing Document, Descovy for PrEP, Meeting of the Antimicrobial Drugs Advisory Committee. 2019. Accessed 2 February 2020. https://fda.gov/advisory-committees/advisory-committee-calendar/august-7- 2019-antimicrobial-drugs-advisory-committee-meeting-announcement-08072019- 08072019#event-materials.
Mayer KH, Molina J-M, Thompson MA, et al. Emtricitabine and tenofovir alafenamide vs emtricitabine and tenofovir disoproxil fumarate for HIV pre-exposure prophylaxis (DISCOVER): primary results from a randomised, double-blind, multicentre, active- controlled, phase 3, non- inferiority trial. The Lancet. 2020; 396(10246):239-254.
Baeten JM, Donnell D, Ndase P, et al. Antiretroviral prophylaxis for HIV prevention in heterosexual men and women. N Engl J Med. 2012;367(5):399-410. doi:doi:10.1056/
Thigpen MC, Kebaabetswe PM, Paxton LA, et Antiretroviral preexposure prophylaxis for heterosexual HIV transmission in Botswana. N Engl J Med. 2012;367(5):423-434. doi:doi:10.1056/NEJMoa1110711.
Van Damme L, Corneli A, Ahmed K, et al. Preexposure prophylaxis for HIV infection among African women. N Engl J Med. 2012;367(5):411-422.
Peterson L, Taylor D, Roddy R, et al. Tenofovir disoproxil fumarate for prevention of HIV infection in women: A phase 2, double-blind, randomized, placebo-controlled trial. PLoS Clin Trial. 2007;2(5):e27.
Marrazzo JM, Ramjee G, Richardson BA, et al. Tenofovir-based preexposure prophylaxis for HIV infection among African women. N Engl J Med. 2015;372(6):509-18. doi:10.1056/NEJMoa1402269.
Wallace M, Bekker LG, Roux S, et al. HPTN 067 ADAPT: “PrEP Ubuntu” and experiences with open-label PrEP among South African women. Program and abstracts of the 8th IAS Conference on HIV Pathogenesis, Treatment and Prevention; July 19-22, 2015; Vancouver, Canada. Abstract TUPEC515.
Gulick R, Wilkin T, Chen Y, et HPTN 069/ACTG 5305: Phase II Study of Maraviroc- Based Regimens for HIV PrEP in MSM. Conference on Retrovirus and Opportunistic Infections (CROI), February 22-25, 2016. Boston. Abstract 103.
Abdool Karim Q, Abdool Karim SS, Frohlich JA, et al. Effectiveness and safety of tenofovir gel, an antiretroviral microbicide, for the prevention of HIV infection in women. Science 2010;329:1168-74.
Rees H, Delany-Moretlwe SA, Lombard C, et al. FACTS 001 phase III trial of pericoital tenofovir 1% gel for HIV prevention in Conference on Retroviruses and Opportunistic Infections; February 23-26, 2015; Seattle, Washington. Abstract 26LB.
Baeten JM et al. MTN-020–ASPIRE Study Team. Use of a Vaginal Ring Containing Dapivirine for HIV-1 Prevention in Women. N Engl J Med. 2016 Dec. 1;375(22):2121- 2132. doi: 10.1056/NEJMoa1506110. Epub 2016 Feb 22. PMID: 26900902; PMCID:
Nel A et al. Ring Study Team. Safety and Efficacy of a Dapivirine Vaginal Ring for HIV Prevention in Women. N Engl J Med. 2016 Dec 1;375(22):2133-2143. doi: 10.1056/ NEJMoa1602046. PMID: 27959766.
Unidad de vigilancia de VIH, ITS y Vigilancia Epidemiológica del VIH y sida en España 2020: Sistema de Información sobre Nuevos Diagnósticos de VIH y Registro Nacional de Casos de Sida. Plan Nacional sobre el Sida – División de control de VIH, ITS, Hepatitis virales y tuberculosis-DG de Salud Pública / Centro Nacional de Epidemiología
Choopanya K, Martin M, Suntharasamai P, et al; Bangkok Tenofovir Study Group. Antiretroviral prophylaxis for HIV infection in injecting drug users in Bangkok, Thailand
Martin M, Vanichseni S, Suntharasamai P, et al; Bangkok Tenofovir Study Group. Factors associated with the uptake of and adherence to HIV pre-exposure prophylaxis in people who have injected drugs: an observational, open-label extension of the Bangkok Tenofovir Lancet HIV. 2017 Feb;4(2):e59-e66. doi: 10.1016/S2352-3018(16)30207- 7.
Guise A, Albers ER, Strathdee SA. Pre-exposure prophylaxis (PrEP) for people who inject drugs: reconciling community views and biomedical advances. Addiction. 2017 Apr;112(4):584-585. doi: 10.1111/add.13759.
Beyrer Pre-exposure prophylaxis for people who inject drugs and their sex partners. Addiction. 2017 Apr;112(4):579-580. doi: 10.1111/add.13527.
US Public Health Preexposure Prophylaxis for the Prevention of HIV Infection in the United States – 2021 Update Clinical Practice Guideline.
Grant RM, Anderson PL, McMahan V, et al. Uptake of pre-exposure prophylaxis, sexual practices, and HIV incidence in men and transgender women who have sex with men: a cohort study. Lancet Infect Dis 2014;14:820-9.
Liu AY, Cohen SE, Vittinghoff E, et al. Preexposure Prophylaxis for HIV Infection Integrated With Municipal- and Community-Based Sexual Health Services. JAMA Intern Med. 2016 Jan;176(1):75-84. doi: 10.1001/jamainternmed.2015.4683.
Marcus JL, Hurley LB, Nguyen DP, et al. Redefining Human Immunodeficiency Virus (HIV) Preexposure Prophylaxis Failures. Clin Infect Dis. 2017 Oct 30;65(10):1768-1769. doi: 10.1093/cid/cix593. PMID: 29020235; PMCID: PMC5849999.
Grulich AE, Jin F, Bavinton BR, et al; Expanded PrEP Implementation in Communities New South Wales (EPIC-NSW) research group. Long-term protection from HIV infection with oral HIV pre-exposure prophylaxis in gay and bisexual men: findings from the expanded and extended EPIC-NSW prospective implementation Lancet HIV. 2021 Aug;8(8):e486-e494. doi: 10.1016/S2352-3018(21)00074-6. Epub 2021 Jul 1. PMID: 34217426.
Hosek SG, Rudy B, Landovitz R, et An HIV Preexposure Prophylaxis Demonstration Project and Safety Study for Young MSM. J Acquir Immune Defic Syndr. 2017;74(1):21-
doi:10.1097/QAI.0000000000001179.
Goodreau SM, Hamilton DT, Jenness SM, et al. Targeting Human Immunodeficiency Virus Pre-Exposure Prophylaxis to Adolescent Sexual Minority Males in Higher Prevalence Areas of the United States: A Modeling J Adolesc Health. 2018 Mar;62(3):311-319. doi: 10.1016/j.jadohealth.2017.09.023.
Greenwald ZR, Maheu-Giroux M, Szabo J, et al. Cohort profile: l'Actuel Pre- Exposure Prophylaxis (PrEP) Cohort study in Montreal, Canada. BMJ Open. 2019 Jun 27;9(6):e028768. doi: 10.1136/bmjopen-2018-028768.
Estcourt C, Yeung A, Nandwani R, et al. Population-level effectiveness of a national HIV preexposure prophylaxis programme in AIDS. 2021 Mar 15;35(4):665-673. doi: 10.1097/QAD.0000000000002790.
Ayerdi Aguirrebengoa O, Vera García M, Arias Ramírez D, et al. Low use of condom and high STI incidence among men who have sex with men in PrEP PLoS One. 2021 Feb 4;16(2):e0245925. doi: 10.1371/journal.pone.0245925.
4. DESARROLLO DE UN PROGRAMA DE PrEP
Criterios para la prescripción de la PrEP
4.1.1 Quién debe recibir PrEP
La PrEP se recomienda a aquellas personas vulnerables a adquirir la infección por el VIH. La mayoría de las guías, como la International AIDS Society (IAS) o el CDC, recomiendan informar de la PrEP a toda persona sexualmente activa y/o personas que se inyectan drogas (PID), para poder así analizar de forma individualizada el riesgo de adquirir el VIH y valorar la idoneidad de la PrEP12.
En España, el 1 de diciembre de 2021, se procedió a la ampliación del colectivo de personas subsidiarias de PrEP, quedando de la siguiente manera3.
Personas sin infección por VIH, con edad igual o mayor de 16 años, y que cumplan los siguientes criterios:
- HSH y personas transgénero que presenten al menos dos de los siguientes criterios:Más de 10 parejas sexuales diferentes en el último año.
- Uso de drogas relacionado con el mantenimiento de relaciones sexuales sin preservativo en el último año.
-
- Práctica de sexo anal sin preservativo en el último año.
- Administración de profilaxis post-exposición en varias ocasiones en el último año.
- Al menos una ITS bacteriana en el último año.
- Mujeres en situación de prostitución que refieran un uso no habitual del preservativo.
- Mujeres y hombres cis, que refieran un uso no habitual del preservativo y que presenten al menos dos de los mismos criterios que en HSH y personas transgénero.
- Usuarios de drogas inyectadas con prácticas de inyección no seguras.
Aunque estos criterios contemplan únicamente los antecedentes de ITS bacterianas, se debe considerar también la hepatitis C como una infección sexualmente transmisible y que también puede constituir un criterio de indicación de PrEP. Asimismo, debería contemplarse la PrEP en las parejas de personas con VIH que no están indetectables (por no estar en TAR o haberlo iniciado recientemente) y en personas que en el momento de la evaluación del riesgo no presentan ninguno de estos criterios, pero que manifiestan un cambio de situación en un futuro inmediato, como por ejemplo dejar de utilizar el preservativo.
4.1.2 Quién debe prescribir la PrEP
La PrEP es una intervención médica y biopsicosocial que debe ser prescrita y supervisada por un facultativo para su inicio. Como requisitos indispensables se debe tener experiencia en tratamiento de la infección por el VIH e ITS y uso de antirretrovirales3. Además, el profesional debe estar formado en competencias culturales para la atención de minorías sexuales, así como para el abordaje del fenómeno del chemsex4. El papel de enfermería especializada es fundamental y podría encargarse de realizar el seguimiento de usuarios no complejos.
4.1.3 Dónde se debe prescribir la PrEP
Se recomienda que los centros que dispensen la PrEP cuenten con la presencia de personal sanitario con la experiencia descrita previamente, capacidad de excluir infección por el VIH y otras ITS en la evaluación inicial y en el seguimiento, capacidad de asistencia urgente a patología derivada del uso de la PrEP (como el diagnóstico y tratamiento de ITS) y capacidad de evaluar una posible toxicidad secundaria a la medicación. Además, la evaluación de los usuarios debe realizarse sin juicios de valor y generando un ambiente de confianza. Idealmente, para comodidad de los usuarios, todas las prestaciones deberían concentrarse en un solo centro con personal cualificado, pero puede existir un acuerdo entre varios centros coordinados. Las guías europeas actuales de la EACS valoran la posibilidad de que, tras una primera evaluación por un experto, la continuación de la PrEP pueda llevarse a cabo por médicos no expertos en VIH, como médicos de Atención Primaria que puedan realizar interconsultas a un médico experto en caso de necesidad5. Los CDC recomiendan la prescripción de la PrEP desde Atención Primaria, Clínicas de ITS, Unidades de VIH y Centros de Atención a personas con adicciones a drogas2.
La medicación utilizada para la PrEP es de dispensación hospitalaria, sin embargo, es necesario acercar el tratamiento antirretroviral desde las farmacias hospitalarias a los dispositivos asistenciales que atienden a estos usuarios: las Clínicas de ITS u otros centros extrahospitalarios, como los centros de Atención Primaria o los centros comunitarios. Los depósitos de farmacia, dependientes del servicio de Farmacia del Hospital, pueden constituir una fórmula adecuada para ello, contemplando también el seguimiento telemático llevado a cabo a través de programas de telefarmacia.
Debe dotarse a las Unidades hospitalarias y extrahospitalarias de personal y recursos suficientes para que puedan atender de modo adecuado la demanda y la asistencia a los usuarios de PrEP.
Es importante garantizar que los centros encargados de la PrEP sigan criterios uniformes de correcta prescripción y seguimiento.
4.1.4 Qué medicación debe utilizarse
Las pautas disponibles actualmente son:
- Un comprimido coformulado de TDF 300 mg y FTC 200 mg en pauta
- Pauta “a demanda” con TDF/FTC. El régimen consiste en 2 comprimidos juntos entre 24 y 2 horas previas a la relación sexual, seguidos de un comprimido cada 24 horas hasta 48 horas después de la última relación La eficacia de esta posología sólo está demostrada en hombres cis que tienen sexo con hombres, por lo que no debería indicarse a otros usuarios. Actualmente la pauta a demanda no está aprobada por la EMA, aunque sí contemplada como una opción por la OMS6. Esta pauta permite disminuir el número de comprimidos mensuales, por lo que puede ser de utilidad en usuarios con toxicidad renal, siempre y cuando sea una pauta adecuada para su actividad sexual.
Se ha demostrado la no inferioridad de TAF/FTC en pauta diaria frente a TDF/FTC, con mejor perfil de seguridad a nivel óseo y mejoría de los marcadores de disfunción renal en HSH y mujeres trans7 Otra modalidad es el uso de Cabotegravir de acción prolongada mediante una inyección bimestral89 En España, ninguno de estos fármacos está aprobados con la indicación de PrEP el momento de la redacción de esta guía.
Recomendaciones
- Se debe valorar la PrEP en toda persona a partir de 16 años de edad que presente algún factor de vulnerabilidad en el último año, de acuerdo con los criterios indicados en este apartado. (A-I)
- Existen otras situaciones no contempladas en estos criterios, pero en los que debe valorarse la indicación de PrEP (diagnóstico de hepatitis C, voluntad de abandono de preservativo…). (B-III)
- Antes de iniciar la PrEP se debe descartar siempre una infección por VIH, mediante serología de 4º generación (AIII), y carga viral si hay sospecha de infección aguda. (B-III)
- La PrEP debe ser prescrita y supervisada por un facultativo con experiencia en el manejo de la infección por VIH e ITS. (A-III)
- Los centros de dispensación de PrEP deben contar, como elementos imprescindibles, con: (A-III)
- Personal sanitario con capacitación en el manejo de la infección por VIH, fármacos antirretrovirales e ITS. Deben ser expertos en consejo preventivo individualizado, salud sexual y competencias culturales para la atención de minorías sexuales.
- Disponibilidad de un servicio de Farmacia que conserve, custodie y dispense la medicación e informe para el seguimiento correcto de la pauta Un depósito de farmacia vinculado al servicio hospitalario podría ser una opción válida para los centros extrahospitalarios.
- Acceso al laboratorio para llevar a cabo el diagnóstico de la infección por el VIH y otras ITS, así como evaluación bioquímica.
- Los centros participantes en programas de PrEP pueden ser variados y adaptarse a diferentes realidades. Se pueden considerar Unidades Hospitalarias de Infección por VIH, Clínicas de ITS, Centros de Salud Sexual y Reproductiva, Centros de Atención Primaria y consultas monográficas de ITS, Unidades de reducción de daños que atiendan a usuarios de chemsex y/o PID, o Centros Podría llegar a plantearse la creación de Centros específicos para el desarrollo y mantenimiento de esta estrategia. (A-III)
- La pauta de elección es la pauta diaria con TDF/FTC. (A-I)
- La pauta a demanda es una alternativa adecuada para HSH en determinadas (A-I)
Evaluación y seguimiento
4.2.1 Antes del comienzo de la PrEP (Visita basal)
La evaluación previa al comienzo de la PrEP requiere una atención integral, que debe
incluir aspectos clínicos, analíticos y consejo asistido. El objetivo es determinar si el usuario es candidato para recibirla. Se pretende excluir una infección preexistente por el VIH, valorar el riesgo de infección y descartar causas que contraindiquen o limiten el uso de los fármacos recomendados, así como ofrecer una evaluación de otros aspectos relacionados con la salud sexual.
a) Evaluación clínica y analítica
- Evaluación clínica. Se debe realizar una historia clínica completa, que incluya hábitos tóxicos y adicciones, conducta sexual, antecedentes personales y específicamente de ITS y medicaciones concomitantes.
- Evaluación analítica: antes de su prescripción se requiere una evaluación analítica con tres objetivos1011.
a. Descartar una infección preexistente por el VIH, incluyendo infecciones agudas. Se deben valorar síntomas y signos de infección aguda y solicitar la serología del En caso de clínica compatible con síndrome retroviral agudo o sospecha fundada de infección reciente y serología negativa se solicitará una carga viral plasmática de VIH, postponiendo el inicio de la PrEP hasta que la infección haya sido razonablemente descartada12.
b.Evaluar la situación serológica del virus de la hepatitis B (VHB). La infección crónica por VHB no contraindica la administración de PrEP diaria, pero sí la pauta a demanda, por lo que es importante conocer la situación serológica. Si no hay evidencia de inmunización previa, las personas susceptibles deben ser vacunadas frente a esta infección.
c. Evaluar la función El uso de TDF puede ocasionar alteraciones de la función renal. Se debe evaluar la función renal basal; solicitar creatinina sérica, filtrado glomerular estimado (FGe) y un análisis sistemático de orina. Se contraindica la PrEP con TDF/FTC si el FGe es menor de 60 mL/min. Aunque la ficha técnica de la combinación a dosis fijas de TDF/ FTC sólo está contraindicada en personas con FGe menor de 50 ml/min, si el FGe está entre 50 y 60 ml/min no se recomienda su prescripción.
- Evaluación de ITS: La evaluación clínica previa a la PrEP debe completarse siempre con un cribado completo de ITS, incluyendo gonococia, clamidiasis, sífilis y hepatitis C.
b) Otras actuaciones
Su objetivo es proporcionar un cuidado integral a las personas que van a recibir la PrEP. Se incluyen en este apartado:
- Serología frente al virus de la hepatitis A. En caso negativo, recomendar y facilitar vacunación.
- Interrogar sobre vacunación contra el Virus del Papiloma Humano (VPH). En caso de no haberla recibido, valorar su vacunación.
- En las mujeres, debe descartarse el embarazo y preguntar expresamente por el deseo gestacional. Hay que informar adecuadamente sobre las consecuencias del uso de TDF/FTC en el embarazo e implementar una adecuada planificación familiar. Es conveniente facilitar la prescripción de anticonceptivos en caso de ser el método elegido.
c) Consejo asistido
Las personas que van a recibir la PrEP deben recibir información clara sobre aspectos importantes:
- La PrEP es una intervención preventiva frente al VIH, que se debe poner en contexto de otras intervenciones preventivas, incluyendo el uso del preservativo.
- La PrEP no protege de otras ITS.
- La PrEP no funciona si la adherencia es incorrecta y puede asociarse con toxicidad si no se vigila adecuadamente.
Se debe además realizar un consejo asistido sobre salud sexual y un refuerzo de la adherencia. Sería conveniente también tener información sobre las parejas sexuales del usuario, y ofrecerle que puedan acudir a la consulta para descartar infecciones por VIH u otras ITS, o valorar la indicación de PrEP.
Incluso en el caso de que la persona no sea candidata para realizar la PrEP, se le proporcionará información sobre los recursos disponibles donde puede encontrar información y consejo sobre salud sexual y prevención del VIH y otras ITS. Además, si lo precisa, se procurará la derivación a diferentes servicios especializados como son la atención a la salud mental y adicciones.
Una vez que se ha decidido que la persona tiene indicación de PrEP, y antes de iniciarla, es importante proporcionar información sobre las visitas y analíticas de seguimiento que requiere la PrEP.
4.2.2 Durante el seguimiento13
a)Visita de inicio con los resultados de la analítica basal (Preferiblemente 1-2 semanas como máximo posteriormente de la analítica basal):(*)
Objetivo: Confirmar que el usuario no está infectado por el VIH, que cumple los criterios y no hay limitaciones para la prescripción de la PrEP.
Actuaciones:
- Evaluación de la analítica basal.
- Consejo asistido (ver 5.2.1 sección C).
- Nueva prueba de VIH en caso de presentar síntomas de primoinfección, posible exposición reciente a VIH o si se ha demorado la visita de inicio.
- Prescripción de la medicación, si está indicado. Valorar la necesidad de profilaxis post-exposición antes de iniciar la PrEP.
- Iniciar vacunación hepatitis A y B, y VPH, si es necesario.
- Programar primera visita de seguimiento (a las 4 semanas).
* Esta visita podrá realizarse junto a la analítica basal si se dispone de técnicas Point of Care que nos permitan realizar una serología y/o carga viral para VIH y determinación de creatinina plasmática. Revisando posteriormente la analítica en un plazo no superior a 7-14 días14.
b) Visita al mes de inicio de la medicación
Objetivo: Valorar la tolerancia de la medicación, así como la adherencia.
Actuaciones:
- Valoración de efectos adversos, uso de otra medicación o drogas de uso recreativo.
- Valoración de la adherencia.
- Analítica con serología para VIH.
- Programar cita para 3 meses.
c) Visitas posteriores (cada 3 meses):
Objetivo: Valorar la tolerancia a la medicación, el grado de adherencia, medicación concomitante, drogas de uso recreativo o con fines sexuales y descartar la infección por el VIH y otras ITS.
Actuaciones:
- Valoración de efectos adversos, medicación concomitante, consumo de drogas.
- Evaluar la adherencia.
- Analítica con serología para VIH y carga viral si sospecha de infección aguda.
- Cribado para sífilis, clamidiasis y gonococia cada tres o seis meses, en función del riesgo de cada persona.
- Serología de VHC cada 6-12 meses, en función del riesgo de cada persona.
- Analítica con valoración de función renal (creatinina plasmática y filtrado glomerular estimado y sistemático de orina) cada 3-6 meses durante el primer año. Posteriormente, se realizará anualmente, salvo mayores de 50 años, FGe<90 mL/min al inicio de PrEP o coexistencia de factores de riesgo, como hipertensión arterial, diabetes mellitus, etc, en los que se realizará cada 6 meses; en caso de detectar descensos significativos de FGe se intensificará el seguimiento.
- Prueba de embarazo (si precisa).
- Consejo Asistido (Ver 5.2.1 sección C)
- Reevaluar necesidad de continuidad en PrEP.
- Prescribir medicación hasta la próxima visita.
- Programar cita para 3 meses.
Podría valorarse realizar las visitas presenciales cada seis meses, intercaladas con auto-test del VIH y seguimiento telemático.
Hay que destacar que el manejo de la PrEP debe realizarse de forma multidisciplinar y en equipo, con la participación de medicina, enfermería, farmacia y los profesionales de centros comunitarios.
Las enfermeras de práctica avanzada en VIH han llevado a cabo desde el inicio de su implementación, la promoción y educación en salud sexual, consejo asistido, refuerzo de la adherencia, obtención de muestras, estudio de contactos, revisión y actualización de vacunas. Esta experiencia indica que el papel de enfermería es fundamental, especialmente en el seguimiento de la PrEP. Ver (Tabla 1).
Recomendaciones
- Realizar una historia clínica completa, que incluya hábitos tóxicos y conducta sexual.
- Antes de su prescripción se requiere una evaluación analítica:
a. Descartar una infección preexistente por el La prueba del VIH se realizará de forma trimestral.
b. Evaluar la situación serológica del virus de la hepatitis
c. Evaluar la función renal cada cada 3-6 meses durante el primer año. Posteriormente, se realizará anualmente, salvo existencia de factores de
- Realizar un cribado completo de ITS: sífilis, clamidiasis y gonococia cada tres o seis meses, y serología de VHC cada 6-12 meses, en función del riesgo de cada persona.
- Ofrecer un consejo asistido sobre prevención del VIH y otras ITS, y enfatizar la importancia de una correcta adherencia.
- Iniciar vacunación hepatitis A y B, y VPH, si es
- Valorar la tolerancia de la medicación y los posibles efectos
- Reevaluar necesidad de continuidad en
4.3 SiPrEP
El sistema de información de los programas de PrEP está impulsado por el Plan nacional sobre SIDA, el centro nacional de Epidemiología y el Instituto de Salud Carlos III15. Tiene la doble finalidad de ofrecer información a personas usuarias o interesadas en el uso de PrEP y recoger datos sobre personas usuarias de PrEP en España para monitorizar su implementación y funcionamiento. Se realiza un control de calidad de datos anualmente, publicando además un informe con los datos más relevantes.
La información recogida incluye:
- Datos epidemiológicos de los participantes.
- Uso y seguimiento: criterios de indicación, adherencia, efectos adversos y motivo de finalización, así como información sobre personas que reciben PrEP fuera de criterios financiados.
- Variables clínicas: diagnóstico de VIH/ITS, función renal y datos sobre infección por SARSCoV2.
- Características conductuales: uso de sustancias recreativas, chemsex y otras prácticas de riesgo para la adquisición del VIH.
4.4 Finalización
Los motivos para finalizar la PrEP pueden ser16:
- Infección por VIH: si se produjera una infección por VIH, el usuario debería iniciar los cuidados adecuados, incluyendo intensificación del tratamiento.
- Pérdida de seguimiento: en todos los ensayos de PrEP se realizaron controles regulares para descartar toxicidad, infección por VIH o presencia de otras ITS. Prolongar la PrEP sin realizar este tipo de controles puede suponer que una persona infectada por el VIH realice biterapia con TDF/FTC, o que exista una toxicidad que no haya sido detectada. Además, la eficacia de la PrEP depende de una buena adherencia, por lo que no se debe dispensar medicación más allá del plazo definido para la visita de seguimiento.
- Toxicidad:
-
- Toxicidad La caída del FGe por debajo de 60 mL/min, el descenso progresivo del FGe sin otra causa conocida o la hipofosfatemia grave, deben llevar a la suspensión de TDF/FTC. También se debe contemplar su suspensión ante la sospecha de tubulopatía proximal.
- Toxicidad ósea. El desarrollo de osteopenia, osteoporosis o fracturas no traumáticas, deben ser motivos de suspensión de TDF/FTC.
- Cualquier otro tipo de toxicidad que condicione la adherencia del individuo a la PrEP.
- Disminución de la situación de riesgo para la adquisición de la infección por el VIH, es decir, finalización de la indicación.
Dado que algunas personas adquieren la infección poco tiempo después de finalizar el uso de PrEP, es importante revisar con el usuario los distintos métodos de prevención de la infección por el VIH, incluyendo la profilaxis post- exposición si fuera preciso17.
Recomendaciones
- La PrEP se deberá suspender en caso de infección por el VIH, pérdida de seguimiento, toxicidad o disminución del riesgo. (AII)
4.5 Situaciones especiales
Embarazo
La prevención de la infección VIH en personas con capacidad de concebir (sexo femenino al nacer) en edad fértil, resulta clave para evitar nuevas infecciones tanto en ellas como en su descendencia(18. El riesgo de infección por el VIH durante el periodo periconcepcional, la gestación y en los primeros meses del postparto, es de dos a seis veces superior; y en el caso de que la mujer resulte infectada, la probabilidad de infectar a sus hijos es de dos a tres veces mayor que en las mujeres con infección crónica sin TAR19202122. De hecho, las infecciones que acontecen durante el embarazo, parto y periodo de lactancia, son la principal razón por la que la mayoría de países no hayan conseguido, a día de hoy, la eliminación de la infección VIH por transmisión vertical23.
En el caso de parejas serodiscordantes, el tratamiento siempre está indicado en el miembro de la pareja infectado. Las relaciones sexuales sin preservativo, periconcepcionales y durante el embarazo, cuando la persona infectada recibe TAR y mantiene una carga viral indetectable, son seguras13202425
ONUSIDA recomienda que los países con elevada incidencia y prevalencia de infección VIH, ofrezcan PrEP a mujeres embarazadas y puérperas con riesgo sustancial de infección por VIH, junto al resto de estrategias de prevención, con el fin de reducir las infecciones en ellas y en sus hijos1826.
Los datos de la farmacocinética son limitados en mujeres embarazadas que toman PrEP, pero sugieren niveles más bajos de TDF; las concentraciones de la mayoría de fármacos disminuyen en el 2º y 3er trimestre del embarazo debido al aumento del volumen de distribución y de la depuración renal27.
La adherencia es el factor limitante más importante para la efectividad. Conocidos los cambios en la farmacocinética y el hecho que se necesitan 20 días para lograr niveles de protección en los tejidos cervico-vaginales con una toma diaria de TDF, deberá realizarse un seguimiento y refuerzo del cumplimiento durante el embarazo.
Los datos actuales en poblaciones africanas, a diferencia de los comunicados en los primeros ensayos clínicos, muestran una aceptación y cumplimiento adecuados que ha contribuido a una clara reducción de las nuevas infecciones en mujeres282930.
En relación con la seguridad de la PrEP con TDF/FTC durante el embarazo y lactancia, la información disponible indica que los resultados perinatales (prematuridad, crecimiento fetal), no fueron diferentes a los de las gestantes no expuestas a TDF/ FTC1319. La exposición a TDF a través de lactancia materna es mínima y no se ha observado que tuviera un impacto negativo en los niños31.
No están aprobados en la actualidad por la FDA ni EMA la PrEP en gestantes o personas que amamantan a sus hijos con: TAF/FTC, Dapivirina (anillos vaginales) o CAB.
Hepatitis B y hepatitis C
Hepatitis B
La infección crónica por el VHC no contraindica la administración de PrEP. Es aconsejable iniciar el tratamiento del VHC cuanto antes, para evitar la posible transmisión por vía sexual a otras personas. Del mismo modo, debe recomendarse tratamiento temprano si se diagnostica una infección aguda por el VHC durante el uso de la PrEP.
Se debe tener en cuenta la posibilidad de interacciones entre la PrEP y el tratamiento del VHC. La interacción más relevante es la elevación de los niveles de TDF, y en consecuencia del riesgo de nefrotoxicidad, en aquellos individuos que reciben al mismo tiempo tratamiento con sofosbuvir3637.
Se debe incluir el cribado del VHC en los controles de la PrEP dado el evidente aumento del riesgo de infección aguda en estas personas3839.
El manejo de una persona candidata a PrEP debe hacerse por profesionales con experiencia en el tratamiento de la infección por VIH y VHB o en conjunto con un hepatólogo, para sopesar la indicación de iniciarle una pauta con fármacos con actividad antiviral para ambos virus, como el TDF/FTC, según las indicaciones y pautas establecidas para el tratamiento del VHB32.
No es aconsejable iniciar tratamiento con entecavir para tratar la infección crónica por VHB en personas candidatas a PrEP, ya que en caso de infección por el VIH podrían aparecer resistencias a lamivudina o a FTC33.
La suspensión del tratamiento con tenofovir en personas con infección crónica por VHB puede dar lugar a un incremento de la replicación del VHB que puede, a su vez, acompañarse de manifestaciones clínicas graves34. Por ello, en personas con infección crónica por VHB que reciben TDF/FTC, como estrategia de PrEP, se debe vigilar estrechamente una posible reactivación del VHB si la PrEP se suspende.
El tratamiento crónico para el VHB con TDF no se ha asociado con la aparición de resistencias a largo plazo35. No se dispone en el momento actual de información acerca de la aparición de mutaciones de resistencia del VHB al FTC en pacientes que reciben la combinación TDF/FTC o TAF/FTC, pero no es de esperar que esto ocurra si la adherencia es correcta.
Hepatitis C
La infección crónica por el VHC no contraindica la administración de PrEP. Es aconsejable iniciar el tratamiento del VHC cuanto antes, para evitar la posible transmisión por vía sexual a otras personas. Del mismo modo, debe recomendarse tratamiento temprano si se diagnostica una infección aguda por el VHC durante el uso de la PrEP.
Se debe tener en cuenta la posibilidad de interacciones entre la PrEP y el tratamiento del VHC. La interacción más relevante es la elevación de los niveles de TDF, y en consecuencia del riesgo de nefrotoxicidad, en aquellos individuos que reciben al mismo tiempo tratamiento con sofosbuvir3637.
Se debe incluir el cribado del VHC en los controles de la PrEP dado el evidente aumento del riesgo de infección aguda en estas personas3839.
4.5.3 Insuficiencia renal
En PVVIH el uso continuado de TDF puede producir toxicidad renal, que se manifiesta habitualmente como disfunción tubular proximal y, con menor frecuencia, como disminución del FGe40. Los datos sobre el efecto en la función renal de las personas en PrEP basada en TDF o TAF son limitados41.
Es necesario evaluar el riesgo de enfermedad renal en el estudio inicial, y realizar un control periódico de la función renal en los usuarios de PrEP, como se detalla en el capítulo correspondiente de esta guía.
En los ensayos clínicos y estudios observacionales sobre PrEP basada en TDF/ FTC, se observaron pequeños descensos en el FGe; reversibles en su mayoría con la suspensión de la PrEP y con mayor frecuencia en personas mayores de 50 años o con un FGe < 90 ml/min al inicio de la PrEP424344.
En el estudio DISCOVER, ensayo clínico que evalúa el uso en PrEP de TAF/ FTC versus TDF/FTC en HSH y un pequeño número de mujeres transgénero, se observó un mejor perfil de tolerancia renal de la pauta con TAF y un resultado más favorable de los marcadores bioquímicos de la función del túbulo proximal (cociente b2 microglobulina/creatinina, cociente proteína fijadora de retinol/creatinina)4546 Esto podría suponer un beneficio a largo plazo en términos de seguridad con el uso de TAF/FTC en usuarios con factores de riesgo para el desarrollo de enfermedad renal (hipertensión arterial, diabetes mellitus...)47.
Los ensayos clínicos y los estudios observacionales de PrEP basada en TDF/FTC han demostrado seguridad en adultos sanos con un FGe ≥ 60 ml/min. No hay datos sobre la seguridad de esta pauta en personas con un FGe < 60 ml/min 8.
El uso de CAB en los estudios de PrEP ha demostrado ser seguro en personas con insuficiencia renal y no requiere ajuste de dosis con FGe < 30 ml/min4748.
Por tanto, la pauta de CAB o TAF/FTC (si FGe ≥ 30 ml/min) podrían ser alternativas a tener en cuenta en personas en las que está contraindicado el uso de TDF por insuficiencia renal, una vez se encuentren disponibles en nuestro país.
No hay datos suficientes que evalúen las diferencias entre el uso de PrEP diaria o a demanda en usuarios con insuficiencia renal, pero podría valorarse plantear la pauta a demanda para reducir la exposición a TDF41.
4.5.4 PrEP en el contexto de la profilaxis post-exposición
Después de una exposición de alto riesgo, la infección por VIH puede prevenirse con la administración rápida de medicamentos ART, como la profilaxis post-exposición (PPE). Hay que tener en cuenta que la eficacia de la PPE disminuye con el tiempo a partir de las dos horas de la administración49.
Algunos estudios han demostrado que los HSH a los que se les ha prescrito la PPE, tienen una probabilidad significativamente mayor de contraer posteriormente el VIH, posiblemente asociado al hecho de mantener conductas que los hacen más vulnerables5051. Por ello, el inicio rápido de PrEP inmediatamente tras finalizar el curso de PPE, ha demostrado ser atractiva, aceptable y segura5253.
4.5.5 Chemsex
El término chemsex es un tipo particular de consumo de sustancias con fines sexuales vinculado a la cultura sexual gay. Ha sido definido como un “uso intencionado de drogas para tener relaciones sexuales por un período largo de tiempo (que puede durar desde varias horas hasta varios días)” entre GBHSH, y cuyo elemento clave es “el tiempo, porque a mayor tiempo puede ocurrir mayor exposición a diversos riesgos o daños”(54. El porcentaje de usuarios de chemsex incluidos en programas de PrEP varía entre un 24% a 63% según las diferentes áreas geográficas(55-58). España es uno de los países de Europa con las tasas más altas reportadas de uso sexualizado de drogas en GBHSH. En este sentido, más de la mitad de los individuos incluidos en los programas de PrEP en nuestro entorno reconocieron haber practicado chemsex en el último año previo al inicio de la PrEP596061.
Las sustancias más frecuentemente asociadas al chemsex son: GHB/GBL, mefedrona u otras catinonas, metanfetamina, poppers, cocaína, ketamina, éxtasis y potenciadores de la erección; siendo habitual el policonsumo6. Las formas de administración son variadas, y la vía intravenosa, conocida en este contexto como slamming, implica mayores riesgos para la salud y representa entre un 2 al 8% en dos cohortes de PrEP en España6061. Estas drogas reducen la percepción del riesgo, pueden desinhibir y provocar una hipersexualidad que facilita las sesiones prolongadas de sexo sin preservativo con un mayor número de parejas y sexo en grupo. Estas sustancias, también favorecen una mayor duración de la actividad sexual pudiendo facilitar la aparición de erosiones o traumatismos en pene o recto, lo que desencadena una mayor susceptibilidad a adquirir VIH y otras infecciones de transmisión sexual54.
La práctica del chemsex no es una barrera para el inicio ni la persistencia en un programa de PrEP. Existen datos en la literatura que confirman que la proporción y la mediana del tiempo hasta la discontinuación entre los individuos que inician PrEP son similares entre los usuarios que practican chemsex y los que no55. Asimismo, ha sido descrito un uso correcto de PrEP y altos niveles de adherencia (auto reportados) entre individuos que practican chemsex(56,57,62,63). No obstante, se ha descrito que la adherencia a la PrEP podría disminuir en el caso de sesiones de chemsex más prolongadas, policonsumo o alteraciones de la salud mental. Esto obliga a realizar una atención global de la salud sexual del individuo que incluya la salud mental y su evaluación en el tiempo para poder detectar prácticas de chemsex problemático con niveles de adherencia subóptimos a PrEP6465.
4.5.6 Adolescentes
La adolescencia es una etapa de cambios físicos y emocionales, en la que la mayoría de los jóvenes definen su identidad sexual y de género e inician las relaciones sexuales. Se trata de un proceso no exento de riesgos, en el que coincide una escasa vinculación al sistema sanitario y en la que los problemas de salud mental y de consumo de sustancias lo complican66676869.
La PrEP en adolescentes debe contemplarse junto a otras intervenciones de prevención tanto del VIH como de otras infecciones de transmisión sexual, y requiere servicios adecuados e implicación de los profesionales que los atienden6. Supone una oportunidad para integrar a los jóvenes con conductas de riesgo, algunas veces en situación de exclusión social, consumo activo de sustancias y sin soporte sociofamiliar, en un programa de salud. Los programas de PrEP deberían permitir además del control médico y seguimiento, incorporar otros profesionales especializados (salud mental, programas de deshabituación, trabajo social…)136970. La diferencia más significativa entre adolescentes y adultos es su situación legal71. En España los adolescentes, a partir de los 16 años, aun cuando son menores de edad, tienen autonomía y capacidad de tomar decisiones relacionadas con su salud. Desde diciembre de 2021, estos adolescentes tienen acceso a la PrEP. A pesar de que debe garantizarse la confidencialidad, es importante trabajar con los jóvenes para poder involucrar a sus padres y/o tutores, siempre con su autorización, buscando mejorar su soporte72. Los menores de 16 años, habitualmente entre 14 y 16 años, según la doctrina del menor maduro, si a juicio del profesional que los atiende tienen una madurez suficiente, en un contexto de ética asistencial, podrían ser considerados de la misma forma que los mayores de 16 años, para la toma de decisiones relacionadas con su salud.
En los países con elevada incidencia de infección VIH, la PrEP es una de las estrategias de prevención prioritaria en las adolescentes, por el impacto que tienen en la epidemia y en la transmisión vertical737475.
Con el fin de vincular a los adolescentes a los programas de PrEP se recomienda su atención en entornos apropiados, en los que además de garantizar la confidencialidad, se les proporcione una atención integral que incorpore cuidados (salud física y mental) así como soporte emocional y social7677. Ello ha demostrado mejorar la vinculación a los programas de PrEP y la adherencia al tratamiento, ambos aspectos primordiales dado que se trata de los dos factores limitantes de la efectividad de la PrEP en adolescentes66707879.
En relación con la seguridad de la PrEP, los estudios ATN 110 (de 18 a 22 años) y 113 (de 15 a 17 años), en jóvenes con relaciones homosexuales, informaron sobre una disminución de la densidad mineral ósea durante el período de uso de TDF/FTC más importante en el grupo de menor edad80 . Estos cambios se normalizaron un año después de interrumpir la PrEP, en el primer grupo (ATN110) pero persistieron en los más jóvenes, y en especial en los que tuvieron una mayor adherencia. Actualmente hay varios estudios en curso que evalúan más que la eficacia de la PrEP, las estrategias para incrementar la aceptación y adherencia81. El menor efecto de TAF/FTC sobre el hueso, supondría una opción quizás más adecuada en los adolescentes que inician la PrEP1369.
Recomendaciones
- Las personas con infección crónica por VHB que estén interesados en realizar profilaxis para el VIH deben ser evaluados de forma conjunta con el hepatólogo o por un profesional con experiencia en el manejo de la infección por VIH y En caso de iniciar PrEP hacerlo con una pauta diaria de TDF/ FTC. (A-II)
- Estos pacientes deben continuar seguimiento clínico de la infección por VHB, con especial atención al momento en el que la PrEP se decida (A-III)
- En pacientes con infección crónica por VHB no se deben usar pautas de PrEP intermitente. (A-III)
- La infección crónica por VHC no contraindica la administración de (A-III)
- Es necesario realizar un cribado e iniciar tratamiento precoz en caso de hepatitis aguda C durante la PrEP. (A-III)
- Debe realizarse un estudio basal de función renal (creatinina sérica, FGe) y análisis de orina antes de iniciar la Se recomienda seguimiento trimestral o semestral para todos los usuarios durante el primer año y más estrecho en caso de factores de riesgo preexistentes. (A-I)
- No se debe administrar PrEP basado en TDF a personas con FGe < 60 ml/ min. (A-I)
- La primera dosis de PPE debe administrarse lo antes posible tras el contacto y no más tarde de 72 horas después del mismo (A-II)
- A las personas que estén tomado PPE y refieran un comportamiento de alto riesgo continuado, debería ofrecérseles pasar a la PrEP inmediatamente tras finalizar el curso de la (A-I)
- En el momento de la transición de PPE a PrEP, debe de realizarse una prueba del VIH de cuarta generación52. (A-II)
- En el caso de personas que están en PrEP pero con adherencia subóptima, se deberá evaluar individualmente la necesidad de realizar PPE dependiendo del tiempo transcurrido desde la última dosis de la PrEP y el tipo de exposición. Tanto en el caso de sexo anal y adherencia menor a 3 comprimidos/semana, o última dosis de PrEP tomada hace más de 7 días, como en el caso de sexo vaginal y adherencia menor a 6 comprimidos/semana o con última toma de dosis superior a los 2 días desde la exposición, debería considerarse un ciclo de PPE. (C-III)
- Se podría valorar la posibilidad de iniciar una PPE, previamente al inicio de la PrEP, en caso de existir una exposición de alto riesgo en las últimas 72 horas. (B-II)
- La PrEP debe recomendarse como una medida de prevención en personas GBHSH que practican chemsex. (A-II)
- La atención a los usuarios de chemsex debe ser integral y centrada en la persona, evitando cualquier juicio moral, discriminación o estigmatización debido al consumo de drogas, e incluyendo herramientas y soporte tanto para la búsqueda de abstinencia como para la reducción de daños. (A-III)
- Es importante la detección precoz del consumo problemático y la derivación oportuna hacia los centros de adicciones, unidades de desintoxicación y/o centros de salud mental, donde se puede abordar el problema desde un enfoque multidisciplinar. (B-III)
- Los adolescentes que reciben atención médica tras presentar una ITS o solicitar PPE al VIH, deben ser dirigidos a un servicio donde puedan recibir atención y asesoramiento sobre PrEP. (A-II)
- La PrEP se ofrecerá dentro de un programa de prevención del VIH y otras ITS a aquellos adolescentes que cumplan criterios para ello (los mismos que los adultos), si tienen una edad igual o superior a 16 años, un peso de al menos 35 Kg y pueden garantizar su seguimiento. (A-I)
- Los programas de PrEP para adolescentes deben contemplar sus características para favorecer su vinculación al mismo y la adherencia al tratamiento. (A-II)
- La probabilidad de una adherencia insuficiente y los efectos secundarios en la salud ósea a largo plazo deben sopesarse frente al beneficio potencial de prevenir una infección VIH en el adolescente. (A-II)
Tablas:

- Cada 3-6 meses durante el primer año.
- Se realizará anualmente, salvo mayores de 50 años, FGe<90 mL/min al inicio de PrEP o coexistencia de factores de riesgo como hipertensión arterial, diabetes mellitus, etc, en los que se realizará cada 6 meses.
- En no vacunados.
- Cada 6 meses en aquellos con prácticas de alto riesgo para la transmisión del VHC.
- El cribado de ITS, y su frecuencia, se puede adaptar a cada usuario en función del riesgo.
Bibliografía:
Saag M, Rajesh , Gandhi MD, et Antiretroviral Drugs for Treatment and Prevention of HIV Infection in Adults: 2020 Recommendations of the International Antiviral Society-USA Panel. JAMA.2020 Oct 27;324(16):1651-1669. doi: 10.1001/jama.2020.17025.
DHHS/CDC Preexposure Prophylaxis for the Prevention of HIV Infection in the United States – 2021 Update Clinical Practice Guideline. https://www.cdc.gov/hiv/pdf/risk/prep/ cdc-hiv-prep-guidelines-2021.pdf (Consultado el 19/05/2022).
Grupo de Trabajo de PrEP. División de Control de VIH, ITS, Hepatitis virales y Tuberculosis. Ministerio de Sanidad. Manual de implementación de un Programa de Profilaxis Preexposición al VIH en España. Actualización diciembre de https://www. sanidad.gob.es/en/ciudadanos/enfLesiones/enfTransmisibles/sida/PrEP/Manual_PrEP_ FINAL.pdf. (Consultado el 19/05/2022).
Hillis A, Germain J, Hope V, et Pre-exposure Prophylaxis (PrEP) for HIV Prevention Among Men Who Have Sex with Men (MSM): A Scoping Review on PrEP Service Delivery and Programming. AIDS Behav. 2020 Nov;24(11):3056-3070.
European AIDS Clinical Guidelines for the clinical management and treatment of HIV-infected adults in Europe (Version 11) EACS 2021. https://www.eacsociety.org/ media/final2021eacsguidelinesv11.0_oct2021.pdf.
What’s the 2+1+1? Event-driven oral pre-exposure prophylaxis to prevent HIV for men who have sex with men: Update to WHO’s recommendation on oral Geneva: World Health Organization; 2019 (WHO/CDS/HIV/19.8). Licence: CC BY-NC-SA 3.0 IGO.
Mayer KH, Molina JM, Thompson MA, et al. Emtricitabine and tenofovir alafenamide vs emtricitabine and tenofovir disoproxil fumarate for HIV pre-exposure prophylaxis (DISCOVER): primary results from a randomised, double-blind, multicentre, active- controlled, phase 3, non-inferiority trial. Lancet. 2020 Jul 25;396(10246):239-254. doi: 10.1016/S0140-6736(20)31065-5. PMID: 32711800).
Landovitz RJ, Donnell D, Clement ME, et al. Cabotegravir for HIV Prevention in Cisgender Men and Transgender Women. N Engl J Med. 2021 Aug 12;385(7):595-608. doi: 10.1056/NEJMoa2101016. PMID: 34379922; PMCID: PMC8448593.
Delany-Moretlwe S, Hughes JP, Bock P, et al. Cabotegravir for the prevention of HIV- 1 in women: results from HPTN 084, a phase 3, randomised clinical trial. Lancet. 2022 May 7;399(10337):1779-1789. doi: 10.1016/S0140-6736(22)00538-4. Epub 2022 Apr 1.
Guideline on When to Start Antiretroviral Therapy and on Pre-Exposure Prophylaxis for HIV. Geneva: World Health Organization; 2015 Sep. PMID: 26598776. http://www.nlm.nih.gov/books/NBK327115/pdf/Bookshelf_NBK327115.pdf (Consultado el 01/06/2016).
Ministerio de Sanidad, Servicios Sociales e Igualdad, Plan Nacional sobre Sida, Guía de recomendaciones para el diagnóstico precoz de VIH en el ámbito sanitario, 2014.
Moodley D, Esterhuizen TM, Pather T, et al. High HIV incidence during pregnancy: compelling reason for repeat HIV testing. AIDS 2009;23:1255-9.
Centers for Disease Control and Prevention. US public health service: Public Health Service: Preexposure prophylaxis for the US prevention of HIV infection in the united states – 2021 update a clinical practice guideline. https://www.cdc.gov/hiv/pdf/risk/prep/ cdc-hiv-prep-guidelines-2021.pdf
Kamis KF, Marx GE, Scott KA, et Same-day HIV pre-exposure prophylaxis (PrEP) initiation during drop-in sexually transmitted diseases clinic appointments is a highly acceptable, feasible, and safe model that engages individuals at risk for HIV into PrEP care. 2019. Open Forum Infect Dis;6( 7):,:ofz310.
https://siprep.isciii.es
Coy KC, Hazen RJ, Kirkham HS, et al. Persistence on HIV preexposure prophylaxis medication over a 2-year period among a national sample of 7148 PrEP users, United States, 2015 to 2017. J Int AIDS Soc. 2019 Feb;22(2):e25252. doi: 10.1002/jia2.25252.
Marcus JL, Hurley LB, Nguyen DP, et al. Redefining HIV preexposure prophylaxis failures. Clin Infect Dis. 2017:cix593.
World Health Preventing HIV during pregnancy and breastfeeding in the context of PrEP technical brief. Geneva, Switzerland: 2017.
Panel on Treatment of HIV During Pregnancy and Prevention of Perinatal Recommendations for Use of Antiretroviral Drugs in Transmission in the United States. July 2022: https://clinicalinfo.hiv.gov/sites/default/files/guidelines/documents/Perinatal_ GL.pdf (Consultado el15/06/2022).
Graybill LA, Kasaro M, Freeborn K, et al. Incident HIV among pregnant and breast- feeding women in sub-Saharan Africa: a systematic review and meta-analysis. AIDS. 2020;34(5):761-776.
Thomson KA, Hughes J, Baeten JM, et al. Increased risk of HIV acquisition among women throughout pregnancy and during the postpartum period: a prospective per-coital- act analysis among women with HIV-infected partners. J Infect Dis. 2018;218(1):16-25.
Mofenson LM. Risk of HIV Acquisition During Pregnancy and Postpartum: A Call for Action. J Infect Dis. 2018 Jun 5;218(1):1-4.
Fruhauf T, Coleman A missed opportunity for U.S. perinatal human immunodeficiency virus elimination: pre-exposure prophylaxis during pregnancy. Obstet Gynecol. 2017;130(4):703-709.
Baza MB, Jerónimo A, Río I, et al. Natural conception is safe for HIV-serodiscordant couples with persistent suppressive antiretroviral therapy for the infected partner. J Womens Health (Larchmt). 2019;28(11):1555-1562.
Bhatt SJ, Douglas N. Undetectable equals untransmittable (U = U): implications for preconception counseling for human immunodeficiency virus serodiscordant Am J Obstet Gynecol. 2020;222(1):53.e51-53.e54.
Joseph Davey DL, Pintye J, Baeten JM, et al.; PrEP in Pregnancy Working Group. Emerging evidence from a systematic review of safety of pre-exposure prophylaxis for pregnant and postpartum women: where are we now and where are we heading? J Int AIDS Soc. 2020 Jan;23(1):e25426.
Pyra M, Anderson PL, Hendrix CW, et al. Tenofovir and tenofovir-diphosphate concentrations during pregnancy among HIV-uninfected women using oral preexposure prophylaxis. AIDS. 2018;32(13):1891-1898.
Scott RK, Hull SJ, Richards RC, et al. Awareness, acceptability, and intention to initiate HIV pre-exposure prophylaxis among pregnant women. AIDS Care. 2021:1-13.
Kinuthia J, Pintye J, Abuna F, et al. Pre-exposure prophylaxis uptake and early continuation among pregnant and post-partum women within maternal and child health clinics in Kenya: results from an implementation Lancet HIV. 2020;7(1):e38-e48.
Joseph Davey DL, Pintye J, Baeten JM, et al. Emerging evidence from a systematic review of safety of pre-exposure prophylaxis for pregnant and postpartum women: where are we now and where are we heading? J Int AIDS Soc. 2020;23(1):e25426.
Mofenson LM, Baggaley RC, Mameletzis I. Tenofovir disoproxil fumarate safety for women and their infants during pregnancy and breastfeeding. 2017;31(2):213-232.
Rodríguez M, Buti M, Esteban R, et al. Documento de consenso de la Asociación Española para el Estudio del Hígado sobre el tratamiento de la infección por el virus de la hepatitis B (2020). Gastroenterol Hepatol. 2020;43(9):559-587. doi:10.1016/j. 2020.03.011.
Jain MK, Zoellner CL. Entecavir can select for M184V of HIV-1: a case of an HIV/ hepatitis B (HBV) naive patient treated for chronic HBV. AIDS 2007;21:2365-6.
Chan HL, Chan CK, Hui AJ, et Effects of tenofovir disoproxil fumarate in hepatitis B e antigen-positive patients with normal levels of alanine aminotransferase and high levels of hepatitis B virus DNA. Gastroenterology 2014;146:1240-8.
Marcellin P, Gane EJ, Flisiak R, et Long termtreatment with tenofovir disoproxilfumarate for chronic hepatitis B infection is safe and well tolerated and associated with durable virologic response with no detectable resistance: 8 year results from two phase 3 trials. American Association for the Study of Liver Diseases (AASLD) Liver Meeting. Boston, November 7-12, 2014. Abstract 229.
Recomendaciones sobre Profilaxis Pre-Exposición en adultos para la Prevención de la Infección por VIH en España Grupo de Estudio de Sida de la SEIMC (GeSIDA). 2016. https://gesida-seimc.org/wp-content/uploads/2017/02/gesida-guiasclinicas-2016- profilaxis_pre-exposicionVIH.pdf4
Gras J, Mahjoub N, Charreau I, et al; IPERGAY Study Early diagnosis and risk factors of acute hepatitis C in high-risk MSM on preexposure prophylaxis. AIDS. 2020 Jan 1;34(1):47-52. Doi: 10.1097/QAD.0000000000002364. PMID: 31789889.
Price JC, McKinney JE, Crouch PC, et al. Sexually Acquired Hepatitis C Infection in HIV-Uninfected Men Who Have Sex With Men Using Preexposure Prophylaxis Against J Infect Dis. 2019 Apr 16;219(9):1373-1376. doi: 10.1093/infdis/jiy670. PMID: 30462305.
Tourret J, Deray G, Isnard-Bagnis C. Tenofovir effect on the kidneys of HIV-infected patients: a double-edged sword? Journal of the American Society of Nephrology : JASN 2013;24:1519-27.
Guidelines for the clinical management and treatment of HIV-infected adults in Europe. (Version 11.0, Octubre 2021). https://www.eacsociety.org/media/ 0_oct2021.pdf
Mugwanya KK, Wyatt C, Celum C, et Changes i glomerular kidney function among hiv-1–uninfected men and women receiving emtricitabine–tenofovir disoproxil fumarate preexposure prophylaxis: A randomized clinical trial. JAMA Intern Med. 2015;175(2):246- 254.
Martin M, Vanichseni S, Suntharasamai P, et al. Renal function of participants in the Bangkok tenofovir study—Thailand, 2005–2012. Clin infect Dis. 2014;59(5):716-724.
Gandhi M, Glidden DV, Mayer K, et Association of age, baseline kidney function, and medication exposure with declines in creatinine clearance on pre-exposure prophylaxis: an observational cohort study. The lancet HIV. 2016;3(11):e521-e528.
Mayer KH, Molina J-M, Thompson MA, et Emtricitabine and tenofovir alafenamide vs emtricitabine and tenofovir disoproxil fumarate for HIV pre-exposure prophylaxis (DISCOVER): primary results from a randomised, double-blind, multicentre, active- controlled, phase 3, non-inferiority trial. The Lancet. 2020;396(10246):239-254.
Ogbuagu O, Podzamczer D, Salazar LC, et Longer-term safety of F/ TAF AND F/TDF for HIV PrEP: DISCOVER Trial Week 96 Results Conference on Retroviruses and Opportunistic Infections (CROI). Accessed 24 March 2020. http://www.croiwebcasts.org/console/player/44704?mediaType=audio&&crd_ fl=0&ssmsrq=1585070251708&ctms=5000&csmsrq=5049
Preventing New HIV Infections | Guidelines and Recommendations | HIV/AIDS | CDC. Published March 29, 2022. https://www.cdc.gov/hiv/guidelines/preventing.html (Consultado el 30/May/2022).
Parasrampuria R, Ford SL, Lou Y, et A phase I study to evaluate the pharmacokinetics and safety of cabotegravir in adults with severe renal impairment and healthy matched control participants. Clin Pharmacol Drug Dev. 2019;8(5):674-681.
DeHaan E, McGowan JP, Fine SM, et al. PEP to Prevent HIV Infection [Internet]. Baltimore (MD): Johns Hopkins University; 2022 Aug 11. PMID: 33026756.
McCormack S, Dunn DT, Desai M, et al. Pre-exposure prophylaxis to prevent the acquisition of HIV-1 infection (PROUD): effectiveness results from the pilot phase of a pragmatic open-label randomised Lancet. 2016 Jan 2;387(10013):53-60. doi: 10.1016/ S0140-6736(15)00056-2. Epub 2015 Sep 9. PMID: 26364263; PMCID: PMC4700047.
Brady M, Rodger A, Asboe D, et al. BHIVA/BASHH guidelines on the use of HIV pre- exposure prophylaxis (PrEP) 2018. HIV Med. 2019 Mar;20 Suppl 2:s2-s80. doi: 10.1111/ hiv.12718. PMID: 30869189.
Cockbain B, Whitlock G; Dean Street Collaborative Group. Immediate PrEP when accessing PEP: A service HIV Med. 2022 Nov;23(10):1108-1112. doi: 10.1111/ hiv.13310. Epub 2022 Mar 29. PMID: 35352455.
O'Byrne P, Orser L, Vandyk A. Immediate PrEP after PEP: Results from an Observational Nurse-Led PEP2PrEP Study. J Int Assoc Provid AIDS Care. 2020 Jan- Dec;19:2325958220939763. doi: 10.1177/2325958220939763. PMID: 32856549; PMCID: PMC7457653.
Documento técnico sobre abordaje del fenómeno del chemsex. Secretaría del Plan Nacional sobre el Sida. Ministerio de Sanidad. 2020. https://www.sanidad.gob.es/ca/ ciudadanos/enfLesiones/enfTransmisibles/sida/chemSex/docs/DocumentoDEF.pdf
Flores Anato JL, Panagiotoglou D, Greenwald ZR, et al. Chemsex practices and pre- exposure prophylaxis (PrEP) trajectories among individuals consulting for PrEP at a large sexual health clinic in Montréal, Canada (2013-2020). Drug and alcohol dependence. 2021;226:108875.
Maxwell S, Shahmanesh M, Gafos M. Pre-exposure prophylaxis (PrEP) uptake and adherence experiences of gay and bisexual men who engage in chemsex: A qualitative study. The International journal on drug policy. 2022;103:103630.
Roux P, Fressard L, Suzan-Monti M, et Is on-Demand HIV Pre-exposure Prophylaxis a Suitable Tool for Men Who Have Sex With Men Who Practice Chemsex? Results From a Substudy of the ANRS-IPERGAY Trial. Journal of acquired immune deficiency syndromes (1999). 2018;79(2):e69-e75.
Hulstein SH, Matser A, van der Loeff MFS, et al. Eligibility for HIV Preexposure Prophylaxis, Intention to Use Preexposure Prophylaxis, and Informal Use of Preexposure Prophylaxis Among Men Who Have Sex With Men in Amsterdam, the Netherlands. Sex Transm Dis. 2021;48(2):86-93.
Encuesta europea on-line para hombres que tienen sexo con hombres (EMIS-2017): resultados en España. Ministerio de Sanidad, 2020.
Laguno M, Ugarte A, Martinez-Rebollar M, et al. PrEP program experience in a hospital HIV Description of baseline user profile and identification of opportunities for improvement. Enfermedades infecciosas y microbiologia clinica (English ed). 2021.
Ayerdi Aguirrebengoa O, Vera García M, Arias Ramírez D, et al. Low use of condom and high STI incidence among men who have sex with men in PrEP PloS one. 2021;16(2):e0245925.
Torres TS, Bastos LS, Kamel L, et al. Do men who have sex with men who report alcohol and illicit drug use before/during sex (chemsex) present moderate/high risk for substance use disorders? Drug and alcohol dependence. 2020;209:107908.
O'Halloran C, Rice B, White E, et al. Chemsex is not a barrier to self-reported daily PrEP adherence among PROUD study participants. The International journal on drug policy. 2019;74:246-254.
Grov C, Rendina HJ, John SA, et Determining the Roles that Club Drugs, Marijuana, and Heavy Drinking Play in PrEP Medication Adherence Among Gay and Bisexual Men: Implications for Treatment and Research. AIDS and behavior. 2019;23(5):1277-1286.
Storholm ED, Volk JE, Marcus JL, et al. Risk Perception, Sexual Behaviors, and PrEP Adherence Among Substance-Using Men Who Have Sex with Men: a Qualitative Study. Prevention science : the official journal of the Society for Prevention Research. 2017;18(6):737-747.
Pettifor A, Stoner M, Pike C, et al. Adolescent lives matter: preventing HIV in adolescents. Curr Opin HIV AIDS. 2018 May;13(3):265-273.
Mullins TLK, Lehmann Oral Pre-Exposure Prophylaxis (PrEP) for HIV Prevention in Adolescents and Young Adults. Curr Pediatr Rep. 2018 Jun;6(2):114-122.
Tanner MR, Miele P, Carter W, et al. Preexposure Prophylaxis for Prevention of HIV Acquisition Among Adolescents:Clinical Considerations, 2020. MMWR Recomm Rep. 2020 Apr 24;69(3):1-12. doi:10.15585/mmwr.rr6903a1.
Machado DM, de Sant Anna Carvalho AM, Riera R. Adolescent pre-exposure prophylaxis for HIV prevention: current Adolesc Health Med Ther. 2017 Nov 29;8:137-148.
PrEP for adolescents: successes, challenges and opportunities. A Statewide Forum Hosted by the New York State Department of Health AIDS Intitute. November 2015. file:///D:/PrEp/HIVG_AdolescentPrep_Meeting-report_final_02-18-20161%20(1).pdf
Culp L, Caucci L. State adolescent consent laws and implications for HIV pre- exposure prophylaxis. Am J Prev Med. 2013;44(1 Suppl 2):S119-24. doi:10.1016/j. 2012.09.044.
Fisher CB, Fried AL, Ibrahim Puri L, et al. "Free Testing and PrEP without Outing Myself to Parents:" Motivation to participate in oral and injectable PrEP clinical trials among adolescent men who have sex with PLoS One. 2018 Jul 25;13(7):e0200560.
Rotheram-Borus MJ, Davis E, Rezai R. Stopping the rise of HIV among adolescents globally. Curr Opin Pediatr. 2018 Feb;30(1):131-136.
Hosek S, Pettifor A. HIV Prevention Interventions for Adolescents. Curr HIV/AIDS Rep. 2019 Feb;16(1):120-128.
Barocas JA, Gai MJ, Nurani A, et Initiation of HIV pre-exposure prophylaxis among youth in the United States, 2015-2018. AIDS Care. 25:1-6.
Pina P, Taggart T, Sanchez Acosta M, et Provider Comfort with Prescribing HIV Pre- Exposure Prophylaxis to Adolescents. AIDS Patient Care STDS. 2021 Oct;35(10):411- 417.
Songtaweesin WN, Kawichai S, Phanuphak N, et al. Youth-friendly services and a mobile phone application to promote adherence to pre-exposure prophylaxis among adolescent men who have sex with men and transgender women at-risk for HIV in Thailand: a randomized control trial. J Int AIDS Soc. 2020 Sep;23 Suppl 5(Suppl 5).
Velloza J, Kapogiannis B, Bekker LG, et al. Interventions to improve daily medication use among adolescents and young adults: what can we learn for youth pre-exposure prophylaxis services? AIDS. 2021 Mar 1;35(3):463-475.
Garrison LE, Haberer JE. Pre-exposure Prophylaxis Uptake, Adherence, and Persistence: A Narrative Review of Interventions in the S. Am J Prev Med. 2021 Nov;61(5 Suppl 1):S73-S86. doi: 10.1016/j.amepre.2021.04.036. PMID: 34686294.
Hosek S, Siberry G, Bell M, et al. Project PrEPare (ATN082): the acceptability and feasibility of an HIV pre-exposure prophylaxis (PrEP) trial with young men who have sex with men (YMSM). Acquir Immune Defic Syndr. 2013;62(4):447–456.
Havens PL, Perumean-Chaney SE, Patki A, et al. Changes in bone mass after discontinuation of preexposure prophylaxis with tenofovir disoproxil fumarate/emtricitabine in young men who have sex with men: extension phase results of Adolescent Trials Network protocols 110 and 113. Clin Infect Dis. 2020;70(4):687-91.
5. ADHERENCIA A LA PrEP
Importancia de la adherencia a la PrEP
Mantener una correcta adherencia a la PrEP es imprescindible para obtener la máxima eficacia preventiva. Estudios como el FEM-PrEP o el iPrEx OLE correlacionan la toma de fármaco y presencia de niveles plasmáticos con la efectividad de la PrEP123.
A pesar de la íntima relación entre adherencia y eficacia, numerosos ensayos clínicos y estudios en vida real muestran niveles de adherencia subóptimos, así como su progresiva disminución con el paso del tiempo3.
Un aspecto fundamental es identificar los factores determinantes de la adherencia. De forma general, en la primera visita es necesario indagar en el entorno socioeconómico, laboral y familiar, la relación y confianza con el profesional sanitario, el conocimiento y expectativas sobre la PrEP, así como aspectos relacionados con la calidad de vida del usuario. Con dicha información se podrá elaborar un plan de visitas y seguimiento personalizado, que incorpore las sensaciones, percepciones y expectativas del usuario con la PrEP y la medición sistemática de la adherencia4.
Entre los factores que se pueden asociar a la falta de adherencia en la PrEP, se encuentran barreras estructurales de acceso, a pesar de la extensión de la financiación a un mayor número de personas vulnerables y su amplia implantación en todas las Comunidades Autónomas, y aspectos relacionados con la percepción y conocimiento sobre la PrEP por parte de los usuarios. En este sentido, el grado de aceptación social de la PrEP en el entorno cercano es un aspecto clave. Una percepción social negativa puede provocar un estigma asociado a su uso. Así, podrían ser considerados como individuos más promiscuos o menos responsables quienes optan por esta opción preventiva5. Sin embargo, la percepción del riesgo a contraer la infección y la presencia de comportamientos de alto riesgo se asocian con una mayor adherencia a la PrEP, mientras que la percepción de falta de eficacia o desconocimiento sobre posible aparición de efectos adversos pueden ser otros motivos para la falta de adherencia67.
Por otro lado, el tipo de pauta puede condicionar la adherencia, de tal modo que la toma diaria puede ser más fácil de seguir que la pauta a demanda, aunque actualmente es frecuente la alternancia de ambos regímenes para adaptar la estrategia PrEP a cada persona89. En este sentido, la introducción en el futuro de nuevas formas de administración, como los inyectables de acción prolongada, ya disponibles en otros países, o transdérmicos supone un cambio del paradigma de la adherencia en la PrEP1011.
Ciertos colectivos pueden ser más vulnerables, como las personas usuarias de drogas y las personas jóvenes12131415. En el caso de las mujeres, una alta adherencia es necesaria debido a las características farmacocinéticas.
Una vez analizados los datos de adherencia de los que disponemos y las barreras a las que los usuarios de PrEP pueden enfrentarse, es necesario adaptar las estrategias de optimización de forma individualizada desde un punto de vista multidimensional, teniendo en cuenta aspectos sociales, económicos, conductuales y las necesidades de la población diana para mejorar la percepción y la adherencia, y por tanto su eficacia.
Intervenciones para mejorar la adherencia
Como se ha demostrado, cuanto mayor sean los niveles de adherencia mayor será la eficacia16. De ahí la importancia de mantener la adherencia en los sujetos mientras se encuentran en PrEP. Intervenciones para mejorar la adherencia constituyen una estrategia fundamental para lograr la eficacia de la PrEP. En nuestro medio es habitualmente la persona en riesgo la que se acerca al sistema sanitario para demandar la PrEP; este hecho es crucial, ya que de entrada supone una motivación de esta persona para seguir el programa de PrEP correctamente. Experiencias en otros ámbitos reflejan la necesidad, entre otras cosas, de incrementar la percepción del riesgo para mejorar la adherencia117.
A través de un metanálisis se realizó un repaso a las posibles intervenciones que se podrían aplicar a las personas en PrEP, copiando las estrategias que se hacen en circunstancias parecidas: población asintomática a la que se le prescribe medicamentos para prevención del embarazo, profilaxis para tuberculosis latente, profilaxis de malaria, medicación para prevenir la osteoporosis, la dislipemia o el ictus18 En el fondo, el tener la percepción de un riesgo es lo que hace mantener la adherencia a la medicación, sabiendo además que solamente continuará la PrEP mientras se tenga riesgo19. Las intervenciones en las que más evidencia se encontró para mejorar la adherencia fueron18:
- Entrevista motivacional por personal sanitario experto.
- Recuento de comprimidos: simple, pero muy eficaz.
- Llamadas por teléfono, para recordar, asesorar o resolver dudas.
- Dispensación de varias cajas de comprimidos a la vez (tratamiento completo entre citas) y blíster con calendario.
- El uso de mensajería electrónica logra una buena aceptación por parte de los usuarios y una buena efectividad.
Todas ellas se podrían aplicar en un programa de PrEP18. Hemos obviado aquellas más complejas y con necesidad de mayores recursos.
Recomendaciones
- La PrEP debe ser una estrategia global, en la que se deben tener en cuenta las características de la población diana, y dependiendo de los recursos disponibles se harán intervenciones adaptadas a dicha población para maximizar la aceptabilidad y la adherencia. (C-III)
Bibliografía:
Corneli A, Perry B, Agot K, Ahmed K, Malamatsho F, Van Damme L. Facilitators of adherence to the study pill in the FEM-PrEP clinical PLoS One. 2015;10(4):e0125458.
Grant RM, Anderson PL, McMahan V, et Uptake of pre-exposure prophylaxis, sexual practices, and HIV incidence in men and transgender women who have sex with men: a cohort study. Lancet Infect Dis. 2014;14(9):820-829.
Haberer JE. Current concepts for PrEP adherence in the PrEP revolution: from clinical trials to routine practice. Curr Opin HIV 2016;11(1):10-17.
Calleja MA, Morillo El modelo CMO en consultas externas de Farmacia Hospitalaria. Barcelona: Euromedice Vivactis; 2016.
Grov C, Flynn AWP, D'Angelo AB, et Gay and Bisexual Men's Strategies to Maintain Daily Adherence to Their HIV Pre-exposure Prophylaxis (PrEP) Medication: Results from a Qualitative Study. Prev Sci. 2019;20(1):168-177.
Blumenthal J, Moore DJ, Jain S, et Recent HIV Risk Behavior and Partnership Type Predict HIV Pre-Exposure Prophylaxis Adherence in Men Who Have Sex with Men. AIDS Patient Care STDS. 2019;33(5):220-226.
Qu D, Zhong X, Xiao G, Dai J, Liang H, Huang A. Adherence to pre-exposure prophylaxis among men who have sex with men: A prospective cohort study. Int J Infect Dis. 2018;75:52-59.
Mutua G, Sanders E, Mugo P, et Safety and adherence to intermittent pre-exposure prophylaxis (PrEP) for HIV-1 in African men who have sex with men and female sex workers. PLoS One. 2012;7(4):e33103.
Coyer L, van den Elshout MAM, Achterbergh RCA, et al. Understanding pre-exposure prophylaxis (PrEP) regimen use: Switching and discontinuing daily and event-driven PrEP among men who have sex with men. EClinicalMedicine. 2020;29-30:100650.
Landovitz RJ, Donnell D, Clement ME, et al. Cabotegravir for HIV Prevention in Cisgender Men and Transgender Women. N Engl J Med. 2021;385(7):595-608.
Delany-Moretlwe S, Hughes JP, Bock P, et Cabotegravir for the prevention of HIV-1 in women: results from HPTN 084, a phase 3, randomised clinical trial [published correction appears in Lancet. 2022 May 7;399(10337):1778]. Lancet. 2022;399(10337):1779-1789.
Closson EF, Mitty JA, Malone J, Mayer KH, Mimiaga Exploring strategies for PrEP adherence and dosing preferences in the context of sexualized recreational drug use among MSM: a qualitative study. AIDS Care. 2018;30(2):191-198.
Marrazzo JM, Ramjee G, Richardson BA, et al. Tenofovir-based preexposure prophylaxis for HIV infection among African N Engl J Med. 2015;372(6):509-518.
Murewanhema G, Malisheni M, Takah NF. The effectiveness of tenofovir-based pre- exposure prophylaxis for prevention of HIV acquisition among sub-Saharan African women at high risk: a systematic review. Pan Afr Med J. 2021;38:308.
Hosek SG, Landovitz RJ, Kapogiannis B, et al. Safety and Feasibility of Antiretroviral Preexposure Prophylaxis for Adolescent Men Who Have Sex With Men Aged 15 to 17 Years in the United States. JAMA 2017;171(11):1063-1071.
Fonner VA, Dalglish SL, Kennedy CE, et al. Effectiveness and safety of oral HIV preexposure prophylaxis for all populations. AIDS. 2016;30(12):1973-1983.
Bazzi AR, Drainoni ML, Biancarelli DL, et al. Systematic review of HIV treatment adherence research among people who inject drugs in the United States and Canada: evidence to inform pre-exposure prophylaxis (PrEP) adherence BMC Public Health. 2019;19(1):31.
Marcus JL, Buisker T, Horvath T, et al. Helping our patients take HIV pre-exposure prophylaxis (PrEP): a systematic review of adherence interventions. HIV Med. 2014;15(7):385-395.
Sidebottom D, Ekström AM, Strömdahl S. A systematic review of adherence to oral pre-exposure prophylaxis for HIV - how can we improve uptake and adherence? BMC Infect Dis. 2018;18(1):581.
Fuchs JD, Stojanovski K, Vittinghoff E, et al. A Mobile Health Strategy to Support Adherence to Antiretroviral Preexposure Prophylaxis. AIDS Patient Care STDS. 2018;32(3):104-111.
6. VISIÓN COMUNITARIA DE LA PrEP
Retos para una implementación efectiva de la PrEP
La aprobación de la PrEP en los Estados Unidos en 2012 no fue acompañada de una implementación rápida y ágil, debido a la controversia generada en la sociedad en general y específicamente en la comunidad de HSH 1 En Europa, la EMA y el ECDC fueron muy reacios a la aprobación de la PrEP al principio, centrando sus preocupaciones en dos aspectos 2. El primero, el impacto negativo que podría tener globalmente sobre la salud sexual; en concreto, sobre el uso del condón y, como consecuencia, el temor a un incremento de las otras infecciones de transmisión sexual. El segundo, su coste-efectividad.
En cuanto al potencial menor uso del preservativo asociado a la PrEP, lo que en realidad debería preocuparnos es si esta nueva herramienta disminuye el riesgo de infección del VIH en personas que no lo usan por distintas razones3 También hay evidencias de que el uso del condón en HSH puede variar considerablemente dependiendo del propio estado serológico, de las parejas sexuales, si se está en TAR, si se trata de una pareja sexual ocasional o estable y del rol en el sexo. Por lo tanto, a la hora de abordar el uso del condón hay que tener en cuenta este conjunto de variables que introducen una mayor complejidad a esta cuestión, y que no se suelen tener en cuenta en los estudios de conductas.
Por lo que se refiere a la preocupación sobre el impacto de la PrEP en la salud sexual, y más concretamente a un hipotético aumento de otras ITS, cabe subrayar que el grupo de los HSH ya presentaba una elevada incidencia de ITS4. El aumento de las ITS, por lo tanto, no podría imputarse únicamente a la introducción de la PrEP, sino también a la ausencia de programas adecuados para su prevención, cribado y tratamiento. Bien al contrario, los controles preceptivos que conlleva la implementación de la PrEP deberían ser percibidos como una oportunidad para introducir estos programas y hacerlos extensivos a las parejas sexuales de las personas diagnosticadas.
El segundo aspecto que se argumenta en contra de la implementación de la PrEP es de naturaleza económica. Diversos estudios demuestran que la PrEP es coste- efectiva, especialmente en aquellas personas que tienen una alta adherencia y, sobre todo, si se prioriza su uso en grupos de población con una elevada incidencia. En este aspecto, un estudio español concluyó que los beneficios económicos de la PrEP se alcanzarían en 16 años. Si se asume una efectividad del 98%, se alcanzaría en 13 años un ahorro de 152 millones de euros y si la PrEP es a demanda con una efectividad del 98% el ahorro en 8 años sería de 218 millones de euros (estimado para 2.400 usuarios)5.
Actualmente, los retos más importantes para la implementación de la PrEP son el acceso y proporcionar las facilidades para que las personas se mantengan en el programa.
El acceso a la PrEP en España no ha sido fácil. En algunas Comunidades Autónomas al acceso al a PrEP está limitada, y como consecuencia se han formado largas listas de espera, lo que implica un riesgo importante de seroconversión al VIH.
Es evidente que todas las partes implicadas deberían promover aumentar el acceso, la demanda y el interés por la PrEP. Un estudio indica que, en primer lugar, deberíamos deshacernos de las listas de verificación de evaluación de riesgos6. En lugar de ello, una prevención integral del VIH debería presentar la PrEP como una opción para cualquier HSH y mujeres transgénero con una vida sexual activa, en función de si la persona siente que la PrEP es la estrategia de prevención que puede usar de manera más efectiva y consistente, en lugar de determinar la "elegibilidad" a través de conversaciones “incómodas” entre la persona y un profesional de la salud.
En segundo lugar, el lenguaje y los mensajes sobre “alto riesgo” pueden ser estigmatizantes y una barrera para la aceptación de la PrEP. Podemos hacer que la PrEP sea más atractiva para los potenciales usuarios centrándonos en los beneficios además de reducir el riesgo de infección:
- Tener menos ansiedad (tranquilidad).
- Tener más autonomía en la negociación con la pareja sexual.
- Experimentar más intimidad durante las relaciones sexuales.
- Mejorar la vida sexual y, por lo tanto, la salud mental.
- Ser parte de algo importante como la eliminación del VIH.
En tercer lugar, podemos crear servicios adicionales para poblaciones con necesidades especiales, donde la PrEP no sea el tema prioritario sino un servicio adicional. Por ejemplo, una clínica para mujeres transgénero donde reciban control y manejo de terapias hormonales.
En los próximos años el continuum de la PrEP (PrEP Cascade of Care) va a adquirir más importancia si queremos conseguir una eliminación virtual del VIH. El continuum consiste en identificar a los candidatos para la PrEP, crear interés en el programa, iniciar la PrEP, mantener una adecuada adherencia y persistencia7. Finalmente, según un estudio en el Reino Unido la PrEP es el mayor contribuidor a la reducción de la incidencia y la eliminación virtual del VIH, definida como una incidencia menor a 1/1.000 p-a, se puede conseguir, según este modelo matemático de la UCL, en un plazo de entre 17 y 33 años8.
Recomendaciones
- Se deben identificar aquellas barreras que puedan dificultar la implementación y continuidad de la PrEP para conseguir un impacto óptimo. (B-III)
- Se debe facilitar el acceso a la PrEP mediante la optimización de las visitas al hospital, clínica de ITS o centros extrahospitalarios, facilitando el seguimiento telemático que incluya teleasistencia y telefarmacia, utilizar pruebas autorrealizables para el VIH y autotoma de muestras para otras ITS y desarrollo de aplicaciones específicas y telemedicina9. (B-III)
Bibliografía:
New York Times Opinion Page. Is PrEP a Good Way to Fight HIV Infections? New York Times, 2014 June 17. https://www.nytimes.com/roomfordebate/2014/06/17/is-prep- a-good-way-to-fight-hiv-infections (Consultado el 06/06/2016).
European Medicines Agency (EMA). Reflection paper on the nonclinical and clinical development for oral and topical HIV preexposure prophylaxis (PrEP). EMA/171264/2012.
Benjamin R. Gay men are using condoms less, but their use varies based on context. POZ, 2016 Jan https://www.poz.com/article/CDC-risk-report-28308-1232 (Consultado el 6/06/2016).
Coll J, Andreu A, Jané M, et Prevalence study of asymptomatic sexually transmitted infection among men who have sex with men in a non-clinical setting in Barcelona. 29th European Conference on Sexually Transmitted Infections, Barcelona 2015 sep 24-26. Abstract P091.
Coll P, Laguna L, Andreu A, et al. Cost-effectiveness Analysis of the daily HIV Pre- Exposure Prophylaxis in Men who have Sex with Men in XII Congreso Nacional de GeSIDA 2021.
Golub SA, Myers JE. Next-Wave HIV Pre-Exposure Prophylaxis Implementation for Gay and Bisexual AIDS Patient Care STDS. 2019 Jun;33(6):253-261. doi: 10.1089/ apc.2018.0290. Epub 2019 May 16. PMID: 31094576; PMCID: PMC6588121.
Liu, G. Colfax, S. Cohen, et al. The Spectrum of Engagement in HIV Prevention: Proposal for a PrEP cascade. www.iapac.org.
Cambiano V, Lampe F, Miners A, et al. Contributions to the Decline in HIV Incidence among GBM in the UK: A Modelling Study - HIV Elimination in 25 Years. Conference on Retroviruses and Opportunistic Infections Virtual, February 12-16, 2022.
Morillo-Verdugo R, Collado-Borell R, Arrondo-Velasco A, et al.. Implementation of pharmaceutical care through Telepharmacy: A guide for professionals and Farm Hosp. 2022 Oct 30;46(7):115-122. English. PMID: 36520566.
Monte-Boquet E, Hermenegildo-Caudevilla M, Vicente-Escrig E, et al. The Telepharmacy patient prioritisation model of the Spanish Society of Hospital Pharmacy. Farm Hosp. 2022 Oct 30;46(7):106-114. English. PMID: 36520565.
7. OTROS ASPECTOS A CONSIDERAR EN LA IMPLEMENTACIÓN DE LA PrEP
7.1 Riesgos de adquisición de otras infecciones de transmisión sexual
A diferencia de lo sucedido con el VIH, los diagnósticos de ITS han ido en aumento en las últimas dos décadas en nuestro medio, especialmente gonococia, clamidiasis y sífilis, y más recientemente hepatitis C en la población HSH12. Esto ha sido debido posiblemente a la mejora en el TAR, que ha conllevado a una menor percepción de la gravedad de la infección, un menor uso del preservativo y el serosorting (preferencia por parejas sexuales del mismo estatus VIH). En algunos ensayos clínicos y estudios observacionales en HSH, una importante proporción de los usuarios de PrEP fueron diagnosticados de alguna ITS bacteriana34
Sin embargo, aún no está claro si el uso de PrEP contribuye al aumento de las ITS o si simplemente los usuarios de PrEP ya tenían más tendencia a adquirir ITS. Una posible causa sería la intensificación y frecuencia del cribado de ITS en los programas de PrEP56. En un estudio reciente realizado en diversos centros proveedores de PrEP en España, no se detectó un aumento significativo de algunas ITS como gonococia, clamidiasis y sífilis7 Según el estudio francés liderado por Molina, sobre usuarios de PrEP diaria y a demanda, no hubo una disminución significativa excepto durante el periodo del confinamiento por la COVID-198.
Pese a la discordancia de resultados en diferentes estudios respecto al posible aumento de incidencia de las ITS en usuarios de PrEP, el cribado de ITS sistemático permite detectar y tratar de manera precoz otras ITS, pudiendo reducir la transmisión de éstas.
Recomendaciones
- Se recomienda cribado para sífilis, clamidiasis y gonococia cada tres o seis meses, en función del riesgo de cada persona. (B-II)
- Se recomienda realizar serología de VHC o PCR (en caso de serología previa positiva) cada 6-12 meses, en función del riesgo de cada (B-II)
7.2 Desarrollo de Resistencias
Aunque el desarrollo de resistencias en individuos que adquieren el VIH estando en PrEP es una preocupación común, las tasas de desarrollo de resistencia siguen siendo bajas9. En caso de seroconversión del VIH, el riesgo de desarrollo de resistencias aumenta con el tiempo de exposición al TDF/FTC.
En el estudio iPrEx, sólo 2 de las 48 personas que tomaban TDF/FTC que adquirieron el VIH mostraron mutaciones de resistencia (M184I)10. En el estudio Partners PrEP, 5 de 63 seroconversores (7,9%) en los brazos activos de la PrEP desarrollaron resistencias11. En un estudio con CAB, se documentó resistencia al inhibidor de la integrasa en 4 de las 9 infecciones que se produjeron en el brazo de CAB12.
Recomendaciones(13
- Prescribir no más de 90 días de medicación a la vez y repetir las pruebas del VIH cada 3 meses. (A-II)
- Las personas que reciben la PrEP a demanda (2-1-1) con TDF/FTC deben recibir el número de pastillas en función a sus necesidades, asegurando siempre el control trimestral. (A-II)
7.3 Adquisición del VIH durante el uso de PrEP
Tal y como se indica en el protocolo de seguimiento, la prueba del VIH debe realizarse cada 3 meses o cuando existen indicadores clínicos que lo aconsejen. Debe tenerse en cuenta que la seroconversión del VIH puede retrasarse por la exposición a TDF/ FTC.
Recomendaciones
Si ocurre una seroconversión de VIH mientras un individuo está tomando la PrEP, deben realizarse lo siguiente13:
- Solicitar estudios de laboratorio rutinarios, carga viral de VIH, recuento de células CD4 y estudio de resistencias genotípicas a las familias que esté tomando. (A-I)
- Una vez que se diagnostica el VIH, es importante convertir el régimen de la PrEP a una pauta de tratamiento antirretroviral supresivo. Si es necesario, el régimen antirretroviral puede modificarse cuando se disponga de los resultados genotípicos. (A-I)
- La persona recién diagnosticada debe recibir asesoramiento sobre su estado serológico y las medidas que debe tomar para prevenir la transmisión del VIH a otras personas. (A-I)
7.4 Toxicidad de la PrEP
Por lo general, la PrEP suele tolerarse correctamente, ocasionando sólo en un 2% de los casos reacciones adversas graves que lleven a su abandono o necesidad de suspensión 14. Sin embargo, sí se han registrado efectos adversos en los distintos ensayos clínicos y estudios post-comercialización que precisan vigilancia. En cuanto a los efectos adversos más frecuentes, comunes a ambos principios activos, distinguimos los gastrointestinales, como náuseas, vómitos y pérdida de peso involuntaria1516. Otros síntomas incluyen la flatulencia, diarrea y dolor abdominal17. Estos síntomas son leves y autolimitados, ocurren en el primer mes de la administración y se resuelven habitualmente en menos de 3 meses, no habiéndose asociado a interrupciones del tratamiento en la mayoría de los casos15. También son frecuentes los mareos y/o cefaleas, así como posible elevación de las transaminasas y aparición de trastornos de la piel, tales como erupción, urticaria o exantemas.
FTC se relaciona con neutropenia, hipertrigliceridemia, hiperglucemia e insomnio. TDF se ha asociado a toxicidad renal por tubulopatía renal proximal, que puede causar insuficiencia renal tipo IV o el síndrome de Fanconi en rarísimas ocasiones. Hay que tener en consideración que el riesgo de afectación renal aumenta en personas mayores de 40 años y/o con disfunción renal preexistente18. Este aspecto se desarrolla de forma detallada en el apartado 5.5.3. Insuficiencia renal.
Además, el TDF también causa osteopenia por alteraciones en la expresión génica de los osteoblastos. Su uso se asocia a una pequeña disminución de la densidad mineral ósea (0,5 a 1,5%) en los primeros meses de su administración, que se estabiliza o se normaliza al interrumpirla. No se ha evidenciado en los ensayos clínicos un aumento de la tasa de fracturas en relación al placebo. El control radiológico de la densidad mineral ósea de rutina, no está indicado para las personas que inician PrEP, a no ser que presenten otros factores de riesgo de fractura como la osteoporosis14.
El uso de PrEP en la gestación parece seguro. La eficacia ha sido evaluada en cuatro de los principales ensayos clínicos de eficacia de la PrEP: el estudio Partners PrEP, el TDF2 Estudio, FEM-PrEP y VOICE, sin que se encontraran diferencias significativas en interrupciones del embarazo, partos prematuros o complicaciones relacionadas con la gestación19.
Bibliografía:
Nguyen VK, Greenwald ZR, Trottier H, et Incidence of sexually transmitted infections before and after preexposure prophylaxis for HIV. AIDS [Internet] 2018 [cited 2021 Jan 29];32(4):523-30.
Volk JE, Marcus JL, Phengrasamy T, et Incident Hepatitis C Virus Infections Among Users of HIV Preexposure Prophylaxis in a Clinical Practice Setting. Clin Infect Dis 2015; 60:1728.
Volk JE, Marcus JL, Phengrasamy T, et al. No New HIV Infections With Increasing Use of HIV Preexposure Prophylaxis in a Clinical Practice Clin Infect Dis 2015; 61:1601.
Molina JM, Charreau I, Spire B, et al. Efficacy, safety, and effect on sexual behaviour of ondemand pre-exposure prophylaxis for HIV in men who have sex with men: an observational cohort study. Lancet HIV 2017; 4:e402.
Gus PrEP and sexually transmitted infections. PrEP Science. A research briefing 2020. https://www.aidsmap.com/about-hiv/prep-and-sexually-transmitted-infections
McCormack S, Dunn DT, Desai M, et al. Pre-exposure prophylaxis to prevent the acquisition of HIV-1 infection (PROUD): effectiveness results from the pilot phase of a pragmatic openlabel randomised trial. Lancet 2016; 387:53.
Marcus JL, Katz KA, Krakower DS, et al. Risk Compensation and Clinical Decision Making - The Case of HIV Preexposure Prophylaxis. N Engl J Med 2019; 380:510.
Molina JM, Ghosn J, Delaugerre C, et al. Incidence of HIV infection with daily or on- demand oral PrEP with TDF/FTC in CROI 2021, Conference on Retroviruses and Opportunistic Infections, March 6-10, 2021. Abstract 148.
Baeten JM, Donnell D, Ndase P, et al. Antiretroviral prophylaxis for HIV prevention in heterosexual men and women. N Engl J Med. 2012 Aug 2;367(5):399-410. doi: 10.1056/
Liegler T, Abdel-Mohsen M, Bentley LG, et al. HIV-1 drug resistance in the iPrEx preexposure prophylaxis trial. J Infect Dis. 2014 Oct 15;210(8):1217-27. doi: 10.1093/ infdis/jiu233. Epub 2014 Apr 16. PMID: 24740633; PMCID: PMC4176446.
Lehman DA, Baeten JM, McCoy CO, et al. Risk of drug resistance among persons acquiring HIV within a randomized clinical trial of single- or dual-agent preexposure prophylaxis. J Infect Dis. 2015 Apr 15;211(8):1211-8. doi: 10.1093/infdis/jiu677. Epub 2015 Jan 13. PMID: 25587020; PMCID: PMC4402339.
Landovitz RJ, Donnell D, Clement ME, et al. Cabotegravir for HIV Prevention in Cisgender Men and Transgender Women. N Engl J Med. 2021 Aug 12;385(7):595-608. doi: 10.1056/NEJMoa2101016. PMID: 34379922; PMCID: PMC8448593.
Centers for Disease Control and Prevention: US Public Health Service: Preexposure prophylaxis for the prevention of HIV infection in the United States—2021 Update: a clinical practice guideline. December 2021:1-108.
James Riddell IV, K. Rivet Amico, Kenneth H.Mayer. HIV Preexposure Prophylaxis. JAMA, March 2018, volumen 319, Number 12: 1261-1268.
Grant RM, Lama JR, Anderson PL, et al. Preexposure chemoprophylaxis for HIV prevention in men who have sex with men. N Engl J Med.2010;363 (27):2587-99.
Baeten JM, Donnell D, Ndase P, et al. Antiretroviral prophylaxis for HIV prevention in heterosexual men and women. N Engl J Med. 2012;367(5):399-410.
Choopanya K, Martin M, Suntharasamai P, et al. Antiretroviral prophylaxis for HIV infection in injecting drug users in bangkok, thailand (the bangkok tenofovir study): A randomised, double-blind, placebo-controlled phase 3 Lancet. 2013;381(9883):2083- 90.
Douglas Drak, Hamish Mcmanus, Tobias Vickers, et al., for the Expanded PrEP Implementation in Communities New South Wales (EPIC-NSW) research group. Renal impairment in a large-scale HIV preexposure prophylaxis implementation cohort. AIDS 2021, 35:2319-2326.
Mugo NR, Hong T, Celum C, et Pregnancy incidence and outcomes among women receiving preexposure prophylaxis for HIV prevention: a randomized clinical trial. Jama. 2014July23-30;312(4):362–371. • Key safety data from pregnant women exposed to TDF for PrEP in major efficacy trial.
8. NUEVOS FÁRMACOS Y ESTRATEGIAS
Las estrategias actuales de la PrEP han demostrado una elevada seguridad y eficacia, siempre condicionadas a una correcta adherencia. Es por este motivo por el cual se buscan nuevas estrategias que faciliten el cumplimiento con formulaciones de acción prolongada, administración local de fármacos o nuevos medicamentos orales.
Cabotegravir
La formulación de cabotegravir (CAB) de acción prolongada (AP) ha sido aprobada en combinación con rilpivirina AP para su uso en el tratamiento de la infección por VIH, tanto por parte de la agencia norteamericana reguladora de los medicamentos y productos sanitarios (FDA) como por parte de la EMA.
La FDA también ha autorizado el uso de CAB AP en la PrEP.
Los estudios ECLAIR y HPTN077 son dos ensayos clínicos en fase IIa en los que se ha analizado la seguridad, tolerancia y aceptabilidad de CAB AP en personas no infectadas por VIH con bajo riesgo de infección frente a placebo12345. Posteriormente, se iniciaron dos nuevos ensayos clínicos en fase III: HPTN083 y HPTN084. Ambos son estudios multicéntricos, doble ciego en los que se ha analizado la eficacia de CAB AP frente a TDF/FTC en personas no infectadas por VIH con alto riesgo de infección. HPTN083 incluía 4566 HSH cis y mujeres transgénero y HPTN084 incluía 3224 mujeres cis678 Los dos estudios se desenmascararon antes de lo previsto debido a la superioridad del CAB AP frente al TDF/FTC, con una menor incidencia de infecciones observada en el primer análisis provisional programado (HR 0,34 y 0,12 respectivamente, ambos estadísticamente significativos). El riesgo de infección fue 66% menor en el grupo de CAB AP que en el de TDF/FTC en HSH y mujeres transgénero, y 88% menor en mujeres cis.
Aunque en ambos ensayos clínicos se administró el CAB oral durante las 4 primeras semanas (oral lead-in), se puede administrar directamente el CAB AP inyectable, tal como consta en la ficha técnica de la FDA y en guías clínicas910.
Como consideraciones a analizar sobre las que todavía no se dispone de suficiente información, resaltar las consecuencias de la finalización de la administración de CAB AP en personas que mantienen un elevado riesgo de infección. Se encontraron niveles detectables de CAB en plasma durante varios meses tras la suspensión del tratamiento. Por ello, se plantea la opción de utilizar una terapia oral con TDF/ FTC que evite la infección y la posible resistencia a los fármacos durante la cola farmacocinética11. Por otro lado, solo se ha estudiado la administración intramuscular de CAB AP en el glúteo, por lo que no se conocen las repercusiones en la absorción en otras zonas en aquellos casos en los que no pueda administrarse en el glúteo (personas con implantes en esta zona)12.
Otras opciones de PrEP
En nuestro medio siguen diagnosticándose un elevado número de infecciones por VIH y éstas ocurren no solo entre HSH, sino también entre mujeres, PID13. Por lo que se hace necesario que exploremos nuevas alternativas adaptadas a estas personas.
I. Anillo intravaginal de Dapivirina 25 mg:
Formado por un anillo de silicona que contiene 25 mg de Dapivirina, que es un inhibidor de la transcriptasa inversa no análogo de nucleósido (no apto por vía oral por su baja absorción). Su papel es el de un microbicida local que actúa tras su inserción vaginal, debiendo ser sustituido cada 28 días.
La eficacia de este fármaco ha sido evaluada frente a placebo en los ensayos clínicos RING y ASPIRE ambos de fase III, con sus respectivos ensayos de continuación DREAM y HOPE de fase IIIb. Estos estudios incluyeron a más de 6.000 mujeres de diferentes países africanos, siendo el resultado principal la capacidad del anillo de reducir aproximadamente una de cada tres nuevas infecciones (en torno al 37%). En todos estos estudios se demostró una buena seguridad, con efectos secundarios leves, poco frecuentes y locales, sin que se demostraran diferencias entre el grupo de Dapivirina y el placebo1415.
La Agencia Europea del Medicamento ha emitido una opinión favorable para el uso del anillo de Dapivirina en zonas sin acceso a la PrEP oral. En 2021, la OMS recomendó su uso combinado con otras estrategias de profilaxis, dado que la eficacia es notablemente inferior a la demostrada por la PrEP oral16.
II. Tenofovir local y otros microbicidas
El TDF se encuentra en estudio en diversas estrategias de administración local tanto vaginal como rectal. Actualmente, como parte del proyecto DREAM, se está evaluando la ducha rectal o enema con TDF a demanda en una (DREAM01 y DREAM 02) o tres dosis (DREAM03). Hasta el momento conocemos que la administración del producto es segura17. Además de lo anterior se encuentran en fases muy precoces de estudio otros geles, films, óvulos y anillos intravaginales que contienen TDF o TAF solos o en combinación con otros fármacos como elvitegravir18. La seguridad y farmacocinética del TAF como PrEP está siendo además evaluado en forma de un implante subcutáneo en un ensayo en fase I/II que se está realizando actualmente en mujeres (CAPRISA 018)19. Otros fármacos solos o en combinación como el Vicriviroc han sido evaluados en anillos vaginales, demostrando fundamentalmente hasta ahora su aceptabilidad, seguridad y tolerabilidad20.
III. Anticuerpos ampliamente neutralizantes:
Existen actualmente datos sobre diversos anticuerpos neutralizantes solos o en combinación, como estrategias de prevención frente al VIH.
Destacamos los estudios HVTN 703/HPTN 081 realizado en mujeres procedentes de África Subsahariana y HVTN 704/HPTN 085 realizado en HSH y mujeres transgénero de Suiza, Estados Unidos y Sudamérica. En ambos estudios se evaluó la infusión intravenosa de dos dosis diferentes del anticuerpo neutralizante VRC01 administradas cada 8 semanas frente a placebo.
De forma global, esta estrategia demostró muy poca eficacia en la prevención de nuevas infecciones por VIH, fundamentalmente debido a que el virus circulante en las regiones donde se realizó el estudio era hasta en un 70% resistente a VRC0121. Cuando se realizó un subanálisis de las personas expuestas a cepas sensibles, la eficacia resultó ser del 75% en la reducción de nuevas infecciones. Estos datos sugieren la necesidad de más estudios para evaluar la eficacia de otros anticuerpos o combinaciones de estos.
IV. Lenacapavir
El Lenacapavir (LEN) es un inhibidor de la cápside, un nuevo fármaco antirretroviral, que actúa en diferentes fases de la replicación del VIH. Una ventaja de este fármaco es que puede administrarse por vía subcutánea cada seis meses, lo que podría resultar muy atractivo como nueva opción de PrEP. Actualmente se están desarrollando dos ensayos clínicos en fase III: PURPOSE 1, en mujeres jóvenes y adolescentes, en donde se compara con el TAF/FTC, y el PURPOSE 2, en hombres cis, personas transgénero (mujeres y hombres) y personas no binarias, que tiene sexo con hombres, en donde se compara con TDF/FTC o TAF/FTC22.
Bibliografía:
Markowitz M, Frank I, Grant RM, et Safety and tolerability of long-acting cabotegravir injections in HIV-uninfected men (ECLAIR): a multicentre, double-blind, randomised, placebo-controlled, phase 2a trial. Lancet HIV. 2017;4(8):e331-e340.
Tolley EE, Zangeneh SZ, Chau G, et al. Acceptability of Long-Acting Injectable Cabotegravir (CAB LA) in HIV-Uninfected Individuals: HPTN 077. AIDS Behav. 2020;24(9):2520-2531.
Landovitz RJ, Li S, Grinsztejn B, et Safety, tolerability, and pharmacokinetics of long- acting injectable cabotegravir in low-risk HIV-uninfected individuals: HPTN 077, a phase 2a randomized controlled trial. PLoS Med. 2018;15(11):e1002690.
Landovitz RJ, Li S, Eron JJ Jr, et Tail-phase safety, tolerability, and pharmacokinetics of long-acting injectable cabotegravir in HIV-uninfected adults: a secondary analysis of the HPTN 077 trial. Lancet HIV. 2020;7(7):e472-e481.
Landovitz RJ, Donnell D, Clement ME, et al. Cabotegravir for HIV Prevention in Cisgender Men and Transgender Women. N Engl J Med. 2021;385(7):595-608.
Marzinke MA, Grinsztejn B, Fogel JM, et Characterization of Human Immunodeficiency Virus (HIV) Infection in Cisgender Men and Transgender Women Who Have Sex With Men Receiving Injectable Cabotegravir for HIV Prevention: HPTN 083. J Infect Dis. 2021;224(9):1581-1592.
Delany-Moretlwe S, Hughes JP, Bock P, et Cabotegravir for the prevention of HIV-1 in women: results from HPTN 084, a phase 3, randomised clinical trial. Lancet. 2022:S0140- 6736(22)00538-4.
Eshleman SH, Fogel JM, Piwowar-Manning E, et al. Characterization of Human Immunodeficiency Virus (HIV) Infections in Women Who Received Injectable Cabotegravir or Tenofovir Disoproxil Fumarate/Emtricitabine for HIV Prevention: HPTN 084. J Infect Dis. 2022:jiab576.
Preexposure prophylaxis for the prevention of HIV infection in the United States
Ficha técnica aprobada por la FDA de Apretude (Cabotegravir AP para PrEP) (Disponible en:
Mayer KH, Allan-Blitz Enhancing HIV Prevention With New Modalities and Routine Sexual History Discussions. JAMA. 2022;327(15):1447-1448.
Coelho LE, Torres TS, Veloso VG, et Pre-exposure prophylaxis 2.0: new drugs and technologies in the pipeline. Lancet HIV. 2019:e788-e799.
Vigilancia epidemiológica del VIH y SIDA en España. Actualización 30 de junio de 2021. Sistema de Información sobre nuevos diagnósticos de VIH. Registro nacional de casos de Plan nacional sobre SIDA. Ministerio de Sanidad, Servicios Sociales e Igualdad. https://www.sanidad.gob.es/ciudadanos/enfLesiones/enfTransmisibles/sida/ vigilancia/Informe_VIH_SIDA_WEB.pdf
Nel A, van Niekerk N, Kapiga S, et al. Safety and Efficacy of a Dapivirine Vaginal Ring for HIV Prevention in Women. N Engl J Med [Internet]. 2016 Dec [cited 2022 Jun 1];375(22):2133–43. https://pubmed.ncbi.nlm.nih.gov/27959766/
Baeten JM, Palanee-Phillips T, Brown ER, et al. Use of a Vaginal Ring Containing Dapivirine for HIV-1 Prevention in N Engl J Med [Internet]. 2016 Dec [cited 2022 Jun 1];375(22):2121. /pmc/articles/PMC4993693/
International Partnership for Microbicides. A Long-Acting Ring for Women’s HIV Prevention. https://www.ipmglobal.org/sites/default/files/ attachments/publication/ipm_ pdf
Tenofovir Rectal Douche to Prevent HIV Transmission - Full Text View - gov [Internet]. [cited 2022 Jun 1]. https://clinicaltrials.gov/ct2/show/NCT04016233.
Safety and Pharmacokinetic Study of Tenofovir Alafenamide (TAF)/Elvitegravir (EVC) Administered Rectally - Full Text View - ClinicalTrials.gov [Internet]. [cited 2022 Jun 1]. https://clinicaltrials.gov/ct2/show/NCT04047420.
Gengiah TN, Abdool Karim Q, Harkoo I, et al. CAPRISA 018: a phase I/II clinical trial study protocol to assess the safety, acceptability, tolerability and pharmacokinetics of a sustained-release tenofovir alafenamide subdermal implant for HIV prevention in BMJ Open [Internet]. 2022 Jan 6 [cited 2022 Jun 1];12(1). https://pubmed.ncbi.nlm.nih. gov/34992111/
Hoesley CJ, Chen BA, Anderson PL, et al. Phase 1 Safety and Pharmacokinetics Study of MK-2048/Vicriviroc (MK-4176)/MK-2048A Intravaginal Rings. Clin Infect Dis [Internet]. 2019 Mar 19 [cited 2022 Jun 1];68(7):1136–43.https://pubmed.ncbi.nlm.nih. gov/30289435/
Corey L, Gilbert PB, Juraska M, et al. Two Randomized Trials of Neutralizing Antibodies to Prevent HIV-1 N Engl J Med [Internet]. 2021 Mar 18 [cited 2022 Jun 1];384(11):1003–14. https://www.nejm.org/doi/full/10.1056/NEJMoa2031738.
Study to Assess Safety and Efficacy of Lenacapavir and Emtricitabine/ Tenofovir Alafenamide for Pre-Exposure Prophylaxis in Adolescent Girls and Young Women at Risk of HIV Infection (PURPOSE 1). https://clinicaltrials.gov/ct2/show/ NCT04994509?term=PURPOSE+1&draw=2&rank=1#wrapper (Consultado el 13/12/2022).
Study to Assess the Effectiveness and Safety of Lenacapavir for Human Immunodeficiency Virus (HIV) Pre-Exposure Prophylaxis (PURPOSE 2). https:// gov/ct2/show/NCT04994509?term=PURPOSE+1&draw=2&rank=1#wrapper (Consultado el 13/12/2022).