Documento de consenso en relación con las alteraciones metabólicas y riesgo cardiovascular en las personas con VIH
Agosto 2025
Notas de la Versión:
Agosto 2025
COMITÉ DE REDACCIÓN (en orden alfabético)
Coordinadores:
- María José Galindo Puerto. Unidad de Enfermedades Infecciosas, Servicio de Medicina Interna, Hospital Clínico Universitario de Valencia, Valencia
- Esteban Martínez Chamorro. Unidad de VIH, Servicio de Infecciones, Hospital Clínic de Barcelona, Barcelona.
Redactores:
- Enrique Bernal Morell. Sección de Enfermedades Infecciosas, Servicio de Medicina Interna, Hospital General Universitario Reina Sofía, Murcia.
- José Ignacio Bernardino de la Serna. Unidad de VIH, Hospital Universitario La Paz, Madrid.
- Pere Domingo Pedrol. Unidad de VIH/Sida, Hospital de la Santa Creu i Sant Pau, Barcelona.
- Carlos Dueñas Gutiérrez. Servicio de Medicina Interna, Hospital Clínico Universitario de Valladolid, Valladolid.
- Vicente Estrada Pérez. Unidad de Enfermedades Infecciosas, Servicio de Medicina Interna, Hospital Clínico San Carlos, Madrid.
- Ana González Cordón. Unidad de VIH, Servicio de Infecciones, Hospital Clínic de Barcelona, Barcelona.
- Xabier Kortajarena Urkola. Servicio de Enfermedades Infecciosas, Hospital Universitario de Donostia, Donostia, Gipuzkoa.
- Mar Masiá Canuto. Unidad de Enfermedades Infecciosas, Servicio de Medicina Interna, Hospital General Universitario de Elche, Elche, Alicante.
- Javier Murillas Angoiti. Servicio de Medicina Interna, Hospital Universitario Son Espases, Palma de Mallorca
- María Saumoy. Unidad VIH e ITS, Servicio de Enfermedades Infecciosas, Hospital Universitario de Bellvitge, L’Hospitalet de Llobregat, Barcelona.
- Sofía Sabato. Fundació Lluita contra les Infeccions, Badalona, Barcelona
- Julián Olalla Sierra. Servicio de Medicina Interna, Hospital Costa del Sol, Marbella, Málaga.
- María Velasco Arribas. Sección de Enfermedades Infecciosas, Servicio de Medicina Interna, Hospital Universitario Fundación Alcorcón, Alcorcón, Madrid
Revisores:
- Miguel Camafort Babloswski. Servicio de Medicina Interna Hospital Clinic de Barcelona, Barcelona.
- Fernando Gómez Peralta. Unidad de Endocrinología y Nutrición Hospital General de Segovia, Segovia.
- Carlos Guijarro Herráiz. Servicio de Medicina Interna, Hospital Universitario Fundación Alcorcón, Alcorcón, Madrid.
- Ángel Merchante Alfaro. Servicio de Endocrinología y Nutrición, Hospital General Universitario de Castellón, Castellón.
- Josep Vidal Cortada. Servicio de Endocrinología, Hospital Clínic de Barcelona, Barcelona.
DECLARACIÓN DE TRANSPARENCIA (conflictos de interés)
Coordinadores:
- María José Galindo Puerto ha efectuado labores de consultoría para Gilead Sciences, Janssen, Merck, ViiV; ha disfrutado de becas para investigación clínica de Janssen y ha recibido compensación económica por elaboración de materiales educativos y ponencias para Gilead Sciences, Janssen, MSD, ViiV y Abvie.
- Esteban Martínez ha recibido honorarios por conferencias o reuniones de asesoría de Gilead, Janssen, MSD y ViiV, y su institución ha recibido subvenciones de investigación de MSD y ViiV.
Revisores/a:
- Josep Vidal ha recibido soporte económico para asesoramiento o actividades científicas de los siguientes Laboratorios Novo-Nordisk, Lilly, Boheringer-Ingelheim, Astra Zeneca, Sanofi, Amgen, Nestlé, Medtronic, Johnson & Johnson.
- Fernando Gómez Peralta declara no tener conflictos de interés con el contenido de su capítulo.
- Miguel Camafort declara no tener ningún conflicto de interés con respecto a ese documento.
- Ángel Merchante declara no tener ningún conflicto de intereses con respecto a este documento.
- Carlos Guijarro: declara no tener ningún conflicto de intereses con respecto a este documento.
Redactores/as:
- Javier Murillas Angoiti declara que no tiene conflictos de interés relevantes que puedan haber influido en el contenido, el desarrollo o las recomendaciones incluidas en estas guías.
- Enrique Bernal Morell ha efectuado labores de consultoría para Gilead Sciences, Johnson and Johnson, Merck Sharp & Dohme y ViiV Healthcare. Ha recibido becas de investigación de Gilead Sciences, y honorarios por charlas de AbbVie, Bristol-Myers Squibb, Gilead Sciences, Johnson and Johnson, Merck Sharp & Dohme y ViiV Healthcare.
- Vicente Estrada ha recibido honorarios por asesoría científica de Johnson&Johnson, Gilead y MSD, y soporte para reuniones científicas de Johnson&Johnson y Gilead
- Sofía Sabato no declara ningún conflicto de interés
- Xabier Kortajarena Urkola no declara ningún conflicto de interés.
- Julián Olalla Sierra ha participado como ponente en actividades de Astra Zéneca, Gilead, GSK, Janssen, MSD, Pfizer y ViiV, ha sido consultor de Astra Zéneca, Gilead, GSK, Janssen, MSD, Pfizer y ViiV, ha participado en ensayos clínicos de Astra Zéneca, Gilead, GSK, MSD y ViiV.
- Ana González-Cordón declara no tener ningún conflicto de intereses con respecto a este documento.
- María Velasco Arribas ha recibido ayudas para investigación clínica del Instituto de Salud Carlos III, de Gilead Sciences y de Angellini; ayudas para realización de actividades docentes de Gilead Sciences, Merck Sharp & Dohme, ViiV Healthcare, Janssen Cilag, Cinfa y Takeda; compensación económica por presentaciones con fines educacionales de Gilead Sciences y Johnson & Johnson; por asesoría científica de Gilead Sciences, ViiV y Angellini y para asistencia a congresos de ViiV Healthcare, Gilead Sciences, Johnson & Johnson y Angellini.
- Carlos Dueñas Gutiérrez ha recibido compensaciones económicas por actividades educativas, consultorías o asistencias a congresos de ViiVHealthcare, Janssen-Cilag, Gilead Sciences y Merck Sharp & Dohme
- José Ignacio Bernardino de la Serna ha recibido compensaciones económicas por asesorías para Gilead, MSD, y VIIV healthcare. Presentaciones e inscripciones a congresos Johnson & Johnson.
- Pere Domingo has received research grants or has been a member of the speaker’s bureau or advisory board panels Janssen&Cilag, Gilead Sciences,
Merck, Sharp & Dohme, ViiV Healthcare, Thera technologies, Ferrer International - Mar Masiá ha recibido honorarios por consultoría y conferencias de Janssen, MSD y ViiV Healthcare; honorarios por asistencia a reuniones y/o viajes de Janssen y MSD.
- Maria Saumoy ha recibido financiación por actividades educacionales, investigación y asistencia a congresos de Gilead Sciences, Janssen-Cilag, Merck Sharp & Dome.
AGRADECIMIENTOS
Dr José Antonio Irribarren, Dr Javier Martínez Sanz, María Pinto Da Solva y el equipo médico de Gilead por sus comentarios y a Dra González Pérez de Villar por su colaboración en la elaboración del capítulo de manejo de la diabetes mellitus en los pacientes con VIH.
1. INTRODUCCIÓN
Objetivos y alcance del documento
Las personas con VIH (PVIH) tienen entre un 50 y un 100% más de riesgo de padecer enfermedades cardiovasculares que la población general. 1 La enfermedad cardiovascular aterosclerótica es la más común y aquella para la que las medidas preventivas están más ampliamente reconocidas, por lo que este documento se centrará en ella. El impacto del VIH sobre el riesgo de enfermedad cardiovascular varía en función del sexo, la edad y el estado inmunovirológico. A los factores de riesgo tradicionales, algunos más frecuentes que en población general, como el hábito tabáquico, se añaden factores relacionados como el VIH como la inflamación y la inmunoactivación. Estudios publicados recientemente, como REPRIEVE, han puesto de manifiesto la necesidad de evaluar con mayor precisión el riesgo cardiovascular e intensificar la prevención primaria en las PVIH.
El objetivo de este documento es aportar información práctica actualizada de forma que sirva como una herramienta de referencia para todos los profesionales sanitarios que tengan que tomar decisiones relacionadas con la prevención, el diagnóstico y el tratamiento de la patología metabólica y cardiovascular en PVIH. El documento va dirigido a todos aquellos profesionales que trabajan en la práctica clínica en el ámbito del VIH. Con el fin de evitar y/o minimizar los posibles conflictos de intereses, cada integrante del panel ha realizado una declaración formal de intereses que se encuentra al final del documento.
Metodología
Para la elaboración de este documento se constituyó un grupo de expertos compuesto por especialistas en medicina interna, endocrinología y nutrición, con experiencia en el ámbito del VIH, actuando dos miembros del panel como coordinadores. Cada miembro del panel aceptó participar de forma voluntaria y altruista. Los redactores de cada capítulo realizaron una revisión de la evidencia científica disponible y cada capítulo fue posteriormente evaluado por los revisores asignados. Una vez que todos los capítulos estuvieron redactados y revisados, los coordinadores compilaron el documento final y lo remitieron a todos los miembros del panel para su discusión final. Una vez que el documento fue consensuado por todo el panel, se envió a la Junta Directiva de GeSIDA para que pudiera someterlo a una revisión pública externa desde la web de GESIDA, como es habitual con otros documentos de GeSIDA.
Para la elaboración de los capítulos se tuvo en cuenta la versión previa del Documento de consenso de sobre alteraciones metabólicas y riesgo cardiovascular en PVIH (Actualización febrero 2017) 2. Además, se realizó una búsqueda bibliográfica en las siguientes bases de datos: Medline, Pubmed, UpToDate, Web of Science, Registro Cochrane y MD Consult de los artículos publicados con posterioridad a 2017.
Para la valoración de la calidad de la evidencia y la graduación de las recomendaciones se ha utilizado una modificación de los criterios de la Infectious Diseases Society of America (IDSA). 3 La siguiente tabla resume los criterios Tabla 1.
Tablas:

Bibliografía:
Zhu S, Wang W, He J, Duan W, Ma X et al Higher Cardiovascular Disease risks in people living with HIV: A systematic review and meta-analysis. J. Glob Health 2024 Apr 26; 14:04078. Doi:10.7189/jogh.14.04078
Documento de consenso sobre alteraciones metabólicas y riesgo cardiovascular en paciente con infección por el VIH. Actualización febrero 2017. Grupo de expertos del Grupo de Estudio sobre Alteraciones Metabólicas (GEAM), de la Secretaría del Plan Nacional sobre el SIDA. En: https://jogh.org/2024/jogh-14-04078
https://www.wikidoc.org/index.php/IDSA_guidelines_classification_scheme
2. ESTILO DE VIDA SALUDABLE
2.1. Introducción
2.2. Dieta
2.3. Ejercicio
2.4. Tabaco, alcohol y consumo de otras sustancias
2.5. Sueño
Introducción
Un estilo de vida saludable comporta beneficios demostrados en la salud metabólica y cardiovascular, así como en la salud global. Abarca diferentes aspectos como una dieta saludable, un ejercicio físico regular, una buena calidad del sueño y una ausencia de consumo de tabaco y otros tóxicos.
Dieta
En PVIH, hay pocos estudios que incluyan recomendaciones dietéticas con el objetivo de mejorar el riesgo cardiovascular. Guías recientes en población general recomiendan el patrón de dieta mediterránea 12. El estudio PREDIMED demostró que el patrón de dieta mediterránea, suplementada con aceite de oliva virgen extra o con frutos secos, se asoció a una reducción de la morbimortalidad cardiovascular en población general 3. Esta y otras dietas similares recomiendan un patrón alimentario basado en alimentos de origen vegetal ricos en fibra, que incluya cereales integrales, frutas, verduras, legumbres y frutos secos. Otras recomendaciones van dirigidas a: sustituir la grasa saturada por grasa insaturada, reducir el consumo de sal, consumir pescado preferentemente azul y restringir el consumo de carne procesada (embutidos, salchichas), alimentos precocinados y azucares libres, especialmente bebidas azucaradas. En la Tabla 1 se describe la frecuencia en la forma y en la cantidad de consumo recomendado de estos alimentos basados en el patrón de dieta mediterránea. En relación con el alcohol, se recomienda limitar el consumo a menos de 100 gr a la semana de bebidas fermentadas (vino y cerveza) 12
Recomendaciones:
- Se recomienda una dieta basada en el patrón de dieta mediterránea (AI)
Ejercicio
El ejercicio físico regular ofrece múltiples beneficios para la salud cardiovascular en la población general, y esto también se aplica a las PVIH45.
Los ensayos clínicos en PVIH, aunque incluían un número limitado de participantes, han objetivado beneficios del ejercicio, tanto aeróbico como de resistencia6. El ejercicio aeróbico de alta intensidad mejora el consumo máximo de oxígeno (VO2max), la capacidad cardiorrespiratoria y la eficiencia en el uso de oxígeno. Además, se asocia con reducción de la fatiga, el peso corporal y la circunferencia de la cintura. El ejercicio moderado también aumenta el VO2max y mejora la composición corporal, especialmente en mayores de 50 años. El entrenamiento de resistencia aumenta la masa muscular y la fuerza, mejora la densidad mineral ósea y previene caídas y fragilidad en mayores. Reduce citocinas proinflamatorias como IL-1ß, IL-6, IL-8 y TNFα, mejorando el perfil inflamatorio. Disminuye el colesterol total, los triglicéridos y el colesterol LDL, y aumenta el colesterol HDL. En personas con síndrome metabólico, reduce la glucosa en ayunas, la hemoglobina A1C, la circunferencia de la cintura y el porcentaje de grasa corporal, aumentando el colesterol HDL. La combinación de ejercicio aeróbico y de resistencia mejora significativamente la capacidad cardiorrespiratoria, la masa magra y disminuye el porcentaje de grasa corporal6.
En conclusión, el ejercicio aeróbico, de resistencia y combinado tiene efectos positivos significativos en la salud cardiovascular y general de las PVIH, reduciendo el riesgo de enfermedades cardiovasculares y mejorando la calidad de vida. La integración de estos ejercicios debería ser implementada en la práctica clínica.
No existen estudios específicos en PVIH que determinen cuál es la actividad física y la duración ideal. Las recomendaciones de esta guía se basan en las de la OMS indicadas en la población general 4.
Recomendaciones:
- Se recomienda sustituir el tiempo sedentario por actividad física de cualquier intensidad para obtener beneficios adicionales para la salud (BI)
- Se recomienda realizar de 150 a 300 minutos de actividad física aeróbica moderada o 75 a 150 minutos de actividad vigorosa por semana Tabla 2. Además, ejercitar todos los grupos musculares principales al menos dos veces por semana (AI)
Tabaco, alcohol y consumo de otras sustancias
El tabaquismo es el principal factor de riesgo modificable implicado en el aumento de riesgo de enfermedad cardiovascular, neoplasias, problemas de salud mental y otras comorbilidades en PVIH. La prevalencia de tabaquismo en PVIH es el doble que en la población general, proporcionalmente mayor en mujeres, con una prevalencia media de 36,1% a nivel mundial, siendo aun mayor (45,2%) en países de alta renta7. Los efectos perjudiciales del tabaco en el organismo se intensifican en el contexto del VIH. En PVIH con tratamiento antirretroviral efectivo, el tabaquismo causa más años de vida perdidos que el propio VIH. Las PVIH que dejan de fumar tienen una mejoría general de su salud y ganan unos 5 años de esperanza de vida 8.
Es prioritario destinar recursos al abandono del tabaquismo en la atención a PVIH. El dejar de fumar es una de las estrategias más eficaces para la prevención de diferentes enfermedades, incluyendo las cardiovasculares. Puede resultar conveniente utilizar diversas estrategias farmacológicas como el uso de terapia sustitutiva de nicotina, bupropion o vareniciclina, así como terapias conductuales. Sin embargo, la combinación de medidas farmacológicas con intervenciones conductuales se ha mostrado más eficaz que cualquiera de las medidas por separado. Como medida inicial se puede utilizar la estrategia Preguntar-Aconsejar-Conectar en las consultas rutinarias Figura 1. Otros recursos electrónicos como aplicaciones para móviles y programas de seguimiento telefónico también han demostrado su utilidad. Las tasas de abandono del tabaquismo y las de recaída en PVIH son similares a las de la población general8.
Se ha observado una mayor prevalencia de consumo de alcohol y de otras drogas en PVIH en comparación con la población general. El consumo de cocaína y metanfetaminas se ha asociado con toxicidad cardiovascular y aumento de eventos coronarios y cerebrovasculares.
Se recomienda restringir el consumo de alcohol a un máximo de 100g a la semana, aunque la mayoría de las autoridades sanitarias coinciden en que cuanto menos mejor, y han reducido los límites recomendados en los últimos años. Superar 100g de alcohol a la semana reduce la esperanza de vida y aumenta el riesgo de enfermedades cardiovasculares. Existen estudios que cuestionan los beneficios del consumo moderado, mostrando además que cualquier cantidad de alcohol aumenta la presión arterial e índice de masa corporal2.
Recomendaciones:
- Se recomienda no fumar por los efectos negativos sobre la salud del consumo de tabaco (AI)
- Se recomienda promover de forma activa el abandono del hábito tabáquico (AI), preferentemente ofreciendo un abordaje combinado con medidas farmacológicas y terapias conductuales (AI)
- Se recomienda restringir el consumo de alcohol a menos de 100g por semana (BI)
Sueño
Las alteraciones del sueño se han asociado a otros factores de riesgo y a una mayor prevalencia de enfermedad cardiovascular. El insomnio, a veces asociado a otras alteraciones como la apnea obstructiva del sueño o el síndrome de las piernas inquietas, pueden tener un impacto en la vida cotidiana. En PVIH se ha descrito una prevalencia de hasta un 58% y frecuentemente son infradiagnosticadas e infra tratadas(9–11).
Existen diferentes escalas validadas para evaluar la calidad del sueño como son el índice de calidad de sueño de Pittsburg o el índice de severidad del insomnio. Es necesario una historia clínica completa para descartar enfermedades, fármacos o tóxicos relacionados.
Se considera que se necesitan al menos 7 horas de sueño por la noche para mantener una salud y funcionalidad óptimas9.
Es necesario promover unas normas higiénicas de sueño (horario, habitación adecuada, y evitar estímulos y estimulantes entre otros). El siguiente escalón incluye la terapia cognitiva conductual (TCC) que puede ser administrada por un profesional sanitario directamente o con ayuda de aplicaciones validadas9. La TCC ha mejorado el insomnio en PVIH, aunque la calidad de los estudios es limitada10.
El tratamiento farmacológico se recomienda cuando la respuesta a la TCC es insuficiente y por periodos cortos de tiempo (menos de 4 semanas). Tratamientos más prolongados se pueden considerar valorando ventajas y desventajas. Los fármacos de elección son las benzodiazepinas y los agonistas de los receptores de las benzodiazepinas. Otras opciones terapéuticas son: bajas dosis de antidepresivos sedativos (mirtazapina, trazodona), antagonistas del receptor de orexina (daridorexant) o agonistas de los receptores de melatonina (ramelteon)9. Se deben tener en cuenta las posibles interacciones farmacológicas con el tratamiento antirretroviral que incluya potenciadores. Algunos fármacos antirretrovirales pueden asociarse a trastornos del sueño, en especial efavirenz y, en menor medida, otros inhibidores de la transcriptasa inversa no nucleósidos y los inhibidores de la integrasa. Cambiar la administración de dolutegravir de la noche a la mañana puede ayudar a mejorar los problemas de sueño en algunos pacientes12; este efecto no se ha visto claramente con otros inhibidores de la integrasa. Se puede plantear el cambio de TAR cuando se han descartado otras causas de insomnio y es persistente. Recientemente se ha publicado un consenso de cribado y tratamiento de trastornos del sueño en PVIH11.
Recomendaciones:
- Se recomienda evaluar duración, calidad del sueño y riesgo de apnea del sueño anualmente (AIII).
- El tratamiento de primera elección del insomnio es la terapia cognitiva conductual. Si no hay respuesta se recomienda tratamiento farmacológico por periodos cortos de tiempo (<4 semanas) (AI).
Gráficos:

Tablas:
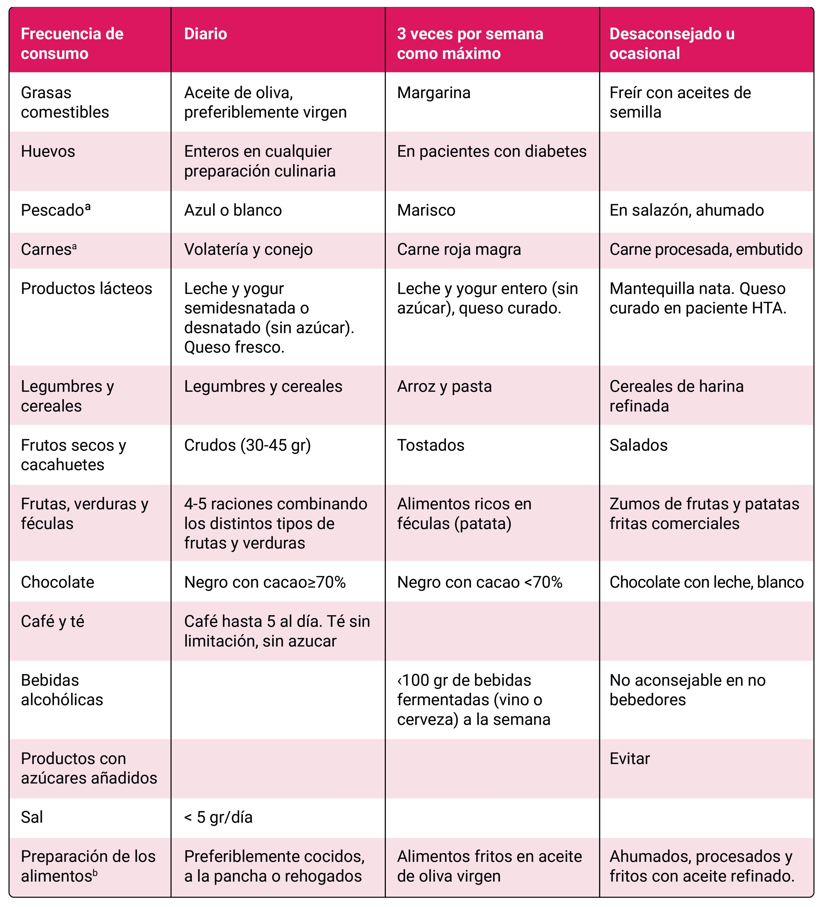
Patrón de dieta mediterránea (extraído de referencia 1). aPescado 2-3 veces a la semana. Consumir pescado o carne una vez al día. b El consumo de platos aderezados con salsa de tomate, ajo, cebolla o puerro elaborada a fuego lento con aceite de oliva virgen (sofrito) puede realizarse a diario.
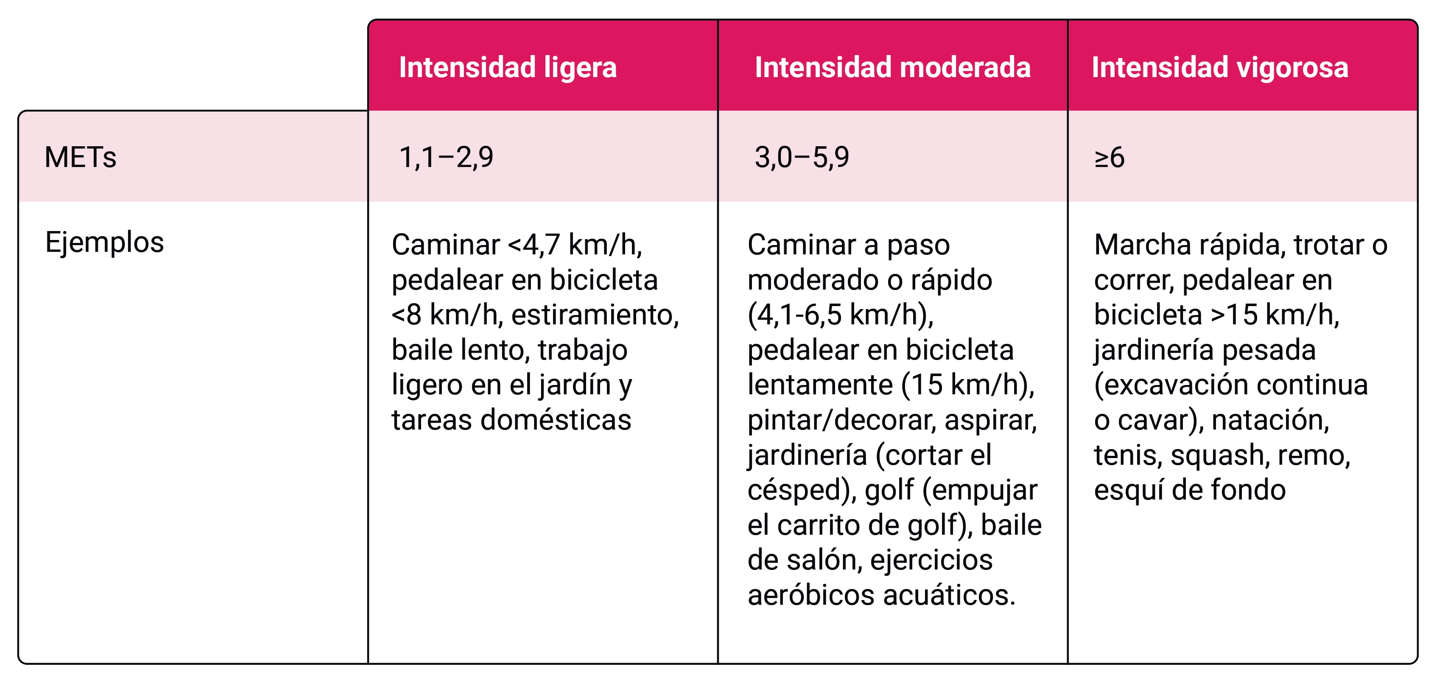
Los equivalentes metabólicos (MET) son las unidades que mide el gasto energético de una actividad física. Se estiman como el gasto energético de una actividad determinada dividido por el gasto energético en reposo. 1 MET equivale al consumo de 3,5 mL de oxígeno por kilogramo de peso corporal por minuto en reposo.
Bibliografía:
Mostaza JM, Pintó X, Armario P, Masana L, Real JT, Valdivielso P, et al. Estándares de la Sociedad Española de Arteriosclerosis 2024 para el control global del riesgo vascular. Clin Investig Arterioscler 2024; 36: 133-194.
Visseren FLJ, Mach F, Smulders YM, Carballo D, Koskinas KC, Bäck M, et al. 2 2021 ESC Guidelines on cardiovascular disease prevention in clinical practice: Developed by the Task Force for cardiovascular disease prevention in clinical practice with representatives of the European Society of Cardiology and 12 medical societies With the special contribution of the European Association of Preventive Cardiology (EAPC). Rev Esp Cardiol (Engl Ed) 2022; 75: 429.
Estruch R, Ros E, Salas-Salvadó J, Covas MI, Corella D, Arós F, et al. Primary Prevention of Cardiovascular Disease with a Mediterranean Diet Supplemented with Extra-Virgin Olive Oil or Nuts. N Engl J Med 2018; 378: e34.
Bull FC, Al-Ansari SS, Biddle S, Borodulin K, Buman MP, Cardon G, et al. World Health Organization 2020 guidelines on physical activity and sedentary behaviour. Br J Sports Med 2020; 54: 1451-1462.
Jakicic JM, Kraus WE, Powell KE, Campbell WW, Janz KF, Troiano RP, et al. Association between Bout Duration of Physical Activity and Health: Systematic Review. Med Sci Sports Exerc 2019; 51: 1213-1219.
Ozemek C, Erlandson KM, Jankowski CM. P Physical activity and exercise to improve cardiovascular health for adults living with HIV. Prog Cardiovasc Dis 2020; 63: 178-183.
Ale BM, Amahowe F, Nganda MM, Danwang C, Wakaba NN, Almuwallad A, et al. Global burden of active smoking among people living with HIV on antiretroviral therapy: a systematic review and meta-analysis. Infect Dis Poverty 2021; 10: 12.
Reddy KP, Kruse GR, Lee S, Shuter J, Rigotti NA. Tobacco Use and Treatment of Tobacco Dependence Among People With Human Immunodeficiency Virus: A Practical Guide for Clinicians. Clin Infect Dis 2022; 75: 525-533.
Riemann D, Espie CA, Altena E, Arnardottir ES, Baglioni C, Bassetti CLA, et al. The European Insomnia Guideline: An update on the diagnosis and treatment of insomnia 2023. J Sleep Res 2023; 32: e14035.
Meng J, Zheng C, Wang H, Välimäki M, Wang M. Non-pharmacological interventions for improving sleep in people living with HIV: a systematic narrative review. Front Neurol 2023; 14: 1017896.
Allavena C, Bastides F, Moroy A, Occhipinti S, Durand F, Barriere G, et al. The screening and management of sleep disturbances in people living with HIV: Delphi consensus. J Sleep Res 2024; 33: e14070.
Capetti AF, Di Giambenedetto S, Latini A, Sterrantino G, De Benedetto I, Cossu MV, et al. Morning dosing for dolutegravir-related insomnia and sleep disorders. HIV Med 2018; 19: e62-e63.
3. GANANCIA EXCESIVA DE PESO. OBESIDAD
3.1. Introducción
3.2. Definiciones
3.3. Enfermedades asociadas
3.4. Causas de obesidad
3.5. Evaluación y diagnostico
3.6. Manejo / tratamiento
3.7. Recomendaciones
Introducción
La prevalencia de sobrepeso y obesidad ha aumentado de forma alarmante en la población general, sobre todo en países desarrollados. Los factores implicados son diversos, destacando el cambio hacia hábitos de vida más sedentarios y la preferencia por dietas ricas en azúcares y grasas saturadas. En el caso de las personas con PVIH, la problemática no es ajena, y se ven afectadas por otros factores adicionales. Desde los primeros años de la epidemia por VIH, tanto la infección por VIH como el tratamiento antirretroviral han contribuido a cambios en la composición corporal. Las primeras terapias utilizadas estaban implicadas en el desarrollo de la lipodistrofia, caracterizada por lipoatrofia subcutánea y acúmulo de grasa visceral en el tronco, que se asociaba a resistencia a la insulina y aumentaba el riesgo de diabetes mellitus y de enfermedad cardiovascular. Las terapias actuales, particularmente los inhibidores de integrasa y el análogo de nucleótido tenofovir alafenamida, se han asociado a un aumento de peso. Un peso superior al normal puede tener un impacto negativo para la salud.
Definiciones
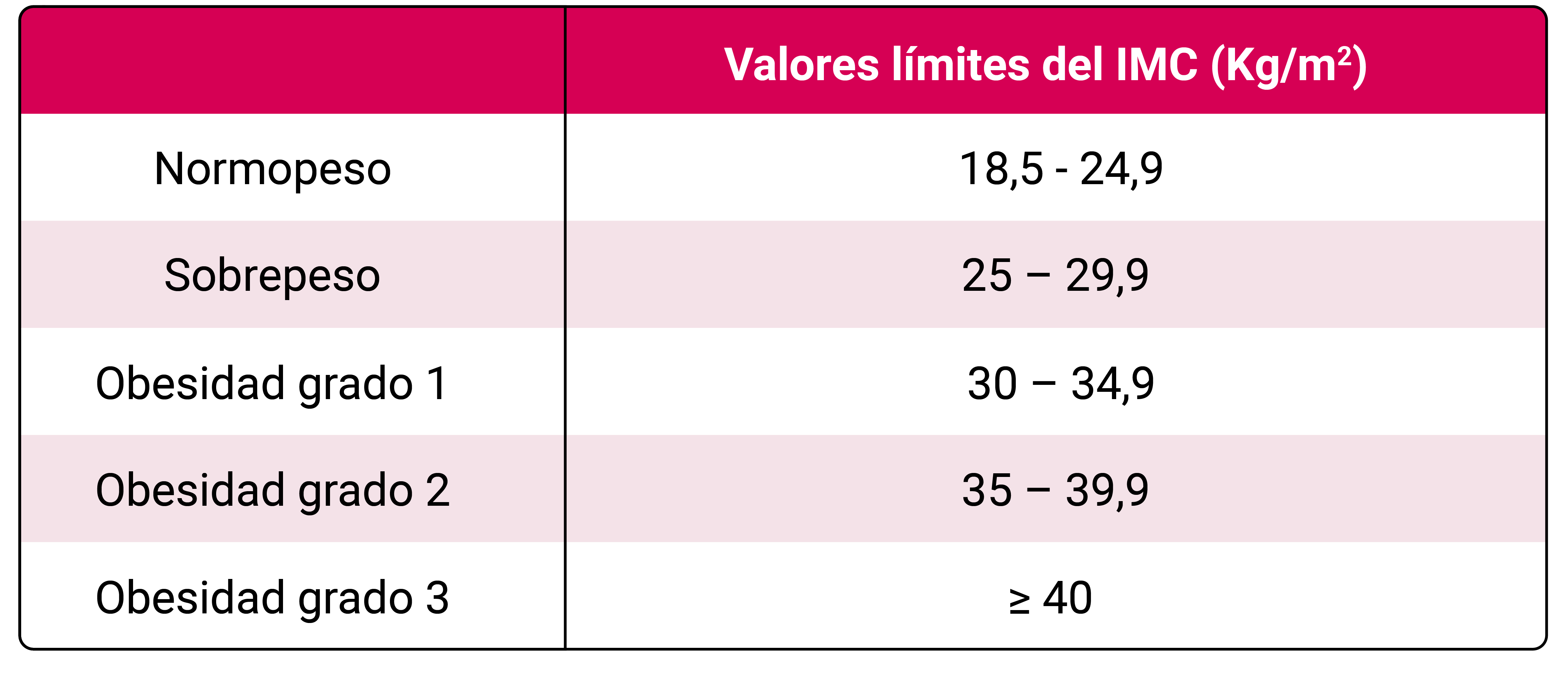
La obesidad es una enfermedad crónica derivada de una disfunción del tejido adiposo por un depósito excesivo y/o una distribución anormal. Su etiología es multifactorial, en la que intervienen tanto determinantes intrínsecos del individuo (causas genéticas y fisiológicas) como extrínsecos (factores contribuyentes ambientales, psicológicos, sociales, y económicos entre otros). La disfunción del tejido adiposo provoca un estado inflamatorio crónico característico de la obesidad, particularmente mayor con la acumulación de tejido adiposo visceral que con la del tejido adiposo subcutáneo. Este estado prolongado de inflamación, de manera sistémica o más local, actúa como un mecanismo patogénico común y retroalimentativo en las complicaciones asociadas con la obesidad 1. La clasificación del sobrepeso y obesidad se muestra en la Tabla 1.
Enfermedades asociadas
El sobrepeso y la obesidad aumentan el riesgo de desarrollar enfermedades que afectan prácticamente todos los sistemas. Entre ellas destacan la diabetes tipo 2, hipertensión arterial, enfermedades cardiovasculares, dislipemia, ciertos tipos de cáncer, apnea obstructiva del sueño, colecistitis, disfunción eréctil, esteatohepatitis no alcohólica y artrosis. Además, tienen un gran impacto en aspectos psicológicos, como la disminución de la autoestima, la distorsión de la imagen corporal y la depresión 2.
Causas de obesidad
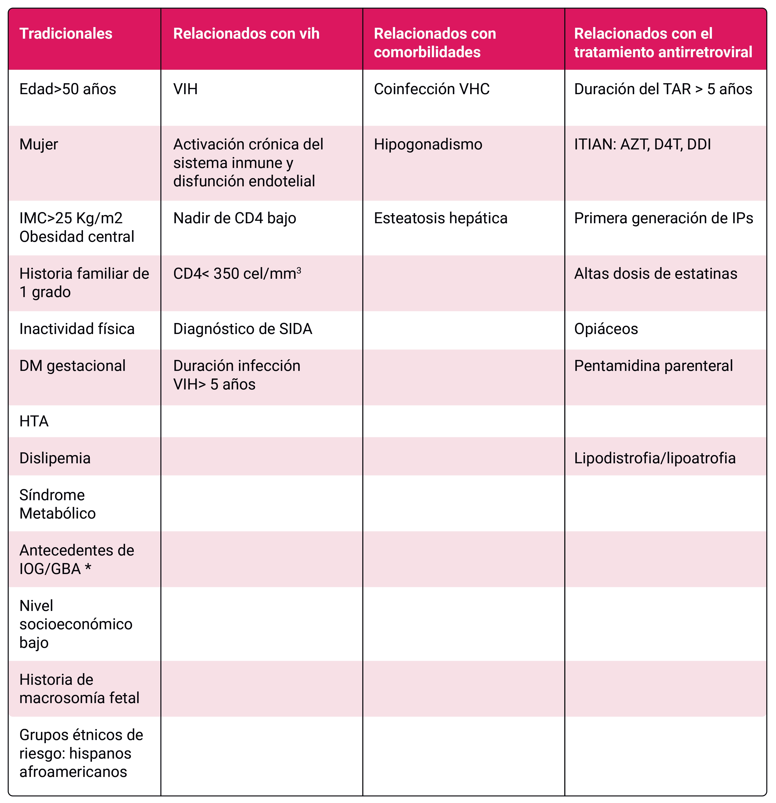
La forma más frecuente de obesidad es aquella resultante de la combinación de una predisposición poligénica y factores ambientales (ambiente obesogénico) que favorecen la ingesta excesiva de calorías en forma alimentos de baja calidad nutricional (por ejemplo, grasas saturadas y azúcares procesados) o el consumo excesivo de alcohol, el sedentarismo, o las alteraciones del sueño. Además, la ganancia de peso y el cambio en la composición corporal (aumento de grasa y disminución de masa muscular) son fenómenos asociados con el envejecimiento. Se estima que el peso corporal de un adulto europeo aumenta entre 0.3 y 0.5 kg por año, lo que convierte a la edad en un factor contribuyente inmodificable. Algunas enfermedades endocrinas como el hipotiroidismo, hipogonadismo y síndrome de Cushing, diversos medicamentos, como algunos fármacos psicotrópicos, esteroides o antidiabéticos orales pueden causar ganancia de peso. En este sentido, ciertos antirretrovirales, tales como los inhibidores de integrasa y el tenofovir alafenamida se han asociado con ganancia de peso excesiva en algunos estudios observacionales, junto a otros factores propios del huésped: raza negra, sexo femenino, y no usuarios de drogas intravenosas; y factores propios de la infección por VIH: recuento de linfocitos CD4 <200/mm3 y RNA de VIH basal >100.000 copias/mL 3.
3.4.1. Impacto del tratamiento antirretroviral
La ganancia de peso en PVIH se observa generalmente en el primer año después del inicio del tratamiento antirretroviral, fenómeno que se considera al menos en parte como un "retorno a la situación basal". No obstante, algunos regímenes se han asociado con una mayor ganancia de peso, especialmente aquellos que contienen inhibidores de integrasa y/o tenofovir alafenamida, en comparación con los regímenes que incluyen disoproxil fumarato y/o efavirenz. La ganancia de peso asociada con estos regímenes es más frecuente en los primeros 1-2 años tras el inicio del tratamiento antirretroviral en personas con PVIH previamente no tratadas y, en menor medida, en personas con PVIH con supresión virológica que cambian determinadas pautas de tratamiento antirretroviral 345. La ganancia de peso no parece concentrarse en un compartimento corporal específico, sino que se distribuye de forma generalizada. 6.
Evaluación y diagnostico
El diagnóstico de obesidad se ha basado tradicionalmente en el Índice de Masa Corporal (IMC). La Tabla 1 presenta la clasificación de las categorías de peso corporal de la Organización Mundial de la Salud según el IMC. Este índice antropométrico de fácil obtención tiene una buena correlación con el porcentaje de grasa corporal. Sin embargo, el IMC tiene limitaciones. Entre ellas, el no informar sobre la distribución de la grasa corporal. Es por ello por lo que, con el fin de mejorar la precisión en la evaluación de la obesidad, los expertos en el tema han propuesto recientemente combinar el IMC con otras medidas que evalúen el exceso de grasa corporal como la circunferencia de cintura o el porcentaje de grasa total en la densitometría o la bioimpedancia. Un valor de circunferencia abdominal ≥102 cm en hombres, o ≥88 cm en mujeres de raza caucásica, indica obesidad abdominal. Un valor de grasa total >25% en hombres y >32% en mujeres de raza caucásica indica exceso de grasa corporal. La circunferencia de cintura (CC) tiene una buena correlación con la grasa visceral y por tanto se añade al IMC en la estimación del riesgo para la salud asociado a obesidad. Hay otras medidas antropométricas, como la relación cintura/altura, que son útiles en la valoración del exceso de grasa pero que no están tan ampliamente implementadas en la práctica clínica como la simple medición de la cintura. En poblaciones no caucásicas, los puntos de corte para el IMC y el exceso de grasa corporal pueden variar, por lo que se recomienda utilizar los valores específicos más apropiados para cada raza.
Las medidas antropométricas son fáciles de aplicar, pero no informa adecuadamente sobre la composición corporal. Más allá de que el IMC pueda sobreestimar la prevalencia de obesidad en personas con mayor masa muscular, en nuestro contexto es importante destacar el riesgo de subestimarla en casos de sarcopenia. El análisis de la composición corporal (compartimento graso y magro) puede realizarse por ejemplo mediante bioimpedancia eléctrica o de forma más precisa mediante densitometría dual de rayos X, aunque estas exploraciones pueden no ser accesibles para la práctica clínica rutinaria.
En personas con PVIH, recomendamos como práctica clínica sencilla, registrar al menos el peso, IMC, y CC, al iniciar o cambiar el tratamiento antirretroviral, y luego cada 6-12 meses
Manejo / tratamiento
Los criterios para la derivación a unidades especializadas en obesidad varían según los recursos de cada centro y la organización sanitaria de cada comunidad autónoma. No obstante, de forma general sugerimos considerar la evaluación por parte de un equipo especializado en los siguientes casos: IMC ≥ 40 Kg/m2, o ≥ 35 Kg/m2 con al menos una patología asociada a la obesidad que no esté adecuadamente controlada, o con sospecha de obesidad secundaria, o cuando la pérdida de peso sea necesaria para una cirugía de trasplante o de prótesis articular. También se debe considerar la derivación en personas con un IMC entre 30 y 35 Kg/m2 y con complicaciones clínicas asociadas a la obesidad.
3.6.1. Recomendaciones sobre estilo de vida
Se requieren cambios significativos en el estilo de vida como parte fundamental del tratamiento (Véase capítulo 2. Estilo de vida saludable). La modificación de la dieta y el aumento de la actividad física representan el primer paso en este proceso. Se recomienda iniciar con la reducción de la ingesta calórica y la implementación de ejercicio físico regular. Se ha observado que una pérdida de peso del 5% del peso corporal está asociada con mejoras en la resistencia a la insulina y la regulación de la presión arterial. Se sugiere abordar estas cuestiones durante la consulta médica, haciendo hincapié en cambios realistas hacia hábitos de vida saludables que sean factibles y se adapten a la rutina diaria del paciente. Además, se destaca la importancia del apoyo de un equipo multidisciplinario, que incluya asesoramiento psicológico y nutricional, para aumentar las probabilidades de éxito en el tratamiento.
3.6.2. Recomendaciones sobre el tratamiento antirretroviral
La selección del régimen antirretroviral, por sí sola, probablemente tenga un efecto muy pequeño sobre el riesgo de obesidad a largo plazo en la mayoría de las personas con PVIH. Los estudios de cambio a biterapias basadas en dolutegravir y lamivudina, sugieren que la discontinuación de tenofovir alafenamida no revierte la ganancia de peso. Aún no se ha establecido con certeza si la discontinuación de los inhibidores de integrasa podría revertir una ganancia de peso asociada con la exposición a dichos fármacos 7. A pesar de esta asociación, se recomienda seguir las recomendaciones actuales para la elección de la TAR tanto en los escenarios de inicio como de cambio de tratamiento, debido a sus claros beneficios. Con los conocimientos actuales no puede recomendarse iniciar un tratamiento antirretroviral determinado o cambiarlo en personas con un peso superior al normal o que tengan una ganancia excesiva de peso. No obstante, es importante proporcionar asesoramiento individualizado sobre el potencial riesgo de aumento de peso y complicaciones metabólicas y cardiovasculares a las personas con PVIH que inicien o modifiquen su tratamiento antirretroviral y fomentar un estilo de vida saludable.
3.6.3. Tratamiento farmacológico
En la actualidad, se disponen de varios fármacos eficaces y seguros para el tratamiento de la obesidad y sus complicaciones, entre los cuales se incluyen los agonistas de los receptores del péptido similar al glucagón-1 (GLP-1) como liraglutida o semaglutida 8; el inhibidor de la lipasa orlistat; y los fármacos psicotrópicos bupropion, naltrexona, o topiramato que disminuyen la sensación de apetito. Entre todos ellos, los fármacos más prometedores por su eficacia y tolerabilidad son los agonistas GLP-1. El uso de estos medicamentos requiere asesoramiento por parte de un especialista, y existe experiencia limitada con liraglutida y con semaglutida en PVIH 9. Los datos disponibles hasta la fecha sugieren que semaglutida sería útil para el control del peso y de la diabetes mellitus tipo 2 en esta población, si bien los estudios han sido de duración limitada.
3.6.4. Tratamiento quirúrgico
La cirugía bariátrica representa una opción terapéutica efectiva a corto y largo plazo. Su indicación requiere evaluación por parte de un equipo multidisciplinario. La información disponible sobre el uso de cirugía bariátrica en personas con PVIH con obesidad es favorable, aunque limitada 1011. Las modificaciones anatómicas del tracto digestivo propias de la cirugía bariátrica pueden alterar la absorción de los fármacos antirretrovirales 12. En este caso, sería recomendable la prescripción de tratamiento antirretroviral parenteral.
Recomendaciones
- No modificar las recomendaciones actuales para la elección del tratamiento antirretroviral por motivos relacionados con el peso, tanto en los escenarios de inicio como de cambio (AI).
- Evaluar peso e índice de masa corporal al inicio y en el momento de cambio del tratamiento antirretroviral, y rutinariamente cada 6-12 meses (AII).
- Incorporar la medición de la circunferencia de cadera (BII).
- Derivar a un equipo especializado en los siguientes casos: IMC ≥40 Kg/m2, o ≥35 Kg/m2 con al menos una patología asociada a la obesidad que no esté adecuadamente controlada, o con sospecha de obesidad secundaria, o cuando la pérdida de peso sea necesaria para una cirugía de trasplante o de prótesis articular (AII).
- Brindar asesoramiento sobre el riesgo potencial de aumento de peso y complicaciones cardio-metabólicas a las personas con PVIH al momento de iniciar o cambiar el tratamiento antirretroviral (AII).
Tablas:
Bibliografía:
Guía Española GIRO. 2024. En: https://www.seedo.es/images/site/giro/GUIA-GIRO-2a-edicin_26NOV2024.pdf
WHO European Regional Obesity Report 2022. En: https://iris.who.int/bitstream/handle/10665/353747/9789289057738-eng.pdf?sequence=1
Sax PE, Erlandson KM, Lake JE, McComsey GA, Orkin C, Esser S, et al. Weight Gain Following Initiation of Antiretroviral Therapy: Risk Factors in Randomized Comparative Clinical Trials. Clin Infect Dis 2020; 71: 1379-1389.
Ogbuagu O, Ruane PJ, Podzamczer D, Salazar LC, Henry K, Asmuth DM, et al. Long-term safety and efficacy of emtricitabine and tenofovir alafenamide vs emtricitabine and tenofovir disoproxil fumarate for HIV-1 pre-exposure prophylaxis: week 96 results from a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet HIV 2021; 8: e397-e407.
Surial B, Mugglin C, Calmy A, Cavassini M, Günthard HF, Stöckle M, et al. Weight and Metabolic Changes After Switching From Tenofovir Disoproxil Fumarate to Tenofovir Alafenamide in People Living With HIV: A Cohort Study. Ann Intern Med 2021; 174: 758-767.
de Lazzari E, Di Gregorio S, Rojas J, Curran A, Domingo P, Negredo E, et al. 48 Week body composition changes in persons with HIV switching to dolutegravir plus lamivudine: a planned subanalysis of the DOLAM randomized clinical trial. J Antimicrob Chemother 2025 Jun 25:dkaf192. doi: 10.1093/jac/dkaf192. Epub ahead of print.
Van Wyk J, Ajana F, Bisshop F, De Wit S, Osiyemi O, Portilla Sogorb J, et al. Efficacy and Safety of Switching to Dolutegravir/Lamivudine Fixed-Dose 2-Drug Regimen vs Continuing a Tenofovir Alafenamide-Based 3- or 4-Drug Regimen for Maintenance of Virologic Suppression in Adults Living With Human Immunodeficiency Virus Type 1: Phase 3, Randomized, Noninferiority TANGO Study. Clin Infect Dis 2020; 71: 1920-1929.
Rubino DM, Greenway FL, Khalid U, O'Neil PM, Rosenstock J, Sørrig R, Wadden TA, et al. Effect of Weekly Subcutaneous Semaglutide vs Daily Liraglutide on Body Weight in Adults With Overweight or Obesity Without Diabetes: The STEP 8 Randomized Clinical Trial. JAMA 2022; 327: 138-150.
Funderburg NT, Ross Eckard A, Wu Q, Sattar A, Ailstock K, Cummings M, et al. The Effects of Semaglutide on Inflammation and Immune Activation in HIV-associated Lipohypertrophy. Open Forum Infect Dis 2025; 12: ofaf152.
Akbari K, Som R, Sampson M, Abbas SH, Ramus J, Jones G. The Effect of Bariatric Surgery on Patients with HIV Infection: a Literature Review. Obes Surg 2018; 28: 2550-2559.
Zino L, Wit F, Rokx C, Den Hollander JG, Van Der Valk M, Richel O, et al. Outcomes of Bariatric Surgery in People With Human Immunodeficiency Virus: A Retrospective Analysis From the ATHENA Cohort. Clin Infect Dis 2023; 77: 1561-1568.
Zino L, Kingma JS, Marzolini C, Richel O, Burger DM, Colbers A. Implications of Bariatric Surgery on the Pharmacokinetics of Antiretrovirals in People Living with HIV. Clin Pharmacokinet 2022; 61: 619-635.
4. DIABETES
4.1. Epidemiología y factores de riesgo
4.2. Diagnóstico
4.3. Cribado
4.4. Tratamiento
4.5. Recomendaciones
La supervivencia de las personas con PVIH cada vez es mayor, por lo que también aumenta el riesgo para desarrollar distintas enfermedades crónicas asociadas al envejecimiento, entre las que se incluye la diabetes mellitus tipo 2 (DM2).
Epidemiología y factores de riesgo
La incidencia de DM2 es hasta 4 veces más frecuente en las PVIH 1 con una prevalencia estimada entre el 2% y el 14% 2. La incidencia de diabetes en personas con PVIH es, en general, mayor en los países mediterráneos que en los del norte de Europa, debido a una combinación de factores sociodemográficos, clínicos y de estilo de vida. También era mayor en las PVIH que iniciaron el tratamiento antirretroviral con anterioridad a 2010 que posteriormente, en parte por una mayor exposición a fármacos con más toxicidad metabólica y de lipodistrofia 3
En España, se ha reportado una incidencia de DM2 de 5,9 (95% CI, 5.1–6.7) casos por cada 1000 PVIH/año. La incidencia aumenta de manera significativa hasta el 14,4 (95% CI, 10.4–19.3) en mayores de 50 años 4.
En la etiopatogenia de la DM2 de las PVIH se incluyen factores tradicionales, de forma similar a la población general. Por otro lado, las PVIH se encuentran además expuestas a otros factores propios de la infección VIH, de las comorbilidades asociadas y del tratamiento antirretroviral Tabla 1 5 6. Algunos factores como el sexo, el recuento de CD4 o la viremia no se han asociado con la aparición de DM2 7.
Los antirretrovirales utilizados en la actualidad no parecen tener un impacto al menos importante sobre el riesgo de DM2. Aparentemente, los inhibidores de proteasa más recientes y algunos inhibidores de la transcriptasa inversa análogos de nucleósidos (emtricitabina, abacavir, tenofovir disoproxil fumarato) y rilpivirina parecen asociarse con un menor riesgo de DM2. En cuanto a los inhibidores de integrasa y el tenofovir alafenamida, no se ha podido demostrar claramente su asociación con el aumento de incidencia de DM2. Una limitación de los estudios es el escaso tiempo de seguimiento y la edad de inclusión de los pacientes, relativamente jóvenes, ya el pico esperado de DM2 aparece generalmente entre los 55 y 60 años. Las estatinas se asocian con un discreto mayor riesgo de DM2 en la población general y en PVIH, incluso con periodos cortos de exposición (< 6 meses), aunque el impacto es mayor en aquellas que personas que ya tienen un mayor riesgo de DM2 7.
Diagnóstico
Los criterios diagnósticos de prediabetes y DM2 en personas con PVIH son similares a los de la población general y viene reflejados en las Tabla 2 y Tabla 3
Cribado
El mayor riesgo de DM2 en las PVIH justifica la necesidad de un cribado rutinario tanto para prevenir la enfermedad y para diagnosticar y comenzar el tratamiento antidiabético lo antes posible 12.
No existe un método de cribado de DM aceptado a nivel internacional. Probablemente tanto la glucemia aleatoria o en ayunas como la HbA1c sean las pruebas recomendadas al diagnóstico de la infección. Si la glucemia aleatoria fuera >200 mg/dL, se tendría que solicitar la determinación de glucemia en ayunas y de HbA1c.
No se debe de olvidar que, la realización del cribado de DM2 es especialmente importante en PCV de mayor riesgo de DM2 por sus antecedentes personales o familiares, por la presencia de factores de riesgo tradicionales y por el uso de fármacos con mayor potencial diabetógeno 13. Se recomienda determinar la glucemia en ayunas o la HbA1c antes de empezar el tratamiento antirretroviral y posteriormente al menos una vez cada año.
Tratamiento
El tratamiento de la diabetes mellitus tipo 1 debería ser iniciado y supervisado por un especialista de Endocrinología. El tratamiento de la diabetes mellitus tipo 2 puede ser llevado a cabo por el médico de VIH, el médico de Atención Primaria, o ambos. Debe considerarse la atención por un especialista en Endocrinología, cuando el tratamiento con 2 o 3 antidiabéticos orales no permite alcanzar los objetivos, o cuando se requiere insulinoterapia.
4.4.1. Medidas no farmacológicas
La modificación del estilo de vida es la base del manejo efectivo de la DM2 y complementa al tratamiento farmacológico para mejorar los resultados de salud (Véase capítulo 2. Estilo de vida saludable). Esto incluye las recomendaciones no farmacológicas de una dieta saludable, actividad física regular, y evitar el tabaco y el alcohol 14.
Un aspecto importante es el control del peso. Conseguir un peso normal (IMC 18-25 kg/m2) es el objetivo ideal. El control del peso es un objetivo de tratamiento añadido al control de la glucemia. La reducción de peso en pacientes con obesidad posee múltiples beneficios más allá del control glucémico, como la reducción de la esteatosis hepática y la mejora de los factores de riesgo cardiovascular.
4.4.2. Objetivos de tratamiento de la DM2
La HbA1c es una medida indirecta de la glucemia promedio de los 2-3 meses previos, y es la herramienta principal para evaluar el estado glucémico. Sus valores están fuertemente relacionados con las complicaciones de la diabetes. Esta prueba debe realizarse de manera rutinaria en todas las personas con diabetes en la evaluación inicial y como parte del seguimiento. En personas ya diagnosticadas de DM2, se recomienda realizar la glicemia y la prueba de HbA1c una vez cada 3-6 meses si no hay buen control glucémico o hay un cambio reciente del tratamiento antidiabético, y cada 12 meses si hay un buen control y no ha habido cambios en el tratamiento. La determinación de albúmina en orina y el examen de fondo de ojo se recomiendan cada 12 meses.
-
- Objetivos de HbA1c. Un objetivo de HbA1c de <7 % (<53 mmol/mol) es adecuado para la mayoría de las PVIH, y debe establecerse en cada consulta para mejorar los resultados. Niveles de HbA1c inferiores pueden ser incluso beneficiosos, siempre que se puedan lograr de manera segura sin hipoglucemia frecuente o grave u otros efectos adversos del tratamiento. En personas con una expectativa de vida limitada o cuando se considere que los daños del tratamiento son mayores que los beneficios, se pueden considerar objetivos glucémicos menos estrictos, como una HbA1c de 7-8 %. En estos casos puede ser razonable evitar el uso de fármacos que pueden comportar riesgo de hipoglucemia (insulina, sulfonilureas o meglitinidas).
- Glucometría. En el caso de utilizar monitorización continua de glucosa, se recomienda un objetivo de tiempo en rango entre 70-180 mg/dL, >70%, con menos de un 4% por debajo del rango (<70 mg/dL) 15.
4.4.3. Tratamiento farmacológico
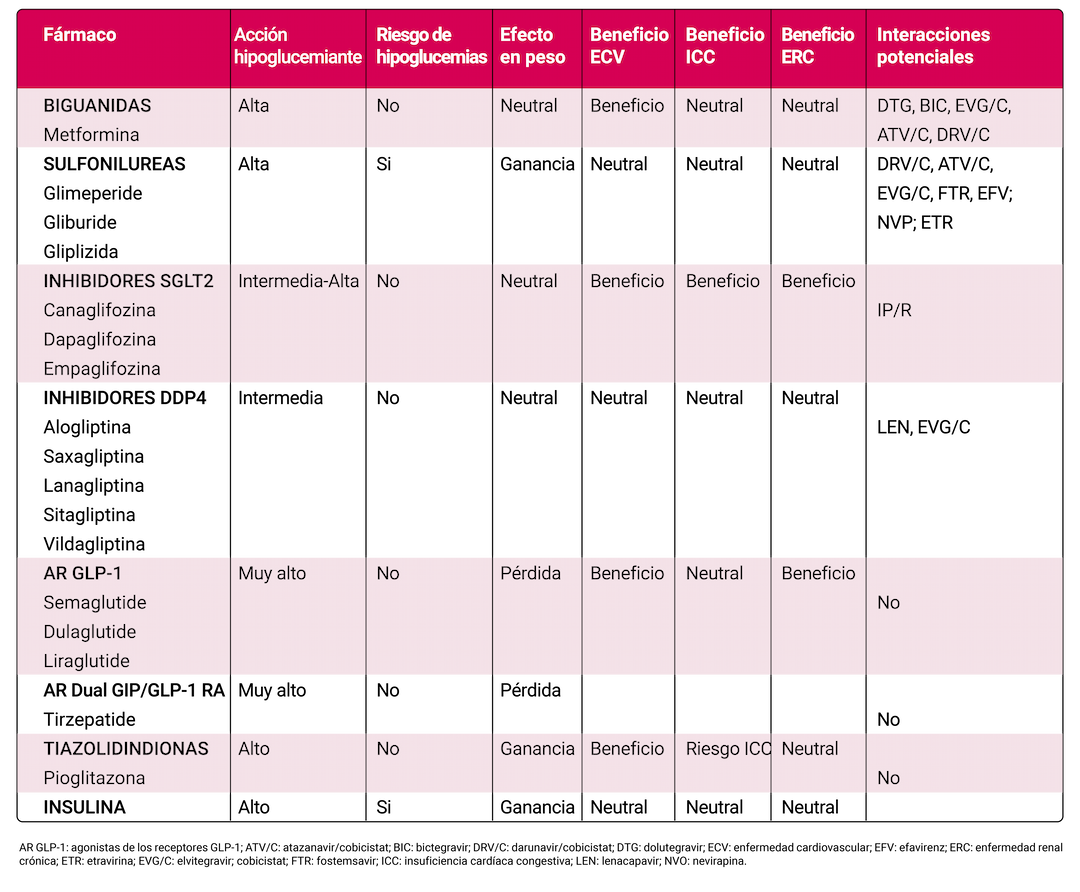
El tratamiento farmacológico debe guiarse por los factores individuales, que incluyen las interacciones potenciales con el tratamiento antirretroviral, las comorbilidades y los posibles efectos adversos; en especial, deben considerarse los objetivos del tratamiento y las preferencias del paciente. El plan de tratamiento debe tener la eficacia adecuada para alcanzar y mantener los objetivos de tratamiento individualizados con respecto a la reducción de la glucosa, la reducción del riesgo de enfermedad cardiovascular y renal, y el control del peso. Un aspecto relevante del tratamiento farmacológico es el evitar la inercia terapéutica, es decir el no realizar modificaciones del tratamiento médico cuando el paciente no está alcanzando los objetivos terapéuticos glucémicos recomendados; además, deben tenerse en cuenta siempre los determinantes sociales que pueden afectar a cada paciente. Las principales características de los fármacos para el tratamiento de la DM se exponen en la Tabla 1. En PVIH debe considerarse especialmente el mayor riesgo de enfermedad cardiovascular y/o enfermedad renal crónica, y en el plan de tratamiento deben incluirse fármacos que reduzcan este riesgo y siempre considerar la prevención primaria cardiovascular con estatinas.
El esquema recomendado de tratamiento se expone en la Figura 1. Si el paciente no presenta ninguna comorbilidad asociada, se debe dirigir el tratamiento en función de que el problema clínico más relevante sea el control o el mantenimiento de la glucemia, o si la prioridad es conseguir el control del peso.
Las comorbilidades que pueden modificar la elección del tratamiento farmacológico son los siguientes:
-
- En adultos con DM2 un riesgo alto de enfermedad cardiovascular ya establecido, el plan de tratamiento debe incluir medicamentos con beneficios demostrados para reducir eventos cardiovasculares (agonistas del receptor del péptido similar al glucagón 1 [AR GLP1] y/o inhibidores del cotransportador de sodio-glucosa 2 [SGLT2]) para el control glucémico y la reducción integral del riesgo cardiovascular, independientemente de la A1C.
- En pacientes con DM2 que tienen insuficiencia cardíaca (ICC, con fracción de eyección reducida o preservada), se recomienda un inhibidor de SGLT2 para el control de la glucemia y la prevención de hospitalizaciones por ICC, independientemente de la A1C. En pacientes con DM2 e ICC sintomática con fracción de eyección preservada (ICFEp) y obesidad, se recomienda un AR GLP-1, con beneficios demostrados tanto para el manejo glucémico como para la reducción de los síntomas relacionados con la IC, independientemente de la A1C.
- En pacientes con DM2 con enfermedad renal crónica, con una tasa de filtración glomerular estimada (eFG) de 20 a 60 ml/min y/o albuminuria, es recomendable el uso de un inhibidor de SGLT2 o un AR GLP-1, con un beneficio demostrado en esta población para el control glucémico (independientemente de la A1C), para retardar la progresión de la ERC y reducir los eventos cardiovasculares. Los beneficios exclusivamente glucémicos de los inhibidores de SGLT2 se reducen con eFG <45 ml/min; por ello, en pacientes con DM2 y ERC avanzada (eFG <30 ml/min), es preferible el uso de AR GLP-1 para el control glucémico debido al menor riesgo de hipoglucemia y para la reducción de eventos cardiovasculares.
- En presencia de DM2 y enfermedad hepática esteatótica asociada a disfunción metabólica (MASLD) y sobrepeso u obesidad, se aconseja el uso de AR GLP-1 o agonistas duales de GIP/GLP-1 por su beneficio en el MASLD y como complemento a intervenciones saludables para la pérdida de peso. En pacientes con DM2 y esteatohepatitis comprobada por biopsia, o aquellos con alto riesgo de fibrosis hepática, es aconsejable pioglitazona, un AR GLP-1 o un AR GIP/GLP-1 dual (o ambas) para el manejo glucémico debido a los posibles efectos beneficiosos sobre la hepatitis.
- En adultos con DM2 un riesgo alto de enfermedad cardiovascular ya establecido, el plan de tratamiento debe incluir medicamentos con beneficios demostrados para reducir eventos cardiovasculares (agonistas del receptor del péptido similar al glucagón 1 [AR GLP1] y/o inhibidores del cotransportador de sodio-glucosa 2 [SGLT2]) para el control glucémico y la reducción integral del riesgo cardiovascular, independientemente de la A1C.
Otras consideraciones terapéuticas del tratamiento de la DM2 son:
-
- En adultos con diabetes tipo 2 que no han alcanzado sus objetivos de peso, se recomiendan intervenciones adicionales para el control de peso (p. ej., intensificación de modificaciones del estilo de vida, programas estructurados de control de peso, agentes farmacológicos o cirugía bariátrica, según proceda).
- En adultos con DM 2, se debe considerar el inicio de insulina, independientemente del tratamiento previo, si existen síntomas de hiperglucemia (como poliuria, polidipsia o pérdida de peso) o si los niveles de HbA1c son >10% o la glucemia es >300 mg/dl. En este caso, es recomendable la consulta a Endocrinología.
- Debe excluirse la presencia de una DM tipo 1 o LADA (latent autoimmune diabetes in adults) en aquellos pacientes con DM mal controlada, sin obesidad, que precisen insulina; en estos casos se recomienda una prueba de péptido C basal y Ac anti-islotes pancreáticos y valorar derivar a Endocrinología.
- En adultos con diabetes tipo 2 que no han alcanzado sus objetivos de peso, se recomiendan intervenciones adicionales para el control de peso (p. ej., intensificación de modificaciones del estilo de vida, programas estructurados de control de peso, agentes farmacológicos o cirugía bariátrica, según proceda).
4.4.3.1. Peculiaridades de las personas con PVIH y con diabetes
-
- Uso de estatinas. La adición de estatinas en PVIH aun con riesgo cardiovascular estimado intermedio-bajo debe considerarse y recomendarse; como se ha demostrado en el estudio Reprieve 16. Las personas con PVIH y DM2 tienen una consideración de riesgo cardiovascular alto y deben tratarse con una estatina a dosis suficiente para los objetivos de LDL colesterol.
- Interacciones entre el tratamiento antirretroviral y los fármacos usados en el tratamiento de la diabetes 17
En general, no existen ninguna interacción grave, limitante, desde el punto de vista clínico entre los fármacos del TAR y los fármacos usados en la DM. Si existen, sin embargo, potenciales interacciones con algunos fármacos que deben considerarse. Las interacciones más conocidas son las de metformina con dolutegravir y bictegravir por inhibición de los transportadores renales OCT2 y MATE1.La ficha técnica europea de Biktarvy® indica que no se requiere ajuste de dosis tras la administración conjunta en pacientes con función renal normal, pero en pacientes con insuficiencia renal moderada se debe considerar un ajuste de dosis de metformina si es necesario. La ficha técnica de los productos que incluyen dolutegravir sugiere limitar la dosis diaria total de metformina a un máximo de metformina 1000 mg. Se recomienda controlar la función renal durante la administración conjunta y controlar la glucemia al iniciar y suspender la administración conjunta. Como la metformina se elimina por vía renal, los pacientes con insuficiencia renal pueden tener un mayor riesgo de complicaciones por metformina debido al aumento de su concentración plasmática. Los potenciadores cobicistat y ritonavir a dosis bajas también pueden inhibir los transportadores tubulares renales y causar un aumento de la concentración plasmática de metformina, aunque no es esperable que tenga relevancia clínica.
En caso de duda se recomienda consultar las posibles interacciones en una fuente fiable como, por ejemplo, HIV Drug Interactions (www.hiv-druginteractions.org)
La Tabla 4 muestra un resumen de los efectos de los fármacos antidiabéticos y las potenciales interacciones con fármacos antirretrovirales.
Recomendaciones
- Los criterios diagnósticos de la diabetes en personas con PVIH son similares a los de la población general (AIII)
- La HbA1c es la prueba diagnóstica más conveniente pese a que existen algunas situaciones que infraestiman su valor (AII)
- El cribado de la diabetes es conveniente en mayores de 45 años, con factores de riesgo y antes de iniciar o modificar el TAR (AII)
- El tratamiento se debe basar en una combinación de medidas no farmacológicas (dieta, ejercicio y control de peso) junto con tratamiento farmacológico individualizado, teniendo en cuenta la presencia de comorbilidades (cardiopatía, enfermedad renal o hepática) y las potenciales interacciones con los fármacos antirretrovirales (AII).
- El uso de estatinas está especialmente indicado por su beneficio cardiovascular (AI)
- Los inhibidores de SGLT2 y los agonistas GLP-1, ofrecen ventajas adicionales en control metabólico, peso y riesgo cardiovascular o renal (AI)
Gráficos:
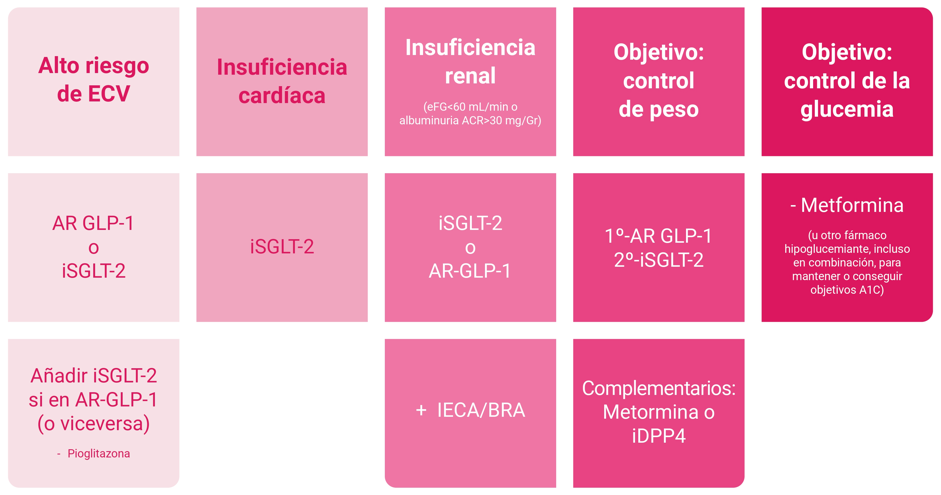
SGLT-2, sodium–glucose cotransporter 2 inhibitor; AR-GLP1, agonistas de los receptores de GLP1; IECA: inhibidores de la enzima convertidora de angiotensina; BRA, bloqueantes de los receptores de angiotensina; iDPP4, inhibidores de dipeptidyl peptidasa 4.
Tablas:
*Intolerancia oral glucosa o Glucosa basal alterada

Tanto la glucosa plasmática en ayunas, como la glucosa plasmática a las 2-h tras prueba de tolerancia oral de glucosa o la HbA1c son apropiados para el diagnóstico y el cribado. Hay que tener en cuenta que las distintas pruebas diagnósticas tienen una variabilidad intraindividual e interindividual 8. Si comparamos los puntos de corte para glucosa plasmática en ayunas y HbA1c, el valor de la prueba de sobrecarga oral tiene una mayor sensibilidad para el diagnóstico de prediabetes y DM2 9.

La determinación de HbA1c es la prueba más conveniente ya que no necesita de ser medida a una hora determinada del día, no requiere ningún tipo de preparación, y presenta mínimas variaciones biológicas. Esto la convierte en la prueba ideal tanto para diagnóstico como seguimiento de la DM2. Pero esta determinación puede infraestimar su valor real en situaciones de hemólisis, como la producida por algunos fármacos (dapsona o trimetropim-sulfametoxazol), tratamiento con abacavir, recuento de CD4 <500 cels/mm3 o embarazo 10. En estos casos parece razonable utilizar la determinación de la glucosa plasmática en ayunas o realizar ambas pruebas (HbA1c y glucosa plasmática en ayunas) de forma combinada 11.
Bibliografía:
Mirza FS, Luthra P, Chirch L. Endocrinological aspects of HIV infection. J Endocrinol Invest 2018; 41: 881-899.
Chenciner L, Barber TJ. Non-infective complications for people living with HIV. Medicine (Abingdon) 2022; 50: 304-307
Nansseu JR, Bigna JJ, Kaze AD, Noubiap JJ. Incidence and Risk Factors for Prediabetes and Diabetes Mellitus Among HIV-infected Adults on Antiretroviral Therapy: A Systematic Review and Meta-analysis. Epidemiology 2018; 29: 431-441
Montes ML, Busca C, Espinosa N, Bernardino JI, Ibarra-Ugarte S, Martín-Carbonero L, et al. Incidence of Diabetes Mellitus and Associated Factors in the Era of Antiretroviral Drugs With a Low Metabolic Toxicity Profile. Open Forum Infect Dis 2024; 11: ofae112
Sarkar S, Brown TT. Diabetes in People with HIV. Curr Diab Rep. 2021 Mar 17;21(5):13
Mohammad Pritom GS, Yang X, Gao H, Chen S, Zhang J, Olatosi B, et al. Examining incidence of diabetes in people with HIV: tracking the shift in traditional and HIV-related risk factors. AIDS 2024; 38: 1057-1065.
Ye Y, Shrestha S, Burkholder G, Bansal A, Erdmann N, Wiener H, et al. Rates and Correlates of Incident Type 2 Mellitus Among Persons Living With HIV-1 Infection. Front Endocrinol (Lausanne) 2020; 11: 555401.
International Expert Committee. International Expert Committee report on the role of the A1C assay in the diagnosis of diabetes. Diabetes Care 2009; 32: 1327–1334
Meijnikman AS, De Block CEM, Dirinck E, Verrijken A, Mertens I, Corthouts B, et al. Not performing an OGTT results in significant underdiagnosis of (pre)diabetes in a high-risk adult Caucasian population. Int J Obes (Lond) 2017; 41: 1615-1620
Daultrey H, Levett T, Oliver N, Vera J, Chakera AJ. HIV and type 2 diabetes: An evolving story. HIV Med 2024; 25: 409-423.
Bar Ziv O, Cahn A, Jansen T, Istomin V, Kedem E, Olshtain-Pops K, et al. Diagnosis and Risk Factors of Prediabetes and Diabetes in People Living with Human Immunodeficiency Virus: Evaluation of Clinical and Microbiome Parameters. J Infect Dis. 2024; 230: 411-420.
Webel AR, Schexnayder J, Cioe PA, Zuñiga JA. A Review of Chronic Comorbidities in Adults Living With HIV: State of the Science. J Assoc Nurses AIDS Care 2021; 32: 322-346.
Fève B, Scheen AJ. When therapeutic drugs lead to diabetes. Diabetologia 2022; 65: 751-762.
American Diabetes Association Professional Practice Committee. 6. Glycemic Goals and Hypoglycemia: Standards of Care in Diabetes-2025. Diabetes Care 2025; 48(Supplement_1): S128-S145.
Battelino T, Danne T, Bergenstal RM, Amiel SA, Beck R, Biester T, et al. Clinical Targets for Continuous Glucose Monitoring Data Interpretation: Recommendations from the International Consensus on Time in Range. Diabetes Care 2019; 42: 1593-1603.
Grinspoon SK, Fitch KV, Zanni MV, Fichtenbaum CJ, Umbleja T, Aberg JA, et al. Pitavastatin to Prevent Cardiovascular Disease in HIV Infection. N Engl J Med 2023; 389: 687-699.
HIV Drug Interactions. En : https://www.hiv-druginteractions.org/
5. HIPERTENSION ARTERIAL
Introducción
La hipertensión arterial (HTA) se ha reportado generalmente como más prevalente en población VIH que en la población general, aunque estudios recientes muestran una prevalencia similar en PVIH con buen control virológico y sin inmunosupresión previa 1. Su prevalencia en las personas con PVIH se ha descrito en un 20-30% y, al igual que en la población general, aumenta progresivamente con la edad 2 Es una de las comorbilidades más frecuentes y probablemente está infradiagnosticada.
Diagnóstico
5.2.1. Medida de la presión arterial:
La correcta medida de la presión arterial (PA) debe realizarse con un dispositivo validado y calibrado, en un ambiente tranquilo, tras estar 5 minutos sentado y al menos 30 minutos después de cualquier ejercicio, consumo de tabaco, café u otros estimulantes. Se debe retirar completamente la prenda del brazo en lugar de remangarla, para evitar un efecto torniquete que pueda interferir con la circulación. Se recomienda medir la presión arterial en ambos brazos al menos en la primera visita, ya que una diferencia en la presión arterial sistólica >10 mmHg entre brazos se asocia con un mayor riesgo de enfermedad cardiovascular. Si se detecta una diferencia >10 mmHg, todas las mediciones posteriores deben realizarse en el brazo con la lectura más alta. Se deben realizar tres mediciones, con un intervalo de 1 a 2 minutos entre cada una, y se utilizará la media de las dos últimas para el registro final.
5.2.2. Cribado:
Cualquier persona de más de 18 años debería tener al menos una medida de PA. Se recomienda cribado al menos anual para las personas mayores de 40 años o más jóvenes con alto riesgo cardiovascular. Se recomienda cribado al menos cada 3 años en caso de menores de 40 años con bajo riesgo cardiovascular.
5.2.3. Confirmación:
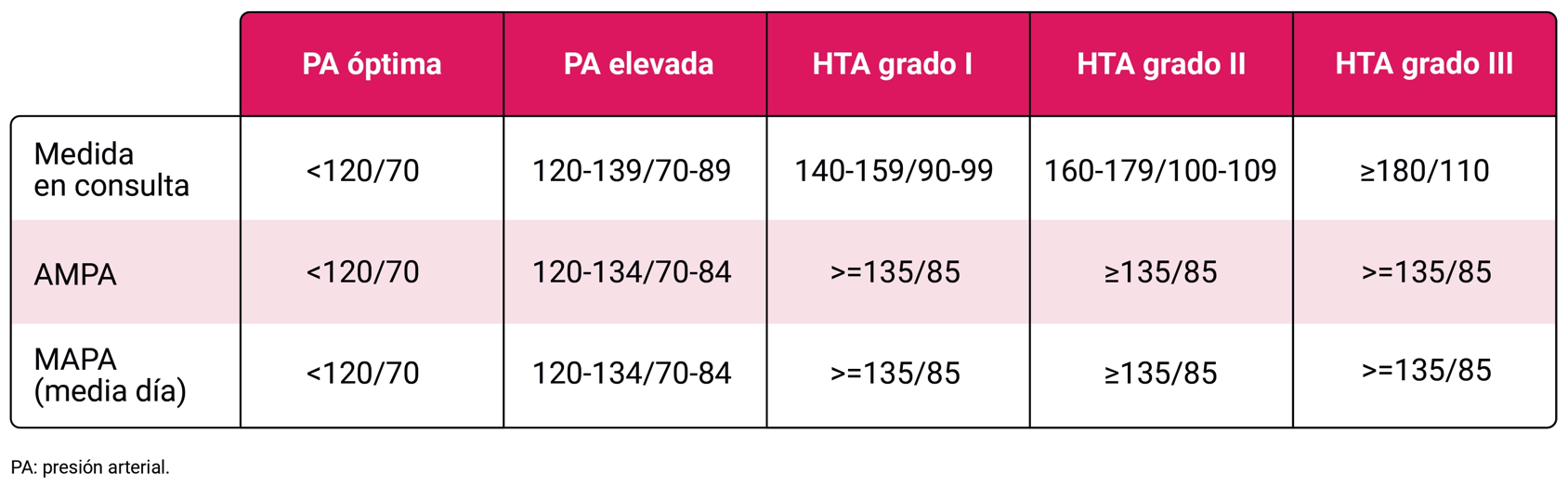
Se considera HTA cuando las medidas en la consulta muestran una PA sistólica confirmada ≥140 mmHg o una PA diastólica de ≥90 mmHg. Se recomienda confirmarlo con mediciones fuera del consultorio (AMPA o MAPA) o al menos una repetición de la medición en el consultorio en una visita posterior.
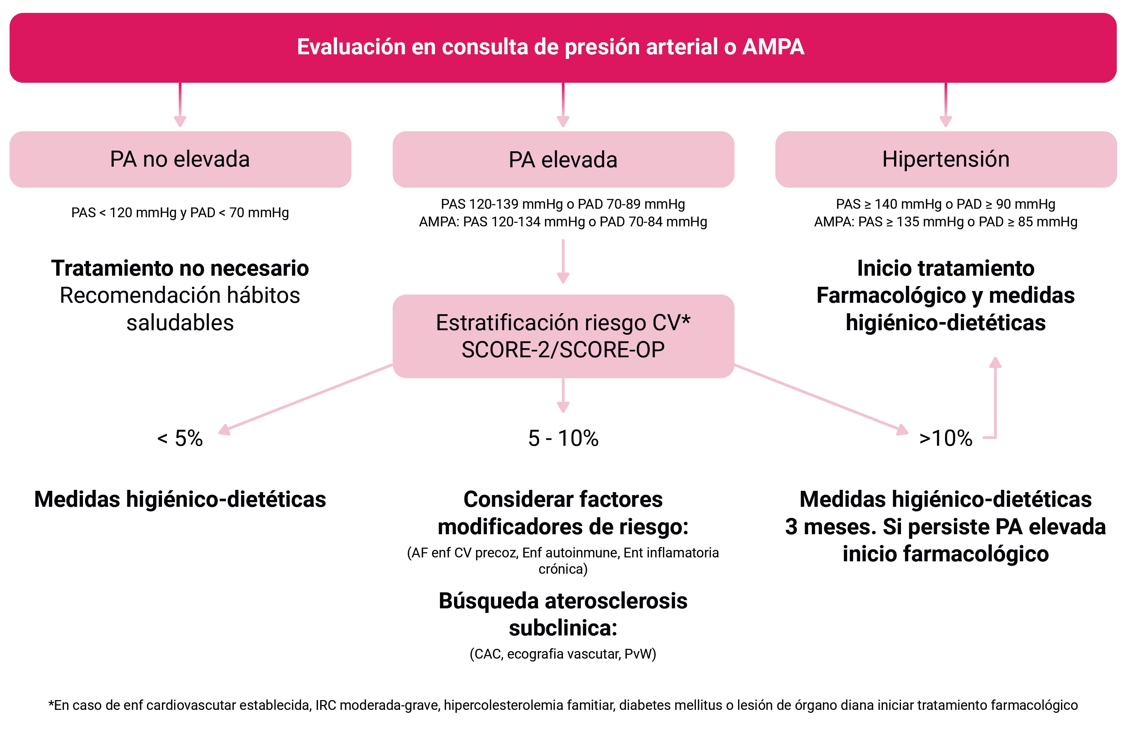
Recientemente, se ha diferenciado un grupo de hipertensión (PA elevada) en personas con cifras previamente consideradas normotensivas de entre 120-140/70-90 Tabla 1.
5.2.4. Exploraciones complementarias
En todos los casos de HTA:
-
-
- Analítica con creatinina, filtrado glomerular estimado, glucosa, perfil lipídico, sodio y potasio, urato, TSH y hemograma.
-
-
-
- Sedimento de orina con cociente albúmina/creatinina
- Electrocardiograma
-
En pacientes seleccionados:
-
-
- Ecocardiograma
-
-
-
- Ecografía carotídea
- Índice tobillo-brazo
- TAC cardiaco
- Troponina o pro-BNP
- Ecografía abdominal
- Fondo de ojo
-
En caso de sospecha de HTA secundaria por anamnesis, exploración física o pruebas complementarias, valorar según sospecha:
-
-
- Cortisol, renina y aldosterona
-
-
-
- PTH, calcio y fósforo
- Catecolaminas en sangre y orina
- Polisomnografía nocturna
- Eco doppler renal
- TAC o RMN
-
Tratamiento 345
Se debe iniciar el tratamiento farmacológico para la hipertensión arterial en todos los individuos que tengan el diagnóstico confirmado (cifras confirmadas en consulta de presión sistólica ≥140 mmHg o diastólica ≥90 mmHg). En aquellos en los que tengan la categoría de presión elevada (120-139 mmHg o 70-89 mmHg) el tratamiento debe iniciarse en función de la estratificación del riesgo CV Figura 1.
Se debe iniciar tratamiento farmacológico en sujetos con presión arterial elevada (preferentemente a aquellos con PA sistólica entre 130-139 mmHg o PA diastólica entre 80-89 mmHg) si presentan una de las siguientes condiciones:
- Enfermedad cardiovascular establecida
- Enfermedad renal crónica moderada-grave (eGFR < 60 mL/min/1.73m2 y albuminuria ≥30mg/g, o eGFR < 30 mL/min/1.73m2 sin albuminuria)
- Evidencia de daño orgánico mediado por presión arterial
- Diabetes mellitus
- Hipercolesterolemia familiar probable o definitiva
El objetivo del tratamiento de la hipertensión arterial es conseguir unas cifras de presión arterial entre 120-129/70-79 mmHg siempre y cuando el tratamiento farmacológico sea bien tolerado.
Una vez conseguido el control de la presión arterial de forma mantenida, se recomienda una periodicidad de revisiones médicas de al menos una vez al año.
5.3.1 Tratamiento general (Medidas higiénico-dietéticas)
La mayoría de las recomendaciones generales de cambios en el estilo de vida tienen efectos beneficiosos que van más allá de la reducción de las cifras de presión arterial. Además de las medidas generales de la dieta, ejercicio, abandono del alcohol y tabaco (véase capítulo 2. Estilo de Vida Saludable), son convenientes medidas adicionales:
-
- Reducir la ingesta de sal (cloruro sódico): la reducción de ingesta de cloruro sódico a menos de 2 gr/día reduce aproximadamente un 20% los eventos cardiovasculares.
-
- Incrementar la ingesta de potasio (frutas y verduras) excepto en aquellas personas con insuficiencia renal moderada-grave.
- Pérdida de peso: una pérdida de 5 Kg de peso se ha asociado con una reducción de 4.4-y 3.6 mmHg de presión sistólica y diastólica. Cualquier dieta con objeto de reducir peso es beneficiosa si bien las mayores evidencias provienen de la dieta mediterránea y la dieta DASH (Dietary Approaches to Stop Hypertension) 6.
- Reducir o, mejor, evitar la ingesta de bebidas energéticas y refrescos azucarados, además del alcohol.
5.3.2 Tratamiento farmacológico
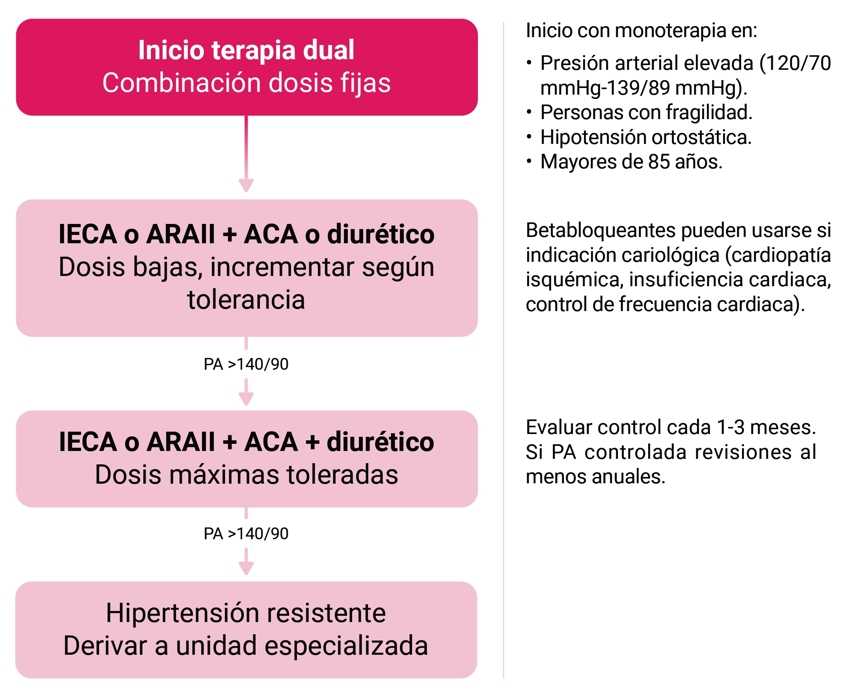
Los fármacos recomendados para el tratamiento de inicio de la hipertensión son: inhibidores del sistema renina angiotensina, tanto inhibidores de la enzima convertidora de la angiotensina (IECA), como los antagonistas del receptor de la angiotensina (ARAII) pero nunca de forma simultánea, además de los antagonistas de canales del calcio dihidropiridinicos (ACA) o los diuréticos tiazídicos (Hidroclorotiazida, clortalidona o Indapamida).
Los betabloqueadores suelen reservarse para personas con cardiopatía isquémica o cuando se precisa un mayor control de la frecuencia cardiaca.
Se define hipertensión resistente como aquellas cifras no controladas (³140/90 mmHg) a pesar del tratamiento con 3 o más fármacos antihipertensivos incluyendo IECA o ARAII, ACA y diuréticos tiazídicos a dosis máximas o dosis máximas toleradas. Estos casos deben referirse a unidades especializadas de hipertensión.
En pacientes con presión arterial elevada (120-139/70-89 mmHg) se debe estratificar el riesgo cardiovascular para guiar el tratamiento Figura 1. Para la estratificación del riesgo cardiovascular, la Sociedad Europea de Hipertensión y la European AIDS Clinical Society recomiendan utilizar las ecuaciones SCORE-2 (entre 40 y 69 años) y SCORE2-OP (para mayores de 70 años) (véase capítulo sobre Enfermedad Cardiovascular Aterosclerótica).
En general se prefiere el inicio de tratamiento farmacológico con combinaciones duales a dosis bajas en un solo comprimido. En casos excepcionales, se puede plantear el inicio de tratamiento farmacológico con monoterapia en personas ancianas (>85 años), en personas con fragilidad y en aquellos con hipotensión ortostática. Figura 2
En personas con cifras de PA elevada (120-139/70-89 mmHg) se iniciará el tratamiento en función del riesgo cardiovascular calculado, según las condiciones previamente descritas.
Recomendaciones
- Se recomienda cribado de hipertensión arterial con una frecuencia al menos anual para las personas mayores de 40 años (CII)
- Se recomienda cribado al menos cada 3 años en caso de menores de 40 años con bajo riesgo cardiovascular. (CII)
- Si cribado con cifras >140/90 se recomienda confirmar de forma ambulatoria mediante AMPA o MAPA (BI)
- El objetivo del tratamiento de la hipertensión arterial es conseguir unas cifras de presión arterial entre 120-129/70-79 mmHg. (AI)
- Se debe recomendar medidas higiénico dietéticas en todos los pacientes. (AIII)
- En personas con hipertensión arterial confirmada (140/90 mmHg) se prefiere el inicio con tratamiento combinado a dosis bajas (IECA o ARAII con ACA o con diuréticos). (AI)
- Los casos de hipertensión resistente (140/90 mmHg a pesar del tratamiento con 3 o más fármacos antihipertensivos incluyendo IECA o ARAII, ACA y diuréticos tiazídicos a dosis máximas o dosis máximas toleradas) deben referirse a un especialista de hipertensión. (AIII)
Gráficos:
Tablas:
Bibliografía:
Gelpi M, Karvig LU, Knudsen AD, Sørensen EW, Benfield T, Afzal S, et al. Incidence of hypertension in people with HIV infection: a longitudinal observational study. AIDS 2023; 37: 1705-1709.
Camps-Vilaró A, Pérez-Fernández S, Subirana I, Teira R, Estrada V, Domingo P, et al. Standardized Comparison of Cardiovascular Risk Factors Prevalence in Spanish Women and Men Living with HIV and in the General Population. J Pers Med 2021; 11: 1085.
EACS Guidelines 2024 guidelines. En: https://eacs.sanfordguide.com/
McEvoy JW, McCarthy CP, Bruno RM, Brouwers S, Canavan MD, Ceconi C, et al. 2024 ESC Guidelines for the management of elevated blood pressure and hypertension. Eur Heart J. 2024 Oct 7;45(38):3912-4018.
Gorostidi M, Gijón-Conde T, de la Sierra A, Rodilla E, Rubio E, Vinyoles E, et al. Guía práctica sobre el diagnóstico y tratamiento de la hipertensión arterial en España, 2022. Sociedad Española de Hipertensión - Liga Española para la Lucha contra la Hipertensión Arterial (SEH-LELHA). Hipertens Riesgo Vasc 2022; 39: 174-194.
Todo lo que debería saber sobre la dieta DASH. En: https://www.seen.es/ModulGEX/workspace/publico/modulos/web/docs/apartados/1867/281220_031756_7928853835.pdf
6. DISLIPEMIA
6.1. Introducción
6.2. Cribado/Diagnóstico
6.3. Tratamiento (general y farmacológico)
6.4. Seguimiento
6.5. Recomendaciones
Introducción
La dislipemia en personas con PVIH es muy frecuente y se asocia con un mayor riesgo de enfermedad cardiovascular.
El patrón más frecuente suele ser el de la dislipemia aterogénica, caracterizada por HDL colesterol bajo y triglicéridos (TG) elevados, acompañado de elevaciones variables de colesterol total y LDL colesterol.
Cribado/Diagnóstico
La determinación de los niveles de colesterol está incluida en las recomendaciones de primera visita y de seguimiento habitual de las PVIH.
Se recomienda realizar un cálculo del riesgo vascular en cada revisión 1 y determinar la lipoproteína (a), como modulador del riesgo, al menos una vez en la vida dada su estabilidad 2.
Para el cálculo del riesgo cardiovascular las guías europeas recomiendan el uso de las escalas SCORE2-SCOREOP con una corrección al alza en las PVIH. Las escalas SCORE2-SCOREOP son las utilizadas habitualmente en la población general europea. No obstante, la recomendación de GeSIDA para el uso de estatinas en PVIH con un riesgo bajo-moderado consideró mejor el uso de la escala ASCVD, ya que es la que se usó en el estudio REPRIEVE (véase capítulo sobre Enfermedad Cardiovascular Aterosclerótica).
En las personas con PVIH con dislipemia debe revisarse la medicación antirretroviral; podría ser necesario un cambio de la misma (atendiendo a otros factores como el historial farmacológico, la presencia de mutaciones de resistencia y otras comorbilidades) hacia una combinación igualmente eficaz pero más neutra desde el punto de vista de los lípidos o sin riesgo de interacciones que impidan el uso de estatinas de alta intensidad si fuera necesario su uso. El efecto del cambio de medicación antirretroviral sobre la dislipemia es modesto en comparación con el uso de fármacos hipolipemiantes.
Los antirretrovirales tienen efectos variables sobre el perfil lipídico, dependiendo de su clase y del fármaco específico. Los inhibidores de la proteasa potenciados con ritonavir o cobicistat (como lopinavir/r o darunavir/c) suelen tener un impacto negativo, elevando el colesterol total, los triglicéridos y el LDL-colesterol. En contraste, los inhibidores de la transcriptasa inversa no nucleósidos (NNRTI) muestran efectos diversos: efavirenz puede aumentar colesterol total y LDL, mientras que nevirapina tiende a elevar el HDL-colesterol. Los inhibidores de la integrasa (INSTI), especialmente dolutegravir, bictegravir y raltegravir, suelen tener un perfil lipídico neutro o ligeramente favorable, aunque elvitegravir/cobicistat puede asociarse con leves aumentos en lípidos por el potenciador farmacocinético. Por su parte, los inhibidores nucleósidos de la transcriptasa inversa (INTI) como tenofovir disoproxil fumarato (TDF) pueden tener un efecto hipolipemiante modesto, mientras que tenofovir alafenamida (TAF) suele asociarse con aumentos en colesterol y triglicéridos.
Tratamiento (general y farmacológico)
El tratamiento de la dislipidemia en personas con PVIH incluye recomendaciones de estilo de vida: dieta mediterránea, ejercicio físico y abstención del tabaco (véase capítulo sobre Estilo de Vida Saludable).
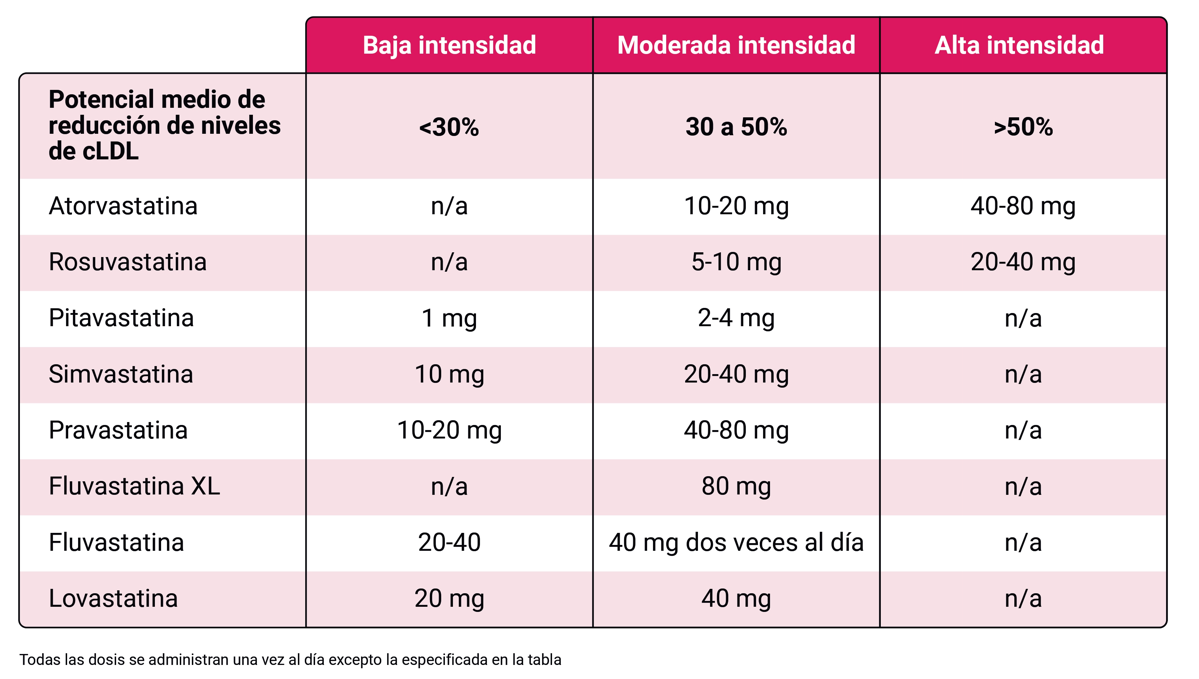
En cuanto al tratamiento farmacológico, las estatinas son la primera opción por su capacidad para reducir la morbi-mortalidad cardiovascular. Se clasifican según su potencia como muestra la Tabla 1. El ensayo REPRIEVE demostró que el uso de pitavastatina en personas con PVIH con un riesgo cardiovascular moderado o bajo como prevención primaria reduce la incidencia de eventos cardiovasculares mayores 3. Los beneficios de las estatinas en la prevención cardiovascular son propios de familia y pueden ser compartidos por cualquier estatina en relación con el descenso del LDL colesterol. Las estatinas pueden presentar riesgo de interacciones con el tratamiento antirretroviral Tabla 2. Los efectos secundarios más comunes incluyen toxicidad muscular y muy raramente hepática, en general no graves.
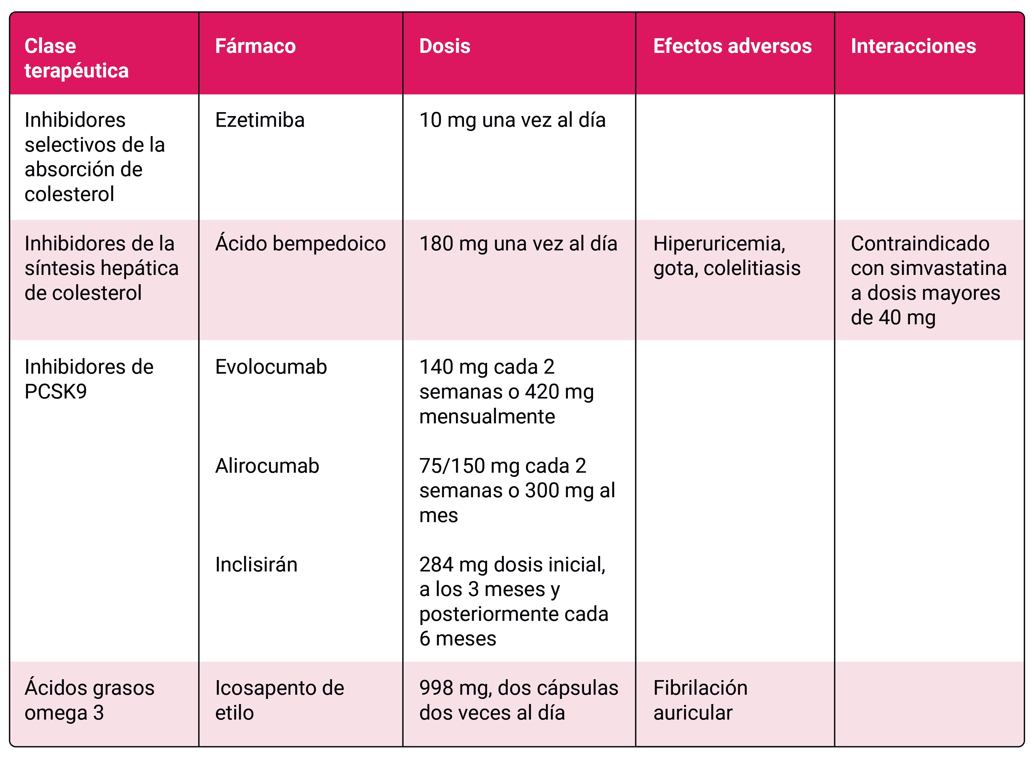
Además de las estatinas, hay otros fármacos hipolipemiantes disponibles Tabla 3. Si no se alcanzan los objetivos terapéuticos con las estatinas, se puede añadir ezetimiba, un inhibidor de la absorción de colesterol, especialmente útil en pacientes que no toleran dosis altas de estatinas. Existe amplia experiencia en su uso combinado con estatinas en PVIH 8. El ácido bempedoico, inhibidor de la síntesis hepática de colesterol, es una opción para personas intolerantes a estatinas o aquellos que no logran los objetivos lipídicos. No presenta interacciones con el tratamiento antirretroviral, pero tiene riesgo de hiperuricemia. Los inhibidores de PCSK9 (proproteina convertasa subtilisina/kexina tipo 9) evolocumab y alirocumab reducen significativamente el colesterol LDL y no tienen interacciones relevantes. Son una opción potente y segura, y evolocumab dispone de un ensayo clínico en personas con PVIH9. Además, el inclisirán, administrado cada seis meses, también es una opción segura sin interacciones farmacológicas. El icosapento de etilo es el único fármaco dirigido a la hipertrigliceridemia que ha demostrado reducción de complicaciones cardiovasculares en pacientes de alto riesgo en tratamiento con estatinas 10.
La elección del tratamiento inicial y los cambios posteriores deben basarse en la expectativa de reducción prevista para alcanzar el objetivo terapéutico Tabla 4.
Seguimiento
Se recomienda realizar una determinación de los lípidos plasmáticos entre 1 y 3 meses después de haber iniciado o modificado un tratamiento hipolipemiante y realizar ajustes convenientemente si no se alcanzan los objetivos. Posteriormente, el seguimiento puede realizarse anualmente.
Las personas con PVIH con dislipemia deberían derivarse a una consulta de lípidos cuando se sospecha una dislipemia familiar o existe toxicidad o dificultad de alcanzar objetivos terapéuticos con el tratamiento convencional.
Recomendaciones
- Se recomienda evaluar la necesidad de tratamiento hipolipemiante en función del riesgo cardiovascular en todas las personas con PVIH(AI).
- A diferencia de la población general, la indicación de estatinas para la prevención primaria del riesgo cardiovascular en personas con PVIH incluye no solo a las personas con riesgo alto, sino también a aquellas con un riesgo moderado o bajo (AI).
- Las estatinas son los fármacos hipolipemiantes de primera elección para reducir el LDL colesterol según la estimación del riesgo cardiovascular (AI). Su elección se basará en la potencia y en el riesgo de interacciones (BII).
- La indicación de estatinas como prevención primaria en personas con PVIH requiere para su inicio y mantenimiento la colaboración entre atención primaria y especializada, y el reconocimiento de dicha indicación por parte del sistema público de salud. (BIII)
- En los casos en los que no se alcancen los objetivos terapéuticos con estatinas, se utilizarán tratamientos de intensificación hipolipemiante igual que en la población general (AII)
Tablas:
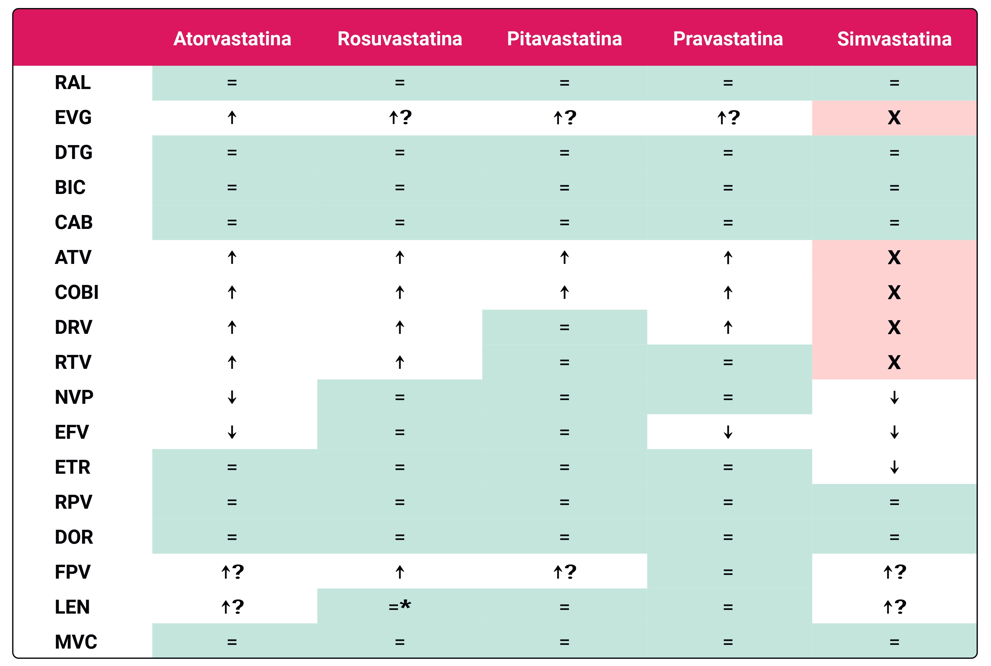
X: No deberían coadministrarse; ↑: Precaución por incremento de niveles estatina y riesgo potencial de toxicidad; ↓: Reducción esperada de la eficacia hipolipemiante por descenso de los niveles plasmáticos de la estatina; =: No interacción esperada. ↑? Precaución por posible incremento no confirmado de niveles estatina y riesgo potencial de toxicidad. * monitorizar más estrechamente por ausencia de información y potencial interacción.
ATV: Atazanavir; BIC: bictegravir; CAB: cabotegravir; DOR: doravirina; DTG: dolutegravir; DRV: darunavir; Cobi: cobicistat; RTV: ritonavir; EFV: efavirenz; FPV: fostemsavir; LEN: lenacapavir; NVP: nevirapina; ETR: etravirina; RPV: rilpivirina; RAL: raltegravir; RPV: rilpivirina; DTG: dolutegravir; MVC: maraviroc.

Bibliografía:
Visseren FLJ, Mach F, Smulders YM, Carballo D, Koskinas KC, Bäck M, et al. 021 ESC Guidelines on cardiovascular disease prevention in clinical practice. Eur Heart J 2021; 42: 3227-3337.
Delgado-Lista J, Mostaza JM, Arrobas-Velilla T, Blanco-Vaca F, Masana L, Pedro-Botet J, et al. Consensus on lipoprotein(a) of the Spanish Society of Arteriosclerosis. Literature review and recommendations for clinical practice. Clin Investig Arterioscler 2024; 36: 243-266.
Grinspoon SK, Fitch KV, Zanni MV, Fichtenbaum CJ, Umbleja T, Aberg JA, et al REPRIEVE Investigators. Pitavastatin to Prevent Cardiovascular Disease in HIV Infection. N Engl J Med 2023; 389: 687-699.
Heidenreich PA, Bozkurt B, Aguilar D, Allen LA, Byun JJ, Colvin MM, al. 2022 AHA/ACC/HFSA Guideline for the Management of Heart Failure: Executive Summary: A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. J Am Coll Cardiol 2022; 79: 1757-1780.
Fegers-Wustrow I, Gianos E, Halle M, Yang E. Comparison of American and European Guidelines for Primary Prevention of Cardiovascular Disease: JACC Guideline Comparison. J Am Coll Cardiol 2022; 79: 1304-1313.
Mostaza JM, Pintó X, Armario P, Masana L, Real JT, Valdivielso P, et al. SEA 2024 Standards for Global Control of Vascular Risk. Clin Investig Arterioscler 2024; 36: 133-194.
Guijarro C, Cosín-Sales J. LDL cholesterol and atherosclerosis: The evidence. Clin Investig Arterioscler 2021; 33 Suppl 1: 25-32
Saeedi R, Johns K, Frohlich J, Bennett MT, Bondy G. Lipid lowering efficacy and safety of Ezetimibe combined with rosuvastatin compared with titrating rosuvastatin monotherapy in HIV-positive patients. Lipids Health Dis 2015; 14:57
Boccara F, Caramelli B, Calmy A, Kumar P, López JAG, Bray S, et al. Long-term effects of evolocumab in participants with HIV and dyslipidemia: results from the open-label extension period. AIDS 2022; 36: 675-682.
Bhatt DL, Steg PG, Miller M, Brinton EA, Jacobson TA, Ketchum SB, et al. Cardiovascular Risk Reduction with Icosapent Ethyl for Hypertriglyceridemia. N Engl J Med 2019; 380: 11-22
7. ENFERMEDAD CARDIOVASCULAR ATEROSCLERÓTICA
Introducción
La enfermedad cardiovascular aterosclerótica (incluyendo enfermedad coronaria, cerebrovascular y enfermedad arterial periférica) es una de las principales causas de morbimortalidad en personas con PVIH1 y se prevé un incremento de su frecuencia relativa a medida que la población con VIH envejece. Además de los factores de riesgo tradicionales, se han implicado otros factores específicamente asociados a la infección por VIH que contribuyen a que el riesgo en esta población sea de hasta el doble respecto al de la población general 2. Por este motivo, se han evaluado estrategias de prevención más exigentes, adaptadas a las personas con PVIH.
7.2. Cribado/Diagnóstico
7.2.1. Cribado de enfermedad cardiovascular
-
-
- En un metaanálisis se ha analizado el rendimiento en población con VIH de las escalas de predicción del riesgo cardiovascular utilizadas en población general. Las escalas habitualmente infraestimaron el riesgo, si bien es cierto que sólo incluyeron un estudio realizado en España con un número muy limitado de eventos cardiovasculares3. Entre todas ellas, la escala de Framingham y la escala ASCVD (Atherosclerotic Cardiovascular Disease) de la Asociación Americana del Corazón/Colegio Americano de Cardiología (AHA/ACC) a 10 años fueron las que tuvieron una mejor capacidad de discriminación. Por otra parte, en el único ensayo de prevención primaria con estatinas en PVIH (estudio REPRIEVE) se utilizó la escala ASCVD 4.
- Se recomienda el cálculo anual del riesgo vascular en hombres y mujeres ≥40 años567 usando preferentemente la escala ASCVD (BII) (recomendada por GeSIDA) o las escalas SCORE2-SCOREOP, recomendada por las Guías de la EACS (BIII) 89.
-
7.2.2. Diagnóstico de la enfermedad cardiovascular subclínica
-
-
- El objetivo de la evaluación de la enfermedad vascular subclínica es re-estratificar el riesgo cardiovascular en personas asintomáticas y sin historia de enfermedad cardiovascular con el fin de redefinir las decisiones terapéuticas. Existe evidencia de que las estrategias convencionales de evaluación y prevención aplicadas a la población general son insuficientes en la población con VIH 4. En los participantes del ensayo REPRIEVE, cuyo riesgo cardiovascular era moderado-bajo, el angio-TAC detectó placa coronaria en el 49% de los participantes y en el 30% de los que tenían un riesgo <2.5% 10. No se recomienda de forma sistemática el uso de pruebas para detectar aterosclerosis subclínica, pero podrían ser útiles para decidir el tratamiento con estatinas en los pacientes con riesgo muy bajo (<5% o <2.5%). Estas pruebas deben ser no invasivas. La Tabla 1 muestra la evidencia y recomendaciones de realización de pruebas de imagen para el diagnóstico de enfermedad aterosclerótica subclínica.
-
7.3. Tratamiento (general y farmacológico)
7.3.1. Prevención primaria
Medidas no farmacológicas: La optimización del estilo de vida es la primera medida que se debe adoptar en cualquier estrategia de prevención Tabla 2 (véase capítulo sobre Estilo de Vida Saludable). Se debe evitar el uso de abacavir porque tiene un efecto intrínseco sobre el aumento del riesgo cardiovascular10.
Medidas farmacológicas: El estudio REPRIEVE (Randomized Trial to Prevent Vascular Events in HIV), es el primer ensayo en prevención primaria en PVIH, que incluyó adultos de 40-75 años en tratamiento antirretroviral y con riesgo cardiovascular a 10 años bajo-moderado (<15%) medido con la escala ASCVD. La mediana de riesgo fue de 4,5% (rango intercuartil: 2,1-7,0). Tras una mediana de seguimiento de 5 años, el tratamiento con 4 mg diarios de pitavastatina frente a placebo demostró una reducción del 35% del riesgo de eventos cardiovasculares4. Hubo un incremento del riesgo de incidencia de diabetes del 35% (intervalo de confianza al 95%, 0.9-1.66) y de síntomas musculares del 74% (1.24-2.45). La reducción del riesgo absoluto fue mayor para las personas con riesgo ≥5%, en las que la recomendación de tratamiento con estatinas en prevención primaria es generalmente más aceptada Tabla 2. Si el riesgo estimado es <5%, el número de personas que es necesario tratar para evitar un evento es >100, por lo que habría que valorar la decisión de una manera individualizada 9. Para la toma de decisiones en estas personas, especialmente si el riesgo es <2,5%, se podría tener en cuenta los “potenciadores del riesgo”, como los factores asociados al VIH que pueden incrementar el riesgo, y/o pruebas de imagen para detectar la presencia de arteriosclerosis subclínica o la medición de biomarcadores Tabla 3. En el caso de que el paciente presente alguno de los factores potenciadores asociados a la infección VIH, se puede considerar multiplicar el riesgo por 1,5 o 2 3, mientras que, si presenta cualquiera de los factores no asociados a la infección expuestos en la tabla 3, debe ser considerado equivalente a un paciente de alto riesgo vascular 311.
En el caso de pacientes cuya estimación de riesgo vascular se clasifique como alta, el enfoque del manejo debe ser similar al de prevención secundaria 356.
7.3.2. Prevención secundaria:
No existen indicaciones específicas para PVIH, por lo que se recomienda seguir las pautas recomendadas para población general tras un evento vascular Figura 1.
Recomendaciones finales
- Se recomienda el cálculo anual del riesgo cardiovascular en hombres y mujeres ≥40 años usando preferentemente la escala ASCVD a 10 años (BII) o la escala SCORE2-SCOREOP (BIII).
- En adultos de 40-75 años con riesgo cardiovascular moderado-bajo (5-20%), se recomienda tratamiento con estatinas (pitavastatina, atorvastatina o rosuvastatina), al menos con intensidad moderada (AI).
- En personas con riesgo bajo/muy bajo (<5%), se recomienda tratamiento con estatinas con intensidad moderada (CI). En este caso habría que valorar la relación riesgo-beneficio, para lo que se podrían considerar los potenciadores del riesgo asociados a la infección por el VIH, la detección de aterosclerosis subclínica o los biomarcadores (CIII).
Gráficos:
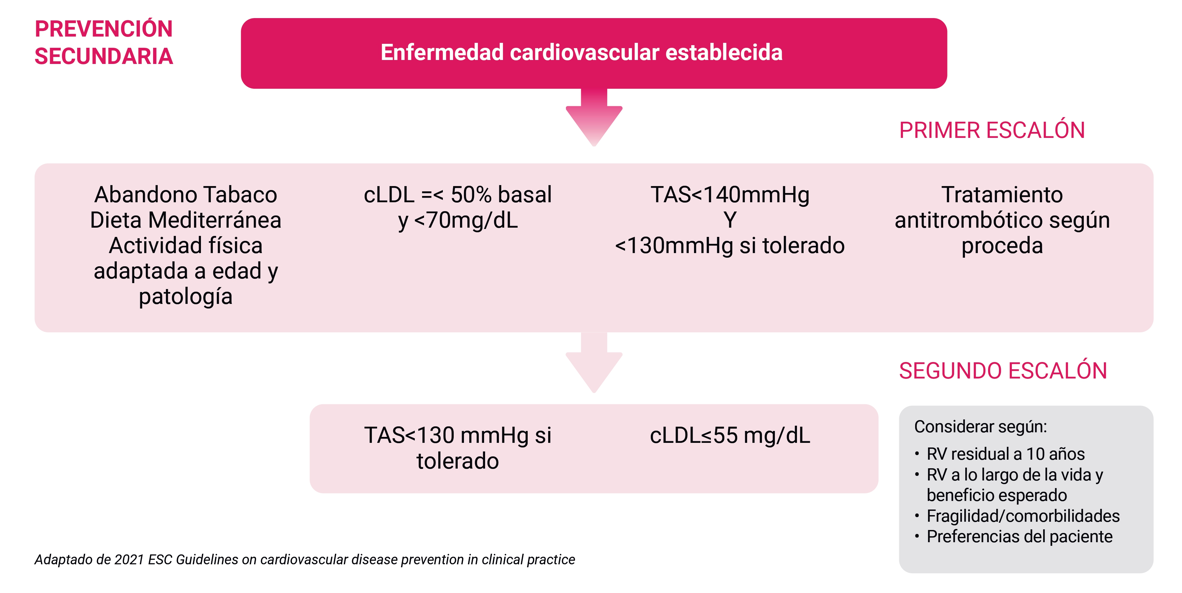
Tablas:
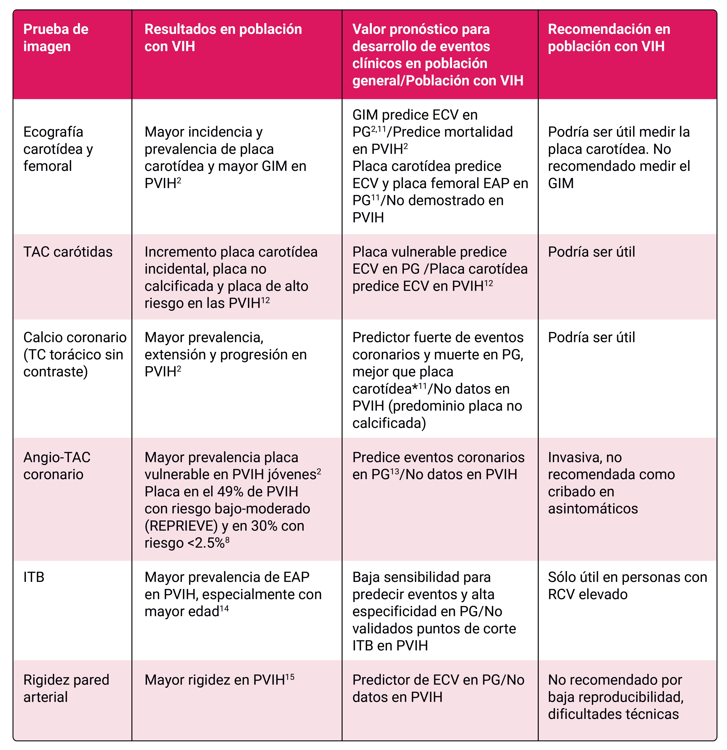
*Consenso entre sociedades científicas en considerar un CC > 100 uu Agatston como modificador de riesgo, sugiriendo, en estas circunstancias, el inicio de tratamiento con estatinas de alta intensidad 11 https://doi.org/10.1016/j.arteri.2024.02.001); 12 https://doi.org/10.1161/CIRCIMAGING.116.005777; 13 10.1097/HCO.0000000000000917; 14 10.1097/QAI.0000000000001795; 15 https://doi.org/10.2991/artres.k.200314.002. PVIH, personas con VIH; GIM, grosor íntima-media; PG, población general; ECV, enfermedad cardiovascular; ITB, índice tobillo-brazo; EAP, enfermedad arterial periférica
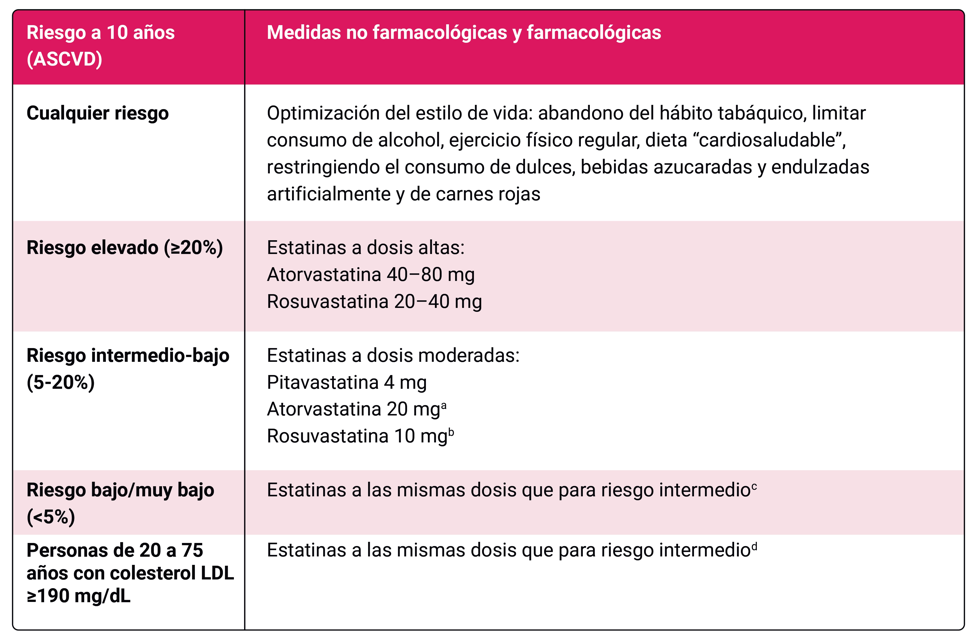
aEn un ensayo aleatorizado de fase 2 con control placebo, la atorvastatina a dosis de 20 mg/día en personas con VIH se asoció con reducciones de la placa coronaria no calcificada mediante angiografía por TC (Lancet HIV. 2015;22:e52-63).
bEn un ensayo aleatorizado de fase 2 con control placebo, la rosuvastatina a dosis de 10 mg al día se asoció con progresión más lenta del espesor íntima-media de la arteria carótida común (AIDS 2016;3014:2195-2203).
cEn este grupo de pacientes en los que el beneficio es más modesto, se podrían tener en cuenta los “potenciadores del riesgo" (Tabla 3).
dRealizar una evaluación adicional del riesgo teniendo en cuenta los potenciadores del riesgo para valorar la posibilidad de tratamiento con estatinas a dosis altas

Bibliografía:
Weber MSR, Duran Ramirez JJ, Hentzien M, Cavassini M, Bernasconi E, Hofmann E, et al. Time Trends in Causes of Death in People With HIV: Insights From the Swiss HIV Cohort Study. Clin Infect Dis 2024; 79: 177-188.
Feinstein MJ, Hsue PY, Benjamin LA, Bloomfield GS, Currier JS, Freiberg MS, et al. Characteristics, Prevention, and Management of Cardiovascular Disease in People Living With HIV: A Scientific Statement from the American Heart Association. Circulation 2019; 140: e98-e124.
Soares C, Kwok M, Boucher KA, Haji M, Echouffo-Tcheugui JB, Longenecker CT, et al. Performance of Cardiovascular Risk Prediction Models Among People Living With HIV: A Systematic Review and Meta-analysis. JAMA Cardiol 2023; 8: 139-149.
Grinspoon SK, Fitch KV, Zanni MV, Fichtenbaum CJ, Umbleja T, Aberg JA, et al. Pitavastatin to Prevent Cardiovascular Disease in HIV Infection. N Engl J Med 2023; 389: 687-699.
Documento de posicionamiento sobre el uso de estatinas en la prevención primaria cardiovascular de las personas con VIH. En: https://gesida-seimc.org/wp-content/uploads/2024/06/documento-de-posicionamiento-del-ensayo-clinico-REPRIEVE-DEFINITIVO.pdf
Alagaratnam J, van Bremen K, Behrens GMN, Boccara F, Cinque P, Gisslén M, MD, et al. Statin use in HIV: European AIDS Clinical Society guidance for the primary prevention of cardiovascular disease. Lancet HIV 2025; 12: e382-e392.
Recommendations for the Use of Statin Therapy as Primary Prevention of Atherosclerotic Cardiovascular Disease in People With HIV. En: https://clinicalinfo.hiv.gov/en/guidelines/hiv-clinical-guidelines-adult-and-adolescent-arv/statin-therapy-people-hiv
Visseren FLJ, Mach F, Smulders YM, Carballo D, Koskinas KC, Bäck M, et al. 2021 ESC Guidelines on cardiovascular disease prevention in clinical practice. Eur Heart J 2021; 42: 3227-3337.
European AIDS Clinical Society. EACS Guidelines Version 12.1, October 2024. En: https://www.eacsociety.org/guidelines/eacs-guidelines/
Fichtenbaum CJ, Malvestutto CD, Watanabe MG, Davies Smith E, Ribaudo HJ, McCallum S, et al. Effects of antiretrovirals on major adverse cardiovascular events in the REPRIEVE trial: a longitudinal cohort analysis. Lancet HIV 2025; 12: e496-e505
Hoffmann U, Lu MT, Foldyna B, Zanni MV, Karady J, Taron J, et al. Assessment of Coronary Artery Disease with Computed Tomography Angiography and Inflammatory and Immune Activation Biomarkers Among Adults with HIV Eligible for Primary Cardiovascular Prevention. JAMA Netw Open 2021; 4: e2114923.
https://doi.org/10.1161/CIRCIMAGING.116.005777;
https://doi.org/10.1097/HCO.0000000000000917;
https://doi.org/10.1097/QAI.0000000000001795;
https://doi.org/10.2991/artres.k.200314.002.