Documento de Prevención y Tratamiento de infecciones oportunistas y otras coinfecciones en pacientes con infección por VIH (Actualización 2021)
ACTUALIZACIÓN 2021
Notas de la Versión:
Previa
LISTADO DE ABREVIATURAS
AINE |
Antiinflamatorios no esteroideos |
CMV |
Citomegalovirus |
CV |
Carga viral |
CrAg |
Antígeno criptocócico |
F18-FDG PET/CT Fluorin-18 |
Fluorodeoxiglucosa tomografía por emisión de positrones |
HTLV-1 |
Virus linfotrópico T humano tipo 1 |
IO |
Infecciones oportunistas |
ITL |
Infección tuberculosa latente |
ITS |
Infecciones de transmisión sexual |
IV |
Intravenosa |
LAMP |
Loop-mediated isothermal amplification |
LBA |
Lavado broncoalveolar |
LCR |
Líquido cefalorraquídeo |
LMP |
Leucoencefalopatía multifocal progresiva |
MAC |
Mycobacterium avium complex |
MNT |
Micobacterias no tuberculosas |
PCR |
Reacción de la polimerasa en cadena |
PIC |
Presión intracraneal |
PL |
Punción lumbar |
PVVIH |
Personas viviendo con VIH |
RM |
Resonancia magnética nuclear |
SNC |
Sistema nervioso central |
SK |
Sarcoma de Kaposi |
SPECT |
Tomografía computarizada por emisión de fotón único |
SRI |
Síndrome de reconstitución inmune |
TAR |
Tratamiento antirretroviral |
TC |
Tomografía axial computerizada |
TCAR |
Tomografía axial computerizada alta resolución |
TMP/SMX |
Trimetoprim / sulfametoxazol |
VHH8 |
Virus herpes humano 8 |
VHS |
Virus del herpes simple |
VIH |
Virus inmunodeficiencia humana |
VJC |
Virus John Cunningham |
VO |
Vía oral |
VPH |
Virus papiloma humano |
VPH-AR |
Virus papiloma humano de alto riesgo |
VVZ |
Virus varicela zoster |
RESUMEN
Las infecciones oportunistas (IO) continúan siendo una causa importante de morbilidad y mortalidad en los pacientes con infección por VIH. Generalmente estas se producen por un retraso en el diagnóstico del VIH y antes de iniciar el tratamiento antirretroviral (TAR). La inmunodepresión grave, puede ser consecuencia del fracaso virológico al TAR o más frecuentemente debido a una falta de adherencia a este.
El presente artículo actualiza las recomendaciones de prevención y tratamiento de diferentes infecciones oportunistas en pacientes con infección por VIH: parasitarias, fúngicas, víricas, micobacterianas, bacterianas y parasitosis u hongos importados.
ABSTRACT
Despite the huge advance that antiretroviral therapy (ART) represents for the prognosis of infection by the human immunodeficiency virus (HIV), opportunistic infections (OI) continue to be a cause of morbidity and mortality in HIV-infected patients. These are generally caused by a delay in the diagnosis of HIV and before starting antiretroviral treatment. Severe immunosuppression can be the consequence of virological failure to ART or more frequently due to lack of adherence.
This article updates the recommendations for the prevention and treatment of different opportunistic infections in HIV-infected patients: infections by parasites, fungi, viruses, mycobacteria, bacteria and imported parasites or fungus.
1. INTRODUCCIÓN
Las infecciones oportunistas (IO) han sido la principal causa de morbilidad y mortalidad de los pacientes infectados por el VIH desde el inicio de la epidemia 1 . Estas se producen años después de haber adquirido la infección por VIH y sin tratamiento antirretroviral (TAR), la muerte acontece en uno o dos años 2 . Una infección oportunista se define como aquella infección que se produce con más frecuencia o con mayor gravedad como consecuencia de una inmunodepresión severa debida a la infección por VIH 3 .
La instauración de pautas eficaces de profilaxis primaria y secundaria frente a las principales IO fue el primer avance significativo para los enfermos, permitiendo un significativo descenso de mortalidad incluso antes de la era del TAR 4 . Con la introducción del TAR se asistió a un notable cambio en la evolución de la infección por VIH, con una drástica reducción de la mortalidad y de la incidencia de enfermedades oportunistas 56 . Sin embargo, continuamos en la actualidad, observando casos de IO en varias situaciones: pacientes que no se sabían infectados por el VIH y que debutan con una IO; enfermos que no reciben TAR por voluntad propia o por falta de seguimiento por el sistema de salud; falta de adherencia al TAR y excepcionalmente por un fracaso de este 7 .
Se estima que aproximadamente un 25% de sujetos infectados por el VIH en España o están sin diagnosticar, o no tienen seguimiento apropiado en el sistema de salud o no tienen una carga viral del VIH indetectable 8 . La tasa de presentadores tardíos con cifras de CD4+ por debajo de 350 o 200 células/μl (45% y 25% respectivamente) es inaceptablemente alta9. Las oportunidades perdidas y el retraso diagnóstico de la infección por VIH son uno de los motivos que justifican que sigamos atendiendo a pacientes con IO. Aún se declaran en nuestro país aproximadamente 400 eventos definitorios de SIDA al año 9 . Por otro lado, una proporción muy importante del retraso diagnóstico recae en población inmigrante9, que puede presentar infecciones importadas para las que hay menos alerta y sospecha clínica en nuestro entorno. Por estos motivos, el tratamiento de las IO sigue siendo un tema de plena actualidad en la asistencia de los pacientes infectados por el VIH.
La neumonía por Pneumocystis jirovecii, la tuberculosis y la candidiasis esofágica son las tres IO más incidentes en España (alcanzando el 60% de todas las IO diagnosticadas en nuestro país). Debemos recordar que a pesar del TAR, hay infecciones que continúan siendo más frecuentes en sujetos infectados por el VIH que en la población general, aún con una mejora en las cifras de linfocitos CD4+, como por ejemplo la neumonía neumocócica, el herpes zóster o la tuberculosis. Por tanto, una correcta evolución inmuno- virológica no evita completamente una IO. Hay que subrayar que, además del tratamiento
y las profilaxis de las IO, es necesario enfatizar la adherencia al calendario vacunal. Por último, no hay que olvidar que, una vez diagnosticada una IO, es preciso iniciar el TAR en las dos primeras semanas del diagnóstico salvo alguna excepción como la meningitis criptocócica por aumento de la mortalidad 10 .
En este documento se actualizan las recomendaciones previas de prevención y tratamiento de infecciones oportunistas en pacientes infectados por el VIH 11 . La fuerza de la recomendación y gradación de las pruebas que la sustentan se basan en una modificación de los criterios de la Infectious Diseases Society of America 12 . Según estos criterios cada recomendación debe ofrecerse siempre (A), en general (B) u opcionalmente (C) y ello basado en los datos obtenidos a partir de uno o más ensayos clínicos aleatorizados con resultados clínicos o de laboratorio (I), de uno o más ensayos no aleatorizados o datos observacionales de cohortes (II) o de la opinión de expertos (III).
Por limitaciones editoriales de espacio se recomienda consultar las tablas donde se detallan las diferentes pautas de profilaxis y tratamiento, tanto preferentes como alternativas, y sus dosis correspondientes, así como las recomendaciones de vacunación en los pacientes con infección por VIH.
Tablas:
Bibliografía:
Gottlieb M, Schroff R, Schanker H, et Pneumocystis carinii pneumonia and mucosal candidiasis in previously healthy homosexual men: evidence of a new acquired cellular immunodeficiency. N Engl J Med. 1981;305:1425-31.
Bacchetti P, Osmond D, Chaisson RE, et al. Survival patterns of the first 500 patients with AIDS in San Francisco. J Infect Dis. 1988;157(5):1044-1047.
Kaplan JE, Masur H, Holmes KK, et USPHS/IDSA guidelines for the prevention of opportunistic infections in persons infected with human immunodeficiency virus: introduction. USPHS/IDSA Prevention of Opportunistic Infections Working Group. Clin Infect Dis. 1995;21 Suppl 1:S1-11.
Lane CH, Laughon B, Falloon J, et al. Recent advances in the management of AIDS- related opportunistic infections. Ann Intern Med 1994;120:945-55.
Detels R, Munoz A, McFarlane G, et Effectiveness of potent antiretroviral therapy on time to AIDS and death in men with known HIV infection duration. Multicenter AIDS Cohort Study Investigators. JAMA. 1998;280(17):1497-1503.
Mocroft A, Vella S, Benfield TL, et al. Changing patterns of mortality across Europe in patients infected with HIV-1. EuroSIDA Study Lancet. 1998;352(9142):1725-1730.
Caro-Murillo AM, Castilla J, Pérez-Hoyos S, et Spanish cohort of naive HIV-infected patients (CoRIS): rationale, organization and initial results. Enferm Infecc Microbiol Clin. 2007; 25(1):23-31.
Unidad de vigilancia del VIH y conductas de Estimación del Continuo de Atención del VIH en España, 2016. Madrid: Centro Nacional de Epidemiología – Instituto de Salud Carlos III / Plan Nacional sobre el Sida – Dirección General de Salud Pública, Calidad e Innovación; 2019.
Unidad de Vigilancia de VIH, ITS y hepatitis. Vigilancia Epidemiológica del VIH y sida en España 2019: Sistema de Información sobre Nuevos Diagnósticos de VIH y Registro Nacional de Casos de Plan Nacional sobre el Sida - D.G. de Salud Pública / Centro Nacional de Epidemiología - ISCIII. Madrid; Nov 2020.
Zolopa A, Andersen J, Powderly W, et Early antiretroviral therapy reduces AIDS progression/death in individuals with acute opportunistic infections: a multicenter randomized strategy trial. PLoS One. 2009;4(5):e5575.
Iribarren JA, Rubio R, Aguirrebengoa K, et al. Executive summary: Prevention and treatment of opportunistic infections and other coinfections in HIV-infected patients: May 2015. Enferm Infecc Microbiol Clin. 2016 Oct;34(8):517-23.
Kish Guide to development of practice guidelines. Clin Infect Dis 2001;32:841-4.
2. INFECCIONES POR PARÁSITOS
Toxoplasma gondii
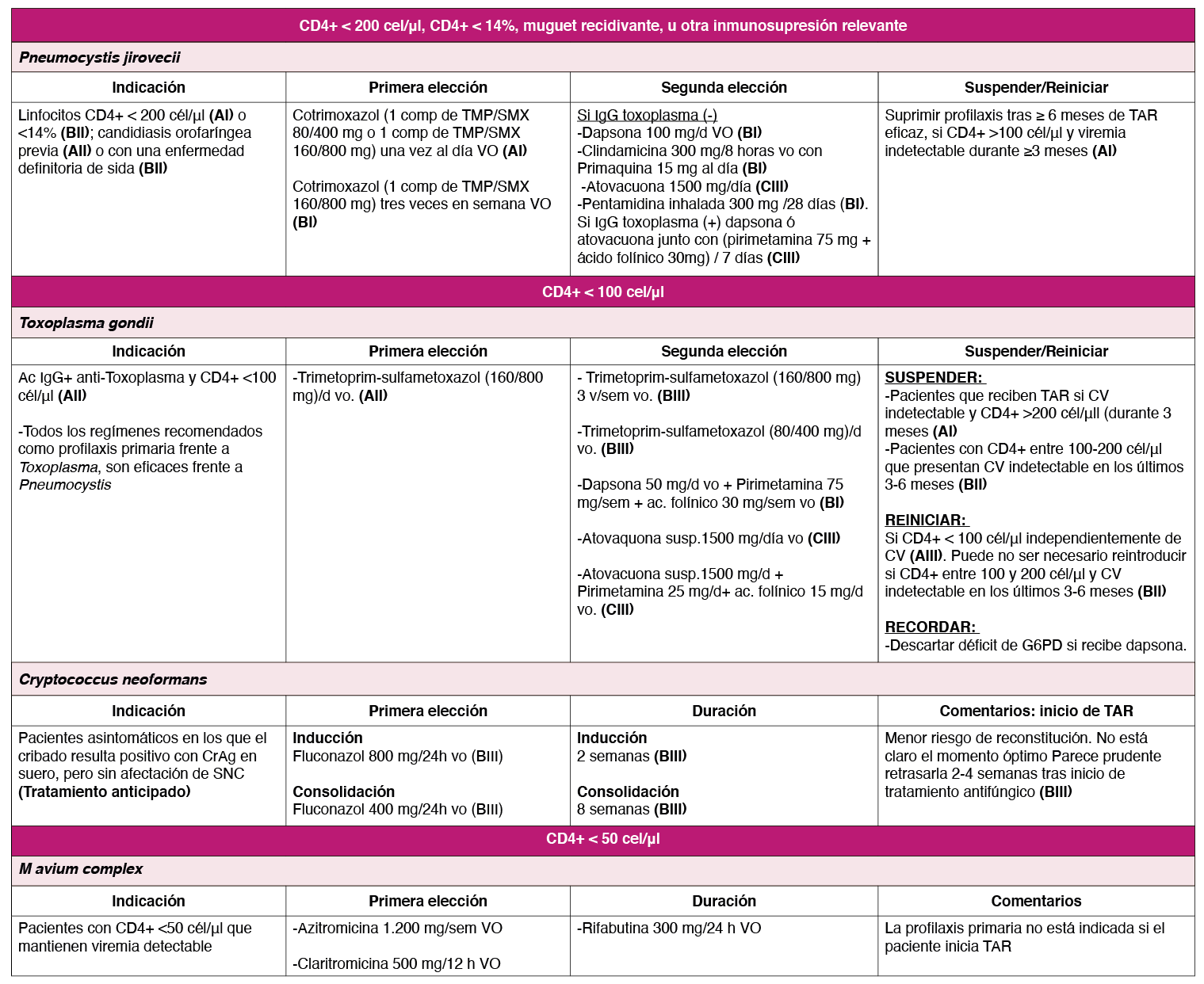
El toxoplasma es un protozoo intracelular de distribución mundial que puede reactivarse en los pacientes con infección por VIH que presentan CD4+ <100 células/μl 1 . La seroprevalencia mundial se estima en torno al 44,2% 2 . Está indicado realizar una serología IgG anti-toxoplasma en la valoración inicial (BIII) y si es positiva realizar profilaxis primaria en pacientes con linfocitos CD4+ < 100 células/μl3 (AII) Tabla 1.
El principal síndrome clínico es la encefalitis focal (cefalea, síntomas neurológicos focales, a veces fiebre y/o crisis comiciales). Las manifestaciones extra cerebrales, no son habituales. La ausencia de IgG anti-toxoplasma positiva no descarta completamente el diagnóstico, aunque lo hace improbable 1 . La TC o RM muestran lesiones múltiples en sustancia gris cortical o ganglios basales, con captación en anillo y edema 1 . Las pruebas de neuroimagen funcional suelen ser negativas (SPECT con Talio o 18-FDG PET/CT). La PCR en LCR tiene alta especificidad (96-100%) pero baja sensibilidad (50%) 4 , sobre todo cuando el paciente ya ha iniciado el tratamiento. Se puede realizar un diagnóstico de presunción en pacientes con clínica, serología y radiología compatible y CD4+ < 100 células/μl, en los que se iniciará un tratamiento empírico con las pautas recomendadas 56 (Tabla 2). En caso de empeoramiento en la primera semana o no mejoría tras el 10º-14º día de tratamiento se deberá plantear un diagnóstico alternativo y valorar la realización de una biopsia cerebral 56 . Los corticoides se utilizarán en caso de efecto masa o edema y los fármacos anticomiciales sólo si hay antecedentes de crisis 56 . Se debe realizar profilaxis secundaria para evitar las recurrencias 6 Tabla 1.
El síndrome de reconstitución inmune relacionado con el toxoplasma es poco frecuente (≈5%). Se observa un empeoramiento paradójico de los síntomas y signos, y en algunos casos puede desenmascarar una toxoplasmosis no diagnosticada. El tratamiento no está estandarizado7, pero incluye mantener el tratamiento antitoxoplasma, el TAR y valorar añadir o incrementar la dosis de corticoides, así como plantearse la posibilidad de diagnósticos alternativos.
Leishmania spp
La prevención de la exposición al parásito debe realizarse mediante el control sanitario de los perros en áreas zoonóticas (área mediterránea, donde predomina L. infantum); así como evitando la exposición a estos animales (especialmente por parte de pacientes
inmunodeprimidos) (CIII), las picaduras por flebotomos y el uso compartido de material para el consumo de drogas por vía intravenosa. No existen medidas de profilaxis primaria8.
El tratamiento de elección de la leishmaniasis visceral es la anfotericina B liposomal (AII), o complejo lipídico 9 , en pautas diversas Tabla 1. Se consideran fármacos alternativos la anfotericina B deoxicolato (toxicidad renal), los antimoniales pentavalentes (toxicidad pancreática y cardiaca) y la miltefosina (BII). En pacientes infectados por el VIH no se ha demostrado la eficacia terapéutica de paromomicina (CIII). Un ensayo clínico etíope pequeño ha demostrado mayor eficacia de la combinación de miltefosina con anfotericina liposomal en pacientes con fracaso al tratamiento de primera línea o con otros fármacos 10 (CI). Tras tratar la infección aguda se administrará profilaxis secundaria (BII). Las formulaciones lipídicas de anfotericina B (liposomal [AII] o complejo lipídico [BI]), son también de elección 89 . En caso de recidiva (frecuente en pacientes muy inmunodeprimidos) es preciso repetir el tratamiento inicial, usar otro régimen o la combinación de los fármacos anteriormente descritos 810 .
No existe recomendación segura sobre la retirada de la profilaxis secundaria frente a Leishmania 12 . Aunque algunos expertos recomiendan mantenerla indefinidamente, puede plantearse suspenderla en pacientes sin recidiva durante 6 meses, que mantienen linfocitos CD4+ >200-350 células/μl y carga viral indetectable durante >3 meses y, si es posible, con PCR para Leishmania en sangre o antígeno en orina negativos 11 (CIII). La profilaxis debe reiniciarse si la cifra de linfocitos CD4+ desciende a < 200 células/μl 8912 (CIII)
Cryptosporidium spp. e Isospora belli
Cryptosporidiosis
Cryptosporidium spp. es un protozoo intracelular de distribución cosmopolita. La enfermedad en humanos suele estar causada por subespecies de Cryptosporidium parvum. Afecta especialmente a pacientes con linfocitos CD4+ <100 células/μl 13 . La trasmisión es fecal-oral a partir de una persona o animal infectado o de agua y alimentos contaminados. Se han descrito brotes en relación con viajes y actividades recreativas acuáticas. Es posible la trasmisión persona a persona durante el coito anal-oral.
Existen formas asintomáticas, pero típicamente produce diarrea moderada/grave acompañada de malestar general, náuseas, dolor abdominal o febrícula. En pacientes inmunodeprimidos cursa con diarrea crónica y malabsorción. En un 10-
30% de los pacientes con SIDA se han descrito manifestaciones extraintestinales (colecistitis, colangitis, hepatitis, y pancreatitis) 13 .
El diagnóstico se basa en la visualización por microscopía, tras concentración y tinción de Ziehl-Neelsen modificada de los ooquistes, inmunofluorescencia directa o reacción en cadena de la polimerasa 14 . Para las dos últimas existen test comerciales disponibles con sensibilidad y especificidad del 100% en el caso de la PCR múltiple frente al 87.5% de sensibilidad y el 100% de especificidad de la inmunofluorescencia 14 . La PCR no distingue quistes viables de no viables por lo que debe ser interpretada en el contexto clínico.
La profilaxis y tratamiento se muestran en la Tabla 1 1517 . Diversos metaanálisis muestran ausencia de respuesta a nitazoxamida o paromomicina si no se acompañan de TAR 1617 . Debe tenerse en cuenta que la nitazoxamida es una medicación extranjera. La prevención se basa en evitar el consumo de alimentos o agua contaminadas 15 .
Cystoisosporiasis
La cystoisosporiasis, anteriormente conocida como isosporiasis, es una parasitosis producida por el protozoo Cystoisospora belli 18. Aunque su distribución es cosmopolita es más frecuente en zonas tropicales y subtropicales. Desde la generalización del TAR es muy infrecuente, apareciendo sobre todo en inmigrantes subsaharianos 19 .
El mecanismo de transmisión es fecal-oral por la ingesta de ooquistes bien persona a persona o por la ingesta de agua o alimentos contaminados. Clínicamente produce una diarrea acuosa acompañada de dolor abdominal, náuseas, vómitos y febrícula. Es junto con Dientamoeba fragilis el único protozoo capaz de producir eosinofilia. En pacientes con infección VIH con linfocitos CD4+ <50 células/μl puede producir diarrea crónica con deshidratación grave, alteraciones iónicas y síndrome de malabsorción 20 . Se han descrito casos de colecistitis alitiásica.
La emisión de quistes en las heces es intermitente y obliga a la realización de al menos tres muestras de heces separadas por un intervalo mínimo de veinticuatro horas. El diagnóstico se basa en la visualización de los ooquistes mediante microscopia óptica tras una técnica de concentración y teñido de las heces con tinción de Kinyoun o auramina.
El tratamiento de elección es el cotrimoxazol Tabla 1 durante diez días (AII) ampliado a 3-4 semanas en caso de persistencia de la clínica (BIII) junto con medidas de
soporte general 21 . Aunque no existen datos suficientes que avalen la profilaxis primaria existen trabajos que vinculan el uso de cotrimoxazol como profilaxis para el Pneumocystis jirovecci con una disminución significativa de las infecciones por Cystoisospora belli.
Tablas:

Bibliografía:
Porter SB, Sande MA. Toxoplasmosis of the central nervous system in the acquired immunodeficiency syndrome. N Engl J Med 1992; 327:1643.
Safarpour H, Cevik M, Zarean M, et Global status of Toxoplasma gondii infection and associated risk factors in people living with HIV. AIDS. 2020 Mar 1;34(3):469-474.
Bucher HC, Griffith L, Guyatt GH, et Meta-analysis of prophylactic treatments against Pneumocystis carinii pneumonia and toxoplasma encephalitis in HIV-infected patients. J Acquir Immune Defic Syndr Hum Retrovirol. 1997 Jun 1;15(2):104-14.
Nogui FL, Mattas S, Turcato Júnior G, et al. Neurotoxoplasmosis diagnosis for HIV-1 patients by real-time PCR of cerebrospinal Braz J Infect Dis. 2009 Feb;13(1):18-23.
Luft BJ, Hafner R, Korzun AH, et al. Toxoplasmic encephalitis in patients with the acquired immunodeficiency syndrome. Members of the ACTG 077p/ANRS 009 Study Team. N Engl J Med. Sep 30 1993;329(14):995-1000.
Katlama C, De Wit S, O'Doherty E, et Pyrimethamine-clindamycin vs. pyrimethamine- sulfadiazine as acute and long-term therapy for toxoplasmic encephalitis in patients with AIDS. Clin Infect Dis. 1996 Feb;22(2):268-75.
Martin-Blondel G, Alvarez M, Delobel P, et al. Toxoplasmic encephalitis IRIS in HIV- infected patients: a case series and review of the J Neurol Neurosurg Psychiatry. Jun 2011;82(6):691-693.
Iribarren JA, Rubio R, Aguirrebengoa K et al; GESIDA/SEIMC Writing Committee. Executive summary: Prevention and treatment of opportunistic infections and other coinfections in HIV-infected patients: May 2015. Enferm Infecc Microbiol Clin. 2016 Oct;34(8):517-23. doi: 10.1016/j.eimc.2016.02.025. Epub 2016 Apr 5. PMID: 27056581.
Panel on Opportunistic Infections in Adults and Adolescents with HIV. Guidelines for the prevention and treatment of opportunistic infections in adults and adolescents with
Diro E, Blesson S, Edwards T, Ritmeijer K, Fikre H, Admassu H, Kibret A, Ellis SJ, Bardonneau C, Zijlstra EE, Soipei P, Mutinda B, Omollo R, Kimutai R, Omwalo G, Wasunna M, Tadesse F, Alves F, Strub-Wourgaft N, Hailu A, Alexander N, Alvar A randomized trial of AmBisome monotherapy and AmBisome and miltefosine combination to treat visceral leishmaniasis in HIV co-infected patients in Ethiopia. PLoS Negl Trop Dis. 2019 Jan 17;13(1):e0006988.
Molina I, Fisa R, Riera C, et Ultrasensitive Real-Time PCR for the clinical management of visceral leishmaniasis in HIV-infected patients. Am J Trop Med Hyg 2013; 89:105-110.
European AIDS Clinical Society (EACS). Guidelines for the management of people living with HIV (PLWH) in Europe. Version 11.0. EACS; October 2021. Disponible en: https://www.eacsociety.org/media/final2021eacsguidelinesv11.0_oct2021.pdf
Wang RJ, Li JQ, Chen YC, et Widespread occurrence of Cryptosporidium infections in patients with HIV/AIDS: epidemiology, clinical feature, diagnosis, and therapy. Acta Trop. 2018;187:257-263.
Adeyemo FE, Singh G, Reddy P et al Methods for the detection of Cryptosporidium and Giardia: From microscopy to nucleic acid based tools in clinical and environmental regimes. Acta Trop. 2018 ;184:15-28.
Abubakar I, Aliyu SH, Arumugam C, et Prevention and treatment of cryptosporidiosis in immunocompromised patients. Cochrane Database Syst Rev. 2007 ;1:CD004932.
Amadi B, Mwiya M, Sianongo et al. High dose prolonged treatment with nitazoxanide is not effective for cryptosporidiosis in HIV positive Zambian children: a randomised controlled trial. BMC Infect Dis. 2009 ;9:195.
Hewitt RG, Yiannoutsos CT, Higgs ES, et Paromomycin: no more effective than placebo for treatment of cryptosporidiosis in patients with advanced human immunodeficiency virus infection. AIDS Clinical Trial Group. Clin Infect Dis. 2000;31:1084- 92.
Centers for Disease Control and Prevention. https://www.cdc.gov/ dpdx/cystoisosporiasis/index.html (Último acceso on May 24, 2021).
Lagrange-Xélot M, Porcher R, Sarfati C, , et al. Isosporiasis in patients with HIV infection in the highly active antiretroviral therapy era in France. HIV Med. 2008; 9: 126-
DeHovitz JA, Pape JW, Boncy M, et Clinical manifestations and therapy of Isospora belli infection in patients with the acquired immunodeficiency syndrome. N Engl J Med. 1986;315:87-90.
Verdier RI, Fitzgerald DW, Johnson WD, et al. Trimethoprim-sulfamethoxazole compared with ciprofloxacin for treatment and prophylaxis of Isospora belli and Cyclospora cayetanensis infection in HIV-infected patients. A randomized, controlled trial. Ann Intern Med. 2000;132:885-888.
Ebrahimzadeh A, Bottone Persistent diarrhea caused by Isospora belli: therapeutic response to pyrimethamine and sulfadiazine. Diagn Microbiol Infect Dis. Oct 1996;26:87- 89.
3. INFECCIONES POR HONGOS
3.1. Pneumocystis jirovecii
3.2. Cryptococcus neoformans
3.3. Candida albicans
3.4. Aspergillus fumigatus
3.5. Microsporidiasis
Pneumocystis jirovecii
Las tres causas más importantes de infección pulmonar por hongos son Pneumocystis jirovecii, Aspergillus spp. y Cryptococcus spp. Los factores de mal pronóstico identificados en un meta-análisis son la edad avanzada, el sexo femenino, el retraso en el diagnóstico, la insuficiencia respiratoria, los tumores sólidos, la lactato deshidrogenasa elevada, la albúmina sérica baja y la coinfección bacteriana, por Aspergillus o por citomegalovirus 1 . La elevación de la deshidrogenasa láctica (LDH> 500 U/L) aumenta en presencia de daño pulmonar, y puede ser una prueba complementaria útil (CIII).
El tratamiento recomendado es el cotrimoxazol intravenoso con ajuste de dosis en caso de disfunción renal 2 (AI). Los corticosteroides tienen un beneficio demostrado en los individuos infectados por el VIH con enfermedad grave. En la enfermedad grave, los corticosteroides deben iniciarse en un plazo de 72 horas 3 (AI). Debería esperarse una mejora en 5-7 días. Deben realizarse investigaciones (lavado broncoalveolar) para detectar infecciones respiratorias concomitantes si no hay mejora clínica o empeoran los síntomas 24 (BII). Se recomienda asociar equinocandinas 45 o cambiar a tratamientos alternativos si hay toxicidad por cotrimoxazol o fracaso del tratamiento (CIII). El uso de ácido folínico no es aconsejable porque puede aumentar el fracaso terapéutico (CIII).
Para profilaxis primaria y secundaria se recomienda ver la (Tabla 1).
El riesgo de síndrome inflamatorio de reconstitución inmunitaria (SRI) en los pacientes que reciben tratamiento para ambas infecciones se ha considerado bajo.
La secuenciación del genoma debería servir para identificar nuevas dianas para el tratamiento, lo que es especialmente importante con la aparición de la enfermedad resistente. La presencia de una mutación en un caso que no responde, o que se está deteriorando, ciertamente apoya la necesidad de cambiar la terapia 5 .
No es necesario aislamiento respiratorio de los pacientes, pero se debería evitar que compartan habitación con personas inmunodeprimidas que no reciben profilaxis.
Cryptococcus neoformans
C.neoformans es un hongo encapsulado de distribución universal con importante poder patógeno en PVVIH en estadio avanzado (CD4+ <100 células/μl) sin TAR. La prevalencia de infección en estos pacientes en España es ≈7% 6 , aunque el uso de TAR ha disminuido la incidencia de enfermedad sintomática. No está indicada la profilaxis primaria en nuestro medio, pero sí el cribado para un diagnóstico precoz en pacientes asintomáticos con recuentos de CD4+ <100 células/μl 7 . La criptococosis se presenta como meningitis subaguda, con cefalea, fiebre y malestar general, además de sintomatología por elevación de presión intracraneal (Pic): letargia, alteraciones conductuales, trastornos visuales. La criptococosis pulmonar se manifiesta con tos, disnea y alteraciones radiológicas (consolidación lobar, infiltrados nodulares o intersticiales bilaterales). Es rara la afectación pulmonar aislada en PVVIH, que normalmente presentarán formas diseminadas (lesiones cutáneas, infiltración de médula ósea, hígado, próstata…) o meningitis concomitante, que debe buscarse activamente, aunque el paciente esté asintomático.
El diagnóstico precoz es clave para reducir la morbi-mortalidad, al iniciarse tratamiento antifúngico que evitará la meningitis 8 . Por ello, debe determinarse el antígeno de criptococo (CrAg) en plasma/suero en todos los pacientes con CD4+ <100 células/μl (AII) 67 . Si resulta positivo se realizará una punción lumbar (PL) para descartar infección del SNC. La meningitis criptocócica se diagnostica mediante determinación de CrAg en líquido cefalorraquídeo (LCR), visualización directa del hongo (tinción con tinta china), PCR o cultivo de LCR (que permite conocer la sensibilidad a antifúngicos).
Aquellos pacientes con CrAg positivo en plasma/suero que no presentan afectación del SNC (LCR negativo para CrAg) deben recibir tratamiento anticipado con fluconazol a las dosis indicadas en la (Tabla 1)(BIII).
El tratamiento de la meningitis criptocócica consiste en 3 fases 7 : inducción (2 semanas, siempre y cuando haya mejoría clínica y se negativice el cultivo del LCR), consolidación (siguientes 8 semanas) y, posteriormente, mantenimiento o profilaxis secundaria, que debe prolongarse mínimo un año, con posibilidad de retirar el antifúngico tras ese tiempo si han pasado al menos 3 meses con CD4+ >100 células/μl y carga viral indetectable (BII) 9 . Los fármacos de elección se muestran en la (Tabla 1). Pueden requerirse PL repetidas o derivación del LCR para controlar la PIC. Está contraindicado el uso de esteroides para el control de la PIC, por asociarse a peor pronóstico (AI). Se recomienda diferir el TAR entre 4-6 semanas (AI) por el mayor riesgo de mortalidad asociado a su inicio precoz 10 , probablemente por reconstitución inmune. En la (Tabla 1) se especifica el tratamiento de las formas extrameníngeas.
Candida albicans
La mayoría de las infecciones por Candida spp. en personas con VIH están causadas por Candida albicans. Las formas clínicas más frecuentes son las candidiasis de mucosas orofaríngea, esofágica y vulvo-vaginal.
La candidiasis orofaríngea se observa con gran frecuencia en pacientes con recuento de linfocitos CD4+ inferior a 200 células/μl y se considera un marcador clínico de inmunodepresión avanzada. El diagnóstico es clínico y no se requiere el cultivo salvo en caso de sospecha de resistencia a antifúngicos. La candidiasis esofágica se presenta habitualmente con cifras más bajas de linfocitos CD4+ y es una de las enfermedades definitorias de sida. La endoscopia digestiva permite confirmar el diagnóstico y descartar otras formas de esofagitis (p. ej por CMV). Aunque la candidiasis vulvo-vaginal no indica obligatoriamente inmunodepresión, las mujeres con VIH pueden tener episodios más agresivos y recurrencias más frecuentes, especialmente en casos de inmunodepresión avanzada.
La prevención primaria de las infecciones por Candida spp. no está indicada debido a la escasa morbimortalidad, alta eficacia del tratamiento y al riesgo de selección de resistencia a los antifúngicos (AIII).
El tratamiento de elección de la candidiasis oral y orofaríngea es fluconazol (AI) y como alternativas itraconazol o posaconazol (BI). En el caso de afectación exclusivamente orofaríngea se puede utilizar un tratamiento tópico con clotrimazol o miconazol (BI) o bien nistatina en solución (BII)1112.
La candidiasis esofágica requiere tratamiento sistémico. El tratamiento de elección es fluconazol (AI), por vía oral o intravenosa en función de la severidad de los síntomas y la dificultad para la toma de fármacos por vía oral1112. También puede utilizarse itraconazol por vía oral (AI) y, como alternativas (en caso de resistencia o toxicidad), voriconazol (BI), isavuconazol (BI), anfotericina B (BI) o equinocandinas (BI), si bien se ha reportado mayor frecuencia de recidiva con equinocandinas en comparación con fluconazol11, 1314. Si no se consigue respuesta al tratamiento inicial se recomienda estudiar otras posibles causas y/o descartar resistencia a los fármacos empleados.
La candidiasis vulvo-vaginal puede tratarse en la mayoría de los casos con pautas cortas de fluconazol (AII) o itraconazol (BII) por vía oral o de forma tópica con clotrimazol o miconazol (AII). Los episodios más severos o recurrentes deben tratarse con pautas de mayor duración.
La profilaxis secundaria no está recomendada. En casos de recidivas muy frecuentes se puede utilizar tratamiento supresor con fluconazol (diario en caso de esofagitis, tres veces por semana en caso de candidiasis oral o vulvo-vaginal) y deberá descartarse resistencia a azoles.
Aspergillus fumigatus
Aunque pueden darse casos de infección invasora por Aspergillus fumigatus en personas con VIH severamente inmunodeprimidas, su incidencia es baja y aparece habitualmente asociada a otros factores de riesgo como neutropenia, tratamiento corticoideo u otras infecciones oportunistas concomitantes.
La prevención primaria no está recomendada.
El tratamiento de la aspergilosis invasora es similar al de otros pacientes inmunodeprimidos y depende de la gravedad del cuadro clínico.
El tratamiento de elección es voriconazol (AI) o isavuconazol (AI) y como alternativas pueden utilizarse anfotericina B liposomal (AII), posaconazol (BII) o equinocandinas (BII). La duración del tratamiento no está bien establecida. Se recomienda un mínimo de 6-12 semanas y debe individualizarse en función de la duración de la inmunodepresión, localización de la enfermedad y evolución clínica. Debe mantenerse, al menos, hasta alcanzar una cifra de linfocitos CD4+ > 200 células/μl 1516 .
Microsporidiasis
Los microorganismos del género Microsporidia se clasificaron inicialmente como protozoos, pero han sido reclasificados como hongos 17 . Son de distribución cosmopolita y la mayoría de las infecciones sintomáticas ocurren en pacientes con infección por VIH con linfocitos CD4+ <100 células/μl, aunque su frecuencia ha disminuido con la generalización del TAR18 . La infección se adquiere por ingesta o inhalación de las esporas mediante la ingesta de agua o alimentos contaminados, persona a persona o por contacto con animales.
Las especies que afectan al hombre con mayor frecuencia son el Enterocytozoon bieneusi, seguido de Encephalitozoon spp., especialmente Encephalitozoon intestinalis. Clínicamente lo más frecuente es la aparición de diarrea que conduce a la malabsorción, pero también puede producir encefalitis, infección ocular, sinusitis, miositis e infección
diseminada. E. bieneusi se asocia con malabsorción, diarrea y colangitis. E. cuniculi se asocia con hepatitis, encefalitis y enfermedad diseminada. E. intestinalis se asocia con diarrea, infección diseminada y queratoconjuntivitis superficial. Anncaliia, Vittaforma y Trachipleistophora se asocian con queratoconjuntivitis. Trachipleistophora está asociado con encefalitis y enfermedad diseminada.
El diagnóstico se basa en la detección por microscopía o por técnicas de detección genómica de las esporas en heces, fluidos corporales o biopsias tisulares. En el caso de la microscopía debe utilizarse una tinción de tricrómico modificada que presenta una sensibilidad del 64% y una especificidad del 100%. Para el diagnóstico de especie es necesaria la microscopía electrónica. Se han desarrollado reacciones en cadena de la polimerasa y LAMP con una sensibilidad del 100% y una especificidad del 97.9% pero no están disponibles comercialmente 1920 .
El tratamiento se muestra en la (Tabla 1) 21 . Debe tenerse en cuenta que la fumagilina es medicación extranjera.
Tablas:

Bibliografía:
Liu, Y.; Su, L.; Jiang, S.J.; Qu, H. Risk factors for mortality from Pneumocystis carinii pneumonia (PCP) innon-HIV patients: A meta-analysis. Oncotarget 2017, 8, 59729–59739.
Guidelines for the Prevention and Treatment of Opportunistic Infections in HIV-Infected Adults and Available online: http://aidsinfo.nih.gov/contentfiles/lvguidelines/ adult_oi.pdf
Wang, I.; Liang, H.; Ye, L.I.; Jiang, J.; Liang, B.; Huang, J. Adjunctive corticosteroids for the treatment of Pneumocystis jirovecii pneumonia in patients with HIV: A meta-analysis. Exp. Ther. Med. 2016, 11, 683–687.
Yu-Shan Huang , Chun-Eng Liu , Shih-Ping Lin et al. Echinocandins as alternative treatment for HIV-infected patients with Pneumocystis pneumonia. AIDS 2019 Jul 1;33(8):1345-1351. doi: 10.1097/QAD.0000000000002207.
White, P.L.; Backx, M.; Barnes, R.A. Diagnosis and management of Pneumocystis jirovecii infection. Expert Rev.Anti. Infect. Ther 2017, 15, 435–447.
Pérez-Jacoiste Asín MA, Bisbal O, Iribarren JA, Pérez-Rivilla A, Mican R, Dronda F, et al. Cryptococcal infection in HIV-infected patients with CD4+ T-cell counts under 100/
European AIDS Clinical Society (EACS). Guidelines for the management of people living with HIV (PLWH) in Europe. Version 11.0. EACS; October 2021. Disponible en: https:// eacsociety.org/media/final2021eacsguidelinesv11.0_oct2021.pdf Última consulta 4 de noviembre de 2021.
Temfack E, Bigna JJ, Luma HN, Spijker R, Meintjes G, Jarvis JN, et al. Impact of routine cryptococcal antigen screening and targeted pre-emptive fluconazole therapy in antiretroviral naive HIV-infected adults with less than 100 CD4 cells/mL: a systematic review and meta-analysis. Clin Infect Dis 2018;66:1122e32.
Mussini C, Pezzotti P, Miró JM, Martínez E, de Quirós JC, Cinque P, et Discontinuation of maintenance therapy for cryptococcal meningitis in patients with AIDS treated with highly active antiretroviral therapy: an international observational study. Clin Infect Dis 2004; 38: 565-71.
Eshun‐Wilson I, Okwen MP, Richardson M, Bicanic Early versus delayed antiretroviral treatment in HIV‐positive people with cryptococcal meningitis. Cochrane Database Syst Rev. 2018; 2018: CD009012.
Pappas PG, Kauffman CA, Andes DR, et al. Clinical practice guideline for the management of candidiasis: 2016 updateby the Infectious Diseases Society of Clin Infect Dis. 2016;62(4):e1-50.
Vazquez JA. Optimal management of oropharyngeal and esophageal candidiasis in patients living with HIV infection. HIV AIDS (Auckl). 2010;2(1):89-101.
Krause DS, Simjee AE, van Rensburg C, et al. A randomized, double-blind trial of anidulafungin versus fluconazole forthe treatment of esophageal candidiasis. Clin Infect Dis. 2004;39(6):770-775.
de Wet N, Llanos-Cuentas A, Suleiman J, et al. A randomized, double-blind, parallel- group, dose-response study of micafungin compared with fluconazole for the treatment of esophageal candidiasis in HIV-positive patients. Clin Infect Dis. 2004;39(6):842-849.
Patterson TF, Thompson GR 3rd, Denning DW, et al. Practice Guidelines for the Diagnosis and Management of Aspergillosis: 2016 Update by the Infectious Diseases Society of America. Clin Infect Dis. 2016 Aug 15;63(4):e1-e60.
Garcia-Vidal C, Ana Alastruey Izquierdo A, Aguilar Guisado M, et al. Documento de consenso del GEMICOMED perteneciente a la Sociedad Española de Enfermedades Infecciosas y Microbiología Cínica (SEIMC) sobre el tratamiento de las infecciones invasoras producidas por Enferm Infecc Microbiol Clin (Engl Ed). 2019 Oct;37(8):535-541. Disponible en: https://seimc.org/contenidos/gruposdeestudio/gemicomed/dcientificos/ documentos/gemicomed-dc-2018-Management_of_aspergillosis.pdf.
Heyworth Genetic aspects and environmental sources of microsporidia that infect the human gastrointestinal tract. Trans R Soc Trop Med Hyg. 2017;111:18-21.
Wang ZD, Liu Q, Liu HH, Li S, Zhang L, Zhao YK, et Prevalence of Cryptosporidium, microsporidia and Isospora infection in HIV-infected people: a global systematic review and meta-analysis. Parasit Vectors. 2018;11:28.
Saigal K, Khurana S, Sharma A, Sehgal R, Malla Comparison of staining techniques and multiplex nested PCR for diagnosis of intestinal microsporidiosis. Diagn Microbiol Infect Dis. 2013 ;77:248-9
Nur Suaidah Nasarudin S, Shazalina Zainudin N, Bernadus M, Mohd Nawi A, Hanafiah A, Osman E. Loop-mediated isothermal amplification for rapid molecular detection of Enterocytozoon bieneusi in faecal specimens. J Med Microbiol. 2015 ;64:1329-1334.
Molina JM, Tourneur M, Sarfati C, Chevret S, de Gouvello A, Gobert JG, Balkan S, Derouin F; Agence Nationale de Recherches sur le SIDA 090 Study Group. Fumagillin treatment of intestinal microsporidiosis. N Engl J Med. 2002 ;346:1963-9.
4. INFECCIONES POR VIRUS
4.1. Virus del herpes simple (VHS-1 y VHS-2)
4.2. Virus varicela zóster (VVZ)
4.3. Virus herpes humano tipo 8 (VHH-8)
4.4. Citomegalovirus (CMV)
4.5. Virus JC
4.6. Virus papiloma humano
Virus del herpes simple (VHS-1 y VHS-2)
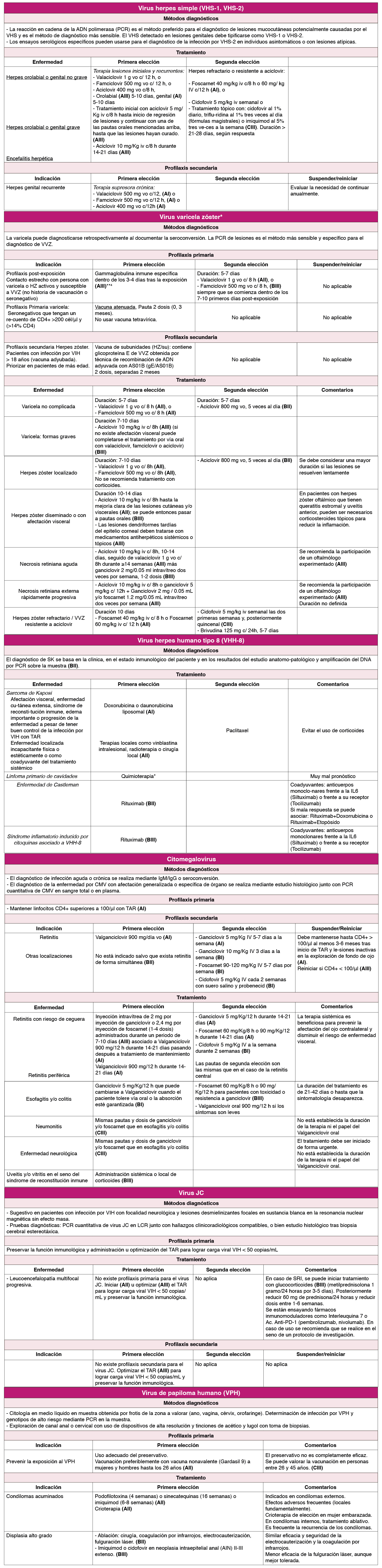
Las formas clínicas más frecuentes son el herpes genital 1 , generalmente producido por VHS-2, y el orolabial, habitualmente debido al VHS-1. En el herpes genital son frecuentes las recurrencias. La infección por VHS-2 aumenta el riesgo de contraer el VIH de dos a tres veces 23 , y en pacientes coinfectados puede aumentar los niveles de ARN del VIH en la sangre y las secreciones genitales 4 .
El tratamiento es más eficaz si se inicia precozmente, en el período prodrómico o en el primer día tras la aparición de las lesiones. El tratamiento antivírico con análogos de nucleósidos es eficaz, seguro y bien tolerado, y en el caso del herpes genital, podría reducir el riesgo de transmisión del VIH-1.
El tratamiento de la encefalitis herpética es similar al empleado en los pacientes inmunocompetentes, y debe iniciarse cuando se sospeche el diagnóstico.
La esofagitis y la proctitis herpética responden al aciclovir intravenoso pudiéndose, tras estabilidad clínica, continuar por vía oral.
Ha de considerarse la posibilidad de resistencia a los antivíricos cuando las lesiones no mejoran después de 7-10 días de un tratamiento correcto y confirmarlo mediante un estudio de sensibilidad.
La profilaxis primaria no está recomendada (AIII) 5 y no existen vacunas. La profilaxis secundaria debe plantearse ante recurrencias graves o para reducir su número. La terapia supresora anti-VHS para prevenir la transmisión de VHS-2 a parejas susceptibles no se recomienda para personas con coinfección por VIH/VHS-2 que no están en TAR (AI) 6 . No hay evidencia sobre el uso de terapia supresora para prevenir la transmisión genital de VHS-1.
Virus varicela zóster (VVZ)
La incidencia de infecciones por VVZ en los pacientes infectados por el VIH es mucho mayor que en la población general y pueden aparecer con cualquier cifra de linfocitos CD4+, pero el riesgo de enfermedad es mayor con recuentos <200 células/μl. Las infecciones por VVZ en adultos sin causas conocidas de inmunodepresión, obligan a descartar
infección por VIH. Las formas de presentación y el curso clínico de las infecciones por VVZ pueden modificarse en pacientes con inmunodepresión avanzada. El TAR reduce la incidencia de herpes zóster, aunque el riesgo de este sigue siendo tres veces mayor que en la población general7 y aumenta en el período de 6 meses inmediatamente posterior al inicio del TAR 8 .
El tratamiento del herpes zóster localizado va dirigido a prevenir la diseminación de la infección, acortar la duración de los síntomas y reducir el riesgo de neuralgia postherpética. No se recomienda el uso de corticoides.
En casos de varicela, herpes zóster diseminado o con afectación visceral es preferible iniciar aciclovir IV. La necrosis retiniana aguda suele responder también al tratamiento con aciclovir IV a dosis altas, que puede continuarse con valaciclovir vo (BIII). En algunos casos puede considerarse también tratamiento intravítreo (BII).
La resistencia del VVZ a los análogos de nucleósidos es excepcional, pero puede existir y responde a foscarnet 9 .
En general no deben emplearse corticoides. Considerar su uso, si no existe contraindicación, con especial cuidado en inmunodeprimidos severos, en: zóster oftálmico (tópico y sistémico), necrosis retiniana aguda, síndrome de Ramsay Hunt y vasculopatía por VVZ, a 1 mg/kg/día 5 días, dosis decrecientes hasta completar 2-3 semanas.
Recientemente se ha aprobado la indicación de la vacuna recombinante frente al herpes zóster para la prevención del herpes zóster y la neuralgia postherpética en personas adultas que viven con el VIH 10 .
Virus herpes humano tipo 8 (VHH-8)
Aconsejamos consultar la Guía de práctica clínica de la infección por herpes virus humano tipo 8 en la población con infección por VIH de GeSIDA 11 .
El VHH-8 se transmite por saliva (mecanismo principal), relaciones sexuales, transfusión y trasplante de órgano sólido.
Se ha asociado a los siguientes procesos clínicos: Sarcoma de Kaposi (SK)
Linfoma primario de cavidades (LPC) Enfermedad de Castleman multicéntrica (ECM)
Linfoma de células B grandes en el contexto de ECM Síndrome inflamatorio inducido por citoquinas (KICS) Síndrome hemofagocítico, pancitopenia, hepatitis
Manifestaciones inespecíficas como fiebre, astenia, linfadenopatía, exantema y diarrea
El Sarcoma de Kaposi (SK) es un tumor mesenquimal originado por el virus herpes humano tipo-8 (VHH-8) que, de forma global, continúa siendo el más frecuente en la población con infección por VIH. Tras la utilización del tratamiento antirretroviral (TAR), su frecuencia ha disminuido y su pronóstico ha mejorado. Sin embargo, el riesgo de desarrollar SK continúa siendo más elevado en las personas con VIH y recuento normal de linfocitos CD4+ que en la población general. Los mecanismos inmunopatológicos por los que hasta un 15% de los pacientes con carga viral indetectable y linfocitos CD4+ > 300 células/μl pueden desarrollar enfermedad progresiva permanecen todavía desconocidos.
El tratamiento, además de un TAR óptimo, puede precisar tratamiento con doxorrubicina o daunorrubicina liposomal si existe afectación visceral o cutánea muy extensa. Se debe evitar el uso de corticoides.
Citomegalovirus (CMV)
La enfermedad por CMV ocurre fundamentalmente por reactivación en pacientes con linfocitos CD4+ <50 células/μl. La retinitis es la forma clínica más grave y antes de la generalización del TAR era la causa más frecuente de ceguera. No está clara la indicación de funduscopias periódicas en pacientes severamente inmunosuprimidos desde la implantación del TAR, pero es importante insistir al paciente que consulte precozmente si tiene algún tipo de alteración de la agudeza visual (BIII). Otras manifestaciones clínicas menos frecuentes son colitis, esofagitis, neumonitis, polirradiculoneuritis y encefalitis 12 .
El diagnóstico de la retinitis se establece mediante oftalmoscopia indirecta debiendo iniciarse tratamiento intravítreo y con valganciclovir oral sin esperar confirmación mediante PCR o antigenemia. La PCR cuantitativa ofrece como ventajas una mejor estandarización, necesitar menos volumen de sangre y ser útil en pacientes con leucopenia. Sin embargo, una PCR negativa en suero no excluye enfermedad por CMV y su positividad tampoco indica afectación de órgano diana. La serología como técnica diagnóstica en el inmunocomprometido tiene muy poco valor 13 , pero se recomienda en grupos con bajas tasas de seroprevalencia de cara a evitar exposiciones de riesgo en caso de ser seronegativos (BIII).
El síndrome de reconstitución inmune se manifiesta en forma de uveítis o vitritis y puede
aparecer tan pronto como a las 4 semanas de iniciar el TAR. Excepcionalmente se han descrito casos hasta 4 años después. Se presenta con mayor frecuencia en pacientes profundamente inmunodeprimidos que con el TAR alcanzan rápidamente cifras de CD4+ superiores a 100 células/μl. Aunque este punto es controvertido, en la actualidad no está demostrada la utilidad del tratamiento preventivo durante 2 semanas, antes de iniciar TAR, en aquellos pacientes con linfocitos CD4+ inferiores a 50 células/μl con carga viral de CMV detectable1415.
El tratamiento de las otras localizaciones debe individualizarse según la localización y gravedad del proceso ( Tabla 3 ) . Es de elección el ganciclovir IV en los casos graves y con dificultades de ingesta oral y el valganciclovir oral por su eficacia, seguridad y comodidad de administración en el resto 9 .
Virus JC
La leucoencefalopatía multifocal progresiva (LMP) es una entidad neurológica producida por el virus JC (poliomavirus), que característicamente presenta, en resonancia nuclear magnética, desmielinización focal con lesiones en sustancia blanca sin efecto masa.
La presentación clínica es variada y generalmente se producen déficits neurológicos focales y progresivos. Las lesiones desmielinizantes pueden afectar cualquier zona del sistema nerviosos central (SNC).
El tratamiento antirretroviral (TAR) es la única intervención, hasta la fecha, que puede prevenir la LMP y mejorar la respuesta celular mediada por linfocitos T. Ello es esencial en el control de la replicación intracerebral del virus JC.
Una baja carga viral en LCR y obtener una respuesta inmune celular específica en sangre y LCR frente al virus JC se asocian a una favorable evolución clínica y un mejor pronóstico. La mortalidad es mayor en aquellos pacientes con linfocitos CD4+ <100 células/μl.
No existe una terapia específica y eficaz frente a LMP. Se han utilizado numerosos fármacos, empíricamente o en ensayos clínicos, sin que ninguno haya demostrado suficiente efectividad y actualmente no se recomiendan (citarabina, cidofovir, mirtazapina, topotecan, mefloquina, interferón alfa entre otros). En los pacientes con infección por VIH- 1 la mejor opción es iniciar (AII) u optimizar (AIII) el TAR con pautas eficaces y potentes que presenten buena penetración en SNC 16 .
El pronóstico ha mejorado tras la introducción del TAR, pasando de supervivencias de 10%
al año al 40%-75% anual, aunque una proporción importante de pacientes presentarán secuelas neurológicas 17 . En los pacientes que experimentan un deterioro clínico o radiológico con TAR, sugestivo de síndrome de reconstitución inmune, los estudios observacionales sugieren administrar corticoesteroides sin interrumpir TAR (BIII) 918 .
Virus papiloma humano
La infección por el virus de papiloma humano (VPH), que es la infección de transmisión sexual (ITS) más frecuente en el mundo, suele ser una infección asintomática. Las personas que viven con VIH tienen mayor prevalencia de infección por VPH, junto con una reducción en el aclaramiento del virus. Esto supone un mayor riesgo de neoplasias (cérvix, ano, vulva, vagina, pene, cavidad oral y orofaringe) 19 que la población general.
Algunos pacientes desarrollan condilomas (sobre todo genotipos 6 y 11 del VPH) 20 . La neoplasia intraepitelial es una displasia de alto grado, precursora del cáncer (los genotipos más frecuentes son 16, 18 y 31) 21 .
La citología en medio líquido es la técnica de cribado de elección, acompañada de la determinación de la presencia de VPH de alto riesgo (AR) mediante PCR, lo que aumenta la sensibilidad. Se debe realizar colposcopia/anoscopia de alta resolución con toma de biopsias ante la presencia de lesiones citológicas y/o presencia de VPH-AR. La utilidad de otros marcadores biológicos como el p16, Ki67, la metilación o los exosomas en personas VIH+ está en estudio actualmente 22 .
El tratamiento de las lesiones de alto grado se realiza mediante ablación (cirugía, coagulación por infrarrojos, electrocauterización, fulguración láser), o utilizando tratamientos tópicos (imiquimod, ácido tricloroacético, cidofovir o podofilotoxina).
El preservativo previene (aunque no totalmente) la infección por VPH. Hay tres vacunas frente al VPH comercializadas. Se recomienda la vacunación de personas VIH+ antes de los 26 años. Algunas Comunidades Autónomas han extendido la indicación de vacunación hasta los 45 años, aunque ante la falta de datos en este rango de edad se debe individualizar esta recomendación 23 .
Para más información se recomienda consultar el Documento de consenso sobre diagnóstico y tratamiento de las infecciones de transmisión sexual elaborado por GESIDA (capítulo 6) 24 .
Tablas:
Bibliografía:
Grupo de expertos del Grupo de Estudio de SIDA de la SEIMC (GESIDA), Secretaría del Plan Nacional sobre el SIDA (SPNS), Grupo de Estudio de ITS ITS de la SEIMC (GEITS), Grupo Español para la Investigación de las Enfermedades de Transmisión Sexual de la Academia Española de Dermatología y Venerología y de la Sociedad Española de Infectología Pediátrica (SEIP). Documento de consenso sobre diagnóstico y tratamiento de las infecciones de transmisión sexual en adultos, niños y adolescentes (actualización de marzo 2017). Available at: https://gesida-seimc.org/wp-content/uploads/2017/06/ Documento_de_consenso_sobre_diagnostico_y_tratamiento_de_las_infecciones_de_ pdf
Wald A, Link Risk of human immunodeficiency virus infection in herpes simplex virus type 2-seropositive persons: a meta-analysis. J Infect Dis. 2002;185(1):45-52. Available at: https://www.ncbi.nlm.nih.gov/pubmed/11756980
Looker KJ, Elmes JAR, Gottlieb SL, et al. Effect of HSV-2 infection on subsequent HIV acquisition: an updated systematic review and meta-analysis. Lancet Infect Dis. 2017;17(12):1303-1316. Available at: https://www.ncbi.nlm.nih.gov/pubmed/28843576
Nagot N, Ouedraogo A, Konate I, et Roles of clinical and subclinical reactivated herpes simplex virus type 2 infection and human immunodeficiency virus type 1 (HIV-1)-induced immunosuppression on genital and plasma HIV-1 levels. J Infect Dis. 2008;198(2):241-
Available at: https://www.ncbi.nlm.nih.gov/pubmed/18593294
Celum C, Hong T, Cent A, et al. Herpes simplex virus type 2 acquisition among HIV-1- infected adults treated with tenofovir disoproxyl fumarate as part of combination antiretroviral therapy: results from the ACTG A5175 PEARLS J Infect Dis. 2017;215(6):907-910. Available at: https://www.ncbi.nlm.nih.gov/pubmed/28453835
Mujugira A, Magaret AS, Celum C, et al. Daily acyclovir to decrease herpes simplex virus type 2 (HSV-2) transmission from HSV-2/HIV-1 coinfected persons: a randomized controlled trial. J Infect Dis. 2013;208(9):1366-1374.
Grabar S, Tattevin P, Selinger-Leneman H, et al. Incidence of herpes zoster in HIV- infected adults in the combined antiretroviral therapy era: results from the FHDH-ANRS CO4 cohort. Clin Infect Dis. 2015;60(8):1269-1277. Disponible en: https://www.ncbi.nlm. gov/pubmed/25601456
Domingo P, Torres OH, Ris J, Vazquez G. Herpes zoster as an immune reconstitution disease after initiation of combination antiretroviral therapy in patients with human immunodeficiency virus type-1 Am J Med. 2001;110(8):605-609. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/11382367
Panel on Opportunistic Infections in Adults and Adolescents with HIV. Guidelines for the prevention and treatment of opportunistic infections in adults and adolescents with HIV: recommendations from the Centers for Disease Control and Prevention, the National Institutes of Health, and the HIV Medicine Association of the Infectious Diseases Society of America. Disponible en: http://aidsinfo.nih.gov/contentfiles/lvguidelines/adult_oi.pdf. Consultado el 29 de junio de 2021 (páginas BB1-12; tablas 2, 6-8].
Centers for Disease Control and Prevention. FDA approval of an extended period for administering VariZIG for postexposure prophylaxis of MMWR Morb Mortal Wkly Rep. 2012;61(12):212. Available at: https://www.ncbi.nlm.nih.gov/pubmed/22456121
Panel de expertos del Grupo de Estudio de SIDA (GeSIDA). Guía de práctica clínica de la infección por herpes virus humano tipo 8 en la población con infección por VIH, Versión 1.0. – Enero de 2021. Accesible en: https://gesida-seimc.org/wp-content/ uploads/2021/03/2021_Guia_GeSIDA.pdf
Wons J, Kempen J, Garweg JG. HIV-induced Retinitis. Ocul Immunol Inflamm. 2020 Nov 16;28(8):1259-1268.
Zhao M, Zhuo C, Li Q, Liu L. Cytomegalovirus (CMV) infection in HIV/AIDS patients and diagnostic values of CMV-DNA detection across different sample types. Ann Palliat Med. 2020 Sep;9(5):2710-2715.
Mattioni S, Pavie J, Porcher R, et al. Assessment of the efficacy and safety of pre- emptive anti-cytomegalovirus (CMV) therapy in HIV-infected patients with CMV Int J STD AIDS. 2015 Apr;26(5):306-12.
Albasanz-Puig A, Suanzes P, Esperalba J, el al. Low frequency of cytomegalovirus (CMV) disease despite high prevalence of CMV viraemia in patients with advanced HIV infection: a clinical and immunological 48-week follow-up study. HIV Med. 2021 May 17.
Berenguer J, Miralles P, Arrizabalaga J, et al. Clinical course and prognostic factors of progressive multifocal leukoencepha-lopathy in patients treated with highly active antiretroviral therapy. Clin Infect Dis 2003; 36:1047-1052.
Fanjul F, Riveiro-Barciela M, González J, et al. Evaluation of progressive multifocal leukoencephalopathy treatments in a Spanish cohort of HIV-infected patients: do protease inhibitors improve survival regardless of central nervous system penetration-effectiveness (CPE) score? HIV Med 2013; 14: 321-325.
European AIDS Clinical Society (EACS). Guidelines for the management of people living with HIV (PLWH) in Europe. Version 11.0. EACS; October 2021. Disponible en: https://www.eacsociety.org/media/final2021eacsguidelinesv11.0_oct2021.pdf
Bouvard V, Baan R, Straif K, et al. A review of human carcinogens--Part B: biological agents. Lancet Oncol 2009;10(4):321-322.
Forman D, de Martel C, Lacey CJ, et al. Global burden of human papillomavirus and related diseases. Vaccine 2012; 30 Suppl 5: F12-23.
Alemany L, Saunier M, Alvarado-Cabrero I, et Human papillomavirus DNA prevalence and type distribution in anal carcinomas worldwide. Int J Cancer 2015; 136: 98-107.
Clinton LK, Miyazaki K, Ayabe A, et al. The LAST guidelines in clinical practice: implementing recommendations for p16 use. Am J Clin Pathol 2015; 144: 844-9.
Wilkin TJ, Chen H, Cespedes MS, et al. A randomized, placebo-controlled trial of the quadrivalent HPV vaccine in HIV-infected adults aged 27 years or older: AIDS Clinical Trials Group protocol A5298. Clin Infect Dis 2018;67(9):1339-1346.
Documento de consenso sobre diagnóstico y tratamiento de las infecciones de transmisión sexual en adultos, niños y adolescentes. GESIDA, SPNS, GEITS, SEIP. Marzo de 2017. Disponible en: https://gesida-seimc.org/wp-content/uploads/2017/06/ Documento_de_consenso_sobre_diagnostico_y_tratamiento_de_las_infecciones_de_ pdf
5. INFECCIÓN POR MICOBACTERIAS
Mycobacterium tuberculosis
A todos los pacientes VIH se les debe realizar cribado de infección tuberculosa latente (ITL) (AII). El riesgo de progresión a tuberculosis se reduce con el TAR y el tratamiento de la ITL 1 preferiblemente con isoniacida durante 6-9 meses (AI), pudiendo utilizar como alternativa isoniazida y rifampicina durante 3 meses (AII) o rifampicina durante 4 meses (BIII).
La enfermedad tuberculosa sensible se trata con 4 fármacos durante dos meses en fase de inducción y con 2 fármacos durante 4 meses más en fase de mantenimiento; esta fase se prolongará hasta 7 meses en pacientes con cavitación, CD4 <100 células/μl o cultivo positivo al finalizar la inducción en ausencia de resistencias. El tratamiento de la tuberculosis en adultos VIH se expone ampliamente en el documento de consenso elaborado por GeSIDA/SEIMC, cuya consulta se recomienda 2 .
Se recomienda iniciar TAR independientemente de la cifra de CD4+ en las dos primeras semanas, una vez comprobada la tolerancia al tratamiento antituberculoso (AI). En el caso de la meningitis tuberculosa, se recomienda demorar el inicio del TAR al menos 4 semanas, eligiendo el momento óptimo en función de la situación clínica del paciente (A1) 3 . Para evitar el síndrome de reconstitución inmune (SRI) se recomienda administrar prednisona en pacientes con CD4 <100 células/μl (40 mg/día durante 2 semanas seguido de 20 mg/día 2 semanas más) 4 (AI). Si el paciente desarrolla SRI se recomienda mantener TAR y antituberculosos, añadiendo AINEs en los casos leves, y prednisona en los moderados-graves (1,5 mg/Kg/día durante 2 semanas + 0,75 mg/Kg/día 2 semanas más en pacientes que reciben rifampicina y 1mg/kg/día y 0,5mg/kg día respectivamente en los que no reciben rifampicina) 5 (AII).
Para la elección de TAR más adecuado se recomienda descartar potenciales interacciones (por ejemplo, en http://www.hiv-druginteractions.org), y revisar las recomendaciones respecto al TAR consensuadas por GeSIDA/PNS, que se actualizan anualmente.
Mycobacterium avium complex
La profilaxis primaria no está indicada si el paciente inicia TAR 6 (CII). Se debe valorar en pacientes con CD4+ <50 células/μl que mantienen viremia detectable, una vez descartada enfermedad por Mycobacterium avium complex (MAC). Los fármacos utilizados son
claritromicina 7 o azitromicina 8 (AI).
El diagnóstico se basa en la sospecha clínica y el aislamiento mediante cultivo de muestras habitualmente estériles. Se han utilizado técnicas de diagnóstico molecular, aunque su utilidad está por determinar 9 .
Antes de comenzar tratamiento, se debe descartar infección tuberculosa.
La enfermedad por MAC requiere tratamiento combinado (B1) con un macrólido (claritromicina en primer lugar o azitromicina si interacciones o intolerancia) asociado a etambutol. Se puede añadir rifabutina en casos de enfermedad severa, si se sospecha resistencia a macrólidos/etambutol, o en pacientes con inmunodeficiencia severa (CD4+
<50 células/μl), alta carga bacteriana o ausencia de TAR.
Se puede considerar quinolonas o amikacina como tercer fármaco cuando no se puede utilizar rifabutina, o como cuarto fármaco en pacientes con enfermedad severa, diseminada o refractaria.
Tras completar 12 meses de tratamiento, se mantendrá azitromicina/claritromicina y etambutol hasta que el paciente tenga CD4+ >100 células/μl y CV del VIH indetectable durante al menos 6 meses, a modo de profilaxis secundaria o tratamiento de mantenimiento.
Si el paciente ya estaba tomando TAR en el momento del diagnóstico del MAC, se debe continuar, y optimizar si mantiene viremia detectable. Si no lo estaba tomando, debe iniciarlo pronto tras iniciar el tratamiento del MAC (B1). Es necesario revisar si existen interacciones farmacológicas (http://www.hiv-druginteractions.org).
El SRI asociado a MAC se relaciona con la existencia de otras enfermedades oportunistas, mayor reducción de la CV del VIH y sintomatología más prolongada 10 .
Otras micobacterias
El riesgo de desarrollar enfermedad por micobacterias no tuberculosas (MNT) se relaciona con el grado de inmunodeficiencia, siendo mayor con recuentos de CD4+ inferiores a 50 células/μl 11 .
La profilaxis primaria no está indicada si el paciente inicia TAR 12 (CII). Se debe valorar en pacientes con CD4+ <50 células/μl que mantienen viremia detectable, una vez descartada enfermedad por MAC. Los fármacos utilizados son claritromicina 13 o azitromicina 14 (AI).
El diagnóstico de certeza se establece cuando se aísla MNT en fluidos o tejidos estériles. Cuando se identifican en muestras no estériles, el diagnóstico depende de los hallazgos clínicos y radiológicos, y de la existencia de un diagnóstico diferencial alternativo.
Las MNT más frecuentes son las siguientes: Mycobacterium kansasii (es la MNT aislada más frecuentemente después de MAC), M. xenopi, M. hemophilum , M. fortuitum, M. chelonae. La experiencia con otras MNT más allá de Mycobacterium kansasii o MAC es limitada. No existen recomendaciones específicas en el paciente con infección VIH en cuanto a su tratamiento y prevención, por lo que se aplican las mismas que para otros grupos de pacientes.
Las decisiones terapéuticas deben ser individualizadas y basadas en el resultado del antibiograma. Para la elección de TAR más adecuado se recomienda consultar las posibles interacciones (http://www.hiv-druginteractions.org).
El SRI asociado a MNT tiene un amplio rango de presentaciones clínicas y de severidad, y su pronóstico a largo plazo es favorable en pacientes adherentes al TAR 15 .
Tablas:

Bibliografía:
Golub J, Pronyk P, Mohapi L, et al. Isoniazid preventive therapy, HAART and tuberculosis risk in HIV-infected adults in South Africa: a prospective cohort Jonathan. AIDS. 2009;23(5):631-636. oi:10.1097/QAD.0b013e328327964f.
Rivero A, Pulido F, et al. Recomendaciones de GeSIDA sobre el tratamiento de la tuberculosis en adultos infectados por el Virus de la Inmunodeficiencia Humana. https:// gesida-seimc.org/wp-content/uploads/2018/08/gesida_TB_en_VIH.pdf. Published
Consolidated guidelines on HIV prevention, testing, treatment, service delivery and monitoring: recommendations for a public health approach. Geneva: World Health Organization; 2021. Licence: CC BY-NC-SA 3.0 IGO.
Meintjes G, Stek C, Blumenthal L, et al. Prednisone for the Prevention of Paradoxical Tuberculosis-Associated IRIS. N Engl J Med. 2018;379(20):1915-1925.
Meintjes G, Wilkinson R, Morroni C, et al. Randomized placebo-controlled trial of prednisone for paradoxical TB-associated immune reconstitution inflammatory
Jung Y, Song KH, Choe PG, et Incidence of disseminated Mycobacterium avium-complex infection in HIV patients receiving antiretroviral therapy with use of Mycobacterium avium-complex prophylaxis. Int J STD AIDS. 2017;28(14):1426-1432. doi:10.1177/0956462417713432.
Pierce M, Crampton S, Henry D, et al. A Randomized Trial Of Clarithromycin As Prophylaxis Against Disseminated Mycobacterium avium Complex Infection In Patients With Advanced Acquired Immunodeficiency New Engl J o f Med. 1996;335:384- 391.
Havlir D, Dubé M, Sattler F, et Prophylaxis against disseminated Mycobacterium avium complex with weekly azitromycin, daily rifabutin, or both. N Engl J Med. 1996;335(6):392- 398.
Marochi-Telles JP, Muniz R, Sztajnbok J, Oliveira AC Disseminated mycobacterium avium on HIV/AIDS: Historical and current literature review. AIDS Rev. 2020;22(1):9-15. doi:10.24875/AIDSRev.20000104.
Smibert OC, Trubiano JA, Cross GB, Hoy JF. Short Communication: Mycobacterium avium Complex Infection and Immune Reconstitution Inflammatory Syndrome Remain a Challenge in the Era of Effective Antiretroviral Therapy. AIDS Res Hum Retroviruses. 2017;33(12):1202-1204.
Alvarez-Uria G, Falcó V, Martín-Casabona N, et al. Non-tuberculous mycobacteria in the sputum of HIV-infected patients: Infection or Int J STD AIDS. 2009;20:193-
doi:10.1258/ijsa.2008.008300.
Jung Y, Song KH, Choe PG, et al. Incidence of disseminated Mycobacterium avium-complex infection in HIV patients receiving antiretroviral therapy with use of Mycobacterium avium-complex prophylaxis. Int J STD AIDS. 2017;28(14):1426-1432. doi:10.1177/0956462417713432.
Pierce M, Crampton S, Henry D, et A randomized trial of clarithromycin as prophylaxis against disseminated infection in patients with advanced acquired immunodeficiency syndrome. New Engl J o f Med. 1996;335:384-391.
Havlir D, Dubé M, Sattler F, et al. Prophylaxis against disseminated Mycobacterium avium complex with weekly azitromycin, daily rifabutin, or N Engl J Med. 1996;335(6):392-
Phillips P, Bonner S, Gataric N, et al. Nontuberculous mycobacterial immune reconstitution syndrome in HIV-infected patients: Spectrum of disease and long-term folow-up. Clin Infect Dis. 2005;41(10):1483-1497. doi:10.1086/497269.
6. INFECCIONES BACTERIANAS
6.1. Bacterias intestinales (Salmonella, Shigella y Campylobacter)
6.2.
6.3. Bacterias respiratorias
6.4. Otras bacterias (Bartonella y Rhodococcus)
Bacterias intestinales (Salmonella, Shigella y Campylobacter)
Las tasas de infección intestinal por enterobacterias son al menos 10 veces superiores entre las personas infectadas por VIH, disminuyendo con el TAR, que ha sido la medida más efectiva en la reducción de su incidencia. El riesgo es mayor en individuos con SIDA o CD4+ <200 células/μl. Los pacientes con inmunosupresión grave tienen mayor riesgo de bacteriemia recidivante por Salmonella 12 .
Las principales vías de transmisión son la ingestión de alimentos o agua contaminada, y la exposición fecal-oral. Los pacientes con CD4+ <200 células/μl deben tomar precauciones basadas en el lavado de manos (Tabla 1). La profilaxis antimicrobiana para prevenir infecciones intestinales bacterianas no está recomendada, tampoco para los viajeros (AIII). En casos seleccionados puede considerarse profilaxis con fluoroquinolonas o rifaximina, similar a la utilizada en viajeros inmunosuprimidos, dependiendo del grado de inmunosupresión, la región del viaje y la duración de este (CIII). En embarazadas o pacientes que ya están tomando profilaxis con cotrimoxazol, esta puede ofrecer cierta protección como alternativa a las fluoroquinolonas o la rifaximina (BIII) 1 .
El tratamiento empírico de la diarrea en pacientes infectados por el VIH no difiere del recomendado para pacientes inmunocompetentes. En el caso de estar indicado iniciarlo, el ciprofloxacino es la primera elección (AIII), ceftriaxona o cefotaxima iv son alternativas razonables (BIII). El tratamiento debe ajustarse en base a los resultados microbiológicos. Es frecuente la resistencia a fluoroquinolonas en Campylobacter jejuni en el Sudeste Asiático, debiéndose tener en cuenta a la hora de prescribir un tratamiento empírico. Las indicaciones de tratamiento específico se recogen en la (Tabla 1) 1 .
La diarrea por Clostridium difficille es común en personas con infección por VIH, especialmente en aquellas con CD4+ < 50 células/μl 4 . También debe recordarse la diarrea causada por otras infecciones oportunistas (MAI, CMV, TBC, Cystoisospora, etc) que serán revisadas en los epígrafes correspondientes1.
Bacterias respiratorias
Las recomendaciones de tratamiento de las infecciones bacterianas respiratorias (sinusitis, otitis, bronquitis y neumonía) en los pacientes que viven con VIH son similares a la población general 5 .
La neumonía bacteriana (NB) recurrente, definida por dos o más episodios durante un año, es una enfermedad definitoria de SIDA. Puede ocurrir con cualquier recuento de linfocitos CD4+. En pacientes en TAR con viremia controlada y CD4+ >350 células/μl el manejo es igual a las personas sin infección por VIH 5 . Aunque la NB ha disminuido con la introducción precoz del TAR, en el estudio START la incidencia de infecciones bacterianas fue 0.87/100 personas/año y el 40% fueron NB5. Streptococcus pneumoniae y Haemophilus spp. son la causa más frecuente de NB y las bacterias atípicas son poco habituales. P. aeruginosa y S. aureus aparecen en enfermedad avanzada (CD4+ < 50 células/μl) con factores de riesgo y en neumonías extensas y graves, sobre todo si son necrotizantes o cavitadas. S. pneumoniae y S. aureus pueden complicar una infección por la gripe previa6. La prueba rápida nasal de SAMR en entornos de alta prevalencia es muy útil para dirigir el tratamiento empírico en formas graves7. No se recomienda la determinación de procalcitonina para la toma de decisiones en pacientes VIH, por falta de evidencia. Las escalas pronósticas (PSI, CURB-65, ATS/IDSA) están validadas para predecir mortalidad en combinación con el recuento de CD4+8. No se recomienda el uso de rutina de la TAC para el diagnóstico, aunque puede ser útil el uso de la ecografía torácica. Se debe mantener alto el índice de sospecha de tuberculosis y evitar en ese caso el uso de fluoroquinolonas.
Las medidas generales recomendadas para prevenir NB son la higiene de manos, el abandono del tabaquismo (AI), del consumo de alcohol y de otras drogas (AI), el TAR eficaz (AII) y evitar el contacto estrecho con casos activos de infección respiratoria.
Múltiples estudios observacionales demuestran los beneficios de la Vacuna Neumocócica Polisacárida (VPP) en personas con VIH, sobre todo en la reducción de bacteriemia y enfermedad neumocócica invasora (ENI) que es 40 veces superior a la población general9. La Vacuna Neumocócica Conjugada VPC-7 ha demostrado un 74% de eficacia en ENI con clara evidencia en CD4+ <200 células/μl 9 (AI). VPC-7 ha sido sustituida por la VPC-13 valente. Otros estudios demostraron mayor respuesta inmunogénica con una dosis de VPC-7 seguida de otra dosis de VPP-23. Se recomienda, como en otros adultos inmunodeprimidos, la vacunación con pauta secuencial (VPC-13+VPP-23) con cualquier recuento de CD4+, comenzando con una dosis de VPC-13 (AI) 10 . Los pacientes con linfocitos CD4+ ≥200 células/μl deben recibir posteriormente una dosis de VPP-23, 8 semanas después (AI). En los pacientes con linfocitos CD4+ <200 células/μl puede emplearse la misma estrategia (CIII), pero es preferible aplazar la dosis de VPP-23 hasta alcanzar linfocitos CD4+ >200 células/μl y haber iniciado TAR (BIII) siendo preferible con una carga viral de VIH <100.000 cop/mL antes de la vacunación. La duración de la protección de VPP-23 es desconocida. Se recomienda re-vacunación tras ≥ 5 años de la primera dosis de VPP-23 (BIII) y no administrar más de 3 dosis de VPP-23 en toda la
vida, con una última dosis en ≥ 65 años. También es posible re-vacunar con VPC-13 a los que hayan recibido primero VPP-23 (AII) 9 .
Está indicada la vacunación anual frente a influenza con vacuna inactivada (AII). La vacuna atenuada está contraindicada (AIII). Pueden administrase en la misma visita ambas vacunas (influenza y neumococo).
La incidencia de infección por H. influenzae tipo B en adultos con VIH es baja por lo que no se recomienda la vacunación (BIII), salvo que se asocie asplenia anatómica o funcional.
La administración diaria de TMP/SMX como profilaxis de P. jirovecii reduce la frecuencia de las infecciones respiratorias bacterianas incluyendo neumococo, pero no está indicado su uso indiscriminado fuera de esta indicación (AIII), tampoco de claritromicina o azitromicina (AIII) 1 .
Otras bacterias (Bartonella y Rhodococcus)
Para prevenir la bartonelosis, los pacientes con infección por VIH y CD4+ < 100 células/μl, deben extremar las precauciones en su contacto con gatos (transmisores de B. henselae), y prevenir la infestación por piojos corporales (transmisores de B.quintana). La profilaxis primaria antibiótica no se recomienda (BIII)1 (Tabla 1).
Todos los pacientes con infección por VIH con bartonelosis deben recibir tratamiento antibiótico (AII). Eritromicina y doxiciclina son de elección para la angiomatosis bacilar (AB), peliosis hepática, bacteriemia y osteomielitis (AII). La duración debe ser ≥3 meses (AII)11. Consultar pautas detalladas en (Tabla 1).
En pacientes naïve con afectación en SNC u oftálmica, el TAR probablemente debe retrasarse hasta 2-4 semanas después de iniciado el tratamiento antibiótico (CIII). El síndrome de reconstitución inmune no se ha descrito en este contexto1.
Si se produce una recaída tras ≥3 meses de tratamiento, está indicado el tratamiento supresor con doxiciclina o un macrólido (AIII) 1 (Tabla 1).
Rhodococcus hoagii (R.equi, reclasificado) causa infección en inmunosuprimidos. La mejor prevención primaria en el VIH es el TAR 12 (Tabla 1).
Debe tratarse con al menos dos antibióticos activos, seleccionados según el estudio
de susceptibilidad, dado el riesgo de emergencia de resistencias (CII), al menos uno con actividad intracelular. Deben completarse ≥2 meses de tratamiento, prolongándose en casos seleccionados. En lesiones extensas, la resección quirúrgica asociada puede ser útil. El TAR debe iniciarse de forma precoz, siendo excepcional el síndrome de reconstitución inmune 13 (Tabla 1).
Se recomienda profilaxis secundaria en pacientes que permanecen inmunosuprimidos tras completar el tratamiento 13 (Tabla 1).
Tablas:

Bibliografía:
Panel on Opportunistic Infections in Adults and Adolescents with HIV. Guidelines for the prevention and treatment of opportunistic infections in adults and adolescents with HIV: recommendations from the Centers for Disease Control and Prevention, the National Institutes of Health, and the HIV Medicine Association of the Infectious Diseases Society of America. Available at http://aidsinfo.nih.gov/contentfiles/lvguidelines/adult_oi.pdf
Panel de expertos de GESIDA y Plan Nacional sobre el Documento de prevención y tratamiento de infecciones oportunistas y otras coinfecciones en pacientes con infección por VIH. Actualización mayo 2015.
Shane AL, Mody RK, Crump JA, et al. 2017 Infectious Diseases Society of America Clinical Practice Guidelines for the Diagnosis and Management of Infectious Diarrhea. Clinical Infectious Diseases. 2017;65(12):e45-e80. doi:10.1093/cid/cix669.
Haines CF, Moore RD, Bartlett JG, et al. Clostridium difficile in a HIV-infected cohort: incidence, risk factors, and clinical outcomes. Nov 13 2013;27(17):2799-2807. Available at http://www.ncbi.nlm.nih.gov/pubmed/23842125
O'Connor J, Vjecha MJ, Phillips AN, et al. Effect of immediate initiation of antiretroviral therapy on risk of severe bacterial infections in HIV-positive people with CD4 cell counts of more than 500 cells per ul: secondary outcome results from a randomised controlled Lancet HIV. 2017 Mar;4(3):e105-e112.
Lamas CC, Coelho LE, Grinsztejn BJ, et Community-acquired lower respiratory tract infections in HIV infected patients on antiretroviral therapy: predictors in a contemporary cohort study. Infection. 2017;45(6):801-809. Available at: https://www.ncbi.nlm.nih.gov/ pubmed/28660356
Parente DM, Cunha CB, Mylonakis E, et al. The clinical utility of methicillin-resistant staphylococcus aureus (MRSA) nasal screening to rule out MRSA pneumonia: a diagnostic meta-analysis with antimicrobial stewardship Clin Infect Dis . 2018;67(1):1-7. Available at: https://www.ncbi.nlm.nih.gov/pubmed/29340593
Almeida A, Almeida AR, Castelo Branco S, et CURB-65 and other markers of illness severity in community-acquired pneumonia among HIV-positive patients. Int J STD AIDS . 2016;27(11):998-1004. Available at:https://www.ncbi.nlm.nih.gov/pubmed/26394997
Recommended Immunization Schedule for Adults and Adolescents with HIV infection (Last updated June, 2021; last reviewed June ,2021).
French N, Gordon SB, Mwalukomo T, et A trial of a 7-valent pneumococcal conjugate vaccine in HIV-infected adults. N Engl J Med. 2010 Mar 4;362(9):812-22. doi: 10.1056/ NEJMoa0903029. PMID: 20200385; PMCID: PMC2873559.
Blanco JR, Raoult D. Enfermedades producidas por Bartonella spp. Enferm Infecc Microbiol Clin. 2005;23(5):313-320.
Gundelly P, Suzuki Y, Ribes JA, et al. Differences in Rhodococcus equi Infections Based on Immune Status and Antibiotic Susceptibility of Clinical Isolates in a Case Series of 12 Patients and Cases in the Literature. BioMed Research International. 2016;2016:e2737295.
Yamshchikov AV, Schuetz A, Lyon GM. Rhodococcus equi infection. The Lancet Infectious Diseases. 2010;10(5):350-359.
Stiles BM, Isaacs RB, Daniel TM, et Role of Surgery in Rhodococcus equi Pulmonary Infections. Journal of Infection. 2002;45(1):59-61.
7. INFECCIONES IMPORTADAS
Parásitos importados
7.1.1 Malaria
La malaria (especialmente por Plasmodium falciparum), constituye una de las infecciones importadas de mayor relevancia debido a su gravedad y frecuencia. Hay actualmente 87 países endémicos, especialmente en África subsahariana y sudeste asiático 1 . En adultos infectados por el VIH hay mayor frecuencia tanto de parasitemia como de paludismo clínico y una mayor gravedad, especialmente si CD4+ <350 células/μl 2 . Los episodios de malaria causan aumentos transitorios de la carga viral de VIH de hasta 1 log.
Las PVVIH viajeras, especialmente inmigrantes que viajan a sus países de origen, deben acudir siempre a una consulta pre-viaje 3 . A los pacientes infectados por el VIH con recuentos bajos de células CD4+ y a las mujeres embarazadas se les debe aconsejar evitar viajar a áreas con transmisión de malaria si es posible (AIII).
Debido a que el paciente con malaria se puede deteriorar rápidamente es necesario un alto índice de sospecha diagnóstica y un tratamiento precoz. El tratamiento empírico no debe retrasarse cuando la sospecha de malaria es alta pero los medios diagnósticos no están disponibles o los resultados se van a demorar (AIII). Todas las PVVIH con infección confirmada o sospechada por P. falciparum deben ser ingresados en el hospital hasta comprobar respuesta al tratamiento (AIII). Las indicaciones de tratamiento son las mismas que en personas no infectadas por el VIH (Tabla 1) 45 . Tanto en el tratamiento como en la quimioprofilaxis se recomienda consultar las interacciones potenciales entre antimaláricos y antirretrovirales (www.interaccionesvih.com; http://www.hiv-druginteractions.org). No hay ninguna razón para aplazar el inicio del TAR o suspenderlo; no se ha descrito síndrome de reconstitución inmune.
7.1.2 Trypanosoma cruzi
La infección aguda por Trypanosoma cruzi es casi exclusiva de zonas endémicas en 21 países, desde el sur de Estados Unidos hasta el norte de Chile y Argentina, excepto Caribe. España es uno de los países no endémicos con mayor número de pacientes o Chagas importado. Suele cursar sin síntomas y unos 60-90 días después de la infección progresa a la forma crónica en ausencia de tratamiento. El 20-30% de los pacientes desarrollarán afectación visceral (principalmente cardiaca) 6 , digestiva (6%) y gran parte del resto quedarán en una fase indeterminada. En nuestro medio, la forma aguda más común es la transmisión materno-fetal y, excepcionalmente, se ha asociado a transfusiones o trasplante de órganos (cribado serológico en donantes). En los pacientes con infección crónica por T. cruzi y VIH ésta protozoosis se comporta como una infección oportunista, por lo que se recomienda hacer cribado serológico en personas procedentes de área endémica (AIII) 7 . Las reactivaciones suelen ocurrir en pacientes con recuentos de linfocitos CD4+ <200 células/μl. En este contexto, se manifiestan como afectación del SNC en forma de lesiones ocupantes de espacio (chagomas) y/o meningoencefalitis 8 o miocarditis, arritmias e insuficiencia cardiaca. La infección crónica se diagnostica mediante serología por doble técnica (una PCR negativa no excluye la infección). En la reactivación, la parasitemia es elevada 9 y el diagnóstico se basa fundamentalmente en métodos parasitarios directos (sangre, LCR u otros fluidos biológicos) o en técnicas de amplificación genómica (LCR, lesiones y sangre) o histología. Se considera la terapia antirretroviral como la mejor opción en la prevención de reactivaciones en pacientes coinfectados (BIII). Por tanto, y dada la elevada morbimortalidad en reactivaciones del SNC, está justificado el inicio del TAR lo más precoz posible (AIII). En los casos en los que esté indicado el tratamiento se recomienda el benznidazol 10 como primera opción frente a nifurtimox, con el que existe menos experiencia (AIII) (Tabla 1). No hay prueba de cura.
7.1.3 Strongyloides stercoralis
La estrongiloidiasis es una infección causada por el helminto Strongyloides stercoralis. Se trata de una parasitosis que puede cronificarse durante décadas merced a un ciclo autoinfectivo y las manifestaciones clínicas pueden ocurrir muchos años después de haber sufrido la infección inicial, por lo que debe sospecharse después de haber residido o viajado a una zona endémica. La estrongiloidiasis es endémica en zonas rurales de áreas tropicales y subtropicales, siendo América Latina, el sudeste asiático, África y las regiones del Pacífico Occidental las zonas del mundo con mayor número de casos 11 .
La principal vía de adquisición es la cutánea a través de suelos contaminados con heces de un individuo portador. La forma más grave de estrongiloidiasis es el síndrome de hiperinfestación, donde grandes cantidades de larvas acceden al torrente sanguíneo provocando clínica gastrointestinal (dolor abdominal agudo, diarrea, vómitos) y respiratoria (incluyendo síndrome de distrés respiratorio agudo). El síndrome de hiperinfestación es más común en personas en tratamiento corticoideo o coinfectadas por el HTLV-11213 . Aunque la estrongiloidiasis diseminada está descrita en pacientes con infección por VIH, esta presentación clínica es muy
rara y se observa más como un fenómeno de reconstitución inmune que asociado a una inmunodepresión severa 1415 . El hallazgo de laboratorio más característico es la eosinofilia en sangre periférica, aunque no siempre está presente, y en el síndrome de hiperinfestación puede estar ausente. El diagnóstico se realiza mediante serología y estudio coproparasitológico (observación de larvas en heces y cultivo de heces).
Las indicaciones de profilaxis primaria y tratamiento en pacientes con infección por VIH se resumen en la (Tabla 1).
7.1.4 Esquistosomiasis
La esquistosomiasis, causada por trematodos del género Schistosoma, es la enfermedad parasitaria más extendida en el mundo después del paludismo. Está presente en áreas tropicales y subtropicales de África, Sudamérica y Asia16 (mapa: https://apps.who.int/neglected_diseases/ntddata/sch/sch.html).
La infección se produce por el contacto de la piel con aguas infestadas de lagos y ríos de las zonas endémicas. Puede pasar desapercibida o manifestarse como un exantema pruriginoso conocido como “dermatitis del nadador” 16 . Semanas después, la esquistosomiasis aguda se manifiesta como un cuadro general que incluye fiebre y eosinofilia.
Las dos formas principales de presentación clínica de la infección crónica son la intestinal y la urogenital, siendo S. mansoni y S. haematobium, respectivamente, las principales especies responsables 16 .
En nuestro medio, la infección afecta mayoritariamente inmigrantes, pero también a expatriados y a viajeros internacionales (habitualmente formas agudas).
Se recomienda el despistaje de la esquistosomiasis en viajeros e inmigrantes procedentes de zonas endémicas mediante cribado serológico y búsqueda de huevos en heces (Asia, Sudamérica y África) y orina (África), aunque no tengan eosinofilia 17 . En pacientes sintomáticos lo ideal es alcanzar el diagnóstico parasitario directo mediante la búsqueda de huevos en orina, heces o tejidos.
El praziquantel (Biltricide®, comprimidos de 600mg, medicación extranjera) es el antiparasitario de elección (AII).
La esquistosomiasis favorece la transmisión del VIH ya que se asocia con un mayor riesgo de infección por el VIH y con mayores cargas virales tras la seroconversión 18 .
No obstante, una vez iniciado el TAR, la respuesta virológica parece depender fundamentalmente de este 19 . Por el contrario, la respuesta al praziquantel en pacientes VIH sin TAR, podría ser peor 20 .
Hongos importados
7.2.1 Histoplasma capsulatum
La histoplasmosis es endémica en algunas regiones de América y también se ha reportado en ciertos países de Asia y África (donde la variedad duboisii causa histoplasmosis africana). En Europa se han descrito casos en relación con el aumento de la movilidad mundial, movimientos migratorios y algún caso autóctono 21.
Los factores de riesgo epidemiológico conocidos incluyen ser originario o viajar a zonas endémicas, contacto con deposiciones de pájaros o murciélagos (guano), espeleología y visita a cuevas, tala de árboles y actividades (limpieza, remodelación, demolición) en edificios antiguos 21 .
Puede presentarse como infección pulmonar localizada o bien como enfermedad diseminada, incluso con afectación del sistema nervioso central (meningitis). La intensidad de exposición y estado inmunológico condicionan la gravedad presentándose formas más graves en pacientes con CD4+ <150 células/μl 2122 .
Todos los estadios de la enfermedad pueden simular una tuberculosis y se puede presentar coinfección con esta entidad 23 .
La profilaxis primaria no está́ recomendada en España. Se recomienda evitar actividades con los factores de riesgo descritos en zonas endémicas en caso de CD4+ <150 células/μl (BI) 2224 .
En la (Tabla 2) se recogen las pautas de inducción y consolidación de tratamiento, de acuerdo con la gravedad de la enfermedad. El tratamiento antirretroviral debe iniciarse lo antes posible tras el inicio del tratamiento antifúngico en los casos en que no hay afectación del sistema nervioso central (AIII). El SRI es poco común en pacientes con SIDA con histoplasmosis. No está claro el papel de los corticoides 2325 .
La profilaxis secundaria con itraconazol está indicada siempre tras completar el tratamiento de consolidación (AIII). Se puede suspender con cifras de linfocitos CD4+ >150 células/μl durante al menos 6 meses, carga viral plasmática de VIH indetectable y cultivo de hongos negativo (AI). Se debe reiniciar si la cifra de linfocitos CD4+ disminuye por debajo de 150 células/μl (BIII) 25 .
7.2.2 Coccidioides immitis
La coccidioidomicosis está causada por un hongo que se encuentra en determinadas áreas de Estados Unidos y norte de México. El riesgo de desarrollar coccidioidomicosis sintomática aumenta en pacientes con < 250 linfocitos CD4+ células/μl 26 . Se han descrito 4 síndromes clínicos: neumonía focal, neumonitis difusa, afectación extratorácica incluyendo meningitis y serología positiva sin manifestaciones clínicas 27 . La profilaxis primaria no está indicada en España.
El tratamiento depende de la forma de presentación 26 (Tabla 2). En casos leves con neumonía focal fluconazol es el tratamiento de elección (AII). Los pacientes graves con afectación pulmonar difusa o afectación extratorácica con enfermedad diseminada deben tratarse inicialmente con anfotericina B liposomal (AII). No se recomienda diferir el inicio del tratamiento antirretroviral, porque el síndrome de reconstitución es infrecuente.
La profilaxis secundaria está indicada en todos los casos con fluconazol o itraconazol (AII). La duración de la misma dependerá de la gravedad de la enfermedad, como se indica en la (Tabla 2).
7.2.3 Blastomyces dermatitidis
La blastomicosis está causada por la inhalación del hongo dimórfico Blastomyces dermatitidis. Es endémica de determinadas regiones de Estados Unidos (sur y sudeste y regiones de los grandes lagos al norte). Produce un cuadro clínico similar a la histoplasmosis con formas pulmonares o enfermedad diseminada con afectación cutánea, osteoarticular, genitourinaria o del sistema nervioso central. La profilaxis y el tratamiento son similares a los de la histoplasmosis.
7.2.4 Talaromyces marneffei (previamente Penicillium marneffei)
La talaromicosis está causada por un hongo dimórfico endémico del sudeste asiático. Afecta a pacientes con infección avanzada por VIH con < 100 linfocitos CD4+ células/μl 28 . Cursa con fiebre, pérdida de peso, hepatoesplenomegalia, adenopatías, lesiones cutáneas en forma de pápulas con centro necrótico, afectación respiratoria y gastrointestina 29 .
El tratamiento consiste en una fase de inducción con anfotericina B 2 semanas, una fase de consolidación con itraconazol 10 semanas y una fase de mantenimiento o profilaxis secundaria con itraconazol hasta que la cifra de linfocitos CD4+ sea > 100 células/μl y la carga viral indetectable al menos 6 meses 29 (AII). En la (Tabla 2) se especifican las pautas de tratamiento.
Tablas:
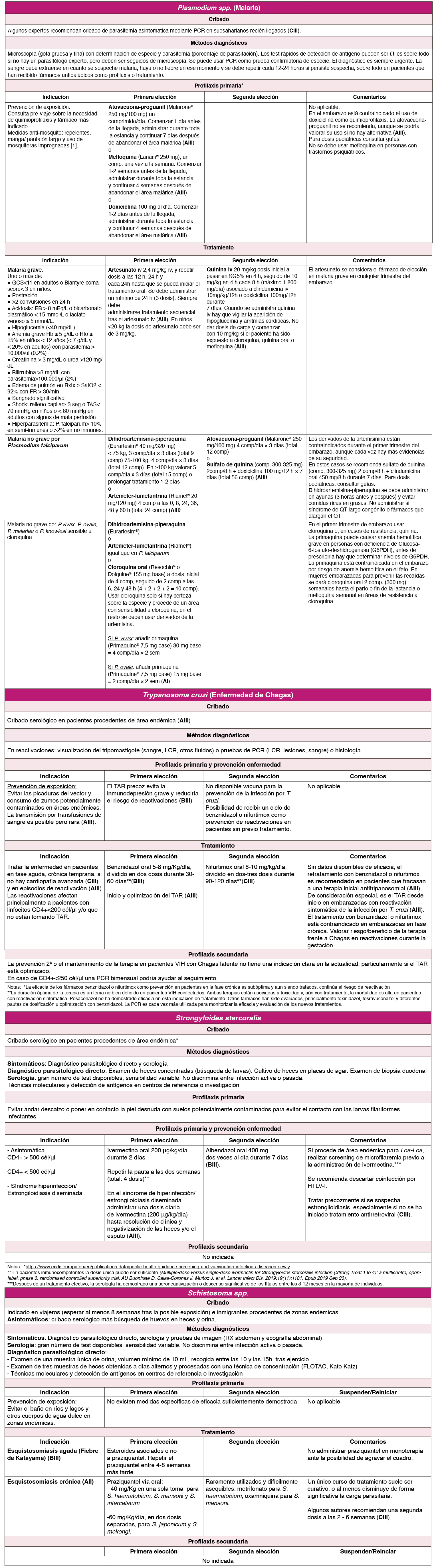
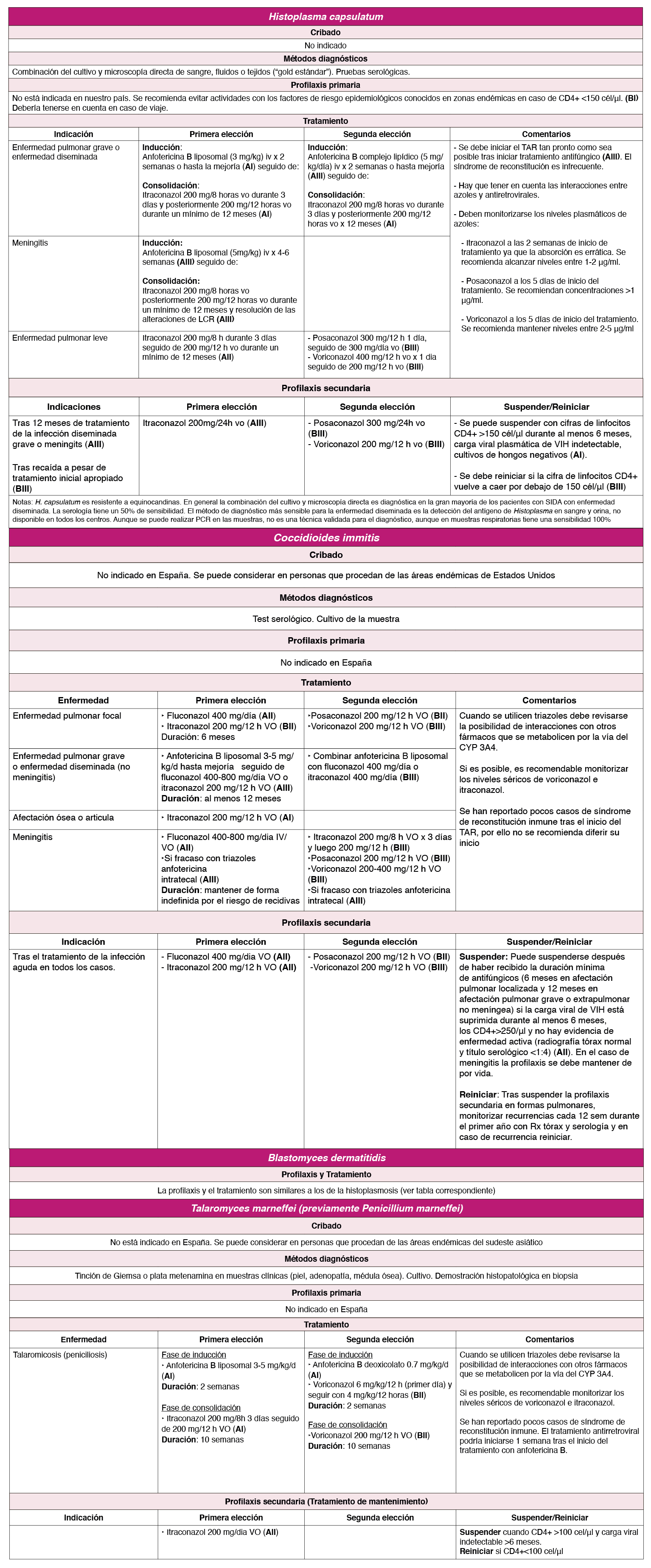
Bibliografía:
World malaria report 2020 [Internet]. [cited 2021 Jun 22]. Disponible en: https://www. int/publications/i/item/9789240015791
Mouala C, Guiguet M, Houzé S, et al. Impact of HIV infection on severity of imported malaria is restricted to patients with CD4 cell counts < 350 cells/microl. AIDS [Internet]. 2009 Sep 24 [cited 2017 Jun 13];23(15):1997–2004. Disponible en: http://www.ncbi.nlm. gov/pubmed/19654499
Morales R, Rodriguez N, Otero S, et Guía de recomendaciones para la prevención de la malaria en viajeros [Internet]. Barcelona: Esmon Publicidad, S.A.; 2019. 1–136 p. Disponible en: http://www.semtsi.es/84/activos/texto/wsemt_pdf_1602-I3GIiR67BpA4wf2K.pdf
WHO Guidelines for malaria [Internet]. Geneva: World Health Organization. Licence: CC BY-NC-SA 0 IGO. 2021 [cited 2021 Jun 15]. p. 1–210. Disponible en: https://www. who.int/publications/i/item/guidelines-for-malaria
Muñoz J, Rojo-Marcos G, Ramírez-Olivencia G, et al. [Diagnosis and treatment of imported malaria in Spain: Recommendations from the Malaria Working Group of the Spanish Society of Tropical Medicine and International Health (SEMTSI)]. Enferm Infecc Microbiol Clin [Internet]. 2015 Jun [cited 2017 Apr 4];33(6):e1–13.
Rassi Jr, A. Rassi, JA Marín-Neto. Chagas disease. Lancet 2010;375: 1388-402.
Pérez-Molina. Management of Trypanosoma cruzi coinfection in HIV-positive individuals outside endemic areas. Curr Opin Infect Dis 2014; 27:9–15.
Bisio, J. Altcheh, J. Lattner et al. Benznidazole treatment of chagasic encephalitis in pregnant woman with AIDS. Emerg Infect Dis 2013;19(9):1490-1492.
Molina, F. Salvador, A. Sánchez-Montalvá. Actualización en enfermedad de Chagas. Enferm Infecc Microbiol Clin 2016;34(2):132-138.
CA Morillo, Marin-Neto, A. Avezum et al. Randomized trial of benznidazole for
Buonfrate D, Bisanzio D, Giorli G, et al. The Global Prevalence of Strongyloides stercoralis Infection. Pathogens 2020; 9.
Keiser PB, Nutman TB. Strongyloides stercoralis in the immunocompromised population. Clinical Microbiology Reviews 2004; 17:208-217.
Porto MA, Alcântara LM, Leal M, et Atypical clinical presentation of strongyloidiasis in a patient co-infected with human T cell lymphotrophic virus type I. Am J Trop Med Hyg 2005; 72:124.
Bar-Yoseph H, Zohar Y, Lorber M. Strongyloidiasis-Related IRIS. J Int Assoc Provid AIDS Care 2017; 16:8.
Kim AC, Lupatkin Strongyloides stercoralis infection as a manifestation of immune restoration syndrome. Clin Infect Dis 2004; 39:439.
Colley DG, Bustinduy AL, Secor WE et Human schistosomiasis. Lancet. 2014; 383 (9936): 2253-64.
Advice Public health guidance on screening and vaccination for infectious diseases in newly arrived migrants within the EU/EEA. 2018.
Patel P, Rose CE, Kjetland EF, Downs JA et Association of schistosomiasis and HIV infections: A systematic review and meta-analysis. Int J Infect Dis. 2021; 102: 544-553. https://doi.org/10.1016/j.ijid.2020.10.088
Masikini P, Colombe S, Marti A et al. Schistosomiasis and HIV-1 viral load in HIV- infected outpatients with immunological failure in Tanzania: a case-control study. BMC Infect Dis. 2019; 19: 249. https://doi.org/10.1186/s12879-019-3876-8
Kallestrup P, Zinyama R, Gomo E, et Schistosomiasis and HIV in Rural Zimbabwe: Efficacy of Treatment of Schistosomiasis in Individuals with HIV Coinfection. Clin Infect Dis, 2006; 42 (12):1781-1789. https://doi.org/10.1086/504380.
Adenis AA, Aznar C, Couppié Histoplasmosis in HIV-Infected Patients: A Review of New Developments and Remaining Gaps. Curr Trop Med Reports [Internet]. 2014;1(2):119–28. Disponible en: https://doi.org/10.1007/s40475-014-0017-8
Myint T, Leedy N, Villacorta Cari E, et al. HIV-Associated Histoplasmosis: Current Perspectives. HIV AIDS (Auckl). 2020;12:113–25.
Diagnosing and Managing Disseminated Histoplasmosis among People Living with Washington, D.C.: Pan American Health Organization and World Health Organization; 2020. License: CC BY-NC-SA 3.0 IGO.
Norman FF, Martín-Dávila P, Fortún J et Imported histoplasmosis: two distinct profiles in travelers and immigrants. J Travel Med. 2009;16(4):258–62.
Murray M, Hine P. Treating progressive disseminated histoplasmosis in people living with HIV. Cochrane database Syst Rev. 2020 Apr;4(4):CD013594.
Ampel NM, Dols CL, Galgiani Coccidioidomycosis during human immunodeficiency virus infection: results of a prospective study in a coccidioidal endemic area. Am J Med. Mar 1993;94(3):235-240.
Fish DG, Ampel NM, Galgiani JN, et al. Coccidioidomycosis during human immunodeficiency virus infection. A review of 77 patients. Medicine (Baltimore). Nov 1990;69:384-391.
Panel on Opportunistic Infections in Adults and Adolescents with HIV. Guidelines for the prevention and treatment of opportunistic infections in adults and adolescents with HIV: recommendations from the Centers for Disease Control and Prevention, the National Institutes of Health, and the HIV Medicine Association of the Infectious Diseases Society of Available at https://clinicalinfo.hiv.gov/sites/default/files/guidelines/documents/ Adult_OI.pdf. Acceso: 25-06-2021. Pag F1-F8 y Pag Z1-Z12.
Supparatpinyo K, Khamwan C, Baosoung V, et al. Disseminated Penicillium marneffei infectionin southeast Asia. Lancet. 1994;344(8915):110-113
Le T, Van Kinh N, Cuc NTK, et al. A Trial of Itraconazole or Amphotericin B for HIV- Associated Talaromycosis. N Engl J Med 2017;376: 2329-2340
8. VACUNACIÓN
Ver Tabla 8 sobre vacunación.
Tablas:
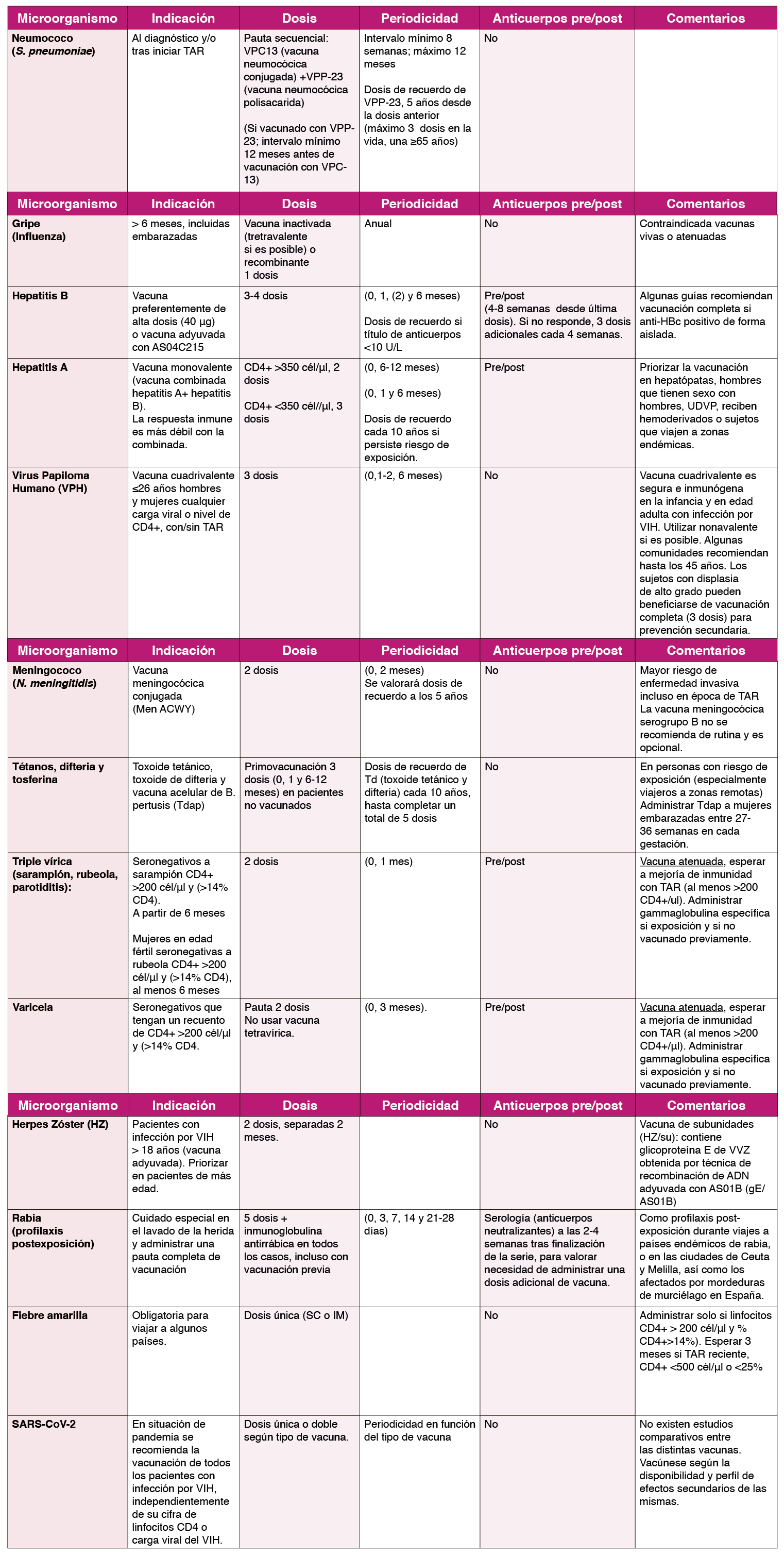
Las personas que reciben TAR no experimentan cambios significativos en la carga viral o en la concentración de linfocitos T después de la administración de vacunas, ya sean atenuadas o inactivadas. En pacientes sin TAR se ha observado, ocasionalmente, un aumento transitorio de la carga viral del que no se derivarían consecuencias clínicas. En general, los títulos de anticuerpos por vacunaciones previas se pueden incrementar tras el TAR, incluso sin la necesidad de una dosis de recuerdo. La respuesta a las vacunas es, en general, mejor en pacientes con ≥ 3 meses de TAR, específicamente después de la mejora del porcentaje de CD4+ (de forma óptima
≥14%) y la reducción de la carga viral (<1000 copias/ml); es por ello que a veces se prefiere esperar a vacunar al inicio de TAR, si bien habrá que evaluar el balance riesgo-beneficio que constituye la espera en estas personas.
Las vacunas inactivadas son seguras, mientras que las vacunas atenuadas triple vírica y varicela están contraindicadas en los estadios de inmunodepresión grave (CD4+ <200 cél/μl).
Se recomienda que los convivientes de las personas con infección por VIH estén correctamente inmunizados frente a la gripe, triple vírica y varicela.
Para la vacunación relacionada con los viajes, se recomienda remitir a una consulta especializada.
9. DECLARACIÓN DE TRANSPARENCIA (CONFLICTOS DE INTERÉS)
Alex Almuedo Riera.
Ha recibido ayudas para realización de actividades docentes de Gilead Sciences, Merck Sharp & Dohme, ViiV Healthcare y Janssen Cilag; compensación económica por presentaciones con fines educacionales de Gilead Sciences y Jansen Cilag; y ha recibido ayudas para asistencia a congresos de Gilead Sciences, Janssen Cilag, Merck Sharp & Dohme y ViiV Healthcare. No conflictos de interés en relación con este documento.
Juan Ambrosioni.
Ha recibido fondos para investigación de Gilead Sciences, ViiV Healthcare, ha participado en Advisory Boards para Gilead Sciences, ViiV Healthcare y Janssen Pharmaceuticals y ha sido miembro de Data Safety Monitoring Boards para HIPRA y Grifols, todo fuera de los temas tratados en las guías.
Pablo Bachiller Luque.
No conflictos de interés en relación con este documento.
Otilia Bisbal Pardo.
Ha recibido honorarios por ponencias científicas, así como becas para asistencia a congresos científicos, de Gilead Sciences y ViiV, y ha participado en cursos de formación organizados por ViiV, MSD y Gilead Sciences.
Noemí Cabello Clotet.
No conflictos de interés en relación con este documento.
Miguel Cervero Jiménez.
Ha participado como consultor de Janssen, VIIV, MSD y GILEAD.
Fernando Dronda Núñez.
No conflictos de interés en relación con este documento.
Vicenç Falcó Ferrer.
He recibido honorarios por participación en reuniones científicas (Janssen-Cylag, Merck Sharp&Dohme, ViiV Healthcare).
A través de su Institución ha recibido subvenciones para proyectos de investigación: Gilead Sciences; contratación de personal para apoyo a la investigación: Merck Sharp&Dohme, ViiV Healthcare; organización de cursos formativos: ViiV Healthcare, Gilead Sciences. Hae recibido subvenciones para asistencia a congresos: Janssen-Cylag, Gilead Sciences, becas GESIDA.
Silvia García Bujalance.
Sin conflictos de interés.
Alejandra Gimeno García.
Ha recibido financiación para asistencia a congresos, y honorarios por labores de consultoría o ponencias de los laboratorios Gilead Sciences, Janssen Cilag, Bristol-Myers Squibb, Merck Sharp and Dohme y ViiV Healthcare, no relacionadas con el presente documento.
Ángela Gutiérrez Liarte.
Ha recibido subvenciones y honorarios personales de Gilead, Janssen y Merck, no relacionados con el presente trabajo.
Arkaitz Imaz Vacas.
Ha disfrutado de ayudas para investigación clínica de Gilead Sciences, Merck Sharp & Dohme y ViiV Healthcare; ha efectuado labores de consultoría para Gilead Sciences, Thera Technologies y ViiV Healthcare; ha recibido compensación económica por charlas de Gilead Sciences, Janssen Cilag y Merck Sharp & Dohme y ViiV Healthcare; compensación económica por presentaciones con fines educacionales de Gilead Sciences, Janssen Cilag y Thera Technologies; y ha recibido ayudas para asistencia a congresos de Gilead Sciences, Janssen Cilag, Merck Sharp & Dohme y ViiV Healthcare. No conflictos de interés en relación con este documento.
Ana Lozano Serrano.
Sin conflictos de interés.
Jara Llenas García.
Ha recibido ayudas para asistencia a congresos de Pfizer, MSD, Gilead, Viiv y Janssen y compensación económica por charlas por Gilead y Janssen. No conflictos de interés en relación con este documento.
Álvaro Mena de Cea.
Ha recibido honorarios como ponente y/o labores de asesoría de Abbvie, Gilead, Janssen, MSD y ViiV. He recibido financiación para el desarrollo de proyectos de investigación de Abbvie, Gilead, Janssen y ViiV.
José Mª Miró Meda.
Ha recibido compensación económica por tareas de consultoría y/o ayudas para investigación clínica de AbbVie, Angelini, Contrafect, Cubist, Genentech, Gilead Sciences, Jansen, Lysovant, Medtronic, MSD, Novartis, Pfizer, y ViiV Healthcare, sin relación con el presente documento.
Ha recibido una beca de investigación personal 80:20 del Institut d’Investigacions Biomèdiques August Pi i Sunyer (IDIBAPS), Barcelona, Spain, during 2017–22.
María Asunción Pérez-Jacoiste Asín.
Ha recibido ayudas de investigación de GIlead.
Azucena Rodríguez Guardado.
Ha recibido becas de investigacion de Gilead y ayuda para congresos de Pzifer y MSD.
Alejandro Salinas Botrán.
Sin conflictos de interés.
Miguel Torralba.
Ha recibido ayudas para asistencia a congresos de Gilead, Janssen, MSD,y Viiv y compensación económica por ponencias de Gilead, Janssen, MSD,y ViiV. No conflictos de interés en relación con este documento.
Maria Eulalia Valencia Ortega.
Ha recibido compensación económica por charlas y labores de asesoría, así como ayuda para asistencia de Congresos por parte de MSD, ViiV Healthcare, Janssen Cilag y Gilead Sciences. No presenta ningún conflicto de interés en relación con el presente documento.
María Velasco Arribas.
Ha recibido ayudas para investigación clínica del Instituto de Salud Carlos III y de Gilead Sciences; ayudas para realización de actividades docentes de Gilead Sciences, Merck Sharp & Dohme, ViiV Healthcare y Janssen Cilag; compensación económica por presentaciones con fines educacionales de Gilead Sciences; y para asistencia a congresos de Gilead Sciences, Janssen Cilag, Merck Sharp & Dohme y ViiV Healthcare. No conflictos de interés en relación con este documento.