Manejo compartido del paciente con infección por VIH entre atención primaria y hospitalaria
Febrero 2022
Notas de la Versión:
Comité de redacción y agradecimientos
Coordinadores
| Ignacio Alastrué (semFYC) | Centro de Información y Prevención del Sida y otras ITS de Valencia. |
| Juan E. Losa (GeSIDA) | Hospital Universitario Fundación Alcorcón. Madrid. |
| Nuria Orozco (semFYC) | Centro de Salud Segorbe. Castellón. |
| María Jesús Pérez Elías (GeSIDA) |
Hospital Ramón y Cajal, IRYCIS. Madrid. |
| Jose L. Ramón (semFYC) | Centro de Salud de Haro. La Rioja. |
Redactores/as y Revisores/as
Cristina Agustí Benito |
CEEISCAT-CIBERESP. Agència de Salut Pública de Catalunya. |
Jésica Abadía (GeSIDA) |
Hospital Río Hortega. Valladolid. |
Gaspar Alonso (GeSIDA) |
Hospital Universitario de Getafe. Madrid. |
Lara Arbizu (semFYC) |
Centro Salud Arnedo. La Rioja. |
Pablo Bachiller (GeSIDA) |
Complejo Asistencial de Segovia. |
Ignacio Barreira (semFYC) |
Hospital General Universitario. Valencia. |
| Josefina Belda (semFYC) | Centro de Información y Prevención del Sida y otras ITS de Alicante |
Pilar Barrufet (GeSIDA) |
Hospital de Mataró. Barcelona. |
Alfonso Cabello (GeSIDA) |
Fundación Jiménez Díaz. Madrid. |
| Arantxa Cabezas (GeSIDA) | Asociación Bienestar y Desarrollo. Barcelona. |
| Lorena Caja (semFYC) | Centro de Salud Fernando el Católico. Castellón |
| Ricard Carrillo (semFYC) | Centro de Salud La Florida Sud. Barcelona. |
| Miguel Cervero (GeSIDA) | Hospital Universitario Severo Ochoa. Madrid. |
| Javier de la Torre (GeSIDA) | Hospital Costa del Sol. Marbella. |
| Ignacio de los Santos (GeSIDA) |
Hospital Universitario de la Princesa. Madrid. |
| Alberto Díaz de Santiago (GeSIDA) |
Hospital Universitario Puerta de Hierro. Madrid. |
| Ana Díez (semFYC) | Centro de Salud Puerta de Arnedo. La Rioja |
| Francisco Fanjul (GeSIDA) | Hospital Universitario Son Espases. Palma. |
| Mª Eugenia Flor (semFYC) | Centro de Salud de Laguardia. Álava. |
| Juan Flores (GeSIDA) | Hospital Arnau de Vilanova Valencia-Lliria |
| Mª José Fuster (GeSIDA) | Directora ejecutiva SEISIDA. Facultad de Psicología UNED. |
| Virginia Fuentes (semFYC) | Centro de Salud Ruzafa. Valencia |
| Carlos Galera (GeSIDA) | Hospital Universitario Virgen Arrixaca. Murcia. |
| Mª José Galindo (GeSIDA) | Hospital Clínico Universitario de Valencia. |
| Lucio J. García-Fraile (GeSIDA) | Hospital Universitario de la Princesa. Madrid. |
| Alejandra Gimeno (GeSIDA) | Hospital Universitario de Torrejón. Madrid. |
| Cristina Gómez (GeSIDA) | Hospital Clínico Universitario Virgen de la Victoria. Málaga. |
| Jana Hernandez (GeSIDA) | Hospital General de Villalba. Madrid. |
| Xabier Kortajarena (GeSIDA) | Hospital Universitario Donostia |
| Juan C. López Bernaldo de Quirós (GeSIDA) |
Hospital General Universitario Gregorio Marañón. Madrid. |
| Juan Macías (GeSIDA) | Hospital Universitario de Valme. Sevilla |
| Andrés Marco Mouriño (GeSIDA) |
Programa de Salud Penitenciaria. Institut Català de la Salut. |
| Luz Martín Carbonero (GeSIDA) |
Hospital Universitario La Paz. Madrid. |
| Javier Martinez Sanz (GeSIDA) | Hospital Ramón y Cajal. Madrid. |
| Juanjo Mascort (semFYC) | Centro de Salud La Florida Sud. Barcelona. |
| Aldana Menéndez (GeSIDA) | Entidad ABD (asociación bienestar y desarrollo) de Barcelona. |
| Dolores Merino (GeSIDA) | Hospital Universitario Juan Ramón Jiménez. Huelva. |
| Carolina Mir (semFYC) | Centro de Salud Serrería 1. Valencia. |
| Raquel Monsalvo (GeSIDA) | Hospital Universitario del Tajo. Madrid. |
| Miriam Navarro (GeSIDA) | Centro de Salud Pública Elx Universidad Miguel Hernández. |
| Sara Nistal (GeSIDA) | Hospital Universitario Rey Juan Carlos. Madrid. |
| Nuria Orozco (semFYC) | Centro de Salud Segorbe. Castellón. |
| Jesús Ortega (semFYC) | Centro de Salud Navarrete. La Rioja. |
| Carmen Peinado (semFYC) | Centro de Salud Nájera. La Rioja. |
| José L. Pérez (GeSIDA) | Hospital Universitario Infanta Cristina. Parla-Madrid. |
| Joseba Portu (GeSIDA) | Hospital Universitario Araba. Vitoria-Gasteiz. |
| Miguel A. Ramiro (GeSIDA) | Clínica Legal. Universidad de Alcalá. Madrid. |
| Melchor Riera (GeSIDA) | Hospital Universitario Son Espases. Palma de Mallorca. |
| Beatriz Rodríguez (semFYC) | Centro Saúde Marín. Pontevedra. |
| Alberto Romero (GeSIDA) | Hospital Universitario de Puerto Real de Cádiz |
| Rafael Rubio García (GeSIDA) | Hospital Universitario 12 de Octubre.Instituto de Investigación |
| Pablo Ryan (GeSIDA) | Hospital Universitario Infanta Leonor. Madrid |
| Jacinto Sánchez (GeSIDA) | Complejo Asistencial Universitario de Palencia. |
| Yolanda Sánchez (semFYC) | Centro de Salud Calahorra. La Rioja. |
| Tatia Santirso (semFYC) | Unidad Docente Multiprofesional de Atención Familiar y |
| José Sanz (GeSIDA) | Hospital Universitario Príncipe de Asturias. Alcalá de |
| Regino Serrano (GeSIDA) | Hospital Universitario de Henares. Madrid. |
| María Velasco (GeSIDA) | Hospital Universitario Fundación Alcorcón. Madrid |
| Mar Vera (GeSIDA) | Centro Sanitario Sandoval. IdiSSC. Hospital Clínico San |
| Cristina Zorzano (semFYC) | Centro de Salud Hormilla. La Rioja. |
Agradecimientos
A Esteban Martinez expresidente de Grupo de Estudio de SIDA de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica y a Juanjo Mascort, coordinador del grupo de trabajo de VIH-Sida de la Sociedad Española de Medicina de Familia y Comunitaria, por su iniciativa de impulsar la redacción de este documento con la implicación de los dos grupos de trabajo de ambas sociedades.
A Marisa Montes (GeSIDA), Jorge Del Romero (Centro Sanitario Sandoval, Madrid); Marta Besa Castellà, Carmen Roca Saumell, Juan Mendive Arbeloa, Mariam de la Poza Abad (Societat Catalana de Medicina Familiar i Comunitària); Mª Isabel Gutiérrez Pérez, Javier Muñoz Gutiérrez, Estibaliz Alonso Saratxaga, Javier Arranz Izquierdo, Mª Eulalia Lucio Villegas, José Mª Molero García, Mª Lluïsa Morató Agustí, Ainhoa Mestraitua Vázquez (Grupo de Trabajo de Enfermedades Infecciosas de la Sociedad Española de Medicina de Familia y Comunitaria), por sus aportaciones y comentarios que han contribuido a mejorar el texto final del documento.
También queremos agradecer el enorme esfuerzo que han realizado los autores y los revisores del documento, tanto de Atención Primaria como de Atención Hospitalaria, que han debido añadir a su trabajo asistencial especialmente penoso en estos dos años, la tarea de redacción y revisión de los capítulos en los que han trabajado.
Y por último, a los coordinadores del trabajo, quienes en medio de la pandemia de COVID-19, con sus sucesivas olas, han coordinado a un elevado número de autores y revisores para redactar un documento en el que se partía desde cero.
Citación sugerida: Panel de expertos del Grupo de estudio de SIDA (GeSIDA) y de la Sociedad Española de Medicina de Familia y Comunitaria (semFYC). MANEJO COMPARTIDO DEL PACIENTE CON INFECCIÓN POR VIH ENTRE ATENCIÓN PRIMARIA Y HOSPITALARIA,
MADRID; Feb 2022. disponible en: https://gesida-seimc.org/wp-content/uploads/2021/09/ Documento_AP.pdf
LISTADO DE ABREVIATURAS
AAD |
Antivirales de Acción Directa |
AAR |
Anoscopia de Alta Resolución |
AH |
Asistencia Hospitalaria |
AP |
Atención Primaria |
ARA II |
Antagonistas de los Receptores de la Angiotensina II |
AUDIT |
Alcohol Use Disorder Identification Test |
CAP |
Centro de Atención Primaria |
CCR5 |
Proteína que se encuentra en las células CD4 a la que se une el |
CD4 |
VIH durante el proceso de infección celular Linfocitos-T CD4 |
CD8 |
Linfocitos-T CD8 |
CDC |
Centros para el Control y Prevención de Enfermedades de |
cél/ųl |
Estados Unidos de América Células/microlitro |
CHC |
Carcinoma Hepatocelular |
CMV |
Citomegalovirus |
CVP |
Carga Viral Plasmática |
CVRS |
Calidad de Vida Relacionada con la Salud |
DM2 |
Diabetes Mellitus tipo 2 |
DMO |
Densidad Mineral Ósea |
ECDC |
Centro Europeo para la Prevención y Control de Enfermedades |
ECV |
Enfermedad Cardiovascular |
EHGMA |
Enfermedad Grasa asociada a Enfermedad Metabólica |
ELISA |
Enzimoinmunoanálisis de Adsorción |
EuroQol |
Europe Quality of life |
FAR |
Fármacos Antirretrovirales |
FDA |
Administración de Alimentos y Medicamentos de los Estados |
FRCV |
Unidos de América Factores de riesgo cardiovascular |
FTC |
Emtricitabina |
FV |
Fracaso Virológico |
GBHSH |
Hombres Gays, Bisexuales y otros Hombres que tienen Sexo con |
GHB/GBL |
Hombres Gammahidroxibutirato |
HADS |
Hospital Anxiety and Depression Scale |
HCC |
Hepatocarcinoma |
HLA-B*5701 |
Detección del subtipo 5701 del gen HLA-B asociado a |
HSIL |
hipersensibilidad a Abacavir Lesiones intraepiteliales escamosas de alto grado |
HZ |
Herpes Zoster |
IECA |
Inhibidores de la Enzima Convertidora de Angiotensina |
IGRA |
Ensayo de liberación de interferón-gamma (TBC) |
INI |
Inhibidor de la Integrasa |
IP |
Inhibidor de Proteasa |
IP/p |
Inhibidor de la Proteasa potenciado |
ITIAN |
Inhibidor Transcriptasa Inversa Análogo de Nucleósido/tido |
ITINAN |
Inhibidor de la Transcriptasa Inversa No Análogo de Nucleósido |
ITS |
Infecciones de Transmisión Sexual |
LGTBI+ |
Lesbianas, gays, transexuales -transgénero, no binarias, con |
expresión de género fluido y otras variaciones de género-, |
|
LOE |
bisexuales, intersexuales y más Lesión Ocupante de Espacio |
LSD |
Dietilamida del ácido lisérgico |
LSIL |
Lesiones intraepiteliales escamosas de bajo grado |
MAP |
Médico de Atención Primaria |
MDMA |
Metanfetamina |
MOS |
Medical Outcomes Study |
MR |
Mutaciones de Resistencia |
MVIH |
Mujeres que viven con el VIH |
OMS |
Organización Mundial de la Salud |
ONG |
Organización/es No Gubernamental/es |
ONUSIDA |
Programa Conjunto de las Naciones Unidas sobre el VIH/Sida |
PAPPS |
Programa de Actividades Preventivas y Promoción de la Salud |
PPD |
Prueba cutánea de derivado proteico purificado (TBC) |
PPE |
Profilaxis PostExposición |
PrEP |
Profilaxis PreExposición |
PROQOL |
Profesional quality of life |
PROs |
Patient Reported Outcomes |
PSA |
Antígeno Prostático Específico |
PVIH |
Personas que viven con el VIH |
RCV |
Riesgo Cardiovascular |
RH |
Rigidez Hepática |
RVS12 |
Respuesta Viral 12 semanas tras finalizar tratamiento |
SIDA/Sida |
Síndrome de Inmunodeficiencia Adquirida |
SIR |
Tasa de incidencia estandarizada |
SIRI |
Síndrome Inflamatorio de Reconstitución Inmune |
SNC |
Sistema Nervioso Central |
SNS |
Sistema Nacional de Salud |
SVE |
Sangrado por rotura de Varices Esofágicas |
TAF |
Tenofovir Alafenamida |
TAR |
Terapia antirretroviral; ídem de alta eficacia |
TBC |
Tuberculosis |
TDF |
Tenofovir Difumarato |
TDS |
Tumores Definitorios de Sida |
TG |
Triglicéridos |
TNDS |
Tumores No Definitorios de Sida |
Trans |
Personas transexuales, transgénero, no binarias, con expresión |
UDI |
de género fluido y otras variaciones de género. Usuario de Drogas Inyectables |
VEB |
Virus de Epstein-Barr |
VHA,B,C |
Virus hepatitis A, B, C |
VHH8 |
Virus del Herpes Humano 8 |
VHS |
Virus Herpes Simple |
VIH |
Virus de la Inmunodeficiencia Humana |
VPH |
Virus del Papiloma Humano |
VVZ |
Virus Varicela Zoster |
WHOQOL- |
World health organization-HIV- Best Available Technique |
HIV-BREF |
Reference Notes |
1. INTRODUCCIÓN
Justificación, objetivos y alcance
En los últimos años las autoridades sanitarias, mundiales y nacionales, han establecido unos objetivos encaminados a disminuir los nuevos casos de infección por el VIH, a realizar un diagnóstico más precoz, y a cuidar a las personas que viven con el VIH (PVIH), para conseguir que se mantengan con una carga viral indetectable y con la mejor calidad de vida posible. Pero, aunque en nuestro país se ha avanzado mucho en este camino, algunos de estos objetivos no son todavía una realidad.
Actualmente la tasa global de nuevos diagnósticos del VIH en España, aunque se ha reducido respecto a décadas pasadas, sigue siendo superior a la media de la Unión Europea. Y, a pesar de que la prueba diagnóstica es gratuita y confidencial, el 45,9% de las personas diagnosticadas del VIH en 2019, todavía presentaba un diagnóstico del VIH tardío 1.
Por otra parte, el curso de la infección por el VIH/Sida ha sufrido un claro cambio desde que se dispone de un tratamiento antirretroviral (TAR) eficaz y hemos asistido a una importante reducción de la morbimortalidad y de la transmisión de la infección por el VIH. Este TAR ha evolucionado hasta unos niveles altísimos de eficacia, tolerancia y sencillez en el 80% de las personas que viven con el VIH.
Pero el escenario asistencial no es necesariamente más sencillo, ya que a la vez que sucede esto, nuestra población ha ido envejeciendo (el porcentaje de personas mayores de 50 años atendidas en los hospitales ha ido ascendiendo progresivamente desde el 12% en 2004 hasta el 55,4% en 2019) 2, y cada vez son más los pacientes con comorbilidades y polimedicación, por lo que resulta fundamental en este momento un abordaje multidisciplinar con la participación de los médicos de atención primaria (MAP), de los especialistas hospitalarios en VIH y de otros médicos de atención hospitalaria.
Estas realidades justifican un abordaje multidisciplinar y coordinado entre Atención Primaria (AP) y Atención Hospitalaria (AH), tanto para realizar tareas de prevención y cribado de la infección por el VIH en la población general, como para atender de forma integral los múltiples aspectos y matices que configuran esa atención, siempre intentando contemplar el principio de la medicina centrada en el paciente.
Al elaborar este trabajo, el objetivo fundamental ha sido realizar un documento de consenso entre la sociedad española de enfermedades infecciosas-grupo de trabajo de SIDA (SEIMC-GeSIDA) y la sociedad española de Medicina de Familia y comunitaria-grupo de trabajo de VIH (semFYC-GdT VIH) que aunara los conocimientos y las evidencias para conseguir el mejor manejo global de las PVIH, y así, evitar nuevas infecciones por el VIH y para diagnosticar cuanto antes a quienes desconocen que son portadores del VIH.
El documento no pretende sustituir a las guías internacionales o nacionales que ya existen, sino utilizar esos conocimientos y recomendaciones para darles una visión en la que prime en todo momento la visión conjunta de AP y AH, facilitando de esta manera la implementación del modelo de cuidados del paciente crónico, en el que la coordinación y los objetivos compartidos son la base de unos mejores resultados en salud.
Se ha dividido el documento en cuatro bloques. En el primero se tratan aspectos de prevención y diagnóstico de la infección por el VIH, fundamentalmente pensados para su implementación en AP, así como los relativos a la derivación a las unidades del VIH de los hospitales y a la vinculación a los cuidados por parte de los profesionales de AP, contemplando algo muy presente en el documento: la bidireccionalidad y la comunicación entre los dos escenarios asistenciales.
En el segundo bloque se contemplan todos los temas relacionados con la atención y manejo clínico de las PVIH. Se abordan los cuidados compartidos y los nuevos modelos de atención, la vacunación de las PVIH, el TAR, incluyendo su monitorización, las interacciones y la adherencia, así como el manejo de las principales comorbilidades, la atención de los problemas específicos de la mujer y de los hábitos tóxicos.
Hemos incluido un tercer bloque para tratar aspectos sociales, incluyendo los temas legales y de confidencialidad, la calidad de vida y el papel de las ONG en la atención de las PVIH, sobre todo de las más vulnerables.
Y para finalizar un cuarto bloque absolutamente necesario que trata de centrar la situación en cuanto a la formación/docencia y la investigación bidireccional y compartida entre AP y AH en todos los temas tratados con anterioridad.
No se han incluido, por no complicar mucho más el documento, aspectos relacionados con las infecciones por el VHC y el VHB, pero en nuestro ánimo está el que se establezcan sinergias en el abordaje de estas infecciones, en aspectos de prevención y cribado, ya que comparten vías de transmisión y son frecuentes las coinfecciones 3.
Esta primera edición pretende ser un documento vivo en el que se aporten puntos de vista y nuevas evidencias por parte no sólo del estamento sanitario o de sus autoridades, sino también desde el punto de vista de los propios pacientes y las ONG que trabajan en el tema.
Metodología
El Panel redactor del documento se integró por clínicos expertos en la enfermedad por el Virus de Inmunodeficiencia Humana (VIH), designados por la Junta Directiva de GeSIDA y el Grupo de Trabajo (GdT) VIH-SIDA de la Sociedad Española de Medicina de Familia y Comunitaria (semFYC), que aceptaron participar voluntariamente y emitir una declaración de conflicto de intereses. La metodología que se describe a continuación se basa en la del Documento de Consenso de GeSIDA/Plan Nacional sobre el Sida respecto al TAR en adultos infectados por el Virus de la Inmunodeficiencia Humana que se actualiza todos los años 4.
Los expertos se distribuyeron en grupos formados por dos redactores (uno de cada sociedad científica) y dos revisores (a partes iguales de cada sociedad) que se encargaron de elaborar cada sección del documento.
Cinco miembros del Panel actuaron como coordinadores y redactores generales (dos de GESIDA y tres de semFYC), cuyo cometido fue ensamblar todas las secciones del documento y encargarse de la redacción y edición final del mismo.
Los redactores de cada grupo revisaron los datos más relevantes de las publicaciones científicas (PubMed y Embase; plataforma Fisterra y AMF; idiomas: español e inglés) y de las comunicaciones a los congresos más recientes hasta el 31 de mayo de 2021.
El texto elaborado por los redactores se sometió a la consideración de sus revisores y se incorporaron las aportaciones aceptadas por consenso. Una vez revisados todos los capítulos por los coordinadores y redactores generales se ensamblaron todas las secciones y se consensuó el borrador de la versión final, que se envió a todos los revisores y redactores para su consideración.
Tras la incorporación de todas las modificaciones aprobadas, el documento se expuso durante 15 días en las páginas web de GeSIDA y se remitió a los socios de los grupos de trabajo de Enfermedades Infecciosas y de VIH de las sociedades federadas de semFYC para que profesionales, pacientes o quien estuviesen interesados hicieran sugerencias que, tras su estudio y deliberación, pudieran ser integradas en el documento final.
Las recomendaciones del documento de consenso se basaron en la evidencia científica y en la opinión de expertos. Se utilizó el sistema de gradación de la Sociedad Americana de Enfermedades Infecciosas de 20012 , en la que cada recomendación se califica con una letra que indica su fuerza [A (debe ofrecerse siempre), B (en general debe ofrecerse) o C (debe ofrecerse opcionalmente)] y un número que expresa las pruebas que sustentan dicha recomendación [I (resultados obtenidos a partir de uno o más ensayos clínicos aleatorizados de aspectos clínicos o de laboratorio o un metaanálisis); II (de uno o más ensayos no aleatorizados o datos observacionales de cohortes); y III (en la opinión de expertos)].
GeSIDA y el GdT VIH-SIDA de semFYC actualizarán este documento en función de la evolución de los conocimientos sobre el manejo compartido de la enfermedad por VIH entre AP y AH.
Bibliografía:
1. Unidad de Vigilancia de VIH, ITS y hepatitis. Vigilancia Epidemiológica del VIH y Sida en España 2019: Sistema de Información sobre Nuevos Diagnósticos de VIH y Registro Nacional de Casos de Plan Nacional sobre el Sida - D.G. de Salud Pública / Centro Nacional de Epidemiología - ISCIII. Madrid; Nov 2020.
2. Encuesta Hospitalaria de pacientes con infección por el Resultados 2019. Análisis de la evolución 2004-2019. Centro Nacional de Epidemiología- Instituto de Salud Carlos III/ Plan Nacional sobre el Sida - D.G. de Salud Pública, Calidad e Innovación / Centro Nacional de Epidemiología - ISCIII. Madrid; mayo 2020. Disponible en: https:// www.mscbs.gob.es/ciudadanos/enfLesiones/enfTransmisibles/sida/vigilancia/Encuesta_ hospitalaria2019.pdf
3. “Plan de prevención y control de la infección por el VIH y las ITS 2021-2030” Nota de Prensa sobre el Documento. Junio 2021. https://www.mscbs.gob.es/gabinete/ do?id=5384
4. Panel de expertos de Gesida y Plan Nacional sobre el Sida. Documento de Consenso de Gesida/Plan Nacional sobre el Sida respecto al tratamiento antirretroviral en adultos infectados por el Virus de la Inmunodeficiencia Humana (Actualización Enero 2020). Accesible: http:// gesida-seimc.org/category/guias-clinicas/antirretroviral-vigentes/ .
(Consultado el 30.05.2020).
5. Kish Guide to Development of Practice Guidelines. Clin Infect Dis 2001; 32: 851-4.
2. PREVENCIÓN, DIAGNÓSTICO Y DERIVACIÓN
2.1. Prevención de la infección por el VIH
2.2. Retraso diagnóstico. Estrategias para optimizar el cribado
2.3. Derivación a las Unidades Hospitalarias
Prevención de la infección por el VIH
Identificación del riesgo
La identificación de aquellos pacientes que tienen mayor riesgo de contraer la infección por el VIH es un punto de partida de gran utilidad para poder implementar las estrategias preventivas disponibles y así evitar nuevas infecciones y mejorar la situación de retraso en el diagnóstico del VIH que existe actualmente en España. La AP, que es la vía de acceso más habitual al sistema sanitario1, la AH fuera del ámbito del VIH y las urgencias tienen un papel fundamental dado que son los lugares donde se atiende a la mayoría de la población general.
Las guías de cribado actuales identifican como personas expuestas a un mayor riesgo de adquirir la infección por el VIH a los hombres gays, bisexuales y hombres que tienen sexo con otros hombres (GBHSH), a las personas con múltiples parejas, a los migrantes originarios de países con elevada prevalencia de infección por el VIH, a las personas que se inyectan drogas, a las personas trabajadoras del sexo y a las personas transgénero2345. Existen otros aspectos a tener en consideración, como el género, la edad, la diversidad funcional, o pertenecer a un grupo étnico minoritario o históricamente desfavorecido67.
Estos y otros factores conductuales pueden ser identificados mediante una correcta anamnesis sexual, lo cual en ocasiones resulta difícil de realizar tanto para el MAP8, como para el hospitalario.
Una anamnesis que incluya el número de parejas sexuales, el uso, o no uso del preservativo, el tipo de prácticas sexuales, el uso de drogas o alcohol durante las relaciones sexuales y el compartir agujas y otra parafernalia al consumir cualquier tipo de drogas, los antecedentes de otras infecciones de transmisión sexual (ITS), así como la situación psicosocial y el país de pertenencia, permite realizar una estimación del riesgo de contraer el VIH. Algunas exposiciones al VIH conllevan un riesgo de transmisión mucho mayor que otras. En la Tabla 1 se muestra el riesgo en función del tipo de práctica sexual.
Algunos factores que pueden aumentar el riesgo de transmisión del VIH son las ITS del propio paciente y la existencia de infección aguda por el VIH, o de infección en una etapa tardía, o la elevada carga viral de los contactos sexuales. Los factores que pueden disminuir el riesgo incluyen el uso de preservativo, la circuncisión masculina, la profilaxis preexposición (PrEP) y postexposición9 (PPE) y que las personas infectadas por el VIH se encuentren diagnosticadas, tratadas y con la carga viral indetectable.
Por otro lado, existen una serie de condiciones indicadoras de infección por el VIH que pueden ser la primera manifestación de la infección en las personas que desconocen su condición de portadores del virus y cuyo conocimiento es de interés para los profesionales para evitar el diagnóstico tardío de la infección10. Estas las veremos con detalle en el capítulo de “Guías clínicas”.
Dadas las dificultades que existen para conocer y aplicar las guías actualizadas de cribado y las consecuencias negativas de no hacerlo, cualquier herramienta que automatice y facilite el proceso una vez validada debe ser considerada1112.
Por todo lo expuesto es importante conocer tanto los factores de riesgo, como identificar adecuadamente aquellas exposiciones que favorecen la infección por el VIH y de esta manera ofertar el cribado de la infección por VIH y otras ITS a la población sexualmente activa lo más pronto posible tras la infección, y en las personas que resulten negativas, implementar las estrategias preventivas adecuadas a su nivel de riesgo, incluyendo la PrEP, la PEP y la educación sanitaria. Y es la AP el lugar idóneo para todo ello dada la accesibilidad y la cercanía del paciente a su MAP, sin descartar otros ámbitos sanitarios y no sanitarios, así como las campañas para captar a la población en situación de mayor riesgo.
Recomendaciones
- Es necesario difundir las guías de cribado que identifican a las personas expuestas a un mayor riesgo de adquirir la infección por el VIH (A-II).
- Es necesario poder realizar una buena anamnesis que permita detectar los factores que aumentan el riesgo de infección por el VIH, para lo que sería necesario mejorar la formación de los profesionales y dotarlos de tiempo suficiente para atender a cada paciente según sus necesidades (B-III).
Medidas preventivas
No farmacológicas
Autores: Andrés Marco Mouriño, Lorena Caja
Revisores: Juan Flores Cid, Nuria Orozco
Las medidas de prevención del VIH deben dirigirse a toda la población, pero esta estrategia global debe combinarse con el diseño e implementación de estrategias específicas para las poblaciones más vulnerables a la infección, como los GBHSH, los usuarios de drogas inyectables (UDI), los trabajadores sexuales, las personas transgénero y las personas recluidas en centros penitenciarios13.
Las estrategias preventivas pueden agruparse por perspectivas temporales (aplicables antes o después de la detección de la infección por VIH) o por ejes, según criterios de prevalencia y riesgo de exposición, como sugiere el Plan del Sida en España14. ONUSIDA recomienda que las medidas preventivas combinen intervenciones biomédicas, comportamentales y estructurales para responder a las necesidades de personas y comunidades concretas15. La Asamblea General de Naciones Unidas propuso garantizar el acceso a opciones de prevención combinada para al menos el 90% de las personas en riesgo para 202016. En la Figura 1 se presenta la prevención combinada como interrelación entre las diferentes estrategias preventivas.
Parece necesario que los servicios de atención del VIH se integren con otros servicios de salud, como ha sugerido una comisión de expertos convocada por la Sociedad Internacional del SIDA y The Lancet17. El trabajo en equipo, y la formación de sus integrantes, redunda en la detección precoz del VIH1819, permite suministrar una amplia gama de recursos preventivos2021 y dota a los infectados de un mayor acceso a otros servicios que necesitan estos pacientes20. La AP y más concretamente el MAP, tiene un papel prioritario en este problema, debido a su capacidad de prestar una atención longitudinal e integral en la consulta, convirtiéndose en un recurso clave para realizar una correcta prevención entre sus pacientes22.
Intervenciones comportamentales
Promueven cambios hacia conductas más saludables. Por ejemplo:
- Campañas de información y educación sobre prevención del VIH
- Programas o campañas de educación sexual integral
- Programas de acercamiento (outreach) a poblaciones vulnerables
- Actividades de educación personalizada, efectuadas entre pares (“iguales”) o mediante profesionales (“educadores de calle”)
- Intervenciones con mediadores culturales o agentes de salud para facilitar la comunicación y reducir las dificultades de acceso a los servicios sanitarios
- Consejo asistido (Counselling) con objeto de ayudar al paciente en la toma de decisiones según sus valores e intereses.
- Programas de asesoramiento sobre reducción de riesgos.
- Marketing comportamental, basado en el behavioral targeting; es decir, en el diseño de campañas en función del comportamiento.
Intervenciones biomédicas
Utilizan métodos diagnósticos y/o clínicos o instrumentos preventivos, ya sean farmacológicos o no. En el siguiente capítulo nos centraremos en los farmacológicos, mientras que en este lo haremos en los no farmacológicos. Como son, por ejemplo:
- Circuncisión masculina voluntaria. Recomendada por ONUSIDA y la OMS en entornos con epidemias generalizadas de VIH para varones de 15 años o más. Reduce el riesgo de infección a través de relaciones sexuales en un 60%2324. No obstante no hay evidencia de que el riesgo disminuya entre sus contactos sexuales, ni en las mujeres. Y tampoco hay evidencias concluyentes del beneficio en GBHSH25.
- Entrega de material preventivo (preservativos, lubricantes y material de inyección, principalmente).
- Detección de la infección por VIH. El cribado del VIH, como el de otras ITS debe realizarse periódicamente en las poblaciones más expuestas a riesgo26.
Intervenciones estructurales
De ámbito comunitario, dirigidas a reducir el estigma, a mejorar los derechos de los ciudadanos y a aumentar el acceso a los servicios de salud. Son intervenciones estructurales:
- las normativas dirigidas a evitar la discriminación y el estigma;
- la promulgación de leyes que protejan los derechos de los infectados; las políticas que abordan la igualdad y sancionan la violencia de género;
- la adopción de estrategias que favorezcan la aceptabilidad y accesibilidad a los servicios de salud; y
- la financiación de iniciativas que sustentan este tipo de estrategias.
RECOMENDACIONES
- Se recomienda que en los ámbitos sanitarios donde se atiende a población general, se identifique el posible riesgo de adquirir el VIH para poder aplicar las medidas de prevención más acordes con cada riesgo (A-II)
- Uso de intervenciones de modificación del comportamiento basadas en la evidencia, que pueden suministrar la información y los conocimientos técnicos para ayudar a disminuir los riesgos, prevenir la transmisión del VIH y aumentar la utilización de los servicios por todos los grupos de población clave (B-II)
- Circuncisión masculina de carácter médico sólo en entornos con epidemia generalizada de la infección por el VIH (C-II)
- Las personas de los grupos “clave” deben utilizar el preservativo de manera correcta y sistemática junto con los lubricantes adecuados para prevenir la transmisión sexual del VIH y otras ITS (A-II)
- Realizar pruebas de detección del VIH periódicamente en poblaciones expuestas a un riesgo elevado (A-III)
- Se recomienda cribar la lues anualmente si hay relaciones sexuales no protegidas* y en el colectivo de GBHSH monitorizar al menos gonorrhoeae, C. trachomatis y VHC**. (B-II*, C-II**)
- Se recomienda la prevención ginecológica y la planificación familiar en las mujeres infectadas por el VIH*. En caso de deseo de embarazo o gestación debe prevenirse la transmisión materno-infantil** (B-III*, A-I**)
- Se recomienda la valoración social, incluyendo el entorno sociofamiliar y los medios de vida, para aportar medidas de apoyo en caso necesario (B-II)
Farmacológicas
Autores: Mar Vera, Lorena Caja
Revisores: Rafael Rubio, Juanjo Mascort
Las medidas preventivas farmacológicas para la prevención de la infección por el VIH, las podemos resumir en cuatro apartados.
1. Profilaxis post-exposición (PPE o PEP) al VIH:
La PPE es una estrategia farmacológica preventiva en la que individuos VIH negativos que han mantenido un posible contacto con el virus, una exposición de riesgo, toman tres fármacos antirretrovirales (FAR) durante 28 días para reducir el riesgo de contraer la infección por el VIH.
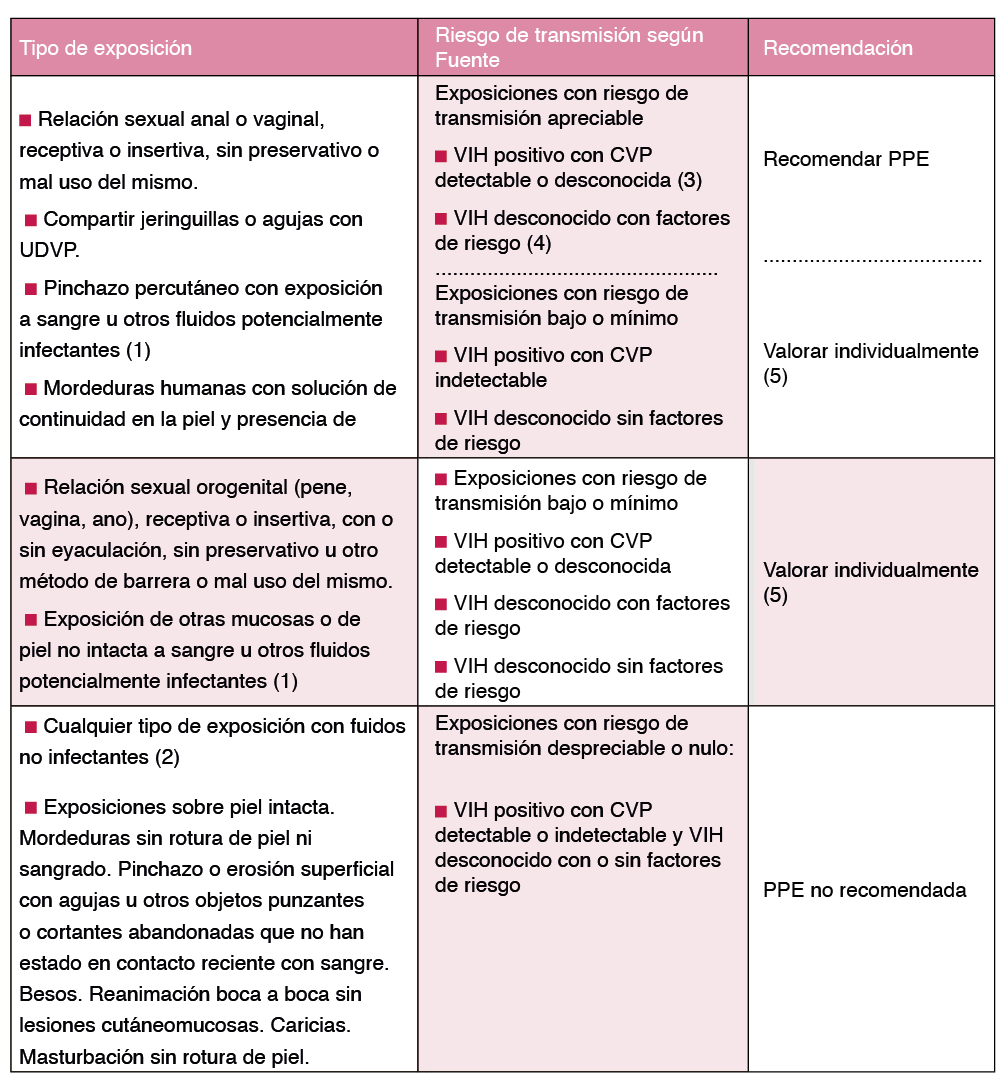
Debe comenzarse en las primeras 72 horas tras la potencial exposición (idealmente en las primeras 6 horas). La PPE ocupacional y no ocupacional debe indicarse tras la valoración del caso fuente, del estado serológico del receptor y de las características de la exposición27 Tabla 2.
Es recomendable realizar un seguimiento del paciente y, en el caso de exposición sexual, conviene descartar otras infecciones de transmisión sexual y, si procede, la gestación.
La prescripción de la PPE se recomienda para personas que han mantenido una exposición de riesgo ocasional.
2. Profilaxis pre-exposición (PrEP o PPrE) al VIH:
La PrEP es una herramienta preventiva consistente en administrar dos FAR a determinadas personas seronegativas para el VIH con prácticas de riesgo considerables Tabla 3, antes de su posible exposición al virus, con el objetivo de reducir la probabilidad de contraer dicha infección28. No debe iniciarse hasta haber descartado la infección.
Un estudio británico estimó que la prevención combinada compuesta por la implantación de la PrEP, junto al diagnóstico precoz del VIH y el acceso inmediato y universal al Tratamiento antiretroviral (TAR), reduciría a la mitad la incidencia del VIH entre los GBHSH en 202029.
En el año 2012 la PrEP fue aprobada por la Administración de Alimentos y Medicamentos de los Estados Unidos de América (FDA) y en 2016 por la Agencia Europea del Medicamento. Desde el 1 de noviembre de 2019 está aprobada y financiada en España por el SNS como tratamiento preventivo de la infección por el VIH30.
El MAP puede informar y recomendar la PrEP (la prescripción en casi todas las comunidades autònomas es hospitalaria), valorar posibles contraindicaciones y efectos adversos31 y promover la adherencia de los usuarios para obtener la máxima eficacia preventiva. Dado que la PrEP no protege frente a otras ITS, conviene realizar un consejo preventivo complementario, promoviendo el uso del preservativo y un cribado periódico de otras ITS.
3. Inicio del tratamiento antirretroviral (TAR) tras el diagnóstico del VIH:
El concepto “tratamiento como prevención” (Treatment as prevention: TasP) surge de la elevada efectividad preventiva del TAR descrita en varios estudios realizados en cohortes de parejas heterosexuales y homosexuales serodiscordantes al VIH, donde se observó una drástica reducción del riesgo de transmisión sexual del virus en aquellas parejas con un miembro infectado que recibía TAR32.
Para obtener el máximo potencial preventivo del TAR para la salud de cada individuo y para la salud pública, también es imprescindible efectuar el diagnóstico precoz de la infección por el VIH. La estrategia preventiva del cribado universal y del TAR precoz (“test and treat”) permite reducir la incidencia del VIH y el control de la pandemia. Además, el desconocimiento de la infección se ha relacionado con un mantenimiento de conductas de riesgo.
Los programas de prevención de la transmisión perinatal del VIH, basados en el consejo preventivo, el cribado sistemático de todas las gestantes salvo que declinen específicamente la oferta (opt-out), el TAR inmediato en las seropositivas y la profilaxis en el neonato, han reducido drásticamente la tasa de transmisión vertical del VIH33.
El TAR suprime persistentemente la carga viral plasmática y genital del VIH y reduce el riesgo de transmisión sexual y perinatal del virus, destacando como la herramienta preventiva más potente frente a la infección por el VIH34.
4. Tratamiento de las infecciones de transmisión sexual
El screening y tratamiento del resto de las ITS resulta fundamental como medida preventiva frente al VIH, ya que otras ITS aumentan el riesgo tanto de adquirir como de transmitir el VIH. En muchas ocasiones las ITS cursan de forma asintomática, especialmente en mujeres y en aquellas de localización extragenital, por lo que es necesario realizar un cribado en función de las prácticas sexuales de cada individuo35.
Las ITS ulcerativas y las de localización rectal incrementan el riesgo de adquirir la infección por el VIH36.
La AP, por su accesibilidad, su continuidad asistencial, por el conocimiento de la población y por la confianza que genera, constituye el marco ideal para identificar a aquellos pacientes que pueden beneficiarse de las medidas preventivas citadas en este capítulo37.
Recomendaciones
- Ofrecer TAR a todos los pacientes diagnosticados ya que suprime persistentemente la carga viral plasmática y genital del VIH y reduce el riesgo de transmisión sexual y perinatal del virus, destacando como la herramienta preventiva más potente frente a la infección por el VIH (A-I).
- Ofrecer la PrEP (A-I) y la PPE (A-II) en aquellas situaciones de riesgo en que están indicadas, ya que también son medidas farmacológicas muy efectivas en la prevención del
- Se recomienda realizar un cribado periódico de las ITS y tratarlas precozmente. Las ITS ulcerativas y de localización rectal incrementan el riego de adquirir el VIH (B-II).
Retraso diagnóstico. Estrategias para optimizar el cribado
Guías clínicas
Autores: Javier de la Torre, Juanjo Mascort
Revisor: Juan Flores
El diagnóstico precoz es probablemente la mayor asignatura pendiente de la respuesta a la infección por el VIH tanto en España como en el resto de los países desarrollados. Con el objetivo de detectar la infección oculta en la población, muchos países comenzaron a implementar estrategias de cribado dirigidas a la población general, una vez evidenciada que la oferta habitual de la prueba de detección del VIH es una intervención rentable, siempre y cuando la prevalencia de infección oculta del VIH sea de al menos del 0,1%38.
Se han publicado distintas recomendaciones sobre el tema: las guías realizadas por los Centros para el control y prevención de enfermedades (CDC) de Estados Unidos de América en 200639, las primeras en indicar la oferta rutinaria a la población general, otras que priorizan la oferta dirigida como las del estudio “Solicitud de VIH en condiciones indicadoras en Atención Primaria” (HIDES)40 o el Centro Europeo para la Prevención y Control de Enfermedades (ECDC)41 y por último las guías de la OMS42 o las del Plan Nacional del Sida de España43 que recomiendan ambos tipos de estrategias; la oferta, dirigida y la rutinaria, en función de la incidencia o prevalencia de la infección por el VIH.
Desde 2006, los CDC39 recomiendan realizar la prueba del VIH a todas las personas entre 14 y 65 años que acudan a un centro sanitario y que la acepten, sin que sea necesario valorar el riesgo de exposición ni que los pacientes presenten sintomatología. Esta recomendación significó un cambio muy relevante ya que, hasta ese momento, la oferta rutinaria se reservaba para embarazadas y personas recluidas en instituciones penitenciarias.
En 2008, Reino Unido comenzó a recomendar la realización de la prueba del VIH a todas las personas que acudieran por primera vez a su Centro de Atención Primaria (CAP) cuando la prevalencia local del VIH fuese superior al 0,2%44. Asimismo, desde 2009 en Francia se realiza el cribado de VIH a la población general entre 15 y 70 años de forma habitual, al menos, una vez en la vida45.
Las guías de la OMS de 201542, recomiendan el cribado rutinario en regiones con epidemia generalizada y alta prevalencia, mientras que en aquellas áreas donde la epidemia está muy concentrada en determinados subgrupos poblacionales y/o la prevalencia del VIH es baja, se recomienda el cribado dirigido. Pero, independientemente del tipo de epidemia y de la prevalencia local, recomiendan el cribado rutinario en las mujeres embarazadas, en las personas de los grupos vulnerables y en las que presentan otras infecciones de transmisión sexual o hepatitis víricas.
En Europa, la guía HIDES40 recomienda firmemente realizar la prueba del VIH a las personas que presenten cualquiera de las enfermedades definitorias de Sida de la clasificación del CDC y ofrecerla a aquellas personas con enfermedades indicadoras del VIH en las que la prevalencia de VIH se considera superior al 0,1%. También indica realizar la prueba a aquellas personas con enfermedades en las que la no detección de la infección por el VIH puede tener implicaciones negativas importantes.
En España, la Guía de recomendaciones para el diagnóstico precoz del VIH en el ámbito sanitario publicada por el Plan Nacional del Sida en 2014, recopila todos los criterios de la Guía HIDES y también recomienda ampliar las indicaciones ya existentes para la realización de la prueba (prueba a personas con síntomas sugerentes, oferta dirigida y de realización obligatoria). En esta guía se recomienda incorporar la oferta habitual para cualquier persona sexualmente activa de entre 20 y 59 años que requiera una extracción de sangre para analítica por cualquier motivo, siempre y cuando resida en provincias cuyas tasas de nuevos diagnósticos de VIH en el citado grupo de edad estuviera por encima del percentil 75 calculado durante los 3 últimos años a nivel nacional43. La Figura 2 muestra los distintos cribados recomendados por esta guía y la población diana a la que va orientado cada uno de ellos y la Tabla 4 recoge detalladamente las indicaciones de solicitud de la prueba del VIH. Según esta Guía la prueba debe repetirse anualmente en consumidores de drogas inyectadas, hombres que mantienen sexo con hombres, personas que ejercen la prostitución, parejas sexuales de personas con el VIH y personas en quienes se detecte un riesgo de exposición continuado.
En general el cribado rutinario de la población general en el marco de la AP en España no ha funcionado como se esperaba por varios motivos; entre otros, la escasa difusión que ha tenido la guía entre los profesionales sanitarios y la falta de claridad del último criterio relativo a las tasas de nuevos diagnósticos de VIH en cada provincia. Y esto hace que se pierdan muchas oportunidades de diagnóstico precoz del VIH46.
Por todo ello diversos autores consideran que se debería actualizar la guía de acuerdo con la última evidencia disponible para incorporar los datos de eficiencia, seleccionando de forma adecuada a los pacientes a los que se realiza la prueba y simplificando el criterio referente a la tasa necesaria de nuevos diagnósticos47.
Recomendaciones
- Actualizar y difundir la Guía de recomendaciones para el diagnóstico precoz del VIH en el ámbito sanitario publicada por el Plan Nacional del Sida, de acuerdo con la última evidencia disponible, definiendo unos estándares de calidad para mejorar la eficacia y la eficiencia de la detección de la infección, contando para ello con los profesionales de AP, AH y de urgencias (A-II).
- Reforzar la formación/información de los profesionales sanitarios sobre las implicaciones del retraso diagnóstico y la importancia del diagnóstico precoz de la infección por el VIH para que soliciten con mayor frecuencia la prueba rutinaria y la dirigida (A-III).
- Implementar estrategias e intervenciones claras y precisas para realizar el cribado del VIH en los diferentes ámbitos sanitarios, AP, AH y en el Área de Urgencias, facilitando a los profesionales las condiciones asistenciales adecuadas para que puedan llevarse a (A-II).
Experiencias prácticas en nuestro medio
Autores: Javier Martínez, Juanjo Mascort
Revisor: Jacinto Sánchez
En España disponemos de diferentes experiencias prácticas en estrategias para optimizar el cribado del VIH, tanto en el ámbito sanitario como en el comunitario, incluyendo unidades móviles, farmacias, locales gestionados por las ONG y estrategias de acercamiento en entornos de alto riesgo con oferta en locales de ocio o en la calle.
Como se ha comentado en el capítulo anterior, las guías españolas recomiendan el cribado dirigido del VIH en personas con condiciones indicadoras de infección por VIH/Sida o antecedentes de exposición de riesgo, pero además incluyen el cribado rutinario en todas aquellas personas entre 20 y 59 años, sexualmente activas, que acudan a una consulta de AP y se les indique una extracción de sangre por cualquier otro motivo.
El proyecto “Evaluación de estrategias para promover el diagnóstico precoz del VIH en AP” en la Comunidad de Madrid (ESTVIH) tiene como objetivo mejorar la implementación de estas recomendaciones. En un primer trabajo se ha evaluado la viabilidad de la implementación de estas estrategias (basadas en condiciones indicadoras, riesgo de exposición y oferta universal) en seis centros de AP. Se observó un mayor reclutamiento de pacientes con la estrategia de condiciones indicadoras (47,2%, frente a tan solo el 18,5% en la oferta universal y el 14,3% en la estrategia basada en el riesgo)48. Aunque los casos de infección por el VIH diagnosticados en ESTVIH fueron pocos, lo cierto es que aquellos diagnosticados por enfermedad indicadora cumplían criterios de retraso diagnóstico o enfermedad avanzada, indicando claramente que es necesario algo más que la enfermedad indicadora.
Otro trabajo de ámbito estatal, el “Estudio de implementación de la oferta rutinaria de la prueba del VIH en AP” (VIH-AP), se marcó como objetivo evaluar la aceptabilidad de la búsqueda oportunista del VIH en los centros de AP. Se incluyeron adultos que nunca se habían realizado la prueba del VIH y a los que se solicitó un análisis de sangre por otro motivo. Del total de 3.314 pacientes, distribuidos en 150 centros de salud, el 93,1% aceptó someterse a la prueba del VIH (a pesar de que el 56,9% consideraba no tener riesgo de infección)49. La prevalencia de infección por el VIH detectada fue del 0,24% y los diagnósticos fueron precoces.
Los proyectos DRIVE (Diagnóstico Rápido de la Infección por VIH en España) realizados en Madrid han evaluado el impacto que tienen las estrategias formativas de colaboración y la dotación a los centros de AP de un cuestionario de autoevaluación del riesgo de infección por el VIH (validado con una sensibilidad y un valor predictivo negativo del 100%), además de pruebas rápidas y de un circuito ágil de derivación de los pacientes diagnosticados. Y han demostrado un beneficio en las tasas de cribado, en los nuevos diagnósticos del VIH y en la reducción del diagnóstico tardío5051. Otros estudios concluyen de manera similar una alta aceptabilidad para el uso de pruebas rápidas en Atención Primaria por parte del personal sanitario52.
En Cataluña también se han realizado proyectos multicéntricos donde se han evaluado el impacto de estas estrategias de colaboración, objetivando también un aumento en la solicitud de serologías en el periodo posterior a las sesiones formativas, aunque ha persistido un alto porcentaje de oportunidades de diagnóstico perdidas5354.
Otros proyectos donde se comparan las diferentes estrategias de cribado en Atención Primaria concluyen que la prueba de VIH guiada por condiciones indicadoras parece ser una estrategia más factible y menos costosa que una estrategia no dirigida5556, aunque la opción de cribado rutinario en áreas con prevalencia superior al 0,1% es la estrategia recomendada actualmente por el Ministerio de Sanidad57.
Por último, en el ámbito sanitario, se ha evaluado la introducción de alertas electrónicas que instan a los médicos de AP a solicitar una prueba del VIH cuando se diagnostica una condición indicadora predefinida, demostrando un aumento significativo de las solicitudes de serologías58.
Además del personal médico, el personal de enfermería debería desempeñar un papel importante en la prevención y diagnóstico del VIH. En nuestro medio existen estudios que muestran el papel que puede tener el personal de enfermería especializado en la atención a los pacientes con el VIH59.
Por otra parte, ya en el ámbito comunitario, la oferta en unidades móviles en entornos de alto riesgo ha conseguido la detección del VIH en una etapa más temprana que en los centros sanitarios y con una baja tasa de falsos positivos60. Existen estrategias de acercamiento en la calle que han demostrado mejorar el diagnóstico precoz del VIH principalmente en los GBHSH y una buena vinculación a los cuidados61. Otros proyectos más recientes evalúan la oferta de auto-toma de saliva en entornos de ocio, con envío de la muestra al laboratorio de referencia y consulta de los resultados a través de una página web segura, demostrando que es una estrategia factible y eficaz62. También existe evidencia del beneficio del cribado en entornos que no son de alto riesgo, como la oferta de pruebas rápidas en farmacias63 o universidades64. Además, desde principios de 2018 se ha implementado la venta de autotest VIH® en farmacias, sin necesidad de receta médica, para su realización en los domicilios65.
Recomendaciones
- Se debe seguir trabajando en el desarrollo de más estrategias de cribado, potenciando las ya existentes, garantizando su continuidad y sostenibilidad, para disminuir el porcentaje de infección oculta y de diagnóstico tardío del VIH (A-II).
- Se recomienda optimizar el cribado del VIH mediante la implementación de estrategias a nivel de AP y entornos comunitarios (B-I).
Derivación a las Unidades Hospitalarias
Valoración e inicio del tratamiento antirretroviral (TAR)
Autora: Sara Nistal
Revisores: Rafael Rubio, Lorena Caja
En España se diagnostican anualmente más de 3.000 nuevos casos de infección por el VIH, y casi un 50% se diagnostican de forma tardía; es decir, cuando presentan un recuento de CD4 inferior a 350 cél/µL o cuando ya han presentado un evento definitorio de Sida. Además esta situación se mantiene estable en los últimos años66.
Esta circunstancia es importante ya que hay que recordar que aquellos pacientes que en el momento del diagnóstico tienen los CD4 por debajo de 350 cél/µL, tienen diez veces más riesgo de fallecer en el primer año tras su diagnóstico, que aquellos que tienen más de 350 cél/µL67. Y por otra parte, que estos pacientes, sin diagnosticar y por tanto sin tratar, son el origen de la mayoría de las nuevas infecciones.
El papel de la AP, como ya hemos visto en apartados anteriores, es fundamental en el diagnóstico precoz, en la promoción de estilos de vida saludables, en el fomento del correcto cumplimiento del TAR, en la detección precoz de enfermedades oportunistas y de otras infecciones de transmisión sexual y en el diagnóstico de comorbilidades asociadas68.
El manejo clínico inicial de los pacientes debe incluir una anamnesis completa, un examen físico dirigido a detectar complicaciones relacionadas con el VIH y la realización de pruebas complementarias para identificar comorbilidades y coinfecciones asociadas, así como para conocer la situación inmunológica y virològica del paciente.
Valoración inicial697071727374.
Anamnesis:
- Fecha aproximada de infección por el VIH, del riesgo potencial (drogas, relaciones sexuales…) o de clínica sugestiva de primoinfección. Fecha de la última serología negativa.
- Potencial fuente de transmisión y conductas de riesgo del paciente (historia sexual, drogas, Chemsex).
País de origen, profesión, aficiones y animales domésticos.
Viajes efectuados, residencia actual y previas.
Antecedente de transfusiones de derivados hemáticos.
Alergias medicamentosas, vacunaciones previas, tratamiento habitual.
Infecciones previas (incluidas ITS) y sintomatología relacionada con el VIH (anamnesis por órganos y aparatos).
Antecedentes familiares de enfermedades metabólicas (Diabetes mellitus tipo II (DM2), cardiovasculares, dislipemias) o tumorales.
Trastornos cognitivos y neurológicos.
Calidad de vida del paciente y hábitos tóxicos (tabaquismo, alcohol, etc.).
Patología médica asociada (hepatopatía, nefropatía…), deseo reproductivo en caso de mujeres, así como exploraciones complementarias realizadas: revisiones ginecológicas (mamografía, citología vaginal), urológicas, colonoscopias, densitometrías…
Exploración física:
- Peso, talla, índice de masa corporal, perímetro abdominal y tensión arterial.
- Adenopatías loco-regionales.
- Piel y mucosas.
- Auscultación cardiaca y pulmonar, exploración abdominal, valoración de extremidades con pulsos periféricos.
- Exploración neurológica y neurocognitiva.
- Examen ginecológico en mujeres (exploración mamaria, citología).
- En los HSH debe realizarse un tacto rectal y/o citología anal.
- Cribado de ITS, incluyendo exudados.
Pruebas complementarias:
- Hemograma y fórmula leucocitaria, recuento plaquetario y subpoblaciones linfocitarias (CD4/CD8).
- Bioquímica básica con filtrado glomerular, perfil hepático y lipídico.
- Anticuerpos (ELISA) y prueba de confirmación si disponemos de una sola serología VIH previa.
- Carga viral del VIH (ARN VIH-1).
- Genotipo de resistencias del VIH-1.
- HLA-B*5701 (Detección del subtipo *5701 del gen HLA-B asociado a hipersensibilidad a Abacavir).
- Serologías: VHA, VHB, VHC, CMV, T. pallidum y T. gondii.
- Sedimento de orina, proteinuria y glucosuria.
- Radiografía de tórax y electrocardiograma.
- PPD (Prueba cutánea de derivado proteico purificado) o IGRA (Prueba ensayo de liberación de interferón-gamma), si inmunodeprimido (TBC).
- Cuestionarios de cribado de depresión y deterioro neurocognitivo.
Otras pruebas complementarias, según se considere:
- Tropismo viral (si se va a pautar TAR que incluya antagonista del receptor CCR5)
- Examen de parásitos en heces, Trypanosoma cruzi, Strongyloides stercolaris, Malaria y Esquistosomiasis, si el paciente procede de un área endémica.
- Densitometría (si existen factores riesgo para la osteoporosis/osteopenia)
- Ecografía abdominal (si existe hipertransaminasemia, coinfección con virus hepatotropos o abuso de alcohol).
- Exploración urológica y solicitar antígeno prostático específico (PSA) en función de las recomendaciones que existen en la población general.
- Cálculo del riesgo cardiovascular (RCV).
Tratamiento
Los objetivos del TAR son conseguir la supresión de la Carga Viral Plasmática (CVP), restablecer y preservar la función inmunológica, reducir la morbilidad asociada a la replicación del VIH, aumentar la supervivencia y prevenir la transmisión del VIH (a menor CVP, menor riesgo de transmisión de la infección).
Las principales sociedades científicas recomiendan el inicio de TAR en todo paciente diagnosticado de infección por el VIH, independientemente de su estado inmunovirológico69.
El inicio rápido del TAR (el mismo día del diagnóstico o en la primera semana) incrementa la proporción de pacientes con supresión virológica.
Aun así, es importante hacer una valoración individualizada del momento adecuado para el inicio del TAR, teniendo en cuenta la disposición del paciente, fundamental para una adecuada adherencia.
La implementación de la estrategia de inicio rápido requiere de una buena coordinación entre los centros donde habitualmente se realiza el diagnóstico del VIH (AP, urgencias, centros de ITS o recursos comunitarios) y las unidades de seguimiento de pacientes con infección por el VIH, circunstancia que no se da con frecuencia.
En la mayoría de las ocasiones no se suele iniciar el TAR en la primera visita, a la espera de algunos resultados analíticos: HLAB57*01, estudio genotípico de resistencias… Sin embargo, sí se debe iniciar el TAR y la profilaxis primaria para P. jirovecii, sin esperar los resultados analíticos en aquellos pacientes con inmunodepresión grave conocida (CD4< 200 cél/µL), en aquellos diagnosticados de alguna enfermedad asociada al VIH, en los pacientes con elevado riesgo de transmisión del VIH (pacientes con múltiples relaciones sexuales o dificultad para la utilización del preservativo), en las mujeres embarazadas en el tercer mes de gestación o cuando aparezcan marcadores clínicos de progresión de la infección crónica del VIH (candidiasis oral, leucoplasia vellosa o síntomas constitucionales: fiebre, sudoración nocturna, astenia crónica, diarrea crónica y/o pérdida de más del 10% del peso).
Las pautas recomendadas para el tratamiento inicial de la infección por el VIH-1 se actualizan anualmente en el “Documento de consenso respecto al tratamiento antirretroviral del adulto con infección por VIH”, elaborado por el Panel de Expertos de GeSIDA y Plan Nacional sobre el Sida75 y consisten en una combinación de dos o tres fármacos FAR.
Las pautas triples deben incluir dos Inhibidores de la transcriptasa inversa análogos de nucleósido/tido (ITIAN) asociados a un Inhibidor de la integrasa (INI), a un Inhibidor de la transcriptasa inversa no nucleósido (ITINN), o a un Inhibidor de la proteasa potenciado (IP/p). La única pauta doble recomendada en el momento actual como TAR de inicio consiste en la combinación de un ITIAN (Lamivudina) y un INI (Dolutegravir). Con estas combinaciones se puede conseguir una CVP indetectable en más del 85% de los pacientes a las 48 semanas de tratamiento75.
Tanto desde AP como desde AH hay que fomentar una adecuada adherencia al TAR, ya que una supresión de la replicación viral duradera mejorará la calidad de vida de los pacientes y reducirá el riesgo de transmisión del VIH (Indetectable=Intransmisible).
Por otra parte, es importante el papel que los MAP tienen en el manejo de posibles interacciones farmacológicas con los FAR. Las posibles interacciones farmacológicas se pueden consultar en diversas páginas web, entre las que podemos destacar:
http://www.hiv-druginteractions.org (la más usada y muy actualizada; en inglés y castellano)
http://app.hivclinic.ca (en inglés)
http://www.hivmedicationguide.com (en inglés y francés)
http://www.interaccionesvih.com (en español)
RECOMENDACIONES
- Se recomienda la administración de TAR a todos los pacientes con infección por el VIH para evitar la progresión de la enfermedad, limitar el efecto nocivo sobre posibles morbilidades coexistentes y disminuir la transmisión del virus (A-I).
- Se recomienda iniciar el TAR tan pronto como sea posible tras el diagnóstico del VIH (A-II)
- El inicio del TAR debe valorarse siempre individualmente, realizándose siempre una determinación de CD4, CVP y prueba de resistencias a los FAR, previa al inicio del tratamiento (A-III).
Otros motivos de derivación
Autor: Lucio J García-Fraile
Revisora: Lorena Caja
El diagnóstico de la infección por el VIH y el inicio del TAR son el motivo principal de derivación de una PVIH a una unidad especializada hospitalaria.
Pero existen muchos momentos en el seguimiento de una PVIH que precisan de valoración hospitalaria, siendo necesario el manejo compartido entre AP Y AH.
Las entidades más relevantes se detallan en los capítulos específicos de este documento (interacciones medicamentosas, comorbilidades orgánicas y psiquiátricas, consumo de tóxicos, chemsex, embarazo y contracepción…), pero en este apartado pretendemos reflejar un conjunto de procesos de diferente índole.
Derivación desde AP a AH
- Procesos relacionados con la Salud sexual, Infecciones de Trasmisión Sexual (ITS) y Síndromes asociados a prácticas sexuales:
- Infección por virus del papiloma humano (VPH) y patología benigna asociada al VPH, sífilis (dudas sobre su tratamiento adecuado, manifestaciones atípicas o aberrantes), uretritis/proctitis/cervicovaginitis en caso de dudas sobre la etiología o cuadros atípicos. Si bien muchas de estas entidades se manejan habitualmente desde AP, en ocasiones pueden ser derivadas a Dermatología o, mejor aún, al especialista en VIH que trata habitualmente al paciente.
- Cribado por contactos/prácticas sexuales de alto riesgo cuando no sea posible realizarlo en AP. En los casos en los que se dé un elevado riesgo de trasmisión de ITS (VIH y otros agentes) se puede requerir de un cribado ampliado en el tiempo, tanto para el paciente con VIH en seguimiento como para sus parejas sexuales. Las pruebas necesarias deberían integrarse en las revisiones programadas con el objetivo de reducir iatrogenia y costes, y de mejorar la adherencia global.
- Planteamiento de estrategias de reducción de riesgo ante prácticas con alto riesgo de trasmisión del VIH y otras ITS u otras entidades.
- Procesos infecciosos no oportunistas (no Sida) frecuentes en personas con VIH: VHA, gastroenteritis bacterianas/víricas, primoinfección por CMV o VEB, contacto/ infección por varicela-zóster, infección aguda o crónica por virus herpes simple (VHS).
- Síndromes/síntomas potencialmente relacionados con el VIH o el TAR, antes de solicitarse una valoración a otros especialistas: gastrointestinal (diarrea, náuseas y vómitos, flatulencia), neuropsiquiátrico (cefalea, mareo, insomnio, irritabilidad, depresión), metabólico (dislipemia, resistencia a la insulina, aumento de peso, lipodistrofia…), nefrológicos (deterioro de la función renal...).
- Los procesos clínicos sistémicos de gravedad potencial son causa habitual de derivación a Medicina Interna, pero en un paciente con VIH deberían abordarse de forma especializada desde la Unidad de VIH (fiebre de origen desconocido, síndrome pseudogripal, síndrome constitucional, diarrea a estudio, alteraciones analíticas relevantes…).
Otros motivos de derivación desde AP a AH podrían ser los siguientes:
- Derivación de pacientes con VIH en tratamiento que requieran la dispensación de medicación en un centro diferente al suyo; situación habitual por razones varias como migraciones, desplazamientos por ocio o trabajo entre otras.
- Detección por parte del MF de pérdidas de seguimiento en la unidad especializada de VIH, con o sin pérdida de adherencia al TAR.
- Procesos administrativos en los que se requiera un informe clínico de la Unidad Hospitalaria de referencia de la PVIH.
Una situación en la que es especialmente importante la colaboración entre AP y AH es la de aquellas PVIH que no quieren acudir a unidades especializadas hospitalarias. Esto puede ocurrir por múltiples razones, coexistiendo la percepción del estigma, condicionantes socioeconómicos, factores culturales, creencias personales y falta de confianza en el sistema sanitario, como principales causas. En estos casos es probable que desde AP se mantenga una relación satisfactoria con la PVIH, pudiéndose aprovechar este vínculo para ofrecer un seguimiento compartido y así plantear estrategias que palien la falta de atención en el nivel hospitalario y el acceso al TAR (profilaxis de IO y la posibilidad de acceder al TAR desde AP) a la vez que se hace hincapié en la prevención a las parejas sexuales del paciente.
Derivación desde AH hacia AP
Se debe derivar a AP a las PVIH que precisen atención en aquellos procesos que son manejados de forma habitual por el MAP:
- Cribado de HTA, DM2, dislipemia.
- Inicio de tratamiento de HTA, DM2, dislipemia.
- Promoción de estilos de vida saludables (deshabituación del hábito tabáquico, alimentación, ejercicio físico…).
- Estudio de condicionantes sociales de vulnerabilidad.
Por otra parte, deben evitarse derivaciones a AP para que los pacientes en seguimiento en las unidades hospitalarias de VIH sean valorados y tratados por otros especialistas hospitalarios, así como para realizar pruebas diagnósticas, estableciendo los circuitos adecuados en aquellos departamentos de salud que carezcan de ellos.
Especial atención merece el tema de las vacunaciones que en muchas ocasiones no está correctamente resuelto ni desde AP ni desde AH.
Por último, es importante recalcar que con el objetivo de optimizar la calidad del modelo asistencial evitando una falta o un exceso de derivaciones de los pacientes con VIH, muchas de estas derivaciones pueden hacerse a través de modelos no presenciales o e-consultas. Éstas permiten un intercambio de información y una alta resolución en problemas clínicos sin que el paciente deba desplazarse, manteniendo así al MAP en el eje central del manejo clínico y de la prevención del paciente con VIH y de su comunidad.
Recomendaciones
- Debe facilitarse una comunicación ágil, telefónica o telemática a ser posible, entre el especialista de MAP y el especialista hospitalario en VIH que facilite el acceso del paciente tras su diagnóstico, así como en aquellas otras situaciones mencionadas en este capítulo. Así se podrá optimizar la calidad asistencial y realizar derivaciones no presenciales o e-consultas, evitar excesos/defectos de derivaciones y garantizar el intercambio de información y una alta resolución. (A-II)
- Se deben generar circuitos de interconsulta rápida bidireccional entre AP y AH, adaptados a las características de cada centro, para las PVIH que presenten ITS, infecciones no asociadas al VIH/Sida, para aquellas que tengan necesidad de estudio de un síndrome sistémico o PVIH que no deseen acudir al hospital y puedan ser atendidas en AP, o aquellas desplazadas que requieren TAR, o que precisan realizar determinados trámites (A-III)
- Se debe derivar a AP a las PVIH que precisen atención en aquellas patologías que son habitualmente manejadas por el MAP, manteniendo a éste en el centro de la asistencia de la (A-II)
Gráficos:


Tablas:
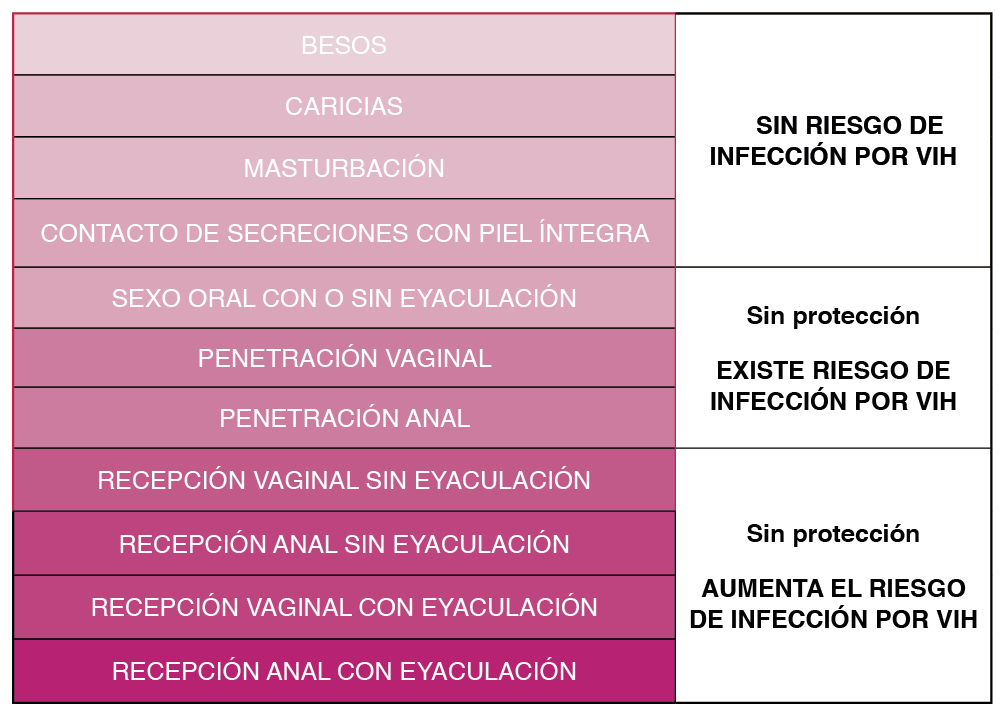
1 Sangre, fluidos que contengan sangre visible, semen, secreciones vaginales, líquidos cefalorraquídeo. pleural pericárdico, peritonal sinovial, amniótico, y leche humana.
2 Orina, heces, saliva, vómitos, secreciones nasales, lágrimas, sudor y esputo, si no contienen sangre visible.
3 Cuanto mayor sea la CVP mayor es el riesgo de transmisión.
4 HSH, UDVP, trabajador del sexo, agresor sexual, antecedentes de ingreso en centros penitenciarios y natural de un país con una prevalencia de VIH superior al 1% (Haití, Bahamas, Jamaica, Belice, Trinidad y Tobago, Estonia, Rusia, Tailandia y África subsahariana)
5 Valorar individualmente cada En general se recomienda inciar PPE si la fuente es VIH + con CVP detectable o desconocida, o si es VIH desconocido sin factores de riesgo. Si la fuente VIH desconocido sin factores de riesgo, se puede considerar no realizar PPE dado que el riesgo de transmisión es muy bajo.


Bibliografía:
1. Ministerio de Sanidad y Secretaria del Plan Nacional sobre el SIDA. Prevención y asistencia de la infección por VIH en Atención Primaria. 2001. Madrid Disponible en https:// www.mscbs.gob.es/ciudadanos/enfLesiones/enfTransmisibles/sida/docs/prevencion_ ap.pdf
2. Ministerio de Sanidad, Igualdad y Asuntos Sociales. Guía de Recomendaciones para el diagnóstico Precoz del VIH en el ámbito 2014. Madrid.
3. Gökengin D, Geretti AM, Begovac J, et (2014). 2014 European guideline on HIV testing. International Journal of STD and AIDS, 25(10), 695–704. https://doi.org/10.1177/0956462414531244
4. World Health (2007). Guidance on provider-initiated HIV testing and counselling in health facilities. Health (San Francisco), 1–60.
5. European Center for Disease Prevention and Control HIV testing: increasing uptake and effectiveness in the European Union [Internet]. Stockholm: ECDC; [cited 2017 Aug 24]. Available from: https://ecdc.europa.eu/sites/portal/files/media/en/publications/ Publications/101129_GUI_HIV_testing.pdf
6. Molina ¿Qué es eso de la interseccionalidad? Aproximación al tratamiento de la diversidad desde la perspectiva de género en España. Investig Fem. 2013;3:203–22.
7. Agustí C, Fernández L, Mascort J; en nombre del Grupo de Trabajo del Diagnóstico Precoz del VIH en Atención Primaria en España. Barreras para el diagnóstico de las infecciones de transmisión sexual y virus de la inmunodeficiencia humana en Atención Primaria en España [Problems in diagnosing sexually transmitted infections and human immunodeficiency virus in primary health care in Spain]. Enferm Infecc Microbiol Clin. 2013 Aug-Sep;31(7):451-4. Spanish. doi: 10.1016/j.eimc.2012.12.012. Epub 2013 Feb PMID: 23428311.
8. Wimberly YH, Hogben M, Moore-Ruffin J, et al. Sexual history-taking among primary care J Natl Med Assoc. 2006;98:1924–1929.
9. Patel P, Borkowf CB, Brooks JT, et al. Estimating per-act HIV transmission risk: a systematic review. 2014. doi: 10.1097/QAD.0000000000000298
10. Grupo de expertos HIV in Europe. Enfermedades indicadoras de infección por VIH. http://www.saei.org/biblioteca/descargar/id/217.
11. Haukoos JS, Hopkins E, Bender B, et Comparison of enhanced targeted rapid HIV screening using the Denver HIV risk score to nontargeted rapid HIV screening in the emergency department. Ann Emerg Med. 2013; 61:353 -361.
12. Pérez Elías MJ, Gómez-Ayerbe C, Pérez Elías P, et al. Development and Validation of an HIV Risk Exposure and Indicator Conditions Questionnaire to Support Targeted HIV Medicine (Baltimore). 2016;95(5):e2612.
13. VIH/Sida. Disponible en: https://www.who.int/es/news-room/fact-sheets/detail/ hiv-aids. Acceso: 4 de diciembre de 2020.
14. Plan Estratégico de Prevención y Control de la infección por VIH y otras infecciones de transmisión sexual. Prórroga 2017-2020. Plan Nacional sobre el Sida, Ministerio de Sanidad, Servicios Sociales e Igualdad,
15. Acción acelerada para la Prevención Combinada. Hacia la reducción de nuevas infecciones por el VIH a menos de 500.000, de aquí a 2020. Ginebra: ONUSIDA, 2015.
16. Naciones Declaración Política sobre el VIH y el SIDA: en la vía rápida para acelerar la lucha contra el VIH y poner fin a la epidemia del SIDA para 2030. Resolución aprobada por la Asamblea General el 8 de junio de 2016. Disponible en: https://www.unaids.org/es/resources/documents/2016/2016-political-declaration-HIV- AIDS. Acceso: 28 de diciembre de 2020
17. Bekker LG, Alleyne G, Baral S, et al. Advancing global health and strengthening the HIV response in the era of the Sustainable Development Goals: the International AIDS Society- Lancet Lancet 2018; 392: 312-358. doi: 10.1016/S0140-6736(18)31070-5
18. Martínez-Sanz J, Pérez-Elias MJ, Muriel A, et Outcome of an HIV education program for primary care providers: Screening and late diagnosis rates. Plos One 2019; 14: e0218380.
19. Chu C, Selwyn An Epidemic in Evolution: The Need for New Models of HIV Care in the Chronic Disease Era. J Urban Health 2011;88:556–566.
20. Kendall CE, Shoemaker ES, Boucher L, et The organizational attributes of HIV care delivery models in Canada: A cross-sectional study. Plos One 2018; 13(6): e0199395.
21. Henny KD, Duke ChC, Geter A, et HIV-Related Training and Correlates of Knowledge, HIV Screening and Prescribing of nPEP and PrEP Among Primary Care Providers in Southeast United States, 2017. AIDS Behav 2019; 23: 2926-2935.
22. Ramón JL, Zorzano VIH-Sida y todo lo que puede hacer el médico de família. AMF 2018;14: 295-304
23. Circuncisión médica masculina voluntaria. VMMC. Disponible en: https:// www.unaids.org/es/resources/presscentre/featurestories/2016/october/20161017_ voluntary-medical-male-circumcision. Acceso: 9 de diciembre de 2020.
24. Auvert B, Taljaard D, Lagarde E, et Correction: Randomized, Controlled Intervention Trial of Male Circumcision for Reduction of HIV Infection Risk: The ANRS 1265 Trial. PLOS Medicine 2006; 3(5):e226. Disponible en: https://journals.plos.org/plosmedicine/ article?id=10.1371/journal.pmed.0030226 Acceso: 13 de diciembre de 2020.
25. Prevención del VIH. Disponible en: https://www.cdc.gov/hiv/spanish/basics/ prevention.html Acceso: 13 de diciembre de 2020.
26. Indicadores de calidad asistencial de GESIDA para la atención de personas que viven con el VIH, 2020. Disponible en: http://gesida-seimc.org/wp-content/ uploads/2020/11/indice_calidad_Guia_GeSIDA.pdf Acceso: 14 de diciembre de 2020.
27. Polo R, Aguirrebengoa K, Vives N, coordinadores. Recomendaciones del SPNS, GESIDA, CEESCAT, SEIP Y AEP sobre profilaxis postexposición frente al VIH, VHB y VHC en adultos y niños. Disponible en: https://www.msssi.gob.es/ciudadanos/enfLesiones/ enfTransmisibles/sida/docs/PPE_14-01- pdf
28. Molina JM et al for the ANRS IPERGAY Study Group. On-Demand Preexposure Prophylaxis in Men at High Risk for HIV-1 Infection. N Engl J Med 2015; 373:2237-2246 December 3, 2015 DOI: 1056/NEJMoa1506273.
29. Punyacharoensin N, Edmunds WJ , De Angelis D, et Effect of pre-exposure prophylaxis and combination HIV prevention for men who have sex with men in the UK: A mathematical modelling study. Lancet HIV. 2016; 3:e94–104.
30. Grupo de Trabajo de PrEP. Plan Nacional Sobre el Sida. Ministerio de Sanidad, Servicios Sociales e Igualdad. Manual de implementación de un Programa de Profilaxis Preexposición al VIH en España. Febrero
31. Ascher SB, Scherzer R, Estrella MM, et HIV pre-exposure prophylaxis with tenofovir disoproxil fumarate/ emtricitabine and changes in kidney function and tubular health. AIDS: December 02, 2019 - Volume Publish Ahead of Print - Issue - doi: 10.1097/QAD.
32. Attia S, Egger M, Muller M, et al. Sexual transmission of HIV according to viral load and antiretroviral therapy: systematic review and meta-analysis. AIDS 2009; 23(11): 1397-
33. Michael S, Saag, MD; Rajesh T, et Antiretroviral Drugs for Treatment and Prevention of HIV Infection in Adults. 2020 Recommendations of the International Antiviral Society- USA Panel. JAMA. 2020;324(16):1651-1669.
34. Alastrué Loscos I, Carrillo Muñoz R, Casanovas Colominas JM, et Infección por el VIH. En: Grupo de Trabajo de Enfermedades Infecciosas de la semFYC. Manual de enfermedades infecciosas en Atención Primaria. 4.ª ed. Barcelona: Congresos y Ediciones Semfyc; 2017. pp. 209-28.
35. Thompson MA, Horberg MA, Agwu AL, et al. Primary Care Guidance for Persons with Human Immunodeficiency Virus: 2020 Update by the HIV Medicine Association of the Infectious Diseases Society of America. Clin Infect Dis [Internet]. 6 de noviembre de 2020 [citado 12 de enero de 2021]; Disponible en: https://academic.oup.com/cid/advancearticle/ doi/10.1093/cid/ciaa1391/5956736
36. Del Romero J, García-Pérez JN, Espasa-Soley M. Prevención y tratamiento de las infecciones de transmisión sexual en personas con alto riesgo, incluyendo pacientes infectados por el Enfermedades Infecc Microbiol Clínica. febrero de 2019; 37(2):117- 26.
37. Ramón JL, Zorzano VIH-Sida y todo lo que puede hacer el Médico de Familia. AMF 2018;14: 295-304.
38. Technical Expert Panel Review of CDC HIV Counseling TaRG. Revised Guidelines for HIV Counseling, Testing, and Referral. 1999. Disponible en: http://www.cdc.gov/mmwr/ preview/mmwrhtml/rr5019a1.htm. (Consulta enero 2021)
39. Branson, Bernard M., et al. “Revised Recommendations for HIV Testing of Adults, Adolescents, and Pregnant Women in Health-Care Settings.” Morbidity and Mortality Weekly Report: Recommendations and Reports, 55, no. 14, 2006, pp. 1-CE-4. JSTOR, www.jstor.org/stable/24842342. (Consulta enero 2021)
40. HIV in Enfermedades indicadoras de infección por VIH: Guía para la realización de la prueba del VIH a adultos en entornos sanitarios, 2011. Disponible en: https://www.eurotest.org/Portals/0/Guidance/2012-014_CHIP_losark-ESPANIA. pdf?ver=2014-02-10-124216-370 (Consulta enero 2021)
41. European Centre for Disease Prevention and Control. HIV testing: increasing uptake and effectiveness in the European Estocolmo: EDCD; 2010. Disponible en: https:// www.ecdc.europa.eu/sites/portal/files/media/en/publications/Publications/101129_GUI_ HIV_testing.pdf (Consulta enero 2021)
42. Consolidated guidelines on HIV testing services, 2015. Disponible en: https://apps.who.int/iris/bitstream/handle/10665/179870/9789241508926_eng. pdf;jsessionid=E224EA7581247FC0170BA9522A9E9D30?sequence=1 (Consulta enero 2021)
43. Guía de recomendaciones para el diagnóstico precoz del VIH en el ámbito Plan Nacional del Sida. MSSSI 2014. Disponible en: https://www.mscbs.gob.es/ciudadanos/ enfLesiones/enfTransmisibles/sida/docs/GUIA_DX_VIH.pdf (Consulta enero 2021)
44. British HIV Association/British Association for Sexual Health and HIV/British Infection Association Adult HIV Testing Guidelines 2020. Disponible en: https://www.bhiva.org/HIV- testing-guidelines
45. Yazdanpanah Y, Perelman J, DiLorenzo MA, et al. Routine HIV screening in France: Clinical impact and cost-efectiveness. PLoS 2010;5:e13132.
46. Agustí C, Montoliu A, Mascort J, et al. Missed opportunities for HIV testing of patients diagnosed with an indicator condition in primary care in Catalonia, Spain. Sex Transm 2016;92:387-92
47. Moreno S, Berenguer J, Fuster-Ruizdeapodaca, MJ, et al. (2018). Early diagnosis. Detección temprana. Enfermedades infecciosas y microbiologia clinica, 36 Suppl 1, 35–
48. Domínguez-Berjón MF, Pichiule-Castañeda M, García-Riolobos MC, et al. A feasibility study for 3 strategies promoting HIV testing in primary health care in Madrid, Spain (ESTVIH project). J Eval Clin Pract 2017; 23: 1408–14.
49. Puentes Torres RC, Aguado Taberné C, Pérula de Torres LA, et al.. Aceptabilidad de la búsqueda oportunista de la infección por el virus de la inmunodeficiencia humana mediante serología en pacientes captados en centros de atención primaria de España: estudio VIH-AP. Aten Primaria 2016; 48: 383–93.
50. Gómez-Ayerbe C, Martínez-Sanz J, Muriel A, et al. Impact of a structured HIV testing program in a hospital emergency department and a primary care center. Plos One 2019; 14:
51. Martínez-Sanz J, Vivancos MJ, Sánchez-Conde M, et Hepatitis C and HIV combined screening in primary care: A cluster randomized trial. J Viral Hepat 2020. Online ahead of print. DOI:10.1111/jvh.13413.
52. Agustí C, Fernàndez-López L, Mascort J, et al. Attitudes to rapid HIV testing among Spanish General HIV Med 2013; 14: 53–6.
53. Cayuelas-Redondo L, Menacho-Pascual I, Noguera-Sánchez P, et al. Solicitud de VIH en condiciones indicadoras en atención primaria: resultados de una colaboración. Enferm Infecc Microbiol Clin 2015; 33: 656–62.
54. Agustí C, Montoliu A, Mascort J, et al. Missed opportunities for HIV testing of patients diagnosed with an indicator condition in primary care in Catalonia, Spain. Sex Transm Infect 2016; 92: 387–92.
55. Menacho I, Sequeira E, Muns M, et al. Comparison of two HIV testing strategies in primary care centres: indicator-condition-guided testing vs. testing of those with non- indicator HIV Med 2013; 14: 33–7.
56. Agustí C, Martín-Rabadán M, Zarco J, et al. Early diagnosis of HIV in Primary Care in Results of a pilot study based on targeted screening based on indicator conditions, behavioral criteria and region of origin. Aten Primaria 2018; 50: 159–65.
57. Ministerio de Sanidad, Servicios Sociales e Igualdad, Plan Nacional sobre Guía de recomendaciones para el diagnóstico precoz del VIH en el ámbito sanitario.
58. Cayuelas Redondo L, Ruíz M, Kostov B, et al. Indicator condition-guided HIV testing with an electronic prompt in primary healthcare: A before and after evaluation of an Sex Transm Infect 2019; 95: 238–43.
59. Font R, Fernandez E, Male RT, et al. Perfil de la enfermera especialista en pacientes VIH en Cataluña. Revista multidisciplinar del SIDA 2013; 6: 35–44.
60. De la Fuente L, Delgado J, Hoyos J, et al. Increasing Early Diagnosis of HIV through Rapid Testing in a Street Outreach Program in AIDS Patient Care STDS 2009; 23: 625–9.
61. Belza MJ, Hoyos J, Balbuena SF, et Assessment of an out reach street-based HIV rapid testing programme as a stradegy to promote early diagnosis: A comparison with two survillance systems in Spain, 2008-2011. Eurosurveillance 2015; 20: 1–11.
62. Agustí C, Muñoz R, González V, et Outreach HIV testing using oral fluid and online consultation of the results: Pilot intervention in Catalonia. Enferm Infecc Microbiol Clin 2020. Online ahead of print. DOI:10.1016/j.eimc.2020.01.020.
63. Fernández-balbuena S, Belza MJ, Zulaica D, et al. Widening the Access to HIV Testing: The Contribution of Three In-Pharmacy Testing Programmes in Spain. PLoS One 2015; 10:
64. Hoyos J, de la Fuente L, Fernández S, et La oferta de la prueba rápida del VIH en la calle dentro del ámbito universitario: ¿una estrategia prioritaria? Gac Sanit 2012; 26: 131–7.
65. Ministerio de Sanidad, Servicios Sociales e Igualdad y Consejo General de Colegios Oficiales de Farmacéuticos. Guía de actuación farmacéutica en la dispensación de productos sanitarios para autodiagnóstico del VIH, Disponible en: https://www.mscbs. gob.es/ciudadanos/enfLesiones/enfTransmisibles/sida/docs/diagnosticoPrecozVIH_05_ Accesible.pdf
66. Vigilancia epidemiológica del VIH y SIDA en España 2019 (actualización 30 de junio de 2020). Unidad de Vigilancia de VIH, ITS y hepatitis. Vigilancia Epidemiológica del VIH y sida en España 2019: Sistema de Información sobre Nuevos Diagnósticos de VIH y Registro Nacional de Casos de Plan Nacional sobre el SIDA - D.G. de Salud Pública/ Centro Nacional de Epidemiología - ISCIII. Madrid; Nov 2020.
67. Rayment M, Asboe D, Sullivan A. HIV testing and management of newly diagnosed Clinical Review. British Medical Journal 2014; 349. doi: 10.1136/bmj.g4275.
68. Thompson M, Horberg M, Agwu A, et al. Primary Care Guidance for Persons With Human Immunodeciency Virus: 2020 Update by th HIV Medicina Association of the Infectious Diseases Society of Clinical Infectious Diseases 2020; 1-28.
69. Ambrosioni J, Nicolás D, Manzardo C, et al. Manejo inicial de la infección aguda y crónica por el VIH-1. Clínica, diagnóstico y tratamiento 2019. Podzamczer D, Miró JM, Mallolas J y Clotet Guía práctica del SIDA.
70. Documento de consenso de GeSIDA sobre control y monitorización de la infección por el VIH (actualización Abril 2018).
71. Miró JM, Manzardo C, Zamora L, et al. Manejo clínico de la infección aguda y crónica por el virus de la inmunodeficiencia humana antes del inicio del tratamiento Enferm Infecc Microbiol Clin. 2011; 29 (10): 759-772.
72. BHIVA guidelines on the routine investigation and monitoring of HIV-1-positive adults (2019). Panel de expertos: Brian A (Chair), Gary B (Vice-chair), Funmi A, et
73. EACS Guidelines 2020. Panel de expertos: Georg B (Chair), Lene R (Coordinator), Arribas J, et
74. Documento de consenso de GeSIDA/Plan nacional sobre el SIDA respecto al tratamiento antirretroviral en adultos infectados por el virus de la inmunodeficiencia humana (Actualización 2020). Panel de expertos de GeSIDA y Plan Nacional sobre el
75. Dyer M, Kerr C, McGowan JP, et Comprehensive Primary Care for Adults With HIV [Internet]. Baltimore (MD): Johns Hopkins University; 2021 Feb. PMID: 33625815. Available from: https://www.ncbi.nlm.nih.gov/books/NBK567851/
76. Cohen DE, Mayer KH. Primary care issues for HIV-infected patients. Infect Dis Clin North 2007 Mar;21(1):49-70, viii. doi: 10.1016/j.idc.2007.01.001. PMID: 17502229.
77. Matthews P, Madge S, Singh S, et al. HIV in Primary Care. 3rd edition. [Internet]. MEDFASH and JUSTRI; 2016. Available from: https://www.nat.org.uk/sites/default/files/ publications/hiv_in_primary_care_0.pdf
3. CUIDADO COMPARTIDO DE LAS PERSONAS QUE VIVEN CON EL VIH
3.1. Coordinación y Calidad asistencial
3.2. Vacunaciones en el paciente con infección por el VIH
3.3. Manejo del Tratamiento ARV actual
3.4. Manejo de las comorbilidades
3.5. Aspectos particulares del seguimiento de las mujeres con VIH
3.6. Hábitos tóxicos
3.7. RECOMENDACIONES
Coordinación y Calidad asistencial
Principales experiencias en cuidados
Autores: Melchor Riera, Nacho Barreira Revisores: Joseba Portu, Juanjo Mascort
Podemos definir la asistencia en cuidados compartidos como aquella atención en la que el MAP atiende a los pacientes con infección por el VIH conjuntamente con el médico de AH, combinando las ventajas de la AP (proximidad y experiencia en enfermedades crónicas) con la experiencia del especialista en FAR1. La OMS ya en 2004 recomendaba la utilización de todos los niveles de asistencia para ayudar al diagnóstico precoz, el asesoramiento y el seguimiento de las PVIH2. En la revisión realizada se aprecia que hay pocos artículos de asistencia compartida o de cambio de AH a AP en países con ingresos elevados345. Los trabajos que evalúan cambios de asistencia se han realizado mayoritariamente en países con recursos medios o bajos678 y no van a ser motivo de la revisión de este artículo por las diferencias asistenciales, geográficas y culturales.
Nos hemos centrado en los trabajos realizados en países con rentas elevadas que evalúan cuidados compartidos, modelos organizativos o intervenciones para intentar mejorar el diagnóstico precoz, la asistencia y la continuidad en el seguimiento de las PVIH.
Mientras en EEUU, algunas zonas de Canadá, Australia o Brasil, muchos pacientes son atendidos por el MAP, en Europa, la atención de las PVIH se ha realizado básicamente en los hospitales9.
Durante los últimos años han surgido diferentes modelos organizativos y de gestión para enfermedades crónicas. Estos modelos han obtenido buenos resultados, mostrando que la optimización de los resultados en salud no solo depende de buenos diagnósticos y tratamientos, sino también de cómo se organiza y se gestiona la asistencia. Para mejorar la asistencia de las PVIH es necesario implementar estrategias de gestión y modelos organizativos que hayan demostrado su efectividad en otras enfermedades crónicas y esto implica mejorar la coordinación entre la AH y AP10.
Muchos de los trabajos de asistencia de pacientes con infección por el VIH en AP se han realizado en Canadá y en EEUU donde se ha intentado implantar el Chronic Care Model (CCM) Tabla 1.
La adopción del modelo completo del CCM durante 18 meses en dos centros de salud de Canadá que atendían a PVIH vulnerables permitió mejoras significativas en algunos indicadores de calidad como: la vacunación frente a neumococo, el cribado de sífilis o TBC, la adherencia al TAR o el porcentaje de pacientes con CVP indetectable11. Otro estudio del Department of Veterans Affairs (VA) demostró que los centros del VA donde se incorporó el modelo CCM obtuvieron un incremento de 3 a 5 veces en la proporción de pacientes en riesgo a los que se ofrecía la prueba del VIH frente a los centros control12. La alerta electrónica fue usada por este grupo de investigadores, indicando qué pacientes tenían mayor riesgo, y aumentando el porcentaje de pacientes cribados para el VIH del 20 al 53%13.
La evaluación prospectiva de un programa para implementar la realización de serologías en personas de mayor riesgo en centros de salud de Madrid y en Urgencias con la realización de un cuestionario que evaluaba el riesgo de exposición e indicadores asociados al VIH, permitió aumentar la tasa de nuevos diagnósticos VIH del 3,1 por 100.000 pacientes atendidos, en los centros control al 29,6 en los centros donde se implementó el programa1415.
Los estudios de Hutchinson y Kendal1617 realizaron cuestionarios a los proveedores para conocer las características de los centros de AP (CAP) que atienden a las PVIH y los servicios que ofrecen; también hay estudios de revisión en este sentido18.
Otros estudios como el de Page1 muestran que no hay diferencias en la adherencia al TAR, ni en el control virológico entre la AP y AH, siendo mayor la satisfacción de los pacientes atendidos en AP.
Otros trabajos realizan intervenciones, como el de Rogers19, que mediante entrevistas semiestructuradas observan mejoras en la calidad de vida y en los síntomas depresivos; o los módulos educativos realizados por pares descrito por Cabral et al.20, sin observar mejoras en el seguimiento.
El estudio de Webel21 realizado para brindar cuidados paliativos tempranos relacionados con la infección por el VIH y otras enfermedades crónicas, no apreció mejoras importantes. Sólo disminuyeron inicialmente los síntomas de malestar y la comprensión de la naturaleza crónica del VIH.
El estudio de Riera22 evaluó mediante un cuestionario el conocimiento y satisfacción de las PVIH con AP y AH y realizaron un proyecto piloto de asistencia compartida en pacientes con buen control de la infección VIH y sin problemática social importante. A los 2 años de seguimiento el 80% de los pacientes siguieron en el proyecto piloto con buena adherencia, control virológico y alto grado de satisfacción.
RECOMENDACIONES
- Se recomienda la utilización de todos los niveles de asistencia para ayudar al diagnóstico precoz, el asesoramiento y el seguimiento compartido de las personas con VIH (B-III).
- Se considera prioritaria la generación de evidencia sobre asistencia compartida en los países con rentas elevadas (C-III).
- Con el aumento de la edad y de las comorbilidades en las PVIH es necesario implementar estrategias de gestión y modelos organizativos que hayan demostrado su efectividad en otras enfermedades crónicas y esto implica mejorar la coordinación entre la AH y la AP (A-III).
Nuevos modelos de atención y coordinación no presencial
Autores: Alfonso Cabello, Juanjo Mascort
Revisores: Carlos Galera, Nacho Barreira
La incidencia mantenida y la reducción de la mortalidad gracias al TAR, hacen que la población de PVIH cada vez esté más envejecida. La aparición de comorbilidades y las interacciones con los diferentes FAR hacen que el seguimiento y la monitorización de estos pacientes sea una tarea cada vez más compleja2324. El manejo compartido entre el especialista en VIH y el MAP se hace cada vez más esencial y está recomendado por las diferentes guías internacionales25. Uno de los mayores retos en España y en los países de nuestro entorno es diagnosticar a todas las PVIH, y este primer “90” de los objetivos de la OMS es aún una de las asignaturas pendientes, donde la implicación y la coordinación entre AP y AH resulta indispensable26. Además, el modelo de abordaje multi e interdisciplinar coordinado, mejora la atención y la adherencia al tratamiento de las PVIH27. Las primeras experiencias en salud digital, donde el paciente tiene acceso a su información, han demostrado aumentar la implicación del paciente en su proceso, más aún si hacemos partícipe al propio sujeto a través de cuestionarios dirigidos28. De hecho, la denominada actualmente como “telemedicina”, permite la prestación de servicios de salud sin la necesidad de desplazamiento del paciente gracias al avance en las tecnologías de comunicación. Está recomendada por las guías internacionales, y son muy recientes las primeras directrices de las sociedades nacionales en el ámbito del manejo de las PVIH29. El concepto de telemedicina no sólo incluye la evaluación e interacción con el paciente, sino también entre los profesionales y la administración30; en este sentido quizás cobre un mayor significado el concepto de salud digital.
Los nuevos modelos de atención al paciente se han diversificado, no sólo por una tendencia al alza en el uso de herramientas digitales en los últimos años31, sino también por cuestiones de necesidad reciente debido a la pandemia por SARS- CoV-2 (probablemente en formatos precipitados, limitados y con necesidades de mejora). La atención al paciente en un formato de telemedicina presenta diferentes escenarios, pudiendo dividirse fundamentalmente en atención sincrónica (aquella que se realiza directamente entre el paciente y el sanitario) y asincrónica (aquella que no se lleva a cabo en tiempo real, sino que se realiza un acto en el que el paciente y el médico se comunican a través de SMS, correo electrónico o aplicaciones móviles)30. Obviamente dicha atención debe ir acompañada de herramientas que aseguren la confidencialidad de los datos y medidas de implementación para superar la brecha digital que se da en algunos colectivos; siendo necesario mantener modelos
mixtos para asegurar la cobertura en la atención a toda la población. El uso de la telemedicina en la atención al paciente ha demostrado aumentar el acceso a la información y la satisfacción por parte éste, así como mejorar sus resultados y reducir los costes30.
Estas referencias, pertenecientes a países con un alto nivel de digitalización en la salud, tienen aún una escasa penetración en nuestro sistema sanitario.
Aun así, cada vez son más frecuentes las experiencias en la coordinación entre AP y la AH a través de sistemas de comunicación integrados en la historia clínica electrónica, como la e-consulta, estableciendo un canal de comunicación entre sanitarios que comparten la atención al paciente, facilitando la coordinación en el manejo del paciente sin necesidad de que éste se desplace, y permitiendo resolver dudas, evitando en muchas ocasiones el ingreso hospitalario o el consumo de ciertos recursos32. Este tipo de herramientas sientan las bases para mejorar la atención en las PVIH, permitiendo, por ejemplo, compartir el manejo de las comorbilidades, adelantar y coordinar las acciones preventivas sobre eventos futuros, resolver dudas sobre posibles interacciones con los FAR, o facilitar la derivación precoz e instauración del tratamiento en casos de nuevo diagnóstico. Aunque todavía tienen un amplio margen de mejora, ya que suelen ser asíncronas y unidireccionales.
Tanto desde GESIDA como desde AP se han elaborado directrices sobre telemedicina, a los que se remite desde este documento3334.
RECOMENDACIONES
- Se deben establecer modelos de atención/comunicación no presencial con la PVIH y entre AH y AP para complementar la atención / comunicación presencial, y conseguir entre ambas mayor proximidad, accesibilidad y longitudinalidad en la atención a los pacientes y mejor coordinación entre los diferentes niveles asistenciales (C-III).
- La Telemedicina ha de contemplarse como una herramienta de ayuda complementaria para optimizar recursos y facilitar la atención de los pacientes, como un conjunto de modelos organizativos integrados y coordinados pero no opuestos (C-III).
- Se ha de avanzar hacia una atención telemática más segura y protocolizada y evaluar sus resultados sobre la salud de las PVIH (C-III).
Beneficios de la coordinación entre AP y AH
Autores: Juan Carlos López, Mª Eugenia Flor
Revisores: Regino Serrano, Carolina Mir
El modelo de atención a PVIH clásicamente se ha focalizado en las consultas especializadas de los hospitales. Sin embargo, en los últimos años la labor preventiva, el abordaje integral de los pacientes y especialmente la eficacia y la seguridad de los TAR, han conseguido que mejore la calidad y la expectativa de vida de estos pacientes hasta casi igualarse con la de los no infectados35. Como consecuencia de la cronicidad de este proceso, el MAP ha ido adquiriendo competencias en el seguimiento de estos pacientes, en la dirección de una asistencia compartida con la AH.
La AP es el escenario ideal para la prevención y el diagnóstico de nuevos casos36 que se derivarán al especialista hospitalario para continuar con el tratamiento, control y seguimiento de la infección VIH. La labor del MAP no termina con la derivación, sino que debe participar en el control de la evolución de la enfermedad, la adherencia terapéutica, prevenir e intentar evitar los efectos adversos de los FAR y sus interacciones con otros fármacos, valorar las principales comorbilidades (en especial los factores de riesgo cardiovascular FRCV) y evitar la polifarmacia37. Es importante mantenerse alerta ante las posibles complicaciones que puedan aparecer y detectar aquellas más graves que requieran ser atendidas en el segundo nivel asistencial.
A lo largo de los últimos años el abordaje de las enfermedades crónicas, en las que están implicados tanto profesionales hospitalarios como de AP, ha dado lugar a modelos asistenciales de cuidado de pacientes crónicos en los que éstos son el centro de la atención. Estos modelos se han basado en la utilización de la medicina basada en la evidencia, en el trabajo multidisciplinar y en el empoderamiento del paciente sobre el autocuidado de su patología.
En otro capítulo de este documento se detallan las experiencias de asistencia compartida entre AP y AH. Destacaremos aquí las más relevantes por lo que a su beneficio se refiere. El programa Care Coordination Program de la ciudad de Nueva York ha demostrado su utilidad ayudando a un mejor control de la replicación vírica, retención en el seguimiento y cuidados del propio paciente3839. De igual manera un programa multidisciplinar dentro del consorcio Kaiser Permanente de California muestra un aumento del cumplimiento terapéutico y del control vírico40 y un estudio realizado en Canadá muestra que la adopción de un modelo de cuidados crónicos en personas con VIH mejora el despistaje de infecciones, la inmunización, el cumplimiento terapéutico y el control vírico41. Finalmente, una revisión sistemática de la literatura concluye que la aplicación del modelo de cuidados crónicos en el VIH debería ser considerado como una de las estrategias más importantes a desarrollar para mejorar el cuidado de estos pacientes42.
Todos estos ejemplos, confirman la utilidad de la aplicación de modelos de cuidado crónico aplicados a la infección por el VIH.
En la tabla adjunta se expresan algunas de las áreas de atención sanitaria que se beneficiarían de esta forma de atender a la PVIH ver Tabla 2.
Los procesos asistenciales integrados tienen como objetivo disminuir la variabilidad en la práctica clínica, garantizar la continuidad asistencial y lograr dar a los pacientes un servicio personalizado y de calidad, que responda a sus necesidades y expectativas. Resulta imprescindible disponer de una historia clínica electrónica compartida, elaborar de forma conjunta guías y protocolos de actuación que perfilen el papel de cada profesional, fomentar la formación continuada, acreditada, práctica y compartida, y realizar proyectos comunes de investigación. Para lograr este modelo de manejo hace falta redefinir el papel de la AP, con un mayor protagonismo y establecer un cauce de comunicación con la AH que ofrezca una asistencia coordinada y verdaderamente multidisciplinar.
RECOMENDACIONES
- Debería implantarse lo antes posible en nuestro medio un modelo de atención crónica y compartida entre AP y AH para las PVIH. Su desarrollo conllevaría grandes beneficios tanto para el paciente como para el sistema sanitario. (B-II)
Vacunaciones en el paciente con infección por el VIH
Calendario vacunal
Autores: Cristina Gómez, Cristina Zorzano
Revisor: José Sanz
Consideraciones generales4243444546
- Las indicaciones y las pautas de vacunación serán similares a las de la población general, especialmente en los pacientes que están recibiendo TAR y mantienen viremia del VIH indetectable y óptima situación inmunológica (recuento de CD4 >500 cél/ųl). Sin embargo, en los pacientes con recuentos <200 CD4/μL (o 14%), está contraindicada la administración de vacunas vivas atenuadas, al estar comprometida la inmunidad celular.
- En los pacientes sin TAR previo, con recuentos de CD4 entre 200 y 350 cél/ųl, en general se recomienda posponer la vacunación hasta que, iniciado el TAR, se logre viremia del VIH indetectable y, si es posible, cierta recuperación inmunológica.
- La inmunogenicidad de las vacunas puede verse reducida si la replicación viral no está controlada con el TAR y/o si el recuento de CD4 es bajo (<200 cél/ųl).
- La duración de la seroprotección es menor que en los individuos no inmunocomprometidos y puede requerir dosis de antígeno vacunal más elevadas o adicionales de recuerdo, especialmente cuando la vacunación previa se administró en circunstancias que reducían su inmunogenicidad.
- En general las vacunas son bien toleradas por los pacientes con infección VIH.
Tipos de vacunas recomendadas
Vacunas inactivadas
- Neumococo: Se debe reforzar su indicación, ya que, a pesar del TAR, y la mejoría inmunovirológica, la incidencia de enfermedad neumocócica invasiva y de neumonía adquirida en la comunidad sigue siendo mayor que en la población seronegativa. Existen dos vacunas que contienen 13 o 23 antígenos polisacáridos capsulares, conjugados con proteína transportadora (13 valente, PCV13) o no conjugados (23 valente, PPV23), respectivamente.
En pacientes nunca vacunados se recomienda administrar la vacuna PCV13 sin demora, independientemente del recuento de CD447, seguida de la vacuna PPV23 al menos 8 semanas después, sobre todo si ya se ha alcanzado un recuento de CD4>200 cél/ųl. En caso contrario, puede administrarse una segunda dosis de PPV23, 5 años después.
La vacunación previa con PPV23 permite introducir la vacuna conjugada PCV13 al menos 1 año después.
- Gripe: Indicada de forma anual, incluye subtipos de virus influenza A y B, seleccionados según la prevalencia prevista cada año por la OMS.
- Hepatitis B: La intensidad y duración de la inmunogenicidad obtenida con esta vacuna es significativamente inferior a lo observado en la población seronegativa, sobre todo con bajos recuentos de CD448. Se recomienda administrar pautas reforzadas (dosis dobles o 4 dosis), a ser posible con instauración previa del TAR. Se recomienda realizar control serológico post-vacunación (a partir de 1-2 meses): si los títulos de Ac antiHBs son <10 UI/L, administrar 3 nuevas dosis de 40 mcg a intervalos mensuales, o una nueva vacunación con la misma pauta, intentando aplazar la revacunación hasta la recuperación del recuento de CD4.
Existe controversia sobre la actuación en pacientes con Ac antiHBc aislado (AgHBs y Ac antiHBs negativos con Ac anti-HBc IgG positivo), pero en general se recomienda descartar infección crónica (ADN del VHB negativo) y en ese caso vacunar del VHB.
- Hepatitis A: Indicada especialmente en ambiente epidemiológico de alto riesgo (situación de brote, pacientes HSH), previa verificación de IgG antiVHA negativa48. Con la siguiente pauta:
- Si CD4>350/mm3 , 2 dosis (0, 6 meses). Se realizarán marcadores serológicos a los 2-3 meses tras la segunda dosis. Si es negativa se administrará una dosis.
- Si CD4<350/ mm3 , 3 dosis (0, 1 y 6 meses). Se realizarán marcadores serológicos a los 2-3 meses tras la tercera dosis. Si es negativa se administrará una dosis.
- La serología prevacunal puede ser coste-efectiva en personas nacidas con anterioridad a 1977, personas que han residido en países de alta o moderada endemicidad, HSH o PID.
- Se recomienda la administración de dosis de recuerdo cada 10 años a personas que continúen en riesgo de exposición.
- Virus Papiloma Humano (VPH): Su infección comporta un riesgo de lesiones anogenitales benignas (implicados los genotipos 6 y 11), y de cáncer de cuello de útero, anal y orofaríngeo (asociado especialmente a los genotipos 16 y 18), que se incrementa en las personas con VIH, dada su mayor prevalencia y su capacidad reducida para el aclaramiento del VPH. Hay comercializadas 3 vacunas (con 2, 4 y 9 genotipos), y la 9-valente está financiada, en varones y mujeres con VIH hasta los 26 años. La inmunogenicidad de la vacuna en pacientes con infección VIH, que reciben TAR, es comparable a la obtenida en la población seronegativa43, y está condicionada a la recuperación del recuento de CD4 y a mantener la viremia del VIH indetectable.
- Herpes Zóster (HZ): la reactivación de virus Varicela- Zóster (VVZ) es 15 veces mayor en pacientes VIH+44. Actualmente disponemos de dosis limitadas de una vacuna recombinante con glicoproteina E del VVZ como componente antigénico con adjuvante AS01B (HZ/su) para la prevención del HZ y de la neuralgia post herpética, destinadas a administrarse a pacientes con algunas enfermedades o tratamientos inmunodepresores y entre ellas a pacientes mayores de 18 años con infección por VIH independientemente del recuento de CD4+45. Se puede administrar a pacientes previamente vacunados con la vacuna antiHZ atenuada con un intervalo mínimo de 8 semanas. La pauta es de dos dosis (0, 2-6m) im en deltoides y no se ha establecido la necesidad de un booster46.
- Meningococo: Existen diferentes vacunas y pautas; aunque en los pacientes con infección VIH existe mayor riesgo de enfermedad meningocócica invasiva, suelen recomendarse las pautas de la población general. La vacuna del meningococo B sólo se indica si existe riesgo añadido (al margen de la infección por VIH).
- Difteria-Tétanos-Pertussis: No existen recomendaciones específicas para los pacientes VIH+. Administrar Td (toxoide tetánico y toxoide diftérico de baja carga antigénica) sí susceptible o si la vacunación fue incompleta (5 dosis).
VACUNAS VIVAS ATENUADAS sólo si linfocitos T CD4 >200/μL (>14%) durante más de 6 meses.
- Triple Vírica (sarampión, rubeola y parotiditis): Su indicación va fundamentalmente dirigida a prevenir el sarampión, dada la mayor gravedad de esta infección en los pacientes VIH frente a la población seronegativa (rubéola y parotiditis presentan gravedad similar). Recomendada en pacientes seronegativos frente al sarampión y en mujeres en edad fértil seronegativas a rubéola. Pauta 2 dosis (0, 1 mes). Se requiere determinación de anticuerpos frente a sarampión y frente a rubéola pre y post vacunación. No usar la vacuna tetravírica. Debe descartarse el embarazo antes de su administración.
- Varicela. Se requiere determinación de anticuerpos pre y post vacunación. Pauta 2 dosis (0, 3 meses). No usar la vacuna tetravírica.
- Herpes zóster: Dada la disponibilidad en nuestro país de una vacuna inactivada frente al virus varicela zóster desde julio de 2021, no se recomienda la administración de la vacuna atenuada frente al Herpes Zóster en estos pacientes.
Escenarios especiales
I. Viajeros con VIH, que viajan a zonas endémicas
Fiebre amarilla: Está constituida por virus atenuados, su indicación viene dada por las exigencias del país de destino (enfermedad endémica en África subsahariana y en las áreas tropicales de Sudamérica). Indicada en pacientes con CD4+ >200 céls/μL, aunque la inmunogenicidad es inferior a la observada en la población seronegativa para el VIH. Contraindicada si neoplasia hematológica (actual/pasada) o afectación tímica. La re-vacunación con una dosis puede ser necesaria en los que tenían una respuesta inmune insuficiente después de la vacunación primaria y también puede ser requerida, en función de las recomendaciones oficiales de las autoridades sanitarias locales, como condición para la entrada en algunos países.
Rabia: Es una vacuna inactivada y la respuesta está reducida en los pacientes con infección VIH, especialmente si los CD4 <200 cél/μL o CVP detectable. Se recomienda verificar respuesta serológica post-vacunal a las 2-4 semanas (administrar refuerzo, tal vez con dosis doble, si título de Ac <0,5 UI/ml). Si persiste el riesgo de exposición puede repetirse periódicamente la vacunación.
Fiebre tifoidea: Existen dos tipos de vacunas (una parenteral compuesta de antígeno polisacárido capsular Vi, y otra oral constituida por virus atenuados), ambas activas como protectoras exclusivamente de la infección por S. typhi. Se obtiene una respuesta reducida con respecto a la población seronegativa para el VIH, especialmente si CD4 <200 cél/μL (en estos pacientes sólo puede aplicarse la vacuna parenteral).
II. Migrantes extranjeros sin documentación sobre su estado vacunal
Hay que tener en cuenta que la cobertura vacunal en países en desarrollo suele ser peor46. Interrogar sobre vacunación y solicitar marcadores serológicos de VHA, VHB, sarampión, rubéola, parotiditis y varicela. En personas sin historia documentada de vacunación previa, sería razonable aplicar el calendario vacunal vigente en nuestro país.
Abordaje de la vacunación de la COVID-19 en la situación actual47
Vacunas muy seguras y altamente eficaces contra la enfermedad grave y sobre la transmisión asintomática. Utilizan la proteína del Spike como inmunógeno y generan respuesta inmune tanto humoral como celular. Aprobadas 17 vacunas frente al SARS-CoV-2, de las que 4 están comercializadas en España:
- Moderna: vacuna de RNAm; 2 dosis separadas 4 semanas.
- Pfizer/BioNTech: vacuna de RNAm; 2 dosis separadas 3 semanas.
- Janssen: vector de adenovirus; 1 dosis (estudios en marcha con 2 dosis)
- Oxford/AstraZeneca: vector de adenovirus de chimpancé; 2 dosis separadas 4-12 semanas (8-12 semanas según OMS). En personas de edad comprendida entre 60-69 años.
Mismas recomendaciones que en población general por grupos de riesgo según edad. Debe priorizarse por condición de muy alto riesgo y menor respuesta vacunal, si los CD4 son inferiores a 200 céls/mm44 (Grupo 7). Se aconseja consultar la última actualización del Ministerio de Sanidad de la estrategia de vacunación frente a COVID-19.
Convivientes con personas con VIH
Se recomienda que los convivientes de las personas con el VIH estén correctamente inmunizados frente a la gripe, triple vírica y varicela46. Ver Tabla 3
RECOMENDACIONES
- Vacunar con las mismas pautas que la población Están contraindicadas las vacunas atenuadas si la cifra de CD4 < 200 cél/μL (A-I).
- Indicada la vacunación de neumococo (A-II), gripe anual (A-II), VHB con dosis altas (A-I) y determinación de respuesta serológica postvacunal (B-I), VHA (A-I), VPH (A-III), y herpes-zóster (en adultos >50 años) (B-I).
Monitorización del estado vacunal
Autores: Miriam Navarro
Revisores: Jana Hernández, Cristina Zorzano
Resulta evidente la necesidad de conseguir protección frente a enfermedades infecciosas evitables mediante vacunación en los pacientes VIH. El problema no radica tanto en la vacunación, aunque en más ocasiones de las deseables los pacientes no son vacunados ni en AH ni en AP, sino en obtener certeza de protección tras la vacuna, pues la respuesta inmune a ésta puede ser significativamente menor en la población VIH no tratada o, en particular, en aquellos con mayor inmunodepresión. Además, incluso en la población VIH bien tratada, con carga viral suprimida, la vacunación suele alcanzar niveles de protección menores y se produce una caída del título de anticuerpos más rápida que en la población no VIH.
Resulta fundamental hacer mención especial a las vacunaciones que el paciente haya recibido, en la historia clínica del paciente.
Siempre que se pueda, se debe monitorizar mediante serología o títulos de anticuerpos la respuesta vacunal. Bien es cierto que no es posible hacer serologías o monitorizar todas las vacunas indicadas en el calendario vacunal habitual. A continuación, se describen las pautas recomendadas para monitorizar el estado vacunal de alguna de ellas en pacientes VIH.
Difteria
Mismas recomendaciones que en población general.
Sólo se medirán títulos de anticuerpos en pacientes expuestos laboralmente (trabajadores de laboratorios) tres meses después de la vacunación, para comprobar la inmunidad o revacunar en caso de no obtenerla42.
Hepatitis A
Medir anticuerpos en la consulta inicial de VIH resulta coste-efectivo.
Una vez vacunado, una dosis de recuerdo cada 10 años es aconsejable si el paciente continúa en riesgo de exposición: HSH, ADVP, pacientes con hepatitis crónica VHB o VHC o viajes a zonas de alta prevalencia46.
Hepatitis B
El título de Anti-HBs desciende con el tiempo. Los factores que aceleran su descenso tras la vacunación son: la infección por el VIH, el hábito tabáquico, el sexo masculino, una edad mayor 40 años, la obesidad, estar en hemodiálisis y la inmunosupresión. A los 20 años de haber recibido la vacuna, solamente el 20-35% de los pacientes tiene títulos protectores (>10 IU/L).
Es aconsejable medir el título de Anti-HBs a las 4-8 semanas de completar la vacunación, ya que los niveles de Ac anti-HBs medidos a las 4 semanas de la post- vacunación predicen la duración de la respuesta.
En base a ello cabría destacar las siguientes recomendaciones:
- Los individuos que no alcancen niveles de Anti-HBs > 10UI/L tras una correcta vacunación, recibirán nuevamente tres dosis a intervalos mensuales, pero con doble dosis de 40mcg43.
- Si, a pesar de ello, no se alcanzan niveles protectores y el paciente tiene menos de 350 CD4, se recomienda reiniciar vacunación cuando alcance dicha cifra de CD4.
- Si se alcanzan niveles de Anti-HBs >10UI/L pero <100UI/L, se recomienda administrar una dosis de recuerdo.
En pacientes no respondedores y dependiendo del riesgo de adquisición de la VHB, es aconsejable medir el HBsAg anualmente o incluso con mayor frecuencia, dependiendo de las prácticas de riesgo. Asimismo, es deseable que el TAR incluya fármacos activos frente al VHB como lamivudina, FTC o tenofovir.
Sarampión/Parotiditis/Rubéola
En España se incorporó la triple vírica al calendario vacunal en la década de los 80, por lo que los pacientes adultos actualmente deberían estar vacunados.
Resulta aconsejable medir IgG frente a rubéola en toda mujer VIH en edad fértil y, en caso de ser IgG negativa, aplicar la vacuna triple vírica con la pauta habitual.
Virus Varicela Zoster (VVZ)
Se recomienda realizar IgG VVZ a la población VIH con historia desconocida de varicela o zoster. Si la IgG es negativa con > 200 CD4 y preferiblemente ya con TAR iniciado, se aconseja vacunación frente a VVZ con dos dosis46 y verificar seroconversión de 4 a 6 semanas tras la segunda dosis.
Dado que la probabilidad de reactivación del VVZ resulta más probable en pacientes mayores de 60 años, se aconseja vacunar a la población mayor de 50 años con VIH en TAR activo con > 200 CD4, cuando la vacuna esté disponible.
Ver Tabla 4
RECOMENDACIONES
- Los sistemas de salud deberían establecer el ámbito en el que se deben indicar y administrar las vacunas en las personas con VIH (C-III).
- La revisión del estado vacunal debe realizarse tanto en AP como en AH (C-III).
- El registro de vacunación debe ser accesible tanto en AP como en AH (C-III).
- Se debe realizar serología frente a VHA y VHB en todos los pacientes al inicio del estudio para valorar su estado vacunal (A-I).
- En mujeres en edad fértil se recomienda serología frente a rubéola, para vacunar si la IgG fuese negativa (C-III).
Manejo del Tratamiento ARV actual
Conceptos y principios del manejo clínico y el tratamiento actual
Autores: Pablo Bachiller, Nacho Barreira
Revisores: María José Galindo, Nuria Orozco
Monitorización
Las pruebas de laboratorio, además de una correcta anamnesis que debe incluir no sólo antecedentes y posibles alergias o intolerancias sino también preferencias, hábitos sociales, horarios laborales y otras circunstancias que puedan favorecer o entorpecer la toma correcta del TAR, tienen un papel fundamental en la valoración inicial del paciente, elección del tratamiento y evaluación de la respuesta y la posible toxicidad del TAR.
En la visita inicial, se realizará una exploración física completa y se solicitarán las determinaciones analíticas generales y otras específicas relativas al VIH. Se recomienda repetir periódicamente estas pruebas. Ver Tabla 5
Poblaciones linfocitarias
La cifra de CD4 en sangre es el indicador más importante del estado inmunológico. Sirve para clasificar la infección por el VIH en estadios pronósticos, evaluar el riesgo de comorbilidad, la vulnerabilidad a determinadas enfermedades oportunistas, la necesidad de su profilaxis y su posible interrupción. Habitualmente se utiliza la cifra absoluta, pero también puede valorarse su porcentaje, que es más estable (se considerarán significativas variaciones superiores al 30% de las cifras absolutas y del 3% en los valores porcentuales). Tras iniciar el TAR, se determinarán cada 3-6 meses (a las 4 semanas en los pacientes que parten de <200 células/μL) o ante cambios clínicos significativos43.
En aquellos pacientes con supresión virológica y que alcanzan una buena reconstitución inmunológica (300-500 CD4/μL durante al menos dos años), la cifra de CD4 proporciona escasa información, pudiéndose recomendar su monitorización anual. En pacientes con más de 500 CD4/μL y cociente CD4/CD8 por encima de 0,5 durante al menos dos años se podría considerar opcional el recuento de los mismos43.
Carga viral plasmática del VIH
La CV plasmática (CVP) hace referencia al número de copias de ARN-VIH presentes por mililitro de plasma. Se debe determinar en la valoración inicial del paciente y antes de iniciarse el TAR. Es el parámetro fundamental para monitorizar su respuesta4344.
El objetivo del TAR es alcanzar la supresión virológica, entendida como ≤50 copias/ ml. La rapidez con la que se alcanza depende de la CVP basal: en pacientes con CVP basales muy elevadas (>100.000 cp/ml) puede retrasarse más de 24 semanas, lo que debe tenerse en cuenta al hablar de prevenir la transmisión del VIH44.
El TAR trata de conseguir de forma permanente la supresión viral, lo que evita la transmisión del VIH (indetectable = intransmisible), se asocia a la máxima recuperación inmunológica y previene la aparición de mutaciones de resistencia464748.
Es conveniente medir la CVP a las cuatro semanas del inicio del TAR y, posteriormente, cada 3-6 meses, para comprobar la respuesta virológica y como medida indirecta de adherencia al TAR y refuerzo de la misma. En pacientes clínicamente estables con CVP repetidamente suprimida y cifras de CD4 >300 células/µl este intervalo puede alargarse hasta los 12 meses. En pacientes con CVP indetectable a los que se modifique el TAR es aconsejable determinar la CVP a las 4-8 semanas para comprobar que se mantiene la supresión virológica4445.
En aquellos que han alcanzado una supresión virológica pueden observarse repuntes virológicos transitorios o “blips”, definidos como determinaciones aisladas de CVP entre 50 y 500 copias/ml, que vuelven a la supresión virológica en la siguiente determinación. En general, no se asocian a un FV posterior y, por tanto, no está indicado un cambio de TAR. Sin embargo, algunos estudios recientes señalan que la presencia de “blips” de forma persistente podrían predecir el fracaso al TAR. En estos casos, se recomienda una monitorización más estrecha de los pacientes, evaluar la adherencia, interacciones farmacológicas, posibles restricciones alimentarias y la barrera genética del TAR4449.
Teniendo en cuenta los datos disponibles se continúa considerando FV a la presencia, confirmada en una segunda determinación, de CVP superior a 50 copias/ mL después de alcanzar la supresión virológica o la imposibilidad de alcanzar una CVP inferior a 50 copias/ml4449.
Se ha propuesto un sistema de monitorización que midiera los aspectos más relevantes de la asistencia de las PVIH mediante el uso de unos indicadores de calidad. La monitorización mediante estos indicadores debe permitir asegurar que lo básico en la atención de estos pacientes se está haciendo bien. Los indicadores también actúan como señal de alarma para identificar problemas o prácticas asistenciales mejorables. Un indicador es un criterio de calidad y, por lo tanto, le son aplicables todas las condiciones y características que se recomiendan en la construcción de criterios (aceptables, comprensibles, relevantes, medibles, etc.)50. Se han definido 53 indicadores, disponibles en la página web de Gesida, que cubren gran parte de la actividad clínica en PVIH50.
Efectos adversos del TAR
Un aspecto fundamental es detectar los efectos secundarios de los FAR de forma precoz, ya que en ocasiones puede conducir a añadir otros tratamientos con el riesgo subsiguiente de interacciones y nuevos efectos adversos potenciales. Los efectos secundarios más frecuentes de los distintos FAR utilizados en la actualidad están en la Tabla 651.
RECOMENDACIONES
- La evaluación inicial de laboratorio debe incluir: hemograma, bioquímica general plasmática, serologías y pruebas específicas de la infección por el VIH, (CVP, CD4 y pruebas de resistencias) (A-II).
- Se debe determinar la cifra absoluta y el porcentaje de CD4 antes de iniciar el TAR y periódicamente en función de la cifra de CD4 basales y la alcanzada tras la estabilización (A-I).
- Se debe determinar la CVP antes del inicio del TAR, a las cuatro semanas después del mismo o tras cualquier cambio y luego cada 3-6 meses una vez alcanzada la supresión virológica (menos de 50 copias/mL de ARN-VIH) (A-II).
- Es fundamental conocer perfectamente los efectos secundarios de los FAR para detectarlos precozmente y actuar de la forma más adecuada, y así evitar aumentar la polifarmacia, interacciones y nuevos efectos secundarios (A-I)
- Deben evaluarse aquellos indicadores de calidad asistencial que permiten asegurar que la atención de estos pacientes se está realizando correctamente, ya que también actúan como señales de alarma para identificar problemas o prácticas asistenciales mejorables (C-III).
Escenarios de tratamiento
Autor: Alberto Díaz.
Revisores: José Sanz, Nacho Barreira
Tratamiento de inicio (en pacientes naive, sin exposición previa a TAR).
El TAR debe iniciarse en todos los pacientes con infección por VIH-1, con o sin sintomatología, y con independencia del número de CD4, para reducir la morbilidad y mortalidad asociadas al VIH, y para prevenir la transmisión (estudios START y TEMPRANO, HPTN 052, PARTNER)7071. En los controladores de élite (PVIH seropositivas que controlan la replicación del VIH de forma natural y tienen CVP indetectable; suponen menos del 1% de las PVIH) que además son controladores inmunológicos la indicación no es tan clara.
En el caso de infecciones oportunistas (excepto TBC y criptococosis) se recomienda no demorar el inicio de TAR más de dos semanas tras el inicio del tratamiento de la infección específica, para evitar la progresión clínica y reducir la mortalidad, así como prevenir la aparición del síndrome inflamatorio de respuesta inmune (SIRI)7172. Ver Tabla 7
El objetivo del tratamiento es reducir la carga viral plasmática por debajo de 50 copias/ml71.
El TAR de inicio se basa en la combinación de 2 o 3 FAR7071. Las pautas preferentes en España se recogen en la siguiente tabla. Ver Tabla 8
Tratamiento de rescate (fracaso del TAR).
El FV se define como la presencia de 2 cargas virales superiores a 50 copias/ml 24 semanas después de haberse iniciado el TAR. Repuntes virológicos transitorios aislados (“blips”) son valores de CVP entre 50 y 500 copias/ml, con valores previo y posterior <50 copias/ml. Los “blips” aislados con CVP<200 copias/ml no tienen repercusión clínica. Sin embargo, los “blips” frecuentes o con cifras de CVP> 200 copias/ml se han asociado a mayor riesgo de FV y aparición de mutaciones de resistencia. A los pacientes con una determinación de CVP entre 50 y 200 tras haber alcanzado la supresión se les debe repetir la CVP en 1-2 meses.
Debemos comprobar y reforzar la adherencia, buscar interacciones farmacológicas,
efectos secundarios, revisar mutaciones de resistencia (MR) previas, y cambiar la pauta de TAR cuanto antes7071. Las MR no desaparecen, por lo que es recomendable considerar todas las MR acumuladas en las sucesivas pruebas para diseñar un nuevo TAR70.
El nuevo TAR debe contener 3 fármacos totalmente activos. Si no es posible, se recomienda la combinación de 2 plenamente activos y si es posible otros que conserven actividad virológica parcial. El objetivo de la nueva pauta es conseguir la supresión virológica en 6 meses71.
A pesar de mantener la supresión virológica algunos pacientes no consiguen aumentar los CD4 por encima de las 200 células/μl, lo que se denomina respuesta inmunológica discordante, se debe a diferentes causas (inicio de TAR tardío, coinfecciones, enfermedades subyacentes como la cirrosis o el cáncer) y conlleva mayor mortalidad75.
Simplificación de tratamiento (cambio de TAR en pacientes con carga viral suprimida).
Existen muchos motivos para cambiar un TAR eficaz: intolerancia, toxicidad, nuevas comorbilidades, VHB, interacciones farmacológicas, disminución del número de comprimidos, de dosis diarias o del número de medicamentos, requerimientos dietéticos, embarazo y coste del propio TAR. El cambio puede ser proactivo cuando se realiza preventivamente, o reactivo cuando el régimen actual ha dejado de ser el ideal para el paciente debido a alguno de los motivos reseñados.
El cambio desde una pauta doble o triple basada en un IP/p o un INI de alta barrera genética a otra basada en un inhibidor de la transcriptasa inversa no análogo de nucleósido (ITINAN) o INI de baja barrera genética solo debe hacerse si se puede garantizar la actividad antiviral de todos los fármacos del nuevo régimen. Si se piensa suspender tenofovir (difumarato ó alafenamida) deberá revisarse previamente la serología del VHB70.
En pacientes tratados con pautas basadas en TDF y con alteraciones significativas de la función renal o de la DMO u otros factores de riesgo para desarrollarlas, este fármaco debe suspenderse. El cambio a una pauta basada en TAF o abacavir es una opción adecuada7071.
En pacientes con alteraciones gastrointestinales asociadas a IP potenciado (IP/p) estos fármacos deben suspenderse. El cambio de la pauta a la coformulación de rilpivirina, FTC y TDF, a la de rilpivirina, FTC y TAF, o a doravirina, FTC y TDF es adecuado70.
En pacientes con dislipemia asociada a IP/p la suspensión de estos fármacos es una opción terapéutica. El cambio de la pauta a la asociación de rilpivirina, FTC y TDF, a la de rilpivirina, FTC y TAF, a la de doravirina, FTC y TDF, a pauta basada en raltegravir o en dolutegravir, o el cambio a la coformulación de bictegravir, FTC y TAF es adecuado70. En pacientes con dislipemia asociada a efavirenz la suspensión de este fármaco es una opción terapéutica; el cambio a raltegravir es adecuado70.
El cambio de dolutegravir/abacavir/lamivudina a bictegravir/ FTC /TAF puede realizarse por decisión clínica, pero no puede recomendarse el cambio buscando un beneficio en el perfil lipídico, función renal o DMO, ni una reducción del RCV70.
Cambio a regímenes de dos fármacos: en pacientes con una pauta con 2 ITIAN e IPp que quieran simplificar el TAR y/o evitar los efectos adversos causados por los ITIAN, el cambio a IPp + lamivudina, a dolutegravir + lamivudina, o a dolutegravir + rilpivirina son opciones adecuadas. Los cambios desde 2 ITIAN + ITINAN o INI, a dolutegravir + lamivudina o a dolutegravir + rilpivirina también resultan apropiados70. El cambio a dolutegravir + darunavir potenciado puede ser una opción en determinados pacientes que quieran simplificar su pauta actual o evitar toxicidades70.
No se debe cambiar triple terapia ni terapia dual a monoterapia con IPp ni con dolutegravir7071.
Tras el cambio de un TAR es recomendable evaluar en un plazo de 3-6 semanas el mantenimiento de la supresión virológica y las determinaciones de laboratorio pertinentes, que dependerán del motivo del cambio (p.e lipidograma, o función renal). Una vez demostrada la continuación de la supresión virológica el paciente puede volver a la rutina de visitas habituales70.
En pacientes con efectos adversos del sistema nervioso central (SNC) causados por efavirenz, éste debe suspenderse. El cambio a rilpivirina o a doravirina son opciones adecuadas70. El cambio a raltegravir también es una opción adecuada70.
Situaciones especiales.
Embarazo. Ver capítulo correspondiente de este documento.
Infección aguda (detección de Ag p24 o CVP del VIH, pero no de anticuerpos) El TAR debe recomendarse en todos los pacientes con infección aguda por el VIH-1 independientemente de los síntomas, gravedad y duración, tan pronto como sea posible, especialmente en pacientes con edad superior a 50 años, embarazadas, y aquellos con enfermedad neurológica71. El tipo de TAR será el mismo que en la infección crónica, especialmente una pauta basada en dolutegravir, bictegravir o darunavir potenciado (TAR de alta barrera genética) hasta tener los resultados de las resistencias basales. Si el paciente había iniciado PrEP debería añadirse un cuarto fármaco hasta disponer del resultado del test de resistencias. Una vez iniciado el TAR debe mantenerse indefinidamente7071.
Infección por VIH-2
Es endémica en África Occidental, con prevalencias superiores al 1% en algunas zonas de Guinea-Bissau y Costa de Marfil. A escala mundial, se estima que entre 1 y 2 millones de personas están infectadas por VIH-2, destacando Brasil e India fuera de África. Se debe iniciar el TAR tan pronto como sea posible y se aconseja monitorizar clínica y CD4 cada 6-12 meses y, si está disponible, la CVP de VIH-270. El uso de ITINAN está contraindicado en el tratamiento de la infección por VIH-270. El régimen de TAR preferente de inicio es la combinación de 2 ITIAN + 1 INI7677. Como alternativa a los INI, puede aconsejarse darunavir/ cobicistat70. En pacientes con infección dual VIH-1/VIH-2 el TAR debe seguir las recomendaciones del VIH-278.
Tuberculosis
Elección de los ITIAN: se puede utilizar abacavir, TDF, lamivudina o FTC. No está recomendado el uso de TAF con rifampicina7071.
Elección del tercer fármaco: efavirenz sigue constituyendo el fármaco de elección a dosis 600 mg/d. Alternativas terapéuticas: raltegravir 800 mg/12 horas, o dolutegravir 50 mg/12 horas. En el caso excepcional de que un IP fuese la única opción debe sustituirse rifampicina por rifabutina y realizar el ajuste correspondiente en las dosis de los fármacos7071.
En caso de SIRI no debe interrumpirse el tratamiento antituberculoso ni el TAR. En pacientes con TBC y <100 CD4/μl se recomienda administrar prednisona (40 mg/día durante 2 semanas y luego 20 mg/día durante 2 semanas más) para prevenir el desarrollo de SIRI. Una vez desarrollado SIRI, para el manejo de los síntomas pueden añadirse antiinflamatorio no esteroideo en las formas leves o moderadas, o corticosteroides en las formas graves70.
Comorbilidades: ver capítulo correspondiente
RECOMENDACIONES
- El TAR debe iniciarse en todos los pacientes con infección por VIH, y debe realizarse lo antes posible, salvo en determinadas infecciones oportunistas (A-I).
- Debemos considerar la simplificación por diferentes motivos, especialmente por toxicidad e interacciones farmacológicas (A-I).
- Existen determinadas situaciones especiales, como el embarazo, la TBC o las comorbilidades (renal, cardiovascular, hepática y otras) que exigen extremar las precauciones en el seguimiento y realizar ajustes posológicos o cambios de los FAR o de la medicación concomitante (A-I).
Interacciones y polifarmacia
Autores: Javier Martínez Sanz, Yolanda Sánchez
Revisores: Jéssica Abadía, Jesús Ortega
Interacciones:
Un número significativo de PVIH reciben otros medicamentos además de los FAR. Las interacciones de los FAR entre sí o con otros medicamentos concomitantes, pueden tener una repercusión clínica importante. Además las PVIH cada vez reciben tratamientos de más prescriptores, y con frecuencia toman productos de herboristería, suplementos dietéticos, medicinas alternativas o drogas recreativas, muchas de ellas metabolizadas por el citocromo P450 (CYP) cuyas principales isoenzimas son CYP3A4 y CYP2D679.
Las interacciones más relevantes suelen ser las farmacocinéticas (dan lugar a una modificación de concentraciones), en especial las que afectan al metabolismo. Los FAR son sustratos de uno o varios sistemas enzimáticos y a la vez pueden comportarse como inductores (disminuye la concentración del otro fármaco) y/o inhibidores de los mismos (aumenta la concentración, lo que supone un mayor riesgo de toxicidad). En general, la inducción es un proceso lento (días o semanas), mientras que la inhibición se produce rápidamente (horas). Algunos FAR pueden ser inhibidores e inductores al mismo tiempo, predominando uno u otro efecto79.
Los FAR responsables de las principales interacciones farmacológicas en estos pacientes son:
- los potenciadores del TAR: ya sea ritonavir (RTV) o cobicistat (COBI)
- IP
- ITINAN
Dentro de los fármacos concomitantes, destacan los agentes del sistema cardiovascular, del SNC y opiáceos mayores como la metadona80.
Algunas interacciones farmacodinámicas (modificación del efecto a nivel de receptor, sin cambios en las concentraciones) tienen interés clínico, ya sea reduciendo o
aumentando la eficacia o la toxicidad. Algunos ejemplos son el incremento de toxicidad renal al administrar conjuntamente dos fármacos con potencial nefrotoxicidad, como tenofovir con antiinflamatorios no esteroideos o antimicrobianos nefrotóxicos, o bien asociar medicamentos que pueden prolongar el intervalo QTc, como por ejemplo hidroxicloroquina y azitromicina utilizados inicialmente en el tratamiento contra la infección causada por SARS-CoV-2.
En un reciente estudio poblacional realizado en la Comunidad de Madrid sobre polifarmacia e interacciones farmacológicas con 22.945 PVIH, se observó una prevalencia de combinaciones contraindicadas con TAR del 3,18%81. Los medicamentos más implicados fueron los corticoides, antipsicóticos (quetiapina), antiagregantes plaquetarios (clopidogrel y ticagrelor), antifúngicos imidazólicos, procinéticos (domperidona) y estatinas (simvastatina)79. Se asociaron a un mayor riesgo de potenciales interacciones graves el uso de IP, elvitegravir/c o ITINAN como núcleo del TAR, mientras que el uso de raltegravir o dolutegravir se asoció a un riesgo significativamente menor (OR 0.72, IC 95% 0.60-0.80)79.
Polifarmacia:
Las comorbilidades asociadas al envejecimiento de la población VIH pueden requerir tratamientos crónicos. La polimedicación se define como el tratamiento con cinco fármacos o más de manera concomitante en un periodo de seis meses. Teniendo en cuenta que el TAR estándar se basa en la administración simultánea de 3 fármacos distintos, la polifarmacia es frecuente, aunque existen pocos datos en población con infección por el VIH mayor de 65 años84. Esto desencadena una mayor complejidad farmacoterapéutica, baja adherencia al tratamiento e interacciones, por lo que la optimización farmacoterapéutica debe ser una prioridad en estos pacientes82.
Marzolini et al. coinciden en que la polimedicación es común en la población de adultos mayores infectados por VIH83. En su estudio con 1.497 pacientes se estimó que el 35% de los pacientes <50 años y el 51% de los ≥50 años podían presentar interacciones potencialmente importantes (asociaciones contraindicadas o que requerían ajuste de dosis que no había sido realizado)83. Datos similares se describen en el estudio de López-Centeno et al., en el que se observó que la polimedicación fue mayor en las PVIH (32,94%) que en las personas sin VIH (22,16%, p <0,001). Esta diferencia se mantuvo de manera constante en todos los estratos de edad, excepto en los individuos ≥ 75 años. La polimedicación fue más común en mujeres que en hombres, tanto en PVIH como en personas sin VIH3.
Gimeno-Gracia et al. describen una prevalencia de polimedicación mayor, definida en este estudio como la “prescripción de seis principios activos incluyendo el TAR”. Alcanza hasta un 71.6% de las PVIH y un 25,6% de polimedicación mayor (“11 principios activos o más”)82. En el estudio realizado por Bastida et al. en el que se identificaron 265 sujetos ≥65 años, el 93% estaba polimedicado. La mayoría de los fármacos asociados al TAR iban dirigidos a tratar enfermedades asociadas al sistema cardiovascular, metabolismo y SNC. Los pacientes cuyo TAR incluía un ITINAN presentaban una probabilidad cuatro veces mayor de estar polimedicados. El 65% de pacientes presentó al menos una interacción potencial y el 6,6% una interacción potencial grave. El número de interacciones farmacológicas potenciales aumenta con el número de fármacos prescritos y es mayor en pacientes tratados con IP84. Las clases de fármacos más consumidas en esta cohorte de pacientes coinciden con el estudio previo de Marzolini, evidenciándose un mayor uso de estatinas, antihipertensivos, antiácidos, vitaminas, hipoglucemiantes, antidepresivos, antipsicóticos y andrógenos84. Las alteraciones neuropsiquiátricas son una de las comorbilidades más frecuentes en pacientes de edad avanzada. Según un estudio reciente en PVIH en España, en torno a un 40% presentaba alto riesgo anticolinérgico80.
En los casos en los que sea necesario el uso concomitante de varios fármacos, es imprescindible la evaluación de las potenciales interacciones con los FAR, siendo de gran ayuda las tablas disponibles en las guías de práctica clínica858687 y en especial las herramientas online como la desarrollada por la Universidad de Liverpool88 (disponible en: https://www.hiv-druginteractions.org/) o la herramienta de interacciones medicamentosas de la web Medscape (https://reference.medscape. com/drug-interactionchecker). Dada la complejidad que implica la polimedicación y su posible impacto negativo sobre la salud de estos pacientes, es necesario un abordaje multidisciplinar teniendo en cuenta que deberemos intentar disminuir el número de principios activos que no sean imprescindibles para así disminuir las posibles interacciones.
RECOMENDACIONES
- La colaboración entre los profesionales de AP y de AH es clave para evitar, en la medida de lo posible, las interacciones graves y para reducir el riesgo de polifarmacia (B-III).
- Tanto el TAR como la medicación concomitante deben estar accesibles en tiempo real para todos los prescriptores de una PVIH (B-II).
- Se debe conciliar y revisar toda la medicación de las PVIH cada vez que se realiza una visita clínica y sobre todo si se va a modificar o añadir medicación. Se deben tener en cuenta las contraindicaciones y realizar ajustes de dosis cuando sea necesario (A-II).
- Considerar el uso de un INI no potenciado como núcleo del TAR si el riesgo de interacciones es elevado, desconocido o incontrolable (A-II).
Adherencia y control del TAR
Autores: Francisco Fanjul, Carmen Peinado
Revisores: Regino Serrano, Yolanda Sánchez
El Documento de Consenso para mejorar la adherencia a la farmacoterapia en pacientes con infección por el virus de la inmunodeficiencia humana en tratamiento antirretroviral redactado por el Grupo de expertos de la Secretaría del Plan Nacional sobre el Sida (SPNS), el Grupo de Estudio de SIDA (GeSIDA) y la Sociedad Española de Farmacia Hospitalaria (SEFH), define en su actualización de febrero de 2020 la adherencia como la capacidad del paciente de implicarse correctamente en la elección, inicio y control de toda la farmacoterapia que tenga prescrita, permitiendo así alcanzar, en la medida de lo posible, los objetivos farmacoterapéuticos planteados en cada momento acorde a su situación clínica y expectativa de salud89.
La adherencia es, además, uno de los principales factores que condicionan la efectividad del TAR en el control virológico del VIH, siendo la falta de ésta un importante predictor de FV, así como de mortalidad o aparición de resistencias farmacológicas90. El FV por falta de adherencia además tendría consecuencias epidemiológicas al poner en peligro el binomio indetectable/intransmisible.
Se han identificado en la literatura numerosas variables o características asociadas con una menor adherencia, pudiendo agruparse las principales en las siguientes categorías;
Determinantes socioeconómicos y culturales: Una situación social desfavorable, un nivel educativo bajo, la falta de arraigo o ser inmigrante (especialmente si el país de procedencia no es europeo) se asocian en nuestro entorno con una peor adherencia. La coexistencia de una barrera idiomática puede resultar un factor agravante91, así como la dificultad para obtener la Tarjeta de Asistencia Sanitaria.
Determinantes sanitarios o comorbilidades: La coinfección por el VHC, algunos trastornos psiquiátricos, un peor estado inmunológico o la presencia de hábitos tóxicos activos como son el enolismo o el consumo de drogas por vía parenteral y otras formas de consumo como el chemsex son factores asociados también con una menor adherencia92.
Determinantes relacionados con el TAR: La dificultad para la correcta toma del tratamiento en pautas con un número elevado de tomas o de comprimidos se asocia también a peor adherencia, resultando por ello óptimos los tratamientos en régimen de pastilla única, cuando sean posibles93.
Determinantes logísticos: La dificultad para el acceso al sistema sanitario bien por distancia o dificultad para compaginar con el horario laboral, el retraso en el inicio del tratamiento o la limitación de horarios junto con las dificultades de recogida de medicación son otros factores de riesgo para adherencia disminuida de acuerdo a la literatura actual94.
Existen varios métodos de control o seguimiento de la adherencia al TAR. Los más extendidos en la práctica clínica son los basados en información proporcionada por el propio paciente, el recuento de pastillas o del número de visitas y la periodicidad en la recogida de medicación. Estos registros, fáciles de implementar y relativamente baratos, pueden presentar sesgos de recogida de información que pueden limitar su exactitud.
Disponemos actualmente de otros métodos más objetivos como la medición de niveles plasmáticos de fármacos e incluso la medición de dosis acumuladas en sangre seca o en el pelo. Sin embargo, por su coste y dificultad, son generalmente realizados en el contexto de ensayos clínicos o en casos seleccionados95.
Así mismo, se han propuesto varias medidas o programas encaminados a la mejora de la adherencia al tratamiento y a la vinculación sanitaria (linkage to care). Aquellas medidas sobre las que existe una mayor evidencia en la literatura actual se basan en el envío de recordatorios mediante dispositivos móviles, la implementación de programas formativos para concienciar a los pacientes respecto a la importancia de la adherencia o la utilización de monitores con o sin programas de tratamiento directamente observado.
La eficacia de cada una de estas medidas es en general modesta por lo que se han utilizado en los últimos años combinaciones que aprovechan un efecto aditivo entre ellas. Estas estrategias parecen obtener mejores resultados y han sido comparadas en meta-análisis recientes96.
Es aquí, en la integración de estrategias sinérgicas para la mejora de la adherencia, donde el papel de la AP en colaboración con los especialistas de Farmacia y los especialistas en VIH podría resultar clave para mantener una correcta vinculación al sistema sanitario y una adherencia óptima en los pacientes.
RECOMENDACIONES
- En cada visita clínica a AP o AH del PVIH se debe investigar y monitorizar la adherencia al TAR (A-II).
- La supervisión de la adherencia debe realizarse mediante la colaboración multidisciplinar entre los diferentes profesionales sanitarios implicados (A-II).
- En la historia clínica y en el informe deben constar la adherencia al TAR como uno de los parámetros claves del seguimiento del PVIH, esta información debe ser compartida por AP y AH (C-III).
- Dados los problemas de fiabilidad de los métodos de medida de la adherencia, se recomienda el uso de dos métodos Los registros de farmacia y el uso de cuestionarios validados sencillos están fácilmente accesibles en la clínica (C-III).
- La atención sanitaria a los pacientes infectados por el VIH debería incluir la implementación de programas para la mejora de la adherencia, especialmente aquellos que combinan diferentes estrategias como son el envío de recordatorios mediante dispositivos móviles, los programas formativos para pacientes o la utilización de monitores. (B-I).
Manejo de las comorbilidades
Riesgo cardiovascular
Autores: Dolores Merino, Ricard Carrillo
Revisores: Miguel Cervero, Carmen Peinado
Con el aumento progresivo en la esperanza de vida de las PVIH debido al TAR, otras comorbilidades comunes asociadas con la edad, especialmente la ECV, están adquiriendo cada vez mayor protagonismo en esta población, habiéndose demostrado que las PVIH tienen mayor riesgo de ECV que la población general9798. Entre los factores implicados en este mayor riesgo se encuentran los FRCV tradicionales (edad, intolerancia hidrocarbonada, DM, tabaquismo, hipertensión y la dislipidemia) factores genéticos, el TAR y factores relacionados con el propio VIH en relación con la inflamación y activación inmune persistente, aún a pesar de tener un buen control inmunovirológico con el TAR99. Los FAR recomendados actualmente tienen muy escaso impacto desde el punto de vista metabólico y cardiovascular.
Identificar los FRCV modificables en esta población y a los pacientes con RCV elevado, es fundamental para implementar medidas preventivas y terapéuticas que disminuyan el riesgo de desarrollo de ECV. AP, en estrecha colaboración con los médicos que controlan la infección por el VIH, juega un papel fundamental para conseguir este objetivo.
1. Evaluación del riesgo cardiovascular (RCV):
Aunque en la actualidad no existen herramientas de evaluación del RCV validadas en PVIH, pueden utilizarse cualquiera de las ecuaciones utilizadas en población general (Framingham, REGICOR, D:A:D, ACC/AHA…) teniendo en cuenta sus limitaciones.
2. Estrategias de prevención y tratamiento:
Existen varias guías que pueden consultarse sobre la prevención y el manejo de la ECV en PVIH100101102103.
Las estrategias para disminuir el RCV incluyen el control de la replicación del VIH mediante el TAR y la identificación y control de los FRCV tradicionales modificables. En la Figura 1 se describe un esquema sencillo sobre la prevención del RCV en las PVIH.
Estilo de vida saludable: Al igual que en la población general, llevar un estilo de vida saludable es esencial en la prevención primaria y secundaria de la ECV. La dieta mediterránea y un estilo de vida activo son fundamentales para prevenir y tratar la obesidad, HTA y DM2. Mención especial merece el tabaquismo, que por sí mismo constituye el mayor factor de RCV modificable que contribuye a la morbimortalidad prematura104, siendo necesario priorizar intervenciones para el abandono del hábito tabáquico desde AP. El manejo y tratamiento del tabaquismo es el mismo que el de la población general.
Dislipidemia: La infección por el VIH reduce los niveles de LDL-c, siendo el patrón de HDL bajos y triglicéridos (TG) elevados común en pacientes con enfermedad avanzada por el VIH y refleja el estado proinflamatorio con sus alteraciones metabólicas asociadas (resistencia a la insulina, adiposidad central, bajos niveles de HDLc y TG altos) de estos pacientes105. La dislipidemia se asocia a FRCV tradicionales, al propio VIH, y al TAR.
Las estatinas son los fármacos hipolipemiantes de elección por su seguridad, eficacia clínica y coste. La selección de la estatina debe hacerse en base tanto a su eficacia como a sus interacciones con los FAR especialmente potenciados con ritonavir ó cobicistat (inhibidores potentes del citocromo P450) e ITIAN, debiendo consultarse siempre que vayan a prescribirse las posibles interacciones (https://www.hiv-druginteractions.org). Pitavastatina es la estatina con un perfil de interacciones más favorable, seguida de rosuvastatina y atorvastatina, mientras que simvastatina es el fármaco que más interacciones potencialmente graves presenta. Los fibratos sólo se aconsejan en caso de hipertrigliceridemia grave (>500 mg/dl) refractaria a tratamiento dietético.
Diabetes: El diagnóstico y manejo de la DM2 en PVIH es el mismo que el de la población general. La hemoglobina glicosilada A1c se utiliza para el diagnóstico de DM2, teniendo en cuenta que en quienes reciben TAR con los FAR: IP, ITINAN; o tienen un nivel de linfocitos CD4+ bajos, el valor puede estar infraestimado. Entre los fármacos antidiabéticos, la metformina es la opción más recomendada excepto en insuficiencia renal avanzada, o riesgo de acidosis láctica. Si no se alcanzan los objetivos con metformina, la asociación de uno u otro fármaco disponible dependerá de la comorbilidad asociada o del nivel de HbA1c. Las Incretinas (inhibidores de DDP-4 [linagliptina, saxagliptina, sitagliptina y vildagliptina], agonistas de GLP-1 [liraglutida, exenatida] e inhibidores de SGLT-2 [dapagliflozina, canagliflozina]) no han sido evaluados en PVIH, pero algunas (por ejemplo, empagliflozina, canaglifozina, dapaglifozina, liraglutide) han demostrado reducir la mortalidad por ECV. No se esperan interacciones significativas con los FAR.
Hipertensión arterial: El diagnóstico, manejo terapéutico y objetivos a alcanzar en la HTA es el mismo que en la población general106. Los Inhibidores de la enzima convertidora de angiotensina (IECA) los antagonistas de los receptores de angiotensina (ARA II) son los fármacos mejor tolerados y con menor riesgo de interacciones. Las guías actuales recomiendan iniciar tratamiento con una combinación de dosis bajas de IECA ó ARA II asociado a tiazidas ó antagonistas del calcio, teniendo en cuenta las interacciones con los FAR.
RECOMENDACIONES
- Se debe valorar el RCV en la evaluación inicial y repetirse anualmente con cualquiera de las herramientas disponibles (I-A).
- Se debe ayudar al paciente, de forma motivacional, a realizar cambios en su estilo de vida, que incluyan evitar el tabaquismo, realizar una dieta más adecuada a sus necesidades y procurar el ejercicio físico (II-A).
- En el manejo de la dislipemia, DM2 e HTA arterial se recomienda utilizar el mismo algoritmo terapéutico que en población no VIH, teniendo en cuenta las interacciones con el TAR (II-A).
- La HbA1c debe solicitarse antes del inicio del TAR. Posteriormente, en pacientes diabéticos la HbA1c debe monitorizarse cada 6 meses con el objetivo de mantener un nivel < 7% (I-A).
Comorbilidades hepáticas, respiratorias, renales, óseas y del SNC
Autores: Juan Macías, Ricard Carrillo
Revisor: Miguel Cerveró
Comorbilidades hepáticas
La micro eliminación del VHC se ha conseguido en la mayoría de los centros que atienden personas que viven con el VIH (PVIH). Como consecuencia, la morbilidad y mortalidad asociadas a la coinfección por VHC han disminuido drásticamente. Sin embargo, ello no significa que tras la curación de la infección por VHC las PVIH con cirrosis queden completamente libres de riesgo de eventos hepáticos. Particularmente, el hepatocarcinoma (HCC) puede emerger años después de la curación. Otros eventos relacionados con la hipertensión portal pueden aparecer al no regresar ésta a niveles normales, como sucede el sangrado por rotura de varices esofágicas (SVE). Todo ello debería llevar a mantener todas las medidas de cribado de estas complicaciones después de la curación del VHC. Sin embargo, es posible predecir fiablemente el desarrollo de complicaciones en PVIH con cirrosis previa al tratamiento del VHC. De modo general, las PVIH que alcanzan una rigidez hepática (RH) <14 kPa en el momento de evaluación de la respuesta viral sostenida 12 semanas tras finalizar tratamiento (RVS12) no presentan eventos hepáticos posteriormente107. Específicamente, al cabo de más de tres años post-RVS12, no se observan HCC en PVIH con RH <14 kPa en la RVS12107. Se podría plantear suspender el cribado de HCC en estas circunstancias, ya que, a pesar de que puedan emerger casos de HCC residuales a más largo plazo, el cribado sistemático de HCC no sería coste- efectivo. Para el SVE, es posible clasificar a las PVIH con cirrosis pretratamiento en aquellas sin riesgo de sangrado empleando el valor de RH <30 kPa y de plaquetas>110.000 /mL en la RVS12. En PVIH con cirrosis pretratamiento que alcancen estas cifras en RVS12 es seguro suspender el cribado de VE108.
La infección por el VHB afecta a alrededor de un 5% de las PVIH. En ellos, el TAR basado en TDF o TAF consigue mantener suprimida la replicación del VHB con eficacia y, en consecuencia, sin datos de hepatopatía. A pesar de lo cual, las PVIH con infección por el VHB deben clasificarse usando la escala PAGE-B (reúne la suma de puntuaciones según edad, sexo y plaquetas) para iniciar cribado de HCC109.
La enfermedad hepática grasa asociada a enfermedad metabólica (EHGMA) es un problema emergente en las PVIH110. Por ello debería realizarse un cribado analítico incluyendo transaminasas y ecográfico en caso de que exista elevación de éstas. Además, deben tratarse enérgicamente todos los procesos metabólicos que se asocian con la EHGMA, particularmente obesidad y DM2.
Comorbilidades respiratorias
En la era del TAR eficaz, con la mayoría de las PVIH con supresión del VIH, los procesos respiratorios se corresponden con los de la población general. Esto implica que el mayor problema es el tabaquismo. Desgraciadamente la prevalencia de tabaquismo en las PVIH es muy elevada. Las consecuencias mayores, enfermedad pulmonar obstructiva crónica y cáncer111, son problemas frecuentes. Deben llevarse a cabo todos los esfuerzos para conseguir el abandono del tabaquismo de las PVIH. Concretamente, el uso de fármacos como vareniciclina o bupropion puede hacerse con seguridad en PVIH con TAR.
Comorbilidades renales
El envejecimiento y la presencia de comorbilidades en las PVIH pueden deteriorar la función renal. Además, el TDF se asocia con riesgo de desarrollo de tubulopatías y deterioro de la función renal113. La función renal debe evaluarse periódicamente en PVIH, determinando el CKD-EPI y un examen básico de orina cada 6 a 12 meses113. Debe actuarse sobre los factores de riesgo renal, controlando especialmente la HTA, la obesidad, la DM2 y el tabaquismo.
Comorbilidades óseas
La pérdida de masa ósea es un proceso asociado al envejecimiento sobre el que, además, actúan factores como el sexo y la fecha de la menopausia, el ejercicio físico, el tabaquismo y fármacos osteopenizantes. Entre éstos se encuentra TDF114. También consideraría como fármacos osteopenizantes además del TDF los IP/p como se demuestran en diferentes cohortes115.
Al menos anualmente, debe calcularse el FRAX. Las PVIH con riesgo de fractura por fragilidad estimado según el FRAX deben evaluarse por medio de densitometría ósea. Tabla 9116117 La presencia de osteoporosis objetivada en esta situación debe tratarse en un primer escalón con bifosfonatos y vitamina D. La prevención de la osteoporosis se basa en abandonar el tabaquismo, realizar ejercicio y consumir derivados lácteos o suplementación con vitamina D114.
Comorbilidades del SNC
Al margen de los trastornos psiquiátricos, la principal comorbilidad de SNC en PVIH es el deterioro cognitivo. Asumido como inevitable consecuencia del envejecimiento, sin embargo, es en buena parte prevenible actuando sobre factores de riesgo vascular. Actualmente, el cribado del deterioro no permite prevenir su progresión con eficacia, por lo que no estaría indicada su valoración salvo en caso de emergencia de síntomas118. Ver Tabla 10
RECOMENDACIONES
- En pacientes con infección por el VIH se deben tener en cuenta en cada visita clínica tanto de AH como de AP, las diferentes formas de comorbilidad hepática, renal, ósea, pulmonar o del SNC, descartando su existencia, realizando los cribados preventivos y modificando si es necesario, los hábitos de vida, el TAR y tratando específicamente la entidad. (I-A)
Infecciones asociadas al VIH
Autores: Jose Luis Pérez, Beatriz Rodríguez
Revisores: Juan Flores, Ricard Carrillo
Las infecciones son una causa frecuente de consulta por parte de los pacientes VIH.
Para prevenir infecciones es necesario que completen su calendario vacunal y es muy importante conocer la situación inmunológica del paciente. Si está recibiendo TAR con buena respuesta (Carga viral plasmática (CVP) indetectable y recuperación inmunológica) será poco probable que tenga una infección oportunista. Si, por el contrario, no ha conseguido una recuperación inmunológica (CD4 <200/µL) existe riesgo, por lo que debemos asegurarnos de que está recibiendo la profilaxis adecuada o prescribirla.
No podemos explicar de forma exhaustiva todas las enfermedades infecciosas que pueden afectar a un paciente VIH por limitación de espacio. Se pueden consultar guías más completas (ver bibliografía).
Vamos a comentar someramente 3 grupos de enfermedades infecciosas. Al final se incluye una tabla resumen.
Infecciones oportunistas119120121122123124125126127:
Han sido la principal causa de morbilidad y mortalidad de los pacientes VIH desde el inicio de la epidemia. Corresponden a la categoría C de la clasificación de la infección por el VIH de los CDC.
Infecciones por parásitos: Destacar la infección por Toxoplasma gondii que en los pacientes VIH puede producir coriorretinitis y lesión ocupante de espacio (LOE) en el SNC. También hay que tener en cuenta en nuestro medio la Leishmaniasis visceral que, aunque no está incluida en la categoría C, se comporta como una infección oportunista. Otros parásitos menos frecuentes son Cryptosporidium, Microsporidios e Cystoisospora belli que producen infección intestinal119120
Infecciones por virus: Destacan la infección por el VHS tipo 1 y 2 (herpes orolabial, genital, esofagitis, proctitis, encefalitis) y la infección por el CMV (más frecuente con inmunodepresión severa <50 CD4) pudiendo producir retinitis, esofagitis, neumonitis, colitis, encefalitis… Otros virus a tener en cuenta son el virus varicela zoster (VVZ), el herpesvirus 8 (Sarcoma de Kaposi) y el virus JC (Leucoencefalopatía multifocal progresiva)119120.
Infecciones por micobacterias: Es fundamental la valoración de la infección por Micobacterium tuberculosis. En todo paciente VIH hay que realizar Mantoux y, si es positivo, descartar enfermedad tuberculosa. Si esta se descarta realizaremos tratamiento de infección tuberculosa latente. Otras micobacterias (Micobacterium avium, micobacterias no tuberculosas) son menos frecuentes121122123.
Infecciones por hongos: Sobre todo Pneumocystis jirovecii que produce característicamente neumonía intersticial en paciente con CD4 <200/µL. También son muy frecuentes las infecciones por Candida (oral, vulvovaginal, esofágica). Otros son más raros (Aspergillus, Cryptococcus y hongos endémicos de áreas geográficas concretas como Histoplasma capsulatum, Coccidioidis immitis, Penicilium marneffei…).119120
Infecciones de transmisión sexual (ITS)124125126
Las ITS son, en ocasiones, asintomáticas y pueden pasar desapercibidas. Hay que buscarlas activamente, sobre todo en pacientes con mayor actividad sexual. La infección por el VIH y las ITS están interrelacionadas (comparten riesgos, incidencia y mecanismos de transmisión) por lo que, ante cualquiera de las ITS que mencionamos se debería realizar un despistaje no solo del VIH sino del resto de ITS.
- Sífilis (Treponema pallidum). Hay distintas presentaciones según el tiempo desde la infección: Sífilis primaria, secundaria, latente precoz, latente tardía, sífilis terciaria (neurosífilis…).
- Gonococia (Neisseria gonorrhoeae). Puede producir infecciones locales (uretritis, cervicitis, epididimitis, enfermedad inflamatoria pélvica, proctitis, faringitis…) pero también infección diseminada.
- Chlamydia trachomatis. Uretritis, cervicitis, proctitis… Una forma específica es el Linfogranuloma venéreo (serotipos L1-L2-L3).
- Trichomonas vaginalis. Vaginitis, cervicitis. Ocasionalmente uretritis en varón.
- VPH (Virus del Papiloma Humano). Relación con el cáncer de cérvix en mujeres y el cáncer anal, entre otros.
- También hay que considerar aquí las hepatitis víricas (VHA, VHB, VHC).
Parasitosis importadas127
La inmigración y los viajes internacionales hacen que las infecciones parasitarias importadas sean cada vez más frecuentes en esta población. Algunas pueden comportarse como oportunistas en pacientes inmunodeprimidos. Las principales a tener en cuenta son:
- Malaria (Plasmodium falciparum fundamentalmente). El mayor riesgo se da en inmigrantes que viajan a sus países de origen y no toman profilaxis. Sospechar en cuadro febril en paciente con viaje reciente a regiones tropicales (sobre todo África subsahariana).
- Enfermedad de Chagas (Trypanosoma cruzi). En nuestro medio vemos la forma crónica. Puede producirse reactivación con < 200 y sobre todo < 100 CD4 en forma de LOE cerebral o meningoencefalitis fundamentalmente. En fase crónica se detecta por serología.
- Estrongiloidiasis (Strongyloides stercolaris). Helmintosis que puede cursar de forma crónica por su ciclo autoinfectivo. Suele ser asintomática u oligosintomática pero existe una forma grave de presentación que es la hiperinfestación. En el VIH puede aparecer como síndrome de reconstitución inmune. Está recomendado hacer cribado en pacientes que vienen de área endémica o en los que tienen eosinofilia.
Ver Tabla 11
RECOMENDACIONES
- Conocer el estado vacunal, situación inmunológica del paciente y el uso de profilaxis para enfermedades oportunistas nos ayudará a plantear un diagnóstico diferencial adecuado ante un cuadro (II-A)
- Realizar un cribado de ITS en pacientes sexualmente activos al menos una vez al año (o más dependiendo de la valoración individual del riesgo). (I-A)
- En pacientes que provienen de otros países (migrantes, viajeros…) hay que hacer búsqueda activa de parasitosis. (II-A)
Cribado de las neoplasias
Autores: Alberto Romero, Nuria Orozco
Revisores: Jacinto Sanches, Ricard Carrillo
En las últimas décadas, la principal causa de muerte en esta población son las enfermedades no relacionadas directamente con el VIH, siendo la más frecuente el cáncer128129. De hecho, las neoplasias son responsables de aproximadamente un tercio de todas las muertes en personas con VIH130. Entre los factores que se relacionan con la mayor incidencia relativa de ciertos tipos de cánceres en la población con VIH, distinguimos tres grupos:
a) Los virus oncogénicos: Son aquellos cuya infección se relaciona estrechamente con el desarrollo de determinados tipos de cáncer. En la población con VIH la incidencia de estos cánceres es mayor que en la población sin VIH, ya sea porque la coinfección simultánea con el VIH potencia la capacidad oncogénica de estos virus, o porque, existe una mayor prevalencia de estas infecciones en esta población en relación con sus hábitos de En este grupo, encontramos el virus de Epstein-Barr (VEB), relacionado con el linfoma, el virus del herpes humano 8 (VHH-8) relacionado con el sarcoma de Kaposi, el linfoma de cavidades y con la enfermedad de Castleman y el VPH relacionado con el cáncer genital y anal. La coinfección con el virus VHC y VHB aumenta el riesgo de HCC en esta población. Una causa viral rara de cáncer es el poliomavirus de células de Merkel, que es el agente etiológico del carcinoma de células de Merkel.
b) Los factores de riesgo inmunitarios e inflamatorios contribuyen directa e indirectamente a la oncogénesis en varios cánceres asociados al VIH y están estrechamente relacionados con la viremia del VIH y la inmunosupresión asociada131.
c) Otros factores de riesgo importantes y modificables son aquellos relacionados con la exposición incrementada a agentes oncogénicos, como el tabaco y el alcohol que ocurre en la población que vive con el VIH132.
En España, según datos comunicados de la cohorte RIS, entre enero de 2004 y noviembre de 2015 la tasa de incidencia estandarizada (SIR) de tumores definitorios de Sida (TDS) (sarcoma de Kaposi, ciertos linfomas no Hodgkin y el cáncer de cuello uterino) fue de 163,90 por 100.000 personas-año, mientras que la de los tumores no definitorios de Sida (TNDS) fue de 664,44 por 100.000 personas-año133.
Las recomendaciones que apoyan las intervenciones de cribado deben considerar cuidadosamente los posibles beneficios y daños de una prueba de cribado del cáncer. La prueba debe identificar los cánceres en una fase en la que una intervención pueda proporcionar una mayor esperanza de vida, pero también minimizar la morbilidad derivada los resultados falsos positivos134. Actualmente y en base a la evidencia disponible, el Ministerio de Sanidad y Consumo del Gobierno español considera únicamente 3 programas poblacionales de cribado de cáncer en la población general (mama, colon y cérvix), sin que exista una recomendación específica para la población que vive con el VIH135.
a) Cáncer de cérvix:
La tasa de incidencia del cáncer de cuello uterino en España se ha registrado en 7,95 casos por cada 100.000 mujeres al año en la población general frente a un 59,09 por cada 100.000 mujeres infectadas por el VIH133. Las guías justifican el co-test simultáneo (citología y prueba del VPH), debido al elevado valor predictivo negativo de la prueba del VPH en mujeres inmunodeprimidas, en las que un co-test negativo permitiría prescindir con seguridad del control anual. De igual modo, en pacientes VIH con recuento de CD4 ≤ 200 cel/μl, el control debe ser más estricto, por existir una estrecha relación entre el recuento bajo de CD4 y el riesgo de infección por VPH de alto riesgo oncogénico136.
b) Cáncer anal
El riesgo de padecer cáncer de epitelio anal es aproximadamente 30 veces mayor en personas infectadas por el VIH respecto a la población general137, llegando a incrementarse hasta 80 veces en hombres que practican sexo con hombres138.
La detección del VPH en canal anal tiene una sensibilidad muy alta pero una especificidad baja para la detección de neoplasias anales, debido a la alta prevalencia de portadores del VPH entre las personas infectadas por el VIH, siendo por lo tanto su detección poco útil en el proceso de toma de decisiones para el triaje de los hallazgos citológicos o la derivación a la Anoscopia de Alta Resolución (AAR)139.
c) Cáncer de colon:
No se ha demostrado un incremento del riesgo relativo de cáncer colorrectal en las personas infectadas por el VIH.
d) Cáncer de mama
El riesgo de cáncer de mama en las mujeres infectadas por el VIH es similar al de la población general.
e) Carcinoma hepatocelular:
El carcinoma hepatocelular (CHC) es de especial interés para pacientes VIH, ya que con frecuencia están coinfectadas por el VHB y el virus de la VHC, con mayor riesgo de progresión acelerada de la hepatitis viral hacia la enfermedad hepática crónica y la cirrosis. Los PVIH tienen un riesgo de CHC cuatro veces mayor que la población general, y la magnitud de este exceso ha permanecido relativamente sin cambios a lo largo del tiempo, incluso en la era de la TAR140. Gracias al acceso universal al tratamiento del VHC con agentes antivirales directos (AAD), en 2018 la prevalencia de la coinfección del VIH y VHC en España se situó en el 3,7%, lo que supuso un descenso del 83,3% del 2015 (22,1%)141.
f) Cáncer de próstata
No hay descritas diferencias significativas en población infectada por el VIH.
RECOMENDACIONES
- En el primer año tras el diagnóstico de la infección por el VIH se recomienda realizar dos citologías cervicales (una cada seis meses) y, si ambas son normales, se repetirá́ una citología anual, incluyendo inspección del ano, vulva y vagina, (III-B).
- En pacientes inmunodeprimidas (III-B). Citología anual a partir de los 21 años. A partir de los 30 años:
Co-test trienal en mujeres con CD4 > 200 cl/μl o con TAR activo. Co-test anual con CD4 < 200 cl/μl o sin TAR (III-B).
- Actualmente, la citología anal, seguido de la AAR, si la citología es anormal, representa el método de elección para el despistaje de lesiones intraepiteliales escamosas de bajo (LSIL) y alto grado (HSIL) (II-B).
- Se recomienda realizar una citología anal anual a pacientes VIH, HSH y mujeres con displasia de tracto genital inferior por VPH (III-B).
- Pacientes con VIH y cirrosis hepática (de cualquier etiología) y aquellos con infección por el VHB y un riesgo estimado de CHC mayor del 0,2% anual, deben ser examinados mediante una ecografía hepática semestral (I-A).
Alteraciones neuropsiquiátricas en la infección VIH
Autores: Pilar Barrufet, Ricard Carrillo
Revisores: Alejandra Gimeno, Virginia Fuentes
La infección por el VIH puede incrementar el riesgo de enfermedad psiquiátrica y a su vez la enfermedad psiquiátrica es un factor de riesgo para la adquisición de la infección por el VIH142. Distintos estudios han demostrado una mayor prevalencia de trastornos psicopatológicos en las personas seropositivas en comparación con la población general143, cuyo abordaje ha de ser multidisciplinar.
La vivencia de una infección crónica como el VIH puede desencadenar respuestas emocionales adaptativas que se expresan mediante alteraciones en algunas funciones fisiológicas como el insomnio, la disfunción sexual, los trastornos del apetito o la fatiga144. Una fuente de estrés relevante se relaciona con el estigma social asociado a la infección, presentando una mayor vulnerabilidad las personas de edad avanzada145. Por ello en personas con infección por el VIH es recomendable valorar su salud emocional prestando atención a las estrategias de afrontamiento y al estigma que pueda generar.
Las principales alteraciones psiquiátricas en los pacientes con infección por el VIH son: la ansiedad y los síndromes depresivos como los trastornos psiquiátricos más prevalentes, el síndrome maniaco, los síndromes psicóticos y los trastornos de la personalidad.
Un estudio reciente estima la prevalencia de desorden de ansiedad generalizada en un 19% de los pacientes con el VIH. Este desorden estaba asociado a una menor prescripción de TAR y a una menor adherencia146. Se estima que la prevalencia de depresión en la infección por el VIH está entre el 30-61%, siendo mayor que en la población general. La evidencia sugiere que la depresión es más frecuente en las mujeres, y se asocia a una menor probabilidad de recibir el TAR, una menor adherencia y un aumento de la mortalidad147.
La principal complicación del VIH a nivel del SNC son los trastornos neurocognitivos, que pueden ser asintomáticos, leves o progresar a demencia144.
Los trastornos por consumo de sustancias también son frecuentes y se han asociado a un peor control de la infección con más conductas de riesgo para la transmisión del VIH147.
AI igual que en la población general, el abordaje de los problemas de salud mental de las personas con infección por el VIH puede realizarse desde AP, o desde las propias unidades de VIH, donde para que la atención sanitaria sea óptima, ha de ser acogedora y libre de estigma148. Es interesante realizar un abordaje multidisciplinar con la participación de AP, la unidad de VIH, y los profesionales en salud mental.
En las consultas evaluaremos los siguientes apartados:
Detección precoz de la enfermedad mental con escalas validadas como el Hospital anxiety and depression scale (HADS)149, y en función del tipo de trastorno su tratamiento inicial o su derivación a salud mental.
Promoción de la continuidad de cuidados y de la adherencia al plan terapéutico.
Conocimiento de los efectos adversos de los psicofármacos y las principales interacciones con los FAR.
Además, la valoración inicial y periódica de los pacientes deberá incluir los puntos incluidos en la Tabla 12144146:
RECOMENDACIONES
- En las personas con infección por el VIH es recomendable valorar su salud emocional prestando atención a las estrategias de afrontamiento y al estigma (A-III).
- En el despistaje de la ansiedad y la depresión, pueden utilizarse escalas validadas como el HADS en el momento del diagnóstico y con periodicidad anual o bianual (A-III).
- Si se identifica sintomatología depresiva deberá evaluarse el riesgo de suicidio mediante la entrevista estructurada MINI (B-II).
Aspectos particulares del seguimiento de las mujeres con VIH
Embarazo
Autores: Luz Martín Carbonero, Tatia Santirso
Revisores: Jéssica Abadía, Lara Arbizu
El riesgo de transmisión materno fetal de la infección por el VIH es casi cero si las mujeres infectadas hacen un correcto seguimiento y tratamiento de su enfermedad150. Esto se traduce en los bajos niveles de infección por el VIH en recién nacidos en España en los últimos cinco años (menos de 6 casos año y sólo 2 en 2019)151. Aun así, son datos alarmantes, pues la transmisión vertical en España debería ser 0. Para conseguirlo, debemos lograr el diagnóstico y la supresión virológica del 100% de las mujeres embarazadas VIH+, especialmente durante el tercer trimestre y en el momento del parto.
1. Cribado del VIH durante el embarazo.
En toda mujer embarazada se debe descartar la infección por el VIH. Lo ideal sería que todas las mujeres con deseo de concebir, así como sus parejas, se sometiesen a una prueba diagnóstica del VIH. Como no suele ocurrir, se recomienda la realización de dicha prueba durante el primer trimestre del embarazo152153 junto con otras serologías (lúes, rubeola, etc). También sería deseable realizar la prueba a las parejas sexuales, en determinadas circunstancias de alta prevalencia o en personas en alto riesgo de adquisición del VIH, ya que la primoinfección por el VIH en la mujer embarazada, conlleva cargas virales altas sanguíneas en la madre, con el consiguiente riesgo de infectar al feto154.
Cuando la mujer se considera de riesgo (pareja VIH+, múltiples parejas, consumo de drogas, enfermedades de transmisión sexual) se recomienda repetir la prueba de VIH en el tercer trimestre155.
En mujeres que llegan al parto sin saber la serología VIH es obligado hacer una prueba rápida de VIH cuanto antes.
2. Concepción en parejas serodiscordantes para evitar la transmisión sexual.
El riesgo de transmisión heterosexual es cercano a cero cuando el miembro infectado tiene la carga viral plasmática (CVP) indetectable156. Por este motivo parejas serodiscordantes en las que el miembro infectado por el VIH tiene la CVP indetectable al menos 6 meses y desean concebir, pueden tener relaciones sexuales desprotegidas157.
3. Manejo de la MVIH en edad fértil.
Toda persona infectada por el VIH en edad fértil debe recibir consejo preconcepcional dirigido a informar sobre la posibilidad de tener hijos sanos y la conveniencia de planificar el embarazo para minimizar los riesgos en la madre y en el hijo152153.
Las PVIH muchas veces desconocen el riesgo casi nulo de la transmisión de su enfermedad al feto en condiciones adecuadas.
- Lo ideal es planificar el embarazo con tiempo, de ahí la importancia de la consulta preconcepcional, realizada en las consultas de AP. En ella, además de promover hábitos saludables, se identificarán posibles riesgos (laborales, ambientales, etc.), se actualizará el calendario vacunal (VHB, neumococo, gripe) (ver capítulo calendario vacunal), se detectarán circunstancias individuales que requieran una especial atención y se recomendará la ingesta de ácido fólico diario (para evitar defectos en el tubo neural) desde uno o dos meses antes de la concepción hasta la semana 12 de gestación (cierre del tubo neural)158.
Desde la consulta preconcepcional, se remitirá a la MVIH a la consulta de VIH para iniciar o cambiar el TAR a pautas con mayores tasas de seguridad durante el embarazo. Tanto el MAP como el médico especialista en VIH deberán revisar todas las medicaciones y hábitos tóxicos de la mujer con el fin de evitar posibles drogas teratogénicas.
4. Manejo del TAR en la mujer embarazada con VIH.
Toda MVIH debe recibir TAR durante todo el embarazo intentando mantener CVP indetectable152153159. El tipo de TAR lo determinará el médico especialista en VIH, de preferencia una triple terapia con dos análogos de nucleósidos y un tercer fármaco teniendo en cuenta los datos de teratogenicidad y niveles farmacocinéticos en el embarazo Tabla 13.
Podemos distinguir dos escenarios:
a) Mujer diagnosticada de infección por el VIH durante el embarazo.
Tan pronto como se produzca el diagnóstico es fundamental derivar a la mujer a una unidad de manejo de pacientes VIH+. El TAR se iniciará cuanto antes teniendo en cuenta las mismas recomendaciones dadas para la mujer embarazada que previamente ya tenía diagnóstico de VIH Tabla 13. De elección como tercer fármaco, acompañando a dos análogos de nucleósido, es preferible el uso de un INI, ya que son los que logran un descenso más rápido de la carga viral, beneficioso para evitar la transmisión materno-fetal. Si el diagnóstico se realiza en el tercer trimestre, ya muy próximos al parto debemos iniciar TAR de inmediato sin esperar los resultados de la confirmación ni otras pruebas.
b) En mujeres ya embarazadas y en tratamiento, se valorará la necesidad de adecuar el TAR Tabla 13 y se derivará a un servicio de Obstetricia para manejo del embarazo y el parto.
En todos los escenarios se dará prioridad a favorecer el seguimiento y la adherencia de la mujer, intentando eliminar todas las barreras y asegurar que la mujer embarazada mantenga o alcance cuánto antes una CVP indetectable.
5. Manejo del parto en mujeres infectadas por el VIH.
En mujeres con CVP menor de 50 cp/ml en la semana 36 de gestación, el riesgo de transmisión maternofetal es muy bajo independientemente de si se realiza cesárea o no159. Por tanto, no está indicada la realización de cesárea salvo que haya indicación obstétrica. Con cargas virales entre 50 y 1000 cp/ml la indicación no es tan clara, algunas guías recomiendan la realización de cesárea153160. Si la CVP es mayor de 1000 cp/ml se recomienda además de cesárea, recibir zidovudina iv intraparto.
6. Lactancia materna.
En países con fácil acceso a fórmulas lácteas maternales como España, se debe evitar la lactancia materna, ya que hay algunos casos descritos de transmisión durante la lactancia en mujeres con carga viral indetectable161.
RECOMENDACIONES
- Para evitar la transmisión vertical toda mujer VIH+ debe recibir TAR e iniciarlo tan pronto como sea posible, preferiblemente antes de la concepción (A-II).
- El TAR de elección debe ser una triple terapia Los fármacos de elección son las combinaciones abacavir-lamivudina o tenofovir- FTC más un tercer fármaco que puede ser raltegravir, dolutegravir o darunavir/ritonavir. La elección de uno u otro dependerá del momento de iniciarlo (previo o no a la concepción), los antecedentes de resistencia o intolerancia a algún fármaco y la preferencia de la paciente (A-II).
- El tratamiento intraparto con ZDV por vía iv está indicado si la CVP es > 1000 copias/ ml o es desconocida en el momento del parto (A-I).
- Durante el parto (aparte de las indicaciones obstétricas) está indicada la cesárea en mujeres con carga viral confirmada o sospechosa de más de 1000 copias/ml (A-II). En mujeres con CVP entre 50-1000 es recomendable, aunque se individualizará cada caso (B-III).
- En nuestro medio se desaconseja la lactancia materna para evitar al máximo el riesgo de transmisión (A-II).
Concepción, anticoncepción y menopausia
Redactores: María Velasco, Lara Arbizu
Revisores: Jana Hernández, Tatia Santirso
Los aspectos que se tratan en este capítulo son de gran importancia para las mujeres que viven con el VIH (MVIH) y por ello deben abordarse tanto en AP como en AH coordinándose y complementándose en el abordaje de cada uno de ellos.
Concepción.
Como se comenta en el capítulo anterior en una pareja en la que uno o los dos miembros están infectados por el VIH o tienen un patrón virológico diferente, es muy importante planear la gestación.
Existen estudios que sugieren una disminución de la fertilidad en mujeres infectadas por el VIH, por lo que ante un paciente con este problema, es interesante realizar un estudio básico de fertilidad y exponer las distintas opciones reproductivas, diferenciando si la persona con infección por el VIH es el hombre la mujer o ambos Tabla 14.
Anticoncepción.
La contracepción es esencial en las personas con infección por el VIH. Es de vital importancia, evitar gestaciones no deseadas, mediante la planificación familiar.
Existe evidencia de que en las PVIH pueden ser empleados la mayoría de los métodos anticonceptivos entre los que se encuentran162:
- Métodos barrera:
- Preservativo masculino: eficacia demostrada, cuando se utiliza correctamente y de forma consistente, frente al embarazo y otras ITS.
- Preservativo femenino: método igual de seguro que el anterior, pero su uso no es tan generalizado.
- Diafragma: no recomendado por ser menos eficaz y no proteger frente a las ITS incluido el VIH.
- Espermicidas: ocasionan disrupción epitelial en la mucosa vaginal por lo que aumenta el riesgo de transmisión del VIH164. Evitar su uso.
- Anticoncepción hormonal:
- No protegen frente a las ITS incluido el VIH, por lo que se recomienda protección dual (anticonceptivos + un método de barrera).
- Es clave tener en cuenta las interacciones con los Se pueden consultar en el capítulo de interacciones y polifarmacia de este documento (apartado 3.3.2) o webs o Apps como http://www.interaccionesvih.com/. Como resumen, no hay interacciones importantes entre los fármacos anticonceptivos y la doravirina, rilpivirina, ITIAN, raltegravir, dolutegravir y bictegravir.
- Anticoncepción de emergencia: se debe utilizar cuando falla otro método. Tanto la píldora postcoital de levonorgestrel 1.5 mg como la de acetato de ulipristal 30mg se pueden utilizar según la posología de cada Hay que destacar que existen FAR, como el efavirenz, nevirapina o uso prolongado de ritonavir que disminuyen la eficacia del acetato de ulipristal, por lo que en este caso no estaría recomendado165.
- DIU: (cobre u hormonal): pueden ser utilizados. En fases avanzadas de la enfermedad por el VIH evitar el hormonal166.
- Esterilización masculina o femenina: anticoncepción permanente. No protegen del VIH, por lo que se recomendará usar preservativo asociado.
Menopausia.
La menopausia puede acelerar el desarrollo de comorbilidades relacionadas con la edad, especialmente osteopenia/osteoporosis, ECV y deterioro neurocognitivo167. La edad de la menopausia puede adelantarse en la infección por el VIH (especialmente con mayor inmunosupresión o valores de CD4 inferiores a 200 cel/mm164). Es controvertido si también es mayor la intensidad de la sintomatología asociada en las mujeres con infección por el VIH. Además, algunos TAR puede contribuir a un empeoramiento de la sintomatología168.
Las recomendaciones generales en la menopausia son las mismas que para las mujeres sin infección por el VIH (ejercicio físico, control del peso, una dieta equilibrada rica en calcio y no fumar)168.
El tratamiento hormonal sustitutivo tiene las mismas indicaciones que en la población sin infección por el VIH169 (síntomas climatéricos moderados y severos que no responden al tratamiento conservador), aunque puede tener menor aceptación y mayor tasa de abandono entre las mujeres con infección por el VIH. El tiempo de uso y la dosis utilizada deben ser los mínimos posibles, y es necesario contemplar las interacciones con algún TAR (IP)169. Para el control de los síntomas, se pueden ensayar otros tratamientos como estrógenos vaginales o tratamientos no hormonales (conductuales, grupos de apoyo, clonidina).
Debido al mayor riesgo de osteoporosis170, se recomienda realización de DEXA en las mujeres posmenopáusicas. La repetición de la prueba dependerá de los valores de la DMO. Para obtener información más detallada se puede consultar el documento de consenso sobre la osteoporosis en la infección por el VIH.171
Las recomendaciones de TAR son las mismas que para la población adulta.
RECOMENDACIONES
- En las PVIH es necesario planificar la gestación en la mejor situación clínica posible, minimizando los riesgos para la mujer, la pareja y el feto, exponiendo las distintas opciones reproductivas, en función de si la persona con infección por el VIH es el hombre, la mujer o ambos (II-A).
- Se recomienda evaluar la edad de aparición de la menopausia, atendiendo a los síntomas asociados a la misma, el envejecimiento prematuro y las comorbilidades (RCV, reducción de la DMO) El tratamiento de los síntomas de la menopausia será conservador; se puede valorar el uso de terapia hormonal sustitutiva (III-A).
- Se aconseja realizar DEXA en las mujeres posmenopáusicas con infección por el VIH. (I-A).
Hábitos tóxicos
Autores: Raquel Monsalvo, Virginia Fuentes
Revisores: Jéssica Abadía, Tatia Santirso
Para promocionar conductas seguras en pacientes con infección por el VIH, al igual que en la población general, se debe realizar educación sanitaria de forma rutinaria, clara y sin prejuicios.
El consumo de sustancias tóxicas puede acelerar la evolución del VIH y afectar a la adherencia al TAR.
1. ALCOHOL
Es la principal sustancia de abuso entre los individuos con VIH. Reducir su consumo contribuye a reducir la transmisión, promover la adherencia al tratamiento y prevenir las complicaciones de salud173.
En las personas con VIH aumenta el riesgo de padecer ECV del 37% al 78%, HCC y disfunción neurocognitiva174, especialmente con el consumo sostenido en el tiempo.
Evaluación
Se debe preguntar rutinariamente por el consumo174 e informar sobre sus efectos deletéreos.
El Alcohol Use Disorder Identification Test (AUDIT)174, es de utilidad en la valoración inicial y en el seguimiento anual o bianual.
En general, el consumo se debería reducir a no más de una bebida por día entre mujeres y dos en hombres evitando el consumo diario (<10-20 g/día)175.
Ver Figura 2
Tratamiento
Los principales tratamientos se basan en terapias psicológicas y de apoyo individual, grupal y socio-familiar. El tratamiento farmacológico es eficaz fundamentalmente en el trastorno moderado-grave176.
Las intervenciones breves reiteradas han demostrado efectividad. Idealmente la intervención debería ofrecerse en el mismo entorno del tratamiento174.
La naltrexona de liberación sostenida constituye una opción bien tolerada y efectiva para disminuir el consumo, aunque con adherencia y retención variables. Nalmefeno presenta menor riesgo de hepatotoxicidad. Acamprosato o disulfiram, que requieren una alta motivación y riesgo de interacción con TAR, son menos empleados176.
2. TABACO
La prevalencia de tabaquismo en personas con VIH llega a triplicar la de la población general y es más resistente a la intervención. Se asocia con una mayor incidencia de enfermedad pulmonar obstructiva crónica, cáncer de pulmón y ECV174.
El abandono del consumo mejora la esperanza de vida una media de 10 años y la calidad de vida de los pacientes, así como su respuesta al tratamiento. En personas con VIH el tratamiento de elección para la deshabituación tabáquica es la vareniclina177.
Evaluación
Se recomienda preguntar sobre el consumo de tabaco a todos los adultos que acudan a consulta una vez cada dos años, y aconsejarles que abandonen el tabaco si fuman175. La intervención se puede basar en la estrategia de las 5 As (averiguar si fuma, aconsejar dejar de fumar, apreciar grado de disposición para dejar de fumar, apoyar y acompañar) y fijar visitas de seguimiento.
Debemos llevar a cabo distintas intervenciones según el deseo de abandono.
Tratamiento
Existe tratamiento farmacológico efectivo para la adicción por nicotina por orden de eficacia: vareniclina, bupropion y la terapia sustitutiva con nicotina (parches, chicles o spray)174.
Las intervenciones deberían considerar rehabilitación cognitiva para disminuir la probabilidad de recaída178.
3. CHEMSEX
Introducción
El término “Chemsex” proviene de la conjunción de las palabras inglesas “chemical” y “sex”. Una de las definiciones más extendidas es “el uso intencionado de drogas estimulantes para tener relaciones sexuales por un período largo de tiempo”179. Cuando el uso de estas sustancias se realiza por vía intravenosa, se denomina “slamming” o “slamsex”180.
Existe una amplia variedad de drogas utilizadas en este contexto. En la actualidad, las más consumidas son: gammahidroxibutirato (GHB/GBL), la cocaína, la mefedrona y el MDMA, siendo muy habitual el policonsumo junto con otras sustancias (ketamina, éxtasis o MDMA, nitrito de amilo –poppers-, alcohol e inhibidores de la fosfodiesterasa-5)181.
Características del usuario de chemsex en España
El consumidor habitual es un HSH en torno a los 35 años, sin pareja, suele residir en grandes urbes, autóctono, con estudios universitarios, utiliza aplicaciones móviles para contactar con otros usuarios y practica chemsex fundamentalmente para aumentar el placer en sus relaciones sexuales e incrementar su resistencia física. Dichas sesiones suelen tener lugar en domicilios privados179.
En el caso del paciente con infección por el VIH, es mayoritariamente español (74%), con estudios universitarios (56%) y en TAR (96%)182.
Impacto clínico en el paciente con infección por el VIH
El Chemsex puede tener impacto sobre la salud de las siguientes formas: incremento de prácticas de riesgo con el consiguiente riesgo de transmisión de ITS182183184 afectación de la salud mental (dependencia, ataques de pánico)179, riesgo de interacciones y disminución de la adherencia al TAR185.
Manejo del usuario chemsex
a) Identificación del posible consumo: Sospechar si existen indicadores físicos (ITS de repetición, hepatitis, infección por el VIH, intoxicaciones de repetición, complicaciones de venopunción), psicológicos (ideación autolítica, trastornos del sueño, del estado de ánimo, irritabilidad, labilidad emocional, sentimientos de vergüenza o soledad, agotamiento psíquico) y sociales (aislamiento social, absentismo laboral recurrente, falta de interés por actividades gratificantes previas)186.
b) Definir circuitos de intervención para el abordaje integral: ver Tabla 15
Conclusiones
El chemsex es un fenómeno en aumento. Es importante realizar una entrevista clínica proactiva para detectar consumo de drogas, con el fin de minimizar el riesgo personal y comunitario asociado al consumo de drogas, y detectar un posible consumo problemático, para derivar al paciente a un centro de atención a las adicciones186.
RECOMENDACIONES
- Se recomienda preguntar sobre el consumo de tabaco a todos los adultos que acudan a consulta al menos una vez cada dos años, y aconsejarles que abandonen el tabaco si fuman proporcionando ayuda mediante intervención específica (A-I).
- Identificar y abordar desde AP los factores que influyen de forma negativa en el cumplimiento del TAR (consumo de alcohol abuso del alcohol y otras drogas) y abordarlos con los recursos disponibles (B-II).
- Derivar a Atención Especializada en Adicciones si hay diagnóstico de dependencia de alcohol (B-III), ante consumidores con un trastorno por uso de nicotina grave (A-III) o consumo problemático de drogas (tanto en chemsex como en usuarios “clásicos”).
- El tratamiento de elección para el abuso de cannabis, cocaína y MDMA es la psicoterapia y/o psicoeducación (B-II).
- Diseñar e implementar protocolos consensuados de trabajo interdisciplinar y derivación entre urgencias hospitalarias, AP, centros de ITS, unidades de VIH e infecciosas de hospitales, recursos de salud mental y adicciones y las organizaciones de base comunitaria (A-III).
- Identificar en cada ciudad un centro de atención preferente para las personas que practican chemsex y asignar al usuario un profesional de referencia para que realice el seguimiento de su caso y contraste las derivaciones entre servicios (A-III).
Gráficos:

Tablas:
NA: no suministrado. ND: no realizado.



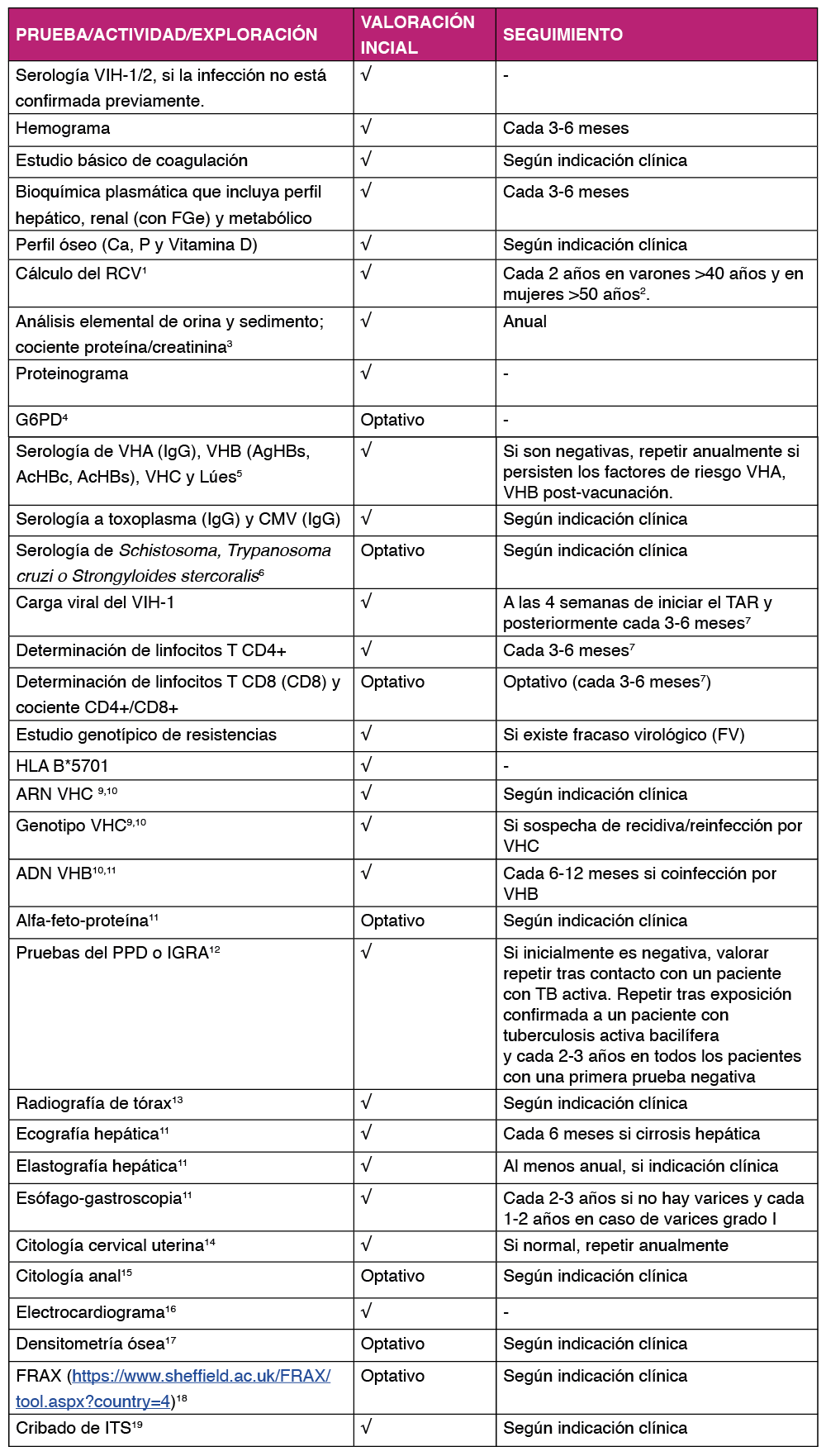
Nota: estas recomendaciones deben considerarse orientativas y pueden ser modificadas de acuerdo con el juicio clínico de los profesionales responsables de la atención al paciente.
√: Realizar
- Preferiblemente con la ecuación ACC/AHA/SCVD (www.cvriskcalculator.com), o, en su defecto, con otras ecuaciones como la de Framingham adaptada a la población con VIH (https://chip.dk/Resources/Clinical-risk-scores), o a la población española (Score: https://heartscore.escardio.org/2016/quickcalculator.aspx?model=spain-castillan).
- Anualmente, si enfermedad cardiovascular (ECV) previa, antecedentes familiares o RCV elevado (>10% en los próximos 10 años).
- Si se usa TDF, realizar 1 y 3 meses después de haberse iniciado el tratamiento y posteriormente cada 6 meses. Si DM2 o HTA, determinar además microalbuminuria y cociente albúmina/creatinina en muestra aislada de
- Inicio de profilaxis con dapsona o sulfonamida si origen africano, asiático o del área mediterránea.
- Inicialmente prueba treponémica y no treponémica, posteriormente únicamente no treponémica si la treponémica es
- Schistosoma sp., Trypanosoma cruzi y Strongyloides stercoralis en personas procedentes de áreas con alta prevalencia de infestación, sobre todo si existe sospecha (por ejemplo, ante la presencia de hematuria, alteración ECG o eosinofilia)
- Se puede considerar determinar la CVP y los CD4 con menos frecuencia (cada 6-12 meses) en pacientes clínicamente estables, con CVP repetidamente suprimida y cifras de CD4 repetidamente >300 células/μL (según criterio médico).
- Realizar solo si se prevé utilizar maraviroc en el esquema terapéutico.
- Si coinfección por
- Si coinfección por VHB se recomienda antes de iniciar el
- Se recomienda consultar las Guías de AEEH/SEIMC de manejo de la VHC (https://seimc.org/contenidos/gruposdeestudio/gehep/ dcientificos/documentos/gehep-seimc_AEEH-dc-2018-HepatitisC.pdf) .
- La sensibilidad disminuye en inmunosupresión grave. La especificidad de PPD disminuye en vacunados (BCG), por lo que se recomienda la utilización de
- Especialmente en pacientes pertenecientes a poblaciones con una elevada prevalencia de TBC, criterios de bronquitis crónica o
- Si se detectan células atípicas, realizar colposcopia y
- Debe realizarse inicialmente en todos los pacientes con hábitos de riesgo (varones homo/bisexuales y mujeres que practican coito anal receptivo) y en los que presentan lesiones perianales o genitales secundarias a VPH. Si citología anormal, debe realizarse anoscopia de alta resolución y biopsia (evidencia de beneficio desconocida; defendida por algunos expertos).
- Especialmente en pacientes con FRCV y/o que vayan a iniciar fármacos que puedan producir problemas de conducción cardíaca.
- Se deben identificar los factores de riesgo de desarrollar alteraciones de la Consúltese el Documento de consenso de GESIDA sobre osteoporosis en la infección por VIH de mayo de 2016 (https://gesida-seimc.org/wp-content/uploads/2017/02/gesida- guiasclinicas-2016-osteoporosis.pdf).
- Se recomienda seguir las recomendaciones el Documento de consenso de GESIDA sobre osteoporosis en la infección por VIH de mayo de 2016 (https://gesida-seimc.org/wp-content/uploads/2017/02/gesida-guiasclinicas-2016-osteoporosis.pdf).
- Valorar el riesgo de ITS y hacer cribado de las mismas siguiendo las recomendaciones del Documento de Consenso sobre las Infecciones de transmisión sexual en adultos, niños y adolescentes de GESIDA/ PNS/GEITS/SEIP, 2017 (https://gesida-seimc.org/ wp-content/uploads/2017/06/Documento_de_consenso_sobre_diagnostico_y_tratamiento_de_las_infecciones_de_transmision_sexual_en_ pdf) .
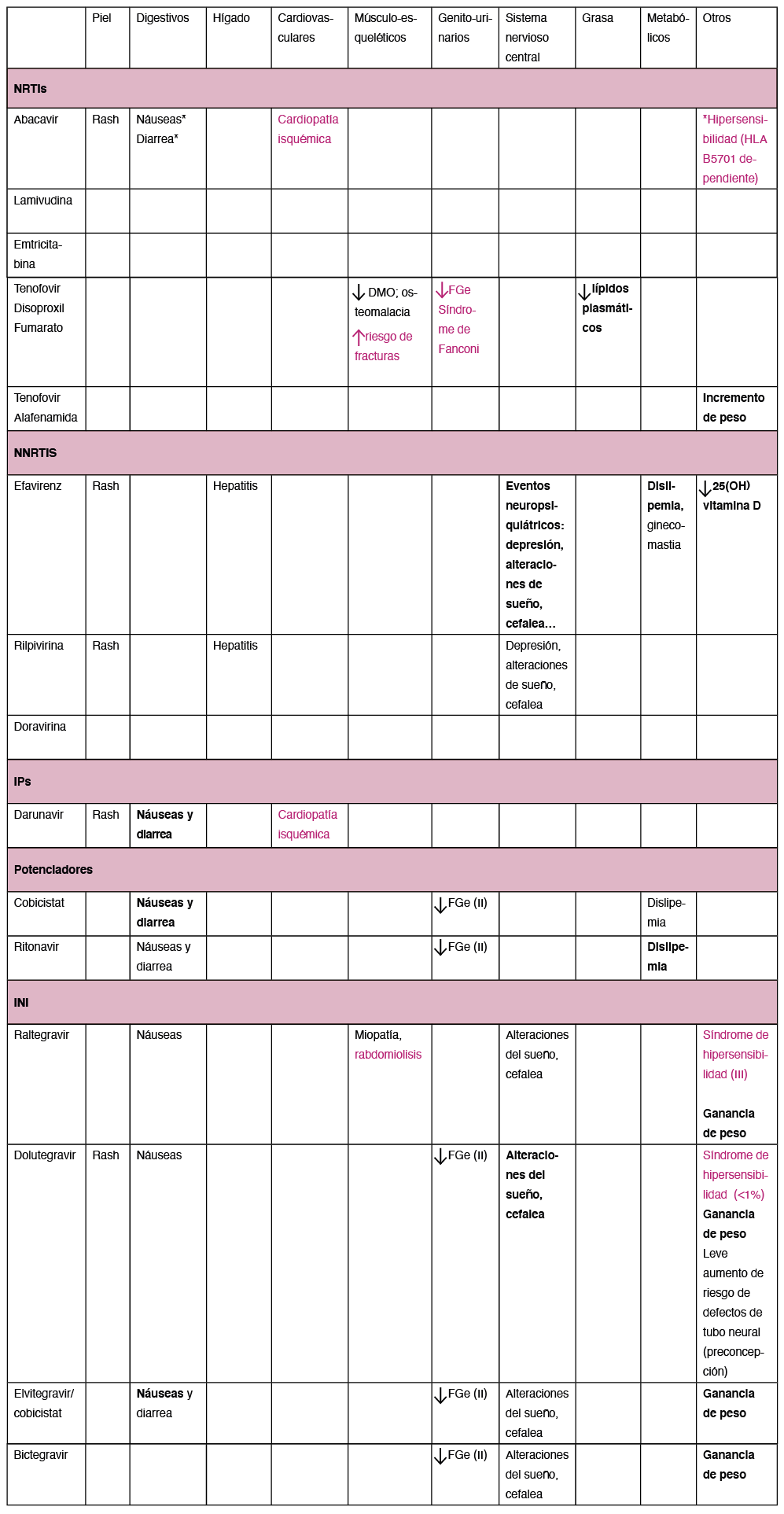
NRTIS: análogos nucleós(t)idos de la transcriptasa reversa; NNRTIS: análogos no nucleósidos de la transcriptasa reversa; IP: inhibidores de proteasa, INI: Inhibidores de integrasa; DMO: densidad mineral ósea; FGe: Filtrado glomerular estimado.
- I) “Efectos frecuentes” (eventos esperados en al menos del 10% de los pacientes tratados) en
“Efectos severos” (eventos que pueden poner en riesgo la vida de una persona y representar una emergencia médica) en rosa. “Efectos ni frecuentes ni severos” en negro.
- I) FGe: disminución del filtrado glomerular estimado por una disminución de la inhibición de la secreción tubular de creatinina sin afectar propiamente al filtrado glomerular real.
III) Se ha comunicado un síndrome DRESS pero solo en 6 casos.
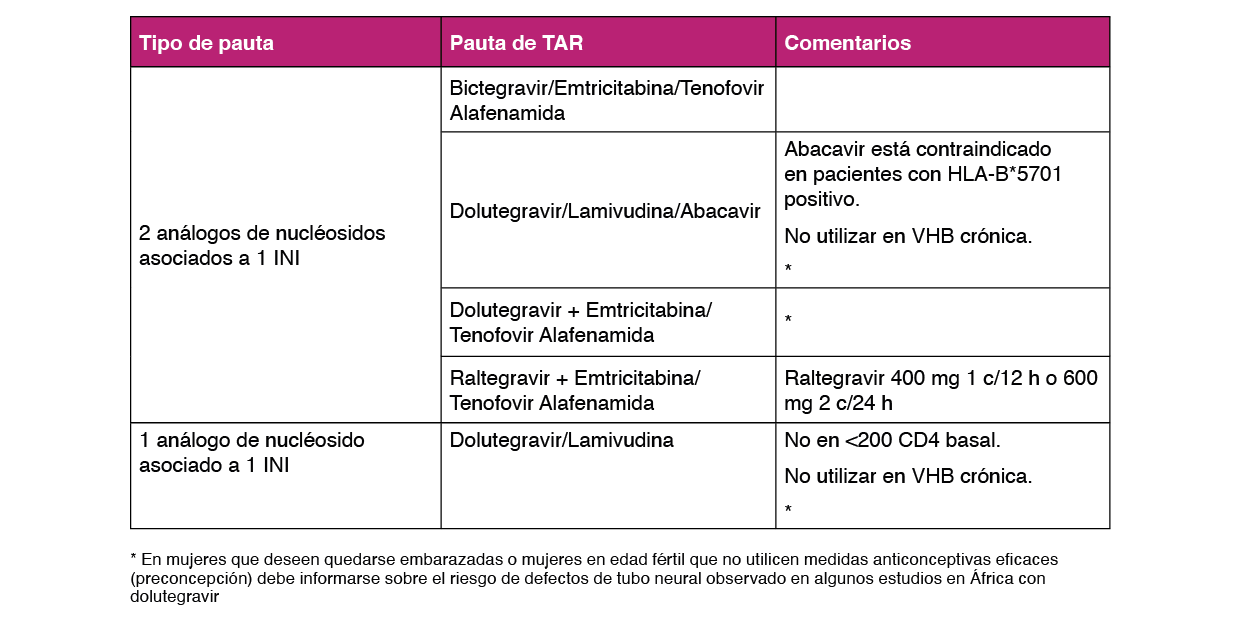
* En mujeres que deseen quedarse embarazadas o mujeres en edad fértil que no utilicen medidas anticonceptivas eficaces (preconcepción) debe informarse sobre el riesgo de defectos de tubo neural observado en algunos estudios en África con dolutegravir.


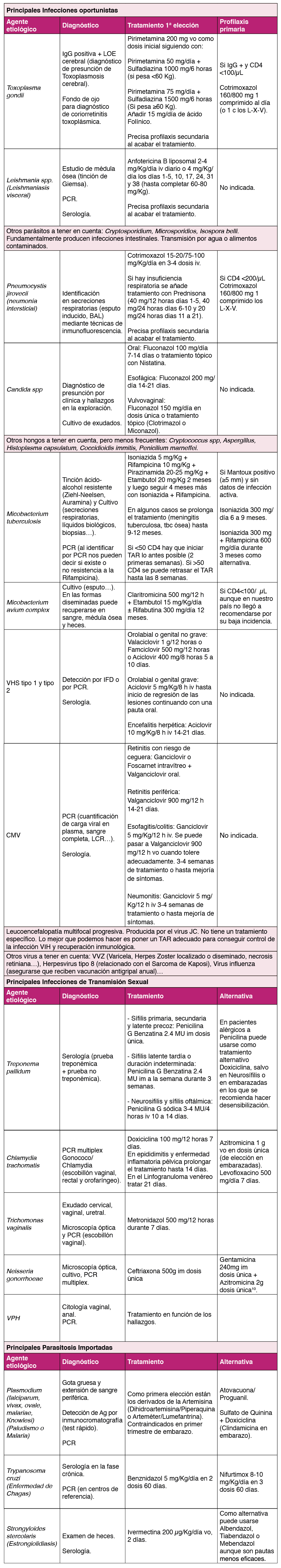


- Raltegravir debe darse en dosis de 400 mg/12 ^No existen datos. #Cobicistat alcanza niveles farmacocinéticos bajos durante el 2º/3er trimestre de embarazo. ##Pueden alcanzar niveles farmacocinéticos bajos durante el 3er trimestre de embarazo, pero suelen ser suficientes para mantener la CV indetectable. Si se continúa con este régimen medir con frecuencia carga viral.** TAF ha demostrado ser eficaz y alcanzar niveles farmacocinéticos adecuados en mujeres que iniciaban el fármaco durante el embarazo. No existen datos de teratogenicidad en primer trimestre. ^^Aumentar dosis en tercer trimestre.
NOTA: Estas indicaciones están en continua revisión.
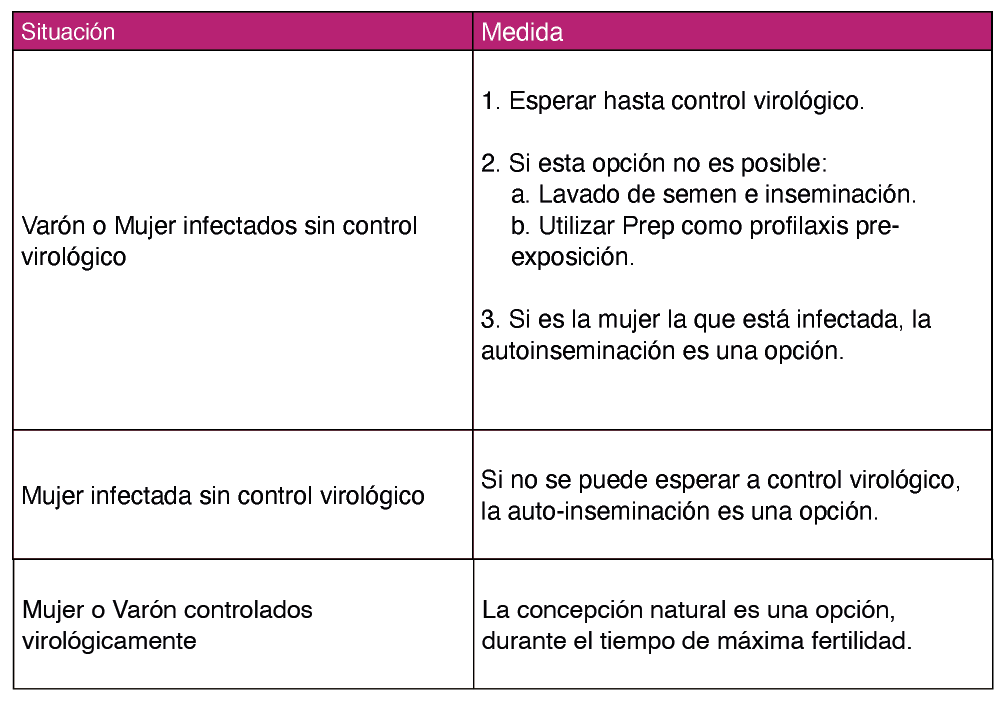
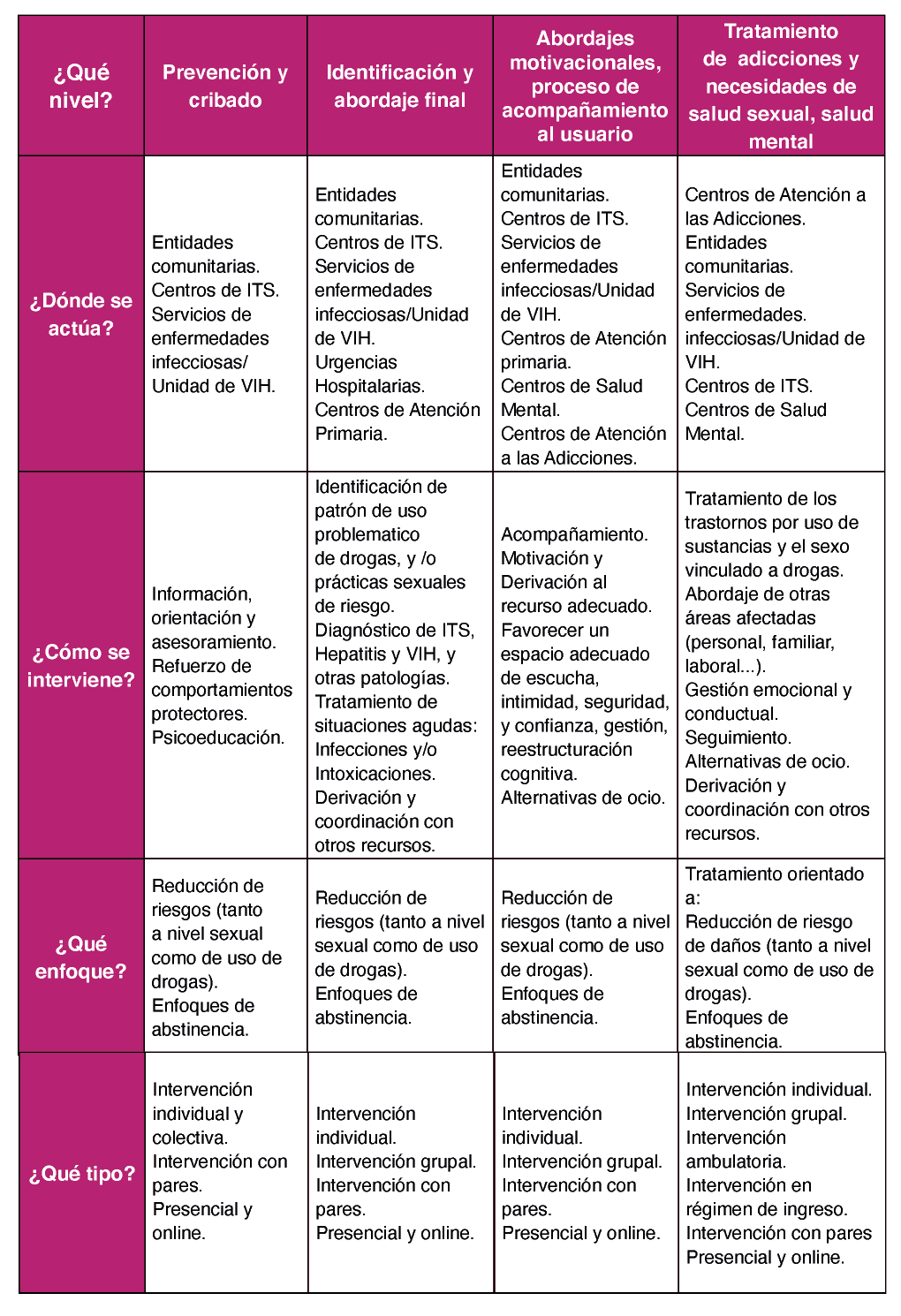
Bibliografía:
1. Page J, Weber R, Somaini B, et al. Quality of generalist vs. specialty care for people with HIV on antiretroviral treatment: a prospective cohort study. HIV Med. 2003 Jul;4(3):276-
2. World Health Organization: Investing in a Comprehensive Health Sector response to HIV/AIDS: Scaling up treatment and accelerating prevention WHO HIV/AIDS Plan. January 2004-December Geneva: World Health Organization, 2004.
3. Odayar J, Myer Transfer of primary care patients receiving chronic care: the next step in the continuum of care. Int Health. 2019 Nov 13;11(6):432-439.
4. Mapp F, Hutchinson J, Estcourt C. A systematic review of contemporary models of shared HIV care and HIV in primary care in high-income settings. Int J STD AIDS. 2015 Dec;26(14):991-7
5. Wong WCW, Luk CW, Kidd MR. Is there a role for primary care clinicians in providing shared care in HIV treatment? A systematic literatura Sex Transm Infect 2012;88:125-131.
6. Cloete C, Regan S, Giddy J, et al. The Linkage Outcomes of a Large-scale, Rapid Transfer of HIV-infected Patients From Hospital-based to Community-based Clinics in South Open Forum Infect Dis. 2014 Aug 12;1(2):ofu058.
7. Cornell M, Lessells R, Fox MP, et al. Mortality among adults transferred and lost to follow-up from antiretroviral therapy programmes in South Africa: a multicenter cohort J Acquir Immune Defic Syndr. 2014 Oct 1;67(2):e67-75.
8. Geng EH, Odeny TA, Lyamuya R, et al. Retention in Care and Patient-Reported Reasons for Undocumented Transfer or Stopping Care Among HIV-Infected Patients on Antiretroviral Therapy in Eastern Africa: Application of a Sampling- Based Approach. Clin Infect 2016 Apr 1;62(7):935-944.
9. Hutchinson J. cita 15 HIV services--what role for primary care? Drug Ther Bull. 2011 Aug;49(8):85. doi: 10.1136/dtb.2011.02.0045. PMID: 21831904.
10. Berenguer J, Álvarez D, Dodero J, et al. Modelo de seguimiento, organización y gestión de la infección por el Enferm Infecc Microbiol Clin 2018; 36(Supl 1):45-49.
11. Tu D, Belda P, Littlejohn D, et al. Adoption of the chronic care model to improve HIV care: in a marginalized, largely aboriginal Can Fam Physician. 2013 Jun;59(6):650- 7.
12. Goetz MB, Bowman C, Hoang T, et Implementing and evaluating a regional strategy to improve testing rates in VA patients at risk for HIV, utilizing the QUERI process as a guiding framework: QUERI Series. Implement Sci. 2008 Mar 19; 3: 16.
13. Goetz MB, Hoang T, Bowman C, et al. A system-wide intervention to improve HIV testing in the Veterans Health J Gen Intern Med. 2008 Aug;23(8):1200-7.
14. Gómez-Ayerbe C, Martínez-Sanz J, Muriel A, et al. Impact of a structured HIV testing program in a hospital emergency department and a primary care PLoS One. 2019 Aug 1;14(8):e0220375.
15. Kay ES, Lacombe-Duncan A, Pinto RM. Predicting Retention in HIV Primary Care:Is There a Missed Visits Continuum Based on Patient Characteristics? AIDS Behav.2019 Sep;23(9):2542-2548.
16. Hutchinson J, Sutcliffe LJ, Williams AJ, et al. Developing new models of shared primary and specialist HIV care in the UK: a survey of current practice. Int J STD AIDS. 2016 Jul;27(8):617-24.
17. Kendall CE, Shoemaker ES, Porter JE, et al. Canadian HIV Care Settings as Patient- Centered Medical Homes (PCMHs). J Am Board Fam 2019. Mar-Apr;32(2):158-167.
18. O'Brien N, Hong QN, Law S, et Health System Features That Enhance Access to Comprehensive Primary Care for Women Living with HIV in High-Income Settings: A Systematic Mixed Studies Review. AIDS Patient Care STDS. 2018 Apr;32(4):129-148.
19. Rogers GD, Barton CA, Pekarsky BA, et al. Caring for a marginalised community: the costs of engaging with culture and Med J Aust. 2005 Nov 21;183(S10):S59-63.
20. Cabral HJ, Davis-Plourde K, Sarango M, et al. Peer Support and the HIV Continuum of Care: Results from a Multi-Site Randomized Clinical Trial in Three Urban Clinics in the United AIDS Behav. 2018 Aug;22(8):2627-2639.
21. Webel A, Prince-Paul M, Ganocy S, et al. Randomized clinical trial of a community navigation intervention to improve well-being in persons living with HIV and other co- AIDS Care. 2019 May;31(5):529-535.
22. Ferre A, Santos-Pinheiro A, Fanjul FJ, et al. Pilot Project of shared assistance with primary care for patients with HIV EACS 2019.
23. Marcus JL, Chao CR, Leyden WA, et al. Narrowing the gap in life expectancy between HIV-infected and HIV-uninfected individuals with access to care. J Acquir Immune Defic Syndr 2016; 73:39–46.
24. Lerner AM, Eisinger RW, Fauci AS. Comorbidities in persons with HIV: the lingering JAMA 2020; 323:19–20.
25. British HIV Association. Standards of care for people living with HIV 2013. London: Mediscript Ltd,
26. Lazarus JV, Safreed-Harmon K, Barton SE, et Beyond viral suppression of HIV – the new quality of life frontier. BMC Med. 2016;14(1):94 s12916-016-0640.
27. Gardner LI, Metsch LR, Anderson-Mahoney P, et al; Antiretroviral Treatment and Access Study Efficacy of a brief case management intervention to link recently diagnosed HIV-infected persons to care. AIDS 2005; 19:423–3.
28. Gardner LI, Giordano TP, Marks G, et al; Retention in Care Study Group. Enhanced personal contact with HIV patients improves retention in primary care: a randomized trial in 6 US HIV Clin Infect Dis 2014; 59:725–34.
29. Melanie A Thompson, Michael A Horberg, Allison L Agwu, et Primary Care Guidance for Persons With Human Immunodeficiency Virus: 2020 Update by the HIV Medicine Association of the Infectious Diseases Society of America, Clinical Infectious Diseases, ciaa1391, https://doi.org/10.1093/cid/ciaa1391.
30. Jeremy D Young, Rima Abdel-Massih, Thomas Herchline, et al. Infectious Diseases Society of America Position Statement on Telehealth and Telemedicine as Applied to the Practice of Infectious Clinical Infectious Diseases. 2019; 68(9):1437–1443.
31. Maloney KM, Bratcher A, Wilkerson R, et al. Electronic and other new media technology interventions for HIV care and prevention: a systematic review. J Int AIDS Soc. 2020 Jan;23(1):e25439. doi: 1002/jia2.25439.
32. De la Huerga T, Mañas C, Gomez O, et al. E-consulta, modelos de intervención telemática en la unidad de coordinación sociosanitaria de un hospital de alta Rev Esp Geriatr Gerontol. 2018;53(S1):10–14.
33. Vidal-Alaball J, Camps-Vilà Directrices para una buena y segura atención telefónica en época de COVID-19. Atención Primaria 53 (2021) 101965. https://doi.org/10.1016/j. aprim.2020.12.006.
34. Panel de Expertos del Grupo de Estudio de SIDA. Documento de Consenso sobre Teleconsulta (TC) para Personas que viven con el VIH. https://gesida-seimc.org/wp- content/uploads/2020/09/TELECONSULTA_Guia_GeSIDA.pdf
35. Deeks SG, Lewin SR, Havlir DV. The end of AIDS: HIV infection as a chronic disease. 2013 November 2;382(9903):1525-33. doi:10.1016/S0140-6736(13)61809-7.
36. Ramón Trapero JL, Zorzano Martínez VIH-Sida y todo lo que puede hacer el médico de familia. AMF 2018;14(5);295-304.
37. Smit M, Brinkman K, Geerlings S, et al. ATHENA observational cohort. Future challenges for clinical care of an ageing population infected with HIV: a modelling Lancet Infect Dis. 2015;15:810-8.
38. Irvine MK, Chamberlin SA, Robbins RS, et al. Improvements in HIV care engagement and viral load suppression following enrollment in a comprehensive HIV care coordination Clin Infect Dis 2015; 60:298–310.
39. McKaylee MR, Kate Penrose, Irvine MK, et al. Impact of an HIV Care Coordination Program on Durable Viral Suppression. J Acquir Immune Defic Syndr 2019;80:46-55.
40. Horberg MA, Hurley LB, Townet WJ, et Determination of Optimized Multidisciplinary Care Team for Maximal Antiretroviral Therapy Adherence J Acquir Immune Defic Syndr. 2012 June 1; 60(2): 183–190.
41. Tu D, Belda P, Littlejohn D, et al. Adoption of the chronic care model to improve HIV care in a marginalized, largely aboriginal population Can Fam Physician 2013;59:650-7.
42. Pasricha A, Deinstadt RTM, Moher D, et Chronic Care Model Decision Support and Clinical Information Systems Interventions for People Living with HIV: A Systematic Review. J Gen Intern Med 28(1):127–35.
43. Grupo de Estudio del SIDA-SEIMC. Documento de consenso de GESIDA sobre control y monitorización de la infección por el Panel de expertos de GESIDA. Vacunaciones. 2018; Cap15: p. 49-53. https://gesida-seimc.org/wp-content/uploads/2018/02/gesida_ DC_Control_Monitorizacion_VIH.pdf
44. Panel on Opportunistic Infections in HIV-Infected Adults and Adolescents. Guidelines for the prevention and treatment of opportunistic infections in HIV-infected adults and adolescents: recommendations from the Centers for Disease Control and Prevention, the National Institutes of Health, and the HIV Medicine Association of the Infectious Diseases Society of Last updated May 29, 2018; http://aidsinfo.nih.gov/contentfiles/ lvguidelines/adult_oi.pdf.
45. Thompson MA, Horberg MA, Allison L, et al. Primary care guidance for persons with human immunodeficiency virus: 2020 Update by the HIV Medicine Association of the Infectious Diseases Society of Clin Infect Dis 2020; DOI: 10.1093/cid/ciaa1391.
46. Geretti AM, Brook G, Csameron C, et British HIV Association Guidelines on the Use of Vaccines in HIV-Positive Adults 2015. HIV Medicine 2016; 17 (Suppl 3), s2-s81.
47. Consejo Interterritorial del Sistema Nacional de Salud. Vacunación específica en personas adultas (≥18 años) con condiciones de Calendario recomendado año 2021. https://www.mscbs.gob.es/profesionales/saludPublica/prevPromocion/vacunaciones/ programasDeVacunacion/riesgo/docs/Anexo3.pdf
48. Centers for Disease Control and Use of 13-valent pneumococcal conjugate vaccine and 23-valent pneumococcal polysaccharide vaccine for adults with immunocompromising conditions: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Morb Mortal Wkly Rep. 2012;61(40):816-9. Available at: https://pubmed.ncbi.nlm.nih.gov/23051612/
49. Mena G, García-Basteiro AL, Bayas JM. Hepatitis B and A vaccination in HIV infected adults: a Hum Vaccin Immunother 2015; 11:2582–98.
50. Rainone V, Giacomet V, Penagini F, et al. Human papilloma virus vaccination induces strong human papilloma virus specific cell-mediated immune responses in HIV-infected adolescents and young AIDS 2015; 29:739–43.
51. Buchbinder SP, Katz MH, Hessol NA, et Herpes zoster and human immunodeficiency virus infection. J Infect Dis. 1992 Nov;166(5):1153-6. doi: 10.1093/infdis/166.5.1153. PMID: 1308664.
52. Grupo de trabajo de vacunación frente a herpes zóster de la Ponencia de Programa y Registro de Comisión de Salud Pública del Consejo Interterritorial del Sistema Nacional de Salud. Ministerio de Sanidad, marzo 2021.HerpesZoster_ RecomendacionesVacunacion.pdf
53. Ficha técnica Disponible en: https://cima.aemps.es/cima/pdfs/es/ft/1181272001/ FT_1181272001.pdf
54. Estrategia de vacunación frente a COVID-19 en España. Grupo de trabajo técnico de vacunación COVID-19 y ponencia de programa y registro de Actualización 22 de julio 2021. SNS.
55. British HIV Association Guidelines on the Use of Vaccines in HIV-Positive Adults 2015.
56. European AIDS Clinical Society Guidelines. Version 10.1. October 2020.
57. Kim DK, Riley LE, Harriman KH, et Recommended immunization schedule for adults aged 19 years or older, UnitedStates, 2017. Ann Intern Med 2017; 166:209–219.
58. World Health Organization. Vaccine position papers. http://www.who.int/immunization/ documents/positionpapers/en/. (Consultado: 10.2017).
59. Documento de consenso de GESIDA sobre control y monitorización de la infección por el VIH. 2018.
60. Documento de consenso de GeSIDA sobre control y monitorización de la infección por VIH (actualización abril 2018). Página 18. Disponible en: https://gesida- seimc.org/wp-content/uploads/2019/03/DOCUMENTO_DE_CONSENSO_GeSIDA_ SOBRE_CONTROL_Y_MONITORIZACION_DE_INFECCION_POR_VIH_ABRIL_2018. pdf
61. Documento de consenso de GeSIDA sobre control y monitorización de la infección por VIH (actualización abril 2018). Página 20. Disponible en: https://gesida- seimc.org/wp-content/uploads/2019/03/DOCUMENTO_DE_CONSENSO_GeSIDA_ SOBRE_CONTROL_Y_MONITORIZACION_DE_INFECCION_POR_VIH_ABRIL_2018. pdf
62. Documento de consenso de GeSIDA sobre control y monitorización de la infección por VIH (actualización abril 2018). Páginas 23-24. Disponible en: https://gesida- seimc.org/wp-content/uploads/2019/03/DOCUMENTO_DE_CONSENSO_GeSIDA_ SOBRE_CONTROL_Y_MONITORIZACION_DE_INFECCION_POR_VIH_ABRIL_2018. pdf
63. Organización Mundial de la Salud (OMS). Directrices unificadas ARV 2013. Capítulo 7: Orientaciones clínicas aplicables a lo largo de todo el proceso asistencial: tratamiento Junio 2013. 7.3: 132-136. Disponible en: https://apps.who.int/iris/bitstream/ handle/10665/129493/9789243505725_spa.pdf?sequence=1
64. Documento de consenso de GeSIDA/Plan Nacional sobre el SIDA respecto al tratamiento antirretroviral en adultos infectados por el virus de la inmunodeficiencia humana (julio 2020). Páginas 20-22. Disponible en: https://gesida-seimc.org/wp-content/ uploads/2020/07/TAR_GUIA_GESIDA_2020_COMPLETA_Julio.pdf
65. Navarro J, Caballero E, Curran A, et Impact of low level viremia on virological failure in HIV-1 infected patients with stable antiretroviral treatment. Antivir Ther 2016:21;345-Disponible en: https://www.intmedpress.com/serveFile.cfm?sUID=21aba578-9675- 4a2a-afc0-bef26a765c65
66. Thompson MA, Horberg MA, Agwu AL, et al. Primary Care Guidance for Persons With Human Immunodeficiency Virus: 2020 Update by the HIV Medicine Association of the Infectious Diseases Society of America. Clin Infect Dis. 2020 Nov 6:ciaa1391. doi: 10.1093/ cid/ciaa1391. Epub ahead of PMID: 33225349. Disponible en: https://academic.oup. com/cid/advance-article/doi/10.1093/cid/ciaa1391/5956736
67. Documento de consenso de GeSIDA/Plan Nacional sobre el SIDA respecto al tratamiento antirretroviral en adultos infectados por el virus de la inmunodeficiencia humana (julio 2020). Páginas 59-61. Disponible en: https://gesida-seimc.org/wp-content/ uploads/2020/07/TAR_GUIA_GESIDA_2020_COMPLETA_Julio.pdf
68. Grupo de Estudio del SIDA (GeSIDA) – Indicadores de calidad asistencial de GESIDA para la atención de personas que viven con el VIH (2021). Páginas 4-6. Disponible en: https://gesida-seimc.org/wp-content/uploads/2021/04/indice_calidad_Guia_GeSIDA.pdf
69. Eacs guidelines version 1 october 2020. Disponible en: https://www.eacsociety. org/media/guidelines-10.1_30032021_1.pdf
70. Panel de expertos del Grupo de Estudio de Sida (GeSIDA) y Plan Nacional sobre el Sida (PNS). Documento de consenso de GeSIDA/Plan Nacional sobre el SIDA respecto al tratamiento antirretroviral en adultos infectados por el virus de la inmunodeficiencia Julio 2020. Accesible en: https://www.eacsociety.org/media/guidelines-10.1_5. pdf (consultado 19.06.2021).
71. EACS Guidelines version 10.1, October 2020. Accesible en: https://www.eacsociety. org/files/guidelines-10.1_5.pdf (consultado 06.2021).
72. Lawn SD, Torok ME, Wood R. Optimum time to start antiretroviral therapy during HIV- associated opportunistic infections. Curr Opin Infect Dis 2011; 24:34-42
73. Makadzange AT, Ndhlovu CE, Takarinda K, et al. Early versus delayed initiation of antiretroviral therapy for concurrent HIV infection and cryptococcal meningitis in sub- saharan Clin Infect Dis 2010;50:1532-8.
74. Boulware DR, Meya DB, Muzoora C, et Timing of antiretroviral therapy after diagnosis of cryptococcal meningitis. N Engl J Med 2014; 370:2487-98.
75. Kelly C, Gaskell KM, Richardson M, et al Discordant Immune Response with Antiretroviral Therapy in HIV1: A Systematic Review of Clinical Outcomes. PLoS ONE 2016; 11(6): doi:10.1371/journal. Pone.0156099.
76. Requena S, Lozano A, Caballero E, et al. Clinical experience with integrase inhibitors in HIV-2 infected individuals in Spain. J Antimicrob Chemother 2019;74:1357-62.
77. Smith RA, Raugi DN, Wu VH, et al. Comparison of the antiviral activity of bictegravir against HIV1 and HIV-2 isolates and integrase inhibitor-resistant HIV-2 Antimicrob Agents Chemother 2019;63:e00014-19.
78. Requena S, Caballero E, Lozano A, et Treatment outcome in dually HIV-1 and HIV-2 coinfected patients living in Spain. AIDS 2019;33: 2167-72.
79. Documento de consenso de GeSIDA/Plan nacional sobre SIDA respecto al tratamiento antirretroviral en adultos infectados por el virus de inmunodeficiencia humana (Enero 2019). Panel de expertos de GeSIDA y del plan nacional sobre SIDA (6.3: interacciones farmacológicas). Disponible en: http://gesida-seimc.org/wp-content/uploads/2019/01/ pdf
80. Grupo de estudio del sida (GeSIDA). Desprescripción farmacológica de la terapia no antirretroviral en pacientes con infección por Noviembre 2018 [accessed 11/2019]. Disponible en: http://gesida-seimc.org/wp-content/uploads/2018/09/gesida_ desprescripcion_farmacologica_de_la_terapia_no_antirretroviral_en_pacientes_con_ infeccion_por_VIH.pdf
81. López‐Centeno B, Badenes‐Olmedo C, Mataix‐Sanjuan Á, et al. Polypharmacy and drug–drug interactions in people living with human immunodeficiency virus in the region of Madrid, Spain: a population‐based study. Clin Infect 2020; 71(2): 353‐ 362
82. Gimeno-Gracia M, Sánchez-Rubio-Ferrández J, Robustillo-Cortés MA, et al. Prevalencia de polifarmacia y complejidad farmacoterapéutica en personas mayores con VIH en España. Estudio Farm Hosp. 2020;44(4):127-34.
83. Marzolini C, Back D, Weber R, et al. Ageing with HIV: medication use and risk for potential drug-drug interactions. J Antimicrob Chemother. 2011;66(9):2107–11.
84. Bastida C, Grau A, Márquez M, et al. Polifarmacia e interacciones farmacológicas potenciales en una población envejecida con infección por el Farm Hosp. 2017;41(5):618-624.
85. EACS Guidelines 0 November 2019. pdf (Part III Drug-Drug interactions) Disponible en: https://www.eacsociety.org/files/2019_guidelines-10.0_final.pdf
86. Guía de interacciones farmacológicas, disponible en: http://www.interaccionesvih.com/ html
87. Panel de expertos de GeSIDA, Plan Nacional sobre el Documento de consenso de GeSIDA/Plan Nacional sobre el Sida respecto al tratamiento antirretroviral en adultos con infección por el virus de la inmunodeficiencia humana (Actualización enero 2014). Enferm Infecc Microbiol Clin. 2014;32(7):446.e1-446.e42.
88. HIV Drug interactions University of Liverpool, disponible en: https://www.hiv- org
89. Grupo de expertos de la Secretaría del Plan Nacional sobre el SIDA (SPNS), Grupo de estudio del SIDA (GeSIDA) y Sociedad Española de Farmacia Hospitalaria (SEFH). Documento de consenso para mejorar la adherencia a la farmacoterapia en paciente con infección por el virus de la inmunodeficiencia humana en tratamiento antirretroviral. Actualización Febrero Disponible en: http://gesida-seimc.org/wp content/ uploads/2020/04/GUIA_GESIDA_febrero_2020_Adherencia.pdf
90. Mannheimer S, Friedland G, Matts J, Child C, Chesney The consistency of adherence to antiretroviral therapy predicts biologic outcomes for human immunodeficiency virus-infected persons in clinical trials. Clin Infect Dis. 2002 Apr 15;34(8):1115-21. doi: 10.1086/339074. Epub 2002 Mar 11. PMID: 11915001.
91. Nachega JB, Uthman OA, Peltzer K, et Association between antiretroviral therapy adherence and employment status: systematic review and meta-analysis. Bull World Health Organ. 2015 Jan 1;93(1):29-41. doi: 10.2471/BLT.14.138149. Epub 2014 Oct 30. PMID: 25558105; PMCID: PMC4271680.
92. Kim J, Lee E, Park BJ, et al. Adherence to antiretroviral therapy and factors affecting low medication adherence among incident HIV-infected individuals during 2009-2016: A nation wide Sci Rep. 2018;8(1):3133. Published 2018 Feb 16. doi:10.1038/s41598- 018-21081-x
93. Baumgartner A, Drame K, Geutjens S, et al. Does the Polypill Improve Patient Adherence Compared to Its Individual Formulations? A Systematic Review. Pharmaceutics. 2020 Feb 22;12(2):190. doi: 3390/pharmaceutics12020190. PMID: 32098393; PMCID: PMC7076630.
94. Govindasamy D, Ford N, Kranzer K. Risk factors, barriers and facilitators for linkage to antiretroviral therapycare: a systematic review, AIDS: October 23rd, 2012 - Volume 26 - Issue 16 - p 2059-2067 doi: 1097/QAD.0b013e3283578b9b
95. Castillo-Mancilla JR, Haberer JE. Adherence Measurements in HIV: New Advancements in Pharmacologic Methods and Real-Time Curr HIV/AIDS Rep. 2018;15(1):49- 59. doi:10.1007/s11904-018-0377-0
96. Kanters S, Park JJ, Chan K, et al. Interventions to improve adherence to antiretroviral therapy: a rapid systematic review. Lancet HIV 2017; 4: e-31-e40 (doi: 10.1016/S2352- 3018(16)30206-5.
97. Shah ASV, Stelzle D, Lee KK, et al. Global burden of atherosclerotic cardiovascular disease in people living with HIV. Circulation 2018;138:1100-12.
98. Grand M, Bia D, Diaz Cardiovascular Risk Assessment in People Living With HIV: A Systematic Review and Meta-Analysis of Real-Life Data. Curr HIV Res. 2020;18(1):5-18.
99. So-Armah K, Benjamin LA, Bloomfield GS, et al. HIV and cardiovascular disease. Lancet 2020;7(4):e279-e293.
100. Documento de consenso sobre las alteraciones metabólicas y Riesgo Cardiovascular en pacientes con Infección por el VIH. Actualización Febrero 2017. Grupo de expertos del Grupo de Estudio sobre Alteraciones Metabólicas (GEAM), de la Secretaría del Plan Nacional sobre el Sida (SPNS) y del Grupo de Estudio de Sida (GeSIDA). http:// gesida-seimc.org/wp-content/uploads/2017/02/gesida-guiasclinicas-2017-Alteraciones_ pdf
101. European AIDS Clinical Society (EACS) Guidelines. Version 10.1. October 2020. https:// eacsociety.org/media/guidelines-10.1_finaljan2021_1.pdf
102. Feinstein MJ, Hsue PY, Benjamin LA, et al. Characteristics, Prevention, and Management of Cardiovascular Disease in People Living With HIV. A Scientific Statement From the American Heart Circulation. 2019;140:e98–e124.
103. Thompson MA, Horberg MA, Agwu AL, et Primary Care Guidance for Persons With Human Immunodeficiency Virus: 2020 Update by the HIV Medicine Association of the Infectious Diseases Society of America. Clin Infect Dis 2020 Nov 6;ciaa1391.
104. Petoumenos K, Worm S, Reiss P, et al. Rates of cardiovascular disease following smoking cessation in patients with HIV infection: results from the D:A:D study. HIV Med 2011;12:412-421.
105. Myerson M, Malvestutto C, Aberg JA. Management of lipid disorders in patients living with J Clin Pharmacol. 2015;55(9):957-74.
106. Unger T, Borghi C, Charchar F, et al. 2020 International Society of Hypertension Global Hypertension Practice Hypertension. 2020;75:1334-1357.
107. Corma-Gómez A, Macías J, Téllez F, et al. Liver Stiffness at the Time of Sustained Virological Response Predicts the Clinical Outcome in People Living With Human Immunodeficiency Virus and Hepatitis C Virus With Advanced Fibrosis Treated With Direct-acting Clin Infect Dis. 2020;71(9):2354-2362.
108. Corma-Gómez A, Macías J, Morano L, et al. Liver Stiffness-Based Strategies Predict Absence of Variceal Bleeding in Cirrhotic Hepatitis C Virus-Infected Patients With and Without Human Immunodeficiency Virus Coinfection After Sustained Virological Response. Clin Infect 2021;72(5):e96-e102. doi:10.1093/cid/ciaa1726
109. Papatheodoridis G, Dalekos G, Sypsa V, et al. PAGE-B predicts the risk of developing hepatocellular carcinoma in Caucasians with chronic hepatitis B on 5-year antiviral J Hepatol. 2016;64(4):800-806. doi:10.1016/j.jhep.2015.11.035
110. Macías J, Pineda JA, Real Non-Alcoholic Fatty Liver Disease in HIV Infection. AIDS Rev. 2017;19(1):35-46.
111. Guía de práctica clínica sobre los Tumores no definitorios de sida e infección por el VIH (Actualización marzo 2019). https://gesida-seimc.org/wp-content/uploads/2019/05/ pdf
112. Lopez-Centeno B, Badenes-Olmedo C, Mataix-Sanjuan A., et al. Polypharmacy and Drug–Drug Interactions in People Living With Human Immunodeficiency Virus in the Region of Madrid, Spain: A Population-Based Clin Infect Dis 2020; 71(2): 353-62.
113. Documento de consenso de GeSIDA para la evaluación y el tratamiento de las enfermedades renales en pacientes con infección por el virus de la inmunodeficiencia https://gesida-seimc.org/wp-content/uploads/2020/07/GUIA_GESIDA_Renal_2020. pdf
114. Documento de consenso sobre la osteoporosis en la infección por el VIH (Mayo 2016). https://gesida-seimc.org/wp-content/uploads/2017/02/gesida-guiasclinicas-2016- pdf
115. Duvivier C, Kolta S, Assoumou L, et al. Greater decrease in bone mineraldensity with protease inhibitor regimens compared with non nucleoside reverse transcriptase inhibitor regimens in HIV-1 infected naive AIDS 2009; 23(7):817–24.
116. Documento de consenso de Gesida/Plan nacional sobre el Sida respecto al tratamiento antirretroviral en adultos infectados por el virus de la inmunodeficiencia humana (Actualización julio 2020). Disponible en: http://gesida-seimc.org/wp-content/ uploads/ 2020/ 07/ TAR_ GUIA_ GESIDA_ pdf
117. Documento de consenso sobre el manejo clínico de la comorbilidad neuropsiquiátrica y cognitiva asociada a la infección por VIH-1. https://gesida-seimc.org/wp-content/ uploads/2021/02/Guia_GESIDA_ManejoClinicoComorbilidad.pdf
118. Documento de prevención y tratamiento de infecciones oportunistas y otras coinfecciones en pacientes con infección por Actualización mayo 2015. http://gesida- seimc.org/wp-content/uploads/2017/02/gesida-guiasclinicas-2015-InfeccionesOportunist asyCoinfeccionesVIH.pdf
119. Panel on Opportunistic Infections in Adults and Adolescents with HIV. Guidelines for the prevention and treatment of opportunistic infections in adults and adolescents with HIV: recommendations from the Centers for Disease Control and Prevention, the National Institutes of Health, and the HIV Medicine Association of the Infectious Diseases Society of Available at https://clinicalinfo.hiv.gov/sites/default/files/guidelines/documents/ Adult_OI.pdf.
120. Recomendaciones de GESIDA sobre el tratamiento de la tuberculosis en los adultos infectados por el virus de la inmunodeficiencia humana. Actualización mayo 2018. http:// gesida-seimc.org/wp-content/uploads/2018/08/gesida_TB_en_VIH.pdf
121. World Health Treatment of tuberculosis: guidelines. 4th ed. World Health Organization Web site. URL: https://www.who.int/news/item/07-05-2010-treatment-of- tuberculosis-guidelines-for-national-programme (acceso 22 noviembre 2020).
122. González-Martín J, García-García JM, Anibarro L, et Documento de consenso sobre diagnóstico, tratamiento y prevención de la tuberculosis. Enferm Infecc Microbiol Clin. 2010; 28(5): 297.e1-297.e20. También publicado en Arch Bronconeumol 2010;46(5):255- 274.
123. Documento de consenso sobre diagnóstico y tratamiento de las infecciones de transmisión sexual en adultos, niños y adolescentes. Actualización marzo 2017. GESIDA. http://gesida-seimc.org/wp-content/uploads/2017/06/Documento_de_consenso_sobre_ pdf
124. Galán Montemayor JC, Lepe Jiménez JA, Otero Guerra L, et al. Diagnóstico micro- biológico de las infecciones de transmisión sexual y otras infecciones genitales. 2018. 24a. Vázquez Valdés F (coor¬dinador). Procedimientos en Microbiología Clínica. Cercenado Mansilla E, Cantón Moreno R (editores). Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (SEIMC). 2018
125. Sexualy transmitted diseases treatment guidelines, MMWR June 5, 2015, Vol 64, Nº3
126. Salvador F, Molina I, Sulleiro E, et al. Tropical diseases screening in immigrant patients with human immunodeficiency virus infection in Am J Trop Med Hyg 2013;88:1196– 1202.
127. Alberny Iglesias M, Bonnet Monné S, Alazamoea Domingo C, at al. Guía terapèutica electrònica. Problemes de salut d’adults: infeccions de transmissió sexual. Barcelona: Institut Català de la Salut,
128. Samji H, Cescon A, Hogg RS, et al. Closing the gap: increases in life expectancy among treated HIV-positive individuals in the United States and Canada. PLoS One. 2013;8(12):e81355.
129. Morlat P, Roussillon C, Henard S, et Causes of death among HIV-infected patients in France in 2010 (national survey): trends since 2000. AIDS. 2014;28(8):1181-91.
130. Bonnet F, Burty C, Lewden C, et al. Changes in cancer mortality among HIV-infected patients: the Mortalité 2005 Survey. Clin Infect 2009;48(5):633-9.
131. Goncalves PH, Montezuma-Rusca JM, Yarchoan R, Uldrick TS. Cancer prevention in HIV-infected Semin Oncol. 2016;43(1):173-88.
132. Conigliaro J, Gordon AJ, McGinnis KA, et al- Rabeneck L, Justice AC, Study VAC-S. How harmful is hazardous alcohol use and abuse in HIV infection: do health care providers know who is at risk? J Acquir Immune Defic 2003;33(4):521-5.
133. García-Abellán J, Del Río L, García JA, et al. Risk of cancer in HIV-infected patients in Spain, 2004-2015. The CoRIS cohort Enferm Infecc Microbiol Clin. 2019;37(8):502- 8.
134. Croswell JM, Ransohoff DF, Kramer BS. Principles of cancer screening: lessons from history and study design Semin Oncol. 2010;37(3):202-15.
135. Programas de cribado de cáncer del Ministerio de Sanidad y Consumo. Gobierno de España. Consultado en: https://www.mscbs.gob.es/profesionales/saludPublica/prevPromocion/ Cribado/cribadoCancer.htm
136. Guía de práctica clínica sobre los Tumores no definitorios de sida e infección por el VIH, 2019. Consultado en https://gesida-seimc.org/wp-content/uploads/2019/05/gesida_ pdf
137. Shiels MS, Cole SR, Kirk GD, Poole C. A meta-analysis of the incidence of non-AIDS cancers in HIV-infected J Acquir Immune Defic Syndr. 2009;52(5):611-22.
138. Silverberg MJ, Lau B, Justice AC, et Risk of anal cancer in HIV-infected and HIV- uninfected individuals in North America. Clin Infect Dis. 2012;54(7):1026-34.
139. Sigel K, Dubrow R, Silverberg M, et Cancer screening in patients infected with HIV. Curr HIV/AIDS Rep. 2011;8(3):142-52.
140. Sahasrabuddhe VV, Shiels MS, McGlynn KA, Engels EA. The risk of hepatocellular carcinoma among individuals with acquired immunodeficiency syndrome in the United Cancer. 2012;118(24):6226-33.
141. Berenguer J, Jarrín I, Pérez-Latorre L, et al. et al. Human Immunodeficiency Virus/ Hepatits C Virus Coinfection in Spain: Elimination Is Feasible, but the Burden of Residual Cirrhosis Will Be Open Forum Infect Dis. 2018;5(1):ofx258.
142. Dyer JG, McGuinness Reducing HIV risk among people with serious mental illness. J Psychosoc Nurs Ment Health Serv. 2008 Apr;46(4):26-34. PMID: 18478806.
143. Brandt R. The mental health of people living with HIV/AIDS in Africa: a systematic review. African Journal of AIDS 2009; 8:2,123-133. DOI: 10.2989/AJAR.2009.8.2.1.853.
144. Documento de consenso sobre el manejo clínico de la comorbilidad neuropsiquiátrica y cognitiva asociada a la infección por VIH-1. Panel de expertos del grupo de estudios de SIDA (GeSIDA). Version 0.-junio de 2020.
145. Guaraldi G, Palella Clinical implications of aging with HIV infection perspectives and the future medical care agenda. AIDS. 2017 Jun 1;31 Suppl 2:S129-S135.
146. Beer L, Tie Y, Padilla M, Shouse RL. Generalized anxiety disorders among persons with Diagnossed HIV in the United States-2015-2016, Medical Monitoring AIDS 2019; 33 (11) 1781-1787).
147. Gallego L, Barreiro P, Lopéz-Ibor J Diagnosis and Clinical Features of Major Neuropsychiatric Disorders in HIV Infection. AIDS reviews. 2011; 3(3):171-9
148. Thompson MA, Horberg MA, Agwu AL, et al. Primary Care Guidance for Persons With Human Immunodeficiency Virus: 2020 Update by the HIV Medicine Association of the Infectious Diseases Society of America, Clinical Infectious Diseases, 2020; ciaa1391, doi: 1093/cid/ciaa1391.
149. Zigmond AS, Snaith RP. The hospital anxiety and depression scale. Acta Psychiatr 1983 Jun; 67(6):361-70. doi: 10.1111/j.1600-0447.1983.tb09716.x. PMID: 6880820.
150. Mandelbrot L, Tubiana R, Le Chenadec J, et al. No perinatal HIV-1 transmission from women with effective antiretroviral therapy starting before conception. Clin Infect Dis 2015;61:1715-25.
151. Vigilancia epidemiológica del VIH y SIDA en España 2019. En: https://www.mscbs. es/ciudadanos/enfLesiones/enfTransmisibles/sida/vigilancia/Informe_VIH_ SIDA_20201130.pdf. [Acceso enero 2021].
152. Recommendations for the use of antiretroviral drugs in pregnant women with HIV infection and interventions to reduce perinatal HIV transmission in the United States. Department of health and human services. In https://clinicalinfo.hiv.gov/en/guidelines/ perinatal/whats-new-guidelines. [acceso enero 2021].
153. Documento de consenso para le seguimiento de la infección por VIH en relación con la reproducción, embarazo, parto y profilaxis de la transmisión vertical en el niño Marzo 2018. En http://gesida-seimc.org/wp-content/uploads/2018/05/gesida_ VIH_embarazo.pdf (acceso 8 enero 2021).
154. Birkhead G, Pulver W, Warren B, et al. Acquiring human immunodeficiency virus during pregnancy and mother-to-child transmission in New York: 2002-2006. Obstet Gynecol 2010;115(6):1247-1255
155. Grupo de trabajo de la Guía de práctica clínica de atención en el embarazo y Guía de práctica clínica de atención en el embarazo y puerperio. Ministerio de Sanidad, Servicios Sociales e Igualdad. Agencia de Evaluación de Tecnologías Sanitarias de Andalucía; 2014.. Guías de Práctica Clínica en el SNS: AETSA 2011/10. En:https://www. mscbs.gob.es/organizacion/sns/planCalidadSNS/pdf/Guia_practica_AEP.pdf
156. Baza MB, Jeronimo A, Rio I, et al. Natural conception is safe for HIV-serodiscordant couples with persistent suppressive antiretroviral therapy for the infected J Womens Health. 2019;28(11):1555-1562.
157. Bhatt SJ, Douglas N. Undetectable equals untransmittable (U = U): implications for preconception counseling for human immunodeficiency virus serodiscordant couples. Am J Obstet 2020;222(1):53 e51-53 e54
158. López García-Franco A, Baeyens Fernández JA, Bailón Muñoz E et al. Actividades preventivas en la atención a la mujer. Actualización PAPPS 2020. Atención Primaria 2020;52(S2):125-148. En https://www.elsevier.es/es-revista-atencion-primaria-27-articulo- actividades-preventivas-mujer-actualizacion-papps-S0212656718303664 (acceso enero 2021).
159. Documento de consenso de GeSIDA/Plan Nacional sobre el SIDA respecto al tratamiento antirretroviral en adultos infectados por el virus de la inmunodeficiencia humana (Julio 2020). En http://gesida-seimc.org/category/guias-clinicas/antirretroviral-vigentes (acceso 8 Enero 2021).
160. Townsend CL, Byrne L, Cortina-Borja M, et Earlier initiation of ART and further decline in mother-to-child HIV transmission rates, 2000-2011. AIDS 2014;28:1049-57.
161. Gilleece Y, Tariq S, Bamford A, et al. British HIV Association guidelines for the management of HIV in pregnancy and postpartum HIV Med 2019; Sup 3:S2-S85.
162. Flynn P, Taha T, Cababasay M, et al; PROMISE Stufy Team. Prevention of HIV-1 transmission through breastfeeding: Efficacy and Safety of maternal antiretroviral therapy versus infant nevirapine prophylaxis for duration of breastfeeding in HIV-1 infected women with high CD4 cell count (IMPAACT PROMISE): A randomized, open-label, clinical J Acquir Immune Defic Syndr 2018;77:383-92.
163. Documento de consenso para le seguimiento de la infección por VIH en relación con la reproducción, embarazo, parto y profilaxis de la transmisión vertical en el niño Marzo 2018. En http://gesida-seimc.org/wp-content/uploads/2018/05/gesida_ VIH_embarazo.pdf (acceso julio 2021).
164. López García-Franco A, Baeyens Fernández JA, Bailón Muñoz E et al. Actividades preventivas en la atención a la mujer. Actualización PAPPS 2020. Atención Primaria 2020;52(S2):125-148. En https://www.elsevier.es/es-revista-atencion-primaria-27-articulo- actividades-preventivas-mujer-actualizacion-papps-S0212656718303664(acceso febrero 2021).
165. Wilkinson, , Nonoxynol-9 fails to prevents STDs, but microbicide research continues. Lancet, 2002. 360(9338): p. 962-3.
166. Ficha técnica de Esmya 5 mg comprimidos (acetato de ulipristal). disponible en: https://www.ema.europa.eu/en/documents/product-information/esmya-epar-product- pdf (consultada en febrero 2021).
167. WHO, Medical eligibility criteria for contraceptive use. 5th Edition ed, ed. W.L.C.-i.-P. 2015.
168. Bull L, Tittle V, Rashid T et HIV and the menopause: A review. Post Rep Health 2018; 24 (1):19-25.
169. Grupo de expertos de la Secretaría del Plan Nacional sobre el Sida (SPNS),Grupo de Estudio de Sida (GeSIDA). Sociedad Española de Ginecología y Obstetricia (SEGO). Sociedad Española de Infectología Pediátrica (SEIP). Ministerio de Sanidad. Documento de consenso sobre la Asistencia en el ámbito sanitario a las mujeres con infección por el Actualización julio 2020.
170. Howells P, Modarres M, Samuel M, et al. Experience of hormone replacement therapy in postmenopausal women living with Post Reproductive Health. 2019;25(2):80-85.
171. Erlandson KM, Lake JE, Sim M, et al. Bone Mineral Density Declines Twice as Quickly Among HIV-Infected Women Compared With J Acquir Immune Defic Syndr. 2018;77(3):288-94.
172. Documento de consenso sobre la osteoporosis en la infección por el VIH. Mayo En https://gesida-seimc.org/documento-de-consenso-sobre-la-osteoporosis-en-la- infeccion-por-el-vih-mayo-2016/
173. Scott-Sheldon LAJ, Carey KB, Johnson BT, et al. Behavioral Interventions Targeting Alcohol Use among People Living with HIV/AIDS: A Systematic Review and Meta-Analysis. AIDS 2017 Nov; 21(Suppl 2): 126–143.
174. Thompson MA, Horberg MA, Agwu AL, et al. Primary Care Guidance for Persons With Human Immunodeficiency Virus: 2020 Update by the HIV
Medicine Association of the Infectious Diseases Society of America.
175. Córdoba García R, Camarelles Guillem F, Muñoz Seco E, et al. Recomendaciones sobre el estilo de Actualización PAPPS 2020. Atención Primaria 2020;52(S2):32-43. En https://www.elsevier.es/es-revista-atencion-primaria-27-pdf-S0212656720302869
176. Documento de consenso sobre las alteraciones psiquiáticas y psicológicas en adultos y niños con infección por el (Actualización febrero 2015). GeSIDA 2015.
177. European Aids Clinical Society Guidelines. Version 10.1. October 2020.
178. Harrison JD, Dochney JA, Blazekovic S, et al. The nature and consequences of cognitive deficits among tobacco smokers with HIV: a comparison to tobacco smokers without HIVJ 2017 Aug;23(4):550-557.
179. Fernández-Dávila P. “Sesión de sexo, morbo y vicio”: una aproximación holística para entender la aparición del fenómeno Chemsex entre hombres gais, bisexuales y otros hombres que tienen sexo con hombres en España. Revista Multidisciplinar del Sida. 2016; 4(7): 41-65.
180. Dolengevich-Segal H, Rodríguez-Salgado B, Ballesteros-López J, Molina-Prado R. An emergent phenomenon. Carta al editor. Adicciones vol. 29, nº3. 2017.
181. Grupo de Trabajo de Chemsex del Plan Nacional Sobre el Informe sobre Chemsex en España. Dirección General de Salud Pública, Calidad e Innovación. Septiembre 2019.
182. Dolengevich-Segal H, Gonzalez-Baeza A, Valencia J, et al. U-SEX GESIDA 9416 Drug-related and psychopathological symptoms in HIV-positive men who have sex with men who inject drugs during sex (slamsex): Data from the U-SEX GESIDA 9416 Study. PLoS One. 2019 Dec 4;14(12):e0220272.
183. Coll J, Fumaz Drogas recreativas y sexo en hombres que tienen sexo con hombres: Chemsex. Riesgos, problemas de salud asociados a su consumo, factores emocionales y estrategias de intervención. Rev. Enf. Emerg 2016; 15(2): 77- 84.
184. Pufall EL, Kall M, Shahmanesh M, Nardone A, et . Sexualized drug use ('chemsex') and high-risk sexual behaviours in HIV-positive men who have sex with men. HIV Med. 2018 Apr;19(4):261-270. doi: 10.1111/hiv.12574. Epub 2018 Jan 24.
185. Garin N, Zurita B, Velasco C. Impacto clínico del chemsex en las personas con VIH. Revista Multidisciplinar del MONOGRÁFICO 2017. Vol. 5 Núm 11. Julio 2017.
186. Documento técnico sobre abordaje del fenómeno del chemsex. Secretaría del Plan Nacional sobre el Ministerio de Sanidad. 2020.
187. Pérez Valero I, Iniesta Mármol C, González Baeza A, et al. Recomendaciones de expertos para la mejora del manejo del abordaje integral del fenómeno del chemsex en España. Merck Sharp & Dohme de España A.;2020.
4. ASPECTOS SOCIALES
4.1. Principales condicionantes sociales de vulnerabilidad. Las Organizaciones no Gubernamentales (ONG) y otros recursos
4.2. Calidad de vida. Condicionantes y su evaluación
4.3. Aspectos legales y éticos
Principales condicionantes sociales de vulnerabilidad. Las Organizaciones no Gubernamentales (ONG) y otros recursos
Autores: Aldana Menéndez, Arantxa Cabezas Pulgarín, Joseba Portu
Revisores: Gaspar Alonso, Beatriz Rodríguez
El objetivo de este capítulo es analizar el impacto negativo de los condicionantes sociales, promover un cambio en la percepción social sobre el VIH y garantizar el acceso igualitario a los servicios, recursos y prestaciones.
La exclusión social relacionada con la epidemia del VIH precisa que el diseño de estrategias de intervención considere la relación entre los determinantes sociales de la salud y el riesgo de infección por el VIH1.
Los condicionantes sociales hacen referencia a situaciones que atraviesan y afectan la vida cotidiana. Tal como establece la OMS, estas circunstancias son el resultado de la distribución del dinero, el poder y los recursos2, y de su intersección con el VIH. Las desigualdades sociales, la marginalidad y vulnerabilidad provocan que vivir con el VIH sea aún más difícil por cuestión de género, privación de libertad, consumo de drogas, edad, estado migratorio, clase social, diversidad funcional (discapacidad cognitiva y física) entre otras, generando situaciones de estigma, discriminación y vulnerando derechos.
Las estrategias de detección, prevención y atención en el ámbito del VIH han de tener en cuenta la desigualdad estructural de partida3. Resulta evidente la desigualdad de género frente al VIH4 y la necesidad de incorporar la perspectiva de género a fin de adaptar las medidas pertinentes. Las mujeres con el VIH reciben una atención basada en un sistema patriarcal y una medicina androcéntrica que históricamente ha invisibilizado sus necesidades en la atención sanitaria5. Los mandatos de género y las normas socioculturales repercuten en el comportamiento sexual, así como en la atención en el ámbito de la salud sexual6.
Otros grupos vulnerables7 que se ven afectados por condicionantes sociales son la comunidad LGTBI+, que precisan medidas como la promoción del diagnóstico precoz, desde centros comunitarios dirigidos a HGBHSH y mujeres trans*8; las personas que se inyectan drogas y/o con consumo problemático, cargan con el doble estigma relacionado con el VIH y el consumo de drogas; la población migrante, racializada y/o en situación administrativa irregular, en muchas ocasiones suman el verse afectadas por el racismo, la xenofobia, y la inequidad territorial en la atención que reciben.
Resulta primordial tener en cuenta el entorno social, un claro ejemplo es el análisis de la situación de las PVIH en el contexto de la COVID-199. Y no podemos olvidar a las personas con discapacidad física y psíquica.
En el abordaje del VIH es importante una estrecha colaboración entre la Administración y las ONG, ya que ha demostrado su repercusión en la calidad, equidad de las políticas y acciones, así como en su eficiencia10.
Las entidades comunitarias ofrecen proximidad en la intervención, una comprensión holística de las problemáticas sociales y la capacidad de dar respuestas a las necesidades emergentes y cambiantes. En este sentido, resultan primordiales las estrategias de intervención socio-comunitarias que se detallan a continuación. Ver Tabla 1.
RECOMENDACIONES
- Incorporar el enfoque de género y tener en cuenta todas las diversidades (sexual, de género, clase, funcional, cognitiva, etaria y cultural), así como los factores estructurales en intersección con la salud y el VIH, teniéndolos en cuenta en la elaboración de la historia clínica y en la atención sanitaria. (A-II)111213
- Adaptar las intervenciones a las particularidades de las PVIH vulnerables y vulneradas, mejorando la interacción entre los servicios socio-comunitarios y la AP/AH. (B-II)14
Calidad de vida. Condicionantes y su evaluación
Autores: María Jose Fuster, Alejandra Gimeno
Revisores: María José Galindo, Beatriz Rodríguez
Los objetivos para los cuidados y tratamiento de las PVIH han ido cambiando a lo largo de los años en función de los avances y las necesidades. Un importante reto actual es que las PVIH lleven una vida saludable que garantice su salud a largo plazo15. Por ello, se propuso un objetivo adicional a la estrategia 90-90-90 de ONUSIDA. A ese objetivo se le llamó “el Cuarto 90” y su significado conlleva mejorar la calidad de vida relacionada con la salud (CVRS) y la salud a largo plazo de las personas con el VIH16.
La CVRS es un concepto multidimensional que hace referencia al impacto de la salud en la percepción individual del bienestar y el funcionamiento en áreas importantes de la vida17. En ella influyen factores sociodemográficos, clínicos, conductuales, y psicosociales18.
Los determinantes sociodemográficos son diversos18. Entre ellos se encuentra el sexo, siendo las mujeres quienes refieren peor CVRS. El nivel de estudios y el estado civil también se asocian y además predicen longitudinalmente la mejora de algunas dimensiones de la CVRS, como el funcionamiento social y la energía. Además, la situación socioeconómica se halla entre los predictores más relevantes de la CVRS, siendo el área más deteriorada en un estudio realizado en España con una muestra amplia de PVIH19.
Respecto a los determinantes relacionados con la infección, existe evidencia de que los marcadores clínicos y las comorbilidades se asocian y predicen la CVRS18. Además, existen condiciones médicas que pueden deteriorarla más que las comorbilidades específicas, como el dolor, los problemas de sueño, los problemas de salud mental, o la fragilidad. Condiciones que, además, influyen negativamente en la supervivencia y en otros indicadores de morbilidad20.
Entre los determinantes conductuales es necesario resaltar el consumo de sustancias, como el tabaco, el alcohol o el uso problemático de drogas. La adherencia al TAR muestra también asociaciones positivas importantes con la CVRS18.
Muchos de los síntomas y condiciones médicas que deterioran la CVRS se relacionan con problemas psicosociales asociados al VIH. El estigma tiene un papel destacado entre ellos21. También existe una alta prevalencia de problemas de salud mental, como ansiedad y depresión, que además es mayor que en personas con otras enfermedades crónicas y que en población general. Estos problemas conducen a menor apoyo social, variable que se relaciona con mejor salud física y mental18.
En España, siguiendo el patrón de otros países que usaron el mismo cuestionario de CVRS, las puntuaciones más bajas se hallan en la dimensión espiritual, que mide preocupaciones relacionadas con el proceso de la infección como el estigma, la preocupación por el futuro y la muerte; en la dimensión de las relaciones sociales, y en la de salud psicológica19.
Varios trabajos apuntan hacia la esencialidad que puede tener identificar los problemas que afectan a la CVRS de las PVIH. No solamente los marcadores de salud física influyen en la CVRS, también tener una mala CVRS puede influir en una peor evolución de la salud. Estudios longitudinales han hallado que las puntuaciones bajas en CVRS predecían menor supervivencia, mayor tasa de hospitalizaciones y otros indicadores de morbilidad22.
Sin embargo, existen pocas guías que ayuden a evaluar y mejorar la CVRS15. La raíz del concepto es la definición de salud de la OMS y por ello muchos instrumentos que la miden incluyen al menos las tres dimensiones de dicha definición, es decir, la salud física, la psicológica y el ámbito social17. No obstante, hay instrumentos que añaden otras dimensiones. Existen dos grandes clases de cuestionarios para medir la CVRS: genéricos y específicos. Los genéricos disponen de datos normativos que permiten comparaciones con otros grupos. Además, algunos permiten obtener medidas de utilidad como los años de vida ajustados por calidad que pueden ser útiles para guiar decisiones clínicas y evaluar los servicios sanitarios. Los específicos miden aspectos concretos del problema de salud al que hacen referencia. Además, son más sensibles a los cambios en la enfermedad o el tratamiento. Utilizar unos u otros depende de los objetivos para los que se use23. Existen diversos cuestionarios útiles en función del propósito. Cooper et al.23, realizan una revisión de cuestionarios cortos genéricos y específicos para medir la CVRS, y concluyen que el EQ-5D-5L es uno de los instrumentos genéricos más usados. Entre los específicos destaca el valor de instrumentos como el PROQOL o el WHOQOL-HIV-BREF, existiendo de este último, validación en castellano21. La Tabla 2 muestra algunos de los cuestionarios de CVRS más utilizados.
Medir la CVRS en la práctica clínica puede ser de gran utilidad para mejorar la salud a largo plazo y la eficiencia de los cuidados, ayudando a detectar, priorizar e intervenir sobre problemas modificables, así como a evaluar la eficacia de las distintas intervenciones y mejorar la comunicación con el paciente24.
RECOMENDACIONES
- Se debe evaluar la CVRS en las PVIH, para individualizar y mejorar la asistencia sanitaria (B-II).
- Habitualmente es en AH donde concurren las circunstancias más favorables para evaluar la CVRS de las PVIH, pero dada la relevancia de esta información y su repercusión sobre otros aspectos de salud, sus resultados deben ser compartidos con AP (B-III).
- La periodicidad de la evaluación dependerá del paciente y el objetivo establecido. Idealmente se debería registrar la CVRS al inicio del TAR y después anualmente, antes de la consulta de seguimiento en AH (B-III).
- El instrumento utilizado dependerá del objetivo. Para cálculos de coste-eficiencia o para comparar con población general, el EQ-5D-5L es de los más Si se pretende conocer el grado de afectación de las diferentes dimensiones de la CVRS, el WHOQOL- HIV-BREF es un cuestionario factible y con evidencias psicométricas en PVIH en España. (B-III).
Aspectos legales y éticos
Autores: Miguel Ángel Ramiro, Gaspar Alonso
Revisores: Carlos Galera, Josefina Belda
Los derechos a la intimidad personal y a la confidencialidad son claves en la atención sanitaria de las personas con VIH o que se sospecha que pueden tener el VIH38, especialmente cuando existe responsabilidad multiprofesional o se hace uso de la telemedicina39. Debe garantizarse la intimidad y confidencialidad en el proceso de información y en la recogida de resultados. Esta garantía incentiva la búsqueda de asistencia sanitaria, la adherencia al TAR, o la realización de pruebas de detección40 La intimidad y confidencialidad evitan la discriminación en el ámbito sanitario41.
Sólo se informará al titular de la información clínica, que es la PVIH. Terceras personas con vinculación familiar o de hecho sólo serán informadas si la PVIH consiente de forma expresa o tácita. Cuando la PVIH entra acompañado a consulta debe advertírsele que está consintiendo tácitamente que el/la acompañante sea informado.
En la historia clínica la referencia al VIH es insoslayable, pero en los informes médicos no específicos de VIH no sería necesaria, así mismo en los certificados médicos atendiendo al principio de minimización42, bastaría con señalar que el estado de salud no supone un impedimento para realizar la actividad o el puesto de trabajo43.
Si la PVIH es migrante, la intervención del intérprete o mediador cultural es crucial para comunicar un resultado positivo. La población inmigrante puede no revelar su estado serológico por miedo a la deportación. Esta consideración es especialmente importante en mujeres vulnerables.
Las PVIH o con sospecha de poder estar infectados por el VIH, con 16 o 17 años deben ser tratadas como mayores de edad: son titulares de la información y pueden consentir. Mientras que en los que tienen 14 o 15 años, dependerá de si el profesional sanitario considera que es maduro o no. No obstante, quienes ostenten la patria potestad pueden acceder a la historia clínica44 y participar en el proceso de decisión si, según el criterio del facultativo, se trata de una actuación de grave riesgo para la vida o salud45.
Las personas con discapacidad tienen derecho a que la información esté en formatos adecuados para que resulte accesible y comprensible46.
Los derechos a la intimidad y confidencialidad pueden limitarse para prevenir daños a terceras personas, tal y como reconoce el código de Deontología médica47. El médico está obligado a revelar la información de salud de una persona cuando respetar su intimidad suponga un perjuicio a otras personas o un peligro colectivo. Antes de revelar la información, se debería ofrecer apoyo a la PVIH para que, mientras no haya logrado alcanzar la indetectabilidad de la carga viral, o utilice adecuadamente medidas que eviten la transmisión, sea ella, o el personal sanitario con su consentimiento expreso quien comunique su estado serológico48. En caso contrario, al tratarse de un posible delito de lesiones, y por tanto considerado delito público, se deberá poner en conocimiento en la Fiscalía o el Juzgado de Instrucción49. Antes de llegar a este límite se deben utilizar todas las estrategias posibles para evitar judicializar el proceso de atención médica.
RECOMENDACIONES
- Los centros de atención sanitaria, tanto de AP como de AH, deben asegurar que la realización de la prueba de detección del VIH y la comunicación de los resultados sean (A-I)
- Debería incrementarse la formación del personal sanitario y administrativo involucrado en la atención de las PVIH en temas de intimidad y confidencialidad en todos los rangos de edad, atendiendo a las cuestiones de impacto de género, discapacidad y extranjería. (A-III)
Tablas:
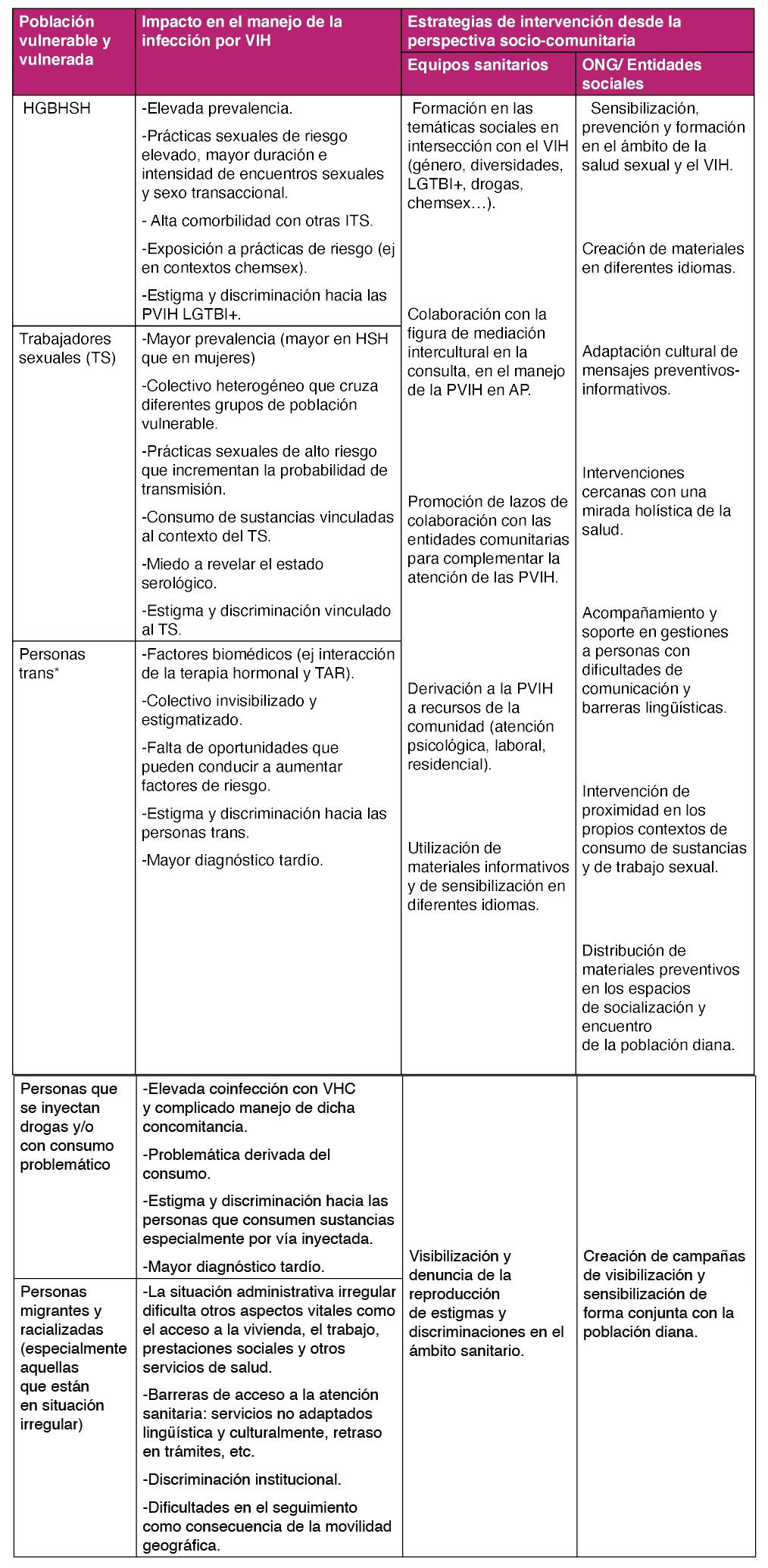
Elaboración propia
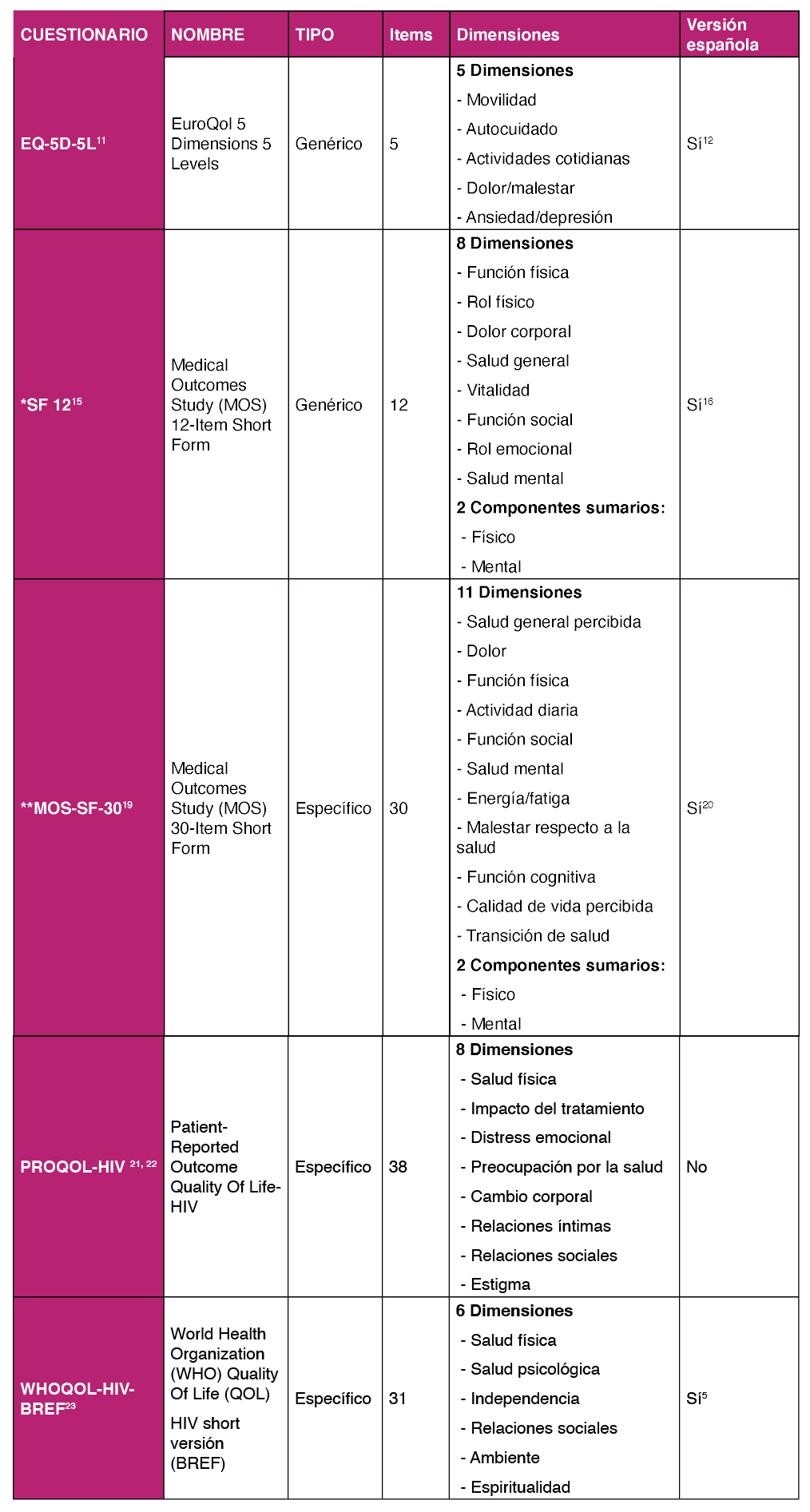
Tabla de elaboración propia
- Existe una versión larga con 36 items, genérico (Medical Outcomes Study (MOS) 36-Item )13 y versión española14
** Existe una versión larga con 35 items, específico (Medical Outcomes Study (MOS)17 HIV y versión española18
Bibliografía:
Ministerio de Sanidad y Consumo. Plan multisectorial frente a la infección por VIH y el Sida 2008-2012. Secretaria de Plan Nacional del Madrid. p 16, 2007. Disponible en: https://www.mscbs.gob.es/ciudadanos/enfLesiones/enfTransmisibles/sida/docs/PMS200812. pdf
Comisión sobre los condicionantes sociales de la salud. Subsanar las desigualdades de una generación. Alcanzar la equidad sanitaria actuando sobre los determinantes sociales de la salud. p 2, 2008. Disponible en: https://apps.who.int/iris/bitstream/ handle/10665/69830/WHO_IER_CSDH_08.1_spa.pdf?sequence=1&isAllowed=y
Whiteside A, Barnett T. AIDS in the Twenty-First Century: Disease and Globalization. First ed 2002. Basingstoke [England]; New York: Palgrave Macmillan, 2006. ISBN: 978- 0-230-59920-8. Disponible en: https://link.springer.com/content/pdf/bfm%3A978-0-230- 59920-8%2F1.pdf
García-Sánchez I. Diferencias de género en el VIH/sida. Escuela Andaluza de Salud Pública. Red de Investigación de Salud y Género. España, 2004. Disponible en: https:// isciii.es/scielo.php?script=sci_arttext&pid=S0213-91112004000500007
Valls Llobet C. Mujeres Invisibles. Editorial de Bolsillo. España, 2006. ISBN: 978- 8497934152
The UNGASS. Vulnerability and Resilience: Gender and HIV/AIDS in Latin America and the International Centre for Research on Women. Washington, D.C, 2002. Disponible en: https://healtheducationresources.unesco.org/sites/default/files/resources/ GenderandHIV.pdf
Morán Arribas M, Rivero A, Fernández E, et al. Magnitud de la infección por VIH, poblaciones vulnerables y barreras de acceso a la atención sanitaria. Enfermedades Infecciosas y Microbiología Clínica. España, 2018. Disponible en: https://www.elsevier. es/es-revista-enfermedades-infecciosas-microbiologia-clinica-28-articulo-magnitud- infeccion-por-vih-poblaciones-S0213005X18302398
Meulbroek M, Dalmau-Bueno A, Saz J, et al. Falling HIV incidence in a community clinic cohort of men who have sex with men and transgender women in Spain, 2020. Disponible en: https://journals.sagepub.com/doi/10.1177/0956462420932424
López Heras La COVID-19 en les persones infectades pel VIH. EAP 2D Universitat. Barcelona. Institut Català de la Salut. Catalunya, 2020. Disponible en: https://canalsalut. gencat.cat/web/.content/_A-Z/S/sida/infosida/COVID-19-i-VIH.pdf
Plan multisectorial frente a la infección por VIH y el sida 2008-2012. Ministerio de Sanidad y Consumo. Secretaria de Plan Nacional del Sida. Madrid, 2008. Disponible en: https://www.mscbs.gob.es/ciudadanos/enfLesiones/enfTransmisibles/sida/docs/PMS200812. pdf
The Centre for Development and Population Activities (CEDPA). Gender and The CEDPA training annual services. Volume III. Washington DC, 1996. Disponible en: https://www.planusa.org/docs/gender-and-development-manual.pdf
El género y el VIH/Sida. Colección prácticas óptimas del ONUSIDA. Actualización agosto 2000. Disponible en: https://www.unaids.org/sites/default/files/ media_asset/jc459-gender-tu_es_0.pdf
Guía práctica para la integración de la perspectiva de género en los programas de prevención del VIH. Ministerio de Sanidad y Consumo. Secretaria de Plan Nacional del Madrid, 2012. Disponible en: https://www.mscbs.gob.es/ciudadanos/enfLesiones/ enfTransmisibles/sida/docs/guiaPrevencionVIH_Accesible.pdf
Adell H, Fernández E, González E, et al. Ejemplos de buenas prácticas: continuidad asistencial entre hospital terciario y entidad de base comunitaria para la atención de personas con Monográfico ONGs 2019. Vol. 7. Núm. 19. España, 2019. Disponible en: https://www.revistamultidisciplinardelsida.com/ejemplos-de-buenas-practicas-continuidad- asistencial-entre-hospital-terciario-y-entidad-de-base-comunitaria-para-la-atencion-de- personas-con-vih/
Guaraldi G, Arends J, Buhk T, et al. “Moving fourth”: A vision toward achieving healthy living with HIV beyond viral suppression. AIDS Rev. 2019;21(3):135-42.
Lazarus J V, Safreed-Harmon K, Barton SE, et Beyond viral suppression of HIV – the new quality of life frontier. BMC Med. 2016;14(1):94.
Post M. Definitions of Quality of Life : What Has Happened and How to Move On. Top Spinal Cord Inj 2014;20(3):167-80.
Degroote S, Vogelaers D, Vandijck What determines health-related quality of life among people living with HIV: an updated review of the literature. Arch Public Heal. 2014;72(1):1-10.
Fuster-Ruizde Apodaca MJ, Laguía A, Safreed-Harmon K, et al. Assessing quality of life in people with HIV in Spain: psychometric testing of the Spanish version of WHOQOL- HIV-BREF. Health Qual Life 2019;17(1):1-13.
Edelman E., Gordon K, Justice AC. Patient and Provider-Reported Symptoms in the Post-cART AIDS Behav. 2011;15(4):853-61.
Fuster-Ruizde apodaca MJ, Molero F, Gil de Montes L, et al. Evolution of HIV-related stigma in Spain between 2008 and AIDS Care. 2014;26(Sup1):S41-5.
Emuren L, Welles S, Polansky M, et al. Lower health-related quality of life predicts all-cause hospitalization among HIV-infected individuals. Health Qual Life Outcomes. 2018;16(1):107.
Cooper V, Clatworthy J, Harding R, et al. Measuring quality of life among people living with HIV: a systematic review of Health Qual Life Outcomes. 15 de diciembre de 2017;15(1):220.
Kall M, Marcellin F, Harding R, et al. Patient-reported outcomes to enhance person- centred HIV Lancet HIV. 2020;7(1):e59-68.
Herdman M, Gudex C, Lloyd A, et al. Development and preliminary testing of the new five-level version of EQ-5D ( EQ-5D-5L ). Qual Life Res. 2011;20(10):1727-1736.
Ramos-Goñi JM, Craig BM, Oppe M, et al. Handling Data Quality Issues to Estimate the Spanish EQ-5D-5L Value Set Using a Hybrid Interval Regression Approach. Value 2018;21(5):596-604.
Ware J, Sherbourne The MOS 36-item short-form health survey (SF-36). I. Conceptual framework and item selection. Med Care. 1992;30(6):473-483.
Alonso J, Prieto L, Anto La versión española del SF-36 Health Survey (Cuestionario de Salud SF-36): un instrumento para la medida de los resultados clínicos. Med Clin (Barc). 1995;104(20):771-776.
Ware JJ, Kosinski M, Keller S. A 12-Item Short-Form Health Survey: construction of scales and preliminary tests of reliability and Med Care. 1996;34(3):222-233.
Schmidt S, Vilagut G, Garin O, et al. Normas de referencia para el Cuestionario de Salud SF-12 versión 2 basadas en población general de Cataluña. Med Clin (Barc). 2012;139(14):613-625.
Revicki D, Sorensen S, Wu A. Reliability and validity of physical and mental health summary scores from the Medical Outcomes Study HIV Health Med Care. 1998;36(2):126-137.
Badía X, Podzamczer D, López-Lavid C, et al. Medicina basada en la evidencia y la validación de cuestionarios de calidad de vida: la versión española del cuestionario MOS- HIV para la evaluación de la calidad de vida en pacientes infectados por el VIH. Enferm Infecc Microbiol 1999;17(Suppl 2):103-113.
Wu AW, Rubin HR, Mathews WC, et A Health Status Questionnaire Using 30 Items From The Medical Outcomes Study: Preliminary Validation in Persons With Early HIV Infection. Med Care. 1991;29(8):786-798.
Remor E. Fiabilidad y validez de la versión española del cuestionario MOS-SF-30 para evaluar la calidad de vida de personas infectadas por el VIH. Atención Primaria. 2003;32(1):15-22.
Duracinsky M, Lalanne C, Le Coeur S, et Psychometric validation of the PROQOL- HIV questionnaire, a new health-related quality of life instrument-specific to HIV disease. Acquir Immune Defic Syndr. 2012;59(5):506-515.
Duracinsky M, Herrmann S, Berzins B, et al. The development of PROQOL-HIV: an international instrument to assess the health-related quality of life of persons living with HIV/AIDS. J Acquir Immune Defic 2012;59(5):498-505.
O’Connell K, Skevington S. An international quality of life instrument to assess wellbeing in adults who are HIV-positive: a short form of the WHOQOL-HIV (31 items). AIDS 2012;16(2):452-460.
Eliminación de la discriminación en el sector sanitario – Paso fundamental para acabar con la epidemia del sida. 2016. https://www.unaids.org/es/resources/ documents/2016/eliminating-discrimination-in-health-care
Documento de consenso sobre teleconsulta (TC) para personas que viven con infección por VIH (PVVIH). 2020. https://gesida-seimc.org/wp-content/uploads/2020/09/ TELECONSULTA_Guia_GeSIDA.pdf
M Salvadori, GV Confidencialidad médica en la atención del paciente con VIH/ Sida. Revista Bioética. 2019; 27(1): 153-163.
Hacer frente a la discriminación – Superar el estigma y la discriminación relacionados con el VIH en centros de atención de la salud y más allá. 2017. https://www.unaids.org/sites/default/files/media_asset/confronting-discrimination_es.pdf
Reglamento (UE) 2016/679 del Parlamento Europeo y del Consejo, de 27 de abril de 2016, relativo a la protección de las personas físicas en lo que respecta al tratamiento de datos personales y a la libre circulación de estos datos y por el que se deroga la Directiva 95/46/CE. https://www.boe.es/doue/2016/119/L00001-00088.pdf
Organización Médica Declaración sobre las cualidades del certificado médico y sobre sus diferencias con los partes y los informes médicos. Acceso en línea [18 febrero 2021]. https://www.cgcom.es/sites/default/files/070126certificados0.pdf
Agencia Española de Protección de Datos. Informe Jurídico 0114/2008. https://www. es/es/documento/2008-0114.pdf
Ley 41/2002, de 14 de noviembre, básica reguladora de la autonomía del paciente y de derechos y obligaciones en materia de información y documentación clínica. https://www. es/buscar/act.php?id=BOE-A-2002-22188
Real Decreto Legislativo 1/2013, de 29 de noviembre, por el que se aprueba el Texto Refundido de la Ley General de derechos de las personas con discapacidad y de su inclusión social. https://www.boe.es/buscar/act.php?id=BOE-A-2013-12632
Organización Médica Colegial. Código de Deontología Médica. https://www.cgcom. es/sites/default/files/codigo_deontologia_medica.pdf
Thompson MA, Horberg MA, Agwu AL, et al. Primary care guidance for persons with Human Immunodeficiency Virus: 2020 Update by the HIV Medicine Association of the Infectious Diseases Society of America. Clinical Infectious Disease. 2020; doi: 10.1093/ cid/ciaa1391.
Real Decreto de 14 de septiembre de 1882 por el que se aprueba la Ley de Enjuiciamiento https://www.boe.es/buscar/act.php?id=BOE-A-1882-6036
5. DOCENCIA E INVESTIGACIÓN COMPARTIDAS EN LA INFECCIÓN POR VIH
5.1. Docencia bidireccional: formatos, periodicidad y contenidos
5.2. Áreas donde es esencial la investigación compartida
Docencia bidireccional: formatos, periodicidad y contenidos
Autores: Ignacio de los Santos, Ana Díez
Revisores: Xabier Kortajarena, Juanjo Mascort
Diferentes estudios realizados en AP, algunos en nuestro medio, identifican diversas barreras aportadas por los profesionales para incorporar la prueba de cribado del VIH en su práctica diaria: falta de tiempo, necesidades de formación12345, el no estar entrenados en su manejo, la falta de confianza para ofrecer la prueba56, la preocupación sobre el rechazo del paciente y problemas de confidencialidad567. De manera recíproca, los médicos de AH también reconocen limitaciones en el manejo de los protocolos de actuación más habituales en AP, no solo de las comorbilidades y el cuidado de crónicos, sino también los relacionados con la promoción de la salud, vacunaciones y cribado de cánceres. Los profesionales de las unidades especializadas en la atención a personas con VIH, que conocen bien estos aspectos, deben colaborar con docencia, y atención compartida en AP, a incorporar las peculiaridades de las personas que viven con VIH.
Una buena comunicación y coordinación entre AP y AH, con un objetivo común centrado en el paciente, un adecuado entrenamiento de los profesionales de la salud y la elaboración de unos protocolos que contemplen las principales opciones de cuidados, son fundamentales para resolver esas barreras678. Apoyar el acceso a una atención de calidad para los pacientes con infección por el VIH se considera importante tanto para mantener la equidad en la atención médica, como para prevenir los excesivos costes de personal y del sistema por una atención y tratamiento inadecuados del VIH9101112, en especial a los que presentan diagnóstico tardío11.
Las diferentes vías por las que los profesionales de AP y AH pueden ser formados o apoyados para entrar en ese sistema de cuidados requiere una considerable atención y flexibilidad. La participación de los MAP en la atención del paciente VIH y el apoyo que deben recibir debe tener en cuenta las diferentes necesidades de los profesionales según el número de casos de PVIH que atienden10.
Por lo tanto, habría tres situaciones diferentes y complementarias dentro de la formación docente, que deberían recibir los profesionales de AP: la prevención, el diagnóstico precoz11 y la atención a pacientes diagnosticados. Y como hablamos de bidireccionalidad, habría que dar a conocer a los profesionales hospitalarios los protocolos más utilizados en AP: atención a la cronicidad, promoción de la salud, vacunaciones y cribado de cánceres, entre otros. En la Tabla 1 se resumen los principales contenidos de cada bloque.
Se han explorado diferentes formatos para impartir la docencia, desde sesiones presenciales hasta teleconferencias y cursos online7, cada uno con sus ventajas y sus inconvenientes, que pueden ser de aplicación individual o conjunta dependiendo de la situación8.
En algunos entornos geográficos se han puesto en marcha proyectos piloto para identificar nuevas formas de impartir docencia que incluyen el “emparejamiento” del MAP con experiencia en la atención al paciente VIH y sin ella, como una forma distinta de "atención compartida"10. También puede estar justificado identificar a un MAP que se convierta en el “referente en VIH/ITS” para gestionar de forma proactiva la formación y compartir conocimientos con sus compañeros13. Sería algo similar al “emparejamiento” pero tendría bajo su paraguas a más médicos y no exigiría tantos MAP con experiencia en la atención al paciente VIH. En estos casos la formación de los médicos “referentes” podría complementarse con estancias formativas en las consultas de VIH y de ITS de los centros hospitalarios y en los centros de dispensación de PrEP.
Hay que destacar el papel fundamental que las sociedades científicas tienen en la formación y que habría que potenciar estableciendo sinergias entre ellas. Hay experiencias de actividades formativas exitosas (presenciales y on-line), promovidas por las sociedades científicas de medicina de familia y comunitaria, así como actividades de formación compartida con grupos de trabajo especializados en la atención al VIH y en el marco de jornadas o congresos organizados por las Sociedades Científicas14.
Como se observa, los contenidos de la formación pueden ser muy amplios y siempre deben tener en cuenta las características de los profesionales a los que van dirigidos. También puede ser diferente el formato en el que se imparte, dependiendo del momento y del número de profesionales a formar. La posibilidad de hacer formación online probablemente flexibiliza horarios y es más fácil adaptarse tanto para impartir como para recibir.
Por lo tanto, proponemos crear un grupo de trabajo entre AH y AP que defina los contenidos concretos, a quienes deben ir dirigidos y quienes deben ser los formadores y acordar el formato más adecuado, dependiendo de los objetivos que se quieran alcanzar11.
RECOMENDACIONES
- Los distintos profesionales de AP y AH deben pactar la realización de sesiones docentes periódicas encaminadas a generar conocimientos comunes en relación con la identificación del riesgo, el cribado y el manejo de la infección por el VIH y sus comorbilidades (A-II). Para favorecer la participación se deben buscar formatos en red y con horario flexible (B-III).
- Los responsables sanitarios deben favorecer y estimular el desarrollo de sesiones conjuntas entre los diferentes niveles asistenciales, en relación con la atención compartida de las personas con infección por el VIH, y también en aquellas con riesgo de adquirirla (A-III).
Áreas donde es esencial la investigación compartida
Autores: Pablo Ryan, Juanjo Mascort
Revisores: Rafael Rubio, Ana Díez
Parte de la investigación en el VIH debe reorientarse hacia el entorno de la AP, y potenciar la investigación compartida entre AP y AH. El uso generalizado del TAR eficaz en la población infectada por el VIH ha mejorado la esperanza de vida de los pacientes con esta infección y ha cambiado el manejo de la enfermedad15 llevándolo a un entorno extrahospitalario donde cobran mayor importancia la prevención primaria y el manejo de comorbilidades relacionadas con la edad. En este apartado se detallan las áreas dónde son esenciales la investigación compartida entre AP y AH Tabla 2.
1) Cribado del VIH
Es importante promover el diagnóstico precoz del VIH en AP para disminuir el número de personas con infección no diagnosticada16. En este sentido, es una prioridad promover la investigación conjunta entre AP, AH y el Servicio de Microbiología, con el fin de encontrar nuevas formas o estrategias de cribado del VIH17 como, por ejemplo: la utilización de nuevas técnicas diagnósticas o tecnologías de la información, la selección de candidatos mediante cuestionarios de conductas de riesgo y condiciones indicadoras o el uso de sistemas de alertas en historias electrónicas.
2) Vinculación a los cuidados
Es necesario y debe ser prioritario investigar qué circuitos de derivación y comunicación bidireccionales entre AP y AH son los más ágiles, resolutivos y eficientes para implementar estrategias de cribado y tratamiento rápido integrados, o poder manejar de forma adecuada las comorbilidades y las interacciones18. Esta área de investigación sigue siendo una asignatura pendiente y sería interesante incluir otras formas de comunicación entre profesionales como por ejemplo la telemática o la “econsulta”.
3) Prevención y diagnóstico
El papel de AP en el campo de la prevención y el diagnóstico de factores de riesgo y enfermedades que son más prevalentes en las personas que viven con el VIH es fundamental para el manejo conjunto. Este manejo compartido abre nuevas vías de investigación y formación en este terreno. Las ITS, son frecuentes en los pacientes con infección por el VIH y cada vez es más frecuente que las manejen los MAP. Aparte de las estrategias de prevención primaria, educación sanitaria, uso del preservativo o PrEP, en la actualidad se están investigando nuevas estrategias terapéuticas en AP, siendo este un campo que requiere potenciarse y realizarlo de forma multidisciplinar19. Complementar la investigación y la formación, con el desarrollo y la implementación de protocolos de atención compartida para estandarizar el manejo, contribuye a homogeneizar la atención en este campo.
4) Envejecimiento y manejo de comorbilidades
Los profesionales de AP tienen experiencia en el manejo integral de personas mayores y de las comorbilidades propias de la edad. La valoración integral de un paciente con infección por el VIH en AP se ocupa de forma estructurada de la evaluación de la capacidad funcional, la salud física, mental y cognitiva, además de las circunstancias sociales y ambientales. Investigar qué estrategias interdisciplinares y protocolos de aplicación conjunta actualizados son más eficaces y eficientes para la mejora del manejo de las comorbilidades de la población con VIH debe ser prioritario20.
5) Adherencia al tratamiento, interacciones y polifarmacia
Es necesario disponer de estrategias multidisciplinares para la mejora de la adherencia, basadas en la monitorización, la motivación y la educación a los pacientes, incluyendo el uso de nuevas tecnologías en aquellos con destrezas digitales, así como la disminución de la complejidad del tratamiento21.
El reto trasciende el control de la infección y se centra en el correcto abordaje de estos pacientes complejos que tienen múltiples comorbilidades y una alta prevalencia de polifarmacia22.
Aunque los tratamientos, hoy en día, son menos complejos y presentan menos interacciones que hace años, es necesario encontrar sistemas que alerten a los médicos de AP y AH de posibles interacciones, ante una nueva prescripción, y que se concilien las medicaciones de los diferentes prescriptores. Los escenarios de optimización de la farmacoterapia y de desprescripción en la población general se deben centrar, en especial en personas polimedicadas, ancianas con fármacos que producen efectos adversos, principios activos duplicados e interacciones entre los distintos fármacos23. Es esencial investigar métodos de desprescripción coordinada entre AP y AH.
6) Estado de salud y calidad de Vida
La investigación cada vez se centra más en el paciente, y en conocer su estado de salud y su calidad de vida. Para ello, se utilizan instrumentos validados y que completan los propios pacientes, como son los PROs, que son capaces de captar las opiniones, sentimientos y experiencias, y valorar y medir los cambios en el estado de salud o bienestar24. Estos instrumentos se utilizan con mayor frecuencia en la investigación de nuevos tratamientos y tecnologías, lo que se traduce en una investigación de calidad, centrada en el paciente, que permite formar y conocer los autocuidados, así como evaluar el rendimiento de los sistemas sanitarios. Evaluar y validar estas herramientas, con la posibilidad de recoger, conocer y aplicar los resultados, en tiempo real, tanto en AP como en AH es un reto para la investigación.
7) Formación
Investigar la forma más eficiente y duradera de formar a los profesionales sanitarios de AP y AH en aspectos relacionados con el cribado del VIH a la población general y en el manejo de las comorbilidades en la población con VIH es un punto clave y existen diferentes formas para vehiculizar esta formación (consultar el capítulo 1 del bloque 4). Es importante implicar a enfermería, tanto de AP como de AH, y a las ONG, así como desarrollar un plan de actuación multidisciplinar, tanto en investigación como en docencia. En todos estos aspectos debe haber una alineación clara entre los profesionales sanitarios, las sociedades científicas y las instituciones sanitarias que promocionen tanto la investigación como la formación.
8) Continuidad asistencial
Resulta imprescindible impulsar y favorecer la investigación compartida entre AP y AH con el objetivo de conocer con mayor profundidad la situación actual del manejo y los circuitos de atención de los pacientes infectados por el VIH y así poder identificar las barreras y dificultades para desarrollar nuevos modelos de atención compartida25. Conocer e integrar a los profesionales de AP en los proyectos comunes, es un primer paso para desarrollar redes y/o grupos de investigación. A través de los servicios de continuidad asistencial y del establecimiento de rutas asistenciales, estas relaciones se pueden consolidar y oficializar dentro de las instituciones implicadas. Las investigaciones realizadas deben tener como objetivo la mejora de la atención de nuestros pacientes y con ello, el desarrollo y la implementación de protocolos de atención compartida para estandarizar los diferentes manejos.
RECOMENDACIONES
- Impulsar la investigación compartida entre los profesionales de AP y AH con la creación de grupos de trabajo multidisciplinar que participen en todas las fases de la investigación en diversas temáticas en relación con la infección por el VIH (B-III).
Tablas:

AH: Asistencia hospitalaria. AP: Atención Primaria, PrEP: profilaxis pre-exposición.
PAPPS: Programa de Actividades Preventivas y Promoción de la Salud.
Bibliografía:
Rai T, Bruton J, Kall M, et al. Experience of primary care for people with HIV: a mixed- method analysis. BJGP 2019 Dec 10;3(4): bjgpopen19X101665.
Prasad R, D'Amico F, Wilson SA, et al. Training family medicine residents in HIV primary care: a national survey of program Fam Med. 2014 Jul-Aug;46(7):527-31.
Burke RC, Sepkowitz KA, Bernstein KT, et al. Why don’t physicians test for HIV? A review of the US AIDS. 2007;21:1617–24.
Busto MJ, García San Miguel L, Castelao ME, et Actitudes y prácticas de los médicos de atención primaria ante el diagnóstico de la infección por virus de la inmunodeficiencia humana. Enferm Infecc Microbiol Clin. 2011;29:490–6.
Agustí C, Fernándeza L, Mascort Enferm Infecc Microbiol Clin. 2013;31(7):451-454.
Martínez Sanz J, Pérez Elías MJ, Muriel A, et Outcome of an HIV education program for primary care providers: Screening and late diagnosis rates. PLoS One. 2019 Jul 2;14(7):e0218380.
Kesten JM, Charlotte F. Davies, et al. Qualitative evaluation of a pilot educational intervention to increase primary care HIV testing. BMC Family Practice 2019; 20:74
Mapp F, Hutchinson J, Estcourt C. A systematic review of contemporary models of shared HIV care and HIV in primary care in high-income settings. Int J STD AIDS. 2015 Dec;26(14):991-7.
Tu D, Belda P, Littlejohn D, et al. Adoption of the chronic care model to improve HIV care: in a marginalized, largely aboriginal Can Fam Physician. 2013 Jun;59(6):650- 7.
Gallant JE, Adimora A, Carmichae JE et al. Essential Components of Effective HIV Care: A Policy Paper of the HIV Medicine Association of the Infectious Diseases Society of America and the Ryan White Medical Providers Coalition. Clinical Infectious Diseases 2011; 53 (11):1043–50.
Rojo A, Arratibel P, Bengoa Descripción del modelo óptimo de atención al paciente con infección por el VIH. Editado por: The Institute for Health and Strategy (SI-Health). ISBN: 978-84-09-06135-8. Julio 2018.
Thompson MA, Horberg MA, Agwu AL, et al. Primary Care Guidance for Persons With Human Immunodeficiency Virus: 2020 Update by the HIV Medicine Association of the Infectious Diseases Society of America. Clin Infect Dis. 2020 Nov 6:ciaa1391. doi: 1093/cid/ciaa1391.
Persson A, Newman CE, Hopwood M, et al. No Ordinary Mainstream Illness: How HIV Doctors Perceive the Qualitative Health Research. 2014;24(1):6-17.
Reunión Nacional. Manejo compartido del paciente VIH entre la atención primaria y la atención hospitalaria Organizada por Gesida/SemFyC. Celebrada el 29/03/2019 en Hospital Ramón y Cajal. Disponible https://gesida-seimc.org/manejo-compartido- del-paciente-vih-entre-la-atencion-primaria-y-la-atencion-hospitalaria/
Teeraananchai S, Kerr SJ, Amin J, Ruxrungtham K, Law MG. Life expectancy of HIV- positive people after starting combination antiretroviral thera-py: a meta-analysis. HIV 2017 Apr;18(4):256–66.
Martínez Sanz J, Pérez Elías MJ. HIV testing in Spain: Are we doing our job? Enferm Infecc Microbiol 2021 Jan;39(1):1–2.
Martínez-Sanz J, Vivancos MJ, Sánchez-Conde M, Gómez-Ayerbe C, Polo L, Labrador C, et al. Hepatitis C and HIV combined screening in primary care: A cluster randomized J Viral Hepat. 2021 Feb;28(2):345–52.
Tso LS, Best J, Beanland R, Doherty M, Lackey M, Ma Q, et Facilitators and barriers in HIV linkage to care interventions: a qualitative evidence review. AIDS Lond Engl. 2016 Jun 19;30(10):1639–53.
Documento GESIDA. Documento de consenso sobre diagnóstico y tratamiento de las infecciones de transmisión sexual en adultos, niños y adolescentes. 2017. Available from: http://gesida-seimc.org/category/guias-clinicas/
Morales Rodriguez K, Khalili J, Trevillyan J, Currier What Is the Best Model for HIV Primary Care? Assessing the Influence of Provider Type on Outcomes of Chronic Comorbidities in HIV Infection. J Infect Dis. 2018 Jun 20;218(2):337–9.
Documento Documento de consenso para mejorar la adherencia a la farmacoterapia en pacientes con infección por el virus de la inmunodeficiencia en tratamiento antirretroviral (Actualización febrero de 2020). 2020. Available from: http:// gesida-seimc.org/category/guias-clinicas/
Cuzin L, Katlama C, Cotte L, Pugliese P, Cheret A, Bernaud C, et Ageing with HIV: do comorbidities and polymedication drive treatment optimization? HIV Med. 2017 Jul;18(6):395–401.
Documento GESIDA. Desprescripción farmacológica de la terapia no antirretroviral en pacientes con infección por VIH (Actualizacion 2018). 2018. Available from: http://gesida- org/category/guias-clinicas/
Edwards TC, Fredericksen RJ, Crane HM, Crane PK, Kitahata MM, Mathews WC, et al. Content validity of Patient-Reported Outcomes Measure-ment Information System (PROMIS) items in the context of HIV clinical care. Qual Life Res Int J Qual Life Asp Treat Care 2016 Feb;25(2):293–302.
Ortega López Á, Morales Asencio JM, Rengel Díaz C, Peñas Cárdenas EM, González Rodríguez MJ, Prado de la Sierra R. Incremento de la participación de Atención Primaria en la asistencia al virus de la inmunodeficiencia humana: opinan los profesionales de las unidades Atención Primaria. 2014 Apr 1;46(4):204–13.
6. Declaración de transparencia (Conflicto de interés)
- José Luis Pérez Quero declara que no presenta ningún conflicto de interés en relación con el presente documento.
José Luis Ramon, declara que no presenta ningún conflicto de interés en relación con el presente documento.
Carolina Mir declara que no presenta ningún conflicto de interés en relación con el presente documento.
Alejandra Jimeno ha recibido financiación para asistencia a congresos, y honorarios por labores de consultoría o ponencias de los laboratorios Gilead Sciences, Janssen Cilag, Bristol-Myers Squibb y ViiV Healthcare, no relacionadas con el presente documento.
María José Fuster ha prestado servicios de asesoramiento a Gilead, Janssen, MSD, ViiV, y Theratechnolologies y ha recibido pagos por ponencias o presentaciones educa- tivas a Gilead, Janssen, MSD, ViiV, y Theratechnolologies.
María Jesús Pérez ha recibido financiación para asistencia a congresos, actividades educacionales o de asesoría, así como becas de las compañías farmacéuticas Gilead, Janssen, Abbvie, MSD y ViiV.
Javier de la Torre ha efectuado labores de consultoría para Bristol-Myers Squibb, Gi- lead Sciences, GlaxoSmithKline, Janssen Cilag, Merck Sharp & Dohme y ViiV Healthca- re; ha recibido honorarios por charlas de AbbVie, Boehringer-Ingelheim, Bris-tol-Myers Squibb, Gilead Sciences, GlaxoSmith-Kline, Janssen Cilag, Merck Sharp & Dohme y ViiV Healthcare.
Lara Arbizu, declara que no presenta ningún conflicto de interés en relación con el pre- sente documento.
Ignacio Barreira, declara que no presenta ningún conflicto de interés en relación con el presente documento.
Josefina Belda, declara que no presenta ningún conflicto de interés en relación con el presente documento.
Ignacio Alastrué, declara que no presenta ningún conflicto de interés en relación con el presente documento.
Nuria Orozco, declara que no presenta ningún conflicto de interés en relación con el presente documento.
Ana Díez, declara que no presenta ningún conflicto de interés en relación con el pre- sente documento.
Mª Eugenia Flor, declara que no presenta ningún conflicto de interés en relación con el presente documento.
Virginia Fuentes, declara que no presenta ningún conflicto de interés en relación con el presente documento.
Carmen Peinado, declara que no presenta ningún conflicto de interés en relación con el presente documento.
Lorena Caja, declara que no presenta ningún conflicto de interés en relación con el presente documento.
Jesus Ortega, declara que no presenta ningún conflicto de interés en relación con el presente documento.
Yolanda Sanchez, declara que no presenta ningún conflicto de interés en relación con el presente documento.
Tatia Santirso, declara que no presenta ningún conflicto de interés en relación con el presente documento.
Beatriz Rodriguez, declara que no presenta ningún conflicto de interés en relación con el presente documento.
Cristina Zamorano, declara que no presenta ningún conflicto de interés en relación con el presente documento.
Juanjo Mascort declara que no presenta ningún conflicto de interés en relación con el presente documento.
Ricard Carrillo declara que no presenta ningún conflicto de interés en relación con el presente documento.
Cristina Agustí, declara que ha recibido financiación para la realización de estudios de investigación por parte de ViiV HealthCare Y Gilead Sciences, Inc, así como pago de dietas y desplazamientos para asistencia a reuniones, conferencias y congresos.
Jésica Abadía, declara no tener conflictos de interés.
Gaspar Alonso, declara que no presenta ningún conflicto de interés en relación con el presente documento.
Pablo Bachiller, declara que no presenta ningún conflicto de interés en relación con el presente documento.
Pilar Barrufet, declara que ha recibido honorarios por actividades educativas y/o con- sultorías y/o ayudas económicas para asistir a congresos por parte de Gilead Sciences, Janssen-Cilag y ViiV Healthcare.
Alfonso Cabello, declara que ha recibido compensaciones económicas por activida- des educativas, consultorías o asistencias/inscripciones a congresos de JanssenCilag, Gilead Sciences, Merck Sharp & Dohme y ViiV Healthcare.
Arantxa Cabezas, declara que no presenta ningún conflicto de interés en relación con el presente documento.
Miguel Cervero, declara que ha participado en reuniones de expertos de : VIIV, GI- LEAD, MSD y Janssen.
Javier de la Torre, declara que ha efectuado labores de consultoría para Bristol-Myers Squibb, Gilead Sciences, GlaxoSmithKline, Janssen Cilag, Merck Sharp & Dohme y ViiV Healthcare; ha recibido honorarios por charlas de AbbVie, Boehringer-Ingelheim, Bristol- Myers Squibb, Gilead Sciences, GlaxoSmithKline, Janssen Cilag, Merck Sharp & Dohme y ViiV Healthcare.
Ignacio de los Santos, declara que no presenta ningún conflicto de interés en rela-ción con el presente documento.
Alberto Díaz de Santiago, declara que no presenta ningún conflicto de interés en relación con el presente documento.
Francisco Fanjul, declara que ha efectuado labores de consultoría para AbbVie, Gilead Sciences, Janssen Cilag, Merck Sharp & Dohme y ViiV Healthcare. He recibido becas de investigación de Gilead Sciences, y honorarios por charlas de AbbVie, Gilead Sciences, Janssen Cilag, Merck Sharp & Dohme y ViiV Healthcare.
Juan Flores, ha recibido aportaciones de laboratorios por charlas o simposium de Abbie, Janssen, ViiV y MSD.
Carlos Galera, declara que no presenta ningún conflicto de interés en relación con el presente documento.
Mª José Galindo, declara que ha prestado servicios de asesoramiento-consultoría a los laboratorios Gilead, Janssen, MSD y ViiV, y ha recibido compensación económica por ponencias o presentaciones educativas a Gilead, Janssen, MSD, Abbvie y ViiV, así como becas para investigación clínica de Janssen, MSD y ViiV.
Lucio J. García-Fraile, declara que ha recibido financiación por actividades formativas y asistencia a congresos de ViiV, MSD, Gilead y Janssen.
Cristina Gómez, declara que no presenta ningún conflicto de interés en relación con el presente documento.
Jana Hernandez declara que no presenta ningún conflicto de interés en relación con el presente documento.
Xabier Kortajarena declara que no presenta ningún conflicto de interés en relación con el presente documento.
Juan C. López Bernaldo de Quirós declara que ha efectuado labores de consultoría y recibido compensación económica por ponencias/conferencias de Janssen Cilag, Merck Sharp & Dohme, ViiV Healthcare y Gilead Sciences.
Juan Macías, declara que ha sido investigador en ensayos clínicos apoyados por Bristol-Myers Squibb, Gilead, Merck Sharp & Dome y ViiV. Ha recibido honorarios por conferencias de Gilead, Bristol-Myers Squibb, Merck Sharp & Dome, Abbvie y ViiV, y honorarios por consultoría de Bristol Myers-Squibb, Gilead, Merck Sharp & Dome y Abbvie.
Andrés Marco Mouriño, declara haber participado en Simposios o impartido confe- rencias para Abbvie, Gilead, Janssen Cilag, MSD y Camurus.
Luz Martín Carbonero, declara que ha recibido financiación para asistencia a congresos, y honorarios por labores de consultoría o ponencias de los laboratorios Gilead Sciences, Janssen Cilag, MSD y ViiV Healthcare, no relacionadas con el pre-sente documento.
Javier Martinez Sanz He recibido compensación económica por actividades promo- cionales de Jannsen-Cilag, Gilead Sciences, MSD y ViiV Healthcare, y actividades de
consultoría para Gilead Sciences.
Aldana Menéndez declara que no presenta ningún conflicto de interés en relación con el presente documento.
Dolores Merino declara que ha recibido pagos por charlas formativas y promociona- les de ViiV Health Care, MSD, Abbvie, Gilead y Janssen. He recibido remuneración por reuniones de asesoría de ViiV Health Care y MSD. Estoy participando en ensayos clinicos promovidos por Glaxo Smtih Kline.
Raquel Monsalvo declara que ha recibido honorarios por impartir charlas formativas por parte de los laboratorios MSD, Gilead, Janssen, ViiV y Novonordisk. Ha recibido financiación por laboratorios MSD para realizar un Experto Universitario en infección por VIH. Se me ha facilitado asistir a congresos y reuniones por parte de MSD, Gilead, Janssen y ViiV.
Miriam Navarro declara que no presenta ningún conflicto de interés en relación con el presente documento.
Sara Nistal declara que no presenta ningún conflicto de interés en relación con el presente documento.
Joseba Portu declara que ha recibido compensaciones económicas por actividades educativas, consultorías de ViiV Healthcare, Gilead Sciences, Merck Sharp & Dohme y Janssen-Cilag.
Miguel A. Ramiro declara que no presenta ningún conflicto de interés en relación con el presente documento.
Melchor Riera declara que no presenta ningún conflicto de interés en relación con el presente documento.
Alberto Romero declara que no presenta ningún conflicto de interés en relación con el presente documento.
Rafael Rubio García declara que ha efectuado labores de consultoría para los laboratorios Abbvie, Bristol-Myers Squibb, Gilead Sciences y Janssen Cilag; ha recibido compensación económica por charlas de Abbvie, Bristol-Myers Squibb, Gilead Sciences, Janssen Cilag, Merck Sharp & Dohme, Roche Pharma y ViiV Healthcare.
Pablo Ryan declara que ha recibido subvenciones y honorarios personales de GILEAD y MSD; y de honorarios personales de AbbVie y ViiV Healthcare, al margen del trabajo presentado.
Jacinto Sánchez declara que no presenta ningún conflicto de interés en relación con el presente documento.
José Sanz declara que no presenta ningún conflicto de interés en relación con el presente documento.
Regino Serrano declara que no presenta ningún conflicto de interés en relación con el presente documento.
María Velasco declara que ha recibido honorarios y/o ayudas para actividades con fines docentes o ponencias de Gilead Sciences, Janssen Cilag, Merck Sharp & Doh-me y ViiV Healthcare. Ha recibido ayudas para investigación de Gilead Sciences.
Mar Vera declara que no presenta ningún conflicto de interés en relación con el presente documento.