Manejo de la enfermedad hepática en personas que viven con VIH
Febrero 2023
Notas de la Versión:
Comité de redacción
Coordinadores/as
Redactores/as y Revisores/as
HEPATITIS A
HEPATITIS B
HEPATITIS C
HEPATITIS E
HEPATOPATÍAS NO VÍRICAS
CIRROSIS HEPÁTICA
Conflictos de interés
Agradecimiento
Coordinadores/as
María Luisa Montes Ramírez (GeSIDA) |
Hospital Universitario La Paz. IdiPAZ. CIBERINFEC |
Juan Macías (GEHEP) |
Hospital Universitario Virgen de Valme Sevilla. Instituto de Biomedicina de Sevilla (IBiS). CIBERINFEC. Departamento de Medicina, Universidad de Sevilla |
Redactores/as y Revisores/as
HEPATITIS A
| Carolina Freyre Carrillo (GEHEP) | Hospital Universitario Puerto Real |
| Juan González- García (GeSIDA) | Hospital Universitario La Paz (HULP). IdiPAZ. CIBERINFEC |
| Federico García García (GEHEP) | Hospital Universitario San Cecilio-Instituto de Investigación Biosanitaria, IBS-Granada. CIBERINFEC |
| Luz Martín-Carbonero (GeSIDA) | Hospital Universitario La Paz (HULP). IdiPAZ |
Álvaro Mena de Cea (GEHEP) |
Complejo Hospitalario Universitario A Coruña (CHUAC). INIBIC |
José Sanz Moreno (GeSIDA) |
Hospital Universitario Príncipe de Asturias (HUPA). Alcalá de Henares |
HEPATITIS B
Cristina Gómez Ayerbe (GEHEP) |
Hospital Virgen de la Victoria. IBIMA |
Carlos Mínguez Gallego (GeSIDA) |
Hospital La Magdalena. Universitat Jaume I |
Antonio Aguilera (GEHEP) |
Hospital Clínico Universitario de Santiago de Compostela. Universidade de Santiago de Compostela |
Luz Martín-Carbonero (GeSIDA) |
Hospital Universitario La Paz. IdiPAZ |
Miguel García Del Toro (GEHEP) |
Consorcio Hospital General Universitario de Valencia |
Miguel Ángel Von Wichman (GeSIDA) |
Hospital Universitario Donostia. Instituto Biodonostia |
HEPATITIS C
Luz Martín-Carbonero (GeSIDA) |
Hospital Universitario La Paz. IdiPAZ |
| Ignacio de los Santos (GEHEP) | Hospital Universitario de La Princesa. CIBERINFEC |
Federico García (GEHEP) |
Hospital Universitario Clínico San Cecilio Granada |
Juan González García (GeSIDA) |
Hospital Universitario La Paz. IdiPAZ. CIBERINFEC |
| Alicia Lázaro (GeSIDA) | Hospital Universitario de Guadalajara |
Luis Morano (GEHEP) |
Hospital Álvaro Cunqueiro. Instituto de Investigación Galicia Sur Universidad de Santiago de Compostela |
HEPATITIS E
| Antonio Rivero Juárez (GeSIDA) | Hospital Universitario Reina Sofía de Córdoba. Grupo de investigación en Virología Clínica y Zoonosis. Instituto Maimónides de Investigación Biomédica de Córdoba (IMIBIC). CIBERINFEC |
Antonio Aguilera Guirao (GEHEP) |
Hospital Clínico Universitario de Santiago de Compostela. Universidad de Santiago de Compostela |
HEPATOPATÍAS NO VÍRICAS
Juan Macías (GEHEP) |
Hospital Universitario Virgen de Valme Sevilla. Instituto de Biomedicina de Sevilla (IBiS). CIBERINFEC. Departamento de Medicina, Universidad de Sevilla |
| Jordi Navarro (GeSIDA) | Hospital Universitari Vall d’Hebron. Barcelona |
| Juan A Pineda (GEHEP) | Hospital Universitario Virgen de Valme. Sevilla. Instituto de Biomedicina de Sevilla (IBiS). CIBERINFEC |
| Miguel García Del Toro (GEHEP) | Consorcio Hospital General Universitario de Valencia |
María Luisa Montes (GeSIDA) |
Hospital Universitario La Paz. IdIPAZ. CIBERINFEC |
CIRROSIS HEPÁTICA
Anaïs Corma-Gómez (GEHEP) |
Hospital Universitario Virgen de Valme. Instituto de Biomedicina de Sevilla (IBiS). CIBERINFEC |
Miguel Ángel Von Wichman (GeSIDA) |
Hospital Universitario Donostia. Instituto Biodonostia |
Juan A Pineda (GEHEP) |
Hospital Universitario Virgen de Valme. Sevilla. Instituto de Biomedicina de Sevilla (IBiS). CIBERINFEC |
Luis Morano (GEHEP) |
Hospital Álvaro Cunqueiro. Instituto de Investigación Galicia Sur Universidad de Santiago de Compostela |
José Sanz (GeSIDA) |
Hospital Universitario Príncipe de Asturias (HUPA). Alcalá de Henares |
Juan González (GeSIDA) |
Hospital Universitario La Paz. IdiPAZ. Madrid. CIBERINFEC |
Conflictos de interés
Con el fin de evitar y/o minimizar los posibles conflictos de interés, los coordinadores, autores y revisores que forman parte de este panel de expertos han realizado una declaración formal de intereses en la que queda constancia explícita de que ninguno de ellos tiene ningún conflicto de interés en la realización de este documento.
Agradecimiento
La Junta Directiva de GeSIDA, de GEHEP y el Panel de Expertos de GeSIDA agradecen las aportaciones y opiniones de Lucio García-Fraile Fraile.
LISTADO DE ABREVIATURAS
AAD |
Antivirales de Acción Directa |
Ac-VHD |
Anticuerpos frente al virus de la hepatitis D |
ALT |
Alanina aminotransferasa |
anti-HBc |
Anticuerpos frente a las proteínas del core del VHB |
anti-HBe |
Anticuerpos frente al antígeno e del VHB |
anti-HBs |
Anticuerpos frente al antígeno de superficie del VHB |
APRI |
AST to Platelet Ratio Index |
ARN |
Ácido ribonucleico |
ARV |
Antirretrovirales |
BLV |
Bulevirtida |
CAP |
Parámetro de atenuación controlada (de controlled attenuation parameter) |
CDC |
Centers for Disease Control and Prevention |
CHC |
Hepatocarcinoma |
CMIA |
Inmunoanálisis quimioluminiscente |
ADN |
Ácido desoxirribonucleico |
cccADN |
ADN circular covalentemente cerrado |
IDSA |
Infectious Diseases Society of America |
EH |
Esteatosis hepática |
EHMet |
Enfermedad hepática metabólica |
EIA |
Enzimoinmunoanálisis |
EDA |
Endoscopia digestiva alta |
ET |
Elastografía hepática de transición con vibración controlada |
ETV |
Entecavir |
FIB-4 |
Indicador de fibrosis en función de edad, ALT, AST y plaquetas |
FLI |
Fatty liver index |
FTC |
Emtricitabina |
GLE |
Glecaprevir |
GLP-1 |
Péptido de tipo 1 similar al glucagón (de glucagon-like peptide-1) |
GZV |
Grazoprevir |
GPVH |
Gradiente de presión venosa hepática |
HA |
Hepatopatía alcohólica |
HBeAg |
Antígeno e del VHB |
HBsAg |
Antígeno de superficie del VHB |
HCRA |
Hepatitis C de reciente adquisición |
HSH |
Hombres que tienen sexo con hombres |
HSI |
Hepatic steatosis index |
HTP |
Hipertensión portal |
ITIAN |
Inhibidor de la transcriptasa inversa análogo de nucleós(t)idos |
NAFDL |
Enfermedad hepática grasa no alcohólica (del inglés “non- alcoholic fatty liver disease). |
NFS |
NAFDL fibrosis score |
IgM |
Inmunoglobulina M |
IgG |
Inmunoglobulina G |
IP |
Inhibidores de la proteasa |
kPa |
Kilopascales |
MAFLD |
Hígado graso asociado a disfunción metabólica |
PAGE-B |
Platelet-Age-GEnder-HBV |
pegIFN |
Interferón pegilado |
PIB |
Pibrentasvir |
PTV |
Paritaprevir |
PVVIH |
Personas que viven con el VIH |
RBV |
Ribavirina |
RH |
Rigidez hepática |
RM |
Resonancia magnética nuclear |
RVS |
Respuesta viral sostenida |
SIDA |
Síndrome de la inmunodeficiencia adquirida |
SOF |
Sofosbuvir |
TAF |
Tenofovir alafenamida |
TAR |
Tratamiento antirretroviral |
TDF |
Tenofovir disoproxil fumarato |
TC |
Tomografía computarizada |
UDI |
Usuarios de drogas intravenosas |
VE |
Varices esofágicas |
VEL |
Velpatasvir |
VHA |
Virus de hepatitis A |
VHB |
Virus de hepatitis B |
VHC |
Virus de hepatitis C |
VHD |
Virus de hepatitis D |
VHE |
Virus de hepatitis E |
VIH |
Virus de la inmunodeficiencia humana |
VOX |
Voxilaprevir |
VPN |
Valor predictivo negativo |
3TC |
Lamivudina |
1. INTRODUCCIÓN
Objetivo y alcance
Desde el año 2009 SEIMC-GeSIDA, en colaboración con AEEH, ha venido realizando documentos de consenso para el seguimiento y tratamiento de las hepatitis virales en las personas infectadas por VIH. Sin embargo, y debido a la implementación de los agentes antivirales de acción directa frente al virus de la hepatitis C, en los últimos 6 años sólo se han publicado dos documentos para el tratamiento de esta coinfección sin incluirse el resto de hepatitis. El cambio que la curación de la hepatitis C ha supuesto en la atención de la enfermedad hepática de las PVVIH, hace muy necesario un documento que aborde la hepatopatía por cualquier causa y ayude a poner foco en el nuevo escenario que nos encontramos en el momento actual.
El presente documento tiene como objetivo revisar y actualizar tanto los aspectos diferenciales de las hepatitis víricas como las recomendaciones de seguimiento y tratamiento en PVVIH. Se ha incluido un capítulo específico del seguimiento post-curación de la hepatitis C en los pacientes con fibrosis avanzada y cirrosis hepática, población muy prevalente en nuestras unidades. Además, y por primera vez, se dedica un capítulo a las hepatopatías no víricas con especial atención a la EHMet, causa principal de la hepatopatía crónica tanto en población con y sin infección por VIH. Las consecuencias de la EHMet van a ser de gran relevancia en la PVVIH en los próximos años y es muy necesario incorporar las recomendaciones vigentes para optimizar la atención que se preste a esta enfermedad. Se incorporan también apartados dedicados a las hepatitis autoinmunes y un apartado específico para diagnóstico y seguimiento de la hepatopatía alcohólica.
Deseamos que el presente documento sea el punto de partida de una nueva atención a la enfermedad hepática de las PVVIH de ahora en adelante, incorporando los enormes cambios epidemiológicos y terapéuticos que se están produciendo.
Metodología
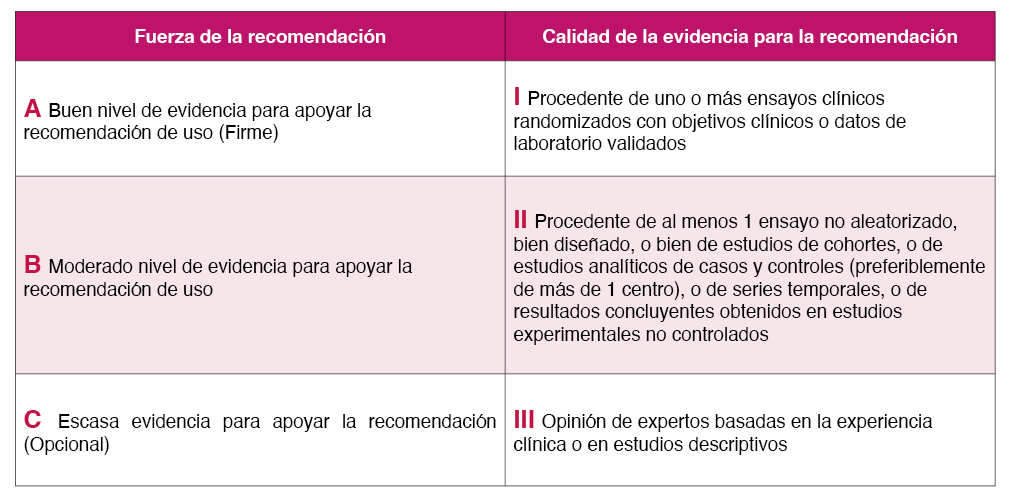
Cada apartado de esta Guía ha sido realizado por redactores y revisores pertenecientes a GeSIDA y GEHEP. Tanto los redactores como los revisores han sido designados por ambas Juntas Directivas. Dos de los miembros del panel han actuado como coordinadores cuyo cometido, además de redactar alguno de los apartados, ha sido ensamblar los distintos apartados y encargarse de la redacción y edición final del mismo. El documento final ha sido consensuado por todo el Panel. En esta guía la fuerza de la recomendación y gradación de las pruebas que la sustentan se basan en una modificación de los criterios de la Infectious Diseases Society of America (IDSA). Según estos criterios cada recomendación debe ofrecerse siempre (A), en general (B) u opcionalmente (C) y ello basado en la calidad de los datos obtenidos a partir de uno o más ensayos clínicos aleatorizados con resultados clínicos o de laboratorio (I), de uno o más ensayos no aleatorizados o datos observacionales de cohortes (II) o de la opinión de expertos (III) Tabla 1.
Tablas:
2. HEPATITIS A
2.1. Epidemiología y consideraciones especiales en el paciente VIH
2.2. Cribado y Diagnóstico
2.3. Prevención y vacunación
2.4. Actitud ante la hepatitis aguda por VHA
Epidemiología y consideraciones especiales en el paciente VIH
El virus de la hepatitis A (VHA) es un virus ARN, cuyo principal reservorio es el humano. Provoca una infección aguda del hígado, sin presentar cronicidad. El virus se transmite de forma esporádica o epidémica de persona a persona vía oral-fecal, hídrica (poco frecuente en países desarrollados) y alimentaria. La excreción fecal comienza una o dos semanas antes del inicio de los síntomas, disminuyendo con la aparición de los mismos y con la presencia de los anticuerpos en el suero 1.
Aunque nuestro país es considerado de baja endemicidad, en los últimos años ha aumentado el número de brotes, en su mayoría en HSH. Durante los años 2016- 2017 en varios países europeos se alcanzaron tasas de incidencia elevadas en esta población, de hasta 9,34 casos por 100.000 habitantes/año 2.
Entre las PVVIH en España, la seroprevalencia de IgG antiVHA ha sido históricamente muy elevada, al menos 3 de cada 4 pacientes 3. Probablemente en la actualidad es aún mayor, ya que muchas personas diagnosticadas recientemente de infección por VIH son de una generación ampliamente vacunada dentro de los programas de salud pública o provienen de zonas de alta endemicidad.
Cribado y Diagnóstico
En la actualidad la mayoría de los algoritmos diagnósticos se basan en la determinación de anticuerpos totales, no modificando la infección por VIH la dinámica de aparición de estos marcadores. El diagnóstico microbiológico mediante ensayos CMIA o EIA, ponen de manifiesto la presencia de anticuerpos IgM o IgG anti-VHA 4.
Los anticuerpos IgM se detectan en las formas agudas, pudiendo persistir hasta 6 meses tras la infección 5. Los anticuerpos IgM pueden detectarse en algunos pacientes a partir de 2-3 semanas tras la administración de la vacuna. Para evitar falsos positivos deben realizarse sólo en pacientes con síntomas o sospecha de infección aguda por VHA. Los anticuerpos IgG se detectan casi al inicio de los síntomas, mantienen la inmunidad durante años, aumenta su prevalencia con la edad y son indistinguibles de los generados por la inmunidad post-vacunal. Las técnicas de detección de ARN no se utilizan en la práctica habitual porque, aunque la negativización de la viremia en PVVIH es más lenta, no se ha asociado con formas de mayor gravedad que hagan necesaria su monitorización 6.
Prevención y vacunación
En PVVIH con frecuencia concurren factores asociados a un riesgo aumentado de infección por VHA, así como factores asociados a gravedad en caso de infección aguda, como son la propia infección por el VIH, edad mayor de 40 años, infección crónica por VHB o VHC, otras hepatopatías o cirrosis de cualquier etiología. Por tanto, las PVVIH son una población diana para la prevención de la infección por VHA.
Las medidas principales de prevención de la infección por VHA son las estrategias de salud pública (depuración de agua y control de manipulación de alimentos), las recomendaciones de higiene personal (lavados de manos, evitar el consumo de alimentos crudos con control higiénico insuficiente y en relaciones sexuales una higiene adecuada y el uso de preservativo), la vacunación y la administración de inmunoglobulinas. El uso de preservativo es eficaz para disminuir la trasmisión de VHA, pero menos que para otras ITS.
A nivel individual, en las PVVIH, la medida más eficaz de prevención de la infección por VHA es la vacunación, sin embargo, estamos lejos de una cobertura vacunal óptima. De hecho, según el informe de 2019 de la encuesta hospitalaria de PVVIH/ SIDA, en España la vacunación frente a VHA, entre pacientes con indicación, no alcanzó el 20% 7.
Los anticuerpos IgG adquiridos tras infección natural o vacunación proporcionan protección a largo plazo. La eficacia de las vacunas frente a VHA se evalúa fundamentalmente determinando la presencia de IgG antiVHA aunque no se ha establecido un título específico de umbral de inmunoprotección y se ha sugerido que cualquier nivel detectable confiere protección 8. La determinación prevacunal de anticuerpos IgG antiVHA es coste-efectiva cuando la seroprevalencia del VHA en la comunidad es superior al 30%. Este es el caso de las PVVIH en España 3.
Las vacunas frente a VHA son muy inmunogénicas e inducen la aparición de anticuerpos neutralizantes en más del 94% de los sujetos un mes después de la primera dosis y en prácticamente el 100% tras la segunda 8. En PVVIH la inmunogenicidad puede ser menor. Esta pérdida de inmunogenicidad está en relación con cifras más bajas de linfocitos CD4+, con viremia VIH >1000 cop/mL en el momento de la vacunación y con el sexo masculino 910. Además, en PVVIH se ha descrito la sero-reversión (pérdida de anticuerpos IgG antiVHA) en cerca de un 5% tras dos años de seroconversión mediante vacunación. También este fenómeno se ha asociado con cifras más bajas de linfocitos CD4+ en sangre y con viremia VIH detectable en el momento de la vacunación 11. Dado el mayor riesgo de infección por VHA, y en su caso de enfermedad grave, GeSIDA en recomendaciones anteriores a la actual 12, IDSA 13, y CDC 14, recomiendan que todas las PVVIH susceptibles de infección por VHA sean vacunadas. La menor inmunogenicidad obtenida en PVVIH ha hecho que CDC recomienden realizar una prueba serológica tras un mes de completar la vacunación para comprobar su eficacia 14.
En la actualidad se comercializan en España dos vacunas inactivadas frente al VHA: Havrix (1440 unidades ELISA para adulto y 720 unidades ELISA para personas entre 1 y 18 años) y Vaqta (50 Unidades para adultos y 25 Unidades para personas entre 1 y 17 años). También están autorizadas vacunas combinadas con antígenos frente a los virus de hepatitis A y B. En adultos y en pacientes inmunocomprometidos, la vacunación de VHA se realiza con dos dosis, administrada la segunda 6 a 12 meses después de la primera 910.
En PVVIH, se ha demostrado una mayor inmunogenicidad tras dos dosis de vacuna que tras una sola dosis 15. Solo un estudio, no adecuadamente potenciado, ha mostrado una mayor eficacia de una pauta de vacuna con tres dosis vs dos dosis 10.
Actitud ante la hepatitis aguda por VHA
No existe tratamiento específico frente al VHA, tan solo vigilancia y tratamiento de soporte. No existen estudios actuales que permitan realizar una recomendación sobre el manejo del TAR en PVVIH que presentan una hepatitis aguda por VHA. En general la toxicidad hepática de los ARV actuales es muy escasa y salvo situación de insuficiencia hepática muy avanzada o colestasis grave, el metabolismo de los ARV no se altera.
En contactos estrechos no inmunes de pacientes con hepatitis aguda por VHA (por ej. convivientes, parejas sexuales, personas que comparten uso de drogas) es eficaz la profilaxis mediante vacuna y/o inmunoglobulinas humanas inespecíficas por vía IM. En los casos en que el contacto estrecho sea un PVVIH no existe ninguna evidencia de que el manejo deba ser diferente.
Recomendaciones
- Realizar la serología frente al VHA, independientemente de la edad, sexo y categoría de exposición, con el objetivo de identificar a los ya inmunizados y a los susceptibles (A-II).
- Vacunar a aquellos con serología negativa, con alta prioridad en todos aquellos con riesgo elevado de infección (HSH, UDI y viajantes a zonas de riesgo), o con riesgo elevado de enfermedad hepática grave en caso de hepatitis aguda por VHA (A-II).
- Vacunar con dos dosis de vacuna frente a VHA, la segunda 6 a 12 meses tras la primera (A-I).
- En general se recomienda realizar un control de seroconversión a partir del mes de haber completado la vacunación (B-II). En pacientes con factores asociados a menor tasa de respuesta este control debe realizarse siempre (A-II).
- Si cifra de linfocitos CD4+ <200 cel/µL o viremia VIH >1000 cop/mL y no hay alto riesgo de infección por VHA a corto plazo, posponer vacunación frente a VHA hasta recuperación inmunológica y control de la replicación viral (A-III). En caso de alto riesgo de infección por VHA vacunar frente a VHA y controlar respuesta tras vacunación (A-III). En aquellos sin respuesta considerar vacunar de nuevo tras recuperación inmunológica y control de la replicación viral (A-III). En pacientes que sí alcanzaron respuesta tras vacunación con linfocitos CD4+ <200 cel/µL o viremia VIH >1000 cop/mL se recomienda controlar la presencia de IgG antiVHA a partir del segundo año y revacunar en caso de sero-reversión (A-II)
- En los casos de hepatitis aguda en pacientes que reciben TAR, los fármacos con potencial toxicidad hepática o metabolizados por el hígado deben utilizarse con precaución (A-III). En general se debe mantener el tratamiento antirretroviral, aunque en caso de insuficiencia hepática o colestasis grave debe suspenderse el tratamiento de forma temporal (B-III).
- En los contactos estrechos infectados por VIH y no inmunizados frente al VHA se recomienda una protección inmediata mediante la administración de una dosis intramuscular de inmunoglobulina y la primera dosis de la vacuna (A-II). Los contactos que estén inmunizados por exposición previa o vacunación no precisan recibir la inmunoglobulina (A-II).
Bibliografía:
Centro Nacional de Epidemiología. Instituto de Salud Carlos Red Nacional de Vigilancia Epidemiológica. Protocolos de la Red Nacional de Vigilancia Epidemiológica. Madrid, 2015. https://www.isciii.es/QueHacemos/Servicios/VigilanciaSaludPublicaRENAVE/ EnfermedadesTransmisibles/Documents/PROTOCOLOS/PROTOCOLOS%20EN%20 BLOQUE/PROTOCOLOS_RENAVE-ciber.pdf
Rapid risk assessment: Hepatitis A outbreak in the EU/EEA mostly affecting men who have sex with men, 3rd update, 28 June 2017. Disponible en: https://www.ecdc. europa.eu/en/publications-data/rapid-risk-assessment-hepatitis-outbreak-eueea-mostly- affecting-men-who-have-sex [consultado 17/05/2022].
González-García J, Mahillo B, Hernández S, et al. Estudio multicéntrico sobre prevalencia de las coinfecciones por virus de hepatitis, indicación de tratamiento de hepatitis crónica C y necesidad de trasplante hepático en pacientes infectados por el VIH en España. Estudio GESIDA 29/02-FIPSE 12185/01 et al. Enferm Infecc Microbiol Clin 2005;23:340-8.
Segundo estudio de seroprevalencia en España. Septiembre Ministerio de sanidad. Disponible en: https://www.sanidad.gob.es/en/profesionales/saludPublica/prevPromocion/ vacunaciones/comoTrabajamos/docs/EstudioSeroprevalencia_ EnfermedadesInmunoprevenibles.pdf
Immunological basis for inmunization series. Module 18: Hepatitis A Update 2019. Disponible en: https://apps.who.int/iris/bitstream/handle/10665/326501/97892516327-eng. pdf?sequence=1&isAllowed=y
Lee YL, Chen G, Chen N, et Less Severe but Prolonged Course of Acute Hepatitis A in Human Immunodeficiency Virus (HIV)–Infected Patients Compared With HIV-Uninfected Patients During an Outbreak: A Multicenter Observational Study. Clin. Infect. Dis. 2018, 67, 1595–1602.
Encuesta hospitalaria de pacientes con infección por el VIH. Resultados de 2019. https://www.sanidad.gob.es/ciudadanos/enfLesiones/enfTransmisibles/sida/vigilancia/ pdf
US Department of Health and Human Services/Centers for Disease Control and Prevention of Hepatitis AVirus Infection in the United States: Recommendations of the Advisory Committee on Immunization Practices, 2020 MMWR / July 3, 2020 / Vol. 69 / No. 5.
Nicolini LA, Giacobbe DR, Di Biagio A and Viscoli Insights on common vaccinations in HIV-infection: efficacy and safety. J Prev Med Hyg 2015; 56: E28-E32.
Phung B-C and Launay Vaccination against viral hepatitis of HIV-1 infected patients. Review. Human Vaccines & Immunotherapeutics 2012; 8: 554–55.
Huang S-H, Huang C-H, Wang N-C, et al. Early Seroreversion After 2 Doses of Hepatitis A Vaccination in HumanImmunodeficiency Virus–Positive Patients: Incidence and Associated Hepatology 2019; 70:466-475.
Recomendaciones de GESIDA / PNS / AEEH sobre tratamiento y manejo del paciente adulto coinfectado por VIH y virus de las hepatitis A, B y
2013 IDSA Clinical Practice Guideline for Vaccination of the Immunocompromised
People Coinfected with HIV and Viral Hepatitis. https://www.cdc.gov/hepatitis/populations/hiv.htm
Effectiveness of hepatitis A vaccination among people living with HIV in Taiwan: Is one dose enough?. Journal of Microbiology, Immunology and Infection; 2022: 55,
3. HEPATITIS B
3.1. Epidemiología y consideraciones especiales en el paciente VIH
3.2. Cribado y Diagnóstico: infección vs hepatitis crónica
3.3. Consecuencias de la hepatitis B crónica
3.4. Prevención y vacunación
3.5. Tratamiento de la infección aguda
3.6. Tratamiento de la infección crónica. Tratamiento en paciente con TAR
3.7. Cribado de hepatocarcinoma. Seguimiento según PAGE-B
3.8. Coinfección con Hepatitis D
Epidemiología y consideraciones especiales en el paciente VIH
Las PVVIH tienen un riesgo potencial alto de infectarse con el VHB, ya que ambos comparten vías de transmisión similares. A nivel mundial se estima que el 10% de las PVVIH también están coinfectadas con el VHB, aunque las tasas de coinfección varían significativamente entre áreas geográficas en función, de los mecanismos locales de transmisión del VIH, del nivel de cobertura vacunal, y de la calidad de los datos epidemiológicos (de prevalencia e incidencia) disponibles 12.
En nuestro país, la prevalencia de infección por el VHB en PVVIH ha ido disminuyendo en los últimos años, siendo en 2021 del 2,5%3 sólo ligeramente superior a la de la población general4.
La infección por el VHB en PVVIH está asociada con mayor carga viral, presencia más frecuente del HBeAg, progresión más rápida de la hepatopatía y aumento de la mortalidad global y relacionada con el hígado5. Por el contrario, la infección crónica por VHB no altera sustancialmente la progresión de la infección por VIH, y no influye en el control virológico del VIH ni en la respuesta de los linfocitos T CD4+ al tratamiento antirretroviral (TAR)67 .
Se estima que hasta en un 10% de coinfectados, con buen cumplimiento terapéutico, se detecta viremia B residual de mecanismo y significación clínica desconocidas y no asociada a mutantes resistentes4.
Cribado y Diagnóstico: infección vs hepatitis crónica
El cribado serológico completo y la evaluación de la infección por VHB incluye las siguientes determinaciones:
HBsAg, anti-HBc (incluido IgM para detectar infección aguda) y anti-HBs, al inicio del seguimiento y cada 12-18 meses si la PVVIH no está completamente vacunada (sobre todo si mantiene prácticas de riesgo). En aquellos con HBsAg positivo se debe solicitar HBeAg, anti-HBe y DNA-VHB.
Se deben descartar además causas no infecciosas de enfermedad hepática crónica, así como la coinfección por el VHD y VHC. También hay que valorar la inmunidad frente al VHA para vacunar si no se detectan anticuerpos (anti-VHA IgG).
El patrón anti-HBc aislado es muy frecuente en las PVVIH, si bien su prevalencia e importancia clínica varía según los diferentes estudios. Ante la posibilidad de que se trate de una hepatitis B oculta, con una prevalencia estimada en PVVIH en torno al 16% en un reciente metaanálisis8 y ante el riesgo de reactivación, debe descartarse la presencia de DNA-VHB, sobre todo en pacientes con CD4+ bajos o que vayan a someterse a tratamientos inmunodepresores, y que no estén en tratamiento con TDF o TAF9.
La positividad de HBsAg durante >6 meses es el marcador definitorio de la infección crónica. El aumento de transaminasas (principalmente ALT) es sugestivo de un proceso de inflamación hepática. En la valoración inicial, se debe evaluar el estatus serológico y virológico, así como el grado de lesión hepática (ALT y métodos no invasivos de fibrosis como la elastometría hepática). En pacientes infectados por el VHB, los test serológicos APRI y FIB-4 para el diagnóstico no invasivo de fibrosis tienen un rendimiento muy limitado para detectar aquellos con fibrosis avanzada, y este rendimiento es aún menor si se encuentran en tratamiento antirretroviral10 . Entre los métodos no invasivos, la elastometría de transición es el mejor biomarcador, estableciéndose por encima de 12,4 kPa el punto de corte para el diagnóstico de cirrosis (F4) en el caso de la población general11 y por encima de 7,8 kPa el punto de corte para fibrosis avanzada (F3-F4) en pacientes coinfectados por el VIH 12 Existen otros marcadores no invasivos de fibrosis en sujetos con hepatitis B crónica, pero se han desarrollado específicamente en poblaciones asiáticas con precisión diagnóstica variable y no existe validación en población coinfectada por el VIH o caucásica1314.
Dentro de la historia natural de la infección por VHB se pueden diferenciar 4 fases de infección activa y una de curación funcional (Tabla 1)15. La fase de curación funcional (fase 5) se caracteriza por un HBsAg negativo con o sin anti-HBs, y anti- HBc positivo, junto a ALT normal y ADN-VHB en suero indetectable. La curación tanto de la hepatitis aguda B como de la hepatitis crónica B no implica erradicación del virus, ya que el genoma del VHB permanece integrado en forma de cccDNA en el núcleo de los hepatocitos 16 Tras la curación funcional, en caso de cirrosis, sigue existiendo riesgo de CHC y si existe inmunosupresión en ausencia de un tratamiento potente frente al VHB, se puede producir reactivación, sobre todo en pacientes con tratamientos inmunosupresores intensivos (como los usados en leucemia y linfoma, trasplante de médula ósea, o glucocorticoides a altas dosis durante al menos 4 semanas) o tratamientos depletivos de células B (como rituximab). También se han descrito casos de reactivación durante el tratamiento del VHC con AAD y ocasionalmente en PVVIH con recuento bajo de linfocitos CD4+ 17.
Consecuencias de la hepatitis B crónica
En pacientes con coinfección por VHB/VIH, la reconstitución inmune tras el inicio del TAR puede asociarse con niveles elevados de transaminasas, al ser inmunomediado el daño hepático inducido por el VHB18.
La infección crónica por VHB aumenta el riesgo de desarrollar cirrosis y es la causa más frecuente de CHC a nivel mundial. Se estima una incidencia de CHC de 0,4- 0,6% anual, siendo el riesgo mayor en cirróticos, en no cirróticos con antecedentes familiares de CHC, etnia asiática o africana, coinfección por el VHD, o edad mayor de 45 años. También en pacientes con niveles elevados de DNA-VHB y/o HBsAg, con determinados genotipos del VHB (C > B) o mutaciones específicas. La supresión viral con tratamiento logra reducir el riesgo de CHC415.
Prevención y vacunación
La vacuna contra la hepatitis B es el principal pilar de la prevención de esta enfermedad. Si no hay evidencia serológica de infección por VHB se debe indicar vacunación. La intensidad y duración de la inmunogenicidad obtenida con esta vacuna en PVVIH es significativamente inferior a lo observado en la población seronegativa, sobre todo en los sujetos que tienen bajos recuentos de CD4+. En el estudio randomizado "ANRS HB03 VIHVAC-B trial" se demuestra una respuesta significativamente mayor con una pauta de 4 dosis dobles por vía intramuscular19.
Existe controversia sobre la actuación en pacientes con anti-HBc aislado, pero en general parece razonable descartar infección crónica oculta (ADN de VHB negativo) y en este caso vacunar frente a VHB20.
En pacientes sin anti-HBs a pesar de la vacunación y factores de riesgo habría que plantearse incluir un TAR activo frente VHB.
Tratamiento de la infección aguda
En una infección aguda por VHB en una PVVIH sin TAR, o con un TAR sin fármacos activos frente al VHB, se debe considerar iniciar TAR con dos ITIAN activos frente al VHB. En los casos graves (coagulopatía o signos de fallo hepático agudo), valorar trasplante hepático4,15.
Tratamiento de la infección crónica. Tratamiento en paciente con TAR
El objetivo ideal que se puede conseguir mediante el tratamiento frente al VHB es la "curación funcional". Esta curación raramente se logra con los tratamientos actuales (tasa media en torno al 8-10% en 5 años para pacientes VIH/VHB en TAR activo contra el VHB)16, y, por lo tanto, el objetivo terapéutico principal será conseguir una supresión mantenida de los niveles plasmáticos del DNA-VHB que se ha relacionado con una menor progresión de fibrosis hepática y un menor desarrollo de hepatocarcinoma21,22.
No existen unos criterios específicos de inicio del tratamiento frente al VHB en pacientes coinfectados por el VIH. Sin embargo, como actualmente se recomienda iniciar el TAR en todos los pacientes infectados por el VIH tan pronto como sea posible, ese tratamiento debería incluir fármacos activos y con elevada barrera de resistencias frente al VHB, ya que el control precoz de la viremia del VHB, el tiempo en que permanece indetectable, así como el aclaramiento de HBsAg o HBeAg cuando se produzca, han demostrado reducir el riesgo de desarrollo de complicaciones hepáticas22,23.
Como posible excepción al inicio precoz del TAR se encontrarían los "controladores de élite". Sin embargo, en caso de coinfección por el VHB, un inicio precoz también podría ser beneficioso, al haberse observado en estos pacientes la presencia de una activación crónica del sistema inmune, que podría contribuir a acelerar las complicaciones en pacientes coinfectados24.
Actualmente hay dos tipos de tratamientos autorizados frente al VHB, el basado en interferón-α y el basado en ITIAN. Los frecuentes efectos adversos, la ausencia de una respuesta virológica duradera, y el no haberse apreciado aumentos en la tasa de aclaramiento de HBeAg o HBsAg al añadir pegIFN al TAR, desaconsejan este tratamiento en pacientes coinfectados1.
De entre los ITIAN, algunos consiguen inhibir la replicación tanto del VIH como del VHB. TDF formando parte del TAR, asociado o no a 3TC o FTC, ha demostrado tener una potente actividad frente a ambos virus, ser eficaz frente a cepas resistentes a 3TC o FTC, y presentar una alta barrera de resistencias. TAF, otro profármaco de tenofovir, ha demostrado tener los mismos beneficios que TDF pero con menor toxicidad, por lo tanto actualmente sería el tratamiento de elección25.
En caso de no poder utilizar tenofovir en ninguna de sus formas, el tratamiento recomendado frente al VHB sería ETV, fármaco sin actividad frente al VIH pero con capacidad para seleccionar la mutación M184V, por lo que debería darse junto a un TAR eficaz.
Al igual que el TAR, el tratamiento frente al VHB debe ser indefinido, no habiéndose establecido criterios de interrupción terapéutica en pacientes infectados por el VIH, y produciéndose rebrotes virales al suspender el tratamiento que pueden ser graves. No existen estudios que avalen qué hacer en los pocos pacientes que consiguen la curación funcional o en los que presentan un anti-HBc aislado, por lo que de manera prudente, podría considerarse individualmente mantener TDF o TAF como parte del TAR.
En caso de no conseguir el control virémico con tenofovir junto a 3TC o FTC, se puede añadir ETV al tratamiento26. En aquellos pacientes con buen cumplimiento terapéutico en los que persista replicación activa se podría solicitar un test genotípico de resistencias, teniendo en cuenta que los test comerciales no hacen resistencias por debajo de 1000 UI/ml. En caso de presentar mutaciones frente a 3TC o FTC, debe incrementarse la dosis de ETV.
Cribado de hepatocarcinoma. Seguimiento según PAGE-B
La detección precoz de hepatocarcinoma es el principal desafío en el seguimiento de los pacientes con infección crónica por VHB y, pese a que no existe una evidencia directa de su beneficio en pacientes coinfectados, se recomienda el cribado mediante ecografías hepáticas semestrales en pacientes cirróticos, o en los no cirróticos con antecedentes familiares de CHC, coinfectados por el VHD, o procedentes de países africanos o asiáticos con edad superior a 40 años en varones, o 50 en mujeres.
Se han desarrollado distintas escalas para medir el riesgo de CHC, pero la única validada en pacientes caucásicos no cirróticos en tratamiento con TDF o ETV es la escala PAGE-B. Esta escala se basa en parámetros fácilmente disponibles: edad, sexo y cifra de plaquetas. En pacientes monoinfectados por el VHB, un valor de la escala inferior a 10 puntos ha demostrado un valor predictivo negativo cercano al 100% y por lo tanto en estos pacientes podría evitarse el cribado de CHC27. Sin embargo, no ha sido validada en sujetos coinfectados por VIH/VHB, y los resultados de algunos estudios ponen en duda la predictibilidad de la escala en esta población28.
Parámetros como una carga viral del VIH elevada o una cifra baja de linfocitos CD4+, se han relacionado con mayores tasas de CHC en pacientes con VIH/VHB, y posiblemente habría que valorar su inclusión en los algoritmos de cribado25 . En cualquier caso, serían necesarios más estudios para verificar la validez de PAGE-B en la población infectada por el VIH, antes de poder establecer una recomendación firme para su empleo.
Por otro lado, la presencia de enfermedad hepática metabólica (EHMet) es muy prevalente en los pacientes coinfectados VIH/VHB30, y se ha relacionado con un aumento del riesgo de hepatocarcinoma, con independencia de la viremia del VHB31. Por lo tanto, la detección de este trastorno y si está presente, la implantación del cribado de CHC, debería plantearse en la rutina de seguimiento de los pacientes coinfectados.
Coinfección con Hepatitis D
La infección por el VHD provoca la forma más grave de hepatitis viral crónica, y en pacientes infectados por los 3 virus VHB/VHD/VIH, el VHD multiplica el riesgo de CHC, de complicaciones hepáticas y muerte. La prevalencia global de la infección por el VHD no es bien conocida, siendo extremadamente variable según la localización geográfica de los estudios, pero un reciente metaanálisis la sitúa en torno al 15% de las PVVIH con presencia de HBsAg32, y en 2018 estaba en torno al 18% en una cohorte española multicéntricA3.
Tratamientos frente al VHD autorizados
Los ITIAN no son efectivos frente a la hepatitis crónica por VHD. El pegIFN-α es hasta ahora el único tratamiento recomendado, pero su eficacia es muy limitada. En el único estudio que evaluó la seguridad y eficacia del IFN-α en PVIH los resultados fueron, en ausencia de un deterioro inmunológico importante, similares a los de los no infectados, con una tasa de respuesta del 6%, frente a un 9% en pacientes sin infección por el VIH33 . En el resto de estudios, en los que no se incluyen PVVIH, los resultados han seguido mostrando tasas de respuesta muy bajas (< 30% a los 6 meses de finalizar el tratamiento). Además, la duración del tratamiento no ha sido bien establecida y tampoco se ha aclarado la definición de respuesta viral sostenida (se han observado rebrotes tardíos mientras el HBsAg siguiera presente34 . Por lo tanto, no existe un tratamiento con la suficiente eficacia frente al VHD, para recomendar su uso de forma generalizada.
Existen actualmente varios fármacos frente al VHD en investigación, y recientemente bulevirtida (BLV) con datos muy limitados, ha sido autorizado por la Agencia Europea del Medicamento con una "aprobación condicional" en espera de recibir más información. Los resultados disponibles en pacientes infectados por VHB/VHD con la dosis autorizada (2 mg subcutáneos/día) muestran resultados esperanzadores (el 45% de los pacientes alcanzaron el objetivo primario del estudio, ARN del VHD indetectable o una disminución ≥ 2 log 10 además de normalizar las transaminasas a las 48 semanas de tratamiento con BLV y TDF, frente a un 2% en los tratados únicamente con TDF; p≤ 0,01)35. Sin embargo, no está establecida la duración óptima del tratamiento ni hay datos en PVVIH. Los datos preliminares apuntan también a una mejoría de la fibrosis hepática.
Recomendaciones
- Se recomienda el cribado serológico del VHB (HBsAg, anti-HBc y anti-HBs) en todos los pacientes infectados por VIH (A-II).
- En aquellos con HBsAg positivo, se recomienda la determinación basal de HBeAg, anti-HBe, la cuantificación de ADN-VHB, la determinación de Anti- VHD, así como la valoración del daño hepático (A-II).
- En caso de anti-HBc aislado con datos de afectación hepática o inmunosupresión significativa, se debe valorar la presencia de hepatitis B oculta, determinando el ADN-VHB en suero (B-II).
- Antes de iniciar el TAR, en PVVIH coinfectados por el VHB se determinará el nivel de viremia del VHB (AIII), y se repetirá la prueba de forma periódica (12-18 meses) para asegurar una supresión eficaz del VHB (A-II).
- En PVVIH no vacunados y susceptibles se recomienda administrar pautas reforzadas de vacuna VHB (dosis dobles o 4 dosis), a ser posible con instauración previa del TAR (A-I). Se recomienda confirmar la seroconversión midiendo niveles de anti-HBs a los 1-2 meses de completar la vacunación (B- I).
- En PVVIH con recuento de linfocitos CD4+ bajos, si los títulos de Ac anti- HBs son < 10 UI/L tras la vacunación completa, se deben administrar 3 nuevas dosis de vacuna de 40 mcg a intervalos mensuales, o una nueva vacunación con la misma pauta, intentando aplazar la revacunación hasta la recuperación del recuento de CD4+ (B-III).
- En caso de infección aguda VHB se recomienda iniciar o modificar el tratamiento a un TAR con dos ITIAN activos frente al VHB (A-II).
- El objetivo terapéutico principal en la infección crónica es conseguir una supresión mantenida de los niveles plasmáticos del DNA-VHB (A-II).
- En la infección crónica, se recomienda iniciar el tratamiento frente al VHB lo antes posible, formando parte del TAR (A-II), incluso en los controladores de élite (A-III).
- Se desaconsejan los tratamientos basados en IFN-α (B-II).
- El antiviral de elección es TAF, o TDF si no estuviera disponible, asociado a 3TC o FTC, formando parte de un TAR eficaz (A-I). En caso de no poder utilizar tenofovir, se debería utilizar ETV añadido a un TAR eficaz (A-III).
- En caso de no conseguir el control virológico con tenofovir junto a 3TC o FTC, se recomienda añadir ETV al tratamiento anterior (B-II).
- La duración del tratamiento es indefinida, debiendo garantizar la presencia de antivirales eficaces frente al VHB en caso de cambios en el TAR (A-II).
- Se recomienda ecografía semestral en los pacientes cirróticos para el cribado de CHC (A-I).
- Se recomienda ecografía semestral como cribado de CHC en pacientes no cirróticos con antecedentes familiares de CHC, procedentes de Asia o África, y mayores de 40 años (hombres) o 50 años (mujeres), así como en coinfectados por el VHD o con EHMet (A-III).
- No hay suficiente evidencia para recomendar de forma generalizada la utilización de la escala PAGE-B para establecer los pacientes no cirróticos candidatos a un cribado del CHC (B-II).
- Los ITIAN solo tienen utilidad frente al VHD cuando consiguen un aclaramiento del HBsAg, pero deben formar parte siempre del tratamiento en pacientes infectados por VIH/VHB/VHD (A-I).
- El IFN-α es el único tratamiento recomendado específicamente frente al VHD, pero no se recomienda en pacientes infectados por VIH/VHB/VHD (B-III).
- Hasta el momento no existen datos suficientes para recomendar la utilización rutinaria de BLV en pacientes infectados por VIH/VHB/VHD. Se valorará en casos seleccionados (C-III).
Tablas:

El ADN-VHB se expresa en UI/ml; * generalmente <1.000 UI/ml;
Bibliografía:
Singh KP, Crane M, Audsley J, et al. HIV-hepatitis B virus coinfection: epidemiology, pathogenesis, and AIDS. 2017;31:2035-2052.
Mason LM, Duffell E, Veldhuijzen IK, et Hepatitis B and C prevalence and incidence in key population groups with multiple risk factors in the EU/EEA: a systematic review. Euro Surveill. 2019;24:1800614.
Pérez-Latorre L, Berenguer J, Micán R, et HIV/HBV coinfection: temporal trends and patient characteristics, Spain, 2002 to 2018. Euro Surveill. 2021;26:2000236.
Rodríguez M, Buti M, Esteban R, et al. Documento de consenso de la Asociación Española para el Estudio del Hígado sobre el tratamiento de la infección por el virus de la hepatitis B (2020). Gastroenterol 2020;43:559-587.
Thornton AC, Jose S, Bhagani S, et al. Hepatitis B, hepatitis C, and mortality among HIV-positive AIDS. 2017;31:2525-2532.
Konopnicki D, Mocroft A, de Wit S, et al. Hepatitis B and HIV: prevalence, AIDS progression, response to highly active antiretroviral therapy and increased mortality in the EuroSIDA AIDS. 2005;19:593-601.
Hoffmann CJ, Seaberg EC, Young S, et al. Hepatitis B and long-term HIV outcomes in coinfected HAART AIDS. 2009;23:1881-9.
Ji DZ, Pang XY, Shen DT, et al. Global prevalence of occult hepatitis B: A systematic review and meta-analysis. J Viral 2022;29:317-329.
Wong GL, Wong VW, Yuen BW, et Risk of hepatitis B surface antigen seroreversion after corticosteroid treatment in patients with previous hepatitis B virus exposure. J Hepatol. 2020;72:57-66.
Kim WR, Berg T, Asselah T, et al. Evaluation of APRI and FIB-4 scoring systems for non-invasive assessment of hepatic fibrosis in chronic hepatitis B patients. J Hepatol. 2016;64:773-80.
Qi X, An M, Wu T, et Transient Elastography for significant liver fibrosis and cirrhosis in chronic hepatitis B: A meta-analysis. Can J Gastroenterol Hepatol. 2018;2018:3406789.
Sterling RK, King WC, Wahed AS, et al. Evaluating noninvasive markers to identify advanced fibrosis by liver biopsy in HBV/HIV co-infected Hepatology. 2020;71:411- 421.
Chen B, Ye B, Zhang J, et al. RDW to platelet ratio: a novel noninvasive index for predicting hepatic fibrosis and cirrhosis in chronic hepatitis PLoS One. 2013;8:e68780.
Yu K, Du Z, Li Q, et Comparison of non-invasive models for predicting liver damage in chronic hepatitis B patients. Gastroenterol Hepatol. 2019;42:281-288.
European Association for the Study of the Liver. EASL 2017 Clinical practice guidelines on the management of hepatitis B virus infection. J Hepatol. 2017;67:370-398.
Boyd A, Dezanet LNC, Lacombe K. Functional cure of hepatitis B virus infection in individuals with HIV-coinfection: a literature Viruses. 2021;13:1341.
Rouphael NG, Talati NJ, Rimland Hepatitis B reverse seroconversion in HIV-positive patients: case series and review of the literature. AIDS. 2007;21:771-4.
Manegold C, Hannoun C, Wywiol A, et al. Reactivation of hepatitis B virus replication accompanied by acute hepatitis in patients receiving highly active antiretroviral therapy. Clin Infect 2001;32:144-8.
Launay O, van der Vliet D, Rosenberg AR, et al. Safety and immunogenicity of 4 intramuscular double doses and 4 intradermal low doses vs standard hepatitis B vaccine regimen in adults with HIV-1: a randomized controlled JAMA. 2011;305:1432-40.
Panel de expertos del Grupo de estudio de SIDA (GeSIDA) y de la Sociedad Española de Medicina de Familia y Comunitaria (semFYC). Manejo compartido del paciente con infección por VIH entre atención primaria y hospitalaria, Madrid; Feb disponible en: https://gesida-seimc.org/wp-content/uploads/2022/02/manejo-compartido-del-paciente- con-infeccion-por-vih.pdf. [Consultado el 02/06/2022].
Lieveld FI, Smit C, Richter C, et Liver decompensation in HIV/Hepatitis B coinfection in the combination antiretroviral therapy era does not seem increased compared to hepatitis B mono-infection. Liver Int. 2019;39:470-483.
Kim HN, Newcomb CW, Carbonari DM, et al. Risk of HCC with hepatitis B viremia among HIV/HBV-coinfected persons in North Hepatology. 2021;74:1190-1202.
Lok AS, Perrillo R, Lalama CM, et al. Low Incidence of Adverse Outcomes in Adults With Chronic Hepatitis B Virus Infection in the Era of Antiviral Therapy. Hepatology. 2021;73(6):2124-2140.
Demosthenes JP, Fletcher GJ, Zachariah UG, et al. Chronic Immune Activation Among Treatment Naïve HIV/HBV Coinfected Individuals From Southern India. Curr HIV Res. 2021;19(4):332-341.
Surial B, Béguelin C, Chave JP, et al. Brief report: switching from TDF to TAF in HIV/ HBV-coinfected Individuals with renal dysfunction- a prospective cohort study. J Acquir Immune Defic 2020;85:227-232.
Ratcliffe L, Beadsworth MB, Pennell A, at al. Managing hepatitis B/HIV co-infected: adding entecavir to truvada (tenofovir disoproxil/ emtricitabine) experienced patients. 2011;25:1051-6.
Papatheodoridis G, Dalekos G, Sypsa V, et al. PAGE-B predicts the risk of developing hepatocellular carcinoma in Caucasians with chronic hepatitis B on 5-year antiviral J Hepatol. 2016;64:800-6.
Wandeler G, Mauron E, Atkinson A, et al. Incidence of hepatocellular carcinoma in HIV/HBV-coinfected patients on tenofovir therapy: Relevance for screening strategies. J 2019;71:274-280.
Sun J, Althoff KN, Jing Y, et al. Trends in hepatocellular carcinoma incidence and risk among persons with HIV in the US and Canada, 1996-2015. JAMA Netw Open. 2021;4:e2037512.
Khalili M, King WC, Kleiner DE, et al. Fatty liver disease in a prospective North American cohort of adults with human immunodeficiency virus and hepatitis B virus Clin Infect Dis. 2021;73:e3275-e3285.
Peleg N, Issachar A, SnehArbib O, et al. Liver steatosis is a strong predictor of mortality and cancer in chronic hepatitis B regardless of viral JHEP Rep. 2019;1(1):9-16.
Shen DT, Han PC, Ji DZ, et al. Epidemiology estimates of hepatitis D in individuals co-infected with human immunodeficiency virus and hepatitis B virus, 2002-2018: A systematic review and meta-analysis. J Viral Hepat. 2021;28:1057-1067.
Puoti M, Rossi S, Forleo MA, et al. Treatment of chronic hepatitis D with interferon alpha-2b in patients with human immunodeficiency virus J Hepatol. 1998;29:45- 52.
Ferrante ND, Lo Re V . Epidemiology, natural history, and treatment of hepatitis delta virus Infection in HIV/hepatitis B virus Curr HIV/AIDS Rep. 2020;17:405-414.
Wedemeyer H, Bogomolov P, Blank A, et Efficacy and safety of bulevirtide monotherapy given at 2 mg or 10 mg dose level once daily for treatment fo chronic hepatitis delta: week 48 primary end point results froma a phase III randomized , multicenter, parallel design study. International Liver Congress, London, 2022 [Abstract GS006].
4. HEPATITIS C
4.1. Epidemiología y consideraciones especiales en el paciente VIH
4.2. Cribado y diagnóstico
4.3. Procedimientos para estimación de la fibrosis
4.4. Hepatitis C de reciente adquisición (HCRA): definición y tratamiento
4.5. Tratamiento de la hepatitis crónica C
4.6. Monitorización post-respuesta
4.7. Tratamiento antirretroviral durante el tratamiento del VHC
Epidemiología y consideraciones especiales en el paciente VIH
Hasta fechas muy recientes, la coinfección por el VHC era una de las comorbilidades más frecuentes en PVVIH en nuestro medio, a lo que se añadía un cambio en la historia natural de la hepatopatía, acelerando la progresión a la cirrosis con el consiguiente aumento de la mortalidad hepática y de cualquier causa. Actualmente, la prevalencia de infección activa por el VHC ha descendido marcadamente. A ello han contribuido factores como el abandono de la drogadicción por vía intravenosa y, de manera fundamental, la aparición y el amplio uso de los AAD, que han contribuido decisivamente a la microeliminación del VHC en algunas poblaciones.
Datos recientes de la cohorte de Gesida 8514, que monitoriza periódicamente la prevalencia de la coinfección VIH/VHC en España, muestran que en el año 2019 la prevalencia de anticuerpos frente al VHC en PVVIH fue de 28,6%, y solo el 2,2% presentaban ARN-VHC detectable en plasma1, siendo las prevalencias previas en 2015 del 37,7% y el 22,1% respectivamente.
Sin embargo, y a pesar de esta drástica reducción de la hepatitis crónica C, desde el año 2000 se ha descrito un aumento en la incidencia de nuevas infecciones por el VHC, en forma de hepatitis aguda o de infección reciente 2, entre HSH con prácticas sexuales de alto riesgo, incluido chemsex, que afecta tanto a PVVIH como a personas sin VIH, particularmente en las grandes ciudades del norte de Europa, Estados Unidos y Australia. En España también se ha observado este fenómeno 3.
Cribado y diagnóstico
El VIH y el VHC comparten vías de transmisión, por lo que es necesario descartar la infección por VHC en todas las PVVIH en el momento del diagnóstico 4.
Por otro lado, dado que la curación de la hepatitis C no produce inmunidad permanente, es necesario mantener estrategias de cribado periódico especialmente en personas con alto riesgo de reinfección como los UDI o HSH con prácticas sexuales de riesgo. En concreto, personas con múltiples parejas sexuales, con ITS de repetición y/o usuarios de chemsex con el fin de diagnosticar y tratar de manera precoz y reducir la transmisión 456.
El diagnóstico se basa inicialmente en la realización de una prueba de anticuerpos frente al VHC y, en caso de ser positiva, se debe establecer si existe replicación
activa del virus determinando el ARN-VHC o el antígeno core (Ag Core), en la misma muestra, si es posible. La determinación del genotipo no es necesaria la mayor parte de las veces, ya que los tratamientos actuales son pangenotípicos. Su principal interés es, por tanto, de carácter epidemiológico. En caso de que se decida realizar la determinación del genotipo, la espera del resultado no debe retrasar el inicio del tratamiento.
En PVVIH infectadas por el VHC el primer test que se positiviza es el ARN-VHC, por lo general en el primer mes, mientras que los anticuerpos son menos sensibles para la infección aguda, con solo 20-25% de positividad en el momento del primer ARN-VHC positivo 7. Para los pacientes ya infectados previamente y con infección resuelta, el único test fiable para diagnosticar nueva infección es el ARN-VHc 8.
Procedimientos para estimación de la fibrosis
Estimar el grado de fibrosis es esencial en personas infectadas por el VHC ya que la presencia de cirrosis indica mayor riesgo de desarrollo de complicaciones hepáticas y condiciona el tratamiento a elegir y el seguimiento posterior (ver capítulo 7).
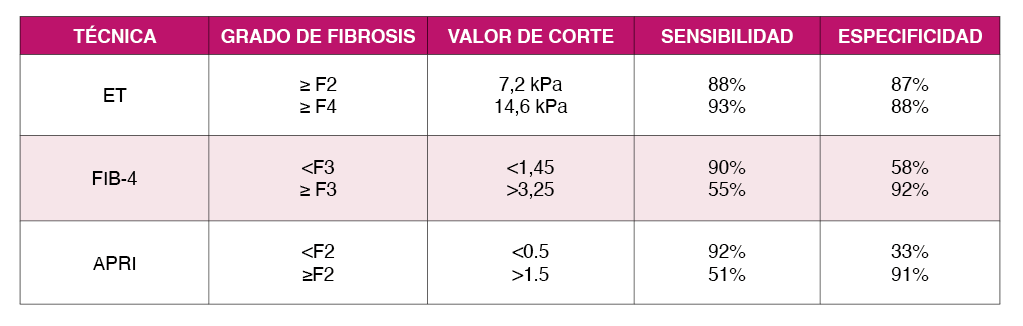
Múltiples pruebas no invasivas han demostrado buena fiabilidad a la hora de estimar la presencia de fibrosis avanzada. Esto ha convertido a la biopsia hepática en algo excepcional, usándose casi exclusivamente en casos de etiología no aclarada 9. En los últimos años se han validado diferentes marcadores séricos como el Fibrometer®, Fibrotest®, el cociente AST/plaquetas (APRI) o el FIB-4, además de la ET y las pruebas de imagen como la ecografía o el TAC. Los marcadores séricos tienen una precisión diagnóstica aceptable para identificar a PVVIH con infección por VHC con fibrosis significativa (F≥2) y pacientes con fibrosis avanzada (≥F3) (Tabla 1). Sin embargo, son menos fiables para identificar cirrosis 10. La ET pueden obtener determinaciones fiables de rigidez hepática en >90% de los casos, permite diferenciar a pacientes sin fibrosis de pacientes con fibrosis avanzada o cirrosis (VPN >90%) y ha sido validado en PVVIH. Por todo ello, se considera el método de elección para el diagnóstico de estimación no invasiva de la fibrosis 11. Además, la evaluación de la rigidez hepática aporta información pronóstica más allá de la clasificación histológica de la rigidez (ver capítulo 7). En algunos casos como en pacientes con colestasis obstructiva, ingesta reciente de alimentos, ejercicio reciente o congestión venosa se puede sobrestimar la fibrosis. Por ello, las determinaciones de rigidez hepática deben realizarse en ayunas y sin haber hecho ejercicio físico. Además, debe interpretarse con cautela el resultado en personas con insuficiencia cardíaca o colestasis. Cuando existen dificultades diagnósticas, se recomienda combinar marcadores séricos con la valoración de la rigidez hepática, repetidos en varias ocasiones. La (Tabla 1) resume las características diagnósticas de las principales técnicas no invasivas para estimar la fibrosis en PVVIH.
Hepatitis C de reciente adquisición (HCRA): definición y tratamiento
En los últimos años se ha acuñado el término de HCRA frente al de hepatitis aguda 2. Se considera que un paciente tiene HCRA cuando presenta IgG anti-VHC positiva de nueva aparición en el último año o en pacientes que tenían anti-VHC positivo previo sin evidencia de replicación viral que presentan ARN-VHC o el Ag-Core detectable en el último año.
En PVVIH con HCRA, las tasas de aclaramiento espontáneo son bajas 3 y estudios recientes sugieren que tratar de manera inmediata la infección por VHC tras su diagnóstico (“diagnosticar y tratar”) es una estrategia coste-eficaz en términos de beneficio individual y epidemiológico 12 y retrasar el inicio del tratamiento puede aumentar el número de pacientes que se pierden durante el seguimiento 13.
Con las pautas actuales de tratamiento frente a la hepatitis crónica se obtienen tasas de eficacia mayores del 90% en pacientes con HCRA tratados de manera precoz 313. Algunos estudios pequeños han evaluado la eficacia de tratamientos más cortos con las pautas recomendadas actualmente (SOF/VEL o GLE/PIB) 1415 Los resultados han sido discrepantes, por lo que de momento no existe suficiente evidencia para tratar de manera diferente a las PVVIH con HCRA respecto a los pacientes con hepatitis C crónica.
Tratamiento de la hepatitis crónica C
La curación de la hepatitis crónica C en PVVIH disminuye la inflamación hepática, la progresión a cirrosis y la mortalidad de causa hepática y no hepática en cualquier estadio de la enfermedad por lo que el tratamiento debe ser una prioridad(16. La eficacia del tratamiento con AAD ha resultado similar en PVVIH y en personas sin infección por VIH en casi todos los estudios 1718.
Ante un paciente coinfectado VIH/VHC que no está recibiendo ningún tratamiento antirretroviral, el documento de consenso de GeSIDA/PNS sobre el TAR en adultos recomienda iniciar primero el TAR y tras comprobar tolerancia iniciar tratamiento frente al VHC 19. En pacientes con alto riesgo de transmisión es conveniente tratar el VHC tan pronto como sea posible para evitar el riesgo de transmisión.
4.5.1 Tratamiento en pacientes sin experiencia previa con AAD
En pacientes naive a AAD, no cirróticos, el tratamiento actual del VHC ofrece una eficacia mayor al 95% con regímenes cortos con medicamentos coformulados y pangenotípicos20 Las pautas pangenotípicas SOF/VEL (400 mg/100 mg) 1 comp al día durante 12 semanas o GLE/PIB (100 mg/40 mg) 3 comp al día durante 8 semanas son actualmente las combinaciones de elección1213. Aunque otras combinaciones ofrecen eficacias similares, éstas ofrecen la ventaja de simplificar el tratamiento al no necesitar el genotipo para su inicio (Tabla 2).
En sujetos infectados por VHC naïve con genotipo no 3 sin cirrosis o con cirrosis en estadio Child-Pugh A, tanto SOF/VEL durante 12 semanas como GLE/PIB durante 8 semanas han demostrado eficacias cercanas al 100%212223. En pacientes cirróticos compensados que han recibido previamente tratamiento con interferón y/o SOF no existen ensayos que valoren la eficacia de GLE/PIB administrado durante 8 semanas, pero sí hay datos de eficacias mayores al 98% alargando el tratamiento a 12 semanas21 (Tabla 2).
En sujetos infectados por VHC con genotipo 3 sin cirrosis la combinación SOF/ VEL 12 semanas y GLE/PIB 8 semanas han demostrado una eficacia similar a lo observado en otros genotipos2122 . Sin embargo, en pacientes cirróticos hay más dudas sobre el tratamiento óptimo y existe discrepancia entre las distintas guías1213 . Esto se debe a menores tasas de respuesta con SOF/VEL en pacientes que tienen la variación Y93H en el gen que codifica la proteína NS5A 24. El panel, siendo consciente de esta limitación, ha decidido simplificar la recomendación de tratamiento a SOF/VEL durante 12 semanas independientemente de la existencia de la variación en base a los siguientes puntos: en primer lugar, los estudios en vida real en pacientes con genotipo 3 tratados con esta pauta, en los que no se conoce si tienen resistencias previas, han mostrado tasas de RVS muy elevadas25 . En segundo lugar, la prevalencia de esta variación es baja y en la mayoría de los centros existe poca accesibilidad a laboratorios que determinen resistencias a AAD por lo que no es una información con la que se pueda contar para decidir la pauta de tratamiento. Por último, en el caso de que el paciente fracasase con SOF/VEL 12 semanas existen pautas de rescate con altas tasas de eficacia26.
Respecto a la combinación GLE/PIB en pacientes con genotipo 3 cirróticos compensados, ha resultado eficaz cuando se administra durante 8 semanas23 Sin embargo, en pacientes cirróticos con experiencia previa (IFN+ SOF o IFN+ telaprevir o boceprevir) un análisis combinado de varios estudios fase 2-3, se observaron tasas de respuesta menores (cercanas al 90%) en estos grupos27 y de momento no se ha demostrado que la duración de 12 semanas sea no inferior a 16 semanas (Tabla 2). Por otra parte, la presencia de la variación A30K en pacientes con genotipo 3 disminuyó las tasas de RVS a GLE/PIB durante 8 semanas 28 . Dada la baja frecuencia de esta variación y la inconveniencia que supone evaluarla en sujetos pretratados, además de que se dispone de combinaciones para rescatar a los fracasos a GLE/PIB, el panel ha decidido recomendar la opción simplificada de tratamiento con GLE/PIB durante 8 semanas en genotipo 3, sin evaluar variaciones asociadas con resistencia.
4.5.2 Tratamiento en pacientes con cirrosis hepática descompensada
En pacientes con cirrosis avanzada (Child-Pugh B o C, o descompensación previa) la curación del VHC también ha demostrado mejoría de la morbimortalidad hepática. La mejoría de función hepática en pacientes pendientes de trasplante hepático ha llevado su salida de la lista de espera 2930 por lo que en situación de cirrosis descompensada deben hacerse todos los esfuerzos por tratar la infección por VHC.
El tratamiento con AAD en esta población tiene algunas consideraciones:
- Los niveles sanguíneos de los IP (GLE, GZR, PTV y VOX) aumentan y en algunos casos se han asociado con riesgo de descompensación hepática, por tanto, su uso está contraindicado12
- Son pacientes con peores tasas de RVS por lo que son necesarias pautas más largas y/o añadir RBV. El estudio ASTRAL 4, que evaluó la eficacia SOF/ VEL en cirrosis descompensada, mostró que los pacientes que recibieron SOF/ VEL más RBV durante 12 semanas obtuvieron mayores tasas de RVS (94%) que los que sólo recibieron SOF/VEL durante 12 semanas (83%). La rama que estudió la pauta de SOF/VEL 24 semanas sin RBV obtuvo una respuesta intermedia (86%) 31 Si se decide tratamiento con RBV se puede comenzar con 600 mg/día e ir aumentando según tolerancia.
4.5.3 Retratamiento en pacientes con fracaso previo a AAD
La combinación SOF/VEL/VOX (400 mg/100 mg/100 mg) un comprimido al día durante 12 semanas en pacientes con fracaso previo a AAD ha logrado eficacias superiores al 90%26. Si el fracaso ha sido a GLE/PIB, la combinación GLE/PIB + SOF también ha demostrado ser eficaz32. En pacientes con múltiples fracasos, el estudio de resistencias del VHC a los AAD puede ser de utilidad a la hora de elegir el tratamiento, seleccionando al menos dos fármacos activos. Estos pacientes, se pueden beneficiar de alargar el tratamiento entre 16 y 24 semanas y/o añadir RBV. Es recomendable individualizar cada caso y consultar con centros con experiencia 33.
4.5.4 Tratamiento de los pacientes con insuficiencia renal
Las combinaciones pangenotípicas GLE/PIB y SOF/VEL pueden darse en pacientes con aclaramiento de creatinina >30 ml/min sin ajuste de dosis3435. Con aclaramientos menores existen más datos de eficacia y seguridad con la combinación GLE/PIB por lo que debe considerarse el tratamiento de elección. Los niveles de SOF se incrementan más de 30 veces cuando el aclaramiento de creatinina es menor a 30 ml/min, sin embargo, los datos existentes de eficacia y seguridad son buenos, por lo que la combinación SOF/VEL puede usarse como alternativa cuando no se pueda usar GLE/PIB. El uso de RBV en pacientes con aclaramiento de creatinina menor a 50 ml/min está contraindicado.
Monitorización post-respuesta
La RVS 12 semanas tras completar el tratamiento supone la curación de la infección. La recidiva del VHC después de la semana 12 del fin del tratamiento con AAD es anecdótica y debe hacer descartar reinfección por VHC36.
Tratamiento antirretroviral durante el tratamiento del VHC
Los AAD interaccionan con múltiples fármacos al metabolizarse por vías hepáticas modificadas por otros fármacos o inhibir ellos mismos algunas vías metabólicas. En PVVIH hay que tener especial cuidado con los fármacos que llevan potenciadores como RIT o COBI. Además, es importante tener en cuenta que otros fármacos, drogas recreacionales y productos de herbolario pueden interaccionar con los AAD, por lo que debemos revisar estas interacciones antes de iniciar el tratamiento del VHC. Existen múltiples webs de interacciones validadas para su uso 37.
Recomendaciones:
- A las PVVIH se les debe realizar el cribado del VHC en el momento del diagnóstico del VIH con serología del VHC y, si esta es positiva, establecer si existe infección activa con la determinación del ARN-VHC o Ag-Core (A-II).
- Debe repetirse el cribado cada 6 o 12 meses en pacientes con riesgo de reinfección: Usuarios de drogas activos y HSH con múltiples parejas sexuales, consumo de chemsex o ITS de repetición (A-II). Este cribado se hará mediante Ac anti-VHC en PVVIH con Ac negativos previos y mediante ARN-VHC o Ag Core en PVVIH con anti-VHC positivo previamente (A-II).
- Se debe evaluar el estadio de fibrosis en todos los pacientes infectados por el VHC con métodos no invasivos (A-II).
- En pacientes con HCRA el tratamiento debe iniciarse de manera precoz sin esperar al posible aclaramiento espontáneo (A-III).
- En la HCRA se recomiendan los mismos regímenes y la misma duración de tratamiento que para la infección crónica (A-I).
- Todas las PVIH con hepatitis crónica C deben recibir tratamiento con AAD, independientemente del grado de fibrosis (A-II).
- Para el inicio del tratamiento del VHC no es necesario disponer del genotipo del VHC (B-I). Si se decide realizar genotipo en ningún caso debe demorar el inicio del tratamiento (B-II).
- Se debe revisar la posible interacción entre el TAR y los AAD, así como otros fármacos concomitantes, antes de iniciar el tratamiento del VHC (A-III).
- Los pacientes que no hayan recibido tratamiento previo con AAD no cirróticos se tratarán con SOF/VEL durante 12 semanas o GLE/PIB durante 8 semanas (A-I).
- Los pacientes con cirrosis compensada (Child-Plugh A) se tratarán con SOF/ VEL durante 12 semanas o GLE/PIB, durante 8 semanas si no han sido previamente tratados y durante 12 semanas si se han tratado anteriormente con IFN + SOF o IPs de primera generación (A-I).
- En pacientes con cirrosis en estadio Child-Pugh B ó C está contraindicado el uso de inhibidores de proteasa (A-I).
- En pacientes con cirrosis en estadio Child-Pugh B ó C se recomienda el tratamiento con SOF/VEL + RBV (1000 mg si <75 kg o 1200 si >75 Kg) durante 12 Si la RBV está contraindicada se recomienda prolongar el tratamiento con SOF/VEL durante 24 semanas (A-I).
- En pacientes que han fracasado a pautas previas con AAD, el tratamiento de elección es la combinación SOF/VEL/VOX durante 12 semanas (A-I).
- A partir del segundo fracaso a AAD, se recomienda realizar test de resistencias y seleccionar el tratamiento intentando incluir en el régimen dos fármacos activos de diferentes familias (B-II).
- En pacientes con insuficiencia renal si el aclaramiento de creatinina es mayor 30 ml/min se puede administrar SOF/VEL o GLE/PIB sin ajuste de Cuando el aclaramiento es menor 30 ml/min se recomienda como primera opción GLE/PIB (A-I).
Tablas:

*Experiencia previa con combinaciones que incluyan SOF+RBV, SOF+Peg IFN+ RBV o Peg IFN+ RBV + TPV o BOC.
** Si se conoce genotipo se puede prolongar el tratamiento a 16 semanas en pacientes con genotipo 3.
^ Las dosis de RBV son 1000 mg/día (<75Kg) 1200 mg/día (≥75 Kg). Se puede empezar con 600 mg e ir aumentando según tolerancia.
Bibliografía:
Fanciulli C, Berenguer J, Busca C, et Epidemiological trends of HIV/HCV coinfection in Spain, 2015–2019. HIV Medicine 2022; Jan 17. doi:10.1111/hiv.13229.
European Treatment Network for HIV, Hepatitis and Global Infectious Diseases (NEAT-ID) Consensus Panel. Recently acquired and early chronic hepatitis C in MSM: recommendations from the European treatment network for HIV, hepatitis and global infectious diseases consensus AIDS 2020, 34:1699–1711
Martín-Carbonero L, Gutierrez-Liarte A, Bisbal O, et Acute hepatitis C: epidemiological characteristics and treatment response in a large cohort of MSM living with HIV in Madrid. PE3/68. Comunicación presentada al 18th European AIDS Conference. Londres 2021.
European Centre for Disease Prevention and Control. Hepatitis B and C epidemiology in selected population groups in the EU/EEA. Stockholm: ECDC; 2018 disponible en https://www.ecdc.europa.eu/sites/default/files/documents/Hepatitis-B-C-epidemiology-in- selected-populations-in-the-EU.pdf
Grov C, Westmoreland DA, Carrico AW and Nash D. Are we on the precipice of a new epidemic? Risk for Hepatitis C among HIV-negative men-, trans women-, and trans men- who have sex with men in the United AIDS Care 2020; May; 32 (SUP2): 74–82. do i:10.1080/09540121.2020.1739204.
Burton MJ, Olivier J, Mena Characteristics of hepatitis C virus coinfection in a human immunodeficiency virus-infected population with lower reported rates of injection drug use. Am J Med Sci 2009; 338: 54–56)
Nastouli E, Thomson EC, Karayiannis P, et al. Diagnosing acute hepatitis C in HIV- infected patients: Nucleic acid testing compared with antibody and antigen–antibody detecting J Clin Virol 2009; 44: 78–80.
Public health guidance on HIV, hepatitis B and C testing in the EU/EEA. European Centre for Disease Prevention and Control, 2018. Disponible en https://www.ecdc.europa. eu/sites/default/files/documents/hiv-hep-testing-guidance_0.pdf
European Association for the Study of the Liver. EASL Clinical Practice Guidelines on non-invasive tests for evaluation of liver disease severity and prognosis – 2021 Journal of Hepatology 2021; 75: 659–689
Macías J, Girón-González JA, González-Serrano M, et al. Prediction of liver fibrosis in human immunodeficiency virus/hepatitis C virus coinfected patients by simple non- invasive Gut 2006;55:409-14.
Vergara S, Macías J, Rivero A, et The use of tranient elastometry for assessing liver fibrosis in patients with HIV and hepatitis C virus coinfection. Clin Infect Dis 2007;45:969- 974.
European Association for the Study of the EASL recommendations on treatment of hepatitis C: Final update of the series. Journal of Hepatology 2020 vol. 73 j 1170–1218
AASLD-IDSA Hepatitis C Guidance Hepatitis C Guidance 2019 Update: American Association for the Study of Liver Diseases–Infectious Diseases Society of America Recommendations for Testing, Managing, and Treating Hepatitis C Virus Infection. Hepatology 2020; 71 (2): 686-721
Matthews GV, Bhagani S, Van der Valk M, et al. Sofosbuvir/velpatasvir for 12 vs. 6 weeks for the treatment of recently acquired hepatitis C J Hepatol 2021;75(4):829-839.
Martinello M, Orkin C, Cooke G, et al. Short-duration pan-genotypic therapy with glecaprevir/pibrentasvir for 6 weeks among people with recent hepatitis C viral infection. Hepatology 2020;72:7–18.
Berenguer J, Álvarez-Pellicer J, Martín PM, et Sustained virological response to interferon plus ribavirin reduces liver-related complications and mortality in patients coinfected with human immunodeficiency virus and hepatitis C virus. Hepatology 2009;50:407-413.
Montes ML, Olveira A, Ahumada A, et al. Similar effectiveness of direct-acting antiviral against hepatitis C virus in patients with and without HIV AIDS 2017; 31(9):1253- 1260.
Berenguer J, Gil-Martín A, Jarrín I, et al; All-oral direct-acting antiviral therapy aganist hepatitis C virus (HCV) in human immunodeficiency virus/HCV-coinfected subjects in real- world practice: Madrid coinfection registry findings. Hepatology 2018;68:32-47.
Documento de consenso de GeSIDA/Plan Nacional sobre el SIDA respecto al tratamiento antirretroviral en adultos infectados por el virus de la inmunodeficiencia En https://gesida-seimc.org/wp-content/uploads/2022/05/GuiaGeSIDAPlan NacionalSobreElSidaRespectoAlTratamientoAntirretroviralEnAdultosInfectadosPor ElVirusDeLaInmunodeficienciaHumanaActualizacionEnero2022.pdf (acceso Julio 2022).
Falade-Nwulia O, Suarez-Cuervo C, Nelson DR, et Oral direct-acting agent therapy for hepatitis C virus infection: a systematic review. Ann Intern Med 2017;166:637-648.
Hezode C, Reau N, Svarovskaia ES, et al. Resistance análisis in patients with genotype 1-6 HCV infection treated with sofosbuvir/velpatasvir in phase III studies. J Hepatol 2018;68:895-903.
Rockstroh J, Lacombe K, Viani R, et Efficacy and safety of Glecaprevir/Pibrentasvir in patients coinfected with hepatitis C virus and human immunodeficiency virus type 1: the EXPEDITION-2 Study. Clin Infect Dis 2018;14;67:1010-17.
Brown R, Buti M, Rodrigues L, et Glecaprevir/pibrentasvir for 8 weeks in treatment-naïve patients with chronic HCV genotypes 1-6 and compensatd cirrhosis: The EXPEDITION-8 trial. Journal of hepatology 2020;72:441-9.
Foster GR, Afdhal NH, Roberts SK. Sofosbuvir and velpatasvir for HCV genotype 2 and 3 N Engl J Med. 2015;373(27):2608-2617.
Mangia A, Milligan S, Khalili M, et al. Global real-world evidence of sofosbuvir/ velpatasvir as simple, effective HCV treatment: Analsis of 5552 patients form 12 cohorts. Liver Int 2020;40:1841-1852.
Bourliere M, Gordon SC, Flamm SL, et Sofosbuvir, velpatasvir, and voxilaprevir for previously treated HCV infection. N Engl J Med 2017;376(22):2134-2146.
Krishnan P, Schnell G, Tripathi R, et al. Pooled resistance analysis in HCV genotype 1-6 infected patients treated with glecaprevir/pibrentasvir in phase 2 and 3 clinical J Hepato2017;66(Suppl. 1): S500.
Zeuzem S, Foster GR, Wang S, et al. Glecaprevir-Pibrentasvir for 8 or 12 Weeks in HCV Genotype 1 or 3 N Engl J Med. 2018; 378: 354-369.
Bittermann T, Reddy In the era of direct-acting antivirals, liver transplant delisting due to clinical improvement for hepatitis C remains infrequent. Clin Gastroenterol Hepatol. 2020;S1542-3565(20):31294-5.
Pascasio JM, Vinaixa C, Ferrer MT, et al. Clinical outcomes of patients undergoing antiviral therapy while awaiting liver J Hepatol. 2017; 67:1168-1176.
Curry MP, O’Leary JG, Bzowej N, et Sofosbuvir and velpatasvir for HCV in patients with decompensated cirrhosis. N Engl J Med 2015;373:2618–2628.
Wyles D, Weiland O, Yao B, et al. Retreatment of patients who failed glecaprevir/ pibrentasvir treatment for hepatitis C virus J Hepatol 2019;70(5):1019-1023.
Howe A, Rodrigo C, Cunningham E, et Characterisics of hepatitis C virus resistance in an international cohort after a decade of direct-acting antifirals. J Hep Rep 2022;4:1000462.
Gane E, Lawitz E, Pugatch D, et Glecaprevir and pibrentasvir in patients with HCV and severe renal impairment. N Engl J Med. 2017;377(15):1448-1455.
Borgia SM, Dearden J, Yoshida EM, et al. Sofosbuvir/velpatasvir for 12 weeks in hepatitis C virus-infected patients with end-stage renal disease undergoing dialysis. J Hepatol 2019;71:660–665.
Sarrazin C, Isakov V, Svarovsdaia Late relapse versus hepatitis C virus reinfection in patients with sustained virologic response after sofosbuvir-based therapies. Clin Infect Dis 2017;64(1):44-52.
5. HEPATITIS E
5.1. Epidemiología y consideraciones especiales en el paciente VIH
5.2. Formas clínica
5.3. Cribado y Diagnóstico
5.4. Tratamiento de la infección crónica
5.5. Prevención y vacunación
Epidemiología y consideraciones especiales en el paciente VIH
El VHE presenta una vía de transmisión y distribución geográfica bien diferenciada en función del genotipo viral. Mientras que los genotipos 1 y 2 se transmiten por vía fecal-oral a partir del agua contaminada, principalmente en Asia y África afectando exclusivamente al ser humano, los genotipos 3 a 8 son zoonóticos y se transmiten por el consumo de alimentos derivados de animales infectados, principalmente cerdo y carne de caza 1. El genotipo 3 presenta una distribución Mundial y es el dominante en Europa. Para este genotipo, existen otras vías de transmisión secundarias como son el trasplante de órganos y la transfusión de hemoderivados, o el consumo de algunos alimentos como la leche, moluscos y vegetales contaminados con heces 1.
En España, la seroprevalencia de la infección por el VHE es muy similar en población general y en población infectada por VIH (15 % vs. 11,9%) según los datos procedentes del 2º Estudio de seroprevalencia en España del Ministerio de Sanidad y de la Red de Investigación en SIDA 23. Por tanto, no existen evidencias de que los pacientes infectados por el VIH sean una población de riesgo para la infección por el VHE 1.
Formas clínica
Las manifestaciones clínicas de la infección por el VHE son muy variables abarcando desde formas subclínicas, hasta cuadros sintomáticos (a veces graves) como hepatitis aguda y fallo hepático agudo4. Además, la infección aguda puede cursar con manifestaciones extrahepáticas graves incluso sin afección de la función hepática, siendo bien conocidas las alternaciones del sistema nervioso central y periférico 45. Por otro lado, la infección aguda por el VHE puede incidir de forma desfavorable en el curso clínico de algunas comorbilidades, como sucede con las hepatopatías crónica, en las que se asocia a una mayor tasa de descompensación hepática y muerte45. El curso clínico en pacientes infectados por el VIH no difiere del descrito en la población general1 Sin embargo, dado que esta población presenta una alta prevalencia de fibrosis hepática avanzada por coinfección por otros virus hepatotropos, hace que la infección por el VHE sea un importante factor de riesgo de descompensación en esta población1.
En pacientes inmunodeprimidos, la infección aguda puede evolucionar a formas crónicas caracterizada por una rápida progresión de la fibrosis hepática y desarrollo de cirrosis y enfermedad hepática terminal5 Hasta el momento, se han descrito 12 casos de infección crónica en pacientes infectados por el VIH, presentando todos ellos un recuento de linfocitos CD4+ <200 células/mL1.
Cribado y Diagnóstico
En todos los pacientes inmunocompetentes con hepatitis aguda se debe de cribar el VHE. Este cribado debe de basarse en la determinación de anticuerpos de tipo IgM y ARN viral de manera conjunta56. El empleo de otros marcadores, como anticuerpos de tipo IgG o IgA, no han demostrado tener valor diagnóstico. Pese a que se ha detectado ARN viral en otras muestras como saliva, leche materna, orina, líquido cefalorraquídeo y heces, la muestra de referencia se considera la sangre periférica4. También debe de cribarse la infección por el VHE en pacientes con manifestaciones extrahepáticas asociadas al VHE45 . En pacientes inmunodeprimidos, como los pacientes infectados por el VIH con <200 CD4+ células/mL, debe de cribarse la infección por el VHE solo mediante la detección de ARN viral, debido a que puede existir un retraso o estar ausente la seroconversión de anticuerpos IgM 45.
La infección crónica se define como la persistencia del ARN viral en sangre periférica por más de 3 meses4 En pacientes inmunodeprimidos con o sin evidencias de daño hepático crónico, es aconsejable la determinación anual de ARN viral del VHE como parte del seguimiento clínico5.
Tratamiento de la infección crónica
Actualmente no existe un tratamiento específico frente a la infección por el VHE4. La experiencia derivada de cohortes de casos sugiere que el empleo de ribavirina 600 mg durante 12 semanas se asocia con aclaramiento viral sostenido en una importante proporción de pacientes5. El tratamiento con esta pauta solo se ha registrado en 6 pacientes infectados por el VIH1, derivándose toda la evidencia de pacientes trasplantados de órgano sólido7.
Prevención y vacunación
No existe una vacuna aprobada para su uso en población general ni en pacientes infectados por el VIH4. Por ello, las principales medidas de prevención pasan por minimizar el riesgo de transmisión, evitando el consumo de alimentos crudos o poco cocinados y agua no depurada, por ello ingerir productos del cerdo y de animales de caza poco cocinados, incluidos los embutidos, así como moluscos crudos, debe de ser evitado en pacientes con alto riesgo de padecer formas crónicas4. Recientemente, se ha evidenciado que pacientes con infección crónica por el VHE presentaban persistencia de ARN viral en el eyaculado8, lo cual podría conducir a la recomendación de usar métodos de barrera durante las relaciones sexuales de estos pacientes.
Recomendaciones
- Se debe de cribar infección por el VHE en todos los pacientes con hepatitis aguda (A-II).
- En los pacientes con cualquiera de las manifestaciones clínicas extrahepáticas que se han asociado con el VHE se recomienda el cribado de infección por VHE, incluso en ausencia de alteraciones hepáticas (B-II).
- Para el cribado debe de realizarse la determinación en paralelo de anticuerpos IgM y ARN viral (A-II).
- En pacientes inmunodeprimidos, por riesgo de evolución a formas crónicas, debe de realizarse el cribado anual de la infección mediante la determinación de ARN viral (A-II).
- El tratamiento de la infección crónica por el VHE es ribavirina 600 mg durante 12 semanas (A-II).
- La prevención de la infección por el VHE se debe basar en ofrecer información dirigida a evitar el contacto con las fuentes de infección (A-II).
- Las personas con riesgo elevado de desarrollar un curso grave de la infección o de cronificación de la misma (pacientes con hepatopatía base o inmunodeprimidas) deben estar específicamente informadas del riesgo (A-II).
Bibliografía:
Rivero-Juárez A, López-López P, Frias M, Rivero A. Hepatitis E Infection in HIV-Infected Patients. Front Microbiol. 2019; 10: 1425 doi:10.3389/fmicb.2019.01425.
2º ESTUDIO DE SEROPREVALENCIAENESPAÑA. Ministerio de Sanidad. Disponible en: https://www.sanidad.gob.es/profesionales/saludPublica/prevPromocion/vacunaciones/ comoTrabajamos/docs/EstudioSeroprevalencia_EnfermedadesInmunoprevenibles.pdf [Último acceso 16 de mayo 2022].
Rivero-Juarez A, Frias M, Lopez-Lopez P, et Hepatitis E 3ra Genotype Infection in People Living With HIV in Spain. Front Microbiol. 2020; 11: 564486. doi:10.3389/ fmicb.2020.564486
Rivero-Juárez A, Aguilera A, Avellón A, et Executive summary: Consensus document of the diagnosis, management and prevention of infection with the hepatitis E virus: Study Group for Viral Hepatitis (GEHEP) of the Spanish Society of Infectious Diseases and Clinical Microbiology (SEIMC). Enferm Infecc Microbiol Clin. 2020; 38 (1): 28-32. doi:10.1016/j.eimc.2018.06.014
European Association for the Study of the Liver; EASL Clinical Practice Guidelines on hepatitis E virus J Hepatol. 2018; 68 (6): 1256-1271. doi:10.1016/j. jhep.2018.03.005
Rivero-Juarez A, Lopez-Lopez P, Pineda JA, et al. Limited Value of Single Sampling for IgM Antibody Determination as a Diagnostic Approach for Acute Hepatitis E Virus Infection. Microbiol 2021; 9 (1): e0038221. doi:10.1128/Spectrum.00382-21
Kamar N, Abravanel F, Behrendt P, et al. Ribavirin for Hepatitis E Virus Infection After Organ Transplantation: A Large European Retrospective Multicenter Study. Clin Infect 2020; 71 (5): 1204-1211. doi:10.1093/cid/ciz953
Horvatits T, Wißmann JE, Johne R, et al. Hepatitis E virus persists in the ejaculate of chronically infected J Hepatol. 2021; 75 (1): 55-63. doi:10.1016/j.jhep.2020.12.030
6. HEPATOPATÍAS NO VÍRICAS
Enfermedad hepática metabólica
6.1.1 Epidemiología
Varios estudios indican que la prevalencia de la esteatosis hepática (EH) en las PVVIH es especialmente frecuente. En España, aproximadamente el 40% de las PVVIH presentan EH 1 Esta elevada prevalencia de EH en PVVIH se ha confirmado en otros países occidentales23. De hecho, la EHMet es el factor relacionado con la morbi-mortalidad hepática que más ha crecido en los últimos años a nivel global 4, convirtiéndose en la principal causa de trasplante hepático tanto en población general como en PVVIH en Estados Unidos5. En las PVVIH, las tasas reportadas de EH se acercan a las comunicadas en situaciones como la diabetes mellitus tipo 2 o la obesidad mórbida. Se desconoce el motivo de esta alta prevalencia. Se cree que cambios en los hábitos de vida interaccionando con factores heredados, así como la propia infección y tratamiento del VIH podrían tener un papel sinérgico sobre la emergencia de la EH.
6.1.2 Diagnóstico
La EHMet se define como la presencia de EH asociada con uno de los siguientes factores: sobrepeso u obesidad (definida como IMC ≥25 kg/m2 en caucásicos o IMC ≥23 kg/m2 en asiáticos), presencia de diabetes mellitus tipo 2 o evidencia de al menos 2 alteraciones metabólicas6. Con esta nueva definición, el consumo de alcohol ha dejado de ser un criterio de exclusión (Figura 1).
La EH consiste en un acúmulo excesivo de grasa en el hígado que suele ir acompañado de un aumento de la resistencia insulínica. El diagnóstico definitivo del espectro completo de EHMet, desde EH a esteatohepatitis con fibrosis, solo se puede realizar mediante una biopsia hepática donde se determine si existe esteatosis, apoptosis hepatocitaria, inflamación y fibrosis. La biopsia hepática tiene múltiples limitaciones y, además, es invasiva y no está exenta de complicaciones.
En lo que respecta a las pruebas de imagen, la ecografía abdominal es una técnica económica y accesible, aunque es muy dependiente de explorador y su sensibilidad es baja7. A pesar de ello, se ha propuesto como técnica de cribado de EHMet8. El parámetro de atenuación controlada (CAP) es una medida incorporada a la elastometría de transición (ET) que permite diagnosticar la esteatosis. Valores de CAP ≥248 dB/m son indicativos de presencia de ≥10% hepatocitos esteatósicos9. Tiene como ventajas un buen rendimiento diagnóstico, con sensibilidad 69% y especificidad 82% para identificar EH9, junto con la facilidad para realizarse dentro de la misma consulta en la que se atiende al paciente y para repetir mediciones a lo largo del tiempo, además de poderse determinar la rigidez hepática en la misma exploración. Está limitada por la necesidad de una ventana ecográfica, por lo que en personas con obesidad puede no ser posible obtener mediciones. La RM puede permitir la medición de la fracción de grasa hepática por medio de técnicas para estimar la fracción de la densidad protónica atribuible a la grasa. La RM con estimación de la fracción de grasa hepática es muy precisa, y se puede evaluar la rigidez hepática por medio de elastografía incorporada a la RM10. Sin embargo, es una técnica costosa y no fácilmente accesible, no disponible a pie de cama y no apropiada para personas con obesidad o claustrofobia.
Existen múltiples biomarcadores validados para evaluar la EH, pese a ello, a día de hoy las guías no recomiendan su uso para el diagnóstico de la EH ya que aportan poca información a las técnicas de imagen mencionadas previamente11 No obstante, la facilidad para calcular índices sencillos como el FLI o HSI puede permitir cribar a PVVIH12 en centros que no tengan acceso a técnicas de imagen. La combinación de dos o más biomarcadores han demostrado ser útiles para evaluar la EHMet en PVVIH con elevación de transaminasas. 13.
Los métodos para determinar el grado de fibrosis hepática no suelen diferir del resto de hepatopatías. Aunque la biopsia hepática sigue siendo el patrón oro, las limitaciones descritas previamente han convertido la ET en la técnica más usada. Se han propuesto los valores de corte de rigidez hepática siguientes en EHMet: F≥2, ≥7 kPa; F≥3, ≥8.7 kPa; F4, ≥10.3 kPa14 Un valor de rigidez hepática < 8 kPa descarta fibrosis significativa con un valor predictivo negativo superior al 90%14. En caso de no disponer de ET, existen marcadores serológicos que permiten valorar el grado de fibrosis. Por su sencillez de cálculo, basado en parámetros rutinarios, pueden emplearse FIB-4 y NFS para detectar y descartar F≥3 12.
6.1.3 Tratamiento
Los diferentes estudios realizados para encontrar fármacos para revertir la EHMet no han sido exitosos, por lo que actualmente no hay ningún fármaco aprobado para su manejo. El control del síndrome metabólico y el tratamiento de las comorbilidades son las únicas estrategias disponibles para tratar la EHMet. Concretamente, la reducción de peso se asocia con reversión del espectro de la EHMet, desde la EH a la esteatohepatitis y la fibrosis hepática15161718. En personas con obesidad mórbida tratadas con cirugía bariátrica, la esteatohepatitis y fibrosis mejoran como consecuencia de la pérdida de peso . 19.
En cuanto a fármacos que han demostrado una mejoría de la EHMet en PVVIH, la pioglitazona20 y la vitamina E21 se han asociado a disminución del valor del CAP a corto plazo. En personas sin VIH y con esteatohepatitis no alcohólica los agonistas del GLP-1, como liraglutida o semaglutida, han demostrado resolución de la esteatohepatitis en el 36-60% de los pacientes y mejoría de la fibrosis en el 33-43% de los sujetos2223. En PVVIH con EHMet, la tesamorelina, un análogo del factor humano liberador de la hormona de crecimiento, resolvió la EH en 35% de los sujetos, aunque no presentó un efecto significativo sobre la fibrosis24. Actualmente, ninguno de estos fármacos está aprobado para su uso en EHMet.
Los fármacos antirretrovirales con toxicidad mitocondrial y/o con un perfil lipídico desfavorable podrían tener un papel en la instauración de la EH. En PVVIH con EH, el cambio de efavirenz por raltegravir se ha asociado en un ensayo clínico a descensos en el valor del CAP25. En un análisis retrospectivo, se observó que los cambios de efavirenz por rilpivirina producían un efecto similar sobre el valor de CAP26. De igual manera, el cambio de inhibidores de la proteasa por raltegravir se ha asociado a descensos del valor del CAP27. No obstante, algunas cohortes han relacionado el uso de los inhibidores de la integrasa con un mayor riesgo de aparición de novo y/o la progresión de la EH2829 El TAF también se ha relacionado con un posible mayor riesgo de desarrollo de EH 28.
6.1.4 Repercusión clínica
Las personas con EHMet tienen un mayor riesgo cardiovascular en comparación con la población general, seguramente, debido a su asociación con el síndrome metabólico. El riesgo aumenta en aquellos pacientes con fibrosis avanzada y múltiples estudios han demostrado que los marcadores bioquímicos de aterosclerosis, así como las lesiones preaterogénicas son más prevalentes en las personas con EHMet30. De hecho, la enfermedad cardiovascular es la causa de muerte más frecuente en la EHMet. Por dicho motivo, se considera la EHMet como un factor de riesgo para la enfermedad coronaria31. Finalmente, las personas con EHMet y esteatohepatitis con fibrosis presentan un riesgo aumentado de eventos y muerte globalmente y por hepatopatía323334. En PVVIH, sin exposición a VHC o VHB ni hepatopatía alcohólica, la rigidez hepática predice el riesgo de muerte por cualquier causa .35.
Hepatitis autoinmunes y miscelánea
6.2.1 Hepatitis Otras hepatopatías crónicas
La infección por VIH no se asocia a un mayor o menor riesgo de padecer una hepatitis autoinmune. El diagnóstico y tratamiento de dicha entidad, no difiere del de la población general. Tan sólo se deben tener en cuenta las posibles interacciones entre el TAR y los fármacos inmunosupresores usados para el tratamiento de la hepatitis autoinmune, con tal de evitar la aparición de efectos secundarios.
6.2.2 Hepatopatía alcohólica
6.2.2.1 Epidemiologia y repercusión clínica
El abuso de alcohol y el VIH coexisten con frecuencia en el mismo individuo. Algunos estudios indican que aproximadamente el 50% de las PVVIH consumen alguna cantidad de alcohol36. Además, las tasas de consumo excesivo de alcohol entre las PVVIH son más altas que las de la población general36, en España un 5% de la población general presenta consumo de riesgo de alcohol (AUDIT ≥8 puntos en hombres y ≥6 en mujeres). Se ha comunicado un amplio rango de prevalencia de consumo excesivo regular, desde el 9% hasta 40- 50%36. El trastorno por consumo de alcohol es un importante factor de riesgo conductual asociado a una mayor incidencia de infección por VIH.
Las consecuencias deletéreas para la salud del alcohol son múltiples36. Se asocian estrechamente con el consumo de alcohol, enfermedades cardiovasculares, neurológicas y psiquiátricas, musculoesqueléticas, digestivas, y numerosos cánceres. En el hígado, puede producir cirrosis y CHC por sí mismo o potenciando a otras hepatopatías. En la era previa a los AAD, en la cohorte de veteranos de los EE.UU, un 1% presentaba cirrosis y un 30% de las cirrosis eran atribuibles al alcohol. Más recientemente, análisis de registros de personas en lista de trasplante hepático han mostrado un aumento de la demanda por HA, paralelo a la disminución de la cirrosis o HCC asociados al VHC37 No disponemos de información epidemiológica actualizada de la situación de la HA en las PVVIH.
La HA puede progresar de hígado graso alcohólico a esteatohepatitis alcohólica, que eventualmente puede conducir a cirrosis y, en algunos casos, a CHC38. La hepatitis aguda alcohólica, una forma grave de esteatohepatitis, es una descompensación clínica aguda asociada con insuficiencia hepática y alta mortalidad. La mayoría de las personas que consumen >40 g de alcohol por día desarrollan hígado graso alcohólico, pero solo un subgrupo de personas tendrá una enfermedad más avanzada. Los factores genéticos, epigenéticos y ambientales podrían explicar la considerable variación interindividual en el fenotipo HA38. No está establecido si la historia natural de la HA en las PVVIH presenta rasgos diferenciales.
6.2.2.2 Cuantificación y evaluación. Diagnóstico de la hepatopatía alcohólica
Una de las mayores barreras para establecer el diagnóstico de consumo de alcohol de riesgo y, en consecuencia, de hepatopatía alcohólica son las dificultades para cuantificar con fiabilidad el consumo de alcohol. Los cálculos de los gramos de alcohol ingeridos por día autorreferidos pueden dar lugar a infraestimar el consumo. El AUDIT fue desarrollado por la OMS como un método simple de detección del consumo excesivo de alcohol y para ayudar en una evaluación breve37. El AUDIT-C se desarrolló como versión aún más breve, con sólo tres preguntas, que se validó para la detección del consumo excesivo de alcohol y abuso/dependencia activa37.
En una PVVIH con datos de enfermedad hepática, en quien se han descartado coinfección por virus de las hepatitis, puede establecerse el diagnóstico de HA en presencia de un AUDIT-C ≥4 para hombres o ≥3 para mujeres39 Si se encuentra otra causa de enfermedad hepática, el consumo de alcohol puede considerarse contribuyente a la misma y probable factor de progresión.
6.2.2.3 Tratamiento de la hepatopatía alcohólica
Las PVVIH con trastorno por consumo de alcohol deben ser remitidas a centros de adicciones para su valoración y manejo. La mayoría de los efectos hepáticos perjudiciales del alcohol se resuelven con la abstinencia al mismo, incluyendo la cirrosis hepática37. La hepatitis aguda alcohólica es una urgencia médica que requiere ingreso hospitalario y manejo agresivo de sus complicaciones37.
Recomendaciones
- En todas las PVVIH debe evaluarse periódicamente, idóneamente cada 12- 24 meses, la presencia de hepatopatía no vírica, en general, y especialmente de EHMet y HA, incluyendo la determinación de rigidez hepática u otros marcadores no invasivos de fibrosis por su implicación pronóstica (A-II).
- El cribado de la EHMet puede realizarse en PVVIH utilizando CAP u otras técnicas de imagen. Los biomarcadores sencillos son técnicas alternativas, que pueden permitir reducir la demanda de técnicas de imagen (A-II).
- La pérdida de peso, junto con el control del resto de factores de riesgo metabólicos, es el primer escalón del tratamiento de la EHMet (A-I).
- El cambio de un TAR con toxicidad mitocondrial o perfil lipídico desfavorable como efavirenz o inhibidores de la proteasa por regímenes con menor toxicidad puede revertir la EH en PVVIH (A-II).
- En PVVIH con EHMet y diabetes mellitus tipo 2, se debe valorar el uso de pioglitazona o agonistas del GLP-1 por su potencial beneficio sobre la esteatohepatitis y/o fibrosis (A-I).
- La evaluación de la HA comprende la valoración periódica, al menos cada 12 meses, del consumo excesivo de alcohol por medio del AUDIT-C (A-II).
- El tratamiento de la HA es la abstinencia del Las PVVIH con trastorno por consumo de alcohol deben ser remitidas a centros de adicciones para su valoración y manejo (A-II).
Tablas:
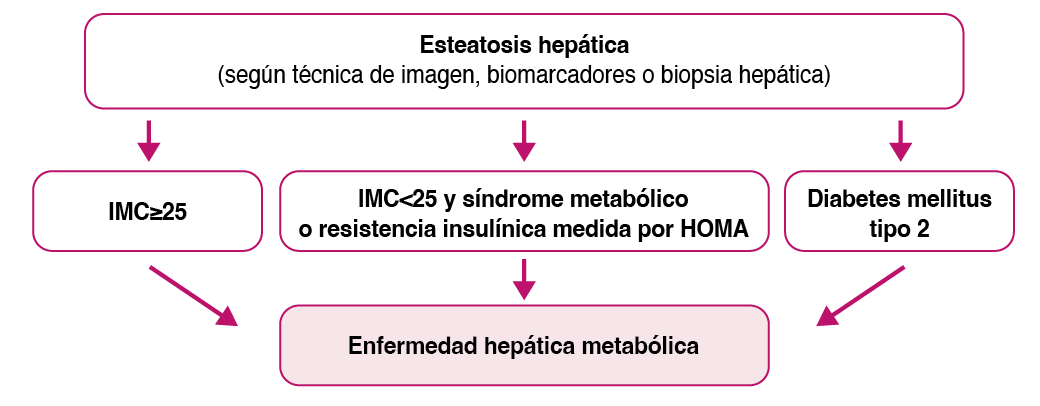
Bibliografía:
Macías J, González J, Tural C, et Prevalence and factors associated with liver steatosis as measured by transient elastography with controlled attenuation parameter in HIV- infected patients. AIDS. 2014;28(9):1279-1287. doi:10.1097/QAD.0000000000000248
Pembroke T, Deschenes M, Lebouché B, et al. Hepatic steatosis progresses faster in HIV mono-infected than HIV/HCV co-infected patients and is associated with liver J Hepatol. 2017;67(4):801-808. doi:10.1016/J.JHEP.2017.05.011
Mohr R, Boesecke C, Dold L, et al. Return-to-health effect of modern combined antiretroviral therapy potentially predisposes HIV patients to hepatic steatosis. Medicine (Baltimore). 2018;97(17). doi:10.1097/MD.0000000000010462
Paik JM, Golabi P, Younossi Y, Mishra A, Younossi Changes in the Global Burden of Chronic Liver Diseases From 2012 to 2017: The Growing Impact of NAFLD. Hepatology. 2020;72(5):1605-1616. doi:10.1002/HEP.31173
Campos-Varela I, Dodge JL, Terrault NA, Brandman D, Price Nonviral liver disease is the leading indication for liver transplant in the United States in persons living with human immunodeficiency virus. Am J Transplant. 2021;21(9):3148-3156. doi:10.1111/ AJT.16569
Eslam M, Newsome PN, Sarin SK, et al. A new definition for metabolic dysfunction- associated fatty liver disease: An international expert consensus statement. J Hepatol. 2020;73(1):202-209. doi:10.1016/J.JHEP.2020.03.039
Bril F, Ortiz-Lopez C, Lomonaco R, et al. Clinical value of liver ultrasound for the diagnosis of nonalcoholic fatty liver disease in overweight and obese patients. Liver Int. 2015;35(9):2139-2146. doi:10.1111/LIV.12840
Marchesini G, Day CP, Dufour JF, et EASL-EASD-EASO Clinical Practice Guidelines for the management of non-alcoholic fatty liver disease. J Hepatol. 2016;64(6):1388-1402. doi:10.1016/J.JHEP.2015.11.004
Karlas T, Petroff D, Sasso M, et Individual patient data meta-analysis of controlled attenuation parameter (CAP) technology for assessing steatosis. J Hepatol. 2017;66(5):1022-1030. doi:10.1016/j.jhep.2016.12.022
Caussy C, Reeder SB, Sirlin CB, Loomba R. Noninvasive, Quantitative Assessment of Liver Fat by MRI-PDFF as an Endpoint in NASH Trials. Hepatology. 2018;68(2):763-772. doi:10.1002/HEP.29797
Berzigotti A, Tsochatzis E, Boursier J, et al. EASL Clinical Practice Guidelines on non-invasive tests for evaluation of liver disease severity and prognosis - 2021 update. J 2021;75(3):659-689. doi:10.1016/J.JHEP.2021.05.025
Yanavich C, Pacheco AG, Cardoso SW, et al. Diagnostic value of serological biomarkers for detection of non-alcoholic fatty liver disease (NAFLD) and/or advanced liver fibrosis in people living with HIV Med. 2021;22(6):445-456. doi:10.1111/HIV.13060
Busca C, Sánchez-Conde M, Rico G, et Assessment of Noninvasive Markers of Steatosis and Liver Fibrosis in HIV-monoinfected Patients on Stable Antiretroviral Regimens. Open Forum Infect Dis. June 2022. doi:10.1093/OFID/OFAC279
Wong VWS, Vergniol J, Wong GLH, et Diagnosis of fibrosis and cirrhosis using liver stiffness measurement in nonalcoholic fatty liver disease. Hepatology. 2010;51(2):454- 462. doi:10.1002/HEP.23312
Musso G, Gambino R, Cassader M, Pagano G. A meta-analysis of randomized trials for the treatment of nonalcoholic fatty liver disease. Hepatology. 2010;52(1):79-104. doi:10.1002/HEP.23623
Patel NS, Hooker J, Gonzalez M, et al. Weight Loss Decreases Magnetic Resonance Elastography Estimated Liver Stiffness in Nonalcoholic Fatty Liver Clin Gastroenterol Hepatol. 2017;15(3):463-464. doi:10.1016/J.CGH.2016.09.150
Promrat K, Kleiner DE, Niemeier HM, et al. Randomized controlled trial testing the effects of weight loss on nonalcoholic steatohepatitis. Hepatology. 2010;51(1):121-129. doi:10.1002/HEP.23276
Vilar-Gomez E, Martinez-Perez Y, Calzadilla-Bertot L, et al. Weight Loss Through Lifestyle Modification Significantly Reduces Features of Nonalcoholic Steatohepatitis. 2015;149(2):367-378.e5. doi:10.1053/J.GASTRO.2015.04.005
Lassailly G, Caiazzo R, Buob D, et Bariatric Surgery Reduces Features of Nonalcoholic Steatohepatitis in Morbidly Obese Patients. Gastroenterology. 2015;149(2):379-388. doi:10.1053/J.GASTRO.2015.04.014
Kamolvisit S, Chirnaksorn S, Nimitphong H, Sungkanuparph S. Pioglitazone for the Treatment of Metabolic-Associated Fatty Liver Disease in People Living With HIV and Cureus. 2021;13(10). doi:10.7759/CUREUS.19046
Sebastiani G, Saeed S, Lebouche B, et al. Vitamin E is an effective treatment for nonalcoholic steatohepatitis in HIV mono-infected patients. AIDS. 2020;34(2):237-244. doi:10.1097/QAD.0000000000002412
Armstrong MJ, Gaunt P, Aithal GP, et al. Liraglutide safety and efficacy in patients with non-alcoholic steatohepatitis (LEAN): a multicentre, double-blind, randomised, placebo-controlled phase 2 study. Lancet. 2016;387(10019):679-690. doi:10.1016/S0140- 6736(15)00803-X
Newsome PN, Buchholtz K, Cusi K, et al. A Placebo-Controlled Trial of Subcutaneous Semaglutide in Nonalcoholic Steatohepatitis. N Engl J Med. 2021;384(12):1113-1124. doi:10.1056/NEJMOA2028395
Stanley TL, Fourman LT, Feldpausch MN, et al. Effects of tesamorelin on non- alcoholic fatty liver disease in HIV: a randomised, double-blind, multicentre trial. lancet 2019;6(12):e821-e830. doi:10.1016/S2352-3018(19)30338-8
Macías J, Mancebo M, Merino D, et al. Changes in liver steatosis after switching from efavirenz to raltegravir among human immunodeficiency virus-infected patients with nonalcoholic fatty liver disease. Clin Infect Dis. 2017;65(6):1012-1019. doi:10.1093/cid/ cix467
Sayago C, Macías J, Conde M, Merchante N, Gómez-Mateos J, Pineda J. Changes in liver steatosis after switching from efavirenz to rilpivirine among HIV-infected patients: The RIFLE study. In: Journal of the International AIDS Society. Vol 21. Glasgow; 2018:86. http://dx.doi.org/10.1002/jia2.25187.
Calza L, Colangeli V, Borderi M, et al. Improvement in liver steatosis after the switch from a ritonavir-boosted protease inhibitor to raltegravir in HIV-infected patients with non- alcoholic fatty liver Infect Dis (Auckl). 2019;51(8):593-601. doi:10.1080/2374423 5.2019.1629008
Bischoff J, Gu W, Schwarze-Zander C, et al. Stratifying the risk of NAFLD in patients with HIV under combination antiretroviral therapy (cART). EClinicalMedicine. 2021;40. doi:10.1016/J.ECLINM.2021.101116
Kirkegaard-Klitbo DM, Thomsen MT, Gelpi M, Bendtsen F, Nielsen SD, Benfield T. Hepatic Steatosis Associated With Exposure to Elvitegravir and Raltegravir. Clin Infect January 2021. doi:10.1093/cid/ciab057
Tana C, Ballestri S, Ricci F, et al. Cardiovascular Risk in Non-Alcoholic Fatty Liver Disease: Mechanisms and Therapeutic Implications. Int J Environ Res Public Health. 2019;16(17). doi:10.3390/IJERPH16173104
Mach F, Baigent C, Catapano AL, et 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular riskThe Task Force for the management of dyslipidaemias of the European Society of Cardiology (ESC) and European Atherosclerosis Society (EAS). Eur Heart J. 2020;41(1):111-188. doi:10.1093/ EURHEARTJ/EHZ455
Sanyal AJ, Van Natta ML, Clark J, et al. Prospective Study of Outcomes in Adults with Nonalcoholic Fatty Liver Disease. N Engl J Med. 2021;385(17):1559-1569. doi:10.1056/ NEJMOA2029349
Hagström H, Nasr P, Ekstedt M, et al. Fibrosis stage but not NASH predicts mortality and time to development of severe liver disease in biopsy-proven NAFLD. J Hepatol. 2017;67(6):1265-1273. doi:10.1016/J.JHEP.2017.07.027
Dulai PS, Singh S, Patel J, et al. Increased risk of mortality by fibrosis stage in nonalcoholic fatty liver disease: Systematic review and meta-analysis. 2017;65(5):1557-1565. doi:10.1002/HEP.29085/SUPPINFO
Macias J, Rivero-Juárez A, Gonzalez-Serna A, et al. Impact of NASH on the survival of people living with CROI 2022, 12–16 Febr 2022, virtual Poster Abstr 518.
Molina P, Bagby G, Nelson Biomedical consequences of alcohol use disorders in the HIV-infected host. Curr HIV Res. 2014;12(4):265-275. doi:10.2174/157016 2X12666140721121849
Crabb DW, Im GY, Szabo G, Mellinger JL, Lucey Diagnosis and Treatment of Alcohol-Associated Liver Diseases: 2019 Practice Guidance From the American Association for the Study of Liver Diseases. Hepatology. 2020;71(1):306-333. doi:10.1002/ HEP.30866
Seitz HK, Bataller R, Cortez-Pinto H, et al. Alcoholic liver disease. Nat Rev Dis Prim. 2018;4(1). doi:10.1038/S41572-018-0014-7
Bradley KA, Debenedetti AF, Volk RJ, Williams EC, Frank D, Kivlahan AUDIT-C as a brief screen for alcohol misuse in primary care. Alcohol Clin Exp Res. 2007;31(7):1208- 1217. doi:10.1111/J.1530-0277.2007.00403.X
7. CIRROSIS HEPÁTICA
7.1. Manejo de la post-respuesta de la hepatitis C crónica con fibrosis avanzada o con cirrosis
7.2. Manejo de la enfermedad hepática avanzada
Manejo de la post-respuesta de la hepatitis C crónica con fibrosis avanzada o con cirrosis
La curación de la infección por el VHC con AAD se asocia a una importante mejoría de la fibrosis hepática, así como de las funciones sintética y purificadora del hígado. Además, tras la curación con AAD, disminuye el GPVH, lo que previene el desarrollo de VE de novo. En consecuencia, se produce una disminución en la incidencia de complicaciones hepáticas, incluido el CHC, y disminuye la mortalidad global y la atribuible a enfermedad hepática. Aun así, persiste un riesgo residual de desarrollar CHC, incluso años tras la RVS, especialmente en pacientes con cirrosis hepática o fibrosis hepática avanzada previa al tratamiento.
Dado que la coinfección por el VIH no se asocia a una mayor incidencia de eventos hepáticos tras la RVS1 el manejo de la enfermedad hepática en individuos monoinfectados por el VHC y coinfectados por el VIH/VHC no debería ser diferente, una vez se alcanza la curación de la infección por el VHC. Hasta la fecha, las principales guías de manejo de pacientes infectados por el VHC recomiendan que, en pacientes con cirrosis hepática, se mantengan las medidas de cribado y vigilancia de complicaciones hepáticas de forma indefinida2.
En los pacientes con enfermedad hepática avanzada, previa a la RVS, los niveles de RH en el momento de la curación, evaluada por ET, podrían ser de utilidad para la estratificación del riesgo residual de desarrollo de eventos hepáticos post-RVS, al igual que ocurre durante la infección activa. En un estudio llevado a cabo en la cohorte nacional GEHEP 011 en PVVIH con infección crónica por VHC y fibrosis pre-tratamiento ≥9,5 KPa, que alcanzaron RVS con regímenes basados en AAD, se demostró que una RH <14 KPa en el momento de la RVS discriminaba a aquellos individuos sin riesgo, o con escaso riesgo, de desarrollar complicaciones hepáticas durante el seguimiento3.
Si bien podrían emerger algunos casos de CHC a largo plazo tras la RVS, la incidencia de estos eventos no justificaría el mantenimiento de un programa de cribado en esta subpoblación, en la que no sería coste-efectivo. Igualmente, en una cohorte prospectiva, se ha evidenciado que el criterio VIH/cirrosis (RH <30 KPa y plaquetas >110.000/mm3) identifica a pacientes con cirrosis hepática con escaso riesgo de desarrollar un primer episodio de sangrado por rotura de VE4. Por todo esto, a pesar de la correlación parcial de la RH con el grado de fibrosis post-RVS, su capacidad predictiva para el desarrollo de eventos clínicos tras la RVS apoya la toma de decisiones de manejo.
La situación de los pacientes con fibrosis F3 según la escala METAVIR es más compleja, ya que se especula con que la evaluación de la fibrosis avanzada podría no ser exacta en algunos casos, lo que conllevaría un infradiagnóstico de la cirrosis. Además, a pesar de la consecución de la RVS, en pacientes con ciertas comorbilidades, el riesgo de progresión a cirrosis y de desarrollar complicaciones hepáticas después de la RVS podría estar aumentado. En general, la diferencia entre la fibrosis avanzada y la cirrosis es muy pequeña, y el hecho de no reconocer la transición entre estos dos estadios lleva a la exclusión de algunos pacientes de los programas de vigilancia. Por todo esto, una opción propuesta por algunos es mantener a todos los pacientes con F3 en programas de vigilancia y cribado de CHC5. Sin embargo, estudios de cohortes nacionales prospectivos han puesto en evidencia que la incidencia de eventos hepáticos en PVVIH en estadio F3 es muy baja36. En esta situación, la implementación de un cribado de CHC tampoco sería coste-efectiva.
Por último, los marcadores séricos, como por ejemplo el FIB-4, pueden ser de gran utilidad en aquellos centros en los que no se disponga de ET7. Si bien, con la evidencia actual pueden no ser precisos en la evaluación de la fibrosis hepática post-RVS, algunos estudios sugieren que sí podrían ser de utilidad en la predicción de eventos clínicos en ese escenario3. A pesar de esto, son necesarios más estudios que validen nuevos puntos de corte, específicamente en PVVIH.
Manejo de la enfermedad hepática avanzada
7.2.1 Manejo de la hipertensión portal
La HTP se asocia con el desarrollo de descompensaciones hepáticas, tales como ascitis, sangrado por varices esófago-gástricas y encefalopatía, entre otras. Las principales guías europeas de manejo del paciente con HTP se basan en las conferencias de consenso de Baveno, la más reciente (Baveno VII) publicada en 20222. En éstas, no se recogen recomendaciones específicas para las PVVIH. Es conocido que, tanto entre PVVIH como en personas sin infección por el VIH, el riesgo de complicaciones se correlaciona con el grado de HTP8
El objetivo de estas guías es establecer los escenarios en los que implementar profilaxis primaria para evitar la aparición de complicaciones hepáticas, y si ya las ha habido, evitar su reaparición instaurando profilaxis secundaria. Según las recomendaciones de Baveno VII, se considera que la HTP clínicamente significativa que condiciona el desarrollo de VE de alto riesgo de sangrado y de descompensación, se produce cuando existen niveles de RH >25KPa, o entre 20 y 25 KPa con menos de 150.000 plaquetas/ mm32. No obstante, estos puntos de corte no han sido validados específicamente en PVVIH.
En un amplio estudio retrospectivo de varias cohortes de PVVIH con daño hepático avanzado compensado, y la mayoría con ARN-VHC detectable, el nuevo criterio VIH/cirrosis (RH < 30KPa y recuento plaquetario >110.000/mm3) parecía presentar un mejor rendimiento diagnóstico con respecto a Baveno VI y Baveno VI expandido, ya que consigue evitar una mayor proporción de EDA, con un elevado VPN, similar a los otros dos criterios 8.
7.2.2 Cribado de hepatocarcinoma
El objetivo principal es su detección en fases precoces para poder aplicar terapias curativas. El principal factor de riesgo es la presencia de cirrosis de cualquier etiología, por lo que estos pacientes deben ser incluidos en los programas de cribado. Dada la menor incidencia de CHC en los pacientes coinfectados por VIH y VHC, con fibrosis avanzada y sin cirrosis (estadio F3), las medidas de cribado de CHC no se consideran coste-efectivas en estos pacientes con los datos disponibles en la actualidad 6.
En cohortes europeas de personas coinfectadas por VIH y VHB, se observó que el tratamiento con tenofovir reducía la incidencia de CHC en los pacientes cirróticos y también en los no cirróticos (especialmente si la puntuación de la escala PAGE-B< 10 puntos) 9 . En población monoinfectada por VHB sin cirrosis se recomienda el cribado en varones mayores de 40 años y mujeres mayores de 50 de origen asiático, en población de origen africano y en personas con antecedentes familiares de CHC, por presentar incidencias superiores a 2/1000 paciente-año. No disponemos de datos suficientes para definir en PVVIH la población no cirrótica que debería ser cribada de forma sistemática.
El método recomendado en la actualidad es la ecografía hepática. En un metaanálisis reciente de la colaboración Cochrane, presentaba una sensibilidad para la detección de CHC del 72-81%, con un rendimiento menor en lesiones de pequeño tamaño. La determinación de alfafetoproteína con un punto de corte de 20 ng/mL es menos sensible y menos específica ya que sus niveles son fluctuantes y pueden estar elevados en presencia de viremia por VHC. El estudio conjunto mediante ecografía y alfafetoproteína aumenta la sensibilidad, pero disminuye la especificidad, con datos procedentes de estudios heterogéneos, por lo que no se puede hacer una recomendación firme. Una de las limitaciones de la exploración por ecografía depende de la calidad de la exploración por lo que se ha propuesto una terminología común para la ecografía, el TC y la RM que estratifica la probabilidad de que se detecte un CHC y la calidad de la exploración10 En Europa no se ha generalizado esta estandarización de los informes.
La periodicidad de la exploración basada en el tiempo de duplicación de una lesión hepática incipiente que permita un diagnóstico con opciones de tratamiento curativo es de 6 meses. En un ensayo clínico en 1278 pacientes cirróticos aleatorizados a control cada 3 o cada 6 meses, no varió la detección de lesiones de hepatocarcinoma< 30 mm 11. En PVVIH al igual que en poblaciones no coinfectadas, en la cohorte GEHEP-02, se ha demostrado que la detección del CHC en programas de cribado se asocia a una supervivencia significativamente superior12. La sensibilidad de la prueba para la detección de lesiones en estadios precoces fue inferior en PVVIH12. El seguimiento regular de los programas de cribado en PVVIH es bajo, de menos del 20% en las 40 cohortes de la colaboración COHERE 13. Es prioritaria la inclusión de todas la PVVIH con cirrosis en programas de cribado de CHC. El cribado se debe considerar negativo con una ecografía con calidad suficiente, en caso contrario se puede valorar la realización de otras técnicas de imagen.
La confirmación del diagnóstico por imagen basado en el predominio de vascularización arterial del tumor, respecto a la portal, se realiza habitualmente mediante TC multifase, RM con contraste o ecografía con contraste. La biopsia hepática, poco empleada en la actualidad, se reserva para casos limitados sin datos concluyentes en los estudios por imagen. No se recomiendan estas técnicas para el cribado por el coste y por no ofrecer mayor sensibilidad respecto a la ecografía 1415.
7.2.3 Tratamiento de hepatocarcinoma
Varias series prospectivas han descrito formas más agresivas de presentación en PVVIH, con lesiones de mayor tamaño, mayor frecuencia de trombosis portal tumoral y presentación de lesiones infiltrativas1617.
El abordaje terapéutico tiene en cuenta la función hepática, la extensión tumoral y la funcionalidad según el algoritmo BCLC (Barcelona Clinic Liver Cancer)1819. En estadios precoces (0-A) se clasifican pacientes con función hepática preservada y hasta 3 lesiones con un máximo de 3 cm de diámetro. Con una lesión única, la primera opción es la resección o la ablación, con preferencia por la primera si queda suficiente volumen hepático remanente y en ausencia de un grado elevado de hipertensión portal. Con más de una lesión, la opción prioritaria es el trasplante hepático.
En estadio B (intermedio) con lesiones irresecables, la opción propuesta es la quimioembolización. En estadio C (avanzado) con invasión portal o extensión extrahepática, las opciones para la terapia sistémica inicial incluyen pautas con sorafenib, lenvatinib, nivolumab o atezolizumab más bevacizumab, si es posible dentro de ensayos clínicos. En estadio D (terminal), se incluyen pacientes no candidatos a trasplante o con enfermedad hepática terminal, candidatos a cuidados sintomáticos y paliativos.
7.2.4 Trasplante
Las indicaciones son las mismas que en la población general 20 sobre todo, el fallo hepático agudo, la insuficiencia hepatocelular grave, las descompensaciones asociadas a HTP en cirróticos de cualquier etiología, y el CHC que cumple los criterios de Milán, no candidato a resección quirúrgica. En PVVIH se requiere también que estén recibiendo tratamiento antirretroviral, con viremia del VIH indetectable y CD4>100-150 células/mL, y sin antecedentes de infección oportunista no erradicable21 Las PVVIH tienen mayor riesgo de pérdida del órgano trasplantado. En una serie que recoge 73206 personas sin infección por VIH trasplantadas en EEUU y Europa, y 658 con infección VIH, la supervivencia del órgano a 3 años era del 77,3% y 64,4% respectivamente, pero ha mejorado en los últimos años de forma más acusada en PVVIH 22.
En algunos países se han iniciado programas que permiten el trasplante de órganos con donante y receptor infectados por VIH, lo que permitiría disponer de un mayor número de donaciones. La experiencia es limitada y se ha observado una mayor incidencia de infecciones y neoplasias 4. En estos momentos no existe cobertura legal en nuestro medio.
Recomendaciones
- En ausencia de otras causas de enfermedad hepática, en pacientes con infección crónica por VHC y cirrosis hepática pre-tratamiento que presentan una RH < 14 KPa en el momento de la RVS, no es necesario continuar con las medidas de cribado de complicaciones hepáticas (A-II).
- En pacientes con cirrosis hepática pre-tratamiento, en los que coexisten otras causas de daño hepático, deben mantenerse las medidas de cribado de eventos hepáticos tras la RVS de forma indefinida hasta que se disponga de más datos (A- II).
- Tras la RVS, en aquellos pacientes que presenten un criterio VIH/cirrosis favorable (RH <30 KPa y plaquetas >110.000/mm3) puede evitarse la EDA de cribado de VE de alto riesgo de sangrado (A-II).
- Tras la RVS, en pacientes cirróticos inicialmente excluidos del programa de cribado de VE de alto riesgo de sangrado, se recomienda realizar una medición de la RH y recuento de plaquetas anualmente. Si durante el seguimiento presentasen una RH >30 KPa o recuento plaquetario <110.000/mm3, deberán ser incluidos en el programa de cribado de VE de alto riesgo y llevarse a cabo una EDA (A-II).
- En pacientes cirróticos con infección por VHC activa puede aplicarse el criterio VIH/ cirrosis (RH <30 KPa y plaquetas >110.000) para seleccionar a aquellos pacientes que pueden ser excluidos en el cribado de VE de alto riesgo de sangrado (B-II).
- Para el manejo de otras descompensaciones distintas del sangrado por rotura de VE y derivadas de la hipertensión portal, se recomienda seguir las directrices de Baveno VII (accesible en: Baveno VII – Renewing consensus in portal hypertension
- Journal of Hepatology (journal-of-hepatology.eu)) (B-III).
- En PVVIH con cirrosis de cualquier etiología se debe realizar cribado de CHC mediante ecografía cada 6 meses para su detección en fases precoces (A-II).
- La confirmación del diagnóstico se realiza mediante TC multifase, RM con contraste o ecografía con contraste (A-II). En casos dudosos con alta probabilidad, la confirmación puede hacer por biopsia hepática (B-II).
- El manejo terapéutico del CHC se debe basar en el algoritmo BCLC con las opciones que se priorizan en cada estadio (A-II).
- Los pacientes cirróticos infectados por VIH tienen las mismas indicaciones de trasplante que la población general (A-II).
- Se recomienda que las PVVIH que van a ser evaluadas para trasplante hepático estén en tratamiento antirretroviral estable (A-II).
Bibliografía:
Corma-Gómez A, Morano L, Téllez F, et HIV infection does not increase the risk of liver complications in hepatitis C virus-infected patient with advanced fibrosis, after sustained virological response with direct-acting antivirals. AIDS. 2019; 33(7): 1167-1174.
de Franchis R, Bosch J, Garcia-Tsao G, et al. Baveno VII - Renewing consensus in portal J Hepatol 2022; 76: 959-974.
Corma-Gómez A, Macías J, Téllez F, et al. Liver Stiffness at the Time of Sustained Virological Response Predicts the Clinical Outcome in People Living With Human Immunodeficiency Virus and Hepatitis C Virus With Advanced Fibrosis Treated With Direct-acting Clin Infect Dis. 2020; 71(9): 2354-2362.
Corma-Gómez A, Macías J, Morano L, et al. Liver Stiffness-Based Strategies Predict Absence of Variceal Bleeding in Cirrhotic Hepatitis C Virus-Infected Patients With and Without Human Immunodeficiency Virus Coinfection After Sustained Virological Response. Clin Infect 2021; 72(5): e96-e102.
Nahon P, Ganne-Carrié N. Management of patients with pre-therapeutic advanced liver fibrosis following HCV JHEP Reports 2019;1:480–9.
Sánchez-Azofra M, Fernández I, García-Buey ML, et al. Hepatocellular carcinoma risk in hepatitis C stage-3 fibrosis after sustained virological response with direct-acting antivirals Liver Int 2021; 41: 2885-2891.
European Association for the Study of the Liver. Clinical Practice Guidelines on non- invasive tests for evaluation of liver disease severity and prognosis - 2021 update. J 2021 Sep;75(3):659-689.
Merchante N, Saroli Palumbo C, Mazzola G, et Prediction of Esophageal Varices by Liver Stiffness and Platelets in Persons with HIV infection and Compensated Advanced Chronic Liver Disease. Clin Infect Dis 2020; 71: 2810-2817.
Wandeler G, Mauron E, Atkinson A, et al. Incidence of hepatocellular carcinoma in HIV/HBV-coinfected patients on tenofovir therapy: Relevance for screening strategies. J Hepatol 2019; 71: 274-280.
Chernyak V, Fowler KJ, Kamaya A, et Liver Imaging Reporting and Data System (LI- RADS) Version 2018: Imaging of Hepatocellular Carcinoma in At-Risk Patients. Radiology 2018; 289: 816–830.
Trinchet JC, Chaffaut C, Bourcier V, et Ultrasonographic Surveillance of Hepatocellular Carcinoma in Cirrhosis: A Randomized Trial Comparing 3- and 6-Month Periodicities. Hepatology 2011; 54: 1987-1997.
Merchante N, Figueruela B, Rodriguez-Fernández M, et al. Low performance of ultrasound surveillance for the diagnosis of hepatocellular carcinoma in HIV-infected AIDS 2019; 33: 269-278.
Willemse S, Smit C, Sogni P, et al. Low compliance with hepatocellular carcinoma screening guidelines in hepatitis B/C virus co‐infected HIV patients with cirrhosis. J Viral Hepat 2019; 26: 1224–1228.
Nadarevic T, Giljaca V, Colli A, et al. Computed tomography for the diagnosis of hepatocellular carcinoma in adults with chronic liver disease. Cochrane Database Syst Rev 2021; 10(10):
Chan MV, Huo YR, Trieu N, et al. Noncontrast MRI for Hepatocellular Carcinoma Detection: A Systematic Review and Meta-analysis - A Potential Surveillance Tool? Clin Gastroenterol Hepatol 2022; 20: 44-56.
Lewin M, Gelu-Simeon M, Ostos M, et Imaging Features and Prognosis of Hepatocellular Carcinoma in Patients with Cirrhosis Who Are Coinfected with Human Immunodeficiency Virus and Hepatitis C Virus. Radiology 2015; 277: 443-453.
Gelu-Simeon M, Lewin M, Ostos M, et al. Prognostic factors of survival in HIV/HCV co-infected patients with hepatocellular carcinoma: the CARCINOVIC Cohort. Liver Int 2019; 39: 136-146.
Marrero JA, Kulik LM, Sirlin CB, et al. Diagnosis, Staging, and Management of Hepatocellular Carcinoma: 2018 Practice Guidance by the American Association for the Study of Liver Hepatology 2018; 68: 723-750.
European Association for the Study of the Liver. EASL Clinical Practice Guidelines: Management of hepatocellular J Hepatol 2018; 69: 182–236.
European Association for the Study of the Liver. Guías de práctica clínica EASL: Trasplante hepático. J Hepatol 2016; 64: 433-485.
Miro JM, Agüero F, Duclos-Vallée JC, et al. Infections in solid organ transplant HIV- infected patients. Clin Microbiol Infect 2014; 20 Suppl 7: 119-130.
Campos-Varela I, Dodge JL, Berenguer M, et Temporal Trends and Outcomes in Liver Transplantation for Recipients With HIV Infection in Europe and United States. Transplantation 2020; 104: 2078-2086.
Durand CM, Florman S, Motter JD, et al. HOPE in action: A prospective multicenter pilot study of liver transplantation from donors with HIV to recipients with HIV. Am J Transplant 2022; 22: 853-864.