Documento de consenso sobre el manejo clínico de la comorbilidad neuropsiquiátrica y cognitiva asociada a la infección por VIH-1
Julio 2020
Notas de la Versión:
Coordinadores y revisores
| Ignacio Pérez Valero |
Facultativo especialista en Medicina Interna – Enfermedades Infecciosas. Unidad de VIH, Servicio de Medicina Interna, Hospital Universitario La Paz – IDIPAZ, Madrid. |
Jordi Blanch |
Facultativo especialista en Psiquiatría y profesor asociado. Servicio de Psiquiatría y Psicología, Hospital Clínic de Barcelona – IDIBAPS, Universidad de Barcelona, Barcelona. Director del Pla Director de Salut Mental i Addiccions, Generalitat de Catalunya. CIBERSAM. |
Redactores por orden alfabético
| Pablo Bachiller Luque |
Facultativo especialista en Medicina Interna – Enfermedades Infecciosas. Servicio de Medicina Interna, Complejo Asistencial de Segovia, Segovia. |
Isabel Cuellar Flores
|
Facultativo especialista en Psicología Clínica e investigadora. Servicio de Pediatría, Hospital Clínico San Carlos, Universidad Complutense de Madrid, Madrid. |
| Helen Dolengevich Segal | Facultativo especialista en Psiquiatría. Servicio de Psiquiatría, Hospital Universitario del Henares, Coslada. |
| Esther García Almodóvar | Facultativo especialista en Medicina Interna – Enfermedades Infecciosas. Servicio de Medicina Interna, Hospital Can Misses, Ibiza. |
Miguel Ángel Goneaga
|
Facultativo especialista en Medicina Interna – Enfermedades Infecciosas. Unidad de Enfermedades Infecciosas del Hospital Universitario Donostia, Guipúzcoa. |
Alicia González Baeza |
Psicóloga investigadora y profesora asociada. Unidad VIH, Servicio de Medicina Interna, Hospital Universitario La Paz – IDIPAZ, Universidad Autónoma de Madrid, Madrid. |
Lorna Leal Alexander |
Médica investigadora asociada. Servicio de Enfermedades Infecciosas – Unidad VIH, Hospital Clínic de Barcelona – IDIBAPS, Universidad de Barcelona, Barcelona. |
María Martínez Rebollar |
Médica investigadora asociada. Servicio de Enfermedades Infecciosas – Unidad VIH, Hospital Clínic de Barcelona – IDIBAPS, Universidad de Barcelona. |
Marta Montero Alonso |
Facultativo especialista en Medicina Interna – Enfermedades Infecciosas. Unidad de Enfermedades Infecciosas, Hospital Universitario y Politécnico la Fe, Valencia. |
José A. Muñoz-Moreno |
Psicólogo investigador. Fundación Lucha contra el SIDA, Servei de Malalties Infeccioses, Hospital Germans Trias i Pujol, Badalona. |
José A. Muñoz-Moreno
|
Psicólogo investigador. Fundación Lucha contra el SIDA, Servei de Malalties Infeccioses, Hospital Germans Trias i Pujol, Badalona. |
María Luisa Navarro Gómez |
Facultativo especialista en Pediatría y profesora asociada. Sección de Enfermedades Infecciosas, Servicio de Pediatría, Hospital Universitario Gregorio Marañón, Universidad Complutense de Madrid, Madrid. |
Rosario Palacios Muñoz |
Facultativo especialista en Medicina Interna – Enfermedades Infecciosas y profesora asociada. UGC de E. Infecciosas, Microbiología Clínica y Medicina Preventiva, Hospital Virgen de la Victoria – IBIMA, Universidad de Málaga, Málaga. |
Daniel Podzamczer |
Facultativo especialista en Medicina Interna – Enfermedades Infecciosas. Jefe de la Unidad de VIH e ITS, Servicio de Enfermedades Infecciosas, Hospital Universitari de Bellvitge – IDIBELL, L’Hospitalet. |
Guadalupe Rúa Cebrián |
Psicóloga General Sanitaria. Instituto Intra-TP. Instituto de Investigación y Tratamiento del Trauma y los Trastornos de la Personalidad, Santiago de Compostela. |
Juan Tiraboschi |
Medico investigador asociado. Unidad de VIH e ITS, Servicio de Enfermedades Infecciosas, Hospital Universitari de Bellvitge – IDIBELL, L’Hospitalet. |
CONFLICTO DE INTERESES
Ignacio Pérez Valero ha recibido pagos por ponencias, consultorías y por la coordinación de proyectos de FMC de Gilead Sciences, Janssen-Cilag, MSD y ViiV. Igualmente, ha sido investigador coordinador de los estudios GeSIDA 9016 y GeSIDA 10418, financiados respectivamente por Gilead Sciences y Janssen-Cilag.
Marta Montero Alonso ha efectuado labores de consultoría para AbbVie, Janssen Cilag, Merck Sharp & Dohme y ViiV Healthcare, y ha recibido honorarios por charlas de AbbVie, Gilead Sciences, Janssen Cilag, Merck Sharp & Dohme y ViiV Healthcare.
Pablo Bachiller Luque, Isabel Cuellar Flores, Helen Dolengevich Segal, Esther García Almodóvar, Miguel Ángel Goneaga, Alicia González Baeza, Lorna Leal Alexander, María Martínez Rebollar, José A. Muñoz-Moreno, María Luisa Navarro Gómez, Rosario Palacios Muñoz, Daniel Podzamczer, Guadalupe Rúa Cebrián y Juan Tiraboschi no han reportado ningún conflicto de interés en relación con la elaboración de este documento.
NOTA
Algunas de las Recomendaciones terapéuticas indicadas en este documento no están aprobadas en ficha técnica, pero el Panel las recomienda en función de los datos publicados al respecto. Cada facultativo prescriptor debe conocer las condiciones para la prescripción de medicamentos cuando se utilizan en indicaciones distintas a las autorizadas (Real Decreto 1015/2009, de 19 de junio, por el que se regula la disponibilidad de medicamentos en situaciones especiales).
1. INTRODUCCIÓN
Los Documentos de Consenso de GeSIDA sobre el manejo de alteraciones psiquiátricas y psicológicas y de los trastornos neurocognitivos asociados al virus de inmunodeficiencia humana tipo-1 (VIH) llevaban sin actualizarse desde hace 5 y 7 años respectivamente. Durante este tiempo, muchos de sus contenidos y Recomendaciones habían perdido su vigencia. Por este motivo la Junta Directiva de GeSIDA decidió en 2019 acometer una revisión, actualización y unificación del contenido de estos dos documentos de consenso, fruto de la cual nace el presente documento.
Desde la publicación de los documentos previos hasta ahora muchas son las cosas que han cambiado. Hemos asistido a la comercialización de fármacos antirretrovirales (ARV), como los inhibidores de la integrasa, más potentes y con menos interacciones farmacológicas. Esto ha conducido a que aspectos hasta entonces cruciales como la penetrabilidad del tratamiento antirretroviral (TAR) en el líquido cefalorraquídeo (LCR) o la interacción del TAR con el tratamiento psicofarmacológico sean cada vez menos relevantes y que otros aspectos antes menores como la neurotoxicidad asociada al TAR hayan adquirido una mayor relevancia. También hemos asistido a un envejecimiento progresivo de las personas que viven con VIH en nuestro país que ha favorecido el aumento de las comorbilidades neuropsiquiátricas y de los fenómenos de declive cognitivo, secundarios al neuroenvejecimiento.
El panel de expertos del presente documento ha intentado dar respuesta a esta nueva realidad actualizando sus Recomendaciones para el manejo de los trastornos neuropsiquiátricos y cognitivos que presentan las personas que viven con VIH en base a las siguientes tres premisas: El rigor científico, la experiencia clínica y su aplicabilidad en las consultas que atienden a las personas que viven con VIH en nuestro medio.
2. METODOLOGÍA
El presente documento de consenso ha sido elaborado por un panel de expertos designados por la Junta Directiva de GeSIDA entre sus socios y colaboradores. El panel del documento estaba integrado por dos coordinadores y 15 redactores. Las funciones encomendadas a los coordinadores han sido: 1) Definir los capítulos del documento y designar a los redactores responsables de cada uno de ellos; Y 2) Revisar el contenido de cada capítulo y dar uniformidad al documento. Las funciones encomendadas a los redactores han sido: 1) Revisar la literatura científica, redactar el capítulo o capítulos asignados y proponer Recomendaciones de práctica clínica; Y 2) Revisar el documento y ratificar su conformidad con las Recomendaciones establecidas por el panel.
Las normas establecidas para la revisión de la literatura comprendieron artículos indexados en Pubmed en lengua inglesa o española y comunicaciones a congresos presentadas en los últimos 5 años, siendo la última fecha de revisión diciembre de 2019. Las Recomendaciones de práctica clínica establecidas para cada sección del documento fueron propuestas por cada redactor, revisadas por los coordinadores y ratificadas por los miembros del panel. En el caso de que una recomendación no contase con la unanimidad del panel, este hecho quedará reflejado en el documento.
El documento, una vez finalizado, fue sometido a revisión por parte de la Junta Directiva y tras obtener su visto bueno, fue publicado en modo borrador en la página web de GeSIDA, estableciéndose un periodo de alegaciones abierto a los socios y colaboradores de GeSIDA. Las alegaciones recibidas fueron valoradas por el panel y en el caso de considerarlo pertinente, fueron incluidas en el documento final.
2.1. MÉTRICA UTILIZADA PARA GRADUAR LAS RECOMENDACIONES
Las Recomendaciones de estas guías se basan en la evidencia científica y en la opinión de expertos. Para graduar la evidencia de las Recomendaciones incluidas en el presente documento ha utilizado la misma metodología utilizada en otras guías de GeSIDA como la de manejo del tratamiento antirretroviral. Ver Tabla 1:
Tablas:

3. ABREVIATURAS
ACVA ARV BHE |
Accidente cerebrovascular agudo Fármacos antirretrovirales Barrera hematoencefálica |
| CHAR- TER | CNS HIV Anti-Retroviral Therapy Effect Research |
DM |
Diabetes mellitus |
DV |
Demencia vascular |
EA |
Enfermedad de Alzheimer |
HTA |
Hipertensión arterial |
IADL |
Instrumental activities of daily living |
ISRS |
Inhibidores selectivos de la recaptación de la serotonina |
ITS |
Infecciones de transmisión sexual |
LCR |
Líquido cefalorraquídeo |
MDMA |
3,4-metilendioxi-metanfetamina |
MoCA |
Montreal Cognitive Assessment |
PAOFI |
Patient’s Assessment of Own Functioning Inventory |
PHQ-9 |
Cuestionario sobre la salud del paciente – 9 |
RM |
Resonancia Magnética |
RR |
Riesgo Relativo |
SNC |
Sistema nervioso central |
TAR |
Tratamiento antirretroviral |
TCH |
D9-Tetrahidrocannabinol |
TNAV |
Trastornos neurocognitivos asociados al VIH |
TCS |
Trastornos por consumo de sustancias |
VHC |
Virus de la hepatitis C |
VIH |
Virus de la inmunodeficiencia humana tipo 1 |
4. ALTERACIONES PSICOLÓGICAS Y PSIQUIÁTRICAS
4.1. Aspectos psicológicos
4.2. Principales síndromes psicopatológicos
4.3. Alteraciones en las funciones fisiológicas
4.4. Trastornos por consumo de sustancias
4.5. Tratamiento de los trastornos psicopatológicos
4.6. Trastornos psiquiátricos en la población pediátrica
Aspectos psicológicos
Un aspecto importante para conseguir el bienestar de las personas que viven con el virus de inmunodeficiencia humana tipo I (VIH) y un control óptimo de la infección es identificar los procesos emocionales que pueden experimentar desde el momento del diagnóstico, así como los mecanismos, adaptativos o desadaptativos, que van a desarrollar para hacer frente a los estresores asociado al hecho de vivir con VIH.
Reacción ante la notificación del diagnóstico
Cuando una persona es diagnosticada de VIH puede experimentar una gran variedad de emociones como tristeza, miedo, rabia, ira, vergüenza, culpa o ansiedad1 y, sentir su pronóstico como incierto a pesar del buen pronóstico de la infección2. Estas emociones y reacciones pueden evolucionar de manera similar a como lo hacen los procesos de duelo, experimentando negación, enfado, negociación, depresión y finalmente aceptación3.
Durante la fase de negación la persona puede pensar que el diagnóstico es erróneo y/o resistirse a iniciar el tratamiento. En la fase de enfado pueden verse reacciones autodestructivas o evitativas como la alta actividad sexual no protegida o el consumo de alcohol y drogas. Durante la fase de negociación la persona puede experimentar fuertes sentimientos de arrepentimiento y culpa y, durante la fase de depresión desesperanza hacia el futuro y hacia sí mismo.
Adaptación frente a la enfermedad
Para adaptarse a vivir con una enfermedad crónica que requiere seguimiento médico continuado y un tratamiento diario, así como a otros cambios relacionados con el diagnóstico, la persona pone en marcha estrategias de afrontamiento. Estas estrategias son adaptativas, cuando permiten afrontar las demandas emocionales y desadaptativas cuando aumentan el nivel de malestar emocional4.
Las estrategias desadaptativas asociadas a mayores niveles de malestar y peor manejo terapéutico son: la evitación y negación; el aislamiento; y los pensamientos de carácter pasivo-rumitativo, los cuales son circulares sobre diversos aspectos de la enfermedad y no centrados en resolución de problemas5. Por el contrario, la persona que realiza un afrontamiento activo-conductual expresa sus emociones, demanda información o busca apoyo social, pone en marcha estrategias adaptativas.
La puesta en marcha de estrategias adaptativas o desadaptativas tras el diagnóstico dependerá de características psicológicas previas como rasgos de personalidad o recursos de regulación emocional, del nivel educativo o del apoyo social percibido, entre otros aspectos7. El desarrollo de estrategias desadaptativas se ha asociado con un peor control de la infección, por su papel en la amplificación del estrés8. Por este motivo es importante que el clínico responsable del VIH sea capaz de identificar la existencia de estas estrategias a tiempo y recomiende al paciente recibir atención psicológica.
Estigma
Una de las fuentes de estrés más relevantes para las personas con VIH se relaciona con el estigma social asociado a ser seropositivo. Este estigma tiene un alto impacto emocional cuando la persona incorpora la devaluación social en su propio sistema de valores9. El estigma que siente el paciente puede ser un estigma percibido, cuando anticipa (de forma real o imaginaria) como la sociedad se va a comportar frente a él/ella, o un autoestigma, cuando la propia persona expresa rechazo y repulsión por su condición de seropositivo10.
El estigma favorece que la persona responda frente a las emociones asociadas al diagnóstico con estrategias desadaptativas, presentando mayores niveles de distrés emocional, ansiedad y depresión11. Asimismo, el estigma se asocia con mayor discriminación, menor apoyo social, un acceso a los recursos sociosanitarios más reducido y, a una menor adherencia al tratamiento antirretroviral y peor control de la infección12.
Control de la infección y adherencia
Un aspecto clave para garantizar el bienestar de las personas con VIH es asegurar que siguen un control de la infección adecuado y toman su tratamiento de forma regular. Diversos estudios han considerado que la adherencia es un modelo de comportamiento psicosocial complejo y multifactorial, influenciado por diversas variables psicológicas13. Por ejemplo, el bajo apoyo social y las estrategias de afrontamiento desadaptativas tienen un efecto negativo a nivel psicológico (mayor ansiedad, depresión, malestar psicológico general), el cual predice una peor adherencia al tratamiento y control del VIH14. En la misma línea, en cuadros de depresión o duelo, la interrupción del TAR pueden estar asociada a sentimientos de culpa excesiva o realizarse como un modo de autolesión15.
Cuando una persona con VIH presenta un control deficiente de la infección y del TAR, se deben de analizar y abordar los aspectos psicológicos anteriormente mencionados así como aspectos como el uso de drogas o alcohol, la desconfianza sobre el TAR, la vergüenza asociada al estigma o la insatisfacción con la asistencia sanitaria. Igualmente, algunas otras estrategias como la simplificación del tratamiento, el uso de ayudas externas de recuerdo (alarmas, calendarios…) o recompensas por cumplimiento podrían ser de utilidad16.
Recomendaciones
- En todas las personas con VIH, especialmente tras el diagnóstico, sería recomendable realizar una valoración de su salud emocional, prestando especial atención a las estrategias de afrontamiento y al estigma (A-III).
- En aquellas personas en las que se detecten estrategias desadaptativas asociadas a cuadros de ansiedad o depresión se aconseja la derivación a un recurso de atención psicológica (A-III).
- En los pacientes con problemas de adherencia a la consulta y al TAR se recomienda realizar valoraciones psicológicas para identificar e intervenir sobre las variables emocionales asociadas a dichos problemas (B-III).
Principales síndromes psicopatológicos
La infección por VIH puede incrementar el riesgo de la enfermedad psiquiátricos y, a su vez, la enfermedad psiquiátrica es un factor de riesgo para la adquisición del VIH1718. Diferentes estudios han demostrado un aumento de la prevalencia de trastornos psicopatológicos en las personas con VIH en comparación con la población general19202122232425. El abordaje de estos trastornos requiere un abordaje multidisciplinar (medicina interna, psicología, psiquiatría, asistentes sociales, enfermería…) implicando, cuando sea posible a enfermería, como profesional de enlace. La valoración inicial y el seguimiento de los trastornos psicopatológicos en las personas con VIH deberá incluir27.
- Antecedentes familiares y personales de enfermedad mental y personales de consumo de tóxicos-drogas.
- Evaluación de la apariencia, del comportamiento, del pensamiento, del lenguaje, del juicio crítico, del estado de ansiedad y depresión, de la queja cognitiva (atención, memoria y funciones ejecutiva), de la motricidad y de la percepción
- Evaluación de la situación laboral, familiar y social.
4.2.1. Síndrome de ansiedad
Se estima que hasta un 47% de las personas con VIH padecerán ansiedad a lo largo de su vida2628. En estas personas, la ansiedad se ha con una merma significativa en la calidad de vida y con problemas en el manejo de la infección (retraso en el inicio del TAR, mala adherencia o pérdida del seguimiento)(26,29-31).
Diagnóstico
El cribado de la ansiedad se realiza mediante escalas que detectan síntomas ansiosos. En las personas con VIH, la más utilizada, es la escala de ansiedad y depresión hospitalaria (HADS) Figura 1. Una puntuación la subescala de ansiedad del HADS de al menos 8 puntos se considera sugestiva de trastorno de ansiedad32. La confirmación del diagnóstico la puede realizar directamente el clínico en la consulta, aplicando una entrevista semiestructurada como la entrevista neuropsiquiátrica internacional MINI33.
Tratamiento
El tratamiento inicial de los cuadros de ansiedad es la psicoterapia cognitivo- conductual, así como los grupos de apoyo, autoayuda y counselling. Cuando sea necesario asociar tratamiento farmacológico, los fármacos de elección serán los inhibidores selectivos de la recaptación de la serotonina (ISRS) a altas dosis34. Las benzodiacepinas (potentes y de vida media corta-media) se reservarán para cuadros de ansiedad aguda (1-2 semanas), en pacientes jóvenes.
4.2.2. Síndromes depresivos
Los síndromes depresivos en general y la depresión (5-20%) en particular son los trastornos psiquiátricos más prevalentes en las personas con VIH326. La prevalencia de depresión entre las personas con VIH es superior a la de la población general(20,35-42). y se ha asociado con peor control de la infección (retraso del inicio del TAR, mala adherencia o pérdida del seguimiento)(29,43-46) y con aumento de la morbi- mortalidad4748.
Diagnóstico
Para el cribado de la depresión se pueden utilizar escalas como el HADS32 aplicadas anual o bianualmente, en función del riesgo49. En personas con un HADS positivo, la confirmación del diagnóstico la puede realizar el médico de VIH, aplicando una entrevista semiestructurada como el MINI33 y descartando un origen orgánico de los síntomas depresivos (analítica completa con hormonas tiroides, folato y vitamina B12)26. Las pruebas de imagen cerebral no están indicadas de rutina y solo se indicarán cuando se sospeche organicidad. En todos los casos en que se identifique sintomatología depresiva habrá que realizar una evaluación del riesgo de suicidio. Para ello se recomienda utilizar la MINI o cualquier otra herramienta validada 33 En caso de que la valoración sea positiva habrá que evaluar que el paciente no reciba fármacos (como por ej. Efavirenz) asociados con un aumento del riesgo suicida y derivarlo para valoración urgente por un psiquiatra3738394041424344454647484950. Además del suicidio existen otras situaciones en las que se requerirá una valoración urgente por psiquiatría: heteroagresividad, repercusión funcional muy marcada, agitación o inhibición psicomotriz o síntomas psicóticos51.
Tratamiento
En la actualidad el modelo de manejo más aceptado para la depresión es el modelo de atención compartida entre salud mental y el médico responsable del paciente51. El tratamiento de la depresión incluye la psicoterapia525354 y los antidepresivos, siendo de elección los ISRS5556.
4.2.3. Síndrome maníaco
La prevalencia de síntomas maníacos en los pacientes con VIH es superior a la observada en la población general (8,1%)5758. La infección por VIH se ha relacionado con exacerbaciones de los síntomas maniacos y en la demencia VIH se han descrito cuadros de manía 596061626364. En relación con el TAR también se han evidenciado cuadros de manía con fármacos como Efavirenz5057. Desde el punto de vista terapéutico, la base del tratamiento de la manía secundaria serían los antipsicóticos y de la manía primaria los antipsicóticos combinados con eutimizantes como el litio o el ácido valproico. Otros fármacos potencialmente útiles, con escasa experiencia de uso en pacientes VIH, son la lamotrigina y la gabapentina556566.
4.2.4. Síndromes psicóticos
Los síndromes psicóticos son trastornos graves, que producen gran ansiedad al paciente, y que requieren un manejo especializado por psiquiatría6768. Como ocurre con la manía, la psicosis puede ser primaria o secundaria al VIH69707172. Los fármacos de elección son los antipsicóticos atípicos (clozapina, Risperidona, Olanzapina, quetiapina, amisulpiride, aripripazol o ziprasidona). El tratamiento se iniciará a dosis bajas y se mantendrá el menor tiempo posible, vigilando siempre la aparición de efectos adversos737475.
4.2.5. Trastornos de la personalidad
Entre las personas con VIH, la prevalencia de los trastornos de la personalidad puede alcanzar el 25%20 siendo los trastornos más comunes los del grupo B (el antisocial, el límite, el histriónico y el narcisista)68 Cuando se sospeche alguno de estos trastornos en la consulta de VIH, se deberá evaluar si existe riesgo de suicidio o autolesivo para posteriormente remitir al paciente, para recibir tratamiento (psicoterapia y farmacoterapia sintomática), a un especialista en salud mental6776.
Recomendaciones
- Se recomienda realizar despistaje de ansiedad y depresión, con escalas validadas como el HADS, en todas las personas con VIH en el momento del diagnóstico y a partir de ahí de forma anual o bianual (A-III).
- Cuando el resultado del despistaje de ansiedad o depresión sea positivo, el diagnóstico podría confirmarse directamente en la consulta, aplicando una entrevista semiestructurada como la MINI (B-II).
- Cuando se detecten síntomas depresivos (nuevos o un agravamiento de los ya existentes) se recomienda siempre evaluar ideación suicida y si se detecta, activar algún circuito de valoración urgente del paciente por parte de psiquiatría (A-III).
- El tratamiento inicial de los trastornos incidentales de ansiedad y de depresión que no cumplan criterios de complejidad se podrá realizar en la consulta de VIH, si se dispone de los medios y la preparación necesaria para ello (C-III).
- Cuando en una persona con VIH se detecte un trastorno maniaco o psicótico de reciente comienzo se recomienda valoración y tratamiento urgente por psiquiatría, así como descartar un origen orgánico del mismo (delirium, deterioro cognitivo, consumo de sustancias o fármacos como Efavirenz, enfermedades del sistema nervioso central (SNC)…) (A-III).
Alteraciones en las funciones fisiológicas
El diagnóstico y la vivencia de una enfermedad crónica como el VIH puede desencadenar respuestas emocionales adaptativas que se expresen mediante alteraciones en algunas funciones fisiológicas. De ellas, las más relevantes son las alteraciones del sueño, de la función sexual, del apetito, o la experimentación de fatiga. Cuando en una persona con VIH se detecten estas alteraciones se debe evaluar cual es la causa subyacente (depresión, el VIH, el TAR, comorbilidades…)77.
4.3.1. Trastornos del sueño
El insomnio es el trastorno del sueño más prevalente en personas con VIH)78. El insomnio es un fenómeno multidimensional en el que están implicados factores biológicos, psicológicos y psicosociales798081.
Diagnóstico
El despistaje del insomnio debería realizarse con frecuencia en el paciente con VIH, ya sea mediante una anamnesis dirigida que evalué la conciliación, la duración, la latencia y la calidad del sueño, así como el uso de hipnóticos o benzodiacepinas, o mediante una escala validada como el índice de calidad de sueño de Pittsburgh Figura 2. El diagnóstico del insomnio es clínico y se realiza por exclusión de otras alteraciones del sueño. El diagnóstico de insomnio se establece cuando se detectan problemas en la conciliación (>30 minutos), en el mantenimiento del sueño (despertares nocturnos de >30 minutos) o despertar precoz (>30 minutos antes de la hora deseada), que condicionan una alteración significativa en la funcionalidad diaria. La realización de pruebas complementarias como la polisomnografía solo estaría indicado en casos en los que se sospeche otro trastorno del sueño o en casos de insomnio refractarios al tratamiento.
Tratamiento
El tratamiento de elección del insomnio sería la psicoterapia (cognitivo-conductual) y la psicoeducación (revisión y corrección de las pautas de higiene del sueño)82. La psicoterapia para el insomnio puede ser proporcionada a través de varios métodos, tales como grupos terapéuticos, programas online, telefónicos o libros. Dentro de las herramientas disponibles, existe una específica para personas con VIH, la escuela del sueño online a la que se puede acceder a través del siguiente enlace: www. mejoratusueño.com. Cuando las técnicas de psicoterapia no sean efectivas o no estén disponibles, se recomienda ofrecer tratamiento farmacológico basado en evidencia83. Otra medida a contemplar en personas con VIH que reciben TAR es valorar si el paciente recibe algún fármaco que pueda inducir o agravar el insomnio como Efavirenz, Rilpivirina o los inhibidores de la integrasa84. Ver (Tabla 1).
4.3.2. Disfunción sexual
La disfunción sexual es un trastorno con una etiología mixta (psicológica y orgánica)8586 que, en el varón se expresa como disfunción eréctil, problemas de eyaculación, reducción del deseo sexual, funcionamiento orgásmico afectado y baja satisfacción sexual87 y en la mujer como disminución de placer y del deseo sexual13. Se estima que la disfunción sexual afecta con más frecuencia a las personas con VIH y que su prevalencia irá en aumento a medida que las personas con VIH envejezcan88, probablemente por una prevalencia de factores de riesgo como el tabaquismo, la obesidad, el sedentarismo, la hipertensión arterial (HTA), la diabetes mellitus (DM), la dislipemia la enfermedad cardiovascular 89.
Diagnóstico
La disfunción sexual requiere un abordaje multifactorial que cubra tanto factores psicológicos (imagen corporal, estigma o ansiedad-depresión asociada con la enfermedad y su trasmisión), como orgánicos: endocrinológicos (déficit de testosterona, hiperprolactinemia o hipertiroidismo), neurológicos (demencias, esclerosis múltiple), vasculares (enfermedad aterosclerótica) y locales (fractura de pene, fibrosis cavernosa…)9091. Otro factor para analizar sería el uso de algunos fármacos (antihipertensivos, antidepresivos, antipsicóticos, antiandrógenos o drogas recreacionales), que pueden justificar hasta el 25% de los casos 92.
Tratamiento
El tratamiento requiere la integración de abordajes psicológicos y médicos. Cuando se detecten disfunciones psicológicas de gravedad, se recomienda la derivación a especialistas en salud mental y sexología91. Respecto al tratamiento médico, la primera indicación sería disminuir o abandonar el consumo de tóxicos (alcohol, tabaco, drogas recreacionales) y modificar el tratamiento en caso de detectase el uso de fármacos que puedan causar disfunción sexual. La segunda, controlar los factores de riesgo vascular y disminuir el sedentarismo. Y la tercera, instaurar tratamiento farmacológico, preferiblemente con un inhibidor de la fosfodiesterasa-5 (sildenafilo, vardenafilo, tadalafilo o avanafilo) como fármaco de primera elección93, siempre ajustando la dosis (www.hiv-druginteracions.org) en función de la pauta de TAR. El uso de terapia sustitutiva con testosterona solo estaría indicado cuando se evidencie un hipogonadismo94. Otras opciones terapéuticas para valorar, en el varón, podrían ser la autoinyección de drogas en el pene, el uso de alprostadil intrauretral o el uso de dispositivos de aspiración en el pene; y, en la mujer, el uso de lubricantes vaginales, el tratamiento de la disfunción del suelo pélvico, el uso de cremas tópicas (1%) de testosterona (solo en mujeres postmenopáusicas) o el uso de fármacos no hormonales como la bremelanotida, la fibanserina o el Bupropion9596.
4.3.3. Trastornos del apetito
Las variaciones del apetito pueden tener un origen orgánico o psicológico. Dentro de las causas psicológicas los trastornos ansioso-depresivos se asocian con frecuencia a variaciones del apetito97. Cuando en la evaluación de una pérdida de apetito se detecten síntomas psicológicos, se recomienda que el paciente sea valorado por un profesional de salud mental.
4.3.4. Fatiga
La fatiga es un síntoma multifactorial, muy comúnmente referido por las personas con VIH98.La fatiga se ha asociado con multitud de factores de riesgo: el VIH o el TAR, el insomnio, la ansiedad, la depresión o el estrés postraumático…889899.
La terapia cognitivo-conductual ha demostrado ser de utilidad en el tratamiento de la fatiga en personas con VIH. Por el momento no existe ningún tratamiento que haya demostrado efectividad reduciendo la fatiga98100.
Recomendaciones
- El despistaje, mediante la anamnesis, de los trastornos del sueño debería realizarse en cada visita médica del paciente (A-III) y de forma anual o bianual mediante escalas como el índice de calidad del sueño de Pittsburg (B-II).
- El tratamiento inicial de los trastornos del sueño se basa en la revisión del cumplimiento de las pautas de higiene del sueño (A-III) y en las técnicas de terapia cognitivo-conductual (A-I).
- Se recomienda evitar hipnóticos y benzodiacepinas en el tratamiento del insomnio crónico. En el agudo, solo serán de elección en cuadros que no responda a las medidas no farmacológicas (C-III).
- En los cuadros de insomnio crónico secundario a trastornos emocionales pueden ser de utilidad los antidepresivos sedantes como la Mirtazapina y la trazodona (C-III).
- Se recomienda realizar despistaje de la disfunción sexual, mediante la anamnesis, de forma anual (A-III).
- El tratamiento de elección de la disfunción sexual son los inhibidores de la fosfodiesterasa-5, ajustados en función de la pauta de TAR (B-I).
- Ante cualquier variación significativa del apetito se recomienda, entre otras medidas, el despistaje de trastornos ansioso-depresivos (A-II).
- La terapia congnitivo-conductual podría ser de utilidad en el manejo de la fatiga(B-II).
Trastornos por consumo de sustancias
En las personas con VIH es muy frecuente identificar el consumo de sustancias psicoactivas. En la mayoría de los casos, estos consumos son ocasionales y esporádicos y no se asocian con problemas de salud. Solo cuando los consumos, inicialmente voluntarios, se vuelven problemáticos (se intensifican, escapan al control del individuo y perjudican la salud, en un contexto psico-bio-social, durante un periodo de tiempo significativo) se puede establecer un diagnóstico de trastorno por consumo de sustancias (TCS).
Los TCS son frecuentes en las personas con VIH101102 En esta población, el diagnóstico precoz y el tratamiento de los TCS es particularmente importante103 dado que, su presencia se ha asociado con un peor control de la infección104105106107, con más conductas de riesgo para la transmisión del VIH108, con más sintomatología asociada al VIH109110, con mayores tasas de hospitalización111, con peor calidad de vida112 y con una menor supervivencia113. Los trastornos por consumo de sustancias más frecuentes en las personas con VIH son:
Alcohol
La prevalencia del consumo excesivo de alcohol en las personas con VIH casi dobla a la de la población general114. Este tipo de consumo se ha relacionado con una mala adherencia al TAR, además de afectar las respuestas del sistema immune115116. La intoxicación por alcohol suele tener un efecto inmunosupresor mientras el consumo crónico podría ser inmunoactivador y causar inflamación crónica y estrés oxidativo115. También se asocia a un mayor riesgo de progresión de la enfermedad y un aumento del riesgo de transmisión117118119120. El consumo de alcohol en las personas con VIH aumenta el riesgo de enfermedades cardiovasculares121 en un rango del 37% al 78% 122 y de cáncer, especialmente hepatocarcinoma123 También se ha asociado a disfunción neurocognitiva124125. Sin embargo, aunque no graves, algunos estudios han descrito interacciones 126 leves del alcohol con Abacavir127, Efavirenz128 Maraviroc129o Ritonavir128.
Nicotina
La prevalencia de tabaquismo entre las personas con VIH es 2-3 veces superior a la de la población general130131y es más difícil que dejen de fumar132. El tabaquismo en las personas con VIH se asocia con un aumento en la incidencia de enfermedad pulmonar obstructiva crónica, cáncer de pulmón y enfermedades cardiovasculares y en la tasa de mortalidad133 que, se reduce al abandonar el hábito tabáquico134135. De igual forma, las personas que dejan de fumar mejoran su calidad de vida136137.
Cannabis
Los principales efectos adversos del cannabis son taquicardia, agitación, náuseas, trastornos cognitivos y trastornos psiquiátricos, como la psicosis o la paranoia138. El consumo de cannabis con fines medicinales o recreativos en las personas con VIH se estima entre 15-40%139140141142. Aunque la influencia o no del cannabis sobre el control del VIH es controvertida143144145, sus efectos secundarios, al menos de momento, desaconsejan su uso.
Cocaína
Se estima que, alrededor de ¼ parte de las personas con VIH en nuestro medio consumen cocaína146. El impacto de este consumo repercute de forma negativa sobre el control y la morbilidad relacionada con la infección y favorece conductas sexuales de riesgo20,147148149. Las principales complicaciones de la cocaína son problemas cardiovasculares, pulmonares, deterioro cognitivo, daño hepático, trastornos obstétricos y trastornos psiquiátricos (irritación, ataques de pánico, paranoia, juicio deteriorado, delirios, alteración del sueño)150.
Opiáceos
Los opiáceos son sustancias que actúan sobre los receptores endógenos opioides (mu, delta, kappa) produciendo analgesia y alteraciones del estado de ánimo. En las últimas dos décadas, el uso de opioides como la oxicodona o el fentanilo se ha asociado con un importante problema de adicción a estas sustancias151 que en algunos casos a favorecido un aumento de la trasmisión del VIH152153.
Estimulantes
El prototipo de estimulante es la 3,4-metilendioxi-metanfetamina (MDMA), un derivado anfetamínico de consumo oral (comprimidos o cristales pulverizados) con efecto empatógeno que favorece el acercamiento interpersonal. Los efectos adversos más relevantes del MDMA son: bruxismo, nistagmo, sudoración profusa, distorsiones visuales, hipertermia, hiponatrimia grave, rabdomiolisis, insuficiencia renal, convulsiones, hepatopatía156y neurotoxicidad157. En los últimos años han aparecido alternativas al MDMA (4-bromo-2,5-dimetoxifeniletilamina) con un perfil mixto (estimulante y psicodélico) y connotaciones eróticas158.
Alucinógenos
Los alucinógenos son sustancias con capacidad para alterar la conciencia, favoreciendo modificaciones en el ánimo, en los procesos de pensamiento y en la percepción del entorno y del yo159 Algunas de las sustancias alucinógenas más utilizadas son la dietilamida del ácido lisérgico, o LSD, la mescalina y la ketamina160. El principal riesgo de estas sustancias radica en la práctica de actividades peligrosas bajo su influencia (como escalar, intentar nadar, etc.)161.
Sustancias asociadas a las relaciones sexuales – “chemsex”
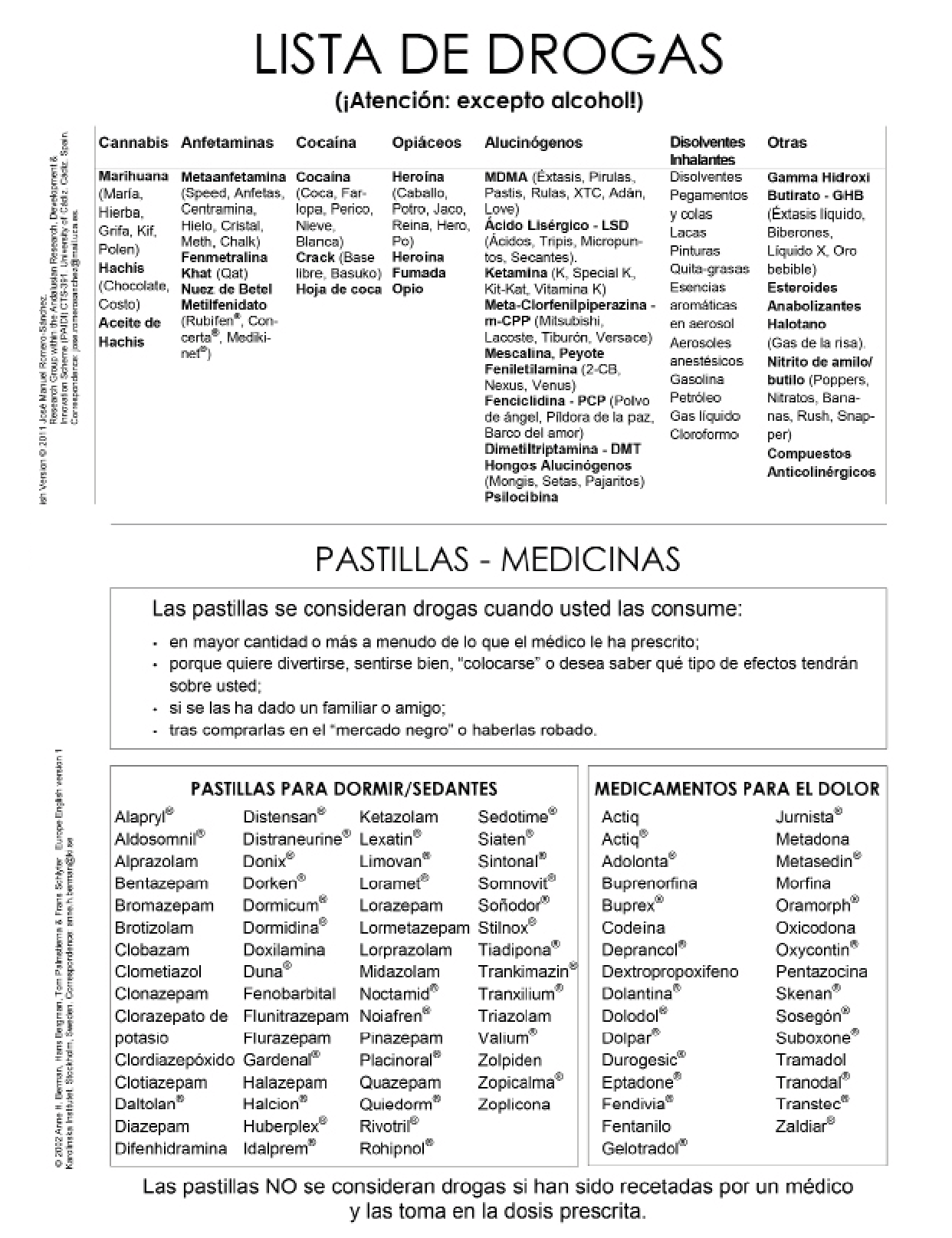
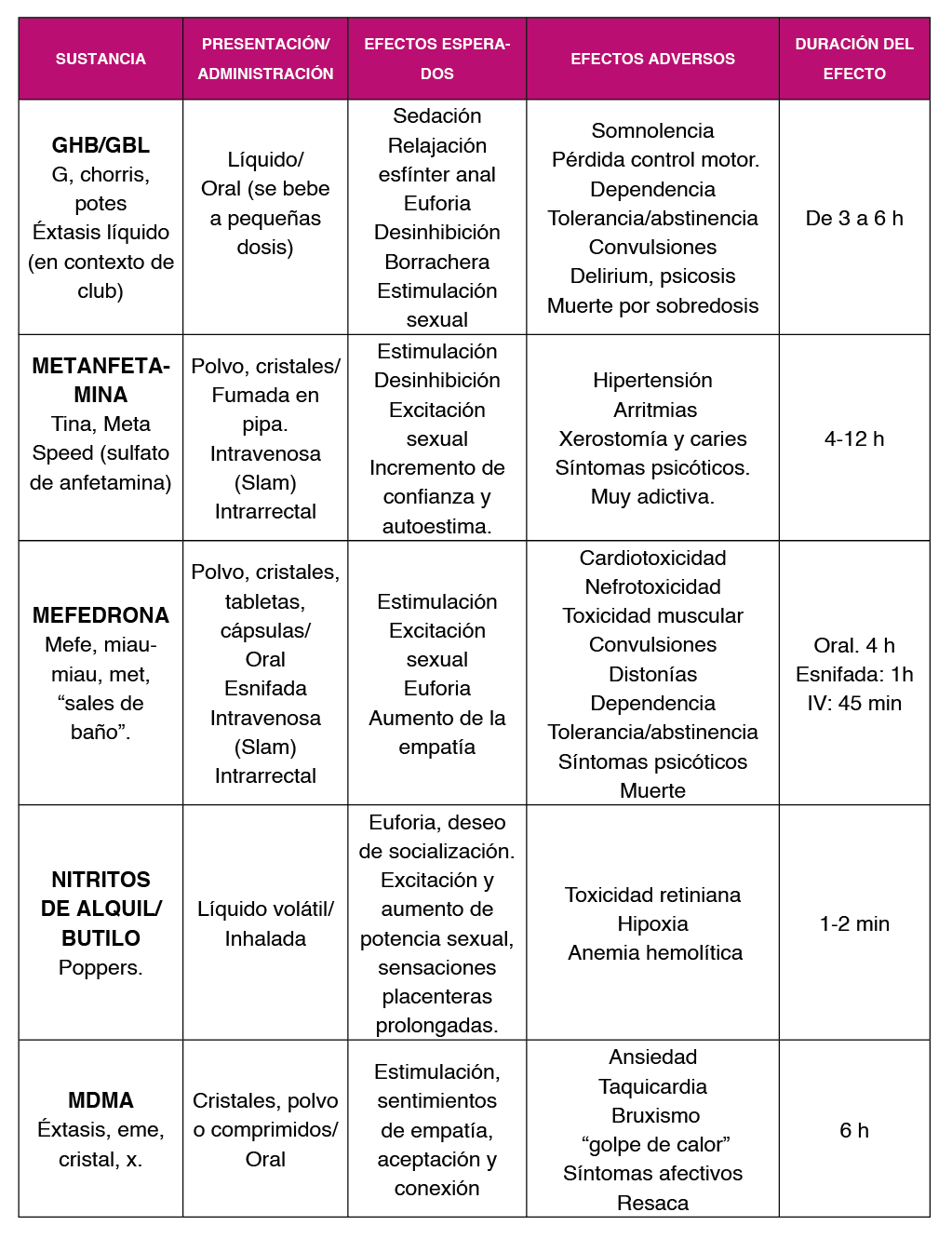
El chemsex hace referencia al uso intencionado de sustancias para potenciar las relaciones sexuales, por un largo periodo de tiempo, generalmente en el colectivo de hombres que tienen sexo con hombres888990. Las sustancias más utilizadas en la práctica del chemsex con sus principales características se incluyen en la Tabla 2 y Tabla 3.
En general, la práctica de chemsex suele ser una actividad recreativa y ocasional que, en personas vulnerables, con el tiempo se trasforma en problemática. En estos casos de chemsex problemático, es frecuente identificar TCS asociados con alguna sustancia, conductas compulsivas conductuales (sexo compulsivo) y otras adicciones comportamentales (adicción a las aplicaciones de contactos).
4.4.1. Diagnóstico
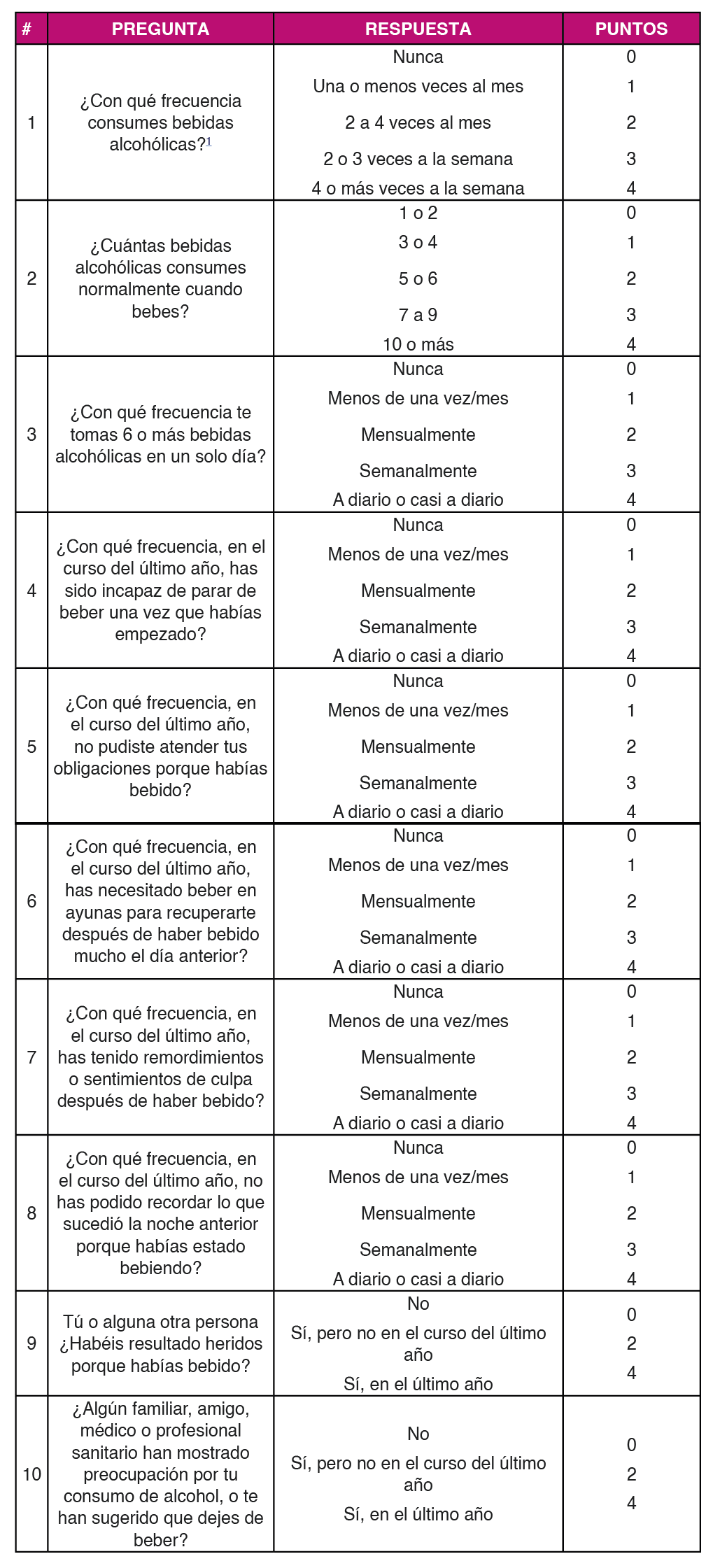
La evaluación del consumo de sustancias debería estar integrada en la anamnesis realizada al paciente con VIH en cada visita. Cuando se detecte el consumo de alguna sustancia psicoactiva, habrá que valorar: su cuantía, su frecuencia, su perfil de consumo, su vía de administración, la predisposición del paciente a abandonar o reducir el consumo, la existencia de complicaciones y de vulnerabilidades (situación social y personal). En la práctica del chemsex, habrá que explorar también el riesgo asociado con las relaciones sexuales (número de parejas, tipo de relaciones sexuales, uso de preservativo o número de infecciones de transmisión sexual (ITS)). Durante la exploración habrá que evaluar la higiene personal, la pérdida o ganancia de peso, los signos secundarios a la venopunción o a la inhalación de drogas (atrofia de la mucosa nasal o perforación del tabique nasal), la pérdida de piezas dentarias y posibles signos de intoxicación o abstinencia. La realización de pruebas de detección de tóxicos no se recomienda de rutina, aunque puede ser de utilidad. Como alternativa a la anamnesis dirigida o de forma complementaria a la misma, existen escalas validadas como la DUDIT (Drug Use Disorders Identification Test) (162 o la AUDIT (Alcohol Use Disorders Identification Test) 163 que pueden ser de utilidad en el despistaje de los TCS Figura 3, Figura 4 y Figura 5. El uso de estas escalas podría ser de utilidad en la valoración inicial tras el diagnóstico de VIH y en el seguimiento de forma anual o bianual, en función del perfil de riesgo del paciente. En aquellas personas con un despistaje positivo, La confirmación del diagnóstico la puede realizar directamente el clínico en la consulta, aplicando una entrevista semiestructurada como la entrevista neuropsiquiátrica internacional MINI 33.
4.4.2. Tratamiento
El manejo del consumo de sustancias deberá realizarse desde la consulta de VIH. El objetivo será minimizar los riesgos asociados al consumo: asegurar la adherencia al TAR, evitar las interacciones farmacológicas, evitar que se compartan las jeringuillas, las pipas o los dispositivos para esnifar... En el caso del chemsex, habrá que explorar y minimizar el riesgo de ITS (uso de la PrEP, del preservativo, screening frecuente de ITS y formación en reducción de riesgos, cuando el paciente opte por prácticas sexuales no protegidas), así como establecer circuitos de derivación específicos para el abordaje global de la sexualidad y el consumo. Cuando el consumo empiece a ser problemático o exista un TCS, el paciente debería ser remitido a un centro especializado en el tratamiento de adicciones para su tratamiento. La base del tratamiento para muchas adicciones (cannabis, cocaína, MDMA) que no cuentan con ningún tratamiento farmacológico específico es la psicoeducación y/o la psicoterapia164165. Desde el punto de vista farmacológico disponemos de tratamiento efectivo frente a la adicción por nicotina (por orden de eficacia: vareniclina166167 el Bupropion166 y terapia de sustitución con nicotina168) y por opiáceos (terapia de sustitución con metadona169). Cuando la adicción se asocie con estigma social, como ocurre por ejemplo con los opiáceos, se recomienda integrar el tratamiento de la adicción y de la infección VIH170171172. El papel del médico de VIH en el tratamiento de los TCS comprenderá la prevención y el manejo de complicaciones médicas, como las sobredosis, las intoxicaciones y las infecciones173174 Estas complicaciones son más frecuentes cuando se consume por vía endovenosa o se practica el policonsumo175.
Recomendaciones
- Se recomienda valorar el consumo de sustancias con regularidad, ya sea mediante la anamnesis y/o utilizando escalas validadas como el DUDIT o el AUDIT (A-III).
- En las personas con VIH que consumen sustancias psicoactivas sin evidencia de TCS, se recomienda la implementación de estrategias de minimización de riesgos (B-III).
- El tratamiento de los TCS debe ser
- El único tratamiento efectivo para los TCS por cannabis, cocaína y MDMA es la psicoterapia y/o psicoeducación (B-II).
- En las personas con VIH el tratamiento de elección para la deshabituación tabáquica es la vareniclina (B-II).
Tratamiento de los trastornos psicopatológicos
En la población general, el primer eslabón en el abordaje de los problemas de salud mental recae en los médicos de atención primaria. Con frecuencia, las personas con VIH utilizan al especialista en VIH como su médico de primaria. Cuando esto ocurre, el especialista en VIH tendrá que asumir las funciones de diagnóstico y tratamiento inicial de los trastornos mentales de sus pacientes, así como la coordinación con los servicios de salud mental176177178. El abordaje recomendado en estos casos se realizará en coordinación y colaboración con los profesionales en salud mental y deberá incluir176177178179180.
- Educación sanitaria sobre VIH y salud
- Educación sobre conductas de riesgo (consumo de sustancias).
- Intervenciones encaminadas a la minimización de
- Detección precoz de la enfermedad mental y, en función del tipo de trastorno, su tratamiento inicial o su derivación a salud
- Promoción de la continuidad de cuidados y de la adherencia al plan terapéutico.
4.5.1. Tratamiento psicofarmacológico
Respecto al tratamiento psicofarmacológico, el especialista en VIH debería estar familiarizado con los efectos adversos y las interacciones de los fármacos que con mayor frecuencia reciben las personas con VIH. Igualmente debería conocer y manejar el tratamiento de primera línea de aquellos trastornos que no requieran para su tratamiento inicial de un especialista en salud mental. A continuación, se describe el manejo de los principales grupos de psicofármacos en las personas con VIH.
4.5.1.1. Antidepresivos
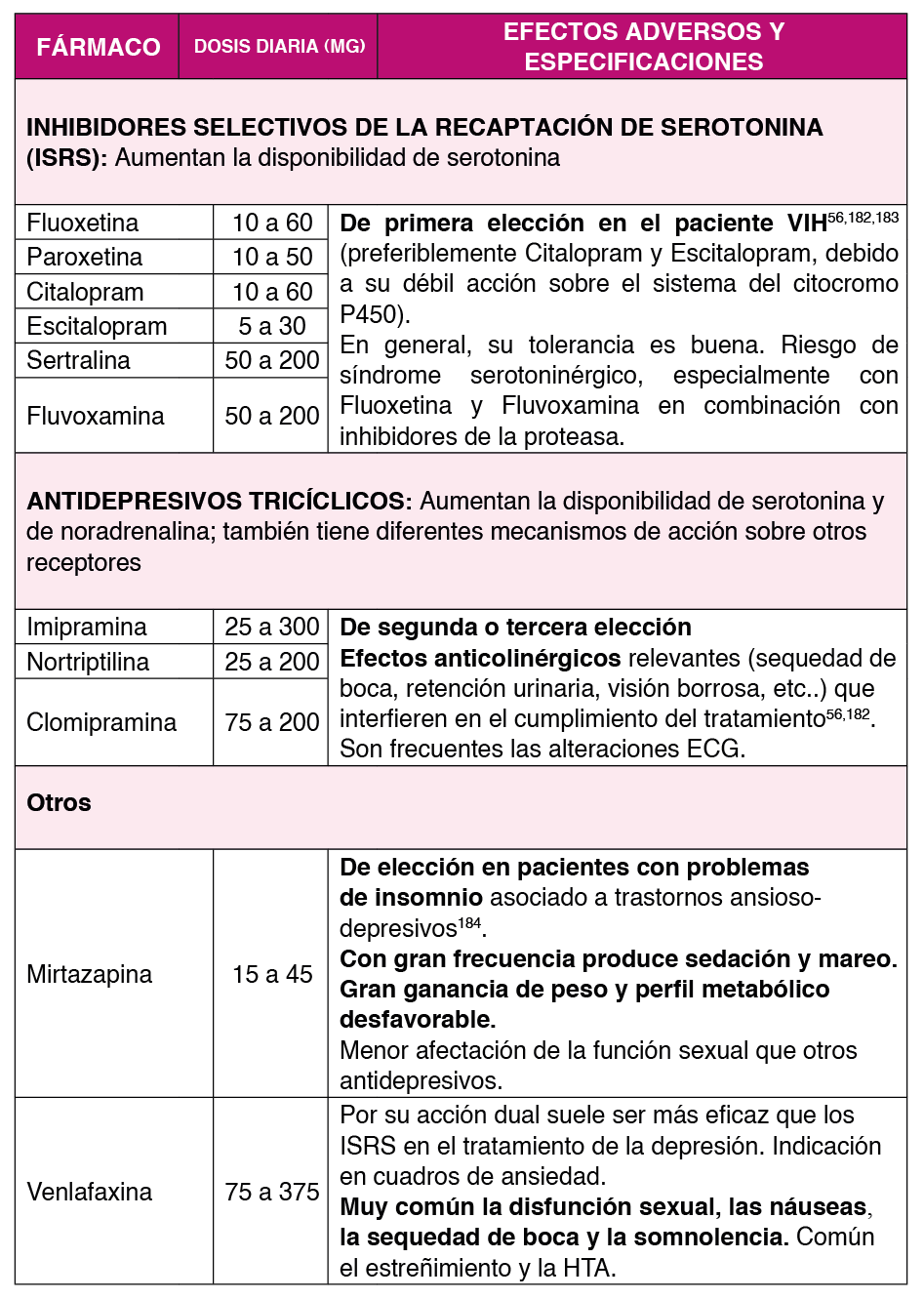
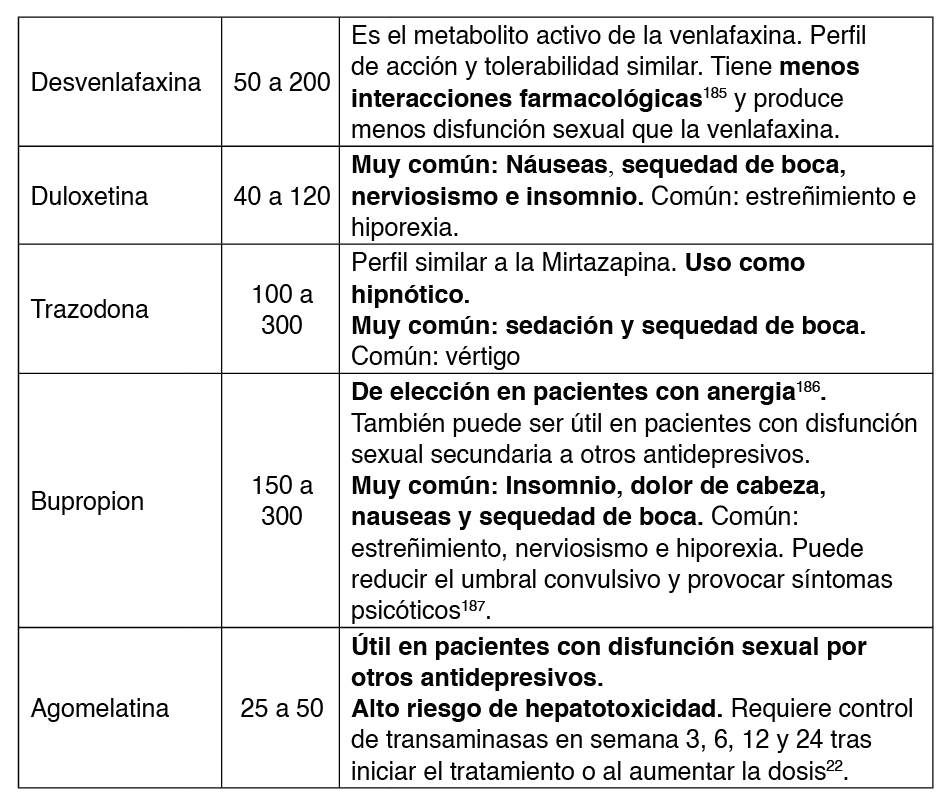
Los antidepresivos son el tratamiento de elección de los trastornos depresivos y de los trastornos de ansiedad Tabla 4 y Tabla 5. En las personas con VIH, los antidepresivos tienen una buena tolerabilidad y su eficacia en el control de los síntomas de ansiedad y depresión es superior a la del placebo181.
Fármacos de elección
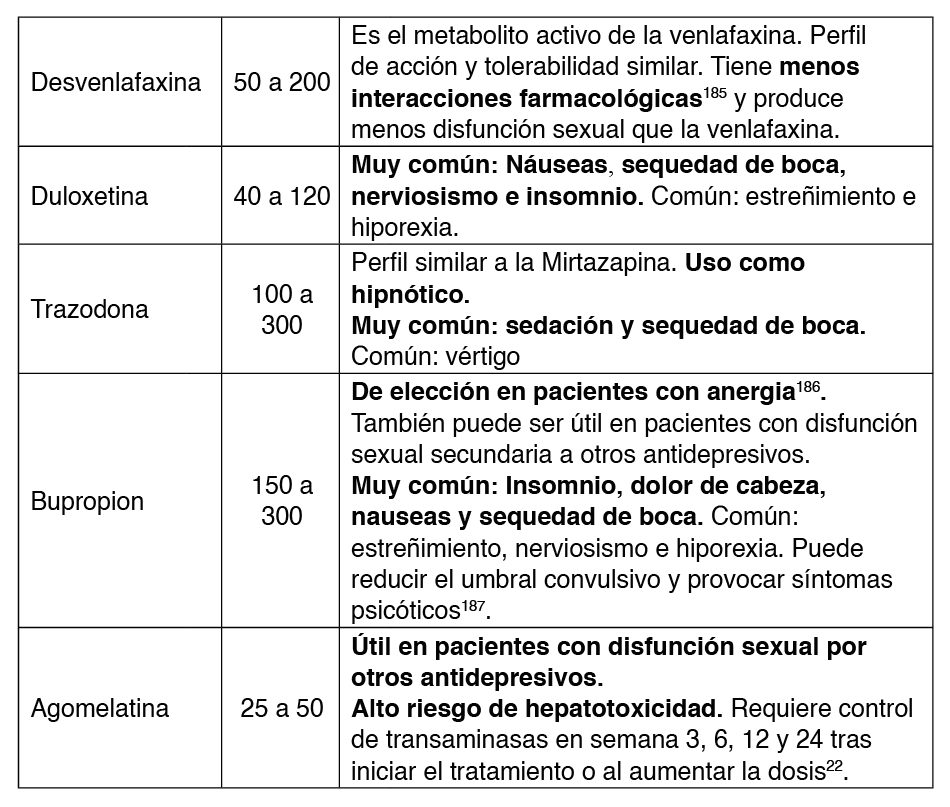
Por su perfil de interacciones los antidepresivos de elección en las personas con VIH serían los ISRS y dentro de ellos, Citalopram y Escitalopram55. En pacientes con comorbilidades el fármaco de elección puede variar. En la Tabla 6 se recoge el fármaco de elección en presencia de algunas comorbilidades comunes en las personas con VIH.
Modelo de tratamiento de la depresión
En las personas con VIH se recomienda un modelo de atención como el de Adams et al, basado en la monitorización188 según los siguientes principios:
- El tratamiento debe buscar la remisión y no la respuesta. Se recomienda ajustar el tratamiento hasta que se haya logrado una recuperación completa sin síntomas depresivos
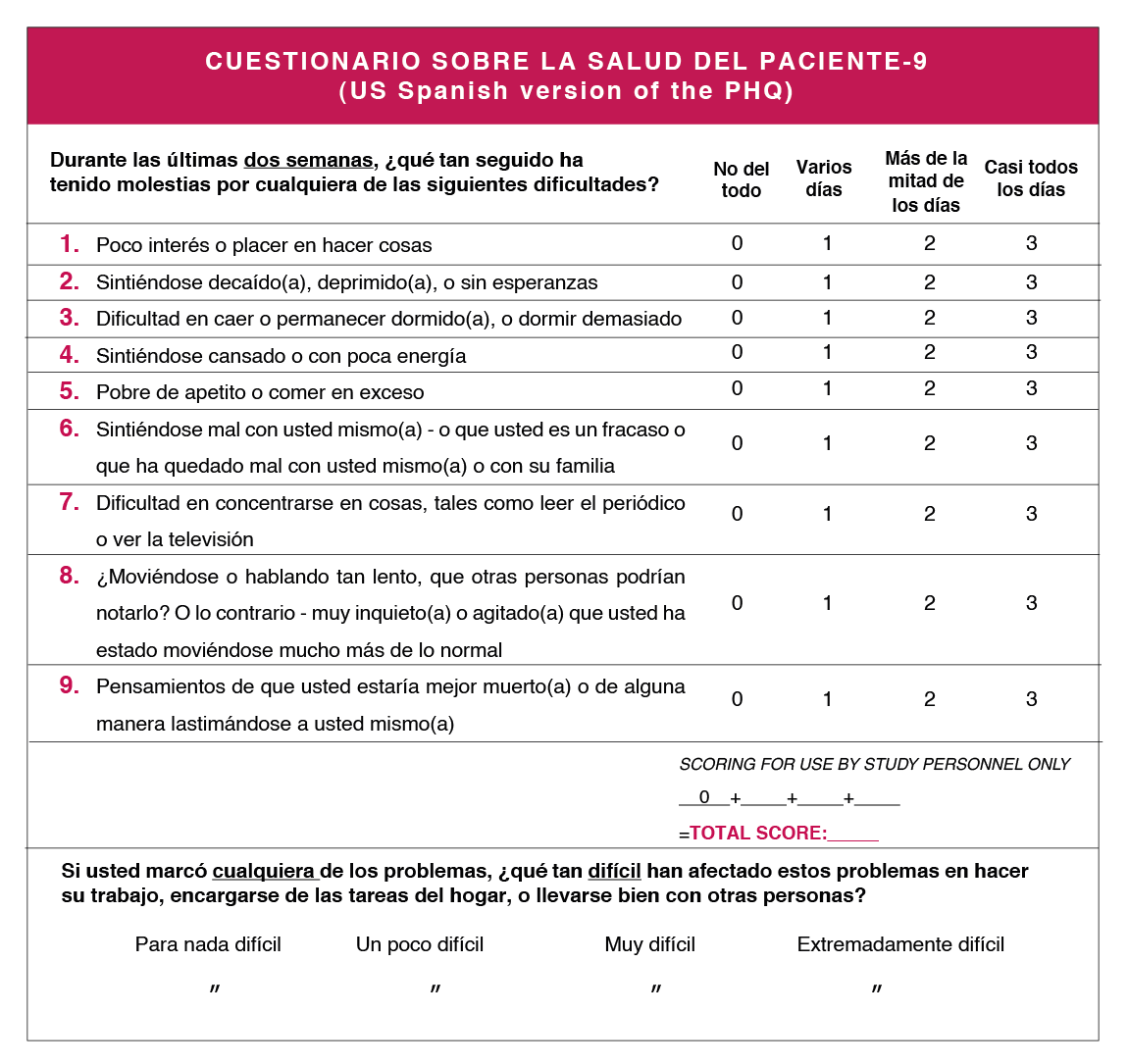
- Evaluación sistemática de los síntomas En pacientes diagnosticados de depresión, las decisiones terapéuticas deben basarse en medidas cuantitativas validadas y no en la impresión clínica. Para ello se recomienda el uso de instrumentos validados como el cuestionario sobre la salud del paciente – 9 (PHQ-9) 189.
- Monitorización frecuente de los efectos La principal causa de interrupción del tratamiento antidepresivo es la aparición de efectos adversos indeseados (disminución de la libido o aumento de peso). La monitorización frecuente y el tratamiento precoz de los efectos adversos disminuye el riesgo de interrupción del tratamiento y aumenta la adherencia.
- Inicio con la mínima dosis Para un mejor control de los efectos adversos y evitar la discontinuación del tratamiento, se recomienda el inicio del tratamiento antidepresivo con la dosis eficaz más baja.
- Aumentar la dosis de forma progresiva hasta alcanzar la remisión. La respuesta al tratamiento debe evaluarse cada 4 semanas y si se observa mejoría insuficiente, la dosis debe aumentarse hasta que se logre la remisión, hasta que los efectos adversos sean intolerables o hasta que se haya alcanzado la dosis máxima.
- Asegurar un tratamiento adecuado antes de cambiar o remitir al Mientras los efectos adversos sean tolerables, antes de considerar el cambio del tratamiento o remitir al paciente a una unidad especializada, el paciente debe recibir el tratamiento durante al menos 12 semanas, al menos 4 de ellas a dosis moderadas o altas).
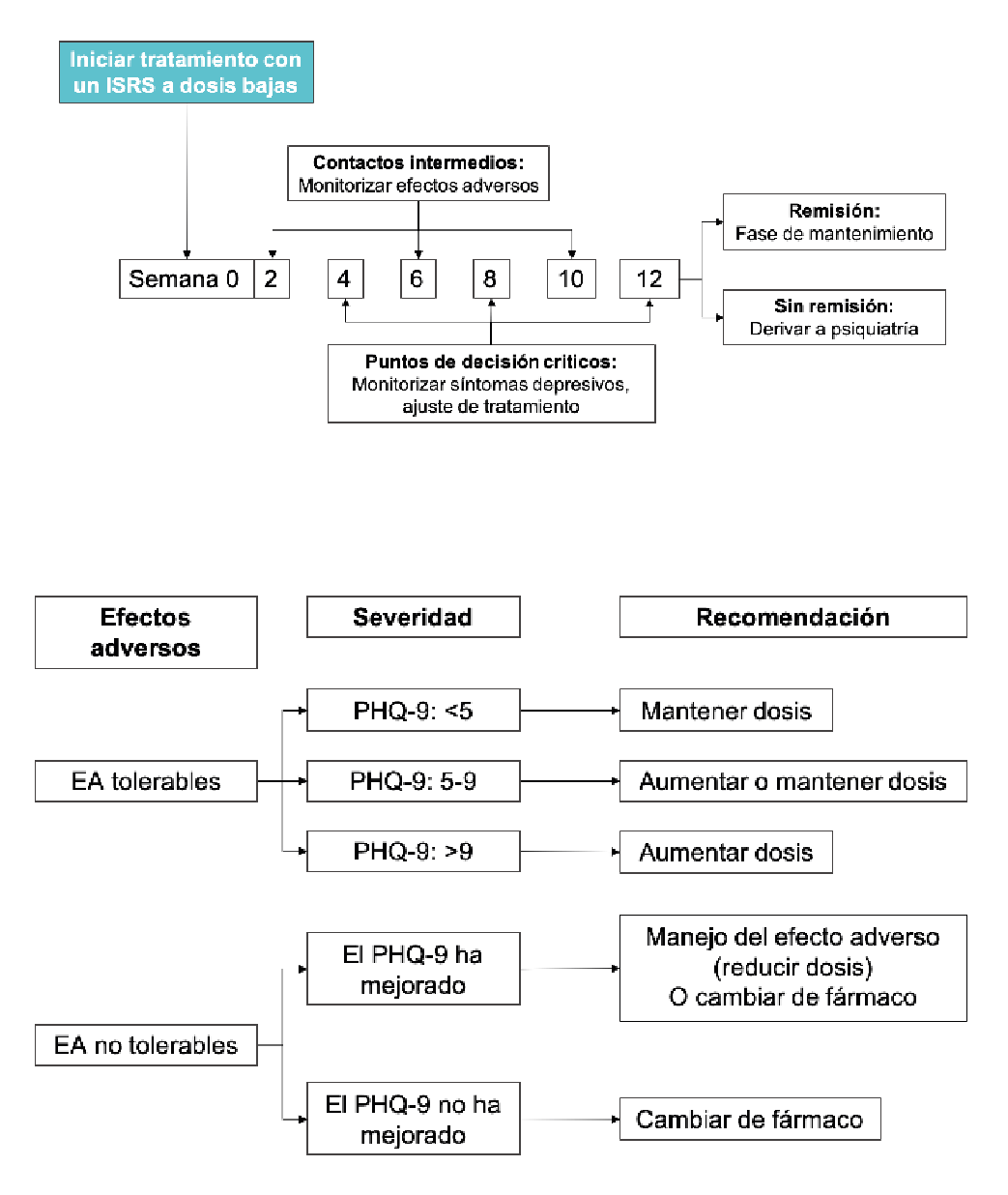
En la Figura 6 se recoge un algoritmo para que el especialista en VIH pueda iniciar el tratamiento de la depresión en la consulta de VIH basado en el modelo de Adams et al188). De forma esquemática el algoritmo propone iniciar el tratamiento con un ISRS a dosis bajas, monitorizando la aparición de efectos adversos en las semanas 2, 6 y 10 del seguimiento y la eficacia en las semanas 4, 8 y 12. La monitorización de efectos adversos puede ser telemática (médico o enfermera). Para evaluar la eficacia se utilizaría la puntuación obtenida por el paciente en el PHQ-9 Figura 7. Como refleja el algoritmo, la indicación de mantener o cambiar la dosis o el tratamiento se basarían en la presencia de efectos adversos y en el resultado del PHQ-9. Si a las 12 semanas desde el inicio del tratamiento no se ha conseguido la remisión de los síntomas depresivos se recomienda derivar al paciente a salud mental. Si se ha conseguido, se recomienda mantener el tratamiento durante 6 meses tras la remisión.
Modelo de tratamiento de la ansiedad
El modelo de tratamiento para la ansiedad es similar al propuesto para la depresión, con la salvedad de que no siempre es posible alcanzar la remisión total y que el mantenimiento del fármaco tras alcanzar la respuesta será de 12 meses en lugar de 6. Respecto a la herramienta para el control sintomático, se podría utilizar la subescala de ansiedad del HADS.
4.5.1.2. Ansiolíticos y otros fármacos hipnótico-sedantes
Benzodiacepinas
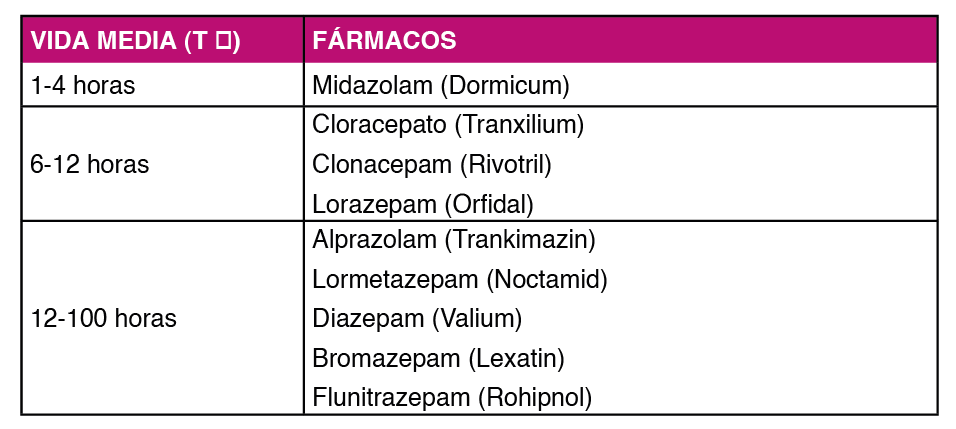
Las benzodiacepinas son fármacos que por su efecto ansiolítico potente están indicados en el tratamiento agudo de la ansiedad. Su uso se recomienda en periodos cortos (4 semanas) ya que así se reduce el riesgo de tolerancia o adicción y se consigue la máxima eficacia79 Es referible evitar este tipo de fármacos en pacientes con dependencia del alcohol y en aquellos que tienen antecedentes de abuso de sustancias190. Igualmente se desaconseja su uso en personas de edad avanzada porque aumentan el riesgo de deterioro cognitivo y de delirium.
Por su vida media, las benzodiacepinas se clasifican en vida media larga y vida media corta o media Tabla 7. Las primeras tienen la ventaja de su dosificación como monodosis nocturna y de presentar un síndrome de retirada menor. Por el contrario, tienen una mayor influencia en la actividad psicomotora y producen sedación diurna. En los pacientes con VIH se recomienda el uso de benzodiacepinas de vida media corta o media, sin metabolitos activos, siendo de elección el Lorazepam.
Gabapentina y Pregabalina
Son antiepilépticos que se utilizan como ansiolíticos. Pregabalina tiene indicación para el trastorno de ansiedad. Son fármacos con riesgo escaso de interacción farmacológica, ya que no se metabolizan. Algunos estudios indican su utilidad en pacientes con VIH con dolor neuropático191.
Zolpidem y Zopiclona
Son fármacos que se usan como hipnóticos en los trastornos del sueño.
4.5.1.2. Antipsicóticos y eutimizantes
Los antipsicóticos y los eutimizantes son fármacos de manejo complejo por su perfil de indicación y sobre todo de efectos adversos, por lo que se recomienda que su prescripción la realice un especialista en psiquiatría. Los antipsicóticos pueden ser utilizados por el especialista en VIH para tratar cuadros de delirium. En el paciente con VIH por su perfil de interacciones, el antipsicótico de elección serían la Paliperidona.
4.5.1.3. Tratamientos alternativos
Con frecuencia las personas con VIH toman sustancias llamadas “naturales” para tratar síntomas como el insomnio, la depresión, la fatiga, la ansiedad o las quejas cognitivas. Alguna de estas sustancias como el hypericum perforatum (hierba de san Juan) tienen importantes interacciones medicamentosas que desaconsejan su uso con el TAR193.
4.5.1.4. Interacciones entre los psicofármacos y el TAR
En las personas con VIH que reciben TAR se recomienda que la elección del tratamiento psicofarmacológico tenga en cuenta el perfil de efectos adversos y de interacciones del TAR177. Para ello se puede consultar el Documento de consenso de GeSIDA sobre el TAR en adultos con VIH194. El tratamiento se debe iniciar con la posología más cómoda posible, a dosis bajas, y el incremento de dosis debe ser lento.
La evaluación de las interacciones entre el TAR y los psicofármacos es compleja porque en la mayoría de los casos estas interacciones se basan en modelos teóricos y no en estudios farmacocinéticos, los cuales además no suelen tener en cuenta que las interacciones múltiples. Antes de prescribir un psicofármaco se recomienda la consulta de interacciones farmacológicas en alguno de estos recursos: www.hiv- druginteractions.org o www.interaccionesvih.com.
Recomendaciones
- Antes del inicio de un tratamiento psicofarmacológico se recomienda evaluar los posibles efectos adversos comunes y las interacciones con el TAR y con el resto de medicación, prescrita y no prescrita (productos naturales, medicinas alternativas, drogas), que toma el paciente (A-III).
- Se recomienda que el inicio de cualquier psicofármaco sea a dosis bajas y el incremento de dosis lento (A-III).
- En las personas con VIH, se recomienda aplicar el modelo de atención basada en la monitorización al tratamiento psicofarmacológico de la depresión (A-III).
- Los fármacos de elección en los trastornos de ansiedad y depresión en las personas con VIH serán los ISRS (A-II).
- Por su bajo riesgo de efectos extrapiramidales, su buen perfil metabólico y la ausencia de interacciones significativas con el TAR, el antipsicótico de elección en las personas con VIH será la Paliperidona (A-III).
- En la consulta de VIH, el uso de benzodiacepinas debería limitarse al tratamiento de cuadros agudos de ansiedad o insomnio (1-4 semanas), siendo la benzodiacepina de elección el lorazepam (C-III).
- Se recomienda limitar el uso de benzodiacepinas en las personas con VIH, especialmente en aquellas de edad avanzada o con antecedentes de trastornos por consumo de alcohol o sustancias (C-II).
4.5.2. Intervenciones psicológicas
El objetivo de las intervenciones psicológicas recomendadas en las personas con VIH es aliviar el sufrimiento relacionado con el diagnóstico de VIH y mejorar su calidad de vida195. Las intervenciones psicológicas en las personas con VIH serían:
El counselling al diagnóstico
El counselling o ayuda psicológica es una intervención que puede realizar cualquier profesional sanitario, formado previamente, orientada a ayudar al paciente a adaptarse a acontecimientos vitales estresantes196197. En las personas con VIH, las intervenciones de counselling pueden ayudar al paciente a afrontar el diagnóstico y a adaptarse a los acontecimientos vitales estresantes asociados con su condición de seropositivo196197 El counselling durante el diagnóstico debe realizarse de forma individual y confidencial, dedicando el tiempo necesario para evaluar el estado emocional y permitir al paciente exponer sus inquietudes y temores198 Los objetivos de esta intervención deben ser:
- Comunicar los resultados de forma clara, precisa y asertiva
- Escuchar al paciente de manera activa
- Asesorar en estrategias básicas de afrontamiento ante la situación estresante para reducir la ansiedad
- Aportar información precisa sobre la enfermedad (síntomas, evolución, opciones de tratamiento…)
- Romper estereotipos sociales y falsas creencias
- Recordar la alta eficacia del tratamiento
- Normalizar posibles intervenciones psicosociales posteriores
- Abordar dudas, dificultades, temores y momento para la comunicación de la seropositividad a su familia o pareja
Es importante resaltar la importancia del profesional sanitario en el apoyo emocional a las familias, para detectar y evitar los procesos de culpabilización por parte de los familiares e implicarles en un estilo de vida más saludable que debe proponerse el paciente199. En la valoración del paciente con VIH hay que tener en cuenta síntomas e indicios clínicos200 cuya presencia haría necesaria la derivación a Salud Mental para una evaluación e intervención especializada:
- Comorbilidad psiquiátrica
- Ideación o verbalización suicida
- Alteraciones anímicas y afectivas recurrentes
- Sentimientos de indefensión y desesperanza
- Conductas desadaptativas con escasa capacidad de afrontamiento
- Síntomas de ansiedad o depresión persistentes compatibles con un trastorno adaptativo de curso crónico
- Rasgos patológicos y desadaptativos de la personalidad
Intervenciones psicoeducativas
Las intervenciones psicoeducativas son estrategias educativas o formativas cuyo objetivo es desarrollar habilidades y recursos propios que permitan afrontar mejor los trastornos mentales, evitar las recaídas y mejorar la calidad de vida. En las personas con VIH, se ha evaluado con resultados inconsistentes, la utilidad de programas de intervención que aborden el malestar emocional, la indefensión, la percepción de falta de control y que promuevan el apoyo social, con el objetivo de mejorar la adherencia y las conductas de autocuidado201202.
Intervenciones psicoterapéuticas
Las intervenciones psicoterapéuticas son tratamientos, individuales, grupales o familiares, de naturaleza psicológica cuyo objetivo es lograr cambios en el comportamiento que mejoren la salud física y psíquica. Estas terapias pueden ser más eficaces para tratar algunos trastornos, como los depresivos leve-moderados, que las intervenciones farmacológicas203204. En las personas con VIH estas terapias van a favorecer una evolución positiva de la infección. La mayoría de los estudios realizados en personas con VIH han tenido un abordaje grupal, siendo escasos los que han evaluado estrategias individuales205206207208.
Terapias grupales
Las terapias grupales son más coste-efectivas que las individuales, por lo que, en un entorno de alta presión asistencial como el nuestro, permiten acceder a ellas a un mayor número de usuarios. Estas terapias han demostrado, al menos en el corto plazo, su utilidad en el manejo del estrés, la depresión, la ansiedad, el funcionamiento psicológico global, el soporte social y la calidad de vida206. Dentro de este grupo de terapias, las intervenciones basadas en mindfulness constituyen otra aproximación eficaz para el manejo del estrés en esta población209210211212.
Terapias individuales
Aunque la evidencia es limitada, dentro de las terapias individuales evaluadas en pacientes con VIH, la psicoterapia interpersonal ha mostrado ser más eficaz que psicoterapia de apoyo o la terapia cognitivo-conductual en el tratamiento de la depresión207.
Recomendaciones
- La formación en estrategias de counseling podría ser de utilidad para todos los profesionales que cuidan de personas con VIH (A-III).
- El uso de estrategias de counselling durante el proceso de trasmisión del diagnóstico de VIH facilitará la adaptación del paciente a la consulta, su aceptación del TAR y permitirá detectar síntomas que requieran valoración por especialistas en salud mental (A-III).
- Estrategias psicoeducativas, como las encaminadas a la prevención de riesgos o a mejorar la adherencia al TAR, podrían ayudar a mejorar la salud mental de las personas con VIH (C-II).
- Las técnicas cognitivo-conductuales (reestructuración cognitiva y técnicas de manejo del estrés) son efectivas en el manejo de estresores asociados al VIH y de la sintomatología ansiosa y depresiva (B-I).
Trastornos psiquiátricos en la población pediátrica
Los niños, niñas y adolescentes que viven con VIH están expuestos a múltiples factores que pueden incrementar su riesgo de tener problemas de salud mental213214. Además de factores biomédicos, sociofamiliares, económico y ambientales, el propio VIH favorece desregulación emocional y conductual al inducir fenómenos de neurotoxicidad a nivel del sistema frontoestriatal215216. Se estima que un tercio de la población pediátrica con VIH puede presentar algún tipo de alteración psicopatológica y que la incidencia de síntomas psicológicos significativos en adolescentes con infección perinatal por VIH podría ser de hasta el 11%217218. Los trastornos más prevalentes en nuestro medio serían la depresión, la ansiedad y el trastorno por déficit de atención219220221. Otros trastornos frecuentes serían las alteraciones del comportamiento y del aprendizaje, así como los déficits a nivel de las funciones ejecutivas y de la velocidad de procesamiento222223224225.
Como ocurre en la población VIH adulta, los trastornos mentales, además de empeorar la calidad de vida, se relaciona con un peor control de la infección, más comportamientos sexuales de riesgo, un mayor consumo de drogas y más dificultades en la transición a servicios de adultos(226–228). Por otra parte, se consideran factores de riesgo para una peor salud mental en menores con VIH: tener alteración de la función cognitiva, la afectación de la salud mental de los cuidadores, experimentar eventos vitales estresantes o vivir en un barrio marginal220.. Los factores que se han considerados protectores serían tener apoyo social, educativo y familiar220.
Diagnóstico
En los menores con VIH, el uso de instrumentos de cribado para la detección de los trastornos mentales favorece su diagnóstico precoz y mejora su pronóstico2. Para detectar depresión disponemos de múltiples instrumentos de cribado validados como el inventario de depresión para niños de Kovacs (CDI)229, la escala para la depresión en adolescentes (RADS)231el HADS231 o el sencillo cuestionario de salud del paciente 2 (PHQ-2)232, capaz de detectar depresión con solo dos preguntas. Para la detección del estigma existe una versión infantil de la escala Berger de VIH y estigma233. Y para otros trastornos como el trastorno por déficit de atención disponemos de escalas como el SNAP IV234 La confirmación del diagnóstico la hará el especialista en psiquiatría y psicología infantil. Existe una versión pediátrica de la entrevista semiestructurada MINI, (MINI-KIDS), que permitiría al especialista en VIH establecer el diagnóstico en la consulta 235.
Tratamiento
Los problemas de salud mental en los menores con VIH están infratratados214217236, probablemente por la falta de una exploración médica rutinaria de los mismos y por problemas de accesibilidad a los recursos de salud mental pediátrica214237. Los estudios disponibles, aunque escasos214238, sugieren que los abordajes psicológicos, como el “Collaborative HIV/AIDS Mental Health Program”, se asocian con mejorías significativas en la salud mental y en síntomas específicos como los depresivos239240241242. La evidencia disponible sugiere beneficios en el tratamiento de los problemas de salud mental en los menores con VIH en servicios de salud mental especializados situados en el mismo
centro que la unidad de VIH y en que se establezcan formulas de enlace y cooperación en la atención entre ambas unidades2. Esta atención multidisciplinar será especialmente importante durante la transición entre las unidades de VIH infantiles y de adultos214237243244
Recomendaciones
- En los menores con VIH se recomienda el uso de instrumentos de cribado para el despistaje precoz de trastornos mentales (A-III).
- El diagnóstico y el tratamiento de trastornos mentales en los menores con VIH debe realizarse en las unidades pediátricas de salud mental (B-III).
- Se recomienda la intervención de especialistas en salud mental durante la transición entre las unidades de VIH infantiles y de adultos (A-III).
Gráficos:

Este cuestionario se ha construido para ayudar a quien le trate a saber cómo se siente usted. Lea cada frase y marque la respuesta que más se ajusta a cómo se sintió usted durante la semana pasada. No piense mucho las respuestas. Lo más seguro es que, si contesta deprisa, sus respuestas podrán reflejar mejor cómo se encontraba usted durante la semana pasada. (Mire la página siguiente para realizar el cuestionario).
Interpretación
La escala está formada por catorce ítems, siete de los cuales miden la ansiedad y los otros siete la depresión (los ítems que miden la depresión están marcados con un asterisco). Cada ítem puntúa de 0 a 3 (de menos a más patología). Las respuestas de las preguntas 1, 3, 5, 6, 8, 10, 11, y 13 se puntúan de la siguiente forma: 3 puntos la primera respuesta, 2 puntos la segunda, 1 punto la tercera y 0 puntos la cuarta. Las respuestas de las preguntas 2, 4, 7, 9, 12, y 14 se puntúan de la siguiente forma: 0 puntos la primera respuesta, 1 punto la segunda, 2 puntos la tercera y 3 puntos la cuarta. Se considera que por debajo de 7 puntos no hay patología, entre 8 y 10 es dudosa, y si es mayor de 10 es indicativa de patología ansiosa o depresiva.
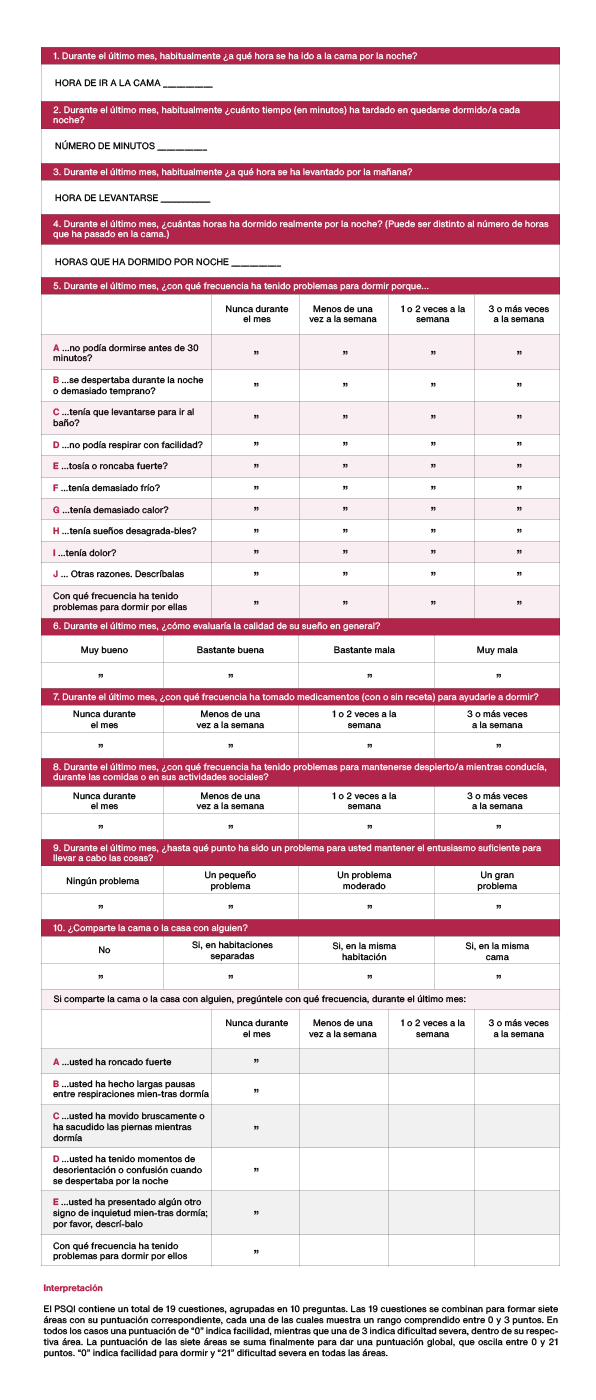
(Spanish version of the Pittsburgh Sleep Quality Index – PSQI)
INSTRUCCIONES: Las siguientes preguntas tratan sobre sus hábitos generales de sueño solamente durante el último mes (los últimos 30 días). Sus respuestas deberán ser lo más precisas posible para la mayoría de los días y noches del último mes. Por favor, conteste a todas las preguntas.

Interpretación DUDIT
Las preguntas 1-9 de la prueba puntúan entre 0 y 4 puntos cada una en función de la respuesta dada (primera columna – 0 puntos, segunda columna – 1 punto, tercera columna
– 2 puntos, cuarta columna – 3 puntos y quinta columna – 4 puntos). Y las preguntas 10-11 de la prueba puntúan entre 0, 2 o 4 puntos cada una en función de la respuesta dada (primera columna – 0 puntos, segunda columna – 2 puntos y tercera columna – 4 puntos). Una puntuación de >6 puntos en hombres y de >2 puntos en mujeres sugieren la existencia de un posible consumo problemático de una o más drogas. Puntuaciones de
>25 puntos es indicativa de probable dependencia a una o más drogas.
Interpretación AUDIT
La puntuación global de la prueba se obtendrá al sumar la puntuación otorgada a cada una de las 10 preguntas de la prueba. Una puntuación de >8 en hombres, o de >7 en mujeres, indica una fuerte probabilidad de daños debido al consumo de alcohol. Un puntaje de 20 o más sugiere una dependencia del alcohol. Una puntuación >13 en mujeres y >15 en hombres es indicativa de probable dependencia al alcohol.
* Elaborado por Spitzer RL y col. mediante una subvención educativa otorgada por Pfizer Inc. No se requiere permisos para reproducir, traducir, presentar o distribuir.
Interpretación
Si hay >4 respuestas en las columnas “mas de la mitad de los días” o “casi todos los días” (incluyendo las preguntas 1 y 2) o >5 (incluyendo la pregunta 1 o la 2), considerar un trastorno depresivo mayor. Sumar las puntuaciones para valorar la severidad (<10 leve, 10- 14 moderado, 15-19 moderado-severo y >20 severo). Considerar otro trastorno depresivo cuando el número de respuestas en las columnas “más de la mitad de los días” o “casi todos los días” sea entre 2-4 (cuando una de esas respuestas corresponde a las preguntas 1 o 2).
Tablas:


Bibliografía:
Cantú Guzmán R, Álvarez Bermúdez J, Torres López E, Martínez Sulvarán O. Impacto psicosocial asociado al diagnóstico de infección por vih/SIDA: apartados cualitativos de medición. Revista Electrónica Medicina, Salud y Published online 2012.
Flowers P, Davis MM, Larkin M, Church S, Marriott C. Understanding the impact of HIV diagnosis amongst gay men in Scotland: An interpretative phenomenological Psychology & Health. 2011;26(10):1378-1391. doi:10.1080/08870446.2010.551213
Zeligman M, Wood AW. Conceptualizing an HIV Diagnosis Through a Model of Grief and Adultspan Journal. 2017;16(1):18-30. doi:10.1002/adsp.12031
Richard Lazarus MVMSF. Estrés y Procesos Cognitivos. (Martinez Roca, ed.).; 1986.
Milena Gaviria A, Quiceno JM, Vinaccia S, Martínez LA, Otalvaro Estrategias de afrontamiento y ansiedad-depresión en pacientes diagnosticados con VIH/SIDA. Terapia Psicologica. 2009;27(1):5-13. doi:10.4067/s0718-48082009000100001
Carrobles JA, Remor E, Rodríguez-Alzamora Afrontamiento, apoyo social percibido y distrés emocional en pacientes con infección por VIH. [Relationshiop of coping and perceived social support to emotional distress in people living with HIV.]. Psicothema. 2003;15(3):420-426.
Chida Y, Vedhara Adverse psychosocial factors predict poorer prognosis in HIV disease: A meta- analytic review of prospective investigations. Brain, Behavior, and Immunity. 2009;23(4):434-445. doi:10.1016/j.bbi.2009.01.013
Ironson GH, O’Cleirigh C, Weiss A, Schneiderman N, Costa PT. Personality and HIV Disease Progression: Role of NEO-PI-R Openness, Extraversion, and Profiles of Psychosomatic Medicine. 2008;70(2):245-253. doi:10.1097/PSY.0b013e31816422fc
Lee RS, Kochman A, Sikkema Internalized Stigma Among People Living with HIV-AIDS. AIDS
Guevara-Sotelo Y, Hoyos-Hernández Vivir con VIH: experiencias de estigma sentido en
Chan RCH, Mak WWS. Cognitive, Regulatory, and Interpersonal Mechanisms of HIV Stigma on the Mental and Social Health of Men Who Have Sex With Men Living With HIV. American Journal of Men’s 2019;13(5):155798831987377. doi:10.1177/1557988319873778
Travaglini LE, Himelhoch SS, Fang LJ. HIV Stigma and Its Relation to Mental, Physical and Social Health Among Black Women Living with HIV/AIDS. AIDS and Behavior. 2018;22(12):3783-3794. doi:10.1007/s10461-018-2037-1
Atkinson JS, Nilsson Schönnesson L, Williams ML, Timpson Associations among correlates of schedule adherence to antiretroviral therapy (ART): A path analysis of a sample of crack cocaine using sexually active African–Americans with HIV infection. AIDS Care. 2008;20(2):253- 262. doi:10.1080/09540120701506788
Johnson CJ, Heckman TG, Hansen NB, Kochman A, Sikkema KJ. Adherence to antiretroviral medication in older adults living with HIV/AIDS: a comparison of alternative models. AIDS Care. 2009;21(5):541-551. doi:10.1080/09540120802385611
Santoro Pablo CF. Tipos de problemas de adherencia entre las personas con VIH y tendencias emergentes en la adherencia al tratamiento antirretroviral (TAR). Revista Multidisciplinar del 2013;1(1):41-58.
Dilla T, Valladares A, Lizán L, Sacristán JA. Adherencia y persistencia terapéutica: causas, consecuencias y estrategias de mejora. Atención Primaria. 2009;41(6):342-348. doi:10.1016/j. 2008.09.031
Owe-Larsson M, Säll L, Salamon E, Allgulander HIV infection and psychiatric illness. African
Dyer JG and Reducing HIV risk among people with serious mental illness. J
Parhami I, Fong TW, Siani A, Carlotti C, Khanlou H. Documentation of Psychiatric Disorders and Related Factors in a Large Sample Population of HIV-Positive Patients in California. AIDS and 2013;17(8):2792-2801. doi:10.1007/s10461-012-0386-8
Bing EG, Burnam MA, Longshore D, et al. Psychiatric Disorders and Drug Use Among Human Immunodeficiency Virus–Infected Adults in the United States. Archives of General Psychiatry. 2001;58(8):721. doi:10.1001/archpsyc.58.8.721
Lopes M, Olfson M, Rabkin J, et Gender, HIV Status, and Psychiatric Disorders. The Journal of
Brandt The mental health of people living with HIV/AIDS in Africa: A systematic review. African
Burnam MA, Bing EG, Morton SC, et Use of mental health and substance abuse treatment services among adults with HIV in the United States. Archives of General Psychiatry. 2001;58(8):729-736. doi:10.1001/archpsyc.58.8.729
Kessler RC, Chiu WT, Demler O, Walters EE. Prevalence, Severity, and Comorbidity of 12-Month DSM-IV Disorders in the National Comorbidity Survey Replication. Archives of General Psychiatry. 2005;62(6):617. doi:10.1001/archpsyc.62.6.617
Schadé A, van Grootheest G, Smit JH. HIV-infected mental health patients: Characteristics and comparison with HIV-infected patients from the general population and non-infected mental health BMC Psychiatry. 2013;13. doi:10.1186/1471-244X-13-35
Gallego L, Barreiro P, Lopez-Ibor Diagnosis and Clinical Features of Major Neuropsychiatric
Pence BW, O’Donnell JK, Gaynes Falling through the cracks. AIDS. 2012;26(5):656-658.
Beer L, Tie Y, Padilla M, Shouse Generalized anxiety disorder symptoms among persons with diagnosed HIV in the United States. AIDS. 2019;33(11):1781-1787. doi:10.1097/ QAD.0000000000002286
Rane MS, Hong T, Govere S, et al. Depression and Anxiety as Risk Factors for Delayed Care- Seeking Behavior in Human Immunodeficiency Virus–Infected Individuals in South Africa. Clinical Infectious 2018;67(9):1411-1418. doi:10.1093/cid/ciy309
Glynn TR, Safren SA, Carrico AW, et al. High Levels of Syndemics and Their Association with Adherence, Viral Non-suppression, and Biobehavioral Transmission Risk in Miami, a S. City with an HIV/AIDS Epidemic. AIDS and Behavior. 2019;23(11):2956-2965. doi:10.1007/s10461-019- 02619-0
Been SK, Schadé A, Bassant N, Kastelijns M, Pogány K, Verbon A. Anxiety, depression and treatment adherence among HIV-infected AIDS Care. 2019;31(8):979-987. doi:10.1080/ 09540121.2019.1601676
Zigmond AS, Snaith The Hospital Anxiety and Depression Scale. Acta Psychiatrica
Ferrando L, Bobes J Gibert M, Soto M, Soto M.I.N.I. Mini International Neuropsychiatric
Baldwin DS, Anderson IM, Nutt DJ, Evidence-basedguidelinesforthepharmacologicaltreatment of anxiety disorders: recommendations from the British Association for Psychopharmacology. Journal of Psychopharmacology. 2005;19(6):567-596. doi:10.1177/0269881105059253
Rabkin HIV and depression: 2008 review and update. Current HIV/AIDS Reports. 2008;5(4):163-
doi:10.1007/s11904-008-0025-1
Leserman HIV disease progression: depression, stress, and possible mechanisms. Biological
Mollan KR, Smurzynski M, Eron JJ, et Association Between Efavirenz as Initial Therapy for HIV- 1 Infection and Increased Risk for Suicidal Ideation or Attempted or Completed Suicide. Annals of Internal Medicine. 2014;161(1):1. doi:10.7326/M14-0293
Slot M, Sodemann M, Gabel C, Holmskov J, Laursen T, Rodkjaer Factors associated with risk of depression and relevant predictors of screening for depression in clinical practice: a cross- sectional study among HIV-infected individuals in Denmark. HIV Medicine. 2015;16(7):393-402. doi:10.1111/hiv.12223
Robertson K, Bayon C, Molina J-M, et al. Screening for neurocognitive impairment, depression, and anxiety in HIV-infected patients in Western Europe and AIDS Care. 2014;26(12):1555- 1561. doi:10.1080/09540121.2014.936813
Morrison MF, Petitto JM, Have T ten, et al. Depressive and Anxiety Disorders in Women With HIV
Rao D, Feldman BJ, Fredericksen RJ, et al. A Structural Equation Model of HIV-Related Stigma, Depressive Symptoms, and Medication Adherence. AIDS and Behavior. 2012;16(3):711-716. doi:10.1007/s10461-011-9915-0
Ciesla JA, Roberts JE. Meta-Analysis of the Relationship Between HIV Infection and Risk for Depressive Disorders. American Journal of Psychiatry. 2001;158(5):725-730. doi:10.1176/appi. 158.5.725
Tegger MK, Crane HM, Tapia KA, Uldall KK, Holte SE, Kitahata MM. The Effect of Mental Illness, Substance Use, and Treatment for Depression on the Initiation of Highly Active Antiretroviral Therapy among HIV-Infected Individuals. AIDS Patient Care and STDs. 2008;22(3):233-243. doi:10.1089/apc.2007.0092
Gonzalez JS, Batchelder AW, Psaros C, Safren Depression and HIV/AIDS Treatment Nonadherence: A Review and Meta-analysis. JAIDS Journal of Acquired Immune Deficiency Syndromes. 2011;58(2):181-187. doi:10.1097/QAI.0B013E31822D490A
Springer SA, Dushaj A, Azar MM. The Impact of DSM-IV Mental Disorders on Adherence to Combination Antiretroviral Therapy Among Adult Persons Living with HIV/AIDS: A Systematic AIDS and Behavior. 2012;16(8):2119-2143. doi:10.1007/s10461-012-0212-3
Sherr L, Clucas C, Harding R, Sibley E, Catalan J. HIV and Depression – a systematic review of Psychology, Health & Medicine. 2011;16(5):493-527. doi:10.1080/13548506.2011.5 79990
Leserman Role of Depression, Stress, and Trauma in HIV Disease Progression. Psychosomatic
So‐Armah K, Gupta S, Kundu S, et Depression and all‐cause mortality risk in HIV‐infected and HIV‐uninfected US veterans: a cohort study. HIV Medicine. 2019;20(5):317-329. doi:10.1111/ hiv.12726
European AIDS Clinical Society. EACS Guidelines version 10.0 — EACS. Published November Accessed June 25, 2020. https://www.eacsociety.org/files/2019_guidelines-10.0_final.pdf.
Treisman GJ, Soudry O. Neuropsychiatric Effects of HIV Antiviral Medications. Drug Safety. 2016;39(10):945-957. doi:10.1007/s40264-016-0440-y
Aragonès E, Roca M, Mora F. Abordaje Compartido de La Depresión: Consenso Multidisciplinar ; 2018. Accessed June 25, 2020. Ebook disponible en: www.semfyc.es/wp-content/ uploads/2018/05/ Consenso_depresion.pdf.
Laperriere A, Ironson GH, Antoni MH, et al. Decreased Depression Up to One Year Following CBSM+ Intervention in Depressed Women with AIDS: The Smart/EST Women’s Project. Journal of Health 2005;10(2):223-231. doi:10.1177/1359105305049772
Carrico AW, Antoni MH, Durán RE, et Reductions in depressed mood and denial coping during
Paulus DJ, Brandt CP, Lemaire C, Zvolensky MJ. Trajectory of change in anxiety sensitivity in relation to anxiety, depression, and quality of life among persons living with HIV/AIDS following transdiagnostic cognitive-behavioral therapy. Cognitive Behaviour Therapy. 2020;49(2):149-163. doi:10.1080/16506073.2019.1621929
Freudenreich O, Goforth HW, Cozza KL, et Psychiatric treatment of persons with HIV/AIDS: An HIV-psychiatry consensus survey of current practices. Psychosomatics. 2010;51(6):480-488. doi:10.1176/appi.psy.51.6.480
Ferrando SJ, Freyberg Treatment of depression in HIV positive individuals: A critical review.
Chandra PS, Desai G, Ranjan HIV & Psychiatric Disorders. Vol 121.; 2005.
de Sousa Gurgel W, da Silva Carneiro AH, Barreto Rebouças D, Negreiros de Matos KJ, do Menino Jesus Silva Leitão T, de Matos e Souza FG. Prevalence of bipolar disorder in a HIV- infected outpatient AIDS Care. 2013;25(12):1499-1503. doi:10.1080/09540121.2013.7 79625
Kieburtz K, Zettelmaier AE, Ketonen L, Tuite M, Caine Manic syndrome in AIDS. American
Ellen SR, Judd FK, Mijch AM, Cockram Secondary Mania in Patients with HIV Infection. Australian
Nakimuli-Mpungu E, Musisi S, Mpungu SK, Katabira Primary Mania Versus HIV-Related Secondary Mania in Uganda. American Journal of Psychiatry. 2006;163(8):1349-1354. doi:10.1176/ ajp.2006.163.8.1349
Robinson Primary Mania Versus Secondary Mania of HIV/AIDS in Uganda. American Journal
Nakimuli-Mpungu E, Musisi S, Kiwuwa Mpungu S, Katabira E. Clinical Presentation of Bipolar Mania in HIV-Positive Patients in Psychosomatics. 2009;50(4):325-330. doi:10.1176/appi. psy.50.4.325
Lyketsos CG, Hanson AL, Fishman M, Rosenblatt A, McHugh PR, Treisman GJ. Manic syndrome early and late in the course of HIV. American Journal of Psychiatry. 1993;150(2):326-327. doi:10.1176/ajp.150.2.326
Nakimuli-Mpungu, Mutamba Brian, Nshemerirwe Slyvia, Kiwuwa Mpungu Steven, Seggane Musisi. Effect of HIV infection on time to recovery from an acute manic HIV/AIDS - Research and Palliative Care. 2010;2:185. doi:10.2147/hiv.s9978
Soares Recent advances in the treatment of bipolar mania, depression, mixed states, and rapid cycling. International Clinical Psychopharmacology. 2000;15(4):183-196. doi:10.1097/00004850- 200015040-00001
American Psychiatric Diagnostic and Statistical Manual of Mental Disorders DSM-5
Stolar A. HIV and Psychiatry, Second Edition: A Training and Resource Manual . Cambridge University Press;
Newton PJ, Newsholme W, Brink NS, Manji H, Williams IG, Miller RF. Acute meningoencephalitis and meningitis due to primary HIV infection. BMJ (Clinical research ed). 2002;325(7374):1225- https://Pubmed.ncbi.nlm.nih.gov/12446542
Anguizola-Tamayo D, Bocos-Portillo J, Pardina-Vilella L, et al. Psychosis of dual origin in HIV infection: Viral escape syndrome and autoimmune encephalitis. Neurology Clinical practice. 2019;9(2):178-180. doi:10.1212/CPJ.0000000000000582
Laher A, Ariefdien N, Etlouba HIV prevalence among first-presentation psychotic patients. HIV
de Ronchi D, Faranca I, Forti P, et al. Development of Acute Psychotic Disorders and HIV-1 The International Journal of Psychiatry in Medicine. 2000;30(2):173-183. doi:10.2190/ PLGX-N48F-RBHJ-UF8K
Singh AN, Golledge H, Catalan Treatment of HIV-related psychotic disorders with risperidone: A series of 21 cases. Journal of Psychosomatic Research. 1997;42(5):489-493. doi:10.1016/S0022- 3999(96)00373-X
Fernandez F, Levy JK. The use of molindone in the treatment of psychotic and delirious patients infected with the human immunodeficiency virus. General Hospital Psychiatry. 1993;15(1):31-35. doi:10.1016/0163-8343(93)90088-6
Sewell DD, Jeste D , McAdams LA, et al. Neuroleptic Treatment of HIV-Associated Psychosis.
Millon Classifying Personality Disorders: An Evolution-Based Alternative to an Evidence-Based
Nanni MG, Caruso R, Mitchell AJ, Meggiolaro E, Grassi Depression in HIV Infected Patients: a
Low Y, Goforth H, Preud’homme X, Edinger J, Krystal A. Insomnia in HIV-infected patients: pathophysiologic . AIDS Reviews. 2014;16:3-13.
Omonuwa TS, Goforth HW, Preud’homme X, Krystal AD. The pharmacologic management of insomnia in patients with Journal of clinical sleep medicine : JCSM : official publication of the American Academy of Sleep Medicine. 2009;5(3):251-262. https://Pubmed.ncbi.nlm.nih. gov/19960648
Fekete EM, Williams SL, Skinta MD. Internalised HIV-stigma, loneliness, depressive symptoms and sleep quality in people living with Psychology & Health. 2018;33(3):398-415. doi:10.1080
Rogers BG, Lee JS, Bainter SA, Bedoya CA, Pinkston M, Safren A multilevel examination of sleep, depression, and quality of life in people living with HIV/AIDS. Journal of health psychology. Published online March 1, 2018:1359105318765632-1359105318765632. doi:10.1177/1359105318765632
Qaseem A, Kansagara D, Forciea MA, Cooke M, Denberg TD. Management of Chronic Insomnia Disorder in Adults: A Clinical Practice Guideline From the American College of Physicians. Annals of Internal 2016;165(2):125. doi:10.7326/M15-2175
Wilson S, Anderson K, Baldwin D, et al. British Association for Psychopharmacology consensus statement on evidence-based treatment of insomnia, parasomnias and circadian rhythm disorders: An Journal of Psychopharmacology. 2019;33(8):923-947. doi:10.1177/0269881119855343
Celesia M., Sofia S. A., Rapisarda L., et al. Anxiety, depression and sleep disturbances in hiv+ patients chronically treated with an Efavirenz-based regimen. Infectious Diseases & Tropical Medicine . 2017;3(2):e394.
Asboe D, Catalan J, Mandalia S, et Sexual dysfunction in HIV-positive men is multi-factorial: A study of prevalence and associated factors. AIDS Care - Psychological and Socio-Medical Aspects of AIDS/HIV. 2007;19(8):955-965. doi:10.1080/09540120701209847
Sandfort TGM, Collier KL, Grossberg R. Addressing sexual problems in HIV primary care: Experiences from patients. Archives of Sexual Behavior. 2013;42(7):1357-1368. doi:10.1007/ s10508-012-0009-5
Waters L, Fisher M, Winston A, et A phase IV, double-blind, multicentre, randomized, placebo- controlled, pilot study to assess the feasibility of switching individuals receiving Efavirenz with continuing central nervous system adverse events to etravirine. AIDS. 2011;25(1):65-71. doi:10.1097/QAD.0b013e328341685b
Pinzone MR, Gussio M, Bellissimo F, et Self-Reported Sexual Dysfunction in HIV-Positive
Laumann EO, Paik A, Rosen Sexual dysfunction in the United States: Prevalence and predictors.
Shamloul R, Ghanem Erectile dysfunction. The Lancet. 2013;381(9861):153-165. doi:10.1016/
Santi D, Brigante G, Zona S, Guaraldi G, Rochira Male sexual dysfunction and HIV-a clinical
Slag MF, Morley JE, Elson MK, et Impotence in Medical Clinic Outpatients. JAMA. 1983;249(13):1736-1740. doi:10.1001/jama.1983.03330370046029
Tsertsvadze A, Fink HA, Yazdi F, et al. Oral Phosphodiesterase-5 Inhibitors and Hormonal Treatments for Erectile Dysfunction: A Systematic Review and Meta-analysis. Annals of Internal 2009;151(9):650. doi:10.7326/0003-4819-151-9-200911030-00150
Brock G, Heiselman D, Maggi M, et al. Effect of Testosterone Solution 2% on Testosterone Concentration, Sex Drive and Energy in Hypogonadal Men: Results of a Placebo Controlled Journal of Urology. 2016;195(3):699-705. doi:10.1016/j.juro.2015.10.083
Cai T, Palumbo F, Liguori G, et al. The intra-meatal application of alprostadil cream (Vitaros®) improves drug efficacy and patient’s satisfaction: results from a randomized, two-administration route, cross-over clinical International Journal of Impotence Research. 2019;31(2):119-125. doi:10.1038/s41443-018-0087-6
Derouet H, Caspari D, Rohde V, Rommel G, Ziegler Treatment of erectile dysfunction with
Zhu Z, Zhao R, Hu Y. Symptom Clusters in People Living With HIV: A Systematic Review. Journal
Jong E, Oudhoff LA, Epskamp C, et Predictors and treatment strategies of HIV-related fatigue in the combined antiretroviral therapy era. AIDS. 2010;24(10):1387-1405. doi:10.1097/ QAD.0b013e328339d004
Bengtson AM, Pence BW, Crane HM, et Disparities in depressive symptoms and antidepressant treatment by gender and race/ethnicity among people living with HIV in the United States. PLoS ONE. 2016;11(8). doi:10.1371/journal.pone.0160738
Webel AR, Perazzo J, Decker M, Horvat-Davey C, Sattar A, Voss J. Physical activity is associated with reduced fatigue in adults living with HIV/AIDS. Journal of Advanced 2016;72(12):3104- 3112. doi:10.1111/jan.13084
Bertholet N, Cheng DM, Samet JH, Quinn E, Saitz R. Alcohol consumption patterns in HIV- infected adults with alcohol problems. Drug and Alcohol Dependence. 2010;112(1-2):160-163. doi:10.1016/j.drugalcdep.2010.05.009
Braithwaite RS, Conigliaro J, Roberts MS, et al. Estimating the impact of alcohol consumption on survival for HIV+ individuals. AIDS Care - Psychological and Socio-Medical Aspects of AIDS/HIV. 2007;19(4):459-466. doi:10.1080/09540120601095734
Lucas GM, Mullen BA, Weidle PJ, Hader S, McCaul ME, Moore RD. Directly Administered Antiretroviral Therapy in Methadone Clinics Is Associated with Improved HIV Treatment Outcomes, Compared with Outcomes among Concurrent Comparison Groups. Clinical Infectious Diseases. 2006;42(11):1628-1635. doi:10.1086/503905
Andersen R, Bozzette S, Shapiro M, et al. Access of vulnerable groups to antiretroviral therapy among persons in care for HIV disease in the United States. HCSUS Consortium. HIV Cost and Services Utilization Study. Health services research. 2000;35(2):389-416. https://Pubmed.ncbi. nih.gov/10857469
Cook RL, Sereika SM, Hunt SC, Woodward WC, Erlen JA, Conigliaro J. Problem drinking and medication adherence among persons with HIV infection. Journal of General Internal Medicine. 2001;16(2):83-88. doi:10.1111/j.1525-1497.2001.00122.x
Azar MM, Springer SA, Meyer JP, Altice FL. A systematic review of the impact of alcohol use disorders on HIV treatment outcomes, adherence to antiretroviral therapy and health care Drug and Alcohol Dependence. 2010;112(3):178-193. doi:10.1016/j.drugalcdep.2010.06.014
Wu ES, Metzger DS, Lynch KG, Douglas Association between alcohol use and HIV viral load. Journal of Acquired Immune Deficiency Syndromes. 2011;56(5). doi:10.1097/ QAI.0b013e31820dc1c8
Stein MD, Hanna L, Natarajan R, et al. Alcohol use patterns predict high-risk HIV behaviors among active injection drug users. Journal of Substance Abuse Treatment. 2000;18(4):359-363. doi:10.1016/S0740-5472(99)00070-7
Mathews WC, McCutchan JA, Asch S, et National estimates of HIV-related symptom prevalence from the HIV cost and services utilization study. Medical Care. 2000;38(7):750-761. doi:10.1097/00005650-200007000-00007
Shacham E, Agbebi A, Stamm K, Overton ET. Alcohol consumption is associated with poor health in HIV clinic patient population: A behavioral surveillance AIDS and Behavior. 2011;15(1):209- 213. doi:10.1007/s10461-009-9652-9
Palepu A, Horton NJ, Tibbetts N, Meli S, Samet Substance abuse treatment and hospitalization among a cohort of HIV-infected individuals with alcohol problems. Alcoholism: Clinical and Experimental Research. 2005;29(3):389-394. doi:10.1097/01.ALC.0000156101.84780.45
Korthuis PT, Tozzi MJ, Nandi V, et Improved quality of life for opioid-dependent patients receiving buprenorphine treatment in HIV clinics. Journal of Acquired Immune Deficiency Syndromes. 2011;56(SUPPL. 1). doi:10.1097/QAI.0b013e318209754c
Lucas GM, Griswold M, Gebo KA, Keruly J, Chaisson RE, Moore Illicit Drug Use and HIV- 1 Disease Progression: A Longitudinal Study in the Era of Highly Active Antiretroviral Therapy. American Journal of Epidemiology. 2006;163(5):412-420. doi:10.1093/aje/kwj059
Galvan FH, Bing EG, Fleishman JA, et al. The prevalence of alcohol consumption and heavy drinking among people with HIV in the United States: Results from the HIV cost and services utilization Journal of Studies on Alcohol. 2002;63(2):179-186. doi:10.15288/jsa.2002.63.179
Bagby GJ, Amedee AM, Siggins RW, Molina PE, Nelson S, Veazey Alcohol and HIV Effects on the Immune System. Alcohol research : current reviews. 2015;37(2):287-297. https://Pubmed. ncbi.nlm.nih.gov/26695751
Amedee A, Nichols W, Robichaux S, Bagby G, Nelson S. Chronic Alcohol Abuse and HIV Disease Progression: Studies with the Non-Human Primate Current HIV Research. 2014;12(4):243- 253. doi:10.2174/1570162x12666140721115717
Ludford KT, Vagenas P, Lama JR, et al. Screening for Drug and Alcohol Use Disorders and Their Association with HIV-Related Sexual Risk Behaviors among Men Who Have Sex with Men in PLoS ONE. 2013;8(8). doi:10.1371/journal.pone.0069966
Parry CD, Blank MB, Pithey AL. Responding to the threat of HIV among persons with mental illness and substance abuse. Current Opinion in Psychiatry. 2007;20(3):235-241. doi:10.1097/ 0b013e3280ebb5f0
Kader R, Govender R, Seedat S, Koch JR, Parry C. Understanding the impact of hazardous and harmful use of alcohol and/or other drugs on ARV adherence and disease progression. PLoS 2015;10(5). doi:10.1371/journal.pone.0125088
Pellowski JA, Kalichman SC, Kalichman MO, Cherry C. Alcohol-antiretroviral therapy interactive toxicity beliefs and daily medication adherence and alcohol use among people living with HIV. AIDS Care - Psychological and Socio-Medical Aspects of AIDS/HIV. 2016;28(8):963-970. doi:10. 1080/09540121.2016.1154134
Williams EC, Hahn JA, Saitz R, Bryant K, Lira MC, Samet Alcohol Use and Human Immunodeficiency Virus (HIV) Infection: Current Knowledge, Implications, and Future Directions. Alcoholism: Clinical and Experimental Research. 2016;40(10):2056-2072. doi:10.1111/acer.13204
Kelso NE, Sheps DS, Cook RL. The association between alcohol use and cardiovascular disease among people living with HIV: A systematic American Journal of Drug and Alcohol Abuse. 2015;41(6):479-488. doi:10.3109/00952990.2015.1058812
McGinnis KA, Fultz SL, Skanderson M, Conigliaro J, Bryant K, Justice Hepatocellular carcinoma and non-Hodgkin’s lymphoma: The roles of HIV, hepatitis C infection, and alcohol abuse. Journal of Clinical Oncology. 2006;24(31):5005-5009. doi:10.1200/JCO.2006.05.7984
Fein G, Biggins CA, MacKay S. Alcohol abuse and HIV infection have additive effects on frontal cortex function as measured by auditory evoked potential P3A latency. Biological Psychiatry. 1995;37(3):183-195. doi:10.1016/0006-3223(94)00119-N
Gongvatana A, Morgan EE, Iudicello JE, Letendre SL, Grant I, Woods SP. A history of alcohol dependence augments HIV-associated neurocognitive deficits in persons aged 60 and older. Journal of 2014;20(5):505-513. doi:10.1007/s13365-014-0277-z
Pérez-Molina JA, Polo R, López-Aldeguer J, et al. Executive summary of the GeSIDA/National AIDS Plan consensus document on antiretroviral therapy in adults infected by the human immunodeficiency virus (updated January 2018). Enfermedades Infecciosas y Microbiologia 2019;37(3):195-202. doi:10.1016/j.eimc.2018.02.010
Mcdowell JA, Chittick GE, Stevens CP, Edwards KD, Stein DS. Pharmacokinetic interaction of Abacavir (1592U89) and ethanol in human immunodeficiency virus-infected adults. Antimicrobial Agents and 2000;44(6):1686-1690. doi:10.1128/AAC.44.6.1686-1690.2000
McCance-Katz EF, Gruber VA, Beatty G, Lum PJ, Rainey Interactions between alcohol and the antiretroviral medications Ritonavir or Efavirenz. Journal of Addiction Medicine. 2013;7(4):264- 270. doi:10.1097/ADM.0b013e318293655a
Gruber VA, Rainey PM, Lum PJ, Beatty GW, Aweeka FT, McCance-Katz Interactions between
Lifson AR, Neuhaus J, Arribas JR, van Berg-Wolf M den, Labriola AM, Read TRH. Smoking- related health risks among persons with HIV in the strategies for management of antiretroviral therapy clinical trial. American Journal of Public Health. 2010;100(10):1896-1903. doi:10.2105/ 2009.188664
Lifson AR, Lando HA. Smoking and HIV: Prevalence, health risks, and cessation strategies. Current HIV/AIDS 2012;9(3):223-230. doi:10.1007/s11904-012-0121-0
Zyambo CM, Burkholder GA, Cropsey KL, et al. Predictors of smoking cessation among people living with HIV receiving routine clinical care. AIDS Care - Psychological and Socio-Medical Aspects of AIDS/HIV. 2019;31(11):1353-1361. doi:10.1080/09540121.2019.1619659
Helleberg M, May MT, Ingle SM, et Smoking and life expectancy among HIV-infected individuals on antiretroviral therapy in Europe and North America. AIDS. 2015;29(2):221-229. doi:10.1097/ QAD.0000000000000540
Petoumenos K, Worm S, Reiss P, et Rates of cardiovascular disease following smoking cessation in patients with HIV infection: Results from the D:A:D study. HIV Medicine. 2011;12(7):412-421. doi:10.1111/j.1468-1293.2010.00901.x
Shepherd L, Ryom L, Law M, et al. Cessation of Cigarette Smoking and the Impact on Cancer Incidence in Human Immunodeficiency Virus–infected Persons: The Data Collection on Adverse Events of Anti-HIV Drugs Clinical Infectious Diseases. 2018;68(4):650-657. doi:10.1093/cid/ ciy508
Vidrine DJ, Arduino RC, Gritz ER. The effects of smoking abstinence on symptom burden and quality of life among persons living with HIV/AIDS. AIDS Patient Care and 2007;21(9):659- 666. doi:10.1089/apc.2007.0022
Reddy KP, Parker RA, Losina E, et Impact of Cigarette Smoking and Smoking Cessation on Life Expectancy Among People With HIV: A US-Based Modeling Study. The Journal of Infectious Diseases. 2016;214(11):1672-1681. doi:10.1093/infdis/jiw430
Tait RJ, Caldicott D, Mountain D, Hill SL, Lenton S. A systematic review of adverse events arising from the use of synthetic cannabinoids and their associated treatment. Clinical Toxicology. 2016;54(1):1-13. doi:10.3109/15563650.2015.1110590
Fogarty A, Rawstorne P, Prestage G, Crawford J, Grierson J, Kippax S. Marijuana as therapy for people living with HIV/AIDS: Social and health aspects. AIDS Care - Psychological and Socio- Medical Aspects of AIDS/HIV. 2007;19(2):295-301. doi:10.1080/09540120600841930
Furler MD, Einarson TR, Millson M, Walmsley S, Bendayan R. Medicinal and Recreational Marijuana Use by Patients Infected with HIV. AIDS Patient Care and STDs. 2004;18(4):215-228. doi:10.1089/108729104323038892
Prentiss D, Power R, Balmas G, Tzuang G, Israelski Patterns of Marijuana Use among Patients with HIV/AIDS Followed in a Public Health Care Setting. Journal of Acquired Immune Deficiency Syndromes. 2004;35(1):38-45. doi:10.1097/00126334-200401010-00005
Woolridge E, Barton S, Samuel J, Osorio J, Dougherty A, Holdcroft A. Cannabis use in HIV for pain and other medical symptoms. Journal of Pain and Symptom Management. 2005;29(4):358- doi:10.1016/j.jpainsymman.2004.07.011
Bonn-Miller MO, Oser ML, Bucossi MM, Trafton Cannabis use and HIV antiretroviral therapy adherence and HIV-related symptoms. Journal of Behavioral Medicine. 2014;37(1):1-10. doi:10.1007/s10865-012-9458-5
Lake S, Kerr T, Capler R, Shoveller J, Montaner J, Milloy High-intensity cannabis use and HIV clinical outcomes among HIV-positive people who use illicit drugs in Vancouver, Canada. International Journal of Drug Policy. 2017;42:63-70. doi:10.1016/j.drugpo.2017.02.009
Sinha S, McCaul ME, Hutton HE, et al. Marijuana use and HIV treatment outcomes among PWH receiving care at an urban HIV clinic. Journal of Substance Abuse Treatment. 2017;82:102-106. doi:10.1016/j.jsat.2017.09.009
Fuster-RuizdeApodaca MJ, Castro-Granell V, Garin N, et al. Prevalence and patterns of illicit drug use in people living with HIV in Spain: A cross-sectional PLoS ONE. 2019;14(6). doi:10.1371/ journal.pone.0211252
Baum MK, Rafie C, Lai S, Sales S, Page B, Campa A. Crack-cocaine use accelerates HIV disease progression in a cohort of HIV-positive drug users. Journal of Acquired Immune Deficiency 2009;50(1):93-99. doi:10.1097/QAI.0b013e3181900129
Shoptaw S, Stall R, Bordon J, et al. Cumulative exposure to stimulants and immune function outcomes among HIV-positive and HIV-negative men in the Multicenter AIDS Cohort Study. International Journal of STD and 2012;23(8):576-580. doi:10.1258/ijsa.2012.011322
Mukerji S, Haghighat R, Misra V, et al. Longitudinal Modeling of Depressive Trajectories Among HIV-Infected Men Using AIDS and Behavior. 2017;21(7):1985-1995. doi:10.1007/s10461- 017-1801-y
European Monitoring Centre for Drugs and Drug Addiction (EMCDDA). Emergency health consequences of cocaine use in Europe. A review of the monitoring of drug-related acute emergencies in 30 European countries | emcdda.europa.eu. Published 2014. Accessed June 19, 2020. https://www.emcdda.europa.eu/publications/scientific-studies/2014/cocaine- emergencies_en
Informe Europeo sobre Drogas Tendencias y doi:10.2810/295940
Montain J, Ti L, Hayashi K, Nguyen P, Wood E, Kerr T. Impact of length of injecting career on HIV incidence among people who inject Addictive Behaviors. 2016;58:90-94. doi:10.1016/j. addbeh.2016.02.020
Peters PJ, Pontones P, Hoover KW, et HIV infection linked to injection use of oxymorphone in Indiana, 2014-2015. New England Journal of Medicine. 2016;375(3):229-239. doi:10.1056/ NEJMoa1515195
Bourne A, Reid D, Hickson F, Torres-Rueda S, Weatherburn P. Illicit drug use in sexual settings (‘chemsex’) and HIV/STI transmission risk behaviour among gay men in South London: Findings from a qualitative study. Sexually Transmitted Infections. 2015;91(8):564-568. doi:10.1136/ sextrans-2015-052052
Fernández Dávila “Sesión de sexo, morbo y vicio”: una aproximación holística para entender la aparición del fenómeno ChemSex entre hombres gais, bisexuales y otros hombres que tienen sexo con hombres en España. Revista Multidisciplinar del SIDA. 2016;4:41-65.
Payancé A, Scotto B, Perarnau JM, de Muret A, Bacq Y. Severe chronic hepatitis secondary to prolonged use of ecstasy and cocaine. Clinics and Research in Hepatology and Gastroenterology. 2013;37(5). doi:10.1016/j.clinre.2013.06.003
Rodríguez Salgado B. Fenetilaminas Clásicas: MDMA y Sus Análogos, p-Metoxianfetaminas y En: Nuevas Drogas Psicoactivas. . Entheos; 2015.
Dolengevich-Segal H, Rodríguez Salgado B, Ramírez JGA, Sánchez-Mateos D. Nuevas Drogas Vol Cap 5. Entheos; 2015. doi:10.20882/adicciones.709
Swanson Unifying theories of psychedelic drug effects. Frontiers in Pharmacology. 2018;9(MAR). doi:10.3389/fphar.2018.00172
Vollenweider Brain mechanisms of hallucinogens and entactogens. Dialogues in clinical neuroscience. 2001;3:265-279.
Nichols D, Grob Is LSD toxic? Forensic science international. 2018;284:141-145. doi:10.1016/j. forsciint.2018.01.006
Hildebrand M. The psychometric properties of the drug use disorders identification test (DUDIT): A review of recent Journal of Substance Abuse Treatment. 2015;53:52-59. doi:10.1016/j. jsat.2015.01.008
Saunders JB, Aasland OG, Babor TF, de La Fuente JR, Grant Development of the Alcohol Use Disorders Identification Test (AUDIT): WHO Collaborative Project on Early Detection of Persons with Harmful Alcohol Consumption‐II. Addiction. 1993;88(6):791-804. doi:10.1111/j.1360-0443.1993. tb02093.x
Gates PJ, Sabioni P, Copeland J, le Foll B, Gowing Psychosocial interventions for cannabis use disorder. Cochrane Database of Systematic Reviews. 2016;2016(5). doi:10.1002/14651858. CD005336.pub4
Wechsberg WM, Golin C, El-Bassel N, Hopkins J, Zule W. Current interventions to reduce sexual risk behaviors and crack cocaine use among HIV-infected individuals. Current HIV/AIDS Reports. 2012;9(4):385-393. doi:10.1007/s11904-012-0131-y
Gonzales D, Rennard SI, Nides M, et al. Varenicline, an α4β2 nicotinic acetylcholine receptor partial agonist, vs sustained-release Bupropion and placebo for smoking cessation: A randomized controlled trial. Journal of the American Medical Association. 2006;296(1):47-55. doi:10.1001/ 296.1.47
West R, Baker CL, Cappelleri JC, Bushmakin AG. Effect of varenicline and Bupropion SR on craving, nicotine withdrawal symptoms, and rewarding effects of smoking during a quit attempt. 2008;197(3):371-377. doi:10.1007/s00213-007-1041-3
Amodei N, Lamb RJ. The Role of Nicotine Replacement Therapy in Early Quitting Success. Nicotine & tobacco research : official journal of the Society for Research on Nicotine and 2010;12(1):1-10. doi:10.1093/NTR/NTP164
World Health Organisation. Consolidated ARV guidelines on the use of antiretroviral drugs for treating and preventing HIV infection: recommendations for a public health approach. Geneva: World Health Published 2013. Accessed June 19, 2020. http://www.who.int/hiv/pub/ guidelines/arv2013/
Beauverie P, Taburet AM, Dessalles MC, Furlan V, Touzeau D. Therapeutic Drug Monitoring of Methadone in HIV-infected Patients Receiving Protease AIDS . 1998;12(18):2510-2511.
Clarke S, Mulcahy F, Bergin C, et al. Absence of Opioid Withdrawal Symptoms in Patients Receiving Methadone and the Protease Inhibitor Lopinavir‐Ritonavir. Clinical Infectious Diseases. 2002;34(8):1143-1145. doi:10.1086/339541
Clarke SM, Mulcahy FM, Tjia J, et al. Pharmacokinetic Interactions of Nevirapine and Methadone and Guidelines for Use of Nevirapine to Treat Injection Drug Users. Clinical Infectious Diseases. 2001;33(9):1595-1597. doi:10.1086/322519
Ostrow DG, Plankey MW, Cox C, et al. Specific sex drug combinations contribute to the majority of recent HIV seroconversions among MSM in the MACS. Journal of Acquired Immune Deficiency 2009;51(3):349-355. doi:10.1097/QAI.0b013e3181a24b20
Kenyon C, Wouters K, Platteau T, Buyze J, Florence E. Increases in condomless chemsex associated with HIV acquisition in MSM but not heterosexuals attending a HIV testing center in Antwerp, AIDS Research and Therapy. 2018;15(1). doi:10.1186/s12981-018-0201-3
Dolengevich-Segal H, Gonzalez-Baeza A, Valencia J, et al. Drug-related and psychopathological symptoms in HIV-positive men who have sex with men who inject drugs during sex (slamsex): Data from the U-SEX GeSIDA 9416 PLoS ONE. 2019;14(12). doi:10.1371/journal.pone.0220272
World Federation for Mental Health SALUD MENTAL EN ATENCIÓN PRIMARIA: MEJORANDO LOS TRATAMIENTOS Y PROMOVIENDO LA SALUD MENTAL. Accessed June 25, 2020. http:// www.infocop.es/view_article.asp?id=2582
Forstein M, Cournos F, Douaihy A, Goodkin K, Wainberg ML, Wapenyi Guideline Watch:
Kendall CE, Shoemaker ES, Boucher L, et al. The organizational attributes of HIV care delivery models in Canada: A cross-sectional PLoS ONE. 2018;13(6). doi:10.1371/journal. pone.0199395
Haggerty JL, Roberge D, Freeman GK, Beaulieu C. Experienced continuity of care when patients see multiple clinicians: A qualitative metasummary. Annals of Family Medicine. 2013;11(3):262- doi:10.1370/afm.1499
Tran BX, Ho RCM, Ho CSH, et Depression among patients with HIV/AIDS: Research development and effective interventions (gapresearch). International Journal of Environmental Research and Public Health. 2019;16(10). doi:10.3390/ijerph16101772
Eshun-Wilson I, Siegfried N, Akena DH, Stein DJ, Obuku EA, Joska JA. Antidepressants for depression in adults with HIV Cochrane Database of Systematic Reviews. 2018;2018(1). doi:10.1002/14651858.CD008525.pub3
Hill L, Lee KC. Pharmacotherapy considerations in patients with HIV and psychiatric disorders: Focus on antidepressants and antipsychotics. Annals of Pharmacotherapy. 2013;47(1):75-89. doi:10.1345/aph.1R343
DeSilva KE, le Flore DB, Marston BJ, Rimland D. Serotonin syndrome in HIV-infected individuals receiving antiretroviral therapy and AIDS. 2001;15(10):1281-1285. doi:10.1097/00002030- 200107060-00010
Cettomai D, McArthur JC. Mirtazapine use in human immunodeficiency virus-infected patients with progressive multifocal leukoencephalopathy. Archives of Neurology. 2009;66(2):255-258. doi:10.1001/archneurol.2008.557
Jann MW, Spratlin V, Momary K, et al. Lack of a pharmacokinetic drug-drug interaction with venlafaxine extended-release/indinavir and desvenlafaxine extended-release/indinavir. European Journal of Clinical 2012;68(5):715-721. doi:10.1007/s00228-011-1180-7
Park J, Vousden M, Brittain C, et al. Dose-related reduction in Bupropion plasma concentrations by Journal of Clinical Pharmacology. 2010;50(10):1180-1187. doi:10.1177/0091270009359524
Pedrol-Clotet E, Deig-Comerma E, Ribell-Bachs M, Vidal-Castell I, García-Rodríguez P, Soler
Uso de bupropión en la deshabituación tabáquica en pacientes infectados por el VIH en tratamiento antirretroviral. Enfermedades Infecciosas y Microbiologia Clinica. 2006;24(8):509-511. doi:10.1157/13092468
Adams JL, Gaynes BN, McGuinness T, Modi R, Willig J, Pence BW. Treating depression within the HIV medical home: A guided algorithm for antidepressant management by HIV clinicians. AIDS Patient Care and 2012;26(11):647-654. doi:10.1089/apc.2012.0113
Pettersson A, Boström KB, Gustavsson P, Ekselius Which instruments to support diagnosis of depression have sufficient accuracy? A systematic review. Nordic Journal of Psychiatry. 2015;69(7):497-508. doi:10.3109/08039488.2015.1008568
Newville H, Roley J, Sorensen Prescription medication misuse among HIV-infected individuals taking antiretroviral therapy. Journal of Substance Abuse Treatment. 2015;48(1):56-61. doi:10.1016/j.jsat.2014.07.013
Johannessen Landmark C. Antiepileptic drugs in non-epilepsy disorders: Relations between mechanisms of action and clinical CNS Drugs. 2008;22(1):27-47. doi:10.2165/00023210- 200822010-00003
HIV Drug University of Liverpool. Accessed June 26, 2020. https://liverpool-hiv-hep. s3.amazonaws.com/prescribing_resources/pdfs/000/000/023/original/TS_Antipsychotic_2019_ Oct.pdf?1571043424
Owen-Smith A, Depadilla L, Diclemente R. The assessment of complementary and alternative medicine use among individuals with HIV: A systematic review and recommendations for future Journal of Alternative and Complementary Medicine. 2011;17(9):789-796. doi:10.1089/ acm.2010.0669
Panel de expertos de GeSIDA y Plan Nacional sobre el Documento de Consenso de GeSIDA/ Plan Nacional Sobre El SIDA Respecto al Tratamiento Antirretroviral En Adultos Infectados Por El Virus de La Inmunodeficiencia Humana.; 2019. Accessed June 25, 2020. http://GeSIDA-seimc. org/wp-content/uploads/2019/01/GeSIDA_DC_TAR_2019_v_final.pdf.
Thomas Mulet V, Aguado Taberna C, Fidalgo Gónzalez S, et La infección por el VIH/SIDA y atención primaria. Atención Primaria. 2004;33(1):3-5. Accessed June 23, 2020. http://www. elsevier.es/es-revista-atencion-primaria-27-articulo-la-infeccion-por-el-vih-SIDA-13056498
Gallego Deike L, Gordillo Álvarez-Valdés M v. Trastornos mentales en pacientes infectados por el
Gordillo V. Trastornos psicológicos y aspectos psicosociales. Manual del SIDA. Published online 1999:605-620.
Casanova Colominas JM, Carmen Rodríguez Fernández M, Gómez García Manejo del paciente con VIH en Atención Primaria. AMF. 2013;9:306-315.
Núñez Rojas AC, Tobón S, Vinaccia Diseño de Un Modelo de Intervención Psicoterapéutica En El Área de La Salud a Partir Del Enfoque Procesal Del Estrés. Vol 13. Universidad de los Andes.; 2006. Accessed June 23, 2020. http://www.scielo.org.co/scielo.php?script=sci_ arttext&pid=S0123-885X2004000200007&lng=en&nrm=iso&tlng=es
Jin Y, Potthoff A, Xu J, et al. Evaluation of Mental Status HIV-Infected Patients: Implications for Treatment. Current HIV Research. 2012;10(6):546-551. doi:10.2174/157016212802429857
Balfour L, Kowal J, Silverman A, et al. A randomized controlled psycho-education intervention trial: Improving psychological readiness for successful HIV medication adherence and reducing depression before initiating HAART. AIDS Care - Psychological and Socio-Medical Aspects of AIDS/HIV. 2006;18(7):830-838. doi:10.1080/09540120500466820
Hill S, Kavookjian J. Motivational interviewing as a behavioral intervention to increase HAART adherence in patients who are HIV-positive: A systematic review of the literature. AIDS Care - Psychological and Socio-Medical Aspects of AIDS/HIV. 2012;24(5):583-592. doi:10.1080/095401 2011.630354
Hollon SD, DeRubeis RJ, Shelton RC, et al. Prevention of relapse following cognitive therapy vs medications in moderate to severe depression. Archives of General Psychiatry. 2005;62(4):417- doi:10.1001/archpsyc.62.4.417
Parikh S v., Segal Z v., Grigoriadis S, et al. Canadian Network for Mood and Anxiety Treatments (CANMAT) Clinical guidelines for the management of major depressive disorder in adults. II. Psychotherapy alone or in combination with antidepressant medication. Journal of Affective 2009;117(SUPPL. 1). doi:10.1016/j.jad.2009.06.042
Spies G, Asmal L, Seedat S. Cognitive-behavioural interventions for mood and anxiety disorders in HIV: A systematic review. Journal of Affective Disorders. 2013;150(2):171-180. doi:10.1016/j. 2013.04.018
Brown JL, Vanable PA. Cognitive-behavioral stress management interventions for persons living with HIV: A review and critique of the Annals of Behavioral Medicine. 2008;35(1):26-40. doi:10.1007/s12160-007-9010-y
Markowitz JC, Kocsis JH, Fishman B, et al. Treatment of depressive symptoms in human immunodeficiency virus- positive patients. Archives of General Psychiatry. 1998;55(5):452-457. doi:10.1001/archpsyc.55.5.452
Markowitz J, Spielman L, Sullivan M, Fishman An Exploratory Study of Ethnicity and Psychotherapy Outcome Among HIV-Positive Patients With Depressive Symptoms. The Journal of psychotherapy practice and research. 2000;9:226-231.
Gayner B, Esplen MJ, de Roche P, et A randomized controlled trial of mindfulness-based stress reduction to manage affective symptoms and improve quality of life in gay men living with HIV. Journal of Behavioral Medicine. 2012;35(3):272-285. doi:10.1007/s10865-011-9350-8
Creswell JD, Myers HF, Cole SW, Irwin MR. Mindfulness meditation training effects on CD4+ T lymphocytes in HIV-1 infected adults: A small randomized controlled trial. Brain, Behavior, and 2009;23(2):184-188. doi:10.1016/j.bbi.2008.07.004
Seyedalinaghi S, Jam S, Foroughi M, et al. Randomized controlled trial of mindfulness-based stress reduction delivered to human immunodeficiency virus-positive patients in Iran: Effects on CD4 + T lymphocyte count and medical and psychological symptoms. Psychosomatic Medicine. 2012;74(6):620-627. doi:10.1097/PSY.0b013e31825abfaa
Gonzalez-Garcia M, Ferrer MJ, Borras X, et al. Effectiveness of mindfulness-based cognitive therapy on the quality of life, emotional status, and CD4 cell count of patients aging with HIV AIDS and Behavior. 2014;18(4):676-685. doi:10.1007/s10461-013-0612-z
World Health Risks to Mental Health : An Overview of Vulnerabilities and Risk
Vreeman RC, McCoy BM, Lee S. Mental health challenges among adolescents living with HIV. Journal of the International AIDS 2017;20(Suppl 3). doi:10.7448/IAS.20.4.21497
Donenberg GR, Pao Youths and HIV/AIDS: Psychiatry’s role in a changing epidemic. Journal of the American Academy of Child and Adolescent Psychiatry. 2005;44(8):728-747. doi:10.1097/01. chi.0000166381.68392.02
González-Scarano F, Martín-García The neuropathogenesis of AIDS. Nature Reviews Immunology. 2005;5(1):69-81. doi:10.1038/nri1527
Marhefka SL, Lyon M, Koenig LJ, et Emotional and behavioral problems and mental health service utilization of youth living with HIV acquired perinatally or later in life. AIDS Care - Psychological and Socio-Medical Aspects of AIDS/HIV. 2009;21(11):1447-1454. doi:10.1080/09540120902883085
García-Navarro C, García I, Medín G, et Aspectos psicosociales en una cohorte de adolescentes con infección por el virus de la inmunodeficiencia humana por transmisión vertical. NeuroCoRISpeS. Enfermedades Infecciosas y Microbiologia Clinica. 2014;32(10):631-637. doi:10.1016/j.eimc.2013.11.008
Mellins CA, Brackis-Cott E, Leu CS, et al. Rates and types of psychiatric disorders in perinatally human immunodeficiency virus-infected youth and Journal of Child Psychology and Psychiatry and Allied Disciplines. 2009;50(9):1131-1138. doi:10.1111/j.1469-7610.2009.02069.x
Mellins CA, Malee Understanding the mental health of youth living with perinatal HIV infection: Lessons learned and current challenges. Journal of the International AIDS Society. 2013;16(1). doi:10.7448/IAS.16.1.18593
le Prevost M, Arenas-Pinto A, Melvin D, et al. Anxiety and depression symptoms in young people with perinatally acquired HIV and HIV affected young people in AIDS Care - Psychological and Socio-Medical Aspects of AIDS/HIV. 2018;30(8):1040-1049. doi:10.1080/09540121.2018.144 1972
Kapetanovic S, Wiegand RE, Dominguez K, et Associations of medically documented psychiatric diagnoses and risky health behaviors in highly active antiretroviral therapy-experienced perinatally HIV-infected youth. AIDS Patient Care and STDs. 2011;25(8):493-501. doi:10.1089/apc.2011.0107
Woods SP, Moore DJ, Weber E, Grant I. Cognitive neuropsychology of HIV-associated neurocognitive Neuropsychology Review. 2009;19(2):152-168. doi:10.1007/s11065-009- 9102-5
van den Hof M, ter Haar AM, Scherpbier HJ, et al. Neurocognitive Development in Perinatally Human Immunodeficiency Virus–infected Adolescents on Long-term Treatment, Compared to Healthy Matched Controls: A Longitudinal Study. Clinical Infectious Diseases. 2020;32:21-29. doi:10.1093/cid/ciz386
Robbins RN, Zimmerman R, Korich R, et al. Longitudinal trajectories of neurocognitive test performance among individuals with perinatal HIV-infection and -exposure: adolescence through young adulthood. AIDS Care - Psychological and Socio-Medical Aspects of AIDS/HIV. 2020;32(1):21-29. doi:10.1080/09540121.2019.1626343
Williams PL, Storm D, Montepiedra G, et al. Predictors of adherence to antiretroviral medications in children and adolescents with HIV infection. Pediatrics. 2006;118(6). doi:10.1542/peds.2006- 0493
Murphy DA, Wilson CM, Durako SJ, Muenz LR, Belzer M. Antiretroviral medication adherence among the REACH HIV-infected adolescent cohort in the USA. AIDS Care - Psychological and Socio-Medical Aspects of AIDS/HIV. 2001;13(1):27-40. doi:10.1080/09540120020018161
Kang E, Delzell DAP, Chhabra M, Oberdorfer Factors associated with high rates of antiretroviral medication adherence among youth living with perinatal HIV in Thailand. International Journal of STD and AIDS. 2015;26(8):534-541. doi:10.1177/0956462414545524
Capilla M, Montes M, Gómez M, Barrio V. Primera adaptación del CDI-S a población española. Acción psicológica, ISSN 1578-908X, Vol 1, No 3, 2002, pags 263-272. 2002;1.
Masip A, Amador-Campos J, Cebollero M. Características psicométricas de la Reynolds Adolescent Depression Scale en población comunitaria y clínica. International Journal of Clinical and Health 2008;8.
Herrero MJ, Blanch J, Peri JM, de Pablo J, Pintor L, Bulbena A. A validation study of the hospital anxiety and depression scale (HADS) in a Spanish population. General Hospital Psychiatry. 2003;25(4):277-283. doi:10.1016/S0163-8343(03)00043-4
Richardson LP, Rockhill C, Russo JE, et Evaluation of the PHQ-2 as a brief screen for detecting major depression among adolescents. Pediatrics. 2010;125(5). doi:10.1542/peds.2009-2712
Berger BE, Ferrans CE, Lashley Measuring stigma in people with HIV: Psychometric assessment of the HIV stigma scale. Research in Nursing and Health. 2001;24(6):518-529. doi:10.1002/nur.10011
Bussing R, Fernandez M, Harwood M, et al. Parent and teacher SNAP-IV ratings of attention deficit hyperactivity disorder symptoms: Psychometric properties and normative ratings from a school district Assessment. 2008;15(3):317-328. doi:10.1177/1073191107313888
Duncan L, Georgiades K, Wang L, et al. Psychometric evaluation of the Mini International Neuropsychiatric Interview for Children and Adolescents (MINI-KID). Psychological Assessment. 2018;30(7):916-928. doi:10.1037/pas0000541
Malhotra S, Padhy SK. Challenges in Providing Child and Adolescent Psychiatric Services in Low Resource Countries. Child and Adolescent Psychiatric Clinics of North America. 2015;24(4):777- doi:10.1016/j.chc.2015.06.007
Philbin MM, Tanner AE, Chambers BD, et Transitioning HIV-infected adolescents to adult care
Skeen SA, Sherr L, Croome N, et al. Interventions to improve psychosocial well-being for children affected by HIV and AIDS: a systematic review. Vulnerable Children and Youth Studies. 2017;12(2):91-116. doi:10.1080/17450128.2016.1276656
McKay MM, Chasse KT, Paikoff R, et al. Family-level impact of the CHAMP family program: A community collaborative effort to support urban families and reduce youth HIV risk exposure. Family 2004;43(1):79-93. doi:10.1111/j.1545-5300.2004.04301007.x
Brown LK, Kennard BD, Emslie GJ, et al. Effective Treatment of Depressive Disorders in Medical Clinics for Adolescents and Young Adults Living with HIV: A Controlled Trial. Journal of Acquired Immune Deficiency 2016;71(1):38-46. doi:10.1097/QAI.0000000000000803
Kennard BD, Brown LT, Hawkins L, et Development and implementation of health and wellness CBT for individuals with depression and HIV. Cognitive and Behavioral Practice. 2014;21(2):237- 246. doi:10.1016/j.cbpra.2013.07.003
Bhana A, McKay MM, Mellins C, Petersen I, Bell C. Family-based HIV prevention and intervention services for youth living in poverty-affected contexts: The CHAMP model of collaborative, evidence- informed programme Journal of the International AIDS Society. 2010;13(SUPPL. 2). doi:10.1186/1758-2652-13-S2-S8
Belfer ML. Critical review of world policies for mental healthcare for children and adolescents. Current Opinion in 2007;20(4):349-352. doi:10.1097/YCO.0b013e3281bc0cf4
Transitioning HIV-infected youth into adult health Pediatrics. 2013;132(1):192-197. doi:10.1542/ peds.2013-1073
5. TRASTORNOS NEUROCOGNITIVOS ASOCIADOS AL VIH
5.1. Etiopatogenia
5.2. Epidemiología
5.3. Factores de riesgo
5.4. Manifestaciones clínicas
5.5. Diagnóstico
5.6. Tratamiento
5.7. ALGORITMO DE TRATAMIENTO DE LOS TNAV (Tabla 9)
La principal complicación producida por el VIH a nivel del SNC son los trastornos neurocognitivos asociados al VIH (TNAV). El desarrollo de un TNAV condiciona una pérdida progresiva de funcionalidad que se puede asociar con una peor calidad y esperanza de vida. Por este motivo, la identificación, la prevención y el tratamiento precoz de los TNAV debería formar parte del manejo integral que requieren las personas con VIH.
Etiopatogenia
Los TNAV son la consecuencia de una serie de procesos patogénicos inducidos, de forma directa o indirecta, por el VIH que alteran la homeostasis cerebral. El VIH es un virus neurotropo y como tal es capaz de atravesar la barrera hematoencefálica (BHE) y de infectar diferentes tipos celulares en el SNC, desde el momento mismo de la infección245. Por lo general, el VIH en el SNC suele estar confinado en los espacios perivasculares del cerebro, donde infecta principalmente linfocitos y en menor medida macrófagos perivasculares. Durante los ciclos de replicación del virus, el VIH puede sufrir mutaciones en su envuelta que van a aumentar su afinidad por las células microgliales y, cuando esto ocurre, el VIH aumenta su capacidad para infiltrar el parénquima cerebral y para producir cuadros de encefalitis246.
Tanto en las formas leves, como en la encefalitis, el daño neuronal no va a ser directo, al carecer el VIH de capacidad para infectar neuronas adultas247, sino la consecuencia de un aumento de la inflamación cerebral (aumento del estrés oxidativo y de los radicales libres), de la producción de sustancias neurotóxicas (por el virus y el sistema inmune) y del depósito de esfingolípidos y beta-amiloide248. En las fases iniciales de la infección, estos fenómenos van a alterar de forma leve la función neuronal y a producir síntomas cognitivos leves249. En las fases avanzadas de la infección, la inflamación y la neurotoxicidad son tan intensas que la neurona no puede responder a la agresión e inicia su apoptosis, lo que favorece que los síntomas cognitivos sean más graves250.
En los pacientes con TNAV, el inicio del TAR produce una disminución de la inflamación y de la neurotoxicidad que contribuye a normalizar el funcionamiento neuronal y glial, lo que se traduce en una mejoría de los síntomas cognitivos del paciente. La persistencia de déficits cognitivos a pesar del TAR ha sido motivo de estudio los últimos 20 años248. Al respecto se han propuesto dos hipótesis, no excluyentes: La primera plantea al cerebro como un santuario donde algunos TAR no penetrarían lo suficiente como para controlar la replicación viral de forma efectiva251252. La segunda hipótesis sugiere que los TNAV son consecuencia de la persistencia de fenómenos inflamatorios y neurotoxicidad no inducidos por la replicación del VIH sino por disfunción astrocitaria248253254 y activación microglia persistente inducida por la translocación bacteriana 255 o la reconstitución inmune256.
Ya sea por replicación viral persistente, por fenómenos inflamatorios o por otras causas indirectas como alteraciones a nivel de la vascular cerebral o el uso de fármacos neurotóxicos257258, la alteración de la homeostasis cerebral va a producir disfunción neuronal (retracción axonal y dendrítica259 alteración del potencial de membrana y desregulación en la liberación o recaptación de neurotransmisores) cuyo correlato clínico serán los TNAV.
Epidemiología
La prevalencia y la incidencia de los TNAV ha cambiado de forma sustancial desde el comienzo de la epidemia del SIDA hasta el momento actual. Debido a este cambio continuo, consecuencia de la mejoría progresiva del TAR y del cambio en el perfil sociodemográfico de los nuevos contagios, muchos de los estudios realizados para estimar la prevalencia e incidencia de los TNAV se han quedado desfasados y es posible que sus resultados sobrestimen la prevalencia e incidencia actual de los TNAV.
Prevalencia
La prevalencia de los TNAV ha sido estimada en diversos estudios. Los más relevantes se han incluido en la Tabla 1. De ellos, el estudio de mayor calidad metodológica es el realizado por la cohorte CNS HIV Anti-Retroviral Therapy Effect Research (CHARTER)260 En este estudio se observó que la prevalencia de los TNAV dependía de la proporción de comorbilidades detectadas en la población, así como de sus características clínico- demográficas. En personas sin comorbilidades, con un buen control inmunovirológico de su infección VIH, la prevalencia de TNAV en este estudio fue del 30% el 83% observado en personas con comorbilidades severas y un control deficiente del VIH.
Abreviaturas: ACTG, AIDS Clinical Trial Group; DE, Desviación Estándar;
HAART, Highly Active Antiretroviral Therapy; TAR, Tratamiento Antirretroviral.
En España, los estudios publicados adolecen de limitaciones metodológicas. Dos estudios, realizados en Madrid (n=191) y Alicante (n=84), siguiendo las Recomendaciones para el diagnóstico establecidas en el consenso de Frascati261, han estimado que la proporción de TNAV en pacientes en TAR, con buen control virológico y sin comorbilidades significativas rondaría el 20-40%262263 Un tercer estudio realizado en Cataluña (n=331), utilizando una metodología similar, estimó proporciones entorno al 40% en naïve y del 50% en pacientes pretratados264 Utilizando técnicas de cribado, un estudio realizado a nivel nacional (n=825) estimó que el 42,5% de las mujeres y el 33,7% de los hombres presentaban, en el Brief Neurocognitive Screen, resultados compatibles con un posible TNAV 265. Otro estudio catalán (n=106), detectó con el NEU niveles ligeramente superiores (48%)264.
Incidencia
Establecer una tasa de incidencia para los TNAV es complicado al tratarse de un proceso dinámico en el que, el grado de deterioro cognitivo necesario para establecer el diagnóstico pueden fluctuar a lo largo del tiempo. Por esta razón, en general se prefiere hablar de tendencias que de tasas de incidencia. En la cohorte CHARTER (n=436), se estimó que, a lo largo del tiempo (mediana 35 meses), el 22,7% de las personas con VIH iban a desarrollar un declinar de su función cognitiva (vs. el 16,5% que iban a mejorar su funcionamiento cognitivo)266.
A pesar de estas limitaciones, disponemos estudios en los que se ha evaluado la incidencia de los TNAV. El más representativo es el estudio ALLRT (n=1166) en el que se estimó, utilizando una prueba de cribado (BNCS), que la incidencia de TNAV era del 21%261. En España, en personas con VIH bien controladas y sin comorbilidades significativas (n=134), la incidencia de TNAV fue del 8,2%267.
Factores de riesgo
La detección de aquellos factores asociados con los TNAV es un elemento clave para establecer las medidas de prevención y el tratamiento de esta entidad. Por este motivo, el número de estudios publicados y de factores identificados (>20) es muy extenso. De cara a unas guías de práctica clínica, consideramos relevante centrarnos en aquellos que tienen un mayor impacto clínico.
Si para ello nos basamos en los datos de la cohorte CHARTER, el declinar cognitivo se asoció fundamentalmente con dos factores, la coexistencia de comorbilidades y el control de la infección con el TAR266.
5.3.1. Comorbilidades
La detección y el tratamiento de las comorbilidades es un elemento relevante a la hora de prevenir y tratar los TNAV. A continuación, comentaremos las más relevantes:
Enfermedad mental
Como se ha avanzado en el punto 4 de estas guías, la enfermedad mental, en general, y la sintomatología depresiva, en particular, se han relacionado con un peor rendimiento cognitivo y un mayor riesgo de desarrollar TNAV.
Consumo de drogas
El consumo de alcohol, cocaína y metanfetamina son factores de riesgo para los TNAV. A este respecto, se han identificado efectos neurotóxicos sinérgicos entre la proteína Tat, la cocaína y la metanfetamina268269, y entre el alcohol y la gp120270. También se ha sugerido un mecanismo común por el que las drogas, al aumentar los niveles de dopamina, pueden favorecer los TNAV al estimular la replicación del VIH en los macrófagos del SNC271272.
Coinfección por el VHC
En el pasado la coinfección VIH/VHC, con independencia del grado de afectación hepática273274, se ha relacionado un mayor riesgo de presentar TNAV275. Actualmente esta asociación no está tan clara.
Alteraciones metabólicas y enfermedad vascular
La obesidad central se ha postulado como uno de los factores metabólicos más relevante asociado a los TNAV276. Otros factores que se han asociado con un mayor riesgo de TNAV son los factores de riesgo clásico277278, así como la enfermedad ateroesclerótica278289.
5.3.2. Tratamiento antirretroviral
En la cohorte CHARTER los participantes que no recibían TAR presentaron el doble de riesgo de declinar cognitivo, con independencia del grado de supresión viral proporcionado por el TAR266. Este papel protector del TAR puede deberse tanto al efecto directo del control de la replicación viral en el SNC como a la prevención de los fenómenos asociados con la inmunodepresión.
Control de la replicación viral
Diversos estudios han observado una relación directa entre los niveles de replicación del VIH y la proporción de TNAV-279. Por el contrario, en el estudio prospectivo realizado por la cohorte CHARTER, el grado de control viral de los pacientes que recibían TAR no se relacionó con el riesgo de presentar declinar cognitivo. Esto podría deberse a dos factores: 1) que el efecto deletéreo de un control viral menos intenso a nivel del SNC sea bajo y por tanto imperceptible durante un periodo de seguimiento relativamente corto como el de la cohorte CHARTER. O 2) que este potencial efecto se vea compensado, como se explica de forma detallada en el punto 7º de esta guía, por una reducción en la potencial neurotoxicidad asociada al TAR.
Inmunosupresión
Diversos estudios han observado una relación inversa entre el nadir de CD4 y el riesgo de presentar un TNAV280. Dentro de los fenómenos asociados con la inmunodepresión que podrían contribuir a los TNAV, se ha postulado la activación inmune secundaria a fenómenos de translocación bacteriana281.
Manifestaciones clínicas
Las manifestaciones clínicas producidas por la infección VIH a nivel del SNC pueden englobarse en tres categorías: alteraciones cognitivas (concentración, atención, memoria…), alteraciones del comportamiento (apatía, pérdida del impulso sexual, desregulación emocional…) y alteraciones motoras. Desde que disponemos del TAR, las mas relevantes y las que en la actualidad guían el diagnóstico de los TNAV son las alteraciones cognitivas282. La queja cognitiva de los TNAV se puede confundir con frecuencia con la de otros trastornos psiquiátricos como la depresión. Un aspecto diferenciador entre ambas entidades es que en los TNAV no suele observarse disforia ni episodios de llanto o tristeza283284.
En la actualidad, la mayoría de las personas con VIH que son diagnosticadas de un TNAV suelen encontrarse asintomáticos o presentar síntomas cognitivos leves3. La afectación cognitiva más común en estos casos suele observarse a nivel de la memoria de trabajo, la atención y las funciones ejecutivas. La mayoría de estos casos suele tener una situación clínica estable durante muchos años y no es infrecuente que en algunos puedan observarse mejorías a nivel cognitivo285. Es infrecuente encontrar alteraciones a nivel motor, si bien, en algunos casos, se pueden identificar alteraciones en la marcha y en la coordinación motriz fina. Por el contrario, no es infrecuente detectar trastornos afectivos (apatía, pérdida del impulso sexual y disminución de la respuesta emocional)286. Desde el punto de vista funcional, los pacientes con TNAV leves no suelen reportan déficits o los atribuyen al estrés o la fatiga. Cuando se detectan alteraciones funcionales, estas suelen ser: dificultad para leer, para realizar tareas complejas o para mantener la concentración en actividades o conversaciones286.
Los pacientes con TNAV severos suelen detectarse en personas con infecciones por VIH avanzadas (CD4 <200 células/mm284280. El inicio de los síntomas suele ser subagudo (déficit de atención y concentración, síntomas depresivos y afectación de la psicomotricidad fina), y su curso fluctuante. Una vez instaurado el cuadro, se suele observar un perfil de afectación subcortical caracterizado por déficits severos a nivel de la memoria, la atención, la concentración, el procesamiento de la información y/o las funciones ejecutivas. Las funciones corticales suelen estar preservadas, siendo excepcional observar fenómenos de afasia, agnosia y apraxia. A nivel motor, las alteraciones durante la exploración neurológica son la norma (movimientos oculares sacádicos, disdiadococinesia, hiperreflexia y aparición de signos de liberación frontal tales como el reflejo de prensión, de succión, hociqueo o los reflejos glabelares), pudiendo en fases terminales observarse un retraso psicomotor severo o cuadros de mutismo. A nivel del comportamiento, suelen evidenciarse alteraciones conductuales y del estado anímico, apatía, abulia, insomnio, irritabilidad y/o ansiedad. En algunos casos, estos cuadros pueden progresar a psicosis y/o trastornos bipolares. De forma característica estos déficits conllevan una afectación severa del funcionamiento diario del individuo. No siendo infrecuente que, los afectados no sean capaces de percibir estos déficits funcionales y sean las personas del entorno del paciente las que los pongan en evidencia282.
Diagnóstico
Los criterios para el diagnóstico de los TNAV fueron establecidos por primera vez por la Asociación Americana de Neurología en 1991287 y modificados en el documento de consenso de expertos de Frascati de 2007282. A pesar de contar con más de 10 años de antigüedad, estos criterios siguen estando vigentes. Desde 2007, han surgido iniciativas como la del Mind Exchange Working Group en 2013288, con el objetivo completar y actualizar aspectos no contemplados o desactualizados del documento de consenso de Frascati.
El diagnóstico de los TNAV se establece en base a la presencia de un cuadro de deterioro cognitivo adquirido en al menos dos áreas cognitivas y a la ausencia otras etiologías a las que pueda atribuirse el deterioro282. Para poder establecer el diagnóstico serán por tanto necesario que el paciente sea evaluado neuropsicológica y médicamente por profesionales expertos.
La clasificación de Frascati gradúa los TNAV en base a los criterios recogidos en la Tabla 2 en TNAV asintomáticos, TNAV leves y demencia VIH. Igualmente establece tres categorías para clasificar las comorbilidades identificadas durante la evaluación médica: Incidentales, contribuyentes y confusoras. Las comorbilidades confusoras serán aquellas cuya presencia pueda justificar per se el cuadro de deterioro cognitivo y cuya presencia no nos permitirá establecer un diagnóstico de TNAV. Por el contrario, las incidentales y contribuyentes serán aquellas cuya presencia no es suficiente para justificar el deterioro y por lo tanto permitirán establecer un diagnóstico de TNAV.
5.5.1. Criterios de selección y cribado
Definir qué pacientes VIH deben ser evaluados a nivel neurocognitivo y cuáles no es un aspecto controvertido sobre el que no existe consenso. Mientras las guías EACS proponen limitar el diagnóstico a pacientes sintomáticos que no presenten comorbilidades confusoras ni cuadros de depresión no tratados49, las Recomendaciones del Mind Exchange Working Group establecían el uso de instrumentos de cribado en todos los pacientes VIH como mínimo al inicio del tratamiento, al cambiar de tratamiento o en presencia de cualquier síntoma neuro- psiquiátrico288 y el documento de consenso de GeSIDA de 2012, abogaba por aplicar una prueba de cribado cada 6 meses a todos los pacientes con quejas cognitivas y/o factores de riesgo (edad >50 años, CD4 actual <200 cels/mm3, nadir de CD4 <350 cels/mm3, SIDA actual o pasado, nivel de escolarización bajo, interrupción del TAR o coinfección por el VIH). Esta disparidad de criterios es consecuencia principalmente de una falta de consenso sobre la entidad de los TNAV asintomáticos y sobre la utilidad y validez de los instrumentos de cribado.
Relevancia de los trastornos asintomáticos
Mientras que para algunos expertos los TNAV asintomáticos tienen la misma trascendencia y pronóstico que los TNAV leves, para otros solo son el resultado de un exceso de sensibilidad de los criterios diagnósticos289290291 y proponen el uso de métodos de evaluación alternativos como el método llamado Comparaciones Multivariadas Normativas (MNC, por sus siglas en inglés, Multivariate Normative Comparisons), que ha sido desarrollado para intentar controlar el número de falsos positivos sin disminuir la sensibilidad292. En el momento actual, la evidencia existente no permite recomendar estos abordajes alternativos a los criterios establecidos por el consenso de Frascati en 2007.
Respecto a si existen diferencias clínicas y pronosticas entre los TNAV asintomáticos y los leves, para Blackstone y cols. la diferencia entre ambas entidades solo radica en el grado de requerimiento cognitivo del individuo y en lo exhaustiva que sea la evaluación funcional293. Teniendo en cuenta esto y que ambas entidades mostraron el mismo riesgo de declinar cognitivo en la cohorte CHARTER294, no hay datos que sustenten una diferenciación clara entre ambas entidades.
Instrumentos de cribado
Debido a la complejidad que conlleva el proceso de diagnóstico de los TNAV se han ensayado distintas estrategias para su cribado, de las cuales las más relevantes se incluyen en la Tabla 3.
La mayor parte de estos instrumentos se basan en la selección y aplicación de una batería breve de pruebas neurocognitivas con alta sensibilidad para la detección de aquellas alteraciones neurocognitivas que son más prevalentes entre los pacientes con un TNAV. Analizando la evidencia disponible, un metaanálisis publicado por Zipursky y col. en AIDS en 2013, identificaba la publicación de estudios de validación para 39 instrumentos de cribado de los TNAV295. Los autores de este metaanálisis concluyeron indicando que ninguna de las estrategias evaluadas dispone de la suficiente sensibilidad y capacidad diagnóstica como para recomendar su uso de forma generalizada. Este metaanálisis también identificó deficiencias metodológicas en la mayoría de los estudios analizados.
En lengua castellana, desde 2013 se han publicado nuevos estudios de validación para alguna de las herramientas ya incluidas en el metaanálisis de Zipursky y col, como la HIV Dementia Scale (HDS) y la International HIV Dementia Scale (IHDS)296, así como para otras nuevas como el Neurocognitive (NEU) Screen297. Como era de esperar, los resultados de sensibilidad (S) y especificidad (E) para el HDS (S: 68,2%, E: 62,7%) y el IHDS (S: 41,3%, E: 75%) fueron modestos y similares a los ya reportados296. Los resultados obtenidos por el NEU Screen fueron mejores y adecuados a los deseables para una prueba de cribado en todos los estratos de edad a partir de los 30 años, siendo esta prueba especialmente sensible en >60 años (S: 91%, E: 92,3%)297. La principal limitación para recomendar el uso del NEU Screen como herramienta de cribado para los TNAV es la ausencia de estudios que confirmen su validez externa.
Recomendaciones:
- No se recomienda el uso rutinario de instrumentos de cribado para los TNAV con el objetivo de establecer una indicación de evaluación neuropsicológica, en ningún perfil de pacientes (A-I).
- En centros con un acceso limitado al diagnóstico neuropsicológico de los TNAV, los instrumentos de cribado pueden ser de utilidad, en pacientes con quejas cognitivas, para establecer criterios de derivación a otros centros con capacidad diagnóstica (C-III).
- De los instrumentos de cribado disponibles, serían de elección aquellos con sensibilidades y especificidades >70%, validados en población VIH española (como el NEU Screen) (A-III).
- Los instrumentos de cribado son de utilidad en estudios epidemiológicos cuyo objetivo sea realizar estimaciones groseras de la posible prevalencia de los TNAV (C-III).
5.5.2. Diagnóstico neuropsicológico
El diagnóstico neuropsicológico de los TNAV comprende la evaluación tanto del funcionamiento cognitivo como del grado de afectación funcional que puedan presentar los pacientes diagnosticados de deterioro cognitivo, a nivel profesional, en el hogar y/o a nivel social.
Evaluación del funcionamiento neurocognitivo
De los métodos para evaluar el funcionamiento cognitivo el que cuenta con un mayor grado de evidencia es el establecido en el documento de consenso de Frascati282. El diagnóstico de deterioro neurocognitivo en base a estos criterios ha sido relacionado en diversos estudios tanto con variables clínicas relacionadas con el VIH, como con marcadores de alteración cerebral asociadas al VIH298299. A continuación, resumimos los aspectos clave a la hora de aplicar estas Recomendaciones.
La evaluación neurocognitiva deberá realizarla un profesional que cuente con la suficiente formación y para su correcta interpretación deberán tenerse en cuenta no solo los resultados de la evaluación sino también del despistaje de comorbilidades médicas. Antes de someter a un paciente a una evaluación cognitiva se debe garantizar que su estado mental no se encuentra alterado por ningún factor externo como por ejemplo un trastorno psiquiátrico activo grave o un cuadro de intoxicación aguda. Cuando se identifiquen alguno de estos factores las guías recomiendan que se posponga la evaluación hasta que estos factores hayan sido tratados.
Siempre que sea posible, la evaluación del funcionamiento cognitivo se realizará mediante el uso de baterías neuropsicológicas amplias, que evalúen el funcionamiento en al menos las siguientes áreas cognitivas: Verbal/lenguaje, atención/memoria de trabajo, abstracción/funciones ejecutivas, memoria (aprendizaje y recuerdo), velocidad de procesamiento de la información, percepción sensorial y habilidades motoras282.
Abreviaturas: WAIS-IV - Wechsler adult intelligence scale IV. TMT - trail maiking test. SDMT – symbol digit modalities test. TAVEC – test de aprendizaje verbal España-complutense. CVLT – California verbal learning test. PMR – Variante de la prueba de COWAT (controlled oral word association) con las letras P, M y R en lugar de F, A y S. GP - grooved pegboard.
* El color trails test sería la alternativa al TMT B en pacientes que no manejen el alfabeto.
El funcionamiento a nivel de cada área se evaluará con al menos dos pruebas diferentes, preferiblemente validadas en población española, y normalizadas por edad, género y/o nivel educativo. No existe consenso sobre cuales deberían de ser esas pruebas. En la Tabla 4 se incluyen algunas de las pruebas que cuentan con mayor consenso de uso en el diagnóstico de los TNAV en población española.
Cuando el resultado obtenido en una prueba o en el estudio de un área neurocognitiva es inferior a una desviación estándar por debajo de la media normativa establecida se entiende que un paciente presenta deterioro neurocognitivo en esa prueba o área. Para establecer que un paciente presenta deterioro neurocognitivo es necesario evidenciar deterioro en al menos dos áreas o dominios cognitivos. En el caso de que se desee realizar una estimación del grado de deterioro será necesario utilizar métodos de evaluación cuantitativos como el global déficit score o los clinical ratings293.
Siempre que se pueda habrá que intentar realizar una evaluación prospectiva del deterioro cognitivo. De esta forma se podrán diferenciar aquellos pacientes que, con independencia de su nivel de funcionamiento, presenten un deterioro progresivo de aquellos en los que el deterioro se encuentre estabilizado. Desafortunadamente la evidencia disponible no establece cada cuanto tiempo debemos reevaluar el funcionamiento cognitivo, aunque se recomienda espaciar las evaluaciones al menos 6 meses para minimizar el aprendizaje relacionado con la repetición (efecto de la práctica). Para evitar este efecto, existen normas de corrección ajustadas por el mismo, pero lamentablemente no han sido validadas en población española300.
En entornos donde la evaluación del funcionamiento cognitivo no se pueda realizar con una batería neuropsicológica amplia, aplicada por un psicólogo con experiencia, cualquier clínico podrá establecer un diagnóstico de presunción utilizando una herramienta estandarizada validada para examinar el estado mental del paciente: Mini-Mental301 y instrumentos de cribado. Los puntos de corte para establecer un diagnóstico de deterioro cognitivo con los principales instrumentos de cribado se pueden consultar en la Tabla 3. El punto de corte recomendado para el mini-mental es de 25-26 puntos para el deterioro cognitivo leve y <25 puntos para el deterioro moderado-severo302. Estos puntos de corte deben utilizarse con precaución al no haber sido todavía validados para el diagnóstico de TNAV en población VIH española.
Evaluación de la funcionalidad
De forma complementaria a la evaluación neurocognitiva, para poder categorizar los TNAV será necesario realizar una evaluación de la funcionalidad del paciente, ya sea mediante el uso de cuestionarios de síntomas funcionales, como el Patient’s Assessment of Own Functioning Inventory (PAOFI) o el instrumental activities of daily living (IADL), o, añadiendo a estos, alguna prueba objetiva como la de manejo de la medicación (MMT). El uso de pruebas objetivas aumenta la sensibilidad para detectar las alteraciones funcionales a costa de aumentar el tiempo de evaluación en al menos 10 minutos303.
Recomendaciones:
- La identificación de la queja cognitiva debería realizarse de forma proactiva al diagnóstico y al menos una vez cada 1-2 años (A-III).
- Siempre que se sospeche la existencia de un TNAV se recomienda la realización de una evaluación neuropsicológica reglada, basada en los criterios establecidos en el Consenso de Frascati de 2007 (A-III).
- Para el diagnóstico de los TNAC se recomienda la utilización de pruebas neuropsicológicas validadas en población española (C-III).
- Se recomienda hacer un control evolutivo de los TNAV en un plazo de tiempo de entre 6 meses y 1-2 años (A-III).
- Cuando no se tenga acceso a una evaluación neurológica reglada, se podrá establecer el diagnóstico posible TNAV si se identifica un resultado alterado en el Mini-Mental o en algún instrumento de cribado (C-III).
- Las pruebas más utilizadas para la evaluación funcional de los TNAV son el PAOFI y el IADL. Se recomienda asociar a estas pruebas subjetivas otra objetiva como la prueba de manejo de la medicación (B-II).
5.5.3. Despistaje de comorbilidades
El diagnóstico de los TNAV, al tratarse de un diagnóstico de exclusión, requiere para su confirmación que se excluya la existencia de comorbilidades que puedan per se justificar el grado de deterioro neurocognitivo evidenciado en la evaluación neuropsicológica del paciente. El documento de consenso de Frascati enumeraba cuales son las principales comorbilidades que hay que evaluar y establece los parámetros para, en presencia de alguna de ellas, poder establecer o no el diagnóstico de TNAV282. En la Tabla 5 se incluyen las situaciones en las que no se podría establecer un diagnóstico de TNAV en base a la presencia de comorbilidades confusoras.
La evaluación de comorbilidades debe ser un proceso clínico que se base en la anamnesis y en los signos detectados durante una exploración neurológica exhaustiva del paciente. Aspectos claves que debe incluir la anamnesis son: la caracterización del perfil del deterioro cognitivo: cortical, subcortical o mixto; La evaluación de antecedentes personales relevantes: rendimiento académico, factores de riesgo cardiovascular, consumo de tóxicos y salud mental, traumatismos craneoencefálicos y enfermedades médicas relevantes (enfermedades definitorias de SIDA, infecciones del sistema nervioso central, neuropatías, coinfección por la hepatitis C, infecciones como el CMV o la sífilis…).
Respecto a la indicación de pruebas complementarias, hay algunas que se recomienda solicitar de rutina y otras de forma dirigida en función de los hallazgos de la anamnesis y la exploración física. En todo paciente con un TNAV se debería disponer de una analítica básica con serologías (hepatitis C, hepatitis B, CMV y sífilis), TSH, testosterona y niveles de vitamina B y folato, un electrocardiograma, una placa de tórax y una ecografía abdominal.
A todos los pacientes se les debería realizar una resonancia magnética cerebral, con el objetivo de evaluar la presencia de atrofia y su perfil y descartar la existencia de lesiones ocupantes de espacio y alteraciones de señal, y una extracción de sangre y líquido cefalorraquídeo (LCR) para descartar que no existe escape viral del VIH en el LCR. A demás de la carga viral en el LCR, recomendamos evaluar en el LCR la existencia de un patrón compatible con meningitis, serologías de sífilis (si procede), PCR de virus herpes, JC y BK y marcadores de la EA: proteína TAU, fosfo-TAU y beta-amiloide.
De forma no rutinaria en algunas ocasiones podría estar también indicado solicitar otras pruebas como un MAPA para despistaje de hipertensión, una evaluación de la agudeza visual y/o auditiva, un electroneurograma para valorar neuropatía o un EEG para valorar cuadros comiciales.
Recomendaciones:
- Todo paciente VIH diagnosticado de deterior cognitivo debe someterse a una evaluación médica para detectar comorbilidades que puedan alterar el funcionamiento neurocognitivo (A-III).
- Siempre que técnicamente sea factible, se deberá ofrecer al paciente con VIH y deterioro cognitivo completar estudio con al menos una resonancia magnética cerebral y una punción lumbar (B-III).
Tratamiento
El tratamiento de los TNAV debe buscar, como primer objetivo, revertir el deterioro neurocognitivo y, cuando esto no sea posible, prevenir el declinar neurocognitivo. Para ello, habrá que intentar controlar tanto los efectos directos e indirectos que el VIH produce en el SNC como los producidos por otras comorbilidades neurocognitivas.
El tratamiento actual de los TNAV es principalmente farmacológico. La única medida que ha demostrado ser altamente eficaz en la prevención y tratamiento de los TNAV más severos es el TAR. La persistencia de TNAV leves a pesar del TAR ha favorecido la proliferación de estudios que han evaluado sin gran éxito el beneficio de añadir al TAR un fármaco neuroprotector frente a la acción del VIH. En los últimos años, se están comenzando a evaluar estrategias no farmacológicas como el manejo de comorbilidades con capacidad de deteriorar el funcionamiento cognitivo, la instauración de hábitos de vida saludables o la neurorehabilitación cognitiva; estrategias cuyos resultados son prometedores, pero todavía no son concluyentes.
5.6.1. Tratamiento farmacológico
5.6.1.1. El tratamiento anitrretroviral
La supresión de la carga viral de VIH es la medida que ha demostrado ser más efectiva, tanto a nivel terapéutico como preventivo, en el tratamiento de los TNAV. El TAR se ha relacionado con una reducción notable en la prevalencia e incidencia de la demencia VIH248, pero no de los TNAV asintomático y leves261284 La persistencia de estas formas leves de TNAV en pacientes tratados con TAR de forma efectiva parece deberse a diversos factores como por ejemplo el inicio del TAR en fases tardías de la infección en las que ya se ha producido un daño neurológico irreversible280.
Un aspecto controvertido sobre el papel del TAR en los TNAV es si todas las pautas de fármacos antirretrovirales (ARV) tienen la misma eficacia en la prevención y tratamiento de los TNAV. Desde los primeros años de uso del TAR se comenzaron a detectar casos de pacientes en los que a pesar de recibir TAR, la carga viral de VIH en LCR se mantenía detectable. El estudio de estos casos mostró que los niveles en LCR para algunos de los ARV que recibían estos pacientes eran inferiores a los necesarios para conseguir una supresión eficaz del VIH. Esto, junto a la constatación en estos pacientes de correlación entre la carga viral en LCR y la presencia de TNAV304, hizo que algunos expertos planteasen que la persistencia de los TNAV a pesar del TAR se debía al uso de ARV con una penetrabilidad en LCR insuficiente para controlar completamente la replicación del VIH en el SNC305. Y que para tratar los TNAV se abogase por el uso de aquellas pautas de TAR con una mayor penetrabilidad en LCR.
Penetrabilidad del TAR en LCR
Múltiples son los estudios farmacocinéticos y farmacodinámicos que se han realizado para caracterizar el perfil de penetrabilidad de los distintos ARV en LCR Tabla 6. En general, el objetivo de estos estudios ha sido estimar el nivel de ARV que se alcanza en LCR y su relación con el nivel plasmático. Las principales limitaciones de estos estudios son: 1) Que en general incluyen un número reducido de casos. 2) Que usan distintas medidas para evaluar la actividad antiviral (concentraciones inhibitorias o efectivas 50 o 90). 3) Que la dosificación estudiada para algunos ARV está obsoleta. Y 4) que en muchos estudios se asumió erróneamente que los ARV en el LCR no se unían a proteínas.
Abreviaturas. LA= Long Acting
*En los casos en que ha habido más de dos estudios, se han seleccionado aquellos con mayor número de muestras, siendo los rangos el menor valor de ambos estudios y el mayor valor de ambos estudios.
**En algunos estudios no estaba reflejado si la IC50 en plasma estaba ajustada o no a proteínas. # Todas las concentraciones de TAF estaban por debajo de la sensibilidad del ensayo
1) Antimicrob Agents Chemother 2002;46:896-9. 2) CROI 2001. Abst. 614. 3) Top HIV Med 2008;16:94- 8. 4) AIDS 1998;12:1941-55. 5) Clin Infect Dis 2005;41:1787-93. 6) AIDS 2011;25:1437-9. 7) J Acquir Immune Defic Syndr 2012;59:376-81. 8) Antimicrob Agents Chemother 2005;49:2504-6. 9) J Antimicrob Chemother 2011;66:354-7. 10) J Antimicrob Chemother 2011;66:354-7. 11) www.ema.europa.eu. 12) PLoS One. 2009;1;49:e6877. 13) Antimicrob Agents Chemothe. 2010;54:5156-60. 14) J Acquir Immune Defic Syndr 2010;55:606-9. 15) AIDS 2012;26:890-3. 16) AIDS 2012 Jul 31;2612:1529-33. 17) AIDS Res Hum Retroviruses 2009;25:457-61. 18) AIDS 2005;19:949-52. 19) AIDS 2009;23:83-7. 20) Clin Infect Dis 2019;ciz926. 21) Antimicrob Agents Chemother 2011;55:813-2. 22) J Infect Dis 2020;2219:1425-1428. 23) J Antimicrob Chemother 2020;753:648-655.
En general, en la actualidad, todos los ARV tienen una penetrabilidad alta en LCR y las concentraciones que alcanzan son suficientemente elevadas como para suprimir la replicación de cepas de VIH salvajes. La única excepción sería Tenofovir, que en LCR alcanza niveles muy inferiores a los plasmáticos (<5%) que no superan la concentración inhibitoria (IC) 50 del VIH en un 23% de los pacientes306. El hallazgo en muestras cerebrales obtenidas de pacientes post- mortem de niveles muy elevados de Tenofovir en el tejido cerebral307 ponen en cuestión que la penetrabilidad de Tenofovir en SNC sea baja y por tanto la capacidad de predecir la penetrabilidad en SNC de un ARV en base a sus concentraciones en LCR.
Traslación clínica de la penetrabilidad de ARV en LCR
Con el objetivo de trasladar los resultados de los estudios de penetrabilidad de los ARV en LCR a la práctica clínica se ha desarrollado scores de penetración del TAR en LCR. El más relevante es el Central Nervous System penetration and effectiveness (CPE) score desarrollado entre 2004 y 2008 en la cohorte CHARTER a partir de las características fisicoquímicas y farmacocinéticas de los distintos ARV. En 2008 fue publicada una primera aproximación que fue corregida en 2010308309. Desde 2010 el CPE score no ha sido revisado. En un estudio publicado en 2019 otros autores han publicado una versión actualizada cuya utilidad no ha sido validada310.
El CPE score demostró predecir el riesgo de presentar replicación viral persistente en LCR311 pero ha sido incapaz de demostrar en la propia cohorte CHARTER su utilidad para predecir los cuadros de escape viral en LCR, la presencia de deterioro cognitivo o el declinar cognitivo 266284312 . Tampoco ha demostrado su utilidad como herramienta que guie la selección del TAR en pacientes con TNAV313. La utilidad del CPE score también ha sido evaluada fuera de CHARTER con resultados contradictorios310314317.
La falta de eficacia del CPE score en muchos estudios se ha sugerido que podría deberse a la buena penetrabilidad que tienen todos los ARV actuales o a factores diferentes al control de la replicación viral como puede ser la neurotoxicidad del TAR318.
Recomendaciones:
- El inicio precoz del TAR y el control de comorbilidades que puedan favorecer negativamente sobre el funcionamiento neurocognitivo son las medidas más efectivas para prevenir el desarrollo de TNAV (A-I).
- En pacientes sin síntomas neurocognitivos, la penetrabilidad en LCR no debe ser uno criterios que guíen la elección del TAR (A-II).
- En pacientes con sospecha de encefalitis VIH, de una enfermedad oportunista del SNC o con escape viral en LCR se recomienda iniciar un TAR que incluya fármacos activos y con alta penetrabilidad en LCR (A-II).
- Los pacientes, diagnosticados de TNAV y tratados con fármacos ARV con baja penetrabilidad en LCR, podría beneficiarse del cambio a una pauta de TAR con mayor penetrabilidad en LCR, siempre que el perfil de tolerabilidad del nuevo TAR sea similar o mejor al del previo (C-I).
- La interrupción del tratamiento antirretroviral está desaconsejada también a nivel de protección del SNC y, por tanto, se debería promover una correcta adherencia a la terapia antiviral (B-III).
5.6.1.2. Tratamiento coadyuvantes
La falta de una eficacia del TAR en el tratamiento de los TNAV ha favorecido el estudio de estrategias terapéuticas adyuvantes con moléculas con propiedades neuroprotectoras in vitro. En general, la mayoría de estos estudios fueron estudios piloto de corta duración, sin potencia para demostrar el beneficio de la molécula evaluada. Por ello sus resultados deben ser interpretados con cautela.
Rivastigmina
La Rivastigmina, un inhibidor de la colinesterasa utilizado como tratamiento sintomático en la enfermedad de Alzheimer (EA), fue evaluada en 27 personas con VIH y deterioro cognitivo, durante entre 20-48 semanas, en dos ensayos clínicos piloto. En ambos, no se observaron beneficios a nivel cognitivo relevantes y sí un porcentaje elevado de efectos adversos y discontinuaciones relacionadas con el fármaco319320.
Minociclina
La Minociclina, por su capacidad para reducir los niveles de óxido nítrico a nivel cerebral, fue evaluada en un ensayo clínico randomizado y doble ciego a 24 semanas en 107 participantes. El uso de minociclina fue seguro, pero no demostró ningún beneficio a nivel cognitivo 321.
Memantina
La Memantina, por su capacidad protectora frente a la excitotoxicidad de la glicoproteína 120, fue evaluada en dos ensayos clínicos, también con resultados negativos a nivel cognitivo322323.
Selegilina
La Selegilina, por su capacidad de reducir la oxidación de radicales libres a nivel cerebral, fue evaluada por vía transdérmica en el ACTG 5090. En este ensayo clínico, ciego a 24 semanas y abierto de semana 24 a 48, el uso de selegilina fue seguro, pero no demostró ningún beneficio a nivel cognitivo324325.
Litio
El Litio, por su capacidad protectora frente a la excitotoxicidad de la glicoproteína 120, ha sido evaluado en tres ensayos clínicos con resultados a nivel cognitivo contradictorios320326327.
Ácido valproico
El ácido valproico, por su capacidad neuroprotectora in vitro frente al VIH, fue evaluado, sin demostrar beneficios a nivel cognitivo, en 22 pacientes en un ensayo clínico doble ciego piloto de 10 semanas328.
Eritropoyetina
La Eritropoyetina ha demostrado capacidad neuroprotectora in vitro329 y en modelos animales330 frente a la excitotoxicidad producida por las proteínas de la envuelta del VIH.
Lexipafant
El Lexipafant, por su efecto como inhibidor del factor activador de las plaquetas (marcador de inflamación asociado al daño neuronal), demostró que podría tener efecto beneficio a nivel cognitivo en un pequeño (n=13) ensayo clínico piloto doble ciego331.
CPI-1189
El CPI-1189, por su efecto antioxidante neuroprotector in vitro, fue evaluado, sin demostrar beneficios a nivel cognitivo frente a placebo, en 64 individuos VIH en un ensayo clínico de 10 semanas332.
Nimodipino
El Nimodipino, por su capacidad como antagonista voltaje-dependiente de los canales de calcio, fue evaluado, sin demostrar beneficios a nivel cognitivo frente a placebo, en 41 pacientes con deterioro cognitivo moderado-severo en un ensayo clínico de 16 semanas333.
Estatinas
El papel de las estatinas, por su capacidad in vitro de modular la respuesta inmune y reducir la replicación del VIH, han sido evaluado en dos estudios, sin demostrar beneficios a nivel cognitivo o de reducción de la carga viral en LCR302334.
Inhibidores selectivos de la recaptación de serotonina (ISRSs)
El papel de los ISRSs, por su capacidad in vitro inhibitoria de la replicación del VIH, ha sido evaluado en un estudio de cohortes en 658 pacientes. Este estudio demostró niveles más bajos de carga viral en LCR y un mejor rendimiento cognitivo en los pacientes tratados con ISRS334
Péptido T
El péptido T (D-ala-péptido T-amida), por su papel protector frente a la excitotoxicidad de la glicoproteína 120, fue evaluado frente a placebo en 143 pacientes en un ensayo clínico doble ciego de 6 meses. Los resultados del estudio solo demostraron un potencial beneficio en el subgrupo de pacientes con un mayor grado de deterioro cognitivo y/o mejor situación inmunológica basal335.
Recomendaciones:
- En pacientes diagnosticados de TNAV no se recomienda el uso de ninguna medida farmacológica adyuvante al TAR (A-I).
5.6.2. Intervenciones no farmacológicas
Los estudios indican que nuestro cerebro y funciones cognitivas pueden ser influidos por factores modificables a través de mecanismos de neuroplasticidad sobre los que podemos intervenir con el objetivo de prevenir o tratar los TNAV336. Dentro de estas intervenciones, que denominamos no farmacológicas, tenemos la prevención de las comorbilidades, la mejora del estilo de vida y la rehabilitación neurocognitiva Tabla 7. De forma general, el manejo de estos factores no difiere de forma sustancian entre los pacientes VIH y la población general.
5.6.2.1. Prevención de las comorbilidades
Como ya se comentó en el punto 5.3, el virus no es la única condición capaz de favorecer el deterioro cognitivo de los pacientes infectados por VIH337. Como veremos a continuación, actuar sobre aquellas de estas condiciones que son modificables podría prevenir el declinar de la función cognitiva en los pacientes con TNAV:
Prevención cardiovascular
La hipertensión arterial (HTA), la diabetes mellitus tipo 2 (DM) y la dislipemia (DL) son comorbilidades muy prevalentes en el VIH, asociadas con un aumento del riesgo de enfermedad microvascular cerebral y deterioro neurocognitivo. Por ejemplo, en pacientes VIH de edad avanzada, se ha identificado relación directa entre un mayor riesgo cardiovascular, estimado por ASCVD y Framingham, y una peor evolución cognitiva tras 4 años de seguimiento338.
Respecto a la HTA, el control de la tensión arterial con hipotensores en pacientes hipertensos con278 y sin338 VIH se ha asociado con menores tasas de demencia y, en población general, con menos riesgo de desarrollo de declinar cognitivo339, pero solo en pacientes sin enfermedad cerebrovascular previa340. Para la DM, aunque no hay evidencia de que el control glucémico prevenga el deterioro cognitivo, sabemos que la hiperglucemia se ha asociado con un efecto deletéreo sobre el funcionamiento cognitivo, tanto en población general341 como en VIH342. Finalmente, la DL se ha asociado tanto en población general343 como VIH344 con un riesgo aumentado de deterioro neurocognitivo. Como ya se ha comentado las estatinas podrían tener un papel tanto en el control de la DL como en la prevención de los TNAV345.
Curación de la hepatitis C
En población general, la curación de la hepatitis C se ha asociado con mejorías a nivel del funcionamiento cognitivo y del metabolismo cerebral346. En VIH, no disponemos de datos sobre el efecto neurocognitivo de curar la hepatitis C. Aunque la evidencia del papel de la hepatitis C sobre la función cognitiva es controvertida347 sería de esperar que los efectos a nivel cognitivo de curar la hepatitis C fueran similares a los evidenciados en población general.
Trastornos mentales
En general, tanto los trastornos mentales como los fármacos utilizados para su tratamiento se han relacionado con tasas elevadas de deterioro neurocognitivo.
Por ejemplo, para la depresión, existe una clara asociación entre esta entidad y la presencia de diversas alteraciones cognitivas (velocidad de procesamiento, funciones ejecutivas, aprendizaje-memoria y motricidad)348. Aunque no está claro el efecto cognitivo a largo plazo que tiene el control de la depresión, a corto plazo sabemos que la depresión va a disminuir el rendimiento cognitivo por lo que se recomienda su tratamiento antes de evaluar a un paciente de un TNAV.
Miscelánea
Existen otras comorbilidades en las que se ha señalado una posible asociación con los TNAV337; dadas su menor prevalencia o el menor grado de evidencia solo las reseñamos: insuficiencia renal crónica, déficit de vitamina B12; déficit de vitamina D, deficiencia de testosterona, disfunción tiroidea subclínica, estrógenos, hipotiroidismo subclínico, síndrome metabólico, obesidad.
5.6.2.2. Intervenciones sobre los factores asociados al estilo de vida
Existe una evidencia creciente de que nuestro estilo de vida contribuye a la capacidad del cerebro para afrontar las enfermedades y reaccionar a los desafíos349. Diversos estudios, la mayoría realizados en población general, han demostrado que la modificación de los principales factores asociados al estilo de vida puede producir beneficios a nivel del funcionamiento cognitivo.
Dieta
Aunque no existe evidencia específica en población VIH, la llamada dieta mediterránea podría tener un efecto protector frente a los TNAV350. Un estudio ha observado una reducción del riesgo de deterioro cognitivo leve del 28% tras 4,5 años de seguimiento en pacientes que seguían una dieta mediterránea351. Respecto a los ácidos grasos omega-3, la última revisión Cochrane de 2016 sobre su valor en la prevención de la demencia no encontró pruebas suficientes para recomendar su uso352.
Actividad física
En población general, el ejercicio físico regular se ha relacionado con menores tasas de deterioro neurocognitivo leve353. En VIH, aunque no se dispone de estudios longitudinales que hayan evaluado el efecto cognitivo de la actividad física, la evidencia sugiere que el ejercicio regular mejora la salud general del cerebro354.
Actividades de ocio
En población general, las actividades de ocio (leer, dibujar, jugar al ajedrez o a las cartas, visitar un museo, tocar música, jardinería, cocinar o realizar actividades sociales, etc…) a lo largo de la vida y especialmente durante la mediana edad y la vejez podrían ser beneficiosas para prevenir la demencia355. Sin embargo, con la evidencia actual, que no incluye estudios específicos para VIH, no podemos establecer una relación causal directa entre ocio y función cognitiva356.
Reducción del estrés
El estrés causa una serie de adaptaciones neuronales y endocrinas complejas que puede comprometer la supervivencia neuronal y disminuir la capacidad plástica del cerebro. En general, los pacientes infectados por VIH suelen tener un mayor distrés psicológico, menor calidad de vida y mayor prevalencia de trastornos psiquiátricos357. Aunque son numerosos los programas de reducción del estrés en pacientes VIH publicados con resultados positivos a nivel de cambios a nivel emocional y calidad de vida358, ninguno ha analizado la repercusión de estas intervenciones sobre el funcionamiento cognitivo.
Tabaquismo
El consumo de tabaco parece asociarse en población general con aumento de riesgo de demencia359360. En VIH, disponemos de un estudio comparativo en el que los fumadores VIH (n=103) tuvieron peores resultados a nivel de la memoria de trabajo y de la velocidad de procesamiento94 En cuanto a actuaciones, ningún estudio longitudinal ha valorado los efectos del abandono tabáquico sobre la cognición.
Consumo de alcohol
La evidencia disponible respecto al efecto del consumo de alcohol sobre la función cognitiva no es concluyente, pero sugiere que un consumo bajo – moderado (<12g de alcohol) podría tener un efecto protector sobre el rendimiento cognitivo, mientras que para consumos mayores el efecto sería negativo361. En VIH, los pacientes con dependencia al alcohol tienen mayores tasas de TNAV362.
Uso de sustancias tóxica
Respecto al consumo de sustancias, la evidencia es contradictoria363364 y su efecto a nivel cognitivo va a depender del grado de consumo y del efecto neurotóxico directo e indirecto de cada sustancia (consultar punto 4.4). Con independencia de ello, se ha objetivado que el aumento de los niveles de dopamina que producen sustancias como la cocaína, la heroína o la metanfetamina produce una desregulación inmune de los monocitos y de la microglia que podría favorecer el desarrollo de los TNAV 365.
5.6.2.3. Rehabilitación cognitiva
La neurorehabilitación se define como el proceso que se ocupa de la mejorar los déficits cognitivos, emocionales, psicosociales y conductuales causados por un daño en el cerebro366. Los objetivos de estas estrategias son minimizar el impacto del deterioro cognitivo, optimizar las capacidades residuales, compensar la incapacidad ya instalada y promover un envejecimiento saludable preservando la dignidad del paciente.
Los programas de neurorehabilitación cognitiva han demostrado ser útiles en varias patologías que cursan con deterioro neurocognitivo como el daño cerebral adquirido367 o la esquizofrenia368. Igualmente, estas técnicas han sido aplicadas con resultados menos claros, aunque alentadores, en la EA, en otras demencias369 y más recientemente en gente mayor sana y con deterioro cognitivo leve370
En el campo del VIH se han publicado muy pocos estudios que evalúen la eficacia de diferentes técnicas de intervención cognitiva371372. Todos estos trabajos aplican técnicas de entrenamiento cognitivo y muestran efectos positivos, aunque varían mucho en su metodología y la muestra Tabla 8.
Aunque la evidencia sobre su utilidad es aún limitada diversos grupos de expertos abogan por el uso de estrategias de neurorehabilitación cognitiva tanto en el campo de la EA373 como del VIH374 con el objetivo de intentar mejorar la cognición del individuo, su funcionalidad y su entorno.
Recomendaciones:
- En el tratamiento de los TNAV:
- Se recomienda el manejo de todas las comorbilidades, susceptibles de ser modificadas, que puedan afectar la función cognitiva del individuo (A-II).
- Se recomiendan las intervenciones encaminadas a favorecer hábitos de vida saludable como el ejercicio físico, la dieta mediterránea y el abandono de tóxicos (A-II). Otras medidas que podrían ser eficaces son favorecer las actividades de ocio y las estrategias de reducción del estrés (B-III).
- Podrían ser de utilidad los programas de rehabilitación y estimulación cognitiva (B-II).
ALGORITMO DE TRATAMIENTO DE LOS TNAV Tabla 9
Tablas:
Abreviaturas: ACTG, AIDS Clinical Trial Group; DE, Desviación Estándar;
HAART, Highly Active Antiretroviral Therapy; TAR, Tratamiento Antirretroviral.


BNC, Brief Neurocognitive; HNRC, E, Especificidad; HIV Neurobehavioral Research Center; MoCA, Montreal Cognitive Assessment; NEU, Neurocognitive; S, Sensibilidad.

Abreviaturas: WAIS-IV - Wechsler adult intelligence scale IV. TMT - trail maiking test. SDMT – symbol digit modalities test. TAVEC – test de aprendizaje verbal España-complutense. CVLT – California verbal learning test. PMR – Variante de la prueba de COWAT (controlled oral word association) con las letras P, M y R en lugar de F, A y S. GP - grooved pegboard.
* El color trails test sería la alternativa al TMT B en pacientes que no manejen el alfabeto.


Valorar la retirada de fármacos que a sus concentraciones terapéuticas se hayan asociado con neurotoxicidad (clínica o in vitro).
** Se recomienda que se incluya una reevaluación neuropsicológica del estatus cognitivo y médica de las comorbilidades.
*** De aplicación universal: Control de comorbilidades neurocognitivas asociadas e intervenciones en mejorar del estilo de vida.
Opcional: Programas de neurorehabilitación, individuales o grupales, o de estimulación neurocognitiva online.

Abreviaturas: Con: Grupo control, Exp: Grupo experimental, VP: Velocidad de procesamiento. MT: Memoria de trabajo. DC: Deterioro cognitivo. TNAV: Trastornos neurocognitivos asociados al VIH. CWMT: Cogmed Working Memory Training.
1) Disability and Rehabilitation 2012;3421:1848–1852. 2) J Assoc Nurses AIDS Care 2012;236:500–510. 3) Front Behav Neurosci 2015;9:306. 4) J Neurosci Nurs 2015;474:247-54. 5) Ann Neurol 2017;811:17-34. 6) JMIR Res Protoc 2017 ;64:e68. 7) Ther Adv Infect Dis 2018;51:19- 28. 8) J Assoc Nurses AIDS Care 2017;284:633-643. 9) Res Nurs Health 2018;411:11-18.
En los estudios más recientes, está primando la estimulación cognitiva de funciones típicamente afectadas por el VIH. Cabe señalar que, aunque los primeros estudios muestren que podría ser una herramienta útil en personas VIH, se necesitan más trabajos para confirmar su eficacia en esta población y conocer qué programas serían los más adecuados.
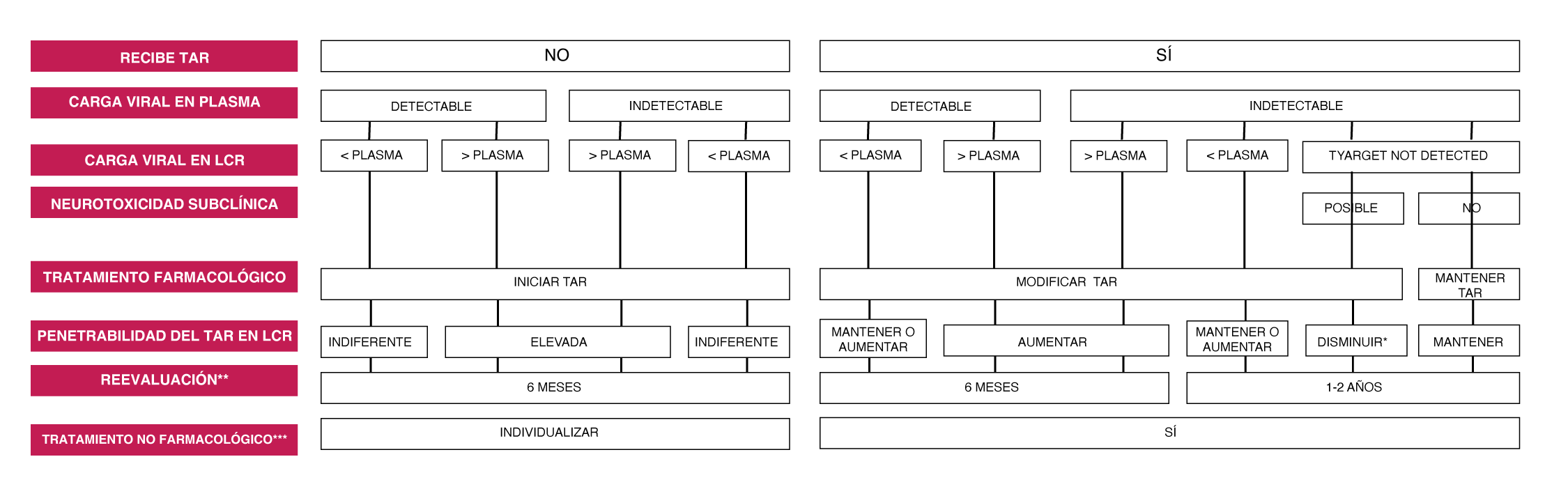
Valorar la retirada de fármacos que a sus concentraciones terapéuticas se hayan asociado con neurotoxicidad (clínica o in vitro).
** Se recomienda que se incluya una reevaluación neuropsicológica del estatus cognitivo y médica de las comorbilidades.
*** De aplicación universal: Control de comorbilidades neurocognitivas asociadas e intervenciones en mejorar del estilo de vida.
Opcional: Programas de neurorehabilitación, individuales o grupales, o de estimulación neurocognitiva online.
Bibliografía:
Cantú Guzmán R, Álvarez Bermúdez J, Torres López E, Martínez Sulvarán O. Impacto psicosocial asociado al diagnóstico de infección por vih/SIDA: apartados cualitativos de medición. Revista Electrónica Medicina, Salud y Published online 2012.
Flowers P, Davis MM, Larkin M, Church S, Marriott C. Understanding the impact of HIV diagnosis amongst gay men in Scotland: An interpretative phenomenological Psychology & Health. 2011;26(10):1378-1391. doi:10.1080/08870446.2010.551213
Zeligman M, Wood AW. Conceptualizing an HIV Diagnosis Through a Model of Grief and Adultspan Journal. 2017;16(1):18-30. doi:10.1002/adsp.12031
Richard Lazarus MVMSF. Estrés y Procesos Cognitivos. (Martinez Roca, ed.).; 1986.
Milena Gaviria A, Quiceno JM, Vinaccia S, Martínez LA, Otalvaro Estrategias de afrontamiento y ansiedad-depresión en pacientes diagnosticados con VIH/SIDA. Terapia Psicologica. 2009;27(1):5-13. doi:10.4067/s0718-48082009000100001
Carrobles JA, Remor E, Rodríguez-Alzamora Afrontamiento, apoyo social percibido y distrés emocional en pacientes con infección por VIH. [Relationshiop of coping and perceived social support to emotional distress in people living with HIV.]. Psicothema. 2003;15(3):420-426.
Chida Y, Vedhara Adverse psychosocial factors predict poorer prognosis in HIV disease: A meta- analytic review of prospective investigations. Brain, Behavior, and Immunity. 2009;23(4):434-445. doi:10.1016/j.bbi.2009.01.013
Ironson GH, O’Cleirigh C, Weiss A, Schneiderman N, Costa PT. Personality and HIV Disease Progression: Role of NEO-PI-R Openness, Extraversion, and Profiles of Psychosomatic Medicine. 2008;70(2):245-253. doi:10.1097/PSY.0b013e31816422fc
Lee RS, Kochman A, Sikkema Internalized Stigma Among People Living with HIV-AIDS. AIDS
Guevara-Sotelo Y, Hoyos-Hernández Vivir con VIH: experiencias de estigma sentido en
Chan RCH, Mak WWS. Cognitive, Regulatory, and Interpersonal Mechanisms of HIV Stigma on the Mental and Social Health of Men Who Have Sex With Men Living With HIV. American Journal of Men’s 2019;13(5):155798831987377. doi:10.1177/1557988319873778
Travaglini LE, Himelhoch SS, Fang LJ. HIV Stigma and Its Relation to Mental, Physical and Social Health Among Black Women Living with HIV/AIDS. AIDS and Behavior. 2018;22(12):3783-3794. doi:10.1007/s10461-018-2037-1
Atkinson JS, Nilsson Schönnesson L, Williams ML, Timpson Associations among correlates of schedule adherence to antiretroviral therapy (ART): A path analysis of a sample of crack cocaine using sexually active African–Americans with HIV infection. AIDS Care. 2008;20(2):253- 262. doi:10.1080/09540120701506788
Johnson CJ, Heckman TG, Hansen NB, Kochman A, Sikkema KJ. Adherence to antiretroviral medication in older adults living with HIV/AIDS: a comparison of alternative models. AIDS Care. 2009;21(5):541-551. doi:10.1080/09540120802385611
Santoro Pablo CF. Tipos de problemas de adherencia entre las personas con VIH y tendencias emergentes en la adherencia al tratamiento antirretroviral (TAR). Revista Multidisciplinar del 2013;1(1):41-58.
Dilla T, Valladares A, Lizán L, Sacristán JA. Adherencia y persistencia terapéutica: causas, consecuencias y estrategias de mejora. Atención Primaria. 2009;41(6):342-348. doi:10.1016/j. 2008.09.031
Owe-Larsson M, Säll L, Salamon E, Allgulander HIV infection and psychiatric illness. African
Dyer JG and Reducing HIV risk among people with serious mental illness. J
Parhami I, Fong TW, Siani A, Carlotti C, Khanlou H. Documentation of Psychiatric Disorders and Related Factors in a Large Sample Population of HIV-Positive Patients in California. AIDS and 2013;17(8):2792-2801. doi:10.1007/s10461-012-0386-8
Bing EG, Burnam MA, Longshore D, et al. Psychiatric Disorders and Drug Use Among Human Immunodeficiency Virus–Infected Adults in the United States. Archives of General Psychiatry. 2001;58(8):721. doi:10.1001/archpsyc.58.8.721
Lopes M, Olfson M, Rabkin J, et Gender, HIV Status, and Psychiatric Disorders. The Journal of
Brandt The mental health of people living with HIV/AIDS in Africa: A systematic review. African
Burnam MA, Bing EG, Morton SC, et Use of mental health and substance abuse treatment services among adults with HIV in the United States. Archives of General Psychiatry. 2001;58(8):729-736. doi:10.1001/archpsyc.58.8.729
Kessler RC, Chiu WT, Demler O, Walters EE. Prevalence, Severity, and Comorbidity of 12-Month DSM-IV Disorders in the National Comorbidity Survey Replication. Archives of General Psychiatry. 2005;62(6):617. doi:10.1001/archpsyc.62.6.617
Schadé A, van Grootheest G, Smit JH. HIV-infected mental health patients: Characteristics and comparison with HIV-infected patients from the general population and non-infected mental health BMC Psychiatry. 2013;13. doi:10.1186/1471-244X-13-35
Gallego L, Barreiro P, Lopez-Ibor Diagnosis and Clinical Features of Major Neuropsychiatric
Pence BW, O’Donnell JK, Gaynes Falling through the cracks. AIDS. 2012;26(5):656-658.
Beer L, Tie Y, Padilla M, Shouse Generalized anxiety disorder symptoms among persons with diagnosed HIV in the United States. AIDS. 2019;33(11):1781-1787. doi:10.1097/ QAD.0000000000002286
Rane MS, Hong T, Govere S, et al. Depression and Anxiety as Risk Factors for Delayed Care- Seeking Behavior in Human Immunodeficiency Virus–Infected Individuals in South Africa. Clinical Infectious 2018;67(9):1411-1418. doi:10.1093/cid/ciy309
Glynn TR, Safren SA, Carrico AW, et al. High Levels of Syndemics and Their Association with Adherence, Viral Non-suppression, and Biobehavioral Transmission Risk in Miami, a S. City with an HIV/AIDS Epidemic. AIDS and Behavior. 2019;23(11):2956-2965. doi:10.1007/s10461-019- 02619-0
Been SK, Schadé A, Bassant N, Kastelijns M, Pogány K, Verbon A. Anxiety, depression and treatment adherence among HIV-infected AIDS Care. 2019;31(8):979-987. doi:10.1080/ 09540121.2019.1601676
Zigmond AS, Snaith The Hospital Anxiety and Depression Scale. Acta Psychiatrica
Ferrando L, Bobes J Gibert M, Soto M, Soto M.I.N.I. Mini International Neuropsychiatric
Baldwin DS, Anderson IM, Nutt DJ, Evidence-basedguidelinesforthepharmacologicaltreatment of anxiety disorders: recommendations from the British Association for Psychopharmacology. Journal of Psychopharmacology. 2005;19(6):567-596. doi:10.1177/0269881105059253
Rabkin HIV and depression: 2008 review and update. Current HIV/AIDS Reports. 2008;5(4):163-
doi:10.1007/s11904-008-0025-1
Leserman HIV disease progression: depression, stress, and possible mechanisms. Biological
Mollan KR, Smurzynski M, Eron JJ, et Association Between Efavirenz as Initial Therapy for HIV- 1 Infection and Increased Risk for Suicidal Ideation or Attempted or Completed Suicide. Annals of Internal Medicine. 2014;161(1):1. doi:10.7326/M14-0293
Slot M, Sodemann M, Gabel C, Holmskov J, Laursen T, Rodkjaer Factors associated with risk of depression and relevant predictors of screening for depression in clinical practice: a cross- sectional study among HIV-infected individuals in Denmark. HIV Medicine. 2015;16(7):393-402. doi:10.1111/hiv.12223
Robertson K, Bayon C, Molina J-M, et al. Screening for neurocognitive impairment, depression, and anxiety in HIV-infected patients in Western Europe and AIDS Care. 2014;26(12):1555- 1561. doi:10.1080/09540121.2014.936813
Morrison MF, Petitto JM, Have T ten, et al. Depressive and Anxiety Disorders in Women With HIV
Rao D, Feldman BJ, Fredericksen RJ, et al. A Structural Equation Model of HIV-Related Stigma, Depressive Symptoms, and Medication Adherence. AIDS and Behavior. 2012;16(3):711-716. doi:10.1007/s10461-011-9915-0
Ciesla JA, Roberts JE. Meta-Analysis of the Relationship Between HIV Infection and Risk for Depressive Disorders. American Journal of Psychiatry. 2001;158(5):725-730. doi:10.1176/appi. 158.5.725
Tegger MK, Crane HM, Tapia KA, Uldall KK, Holte SE, Kitahata MM. The Effect of Mental Illness, Substance Use, and Treatment for Depression on the Initiation of Highly Active Antiretroviral Therapy among HIV-Infected Individuals. AIDS Patient Care and STDs. 2008;22(3):233-243. doi:10.1089/apc.2007.0092
Gonzalez JS, Batchelder AW, Psaros C, Safren Depression and HIV/AIDS Treatment Nonadherence: A Review and Meta-analysis. JAIDS Journal of Acquired Immune Deficiency Syndromes. 2011;58(2):181-187. doi:10.1097/QAI.0B013E31822D490A
Springer SA, Dushaj A, Azar MM. The Impact of DSM-IV Mental Disorders on Adherence to Combination Antiretroviral Therapy Among Adult Persons Living with HIV/AIDS: A Systematic AIDS and Behavior. 2012;16(8):2119-2143. doi:10.1007/s10461-012-0212-3
Sherr L, Clucas C, Harding R, Sibley E, Catalan J. HIV and Depression – a systematic review of Psychology, Health & Medicine. 2011;16(5):493-527. doi:10.1080/13548506.2011.5 79990
Leserman Role of Depression, Stress, and Trauma in HIV Disease Progression. Psychosomatic
So‐Armah K, Gupta S, Kundu S, et Depression and all‐cause mortality risk in HIV‐infected and HIV‐uninfected US veterans: a cohort study. HIV Medicine. 2019;20(5):317-329. doi:10.1111/ hiv.12726
European AIDS Clinical Society. EACS Guidelines version 10.0 — EACS. Published November Accessed June 25, 2020. https://www.eacsociety.org/files/2019_guidelines-10.0_final.pdf.
Treisman GJ, Soudry O. Neuropsychiatric Effects of HIV Antiviral Medications. Drug Safety. 2016;39(10):945-957. doi:10.1007/s40264-016-0440-y
Aragonès E, Roca M, Mora F. Abordaje Compartido de La Depresión: Consenso Multidisciplinar ; 2018. Accessed June 25, 2020. Ebook disponible en: www.semfyc.es/wp-content/ uploads/2018/05/ Consenso_depresion.pdf.
Laperriere A, Ironson GH, Antoni MH, et al. Decreased Depression Up to One Year Following CBSM+ Intervention in Depressed Women with AIDS: The Smart/EST Women’s Project. Journal of Health 2005;10(2):223-231. doi:10.1177/1359105305049772
Carrico AW, Antoni MH, Durán RE, et Reductions in depressed mood and denial coping during
Paulus DJ, Brandt CP, Lemaire C, Zvolensky MJ. Trajectory of change in anxiety sensitivity in relation to anxiety, depression, and quality of life among persons living with HIV/AIDS following transdiagnostic cognitive-behavioral therapy. Cognitive Behaviour Therapy. 2020;49(2):149-163. doi:10.1080/16506073.2019.1621929
Freudenreich O, Goforth HW, Cozza KL, et Psychiatric treatment of persons with HIV/AIDS: An HIV-psychiatry consensus survey of current practices. Psychosomatics. 2010;51(6):480-488. doi:10.1176/appi.psy.51.6.480
Ferrando SJ, Freyberg Treatment of depression in HIV positive individuals: A critical review.
Chandra PS, Desai G, Ranjan HIV & Psychiatric Disorders. Vol 121.; 2005.
de Sousa Gurgel W, da Silva Carneiro AH, Barreto Rebouças D, Negreiros de Matos KJ, do Menino Jesus Silva Leitão T, de Matos e Souza FG. Prevalence of bipolar disorder in a HIV- infected outpatient AIDS Care. 2013;25(12):1499-1503. doi:10.1080/09540121.2013.7 79625
Kieburtz K, Zettelmaier AE, Ketonen L, Tuite M, Caine Manic syndrome in AIDS. American
Ellen SR, Judd FK, Mijch AM, Cockram Secondary Mania in Patients with HIV Infection. Australian
Nakimuli-Mpungu E, Musisi S, Mpungu SK, Katabira Primary Mania Versus HIV-Related Secondary Mania in Uganda. American Journal of Psychiatry. 2006;163(8):1349-1354. doi:10.1176/ ajp.2006.163.8.1349
Robinson Primary Mania Versus Secondary Mania of HIV/AIDS in Uganda. American Journal
Nakimuli-Mpungu E, Musisi S, Kiwuwa Mpungu S, Katabira E. Clinical Presentation of Bipolar Mania in HIV-Positive Patients in Psychosomatics. 2009;50(4):325-330. doi:10.1176/appi. psy.50.4.325
Lyketsos CG, Hanson AL, Fishman M, Rosenblatt A, McHugh PR, Treisman GJ. Manic syndrome early and late in the course of HIV. American Journal of Psychiatry. 1993;150(2):326-327. doi:10.1176/ajp.150.2.326
Nakimuli-Mpungu, Mutamba Brian, Nshemerirwe Slyvia, Kiwuwa Mpungu Steven, Seggane Musisi. Effect of HIV infection on time to recovery from an acute manic HIV/AIDS - Research and Palliative Care. 2010;2:185. doi:10.2147/hiv.s9978
Soares Recent advances in the treatment of bipolar mania, depression, mixed states, and rapid cycling. International Clinical Psychopharmacology. 2000;15(4):183-196. doi:10.1097/00004850- 200015040-00001
American Psychiatric Diagnostic and Statistical Manual of Mental Disorders DSM-5
Stolar A. HIV and Psychiatry, Second Edition: A Training and Resource Manual . Cambridge University Press;
Newton PJ, Newsholme W, Brink NS, Manji H, Williams IG, Miller RF. Acute meningoencephalitis and meningitis due to primary HIV infection. BMJ (Clinical research ed). 2002;325(7374):1225- https://Pubmed.ncbi.nlm.nih.gov/12446542
Anguizola-Tamayo D, Bocos-Portillo J, Pardina-Vilella L, et al. Psychosis of dual origin in HIV infection: Viral escape syndrome and autoimmune encephalitis. Neurology Clinical practice. 2019;9(2):178-180. doi:10.1212/CPJ.0000000000000582
Laher A, Ariefdien N, Etlouba HIV prevalence among first-presentation psychotic patients. HIV
de Ronchi D, Faranca I, Forti P, et al. Development of Acute Psychotic Disorders and HIV-1 The International Journal of Psychiatry in Medicine. 2000;30(2):173-183. doi:10.2190/ PLGX-N48F-RBHJ-UF8K
Singh AN, Golledge H, Catalan Treatment of HIV-related psychotic disorders with risperidone: A series of 21 cases. Journal of Psychosomatic Research. 1997;42(5):489-493. doi:10.1016/S0022- 3999(96)00373-X
Fernandez F, Levy JK. The use of molindone in the treatment of psychotic and delirious patients infected with the human immunodeficiency virus. General Hospital Psychiatry. 1993;15(1):31-35. doi:10.1016/0163-8343(93)90088-6
Sewell DD, Jeste D , McAdams LA, et al. Neuroleptic Treatment of HIV-Associated Psychosis.
Millon Classifying Personality Disorders: An Evolution-Based Alternative to an Evidence-Based
Nanni MG, Caruso R, Mitchell AJ, Meggiolaro E, Grassi Depression in HIV Infected Patients: a
Low Y, Goforth H, Preud’homme X, Edinger J, Krystal A. Insomnia in HIV-infected patients: pathophysiologic . AIDS Reviews. 2014;16:3-13.
Omonuwa TS, Goforth HW, Preud’homme X, Krystal AD. The pharmacologic management of insomnia in patients with Journal of clinical sleep medicine : JCSM : official publication of the American Academy of Sleep Medicine. 2009;5(3):251-262. https://Pubmed.ncbi.nlm.nih. gov/19960648
Fekete EM, Williams SL, Skinta MD. Internalised HIV-stigma, loneliness, depressive symptoms and sleep quality in people living with Psychology & Health. 2018;33(3):398-415. doi:10.1080
Rogers BG, Lee JS, Bainter SA, Bedoya CA, Pinkston M, Safren A multilevel examination of sleep, depression, and quality of life in people living with HIV/AIDS. Journal of health psychology. Published online March 1, 2018:1359105318765632-1359105318765632. doi:10.1177/1359105318765632
Qaseem A, Kansagara D, Forciea MA, Cooke M, Denberg TD. Management of Chronic Insomnia Disorder in Adults: A Clinical Practice Guideline From the American College of Physicians. Annals of Internal 2016;165(2):125. doi:10.7326/M15-2175
Wilson S, Anderson K, Baldwin D, et al. British Association for Psychopharmacology consensus statement on evidence-based treatment of insomnia, parasomnias and circadian rhythm disorders: An Journal of Psychopharmacology. 2019;33(8):923-947. doi:10.1177/0269881119855343
Celesia M., Sofia S. A., Rapisarda L., et al. Anxiety, depression and sleep disturbances in hiv+ patients chronically treated with an Efavirenz-based regimen. Infectious Diseases & Tropical Medicine . 2017;3(2):e394.
Asboe D, Catalan J, Mandalia S, et Sexual dysfunction in HIV-positive men is multi-factorial: A study of prevalence and associated factors. AIDS Care - Psychological and Socio-Medical Aspects of AIDS/HIV. 2007;19(8):955-965. doi:10.1080/09540120701209847
Sandfort TGM, Collier KL, Grossberg R. Addressing sexual problems in HIV primary care: Experiences from patients. Archives of Sexual Behavior. 2013;42(7):1357-1368. doi:10.1007/ s10508-012-0009-5
Waters L, Fisher M, Winston A, et A phase IV, double-blind, multicentre, randomized, placebo- controlled, pilot study to assess the feasibility of switching individuals receiving Efavirenz with continuing central nervous system adverse events to etravirine. AIDS. 2011;25(1):65-71. doi:10.1097/QAD.0b013e328341685b
Pinzone MR, Gussio M, Bellissimo F, et Self-Reported Sexual Dysfunction in HIV-Positive
Laumann EO, Paik A, Rosen Sexual dysfunction in the United States: Prevalence and predictors.
Shamloul R, Ghanem Erectile dysfunction. The Lancet. 2013;381(9861):153-165. doi:10.1016/
Santi D, Brigante G, Zona S, Guaraldi G, Rochira Male sexual dysfunction and HIV-a clinical
Slag MF, Morley JE, Elson MK, et Impotence in Medical Clinic Outpatients. JAMA. 1983;249(13):1736-1740. doi:10.1001/jama.1983.03330370046029
Tsertsvadze A, Fink HA, Yazdi F, et al. Oral Phosphodiesterase-5 Inhibitors and Hormonal Treatments for Erectile Dysfunction: A Systematic Review and Meta-analysis. Annals of Internal 2009;151(9):650. doi:10.7326/0003-4819-151-9-200911030-00150
Brock G, Heiselman D, Maggi M, et al. Effect of Testosterone Solution 2% on Testosterone Concentration, Sex Drive and Energy in Hypogonadal Men: Results of a Placebo Controlled Journal of Urology. 2016;195(3):699-705. doi:10.1016/j.juro.2015.10.083
Cai T, Palumbo F, Liguori G, et al. The intra-meatal application of alprostadil cream (Vitaros®) improves drug efficacy and patient’s satisfaction: results from a randomized, two-administration route, cross-over clinical International Journal of Impotence Research. 2019;31(2):119-125. doi:10.1038/s41443-018-0087-6
Derouet H, Caspari D, Rohde V, Rommel G, Ziegler Treatment of erectile dysfunction with
Zhu Z, Zhao R, Hu Y. Symptom Clusters in People Living With HIV: A Systematic Review. Journal
Jong E, Oudhoff LA, Epskamp C, et Predictors and treatment strategies of HIV-related fatigue in the combined antiretroviral therapy era. AIDS. 2010;24(10):1387-1405. doi:10.1097/ QAD.0b013e328339d004
Bengtson AM, Pence BW, Crane HM, et Disparities in depressive symptoms and antidepressant treatment by gender and race/ethnicity among people living with HIV in the United States. PLoS ONE. 2016;11(8). doi:10.1371/journal.pone.0160738
Webel AR, Perazzo J, Decker M, Horvat-Davey C, Sattar A, Voss J. Physical activity is associated with reduced fatigue in adults living with HIV/AIDS. Journal of Advanced 2016;72(12):3104- 3112. doi:10.1111/jan.13084
Bertholet N, Cheng DM, Samet JH, Quinn E, Saitz R. Alcohol consumption patterns in HIV- infected adults with alcohol problems. Drug and Alcohol Dependence. 2010;112(1-2):160-163. doi:10.1016/j.drugalcdep.2010.05.009
Braithwaite RS, Conigliaro J, Roberts MS, et al. Estimating the impact of alcohol consumption on survival for HIV+ individuals. AIDS Care - Psychological and Socio-Medical Aspects of AIDS/HIV. 2007;19(4):459-466. doi:10.1080/09540120601095734
Lucas GM, Mullen BA, Weidle PJ, Hader S, McCaul ME, Moore RD. Directly Administered Antiretroviral Therapy in Methadone Clinics Is Associated with Improved HIV Treatment Outcomes, Compared with Outcomes among Concurrent Comparison Groups. Clinical Infectious Diseases. 2006;42(11):1628-1635. doi:10.1086/503905
Andersen R, Bozzette S, Shapiro M, et al. Access of vulnerable groups to antiretroviral therapy among persons in care for HIV disease in the United States. HCSUS Consortium. HIV Cost and Services Utilization Study. Health services research. 2000;35(2):389-416. https://Pubmed.ncbi. nih.gov/10857469
Cook RL, Sereika SM, Hunt SC, Woodward WC, Erlen JA, Conigliaro J. Problem drinking and medication adherence among persons with HIV infection. Journal of General Internal Medicine. 2001;16(2):83-88. doi:10.1111/j.1525-1497.2001.00122.x
Azar MM, Springer SA, Meyer JP, Altice FL. A systematic review of the impact of alcohol use disorders on HIV treatment outcomes, adherence to antiretroviral therapy and health care Drug and Alcohol Dependence. 2010;112(3):178-193. doi:10.1016/j.drugalcdep.2010.06.014
Wu ES, Metzger DS, Lynch KG, Douglas Association between alcohol use and HIV viral load. Journal of Acquired Immune Deficiency Syndromes. 2011;56(5). doi:10.1097/ QAI.0b013e31820dc1c8
Stein MD, Hanna L, Natarajan R, et al. Alcohol use patterns predict high-risk HIV behaviors among active injection drug users. Journal of Substance Abuse Treatment. 2000;18(4):359-363. doi:10.1016/S0740-5472(99)00070-7
Mathews WC, McCutchan JA, Asch S, et National estimates of HIV-related symptom prevalence from the HIV cost and services utilization study. Medical Care. 2000;38(7):750-761. doi:10.1097/00005650-200007000-00007
Shacham E, Agbebi A, Stamm K, Overton ET. Alcohol consumption is associated with poor health in HIV clinic patient population: A behavioral surveillance AIDS and Behavior. 2011;15(1):209- 213. doi:10.1007/s10461-009-9652-9
Palepu A, Horton NJ, Tibbetts N, Meli S, Samet Substance abuse treatment and hospitalization among a cohort of HIV-infected individuals with alcohol problems. Alcoholism: Clinical and Experimental Research. 2005;29(3):389-394. doi:10.1097/01.ALC.0000156101.84780.45
Korthuis PT, Tozzi MJ, Nandi V, et Improved quality of life for opioid-dependent patients receiving buprenorphine treatment in HIV clinics. Journal of Acquired Immune Deficiency Syndromes. 2011;56(SUPPL. 1). doi:10.1097/QAI.0b013e318209754c
Lucas GM, Griswold M, Gebo KA, Keruly J, Chaisson RE, Moore Illicit Drug Use and HIV- 1 Disease Progression: A Longitudinal Study in the Era of Highly Active Antiretroviral Therapy. American Journal of Epidemiology. 2006;163(5):412-420. doi:10.1093/aje/kwj059
Galvan FH, Bing EG, Fleishman JA, et al. The prevalence of alcohol consumption and heavy drinking among people with HIV in the United States: Results from the HIV cost and services utilization Journal of Studies on Alcohol. 2002;63(2):179-186. doi:10.15288/jsa.2002.63.179
Bagby GJ, Amedee AM, Siggins RW, Molina PE, Nelson S, Veazey Alcohol and HIV Effects on the Immune System. Alcohol research : current reviews. 2015;37(2):287-297. https://Pubmed. ncbi.nlm.nih.gov/26695751
Amedee A, Nichols W, Robichaux S, Bagby G, Nelson S. Chronic Alcohol Abuse and HIV Disease Progression: Studies with the Non-Human Primate Current HIV Research. 2014;12(4):243- 253. doi:10.2174/1570162x12666140721115717
Ludford KT, Vagenas P, Lama JR, et al. Screening for Drug and Alcohol Use Disorders and Their Association with HIV-Related Sexual Risk Behaviors among Men Who Have Sex with Men in PLoS ONE. 2013;8(8). doi:10.1371/journal.pone.0069966
Parry CD, Blank MB, Pithey AL. Responding to the threat of HIV among persons with mental illness and substance abuse. Current Opinion in Psychiatry. 2007;20(3):235-241. doi:10.1097/ 0b013e3280ebb5f0
Kader R, Govender R, Seedat S, Koch JR, Parry C. Understanding the impact of hazardous and harmful use of alcohol and/or other drugs on ARV adherence and disease progression. PLoS 2015;10(5). doi:10.1371/journal.pone.0125088
Pellowski JA, Kalichman SC, Kalichman MO, Cherry C. Alcohol-antiretroviral therapy interactive toxicity beliefs and daily medication adherence and alcohol use among people living with HIV. AIDS Care - Psychological and Socio-Medical Aspects of AIDS/HIV. 2016;28(8):963-970. doi:10. 1080/09540121.2016.1154134
Williams EC, Hahn JA, Saitz R, Bryant K, Lira MC, Samet Alcohol Use and Human Immunodeficiency Virus (HIV) Infection: Current Knowledge, Implications, and Future Directions. Alcoholism: Clinical and Experimental Research. 2016;40(10):2056-2072. doi:10.1111/acer.13204
Kelso NE, Sheps DS, Cook RL. The association between alcohol use and cardiovascular disease among people living with HIV: A systematic American Journal of Drug and Alcohol Abuse. 2015;41(6):479-488. doi:10.3109/00952990.2015.1058812
McGinnis KA, Fultz SL, Skanderson M, Conigliaro J, Bryant K, Justice Hepatocellular carcinoma and non-Hodgkin’s lymphoma: The roles of HIV, hepatitis C infection, and alcohol abuse. Journal of Clinical Oncology. 2006;24(31):5005-5009. doi:10.1200/JCO.2006.05.7984
Fein G, Biggins CA, MacKay S. Alcohol abuse and HIV infection have additive effects on frontal cortex function as measured by auditory evoked potential P3A latency. Biological Psychiatry. 1995;37(3):183-195. doi:10.1016/0006-3223(94)00119-N
Gongvatana A, Morgan EE, Iudicello JE, Letendre SL, Grant I, Woods SP. A history of alcohol dependence augments HIV-associated neurocognitive deficits in persons aged 60 and older. Journal of 2014;20(5):505-513. doi:10.1007/s13365-014-0277-z
Pérez-Molina JA, Polo R, López-Aldeguer J, et al. Executive summary of the GeSIDA/National AIDS Plan consensus document on antiretroviral therapy in adults infected by the human immunodeficiency virus (updated January 2018). Enfermedades Infecciosas y Microbiologia 2019;37(3):195-202. doi:10.1016/j.eimc.2018.02.010
Mcdowell JA, Chittick GE, Stevens CP, Edwards KD, Stein DS. Pharmacokinetic interaction of Abacavir (1592U89) and ethanol in human immunodeficiency virus-infected adults. Antimicrobial Agents and 2000;44(6):1686-1690. doi:10.1128/AAC.44.6.1686-1690.2000
McCance-Katz EF, Gruber VA, Beatty G, Lum PJ, Rainey Interactions between alcohol and the antiretroviral medications Ritonavir or Efavirenz. Journal of Addiction Medicine. 2013;7(4):264- 270. doi:10.1097/ADM.0b013e318293655a
Gruber VA, Rainey PM, Lum PJ, Beatty GW, Aweeka FT, McCance-Katz Interactions between
Lifson AR, Neuhaus J, Arribas JR, van Berg-Wolf M den, Labriola AM, Read TRH. Smoking- related health risks among persons with HIV in the strategies for management of antiretroviral therapy clinical trial. American Journal of Public Health. 2010;100(10):1896-1903. doi:10.2105/ 2009.188664
Lifson AR, Lando HA. Smoking and HIV: Prevalence, health risks, and cessation strategies. Current HIV/AIDS 2012;9(3):223-230. doi:10.1007/s11904-012-0121-0
Zyambo CM, Burkholder GA, Cropsey KL, et al. Predictors of smoking cessation among people living with HIV receiving routine clinical care. AIDS Care - Psychological and Socio-Medical Aspects of AIDS/HIV. 2019;31(11):1353-1361. doi:10.1080/09540121.2019.1619659
Helleberg M, May MT, Ingle SM, et Smoking and life expectancy among HIV-infected individuals on antiretroviral therapy in Europe and North America. AIDS. 2015;29(2):221-229. doi:10.1097/ QAD.0000000000000540
Petoumenos K, Worm S, Reiss P, et Rates of cardiovascular disease following smoking cessation in patients with HIV infection: Results from the D:A:D study. HIV Medicine. 2011;12(7):412-421. doi:10.1111/j.1468-1293.2010.00901.x
Shepherd L, Ryom L, Law M, et al. Cessation of Cigarette Smoking and the Impact on Cancer Incidence in Human Immunodeficiency Virus–infected Persons: The Data Collection on Adverse Events of Anti-HIV Drugs Clinical Infectious Diseases. 2018;68(4):650-657. doi:10.1093/cid/ ciy508
Vidrine DJ, Arduino RC, Gritz ER. The effects of smoking abstinence on symptom burden and quality of life among persons living with HIV/AIDS. AIDS Patient Care and 2007;21(9):659- 666. doi:10.1089/apc.2007.0022
Reddy KP, Parker RA, Losina E, et Impact of Cigarette Smoking and Smoking Cessation on Life Expectancy Among People With HIV: A US-Based Modeling Study. The Journal of Infectious Diseases. 2016;214(11):1672-1681. doi:10.1093/infdis/jiw430
Tait RJ, Caldicott D, Mountain D, Hill SL, Lenton S. A systematic review of adverse events arising from the use of synthetic cannabinoids and their associated treatment. Clinical Toxicology. 2016;54(1):1-13. doi:10.3109/15563650.2015.1110590
Fogarty A, Rawstorne P, Prestage G, Crawford J, Grierson J, Kippax S. Marijuana as therapy for people living with HIV/AIDS: Social and health aspects. AIDS Care - Psychological and Socio- Medical Aspects of AIDS/HIV. 2007;19(2):295-301. doi:10.1080/09540120600841930
Furler MD, Einarson TR, Millson M, Walmsley S, Bendayan R. Medicinal and Recreational Marijuana Use by Patients Infected with HIV. AIDS Patient Care and STDs. 2004;18(4):215-228. doi:10.1089/108729104323038892
Prentiss D, Power R, Balmas G, Tzuang G, Israelski Patterns of Marijuana Use among Patients with HIV/AIDS Followed in a Public Health Care Setting. Journal of Acquired Immune Deficiency Syndromes. 2004;35(1):38-45. doi:10.1097/00126334-200401010-00005
Woolridge E, Barton S, Samuel J, Osorio J, Dougherty A, Holdcroft A. Cannabis use in HIV for pain and other medical symptoms. Journal of Pain and Symptom Management. 2005;29(4):358- doi:10.1016/j.jpainsymman.2004.07.011
Bonn-Miller MO, Oser ML, Bucossi MM, Trafton Cannabis use and HIV antiretroviral therapy adherence and HIV-related symptoms. Journal of Behavioral Medicine. 2014;37(1):1-10. doi:10.1007/s10865-012-9458-5
Lake S, Kerr T, Capler R, Shoveller J, Montaner J, Milloy High-intensity cannabis use and HIV clinical outcomes among HIV-positive people who use illicit drugs in Vancouver, Canada. International Journal of Drug Policy. 2017;42:63-70. doi:10.1016/j.drugpo.2017.02.009
Sinha S, McCaul ME, Hutton HE, et al. Marijuana use and HIV treatment outcomes among PWH receiving care at an urban HIV clinic. Journal of Substance Abuse Treatment. 2017;82:102-106. doi:10.1016/j.jsat.2017.09.009
Fuster-RuizdeApodaca MJ, Castro-Granell V, Garin N, et al. Prevalence and patterns of illicit drug use in people living with HIV in Spain: A cross-sectional PLoS ONE. 2019;14(6). doi:10.1371/ journal.pone.0211252
Baum MK, Rafie C, Lai S, Sales S, Page B, Campa A. Crack-cocaine use accelerates HIV disease progression in a cohort of HIV-positive drug users. Journal of Acquired Immune Deficiency 2009;50(1):93-99. doi:10.1097/QAI.0b013e3181900129
Shoptaw S, Stall R, Bordon J, et al. Cumulative exposure to stimulants and immune function outcomes among HIV-positive and HIV-negative men in the Multicenter AIDS Cohort Study. International Journal of STD and 2012;23(8):576-580. doi:10.1258/ijsa.2012.011322
Mukerji S, Haghighat R, Misra V, et al. Longitudinal Modeling of Depressive Trajectories Among HIV-Infected Men Using AIDS and Behavior. 2017;21(7):1985-1995. doi:10.1007/s10461- 017-1801-y
European Monitoring Centre for Drugs and Drug Addiction (EMCDDA). Emergency health consequences of cocaine use in Europe. A review of the monitoring of drug-related acute emergencies in 30 European countries | emcdda.europa.eu. Published 2014. Accessed June 19, 2020. https://www.emcdda.europa.eu/publications/scientific-studies/2014/cocaine- emergencies_en
Informe Europeo sobre Drogas Tendencias y doi:10.2810/295940
Montain J, Ti L, Hayashi K, Nguyen P, Wood E, Kerr T. Impact of length of injecting career on HIV incidence among people who inject Addictive Behaviors. 2016;58:90-94. doi:10.1016/j. addbeh.2016.02.020
Peters PJ, Pontones P, Hoover KW, et HIV infection linked to injection use of oxymorphone in Indiana, 2014-2015. New England Journal of Medicine. 2016;375(3):229-239. doi:10.1056/ NEJMoa1515195
Bourne A, Reid D, Hickson F, Torres-Rueda S, Weatherburn P. Illicit drug use in sexual settings (‘chemsex’) and HIV/STI transmission risk behaviour among gay men in South London: Findings from a qualitative study. Sexually Transmitted Infections. 2015;91(8):564-568. doi:10.1136/ sextrans-2015-052052
Fernández Dávila “Sesión de sexo, morbo y vicio”: una aproximación holística para entender la aparición del fenómeno ChemSex entre hombres gais, bisexuales y otros hombres que tienen sexo con hombres en España. Revista Multidisciplinar del SIDA. 2016;4:41-65.
Payancé A, Scotto B, Perarnau JM, de Muret A, Bacq Y. Severe chronic hepatitis secondary to prolonged use of ecstasy and cocaine. Clinics and Research in Hepatology and Gastroenterology. 2013;37(5). doi:10.1016/j.clinre.2013.06.003
Rodríguez Salgado B. Fenetilaminas Clásicas: MDMA y Sus Análogos, p-Metoxianfetaminas y En: Nuevas Drogas Psicoactivas. . Entheos; 2015.
Dolengevich-Segal H, Rodríguez Salgado B, Ramírez JGA, Sánchez-Mateos D. Nuevas Drogas Vol Cap 5. Entheos; 2015. doi:10.20882/adicciones.709
Swanson Unifying theories of psychedelic drug effects. Frontiers in Pharmacology. 2018;9(MAR). doi:10.3389/fphar.2018.00172
Vollenweider Brain mechanisms of hallucinogens and entactogens. Dialogues in clinical neuroscience. 2001;3:265-279.
Nichols D, Grob Is LSD toxic? Forensic science international. 2018;284:141-145. doi:10.1016/j. forsciint.2018.01.006
Hildebrand M. The psychometric properties of the drug use disorders identification test (DUDIT): A review of recent Journal of Substance Abuse Treatment. 2015;53:52-59. doi:10.1016/j. jsat.2015.01.008
Saunders JB, Aasland OG, Babor TF, de La Fuente JR, Grant Development of the Alcohol Use Disorders Identification Test (AUDIT): WHO Collaborative Project on Early Detection of Persons with Harmful Alcohol Consumption‐II. Addiction. 1993;88(6):791-804. doi:10.1111/j.1360-0443.1993. tb02093.x
Gates PJ, Sabioni P, Copeland J, le Foll B, Gowing Psychosocial interventions for cannabis use disorder. Cochrane Database of Systematic Reviews. 2016;2016(5). doi:10.1002/14651858. CD005336.pub4
Wechsberg WM, Golin C, El-Bassel N, Hopkins J, Zule W. Current interventions to reduce sexual risk behaviors and crack cocaine use among HIV-infected individuals. Current HIV/AIDS Reports. 2012;9(4):385-393. doi:10.1007/s11904-012-0131-y
Gonzales D, Rennard SI, Nides M, et al. Varenicline, an α4β2 nicotinic acetylcholine receptor partial agonist, vs sustained-release Bupropion and placebo for smoking cessation: A randomized controlled trial. Journal of the American Medical Association. 2006;296(1):47-55. doi:10.1001/ 296.1.47
West R, Baker CL, Cappelleri JC, Bushmakin AG. Effect of varenicline and Bupropion SR on craving, nicotine withdrawal symptoms, and rewarding effects of smoking during a quit attempt. 2008;197(3):371-377. doi:10.1007/s00213-007-1041-3
Amodei N, Lamb RJ. The Role of Nicotine Replacement Therapy in Early Quitting Success. Nicotine & tobacco research : official journal of the Society for Research on Nicotine and 2010;12(1):1-10. doi:10.1093/NTR/NTP164
World Health Organisation. Consolidated ARV guidelines on the use of antiretroviral drugs for treating and preventing HIV infection: recommendations for a public health approach. Geneva: World Health Published 2013. Accessed June 19, 2020. http://www.who.int/hiv/pub/ guidelines/arv2013/
Beauverie P, Taburet AM, Dessalles MC, Furlan V, Touzeau D. Therapeutic Drug Monitoring of Methadone in HIV-infected Patients Receiving Protease AIDS . 1998;12(18):2510-2511.
Clarke S, Mulcahy F, Bergin C, et al. Absence of Opioid Withdrawal Symptoms in Patients Receiving Methadone and the Protease Inhibitor Lopinavir‐Ritonavir. Clinical Infectious Diseases. 2002;34(8):1143-1145. doi:10.1086/339541
Clarke SM, Mulcahy FM, Tjia J, et al. Pharmacokinetic Interactions of Nevirapine and Methadone and Guidelines for Use of Nevirapine to Treat Injection Drug Users. Clinical Infectious Diseases. 2001;33(9):1595-1597. doi:10.1086/322519
Ostrow DG, Plankey MW, Cox C, et al. Specific sex drug combinations contribute to the majority of recent HIV seroconversions among MSM in the MACS. Journal of Acquired Immune Deficiency 2009;51(3):349-355. doi:10.1097/QAI.0b013e3181a24b20
Kenyon C, Wouters K, Platteau T, Buyze J, Florence E. Increases in condomless chemsex associated with HIV acquisition in MSM but not heterosexuals attending a HIV testing center in Antwerp, AIDS Research and Therapy. 2018;15(1). doi:10.1186/s12981-018-0201-3
Dolengevich-Segal H, Gonzalez-Baeza A, Valencia J, et al. Drug-related and psychopathological symptoms in HIV-positive men who have sex with men who inject drugs during sex (slamsex): Data from the U-SEX GeSIDA 9416 PLoS ONE. 2019;14(12). doi:10.1371/journal.pone.0220272
World Federation for Mental Health SALUD MENTAL EN ATENCIÓN PRIMARIA: MEJORANDO LOS TRATAMIENTOS Y PROMOVIENDO LA SALUD MENTAL. Accessed June 25, 2020. http:// www.infocop.es/view_article.asp?id=2582
Forstein M, Cournos F, Douaihy A, Goodkin K, Wainberg ML, Wapenyi Guideline Watch:
Kendall CE, Shoemaker ES, Boucher L, et al. The organizational attributes of HIV care delivery models in Canada: A cross-sectional PLoS ONE. 2018;13(6). doi:10.1371/journal. pone.0199395
Haggerty JL, Roberge D, Freeman GK, Beaulieu C. Experienced continuity of care when patients see multiple clinicians: A qualitative metasummary. Annals of Family Medicine. 2013;11(3):262- doi:10.1370/afm.1499
Tran BX, Ho RCM, Ho CSH, et Depression among patients with HIV/AIDS: Research development and effective interventions (gapresearch). International Journal of Environmental Research and Public Health. 2019;16(10). doi:10.3390/ijerph16101772
Eshun-Wilson I, Siegfried N, Akena DH, Stein DJ, Obuku EA, Joska JA. Antidepressants for depression in adults with HIV Cochrane Database of Systematic Reviews. 2018;2018(1). doi:10.1002/14651858.CD008525.pub3
Hill L, Lee KC. Pharmacotherapy considerations in patients with HIV and psychiatric disorders: Focus on antidepressants and antipsychotics. Annals of Pharmacotherapy. 2013;47(1):75-89. doi:10.1345/aph.1R343
DeSilva KE, le Flore DB, Marston BJ, Rimland D. Serotonin syndrome in HIV-infected individuals receiving antiretroviral therapy and AIDS. 2001;15(10):1281-1285. doi:10.1097/00002030- 200107060-00010
Cettomai D, McArthur JC. Mirtazapine use in human immunodeficiency virus-infected patients with progressive multifocal leukoencephalopathy. Archives of Neurology. 2009;66(2):255-258. doi:10.1001/archneurol.2008.557
Jann MW, Spratlin V, Momary K, et al. Lack of a pharmacokinetic drug-drug interaction with venlafaxine extended-release/indinavir and desvenlafaxine extended-release/indinavir. European Journal of Clinical 2012;68(5):715-721. doi:10.1007/s00228-011-1180-7
Park J, Vousden M, Brittain C, et al. Dose-related reduction in Bupropion plasma concentrations by Journal of Clinical Pharmacology. 2010;50(10):1180-1187. doi:10.1177/0091270009359524
Pedrol-Clotet E, Deig-Comerma E, Ribell-Bachs M, Vidal-Castell I, García-Rodríguez P, Soler
Uso de bupropión en la deshabituación tabáquica en pacientes infectados por el VIH en tratamiento antirretroviral. Enfermedades Infecciosas y Microbiologia Clinica. 2006;24(8):509-511. doi:10.1157/13092468
Adams JL, Gaynes BN, McGuinness T, Modi R, Willig J, Pence BW. Treating depression within the HIV medical home: A guided algorithm for antidepressant management by HIV clinicians. AIDS Patient Care and 2012;26(11):647-654. doi:10.1089/apc.2012.0113
Pettersson A, Boström KB, Gustavsson P, Ekselius Which instruments to support diagnosis of depression have sufficient accuracy? A systematic review. Nordic Journal of Psychiatry. 2015;69(7):497-508. doi:10.3109/08039488.2015.1008568
Newville H, Roley J, Sorensen Prescription medication misuse among HIV-infected individuals taking antiretroviral therapy. Journal of Substance Abuse Treatment. 2015;48(1):56-61. doi:10.1016/j.jsat.2014.07.013
Johannessen Landmark C. Antiepileptic drugs in non-epilepsy disorders: Relations between mechanisms of action and clinical CNS Drugs. 2008;22(1):27-47. doi:10.2165/00023210- 200822010-00003
HIV Drug University of Liverpool. Accessed June 26, 2020. https://liverpool-hiv-hep. s3.amazonaws.com/prescribing_resources/pdfs/000/000/023/original/TS_Antipsychotic_2019_ Oct.pdf?1571043424
Owen-Smith A, Depadilla L, Diclemente R. The assessment of complementary and alternative medicine use among individuals with HIV: A systematic review and recommendations for future Journal of Alternative and Complementary Medicine. 2011;17(9):789-796. doi:10.1089/ acm.2010.0669
Panel de expertos de GeSIDA y Plan Nacional sobre el Documento de Consenso de GeSIDA/ Plan Nacional Sobre El SIDA Respecto al Tratamiento Antirretroviral En Adultos Infectados Por El Virus de La Inmunodeficiencia Humana.; 2019. Accessed June 25, 2020. http://GeSIDA-seimc. org/wp-content/uploads/2019/01/GeSIDA_DC_TAR_2019_v_final.pdf.
Thomas Mulet V, Aguado Taberna C, Fidalgo Gónzalez S, et La infección por el VIH/SIDA y atención primaria. Atención Primaria. 2004;33(1):3-5. Accessed June 23, 2020. http://www. elsevier.es/es-revista-atencion-primaria-27-articulo-la-infeccion-por-el-vih-SIDA-13056498
Gallego Deike L, Gordillo Álvarez-Valdés M v. Trastornos mentales en pacientes infectados por el
Gordillo V. Trastornos psicológicos y aspectos psicosociales. Manual del SIDA. Published online 1999:605-620.
Casanova Colominas JM, Carmen Rodríguez Fernández M, Gómez García Manejo del paciente con VIH en Atención Primaria. AMF. 2013;9:306-315.
Núñez Rojas AC, Tobón S, Vinaccia Diseño de Un Modelo de Intervención Psicoterapéutica En El Área de La Salud a Partir Del Enfoque Procesal Del Estrés. Vol 13. Universidad de los Andes.; 2006. Accessed June 23, 2020. http://www.scielo.org.co/scielo.php?script=sci_ arttext&pid=S0123-885X2004000200007&lng=en&nrm=iso&tlng=es
Jin Y, Potthoff A, Xu J, et al. Evaluation of Mental Status HIV-Infected Patients: Implications for Treatment. Current HIV Research. 2012;10(6):546-551. doi:10.2174/157016212802429857
Balfour L, Kowal J, Silverman A, et al. A randomized controlled psycho-education intervention trial: Improving psychological readiness for successful HIV medication adherence and reducing depression before initiating HAART. AIDS Care - Psychological and Socio-Medical Aspects of AIDS/HIV. 2006;18(7):830-838. doi:10.1080/09540120500466820
Hill S, Kavookjian J. Motivational interviewing as a behavioral intervention to increase HAART adherence in patients who are HIV-positive: A systematic review of the literature. AIDS Care - Psychological and Socio-Medical Aspects of AIDS/HIV. 2012;24(5):583-592. doi:10.1080/095401 2011.630354
Hollon SD, DeRubeis RJ, Shelton RC, et al. Prevention of relapse following cognitive therapy vs medications in moderate to severe depression. Archives of General Psychiatry. 2005;62(4):417- doi:10.1001/archpsyc.62.4.417
Parikh S v., Segal Z v., Grigoriadis S, et al. Canadian Network for Mood and Anxiety Treatments (CANMAT) Clinical guidelines for the management of major depressive disorder in adults. II. Psychotherapy alone or in combination with antidepressant medication. Journal of Affective 2009;117(SUPPL. 1). doi:10.1016/j.jad.2009.06.042
Spies G, Asmal L, Seedat S. Cognitive-behavioural interventions for mood and anxiety disorders in HIV: A systematic review. Journal of Affective Disorders. 2013;150(2):171-180. doi:10.1016/j. 2013.04.018
Brown JL, Vanable PA. Cognitive-behavioral stress management interventions for persons living with HIV: A review and critique of the Annals of Behavioral Medicine. 2008;35(1):26-40. doi:10.1007/s12160-007-9010-y
Markowitz JC, Kocsis JH, Fishman B, et al. Treatment of depressive symptoms in human immunodeficiency virus- positive patients. Archives of General Psychiatry. 1998;55(5):452-457. doi:10.1001/archpsyc.55.5.452
Markowitz J, Spielman L, Sullivan M, Fishman An Exploratory Study of Ethnicity and Psychotherapy Outcome Among HIV-Positive Patients With Depressive Symptoms. The Journal of psychotherapy practice and research. 2000;9:226-231.
Gayner B, Esplen MJ, de Roche P, et A randomized controlled trial of mindfulness-based stress reduction to manage affective symptoms and improve quality of life in gay men living with HIV. Journal of Behavioral Medicine. 2012;35(3):272-285. doi:10.1007/s10865-011-9350-8
Creswell JD, Myers HF, Cole SW, Irwin MR. Mindfulness meditation training effects on CD4+ T lymphocytes in HIV-1 infected adults: A small randomized controlled trial. Brain, Behavior, and 2009;23(2):184-188. doi:10.1016/j.bbi.2008.07.004
Seyedalinaghi S, Jam S, Foroughi M, et al. Randomized controlled trial of mindfulness-based stress reduction delivered to human immunodeficiency virus-positive patients in Iran: Effects on CD4 + T lymphocyte count and medical and psychological symptoms. Psychosomatic Medicine. 2012;74(6):620-627. doi:10.1097/PSY.0b013e31825abfaa
Gonzalez-Garcia M, Ferrer MJ, Borras X, et al. Effectiveness of mindfulness-based cognitive therapy on the quality of life, emotional status, and CD4 cell count of patients aging with HIV AIDS and Behavior. 2014;18(4):676-685. doi:10.1007/s10461-013-0612-z
World Health Risks to Mental Health : An Overview of Vulnerabilities and Risk
Vreeman RC, McCoy BM, Lee S. Mental health challenges among adolescents living with HIV. Journal of the International AIDS 2017;20(Suppl 3). doi:10.7448/IAS.20.4.21497
Donenberg GR, Pao Youths and HIV/AIDS: Psychiatry’s role in a changing epidemic. Journal of the American Academy of Child and Adolescent Psychiatry. 2005;44(8):728-747. doi:10.1097/01. chi.0000166381.68392.02
González-Scarano F, Martín-García The neuropathogenesis of AIDS. Nature Reviews Immunology. 2005;5(1):69-81. doi:10.1038/nri1527
Marhefka SL, Lyon M, Koenig LJ, et Emotional and behavioral problems and mental health service utilization of youth living with HIV acquired perinatally or later in life. AIDS Care - Psychological and Socio-Medical Aspects of AIDS/HIV. 2009;21(11):1447-1454. doi:10.1080/09540120902883085
García-Navarro C, García I, Medín G, et Aspectos psicosociales en una cohorte de adolescentes con infección por el virus de la inmunodeficiencia humana por transmisión vertical. NeuroCoRISpeS. Enfermedades Infecciosas y Microbiologia Clinica. 2014;32(10):631-637. doi:10.1016/j.eimc.2013.11.008
Mellins CA, Brackis-Cott E, Leu CS, et al. Rates and types of psychiatric disorders in perinatally human immunodeficiency virus-infected youth and Journal of Child Psychology and Psychiatry and Allied Disciplines. 2009;50(9):1131-1138. doi:10.1111/j.1469-7610.2009.02069.x
Mellins CA, Malee Understanding the mental health of youth living with perinatal HIV infection: Lessons learned and current challenges. Journal of the International AIDS Society. 2013;16(1). doi:10.7448/IAS.16.1.18593
le Prevost M, Arenas-Pinto A, Melvin D, et al. Anxiety and depression symptoms in young people with perinatally acquired HIV and HIV affected young people in AIDS Care - Psychological and Socio-Medical Aspects of AIDS/HIV. 2018;30(8):1040-1049. doi:10.1080/09540121.2018.144 1972
Kapetanovic S, Wiegand RE, Dominguez K, et Associations of medically documented psychiatric diagnoses and risky health behaviors in highly active antiretroviral therapy-experienced perinatally HIV-infected youth. AIDS Patient Care and STDs. 2011;25(8):493-501. doi:10.1089/apc.2011.0107
Woods SP, Moore DJ, Weber E, Grant I. Cognitive neuropsychology of HIV-associated neurocognitive Neuropsychology Review. 2009;19(2):152-168. doi:10.1007/s11065-009- 9102-5
van den Hof M, ter Haar AM, Scherpbier HJ, et al. Neurocognitive Development in Perinatally Human Immunodeficiency Virus–infected Adolescents on Long-term Treatment, Compared to Healthy Matched Controls: A Longitudinal Study. Clinical Infectious Diseases. 2020;32:21-29. doi:10.1093/cid/ciz386
Robbins RN, Zimmerman R, Korich R, et al. Longitudinal trajectories of neurocognitive test performance among individuals with perinatal HIV-infection and -exposure: adolescence through young adulthood. AIDS Care - Psychological and Socio-Medical Aspects of AIDS/HIV. 2020;32(1):21-29. doi:10.1080/09540121.2019.1626343
Williams PL, Storm D, Montepiedra G, et al. Predictors of adherence to antiretroviral medications in children and adolescents with HIV infection. Pediatrics. 2006;118(6). doi:10.1542/peds.2006- 0493
Murphy DA, Wilson CM, Durako SJ, Muenz LR, Belzer M. Antiretroviral medication adherence among the REACH HIV-infected adolescent cohort in the USA. AIDS Care - Psychological and Socio-Medical Aspects of AIDS/HIV. 2001;13(1):27-40. doi:10.1080/09540120020018161
Kang E, Delzell DAP, Chhabra M, Oberdorfer Factors associated with high rates of antiretroviral medication adherence among youth living with perinatal HIV in Thailand. International Journal of STD and AIDS. 2015;26(8):534-541. doi:10.1177/0956462414545524
Capilla M, Montes M, Gómez M, Barrio V. Primera adaptación del CDI-S a población española. Acción psicológica, ISSN 1578-908X, Vol 1, No 3, 2002, pags 263-272. 2002;1.
Masip A, Amador-Campos J, Cebollero M. Características psicométricas de la Reynolds Adolescent Depression Scale en población comunitaria y clínica. International Journal of Clinical and Health 2008;8.
Herrero MJ, Blanch J, Peri JM, de Pablo J, Pintor L, Bulbena A. A validation study of the hospital anxiety and depression scale (HADS) in a Spanish population. General Hospital Psychiatry. 2003;25(4):277-283. doi:10.1016/S0163-8343(03)00043-4
Richardson LP, Rockhill C, Russo JE, et Evaluation of the PHQ-2 as a brief screen for detecting major depression among adolescents. Pediatrics. 2010;125(5). doi:10.1542/peds.2009-2712
Berger BE, Ferrans CE, Lashley Measuring stigma in people with HIV: Psychometric assessment of the HIV stigma scale. Research in Nursing and Health. 2001;24(6):518-529. doi:10.1002/nur.10011
Bussing R, Fernandez M, Harwood M, et al. Parent and teacher SNAP-IV ratings of attention deficit hyperactivity disorder symptoms: Psychometric properties and normative ratings from a school district Assessment. 2008;15(3):317-328. doi:10.1177/1073191107313888
Duncan L, Georgiades K, Wang L, et al. Psychometric evaluation of the Mini International Neuropsychiatric Interview for Children and Adolescents (MINI-KID). Psychological Assessment. 2018;30(7):916-928. doi:10.1037/pas0000541
Malhotra S, Padhy SK. Challenges in Providing Child and Adolescent Psychiatric Services in Low Resource Countries. Child and Adolescent Psychiatric Clinics of North America. 2015;24(4):777- doi:10.1016/j.chc.2015.06.007
Philbin MM, Tanner AE, Chambers BD, et Transitioning HIV-infected adolescents to adult care
Skeen SA, Sherr L, Croome N, et al. Interventions to improve psychosocial well-being for children affected by HIV and AIDS: a systematic review. Vulnerable Children and Youth Studies. 2017;12(2):91-116. doi:10.1080/17450128.2016.1276656
McKay MM, Chasse KT, Paikoff R, et al. Family-level impact of the CHAMP family program: A community collaborative effort to support urban families and reduce youth HIV risk exposure. Family 2004;43(1):79-93. doi:10.1111/j.1545-5300.2004.04301007.x
Brown LK, Kennard BD, Emslie GJ, et al. Effective Treatment of Depressive Disorders in Medical Clinics for Adolescents and Young Adults Living with HIV: A Controlled Trial. Journal of Acquired Immune Deficiency 2016;71(1):38-46. doi:10.1097/QAI.0000000000000803
Kennard BD, Brown LT, Hawkins L, et Development and implementation of health and wellness CBT for individuals with depression and HIV. Cognitive and Behavioral Practice. 2014;21(2):237- 246. doi:10.1016/j.cbpra.2013.07.003
Bhana A, McKay MM, Mellins C, Petersen I, Bell C. Family-based HIV prevention and intervention services for youth living in poverty-affected contexts: The CHAMP model of collaborative, evidence- informed programme Journal of the International AIDS Society. 2010;13(SUPPL. 2). doi:10.1186/1758-2652-13-S2-S8
Belfer ML. Critical review of world policies for mental healthcare for children and adolescents. Current Opinion in 2007;20(4):349-352. doi:10.1097/YCO.0b013e3281bc0cf4
Transitioning HIV-infected youth into adult health Pediatrics. 2013;132(1):192-197. doi:10.1542/ peds.2013-1073
Valcour V, Chalermchai T, Sailasuta N, et Central Nervous System Viral Invasion and
doi:10.1093/infdis/jis326
Gras G, Kaul M. Molecular mechanisms of neuroinvasion by monocytes-macrophages in HIV-1 Retrovirology. 2010;7. doi:10.1186/1742-4690-7-30
Vitkovic L, Tardieu M. Neuropathogenesis of HIV-1 infection. Outstanding questions. Comptes Rendus de l’Academie des Sciences - Serie III. 1998;321(12):1015-1021. doi:10.1016/S0764- 4469(99)80057-2
Saylor D, Dickens AM, Sacktor N, et al. HIV-associated neurocognitive disorder - Pathogenesis and prospects for treatment. Nature Reviews Neurology. 2016;12(4):234-248. doi:10.1038/ 2016.27
Lindl KA, Marks DR, Kolson DL, Jordan-Sciutto KL. HIV-associated neurocognitive disorder: Pathogenesis and therapeutic Journal of Neuroimmune Pharmacology.
Vago L, Bonetto S, Nebuloni M, et al. Pathological findings in the central nervous system of AIDS patients on assumed antiretroviral therapeutic regimens: Retrospective study of 1597 autopsies. 2002;16(14):1925-1928. doi:10.1097/00002030-200209270-00009
Fois AF, Brew The Potential of the CNS as a Reservoir for HIV-1 Infection: Implications for HIV Eradication. Current HIV/AIDS Reports. 2015;12(2):299-303. doi:10.1007/s11904-015-0257-9
Canestri A, Lescure F, Jaureguiberry S, et al. Discordance Between Cerebral Spinal Fluid and Plasma HIV Replication in Patients with Neurological Symptoms Who Are Receiving Suppressive Antiretroviral Clinical Infectious Diseases. 2010;50(5):773-778. doi:10.1086/650538
Churchill MJ, Gorry PR, Cowley D, et al. Use of laser capture microdissection to detect integrated HIV-1 DNA in macrophages and astrocytes from autopsy brain tissues. Journal of NeuroVirology. 2006;12(2):146-152. doi:10.1080/13550280600748946
Cassol E, Misra V, Dutta A, Morgello S, Gabuzda D. Cerebrospinal fluid metabolomics reveals altered waste clearance and accelerated aging in HIV patients with neurocognitive impairment. 2014;28(11):1579-1591. doi:10.1097/QAD.0000000000000303
Ancuta P, Kamat A, Kunstman KJ, et al. Microbial translocation is associated with increased monocyte activation and dementia in AIDS patients. PLoS ONE. 2008;3(6). doi:10.1371/journal. 0002516
Fauci AS, Marston Ending the HIV-AIDS pandemic - Follow the science. New England Journal of Medicine. 2015;373(23):2197-2199. doi:10.1056/NEJMp1502020
Etherton MR, Lyons JL, Ard KL. HIV-associated Neurocognitive Disorders and Antiretroviral Therapy: Current Concepts and Controversies. Current Infectious Disease Reports. 2015;17(6). doi:10.1007/s11908-015-0485-6
Robertson K, Liner J, Meeker RB. Antiretroviral neurotoxicity. Journal of NeuroVirology. 2012;18(5):388-399. doi:10.1007/s13365-012-0120-3
Rojas-Celis V, Valiente-Echeverría F, Soto-Rifo R, Toro-Ascuy D. New Challenges of HIV-1 Infection: How HIV-1 Attacks and Resides in the Central Nervous Cells. 2019;8(10):1245. doi:10.3390/cells8101245
Antinori A, Arendt G, Becker JT, et Updated research nosology for HIV-associated neurocognitive disorders. Neurology. 2007;69(18):1789-1799. doi:10.1212/01.WNL.0000287431.88658.8b
Robertson KR, Smurzynski M, Parsons TD, et al. The prevalence and incidence of neurocognitive impairment in the HAART AIDS. 2007;21(14):1915-1921. doi:10.1097/QAD.0b013e32828e4e27
Pérez-Valero I, González-Baeza A, Estébanez M, et al. Neurocognitive Impairment in Patients Treated with Protease Inhibitor Monotherapy or Triple Drug Antiretroviral Therapy. PLoS ONE. 2013;8(7). doi:10.1371/journal.pone.0069493
Portilla I, Reus S, León R, et al. Neurocognitive Impairment in Well-Controlled HIV-Infected Patients: A Cross-Sectional AIDS Research and Human Retroviruses. 2019;35(7):634- 641. doi:10.1089/aid.2018.0279
Muñoz-Moreno JA, Pérez-Álvarez N, Muñoz-Murillo A, et Classification models for neurocognitive impairment in HIV infection based on demographic and clinical variables. PLoS ONE. 2014;9(9). doi:10.1371/journal.pone.0107625
CASADO JL, BAYÓN C, PÉREZ VALERO I, et Estudio transversal para evaluar y analizar la prevalencia de detección positiva de síntomas de ansiedad, depresión y deterioro neurocognitivo en pacientes infectados por el VIH-1: estudio CRANIum. Subanálisis por sexos de la población española. SIDA STUDI. Enfermedades Infecciosas y Microbiología Clínica. 2012;30:26-27. Accessed June 23, 2020. http://www.sidastudi.org/es/registro/ff8081813b4c32e8013bff80010100d6
Heaton RK, Franklin DR, Deutsch R, et al. Neurocognitive Change in the Era of HIV Combination Antiretroviral Therapy: The Longitudinal CHARTER Clinical Infectious Diseases. 2015;60(3):473-480. doi:10.1093/cid/ciu862
Pérez-Valero I, González-Baeza A, Estébanez M, et A prospective cohort study of neurocognitive function in aviremic HIV-infected patients treated with 1 or 3 antiretrovirals. Clinical infectious diseases : an official publication of the Infectious Diseases Society of America. 2014;59(11):1627- 1634. doi:10.1093/cid/ciu640
Langford D, Grigorian A, Hurford R, Adame A, Crews L, Masliah E. The role of mitochondrial alterations in the combined toxic effects of human immunodeficiency virus Tat protein and methamphetamine on calbindin positive-neurons. Journal of NeuroVirology. 2004;10(6):327-337. doi:10.1080/13550280490520961
Gandhi N, Saiyed ZM, Napuri J, et al. Interactive role of human immunodeficiency virus type 1 (HIV-1) clade-specific Tat protein and cocaine in blood-brain barrier dysfunction: Implications for HIV-1associated neurocognitive Journal of NeuroVirology. 2010;16(4):295-306. doi:10.3 109/13550284.2010.499891
Chen W, Tang Z, Fortina P, et al. Ethanol potentiates HIV-1 gp120-induced apoptosis in human neurons via both the death receptor and NMDA receptor Virology. 2005;334(1):59-73. doi:10.1016/j.virol.2005.01.014
Gaskill PJ, Calderon TM, Luers AJ, Eugenin EA, Javitch JA, Berman JW. Human immunodeficiency virus (HIV) infection of human macrophages is increased by dopamine: A bridge between HIV- associated neurologic disorders and drug American Journal of Pathology. 2009;175(3):1148- 1159. doi:10.2353/ajpath.2009.081067
Purohit V, Rapaka R, Shurtleff D. Drugs of abuse, dopamine, and HIV-associated neurocognitive disorders/HIV-associated dementia. Molecular Neurobiology. 2011;44(1):102-110. doi:10.1007/ s12035-011-8195-z
Aronow HA, Weston AJ, Pezeshki BB, Lazarus TS. Effects of coinfection with HIV and hepatitis C virus on the nervous The AIDS reader. 2008;18(1):43-48. http://europepmc.org/abstract/ MED/18240452
Morgello S, Estanislao L, Ryan E, et al. Effects of hepatic function and hepatitis C virus on the nervous system assessment of advanced-stage HIV-infected individuals. AIDS. 2005;19(SUPPL. 3). doi:10.1097/01.aids.0000192079.49185.f9
Cherner M, Letendre S, Heaton RK, et Hepatitis C augments cognitive deficits associated with HIV infection and methamphetamine. Neurology. 2005;64(8):1343-1347. doi:10.1212/01. WNL.0000158328.26897.0D
McCutchan JA, Marquie-Beck JA, FitzSimons CA, et al. Role of obesity, metabolic variables, and diabetes in HIV-associated neurocognitive Neurology. 2012;78(7):485-492. doi:10.1212/ WNL.0b013e3182478d64
Valcour VG, Sacktor NC, Paul RH, et al. Insulin resistance is associated with cognition among HIV-1-infected patients: The Hawaii aging with HIV Journal of Acquired Immune Deficiency Syndromes. 2006;43(4):405-410. doi:10.1097/01.qai.0000243119.67529.f5
Wright EJ, Grund B, Robertson K, et al. Cardiovascular risk factors associated with lower baseline cognitive performance in HIV-positive persons. Neurology. 2010;75(10):864-873. doi:10.1212/ 0b013e3181f11bd8
Livelli A, Vaida F, Ellis RJ, et al. Correlates of HIV RNA concentrations in cerebrospinal fluid during antiretroviral therapy: a longitudinal cohort study. The Lancet HIV. 2019;6(7):e456-e462. doi:10.1016/S2352-3018(19)30143-2
Ellis RJ, Badiee J, Vaida F, et CD4 nadir is a predictor of HIV neurocognitive impairment in the era of combination antiretroviral therapy. AIDS. 2011;25(14):1747-1751. doi:10.1097/ QAD.0b013e32834a40cd
Airoldi M, Bandera A, Trabattoni D, et al. Neurocognitive Impairment in HIV-Infected Naïve Patients with Advanced Disease: The Role of Virus and Intrathecal Immune Activation. Clinical & developmental 2012;2012:467154. doi:10.1155/2012/467154
Antinori A, Arendt G, Becker JT, et Updated research nosology for HIV-associated neurocognitive disorders. Neurology. 2007;69(18):1789-1799. doi:10.1212/01.WNL.0000287431.88658.8b
Watkins CC, Treisman GJ. Cognitive impairment in patients with Aids – Prevalence and severity. HIV/AIDS - Research and Palliative 2015;7:35-47. doi:10.2147/HIV.S39665
Heaton RK, Clifford DB, Franklin DR, et al. HIV-associated neurocognitive disorders persist in the era of potent antiretroviral therapy: Charter Study. Neurology. 2010;75(23):2087-2096. doi:10.1212/ 0b013e318200d727
Heaton RK, Franklin DR, Deutsch R, et al. Neurocognitive Change in the Era of HIV Combination Antiretroviral Therapy: The Longitudinal CHARTER Clinical Infectious Diseases. 2015;60(3):473-480. doi:10.1093/cid/ciu862
Cysique LA, Brew Comorbid depression and apathy in HIV-associated neurocognitive disorders in the era of chronic HIV infection. In: Handbook of Clinical Neurology. Vol 165. Elsevier B.V.; 2019:71-82. doi:10.1016/B978-0-444-64012-3.00006-X
Janssen RS, Cornblath DR, Epstein LG, et al. Nomenclature and research case definitions for neurologic manifestations of human immunodeficiency virus-type 1 (HIV-1) infection. Neurology. 1991;41(6):778-785. doi:10.1212/wnl.41.6.778
Antinori A, Arendt G, Grant I, et al. Assessment, Diagnosis, and Treatment of HIV-Associated Neurocognitive Disorder: A Consensus Report of the Mind Exchange Program. Clinical Infectious 2013;56. doi:10.1093/cid/cis975
Gisslén M, Price RW, Nilsson The definition of HIV-associated neurocognitive disorders: Are we overestimating the real prevalence? BMC Infectious Diseases. 2011;11. doi:10.1186/1471-2334- 11-356
Meyer ACL, John Boscardin W, Kwasa JK, Price RW. Is it time to rethink how neuropsychological tests are used to diagnose mild forms of HIV-associated neurocognitive disorders? Impact of false-positive rates on prevalence and Neuroepidemiology. 2013;41(3-4):208-216. doi:10.1159/000354629
Underwood J, de Francesco D, Leech R, Sabin CA, Winston Medicalising normality? Using a simulated dataset to assess the performance of different diagnostic criteria of HIV-associated cognitive impairment. PLoS ONE. 2018;13(4). doi:10.1371/journal.pone.0194760
Huizenga HM, Smeding H, Grasman RPPP, Schmand B. Multivariate normative comparisons. 2007;45(11):2534-2542. doi:10.1016/j.neuropsychologia.2007.03.011
Blackstone K, Moore DJ, Franklin DR, et al. Defining neurocognitive impairment in HIV: Deficit scores versus clinical ratings. Clinical Neuropsychologist. 2012;26(6):894-908. doi:10.1080/1385 2012.694479
Grant I, Franklin DR, Deutsch R, et al. Asymptomatic HIV-associated neurocognitive impairment increases risk for symptomatic Neurology. 2014;82(23):2055-2062. doi:10.1212/ WNL.0000000000000492
Zipursky AR, Gogolishvili D, Rueda S, et al. Evaluation of brief screening tools for neurocognitive impairment in HIV/AIDS: A systematic review of the literature. AIDS. 2013;27(15):2385-2401. doi:10.1097/QAD.0b013e328363bf56
López E, Steiner AJ, Smith K, et Diagnostic utility of the HIV dementia scale and the international HIV dementia scale in screening for HIV-associated neurocognitive disorders among Spanish- speaking adults. Applied Neuropsychology:Adult. 2017;24(6):512-521. doi:10.1080/23279095.20 16.1214835
Prats A, López-Masramon E, Pérez-Álvarez N, et al. NEU Screen Shows High Accuracy in Detecting Cognitive Impairment in Older Persons Living With HIV. The Journal of the Association of Nurses in AIDS Care : 2019;30(1):35-41. doi:10.1097/JNC.0000000000000003
Cherner M, Masliah E, Ellis RJ, et Neurocognitive dysfunction predicts postmortem findings of
Moore DJ, Masliah E, Rippeth JD, et Cortical and subcortical neurodegeneration is associated with HIV neurocognitive impairment. AIDS. 2006;20(6):879-887. doi:10.1097/01. aids.0000218552.69834.00
Cysique LA, Casaletto KB, Heaton Reliably Measuring Cognitive Change in the Era of Chronic HIV Infection and Chronic HIV-Associated Neurocognitive Disorders. In: Current Topics in Behavioral Neurosciences. Curr Top Behav Neurosci; 2019. doi:10.1007/7854_2019_116
Folstein MF, Folstein SE, McHugh PR. “Mini-mental state”. A practical method for grading the cognitive state of patients for the clinician. Journal of Psychiatric Research. 1975;12(3):189-198. doi:10.1016/0022-3956(75)90026-6
Ganesan A, Crum-Cianflone N, Higgins J, et al. High Dose Atorvastatin Decreases Cellular Markers of Immune Activation Without Affecting HIV-1 RNA Levels: Results of a Double-blind Randomized Placebo Controlled Clinical Trial. The Journal of infectious diseases. 2011;203:756- doi:10.1093/infdis/jiq115
Blackstone K, Moore DJ, Heaton RK, et Diagnosing symptomatic HIV-associated neurocognitive disorders: Self-report versus performance-based assessment of everyday functioning. Journal of the International Neuropsychological Society. 2012;18(1):79-88. doi:10.1017/S135561771100141X
Sevigny JJ, Albert SM, McDermott MP, et al. Evaluation of HIV RNA and markers of immune activation as predictors of HIV-associated Neurology. 2004;63(11):2084-2090. doi:10.1212/01.WNL.0000145763.68284.15
Vernazza P, Daneel S, Schiffer V, et al. The role of compartment penetration in PI-Monotherapy: The Atazanavir-Ritonavir Monomaintenance (ATARITMO) Trial. AIDS. 2007;21(10):1309-1315. doi:10.1097/QAD.0b013e32814e6b1c
Best BM, Letendre SL, Koopmans P, et Low cerebrospinal fluid concentrations of the nucleotide HIV reverse transcriptase inhibitor, Tenofovir. Journal of Acquired Immune Deficiency Syndromes. 2012;59(4):376-381. doi:10.1097/QAI.0b013e318247ec54
Bumpus S, Qing MA, Best Antiretroviral Concentrations in Brain Tissue Are Similar to or Exceed Those in CSF. - CROI Conference. Conference on Retroviruses ans Oppotunistic Infections (CROI) . Published 2015. Accessed June 24, 2020. https://www.croiconference.org/abstract/ antiretroviral-concentrations-brain-tissue-are-similar-or-exceed-those-csf/
Letendre S, Marquie-Beck J, Capparelli E, et al. Validation of the CNS penetration-effectiveness rank for quantifying antiretroviral penetration into the central nervous system. Archives of 2008;65(1):65-70. doi:10.1001/archneurol.2007.31
Letendre S, Ellis R, Everall I, Ances B, Bharti A, Mccutchan Neurologic Complications of HIV
Santos G, Locatelli I, Metral M, et Cross-Sectional and Cumulative Longitudinal Central Nervous System Penetration Effectiveness Scores Are Not Associated With Neurocognitive Impairment in a Well Treated Aging Human Immunodeficiency Virus-Positive Population in Switzerland. Open forum infectious diseases. 2019;6:ofz277. doi:10.1093/ofid/ofz277
Letendre S, FitzSimons C, Ellis R, Clifford D, Collier A, Gelman Correlates of CSF Viral Loads in 1,221 volunteers of the CHARTER cohort. CROI Conference. 17th Conference on Retroviruses ans Oppotunistic Infections (CROI) . Published 2010. Accessed June 24, 2020. https://charternntc. org/content/correlates-csf-viral-loads-1221-volunteers-charter-cohort
Perez-Valero I, Ellis R, Heaton R, et al. Cerebrospinal fluid viral escape in aviremic HIV-infected patients receiving antiretroviral therapy: Prevalence, risk factors and neurocognitive AIDS. 2019;33(3):475-481. doi:10.1097/QAD.0000000000002074
Ellis RJ, Letendre S, Vaida F, et al. Randomized Trial of Central Nervous System–Targeted Antiretrovirals for HIV-Associated Neurocognitive Clinical Infectious Diseases. 2014;58(7):1015-1022. doi:10.1093/cid/cit921
Tozzi V, Balestra P, Salvatori MF, et al. Changes in cognition during antiretroviral therapy: Comparison of 2 different ranking systems to measure antiretroviral drug efficacy on HIV-associated neurocognitive disorders. Journal of Acquired Immune Deficiency Syndromes. 2009;52(1):56-63. doi:10.1097/QAI.0b013e3181af83d6
Smurzynski M, Wu K, Letendre S, et Effects of central nervous system antiretroviral penetration on cognitive functioning in the ALLRT cohort. AIDS. 2011;25(3):357-365. doi:10.1097/ QAD.0b013e32834171f8
Cysique LA, Vaida F, Letendre S, et Dynamics of cognitive change in impaired HIV-
Marra CM, Zhao Y, Clifford DB, et Impact of combination antiretroviral therapy on cerebrospinal fluid HIV RNA and neurocognitive performance. AIDS. 2009;23(11):1359-1366. doi:10.1097/ QAD.0b013e32832c4152
Robertson KR, Su Z, Margolis DM, et Neurocognitive effects of treatment interruption in stable HIV-positive patients in an observational cohort. Neurology. 2010;74(16):1260-1266. doi:10.1212/ WNL.0b013e3181d9ed09
Simioni S, Cavassini M, Annoni JM, et Rivastigmine for HIV-associated neurocognitive disorders: A randomized crossover pilot study. Neurology. 2013;80(6):553-560. doi:10.1212/ WNL.0b013e3182815497
Muñoz-Moreno JA, Prats A, Moltó J, et al. Transdermal rivastigmine for HIV-associated cognitive impairment: A randomized pilot PLoS ONE. 2017;12(8). doi:10.1371/journal.pone.0182547
Sacktor N, Miyahara S, Deng L, et al. Minocycline treatment for HIV-associated cognitive impairment: results from a randomized trial. Neurology. 2011;77(12):1135-1142. doi:10.1212/ 0b013e31822f0412
Zhao Y, Navia BA, Marra CM, et al. Memantine for AIDS dementia complex: Open-label report of actg HIV Clinical Trials. 2010;11(1):59-67. doi:10.1310/hct1101-59
Schifitto G, Navia BA, Yiannoutsos CT, et Memantine and HIV-associated cognitive impairment: A neuropsychological and proton magnetic resonance spectroscopy study. AIDS. 2007;21(14):1877- 1886. doi:10.1097/QAD.0b013e32813384e8
Schifitto G, Zhang J, Evans SR, et al. A multicenter trial of selegiline transdermal system for HIV-associated cognitive Neurology. 2007;69(13):1314-1321. doi:10.1212/01. wnl.0000268487.78753.0f
Evans SR, Yeh TM, Sacktor N, et al. Selegiline Transdermal System (STS) for HIV-associated cognitive impairment: Open-label report of ACTG 5090. HIV Clinical Trials. 2007;8(6):437-446. doi:10.1310/hct0806-437
Letendre SL, Woods SP, Ellis RJ, et Lithium improves HIV-associated neurocognitive impairment. AIDS. 2006;20(14):1885-1888. doi:10.1097/01.aids.0000244208.49123.1b
Schifitto G, Zhong J, Gill D, et al. Lithium therapy for human immunodeficiency virus type 1-associated neurocognitive Journal of NeuroVirology. 2009;15(2):176-186. doi:10.1080/13550280902758973
Schifitto G, Peterson DR, Zhong J, et al. Valproic acid adjunctive therapy for HIV-associated cognitive impairment: A first Neurology. 2006;66(6):919-921. doi:10.1212/01. wnl.0000204294.28189.03
Digicaylioglu M, Kaul M, Fletcher L, Dowen R, Lipton Erythropoietin protects
Kang YJ, Digicaylioglu M, Russo R, et al. Erythropoietin plus insulin-like growth factor-I protects against neuronal damage in a murine model of human immunodeficiency virus-associated neurocognitive Annals of Neurology. 2010;68(3):342-352. doi:10.1002/ana.22070
Schifitto G, Sacktor N, Marder K, et Randomized trial of the platelet-activating factor antagonist lexipafant in HIV-associated cognitive impairment. Neurology. 1999;53(2):391-396. doi:10.1212/ wnl.53.2.391
Clifford DB, McArthur JC, Schifitto G, et al. A randomized clinical trial of CPI-1189 for HIV- associated cognitive-motor Neurology. 2002;59(10):1568-1573. doi:10.1212/01. WNL.0000034177.47015.DA
Navia BA, Dafni U, Simpson D, et al. A phase I/II trial of nimodipine for HIV-related neurologic Neurology. 1998;51(1):221-228. doi:10.1212/WNL.51.1.221
Letendre SL, Marquie-Beck J, Ellis RJ, et al. The role of cohort studies in drug development: Clinical evidence of antiviral activity of serotonin reuptake inhibitors and HMG-CoA reductase inhibitors in the central nervous system. Journal of Neuroimmune Pharmacology. 2007;2(1):120- doi:10.1007/s11481-006-9054-y
Heseltine PNR, Goodkin K, Atkinson JH, et Randomized double-blind placebo-controlled trial of peptide T for HIV- associated cognitive impairment. Archives of Neurology. 1998;55(1):41-51. doi:10.1001/archneur.55.1.41
Kleim JA, Jones TA. Principles of Experience-Dependent Neural Plasticity: Implications for Rehabilitation After Brain Damage. Journal of speech, language, and hearing research : JSLHR. 2008;51(1). doi:10.1044/1092-4388(2008/018)
Plassman BL, Williams JW, Burke JR, Holsinger T, Benjamin S. Systematic review: Factors associated with risk for and possible prevention of cognitive decline in later life. In: Annals of Internal Medicine. Vol 153. American College of Physicians; 2010:182-193. doi:10.7326/0003- 4819-153-3-201008030-00258
Chow FC, Lyass A, Mahoney TF, et Baseline 10-Year Cardiovascular Risk Scores Predict Cognitive Function in Older Persons, and Particularly Women, Living With Human Immunodeficiency Virus Infection. Clinical Infectious Diseases. Published online January 3, 2020. doi:10.1093/cid/ciz1214
Tzourio C, Anderson C, Chapman N, et Effects of blood pressure lowering with perindopril and indapamide therapy on dementia and cognitive decline in patients with cerebrovascular disease. Archives of Internal Medicine. 2003;163(9):1069-1075. doi:10.1001/archinte.163.9.1069
McGuinness B, Todd S, Passmore P, Bullock Blood pressure lowering in patients without prior cerebrovascular disease for prevention of cognitive impairment and dementia. Cochrane Database of Systematic Reviews. 2009;2009(4). doi:10.1002/14651858.CD004034.pub3
Cox DJ, Kovatchev BP, Gonder-Frederick LA, et al. Relationships between hyperglycemia and cognitive performance among adults with type 1 and type 2 Diabetes Care. 2005;28(1):71- 77. doi:10.2337/diacare.28.1.71
McCutchan A, Marquie-Beck J, Letendre Contributions of metabolic syndrome to neurocognitive impairment. . Program and abstracts of the 16th Conference on Retroviruses and Opportunistic Infections. Published February 2009. Accessed June 26, 2020. https://www.thebodypro.com/ article/croi-2009-highlights-review-cardiovascular-disease-hiv
Kivipelto M, Helkala E-L, Laakso MP, et al. Apolipoprotein E ϵ4 Allele, Elevated Midlife Total Cholesterol Level, and High Midlife Systolic Blood Pressure Are Independent Risk Factors for Late-Life Alzheimer Disease. Annals of Internal Medicine. 2002;137(3):149. doi:10.7326/0003- 4819-137-3-200208060-00006
Letendre S. Central nervous system complications in HIV disease: HIV-associated neurocognitive Topics in antiviral medicine. 2011;19(4):137-142. https://Pubmed.ncbi.nlm.nih. gov/22156215
Yadav A, Betts MR, Collman Statin modulation of monocyte phenotype and function: implications for HIV-1-associated neurocognitive disorders. Journal of NeuroVirology. 2016;22(5):584-596. doi:10.1007/s13365-016-0433-8
Byrnes V, Miller A, Lowry D, et al. Effects of anti-viral therapy and HCV clearance on
Clifford DB, Vaida F, Kao YT, et Absence of neurocognitive effect of hepatitis C infection in HIV- coinfected people. Neurology. 2015;84(3):241-250. doi:10.1212/WNL.0000000000001156
Rubin LH, Maki HIV, Depression, and Cognitive Impairment in the Era of Effective Antiretroviral Therapy. Current HIV/AIDS Reports. 2019;16(1):82-95. doi:10.1007/s11904-019-00421-0
Vance DE, Eagerton G, Harnish B, McKie P, Fazeli PL. Cognitive prescriptions: A nursing approach to increasing cognitive reserve. Journal of Gerontological Nursing. 2011;37(4):22-31. doi:10.3928/00989134-20101202-03
Féart C, Samieri C, Barberger-Gateau P. Mediterranean diet and cognitive function in older Current Opinion in Clinical Nutrition and Metabolic Care. 2010;13(1):14-18. doi:10.1097/ MCO.0b013e3283331fe4
Scarmeas N, Stern Y, Mayeux R, Manly JJ, Schupf N, Luchsinger JA. Mediterranean diet and mild cognitive Archives of Neurology. 2009;66(2):216-225. doi:10.1001/archneurol.2008.536
Burckhardt M, Herke M, Wustmann T, Watzke S, Langer G, Fink Omega-3 fatty acids for the treatment of dementia. Cochrane Database of Systematic Reviews. 2016;2016(4). doi:10.1002/14651858.CD009002.pub3
Smith PJ, Blumenthal JA, Hoffman BM, et Aerobic exercise and neurocognitive performance: A meta-analytic review of randomized controlled trials. Psychosomatic Medicine. 2010;72(3):239- 252. doi:10.1097/PSY.0b013e3181d14633
Monroe AK, Zhang L, Jacobson L, et The association between physical activity and cognition in men with and without HIV infection. HIV Medicine. 2017;18. doi:10.1111/hiv.12490
Kåreholt I, Lennartsson C, Gatz M, Parker MG. Baseline leisure time activity and cognition more than two decades International Journal of Geriatric Psychiatry. 2011;26(1):65-74. doi:10.1002/ gps.2490
Stern C, Munn Z. Cognitive leisure activities and their role in preventing dementia: a systematic International journal of evidence-based healthcare. 2010;8(1):2-17. doi:10.1111/j.1744- 1609.2010.00150.x
Catz SL, Gore-Felton C, McClure JB. Psychological distress among minority and low-income women living with Behavioral Medicine. 2002;28(2):53-60. doi:10.1080/08964280209596398
Duncan LG, Moskowitz JT, Neilands TB, Dilworth SE, Hecht FM, Johnson MO. Mindfulness-based stress reduction for HIV treatment side effects: A randomized, wait-list controlled Journal of
Anstey KJ, von Sanden C, Salim A, O’Kearney R. Smoking as a Risk Factor for Dementia and Cognitive Decline: A Meta-Analysis of Prospective Studies. American Journal of Epidemiology. 2007;166(4):367-378. doi:10.1093/aje/kwm116
Harrison JD, Dochney JA, Blazekovic S, et al. The nature and consequences of cognitive deficits among tobacco smokers with HIV: a comparison to tobacco smokers without HIV. Journal of 2017;23(4):550-557. doi:10.1007/s13365-017-0526-z
Kim JW, Lee DY, Lee BC, et al. Alcohol and cognition in the elderly: A review. Psychiatry 2012;9(1):8-16. doi:10.4306/pi.2012.9.1.8
Martin-Thormeyer EM, Paul Drug abuse and hepatitis C infection as comorbid features of HIV associated neurocognitive disorder: Neurocognitive and neuroimaging features. Neuropsychology Review. 2009;19(2):215-231. doi:10.1007/s11065-009-9101-6
Nath A. Human immunodeficiency virus-associated neurocognitive disorder: Pathophysiology in relation to drug addiction. Annals of the New York Academy of Sciences. 2010;1187:122-128. doi:10.1111/j.1749-6632.2009.05277.x
Byrd DA, Fellows RP, Morgello S, et Neurocognitive impact of substance use in HIV infection. Journal of Acquired Immune Deficiency Syndromes. 2011;58(2):154-162. doi:10.1097/ QAI.0b013e318229ba41
Gaskill PJ, Calderon TM, Coley JS, Berman JW. Drug induced increases in CNS dopamine alter monocyte, macrophage and T cell functions: Implications for HAND. Journal of Neuroimmune 2013;8(3):621-642. doi:10.1007/s11481-013-9443-y
Neuropsychological Routledge; 2017. doi:10.4324/9781315629537
Cicerone KD, Langenbahn DM, Braden C, et al. Evidence-based cognitive rehabilitation: Updated review of the literature from 2003 through Archives of Physical Medicine and Rehabilitation. 2011;92(4):519-530. doi:10.1016/j.apmr.2010.11.015
Dickinson D, Tenhula W, Morris S, et al. A randomized, controlled trial of computer-assisted cognitive remediation for schizophrenia. American Journal of Psychiatry. 2010;167(2):170-180. doi:10.1176/appi.ajp.2009.09020264
Yu F, Rose KM, Burgenr SC, et Cognitive training for early-stage Alzheimer’s disease and dementia. Journal of Gerontological Nursing. 2009;35(3):23-29. doi:10.3928/00989134- 20090301-10
Martin M, Clare L, Altgassen AM, Cameron MH, Zehnder F. Cognition-based interventions for healthy older people and people with mild cognitive Cochrane Database of Systematic Reviews. 2011;(1). doi:10.1002/14651858.cd006220.pub2
Becker JT, Dew MA, Aizenstein HJ, et al. A pilot study of the effects of internet-based cognitive stimulation on neuropsychological function in HIV Disability and Rehabilitation. 2012;34(21):1848-1852. doi:10.3109/09638288.2012.667188
Muñoz-Moreno JA, Fumaz CR, Ferrer MJ, et Benefits of a Cognitive Rehabilitation Program on Neurocognitive Impairment in HIV-Infected Patients. Preliminary Findings. Journal of the International Neuropsychological Society. 2007;13(1 Suplement 1:19).
Guideline for Alzheimer`s Disease . California workgroup on Guidelines for Alzheimer`s Disease Management. Published 2008. Accessed June 26, 2020. http://caalz.org/ guidelines.htm.
Cognitive disorders and HIV/AIDS: HIV-associated dementia and delirium. . New York (NY): New York State Department of Published September 12, 2007. Accessed June 25, 2020. http:// guideline.gov/content.aspx?id=12561.
Kritsilis M, Rizou S v., Koutsoudaki PN, Evangelou K, Gorgoulis VG, Papadopoulos D. Ageing, cellular senescence and neurodegenerative disease. International Journal of Molecular Sciences. 2018;19(10). doi:10.3390/ijms19102937
5. 5. TRASTORNOS NEUROCOGNITIVOS ASOCIADOS AL VIH
5.1. ETIOPATOGENIA
5.2. EPIDEMIOLOGÍA
5.3. FACTORES DE RIESGO
5.4. MANIFESTACIONES CLÍNICAS
5.5. DIAGNÓSTICO
La principal complicación producida por el VIH a nivel del SNC son los trastornos neurocognitivos asociados al VIH (TNAV). El desarrollo de un TNAV condiciona una pérdida progresiva de funcionalidad que se puede asociar con una peor calidad y esperanza de vida. Por este motivo, la identificación, la prevención y el tratamiento precoz de los TNAV debería formar parte del manejo integral que requieren las personas con VIH.
ETIOPATOGENIA
Los TNAV son la consecuencia de una serie de procesos patogénicos inducidos, de forma directa o indirecta, por el VIH que alteran la homeostasis cerebral. El VIH es un virus neurotropo y como tal es capaz de atravesar la barrera hematoencefálica (BHE) y de infectar diferentes tipos celulares en el SNC, desde el momento mismo de la infección(. Por lo general, el VIH en el SNC suele estar confinado en los espacios perivasculares del cerebro, donde infecta principalmente linfocitos y en menor medida macrófagos perivasculares. Durante los ciclos de replicación del virus, el VIH puede sufrir mutaciones en su envuelta que van a aumentar su afinidad por las células microgliales y, cuando esto ocurre, el VIH aumenta su capacidad para infiltrar el parénquima cerebral y para producir cuadros de encefalitis (.
Tanto en las formas leves, como en la encefalitis, el daño neuronal no va a ser directo, al carecer el VIH de capacidad para infectar neuronas adultas(, sino la consecuencia de un aumento de la inflamación cerebral (aumento del estrés oxidativo y de los radicales libres), de la producción de sustancias neurotóxicas (por el virus y el sistema inmune) y del depósito de esfingolípidos y beta-amiloide. En las fases iniciales de la infección, estos fenómenos van a alterar de forma leve la función neuronal y a producir síntomas cognitivos leves(. En las fases avanzadas de la infección, la inflamación y la neurotoxicidad son tan intensas que la neurona no puede responder a la agresión e inicia su apoptosis, lo que favorece que los síntomas cognitivos sean más graves(.
En los pacientes con TNAV, el inicio del TAR produce una disminución de la inflamación y de la neurotoxicidad que contribuye a normalizar el funcionamiento neuronal y glial, lo que se traduce en una mejoría de los síntomas cognitivos del paciente. La persistencia de déficits cognitivos a pesar del TAR ha sido motivo de estudio los últimos 20 años(. Al respecto se han propuesto dos hipótesis, no excluyentes: La primera plantea al cerebro como un santuario donde algunos TAR no penetrarían lo suficiente como para controlar la replicación viral de forma efectiva(. La segunda hipótesis sugiere que los TNAV son consecuencia de la persistencia de fenómenos inflamatorios y neurotoxicidad no inducidos por la replicación del VIH sino por disfunción astrocitaria( y activación microglia persistente inducida por la translocación bacteriana255 o la reconstitución inmune(.
Ya sea por replicación viral persistente, por fenómenos inflamatorios o por otras causas indirectas como alteraciones a nivel de la vascular cerebral o el uso de fármacos neurotóxicos(, la alteración de la homeostasis cerebral va a producir disfunción neuronal (retracción axonal y dendrítica, alteración del potencial de membrana y desregulación en la liberación o recaptación de neurotransmisores) cuyo correlato clínico serán los TNAV.
EPIDEMIOLOGÍA
La prevalencia y la incidencia de los TNAV ha cambiado de forma sustancial desde el comienzo de la epidemia del SIDA hasta el momento actual. Debido a este cambio continuo, consecuencia de la mejoría progresiva del TAR y del cambio en el perfil sociodemográfico de los nuevos contagios, muchos de los estudios realizados para estimar la prevalencia e incidencia de los TNAV se han quedado desfasados y es posible que sus resultados sobrestimen la prevalencia e incidencia actual de los TNAV.
Prevalencia
La prevalencia de los TNAV ha sido estimada en diversos estudios. Los más relevantes se han incluido en la Tabla 5. De ellos, el estudio de mayor calidad metodológica es el realizado por la cohorte CNS HIV Anti-Retroviral Therapy Effect Research (CHARTER)
- . En este estudio se observó que la prevalencia de los TNAV dependía de la proporción de comorbilidades detectadas en la población, así como de sus características clínico- demográficas. En personas sin comorbilidades, con un buen control inmunovirológico de su infección VIH, la prevalencia de TNAV en este estudio fue del 30% el 83% observado en personas con comorbilidades severas y un control deficiente del VIH.
En España, los estudios publicados adolecen de limitaciones metodológicas. Dos estudios, realizados en Madrid (n=191) y Alicante (n=84), siguiendo las Recomendaciones para el diagnóstico establecidas en el consenso de Frascati261, han estimado que la proporción de TNAV en pacientes en TAR, con buen control virológico y sin comorbilidades significativas rondaría el 20-40%(.) Un tercer estudio realizado en Cataluña (n=331), utilizando una metodología similar, estimó proporciones entorno al 40% en naïve y del 50% en pacientes pretratados(. Utilizando técnicas de cribado, un estudio realizado a nivel nacional (n=825) estimó que el 42,5% de las mujeres y el 33,7% de los hombres presentaban, en el Brief Neurocognitive Screen, resultados compatibles con un posible TNAV 265. Otro estudio catalán (n=106), detectó con el NEU niveles ligeramente superiores (48%)(.
Incidencia
Establecer una tasa de incidencia para los TNAV es complicado al tratarse de un proceso dinámico en el que, el grado de deterioro cognitivo necesario para establecer el diagnóstico pueden fluctuar a lo largo del tiempo. Por esta razón, en general se prefiere hablar de tendencias que de tasas de incidencia. En la cohorte CHARTER (n=436), se estimó que, a lo largo del tiempo (mediana 35 meses), el 22,7% de las personas con VIH iban a desarrollar un declinar de su función cognitiva (vs. el 16,5% que iban a mejorar su funcionamiento cognitivo).
A pesar de estas limitaciones, disponemos estudios en los que se ha evaluado la incidencia de los TNAV. El más representativo es el estudio ALLRT (n=1166) en el que se estimó, utilizando una prueba de cribado (BNCS), que la incidencia de TNAV era del 21%(. En España, en personas con VIH bien controladas y sin comorbilidades significativas (n=134), la incidencia de TNAV fue del 8,2% (.
FACTORES DE RIESGO
La detección de aquellos factores asociados con los TNAV es un elemento clave para establecer las medidas de prevención y el tratamiento de esta entidad. Por este motivo, el número de estudios publicados y de factores identificados (>20) es muy extenso. De cara a unas guías de práctica clínica, consideramos relevante centrarnos en aquellos que tienen un mayor impacto clínico.
Si para ello nos basamos en los datos de la cohorte CHARTER, el declinar cognitivo se asoció fundamentalmente con dos factores, la coexistencia de comorbilidades y el control de la infección con el TAR(.
5.1.1. COMORBILIDADES
La detección y el tratamiento de las comorbilidades es un elemento relevante a la hora de prevenir y tratar los TNAV. A continuación, comentaremos las más relevantes:
Enfermedad mental
Como se ha avanzado en el punto 4 de estas guías, la enfermedad mental, en general, y la sintomatología depresiva, en particular, se han relacionado con un peor rendimiento cognitivo y un mayor riesgo de desarrollar TNAV.
Consumo de drogas
El consumo de alcohol, cocaína y metanfetamina son factores de riesgo para los TNAV. A este respecto, se han identificado efectos neurotóxicos sinérgicos entre la proteína Tat, la cocaína y la metanfetamina, y entre el alcohol y la gp120(. También se ha sugerido un mecanismo común por el que las drogas, al aumentar los niveles de dopamina, pueden favorecer los TNAV al estimular la replicación del VIH en los macrófagos del SNC(.
Coinfección por el VHC
En el pasado la coinfección VIH/VHC, con independencia del grado de afectación hepática(, se ha relacionado un mayor riesgo de presentar TNAV(. Actualmente esta asociación no está tan clara.
Alteraciones metabólicas y enfermedad vascular
La obesidad central se ha postulado como uno de los factores metabólicos más relevante asociado a los TNAV(. Otros factores que se han asociado con un mayor riesgo de TNAV son los factores de riesgo clásico(, así como la enfermedad ateroesclerótica(.
5.1.2. TRATAMIENTO ANTIRRETROVIRAL
En la cohorte CHARTER los participantes que no recibían TAR presentaron el doble de riesgo de declinar cognitivo, con independencia del grado de supresión viral proporcionado por el TAR(. Este papel protector del TAR puede deberse tanto al efecto directo del control de la replicación viral en el SNC como a la prevención de los fenómenos asociados con la inmunodepresión.
Control de la replicación viral
Diversos estudios han observado una relación directa entre los niveles de replicación del VIH y la proporción de TNAV(. Por el contrario, en el estudio prospectivo realizado por la cohorte CHARTER, el grado de control viral de los pacientes que recibían TAR no se relacionó con el riesgo de presentar declinar cognitivo. Esto podría deberse a dos factores: 1) que el efecto deletéreo de un control viral menos intenso a nivel del SNC sea bajo y por tanto imperceptible durante un periodo de seguimiento relativamente corto como el de la cohorte CHARTER. O 2) que este potencial efecto se vea compensado, como se explica de forma detallada en el punto 7º de esta guía, por una reducción en la potencial neurotoxicidad asociada al TAR.
Inmunosupresión
Diversos estudios han observado una relación inversa entre el nadir de CD4 y el riesgo de presentar un TNAV(. Dentro de los fenómenos asociados con la inmunodepresión que podrían contribuir a los TNAV, se ha postulado la activación inmune secundaria a fenómenos de translocación bacteriana(.
MANIFESTACIONES CLÍNICAS
Las manifestaciones clínicas producidas por la infección VIH a nivel del SNC pueden englobarse en tres categorías: alteraciones cognitivas (concentración, atención, memoria…), alteraciones del comportamiento (apatía, pérdida del impulso sexual, desregulación emocional…) y alteraciones motoras. Desde que disponemos del TAR, las mas relevantes y las que en la actualidad guían el diagnóstico de los TNAV son las alteraciones cognitivas(. La queja cognitiva de los TNAV se puede confundir con frecuencia con la de otros trastornos psiquiátricos como la depresión. Un aspecto diferenciador entre ambas entidades es que en los TNAV no suele observarse disforia ni episodios de llanto o tristeza(.
En la actualidad, la mayoría de las personas con VIH que son diagnosticadas de un TNAV suelen encontrarse asintomáticos o presentar síntomas cognitivos leves(. La afectación cognitiva más común en estos casos suele observarse a nivel de la memoria de trabajo, la atención y las funciones ejecutivas. La mayoría de estos casos suele tener una situación clínica estable durante muchos años y no es infrecuente que en algunos puedan observarse mejorías a nivel cognitivo(. Es infrecuente encontrar alteraciones a nivel motor, si bien, en algunos casos, se pueden identificar alteraciones en la marcha y en la coordinación motriz fina. Por el contrario, no es infrecuente detectar trastornos afectivos (apatía, pérdida del impulso sexual y disminución de la respuesta emocional)(. Desde el punto de vista funcional, los pacientes con TNAV leves no suelen reportan déficits o los atribuyen al estrés o la fatiga. Cuando se detectan alteraciones funcionales, estas suelen ser: dificultad para leer, para realizar tareas complejas o para mantener la concentración en actividades o conversaciones(.
Los pacientes con TNAV severos suelen detectarse en personas con infecciones por VIH avanzadas (CD4 <200 células/mm)(. El inicio de los síntomas suele ser subagudo (déficit de atención y concentración, síntomas depresivos y afectación de la psicomotricidad fina), y su curso fluctuante. Una vez instaurado el cuadro, se suele observar un perfil de afectación subcortical caracterizado por déficits severos a nivel de la memoria, la atención, la concentración, el procesamiento de la información y/o las funciones ejecutivas. Las funciones corticales suelen estar preservadas, siendo excepcional observar fenómenos de afasia, agnosia y apraxia. A nivel motor, las alteraciones durante la exploración neurológica son la norma (movimientos oculares sacádicos, disdiadococinesia, hiperreflexia y aparición de signos de liberación frontal tales como el reflejo de prensión, de succión, hociqueo o los reflejos glabelares), pudiendo en fases terminales observarse un retraso psicomotor severo o cuadros de mutismo. A nivel del comportamiento, suelen evidenciarse alteraciones conductuales y del estado anímico, apatía, abulia, insomnio, irritabilidad y/o ansiedad. En algunos casos, estos cuadros pueden progresar a psicosis y/o trastornos bipolares. De forma característica estos déficits conllevan una afectación severa del funcionamiento diario del individuo. No siendo infrecuente que, los afectados no sean capaces de percibir estos déficits funcionales y sean las personas del entorno del paciente las que los pongan en evidencia(.
DIAGNÓSTICO
Los criterios para el diagnóstico de los TNAV fueron establecidos por primera vez por la Asociación Americana de Neurología en 1991( y modificados en el documento de consenso de expertos de Frascati de 2007. A pesar de contar con más de 10 años de antigüedad, estos criterios siguen estando vigentes. Desde 2007, han surgido iniciativas como la del Mind Exchange Working Group en 2013(, con el objetivo completar y actualizar aspectos no contemplados o desactualizados del documento de consenso de Frascati.
El diagnóstico de los TNAV se establece en base a la presencia de un cuadro de deterioro cognitivo adquirido en al menos dos áreas cognitivas y a la ausencia otras etiologías a las que pueda atribuirse el deterioro(. Para poder establecer el diagnóstico serán por tanto necesario que el paciente sea evaluado neuropsicológica y médicamente por profesionales expertos.
La clasificación de Frascati gradúa los TNAV en base a los criterios recogidos en la Tabla 6 en TNAV asintomáticos, TNAV leves y demencia VIH. Igualmente establece tres categorías para clasificar las comorbilidades identificadas durante la evaluación médica: Incidentales, contribuyentes y confusoras. Las comorbilidades confusoras serán aquellas cuya presencia pueda justificar per se el cuadro de deterioro cognitivo y cuya presencia no nos permitirá establecer un diagnóstico de TNAV. Por el contrario, las incidentales y contribuyentes serán aquellas cuya presencia no es suficiente para justificar el deterioro y por lo tanto permitirán establecer un diagnóstico de TNAV.
CRITERIOS DE SELECCIÓN Y CRIBADO
Definir qué pacientes VIH deben ser evaluados a nivel neurocognitivo y cuáles no es un aspecto controvertido sobre el que no existe consenso. Mientras las guías EACS proponen limitar el diagnóstico a pacientes sintomáticos que no presenten comorbilidades confusoras ni cuadros de depresión no tratados, las Recomendaciones del Mind Exchange Working Group establecían el uso de instrumentos de cribado en todos los pacientes VIH como mínimo al inicio del tratamiento, al cambiar de tratamiento o en presencia de cualquier síntoma neuro- psiquiátrico y el documento de consenso de GeSIDA de 2012, abogaba por aplicar una prueba de cribado cada 6 meses a todos los pacientes con quejas cognitivas y/o factores de riesgo (edad >50 años, CD4 actual <200 cels/mm3, nadir de CD4 <350 cels/mm3, SIDA actual o pasado, nivel de escolarización bajo, interrupción del TAR o coinfección por el VIH). Esta disparidad de criterios es consecuencia principalmente de una falta de consenso sobre la entidad de los TNAV asintomáticos y sobre la utilidad y validez de los instrumentos de cribado.
Relevancia de los trastornos asintomáticos
Mientras que para algunos expertos los TNAV asintomáticos tienen la misma trascendencia y pronóstico que los TNAV leves, para otros solo son el resultado de un exceso de sensibilidad de los criterios diagnósticos289–291 y proponen el uso de métodos de evaluación alternativos como el método llamado Comparaciones Multivariadas Normativas (MNC, por sus siglas en inglés, Multivariate Normative Comparisons), que ha sido desarrollado para intentar controlar el número de falsos positivos sin disminuir la sensibilidad. En el momento actual, la evidencia existente no permite recomendar estos abordajes alternativos a los criterios establecidos por el consenso de Frascati en 2007.
Respecto a si existen diferencias clínicas y pronosticas entre los TNAV asintomáticos y los leves, para Blackstone y cols. la diferencia entre ambas entidades solo radica en el grado de requerimiento cognitivo del individuo y en lo exhaustiva que sea la evaluación funcional . Teniendo en cuenta esto y que ambas entidades mostraron el mismo riesgo de declinar cognitivo en la cohorte CHARTER, no hay datos que sustenten una diferenciación clara entre ambas entidades.
Instrumentos de cribado
Debido a la complejidad que conlleva el proceso de diagnóstico de los TNAV se han ensayado distintas estrategias para su cribado, de las cuales las más relevantes se incluyen en la Tabla 7.
La mayor parte de estos instrumentos se basan en la selección y aplicación de una batería breve de pruebas neurocognitivas con alta sensibilidad para la detección de aquellas alteraciones neurocognitivas que son más prevalentes entre los pacientes con un TNAV. Analizando la evidencia disponible, un metaanálisis publicado por Zipursky y col. en AIDS en 2013, identificaba la publicación de estudios de validación para 39 instrumentos de cribado de los TNAV. Los autores de este metaanálisis concluyeron indicando que ninguna de las estrategias evaluadas dispone de la suficiente sensibilidad y capacidad diagnóstica como para recomendar su uso de forma generalizada. Este metaanálisis también identificó deficiencias metodológicas en la mayoría de los estudios analizados.
En lengua castellana, desde 2013 se han publicado nuevos estudios de validación para alguna de las herramientas ya incluidas en el metaanálisis de Zipursky y col, como la HIV Dementia Scale (HDS) y la International HIV Dementia Scale (IHDS), así como para otras nuevas como el Neurocognitive (NEU) Screen297. Como era de esperar, los resultados de sensibilidad (S) y especificidad (E) para el HDS (S: 68,2%, E: 62,7%) y el IHDS (S: 41,3%, E: 75%) fueron modestos y similares a los ya reportados. Los resultados obtenidos por el NEU Screen fueron mejores y adecuados a los deseables para una prueba de cribado en todos los estratos de edad a partir de los 30 años, siendo esta prueba especialmente sensible en >60 años (S: 91%, E: 92,3%). La principal limitación para recomendar el uso del NEU Screen como herramienta de cribado para los TNAV es la ausencia de estudios que confirmen su validez externa.
Recomendaciones:
- No se recomienda el uso rutinario de instrumentos de cribado para los TNAV con el objetivo de establecer una indicación de evaluación neuropsicológica, en ningún perfil de pacientes (A-I).
- En centros con un acceso limitado al diagnóstico neuropsicológico de los TNAV, los instrumentos de cribado pueden ser de utilidad, en pacientes con quejas cognitivas, para establecer criterios de derivación a otros centros con capacidad diagnóstica (C-III).
- De los instrumentos de cribado disponibles, serían de elección aquellos con sensibilidades y especificidades >70%, validados en población VIH española (como el NEU Screen) (A-III).
- Los instrumentos de cribado son de utilidad en estudios epidemiológicos cuyo objetivo sea realizar estimaciones groseras de la posible prevalencia de los TNAV (C-III).
5.1.1. DIAGNÓSTICO NEUROPSICOLÓGICO
El diagnóstico neuropsicológico de los TNAV comprende la evaluación tanto del funcionamiento cognitivo como del grado de afectación funcional que puedan presentar los pacientes diagnosticados de deterioro cognitivo, a nivel profesional, en el hogar y/o a nivel social.
Evaluación del funcionamiento neurocognitivo
De los métodos para evaluar el funcionamiento cognitivo el que cuenta con un mayor grado de evidencia es el establecido en el documento de consenso de Frascati. El diagnóstico de deterioro neurocognitivo en base a estos criterios ha sido relacionado en diversos estudios tanto con variables clínicas relacionadas con el VIH, como con marcadores de alteración cerebral asociadas al VIH. A continuación, resumimos
los aspectos clave a la hora de aplicar estas Recomendaciones.
La evaluación neurocognitiva deberá realizarla un profesional que cuente con la suficiente formación y para su correcta interpretación deberán tenerse en cuenta no solo los resultados de la evaluación sino también del despistaje de comorbilidades médicas. Antes de someter a un paciente a una evaluación cognitiva se debe garantizar que su estado mental no se encuentra alterado por ningún factor externo como por ejemplo un trastorno psiquiátrico activo grave o un cuadro de intoxicación aguda. Cuando se identifiquen alguno de estos factores las guías recomiendan que se posponga la evaluación hasta que estos factores hayan sido tratados.
Siempre que sea posible, la evaluación del funcionamiento cognitivo se realizará mediante el uso de baterías neuropsicológicas amplias, que evalúen el funcionamiento en al menos las siguientes áreas cognitivas: Verbal/lenguaje, atención/memoria
de trabajo, abstracción/funciones ejecutivas, memoria (aprendizaje y recuerdo), velocidad de procesamiento de la información, percepción sensorial y habilidades motoras.
El funcionamiento a nivel de cada área se evaluará con al menos dos pruebas diferentes, preferiblemente validadas en población española, y normalizadas por edad, género y/o nivel educativo. No existe consenso sobre cuales deberían de ser esas pruebas. En la Tabla 8 se incluyen algunas de las pruebas que cuentan con mayor consenso de uso en el diagnóstico de los TNAV en población española.
Cuando el resultado obtenido en una prueba o en el estudio de un área neurocognitiva es inferior a una desviación estándar por debajo de la media normativa establecida se entiende que un paciente presenta deterioro neurocognitivo en esa prueba o área. Para establecer que un paciente presenta deterioro neurocognitivo es necesario evidenciar deterioro en al menos dos áreas o dominios cognitivos. En el caso de que se desee realizar una estimación del grado de deterioro será necesario utilizar métodos de evaluación cuantitativos como el global déficit score o los clinical ratings293.
Siempre que se pueda habrá que intentar realizar una evaluación prospectiva del deterioro cognitivo. De esta forma se podrán diferenciar aquellos pacientes que, con independencia de su nivel de funcionamiento, presenten un deterioro progresivo de aquellos en los que el deterioro se encuentre estabilizado. Desafortunadamente la evidencia disponible no establece cada cuanto tiempo debemos reevaluar el funcionamiento cognitivo, aunque se recomienda espaciar las evaluaciones al menos 6 meses para minimizar el aprendizaje relacionado con la repetición (efecto de la práctica). Para evitar este efecto, existen normas de corrección ajustadas por el mismo, pero lamentablemente no han sido validadas en población española.
En entornos donde la evaluación del funcionamiento cognitivo no se pueda realizar con una batería neuropsicológica amplia, aplicada por un psicólogo con experiencia, cualquier clínico podrá establecer un diagnóstico de presunción utilizando una herramienta estandarizada validada para examinar el estado mental del paciente: Mini-Mental y instrumentos de cribado. Los puntos de corte para establecer un diagnóstico de deterioro cognitivo con los principales instrumentos de cribado se pueden consultar en la Tabla 7. El punto de corte recomendado para el mini-mental es de 25-26 puntos para el deterioro cognitivo leve y <25 puntos para el deterioro moderado-severo. Estos puntos de corte deben utilizarse con precaución al no haber sido todavía validados para el diagnóstico de TNAV en población VIH española.
Evaluación de la funcionalidad
De forma complementaria a la evaluación neurocognitiva, para poder categorizar los TNAV será necesario realizar una evaluación de la funcionalidad del paciente, ya sea mediante el uso de cuestionarios de síntomas funcionales, como el Patient’s Assessment of Own Functioning Inventory (PAOFI) o el instrumental activities of daily living (IADL), o, añadiendo a estos, alguna prueba objetiva como la de manejo de la medicación (MMT). El uso de pruebas objetivas aumenta la sensibilidad para detectar las alteraciones funcionales a costa de aumentar el tiempo de evaluación en al menos 10 minutos303.
Recomendaciones:
- La identificación de la queja cognitiva debería realizarse de forma proactiva al
diagnóstico y al menos una vez cada 1-2 años (A-III).
- Siempre que se sospeche la existencia de un TNAV se recomienda la realización de una evaluación neuropsicológica reglada, basada en los criterios establecidos en el Consenso de Frascati de 2007 (A-III).
- Para el diagnóstico de los TNAC se recomienda la utilización de pruebas neuropsicológicas validadas en población española (C-III).
- Se recomienda hacer un control evolutivo de los TNAV en un plazo de tiempo de entre 6 meses y 1-2 años (A-III).
- Cuando no se tenga acceso a una evaluación neurológica reglada, se podrá establecer el diagnóstico posible TNAV si se identifica un resultado alterado en el Mini-Mental o en algún instrumento de cribado (C-III).
- Las pruebas más utilizadas para la evaluación funcional de los TNAV son el PAOFI y el IADL. Se recomienda asociar a estas pruebas subjetivas otra objetiva como la prueba de manejo de la medicación (B-II).
5.1.1. DESPISTAJE DE COMORBILIDADES
El diagnóstico de los TNAV, al tratarse de un diagnóstico de exclusión, requiere para su confirmación que se excluya la existencia de comorbilidades que puedan per se justificar el grado de deterioro neurocognitivo evidenciado en la evaluación neuropsicológica del paciente. El documento de consenso de Frascati enumeraba cuales son las principales comorbilidades que hay que evaluar y establece los parámetros para, en presencia de alguna de ellas, poder establecer o no el diagnóstico de TNAV. En la Tabla 9 se incluyen las situaciones en las que no se podría establecer un diagnóstico de TNAV en base a la presencia de comorbilidades confusoras.
Tabla 9: Comorbilidades confusoras que no permitirían establecer en un paciente con deterioro cognitivo un diagnóstico de TNAV
- Evidencia de una ejecución subóptima, intoxicación o abstinencia durante la realización de la evaluación neuropsicológica.
- Trastorno depresivo mayor con síntomas psicóticos.
- Traumatismo craneoencefálico (leve o severo) con secuelas funcionales que imposibiliten al paciente volver a trabajar o estudiar con
- Retraso mental o retraso educativo
- Trastorno por uso de sustancias con un impacto significativo en el funcionamiento
diario del paciente.
- Enfermedad oportunista del sistema nervioso central aguda: Meningitis, encefalitis, tumores,
- Enfermedades neurológicas activas: Esclerosis múltiple progresiva, epilepsia, accidente cerebrovascular agudo (ACVA), demencia de otras etiologías.
- Enfermedades sistémicas agudas definitorias de SIDA o no definitorias que cursen con un síndrome constitucional o con malnutrición (déficit de tiamina o vitamina B12).
- Hepatopatía por virus C severa (Child-Pugh B o C).
La evaluación de comorbilidades debe ser un proceso clínico que se base en la anamnesis y en los signos detectados durante una exploración neurológica exhaustiva del paciente. Aspectos claves que debe incluir la anamnesis son: la caracterización del perfil del deterioro cognitivo: cortical, subcortical o mixto; La evaluación de antecedentes personales relevantes: rendimiento académico, factores de riesgo cardiovascular, consumo de tóxicos y salud mental, traumatismos craneoencefálicos y enfermedades médicas relevantes (enfermedades definitorias de SIDA, infecciones del sistema nervioso central, neuropatías, coinfección por la hepatitis C, infecciones como el CMV o la sífilis…).
Respecto a la indicación de pruebas complementarias, hay algunas que se recomienda solicitar de rutina y otras de forma dirigida en función de los hallazgos de la anamnesis y la exploración física. En todo paciente con un TNAV se debería disponer de una analítica básica con serologías (hepatitis C, hepatitis B, CMV y sífilis), TSH, testosterona y niveles de vitamina B y folato, un electrocardiograma, una placa de tórax y una ecografía abdominal.
A todos los pacientes se les debería realizar una resonancia magnética cerebral, con el objetivo de evaluar la presencia de atrofia y su perfil y descartar la existencia de lesiones ocupantes de espacio y alteraciones de señal, y una extracción de sangre y líquido cefalorraquídeo (LCR) para descartar que no existe escape viral del VIH en el LCR. A demás de la carga viral en el LCR, recomendamos evaluar en el LCR la
existencia de un patrón compatible con meningitis, serologías de sífilis (si procede), PCR de virus herpes, JC y BK y marcadores de la EA: proteína TAU, fosfo-TAU y beta-amiloide.
De forma no rutinaria en algunas ocasiones podría estar también indicado solicitar otras pruebas como un MAPA para despistaje de hipertensión, una evaluación de la agudeza visual y/o auditiva, un electroneurograma para valorar neuropatía o un EEG para valorar cuadros comiciales.
Recomendaciones:
- Todo paciente VIH diagnosticado de deterior cognitivo debe someterse a una evaluación médica para detectar comorbilidades que puedan alterar el funcionamiento neurocognitivo (A-III).
- Siempre que técnicamente sea factible, se deberá ofrecer al paciente con VIH y deterioro cognitivo completar estudio con al menos una resonancia magnética cerebral y una punción lumbar (B-III).
5.1. TRATAMIENTO
El tratamiento de los TNAV debe buscar, como primer objetivo, revertir el deterioro neurocognitivo y, cuando esto no sea posible, prevenir el declinar neurocognitivo. Para ello, habrá que intentar controlar tanto los efectos directos e indirectos que el VIH produce en el SNC como los producidos por otras comorbilidades neurocognitivas.
El tratamiento actual de los TNAV es principalmente farmacológico. La única medida que ha demostrado ser altamente eficaz en la prevención y tratamiento de los TNAV más severos es el TAR. La persistencia de TNAV leves a pesar del TAR ha favorecido la proliferación de estudios que han evaluado sin gran éxito el beneficio de añadir al TAR un fármaco neuroprotector frente a la acción del VIH. En los últimos años, se están comenzando a evaluar estrategias no farmacológicas como el manejo de comorbilidades con capacidad de deteriorar el funcionamiento cognitivo, la instauración de hábitos de vida saludables o la neurorehabilitación cognitiva; estrategias cuyos resultados son prometedores, pero todavía no son concluyentes.
5.6.1 TRATAMIENTO FARMACOLÓGICO
- EL TRATAMIENTO ANTIRRETROVIRAL
La supresión de la carga viral de VIH es la medida que ha demostrado ser más efectiva, tanto a nivel terapéutico como preventivo, en el tratamiento de los TNAV. El TAR se ha relacionado con una reducción notable en la prevalencia e incidencia de la demencia VIH, pero no de los TNAV asintomático y leves. La persistencia de estas formas leves de TNAV en pacientes tratados con TAR de forma efectiva parece deberse a diversos factores como por ejemplo el inicio del TAR en fases tardías de la infección en las que ya se ha producido un daño neurológico irreversible.
Un aspecto controvertido sobre el papel del TAR en los TNAV es si todas las pautas de fármacos antirretrovirales (ARV) tienen la misma eficacia en la prevención y tratamiento de los TNAV. Desde los primeros años de uso del TAR se comenzaron a detectar casos de pacientes en los que a pesar de recibir TAR, la carga viral de VIH en LCR se mantenía detectable. El estudio de estos casos mostró que los niveles en LCR para algunos de los ARV que recibían estos pacientes eran inferiores a los necesarios para conseguir una supresión eficaz del VIH. Esto, junto a la constatación en estos pacientes de correlación entre la carga viral en LCR y la presencia de TNAV, hizo que algunos expertos planteasen que la persistencia de los TNAV a pesar del TAR se debía al uso de ARV con una penetrabilidad en LCR insuficiente para controlar completamente la replicación del VIH en el SNC. Y que para tratar los TNAV se abogase por el uso de aquellas pautas de TAR con una mayor penetrabilidad en LCR.
Penetrabilidad del TAR en LCR
Múltiples son los estudios farmacocinéticos y farmacodinámicos que se han realizado para caracterizar el perfil de penetrabilidad de los distintos ARV en LCR (Tabla 10). En general, el objetivo de estos estudios ha sido estimar el nivel de ARV que se alcanza en LCR y su relación con el nivel plasmático. Las principales limitaciones de estos estudios son: 1) Que en general incluyen un número reducido de casos. 2) Que usan distintas medidas para evaluar la actividad antiviral (concentraciones inhibitorias o efectivas 50 o 90). 3) Que la dosificación estudiada para algunos ARV está obsoleta. Y 4) que en muchos estudios se asumió erróneamente que los ARV en el LCR no se unían a proteínas.
En general, en la actualidad, todos los ARV tienen una penetrabilidad alta en LCR y las concentraciones que alcanzan son suficientemente elevadas como para suprimir la replicación de cepas de VIH salvajes. La única excepción sería Tenofovir, que en LCR alcanza niveles muy inferiores a los plasmáticos (<5%) que no superan la concentración inhibitoria (IC) 50 del VIH en un 23% de los pacientes. El hallazgo en muestras cerebrales obtenidas de pacientes post- mortem de niveles muy elevados de Tenofovir en el tejido cerebral ponen en cuestión que la penetrabilidad de Tenofovir en SNC sea baja y por tanto la capacidad de predecir la penetrabilidad en SNC de un ARV en base a sus concentraciones en LCR.
Traslación clínica de la penetrabilidad de ARV en LCR
Con el objetivo de trasladar los resultados de los estudios de penetrabilidad de los ARV en LCR a la práctica clínica se ha desarrollado scores de penetración del TAR en LCR. El más relevante es el Central Nervous System penetration and effectiveness (CPE) score desarrollado entre 2004 y 2008 en la cohorte CHARTER a partir de las características fisicoquímicas y farmacocinéticas de los distintos ARV. En 2008 fue publicada una primera aproximación que fue corregida en 2010. Desde 2010 el CPE score no ha sido revisado. En un estudio publicado en 2019 otros autores han publicado una versión actualizada cuya utilidad no ha sido validada310.
El CPE score demostró predecir el riesgo de presentar replicación viral persistente en LCR pero ha sido incapaz de demostrar en la propia cohorte CHARTER su utilidad para predecir los cuadros de escape viral en LCR, la presencia de deterioro cognitivo o el declinar cognitivo. Tampoco ha demostrado su utilidad como herramienta que guie la selección del TAR en pacientes con TNAV. La utilidad del CPE score también ha sido evaluada fuera de CHARTER con resultados contradictorios310,314–317.
La falta de eficacia del CPE score en muchos estudios se ha sugerido que podría deberse a la buena penetrabilidad que tienen todos los ARV actuales o a factores diferentes al control de la replicación viral como puede ser la neurotoxicidad del TAR.
Recomendaciones:
- El inicio precoz del TAR y el control de comorbilidades que puedan favorecer negativamente sobre el funcionamiento neurocognitivo son las medidas más efectivas para prevenir el desarrollo de TNAV (A-I).
- En pacientes sin síntomas neurocognitivos, la penetrabilidad en LCR no debe ser uno criterios que guíen la elección del TAR (A-II).
- En pacientes con sospecha de encefalitis VIH, de una enfermedad oportunista del SNC o con escape viral en LCR se recomienda iniciar un TAR que incluya fármacos activos y con alta penetrabilidad en LCR (A-II).
- Los pacientes, diagnosticados de TNAV y tratados con fármacos ARV con baja penetrabilidad en LCR, podría beneficiarse del cambio a una pauta de TAR con mayor penetrabilidad en LCR, siempre que el perfil de tolerabilidad del nuevo TAR sea similar o mejor al del previo (C-I).
- La interrupción del tratamiento antirretroviral está desaconsejada también a nivel de protección del SNC y, por tanto, se debería promover una correcta adherencia a la terapia antiviral (B-III).
5.6.1.1. TRATAMIENTOS COADYUVANTES
La falta de una eficacia del TAR en el tratamiento de los TNAV ha favorecido el estudio de estrategias terapéuticas adyuvantes con moléculas con propiedades neuroprotectoras in vitro. En general, la mayoría de estos estudios fueron estudios piloto de corta duración, sin potencia para demostrar el beneficio de la molécula evaluada. Por ello sus resultados deben ser interpretados con cautela.
Rivastigmina
La Rivastigmina, un inhibidor de la colinesterasa utilizado como tratamiento sintomático en la enfermedad de Alzheimer (EA), fue evaluada en 27 personas con VIH y deterioro cognitivo, durante entre 20-48 semanas, en dos ensayos clínicos piloto. En ambos, no se observaron beneficios a nivel cognitivo relevantes y sí un porcentaje elevado de efectos adversos y discontinuaciones relacionadas con el fármaco.
Minociclina
La Minociclina, por su capacidad para reducir los niveles de óxido nítrico a nivel cerebral, fue evaluada en un ensayo clínico randomizado y doble ciego a 24 semanas en 107 participantes. El uso de minociclina fue seguro, pero no demostró ningún beneficio a nivel cognitivo.
Memantina
La Memantina, por su capacidad protectora frente a la excitotoxicidad de la glicoproteína 120, fue evaluada en dos ensayos clínicos, también con resultados negativos a nivel cognitivo.
Selegilina
La Selegilina, por su capacidad de reducir la oxidación de radicales libres a nivel cerebral, fue evaluada por vía transdérmica en el ACTG 5090. En este ensayo clínico, ciego a 24 semanas y abierto de semana 24 a 48, el uso de selegilina fue seguro, pero no demostró ningún beneficio a nivel cognitivo.
Litio
El Litio, por su capacidad protectora frente a la excitotoxicidad de la glicoproteína 120, ha sido evaluado en tres ensayos clínicos con resultados a nivel cognitivo contradictorios.
Ácido valproico
El ácido valproico, por su capacidad neuroprotectora in vitro frente al VIH, fue evaluado, sin demostrar beneficios a nivel cognitivo, en 22 pacientes en un ensayo clínico doble ciego piloto de 10 semanas.
Eritropoyetina
La Eritropoyetina ha demostrado capacidad neuroprotectora in vitro y en modelos animales frente a la excitotoxicidad producida por las proteínas de la envuelta del VIH.
Lexipafant
El Lexipafant, por su efecto como inhibidor del factor activador de las plaquetas (marcador de inflamación asociado al daño neuronal), demostró que podría tener efecto beneficio a nivel cognitivo en un pequeño (n=13) ensayo clínico piloto doble ciego.
CPI-1189
El CPI-1189, por su efecto antioxidante neuroprotector in vitro, fue evaluado, sin demostrar beneficios a nivel cognitivo frente a placebo, en 64 individuos VIH en un ensayo clínico de 10 semanas.
Nimodipino
El Nimodipino, por su capacidad como antagonista voltaje-dependiente de los canales de calcio, fue evaluado, sin demostrar beneficios a nivel cognitivo frente a placebo, en 41 pacientes con deterioro cognitivo moderado-severo en un ensayo clínico de 16 semanas.
Estatinas
El papel de las estatinas, por su capacidad in vitro de modular la respuesta inmune y reducir la replicación del VIH, han sido evaluado en dos estudios, sin demostrar beneficios a nivel cognitivo o de reducción de la carga viral en LCR.
Inhibidores selectivos de la recaptación de serotonina (ISRSs)
El papel de los ISRSs, por su capacidad in vitro inhibitoria de la replicación del VIH, ha sido evaluado en un estudio de cohortes en 658 pacientes. Este estudio demostró niveles más bajos de carga viral en LCR y un mejor rendimiento cognitivo en los pacientes tratados con ISRSs.
Péptido T
El péptido T (D-ala-péptido T-amida), por su papel protector frente a la excitotoxicidad de la glicoproteína 120, fue evaluado frente a placebo en 143 pacientes en un ensayo clínico doble ciego de 6 meses. Los resultados del estudio solo demostraron un potencial beneficio en el subgrupo de pacientes con un mayor grado de deterioro cognitivo y/o mejor situación inmunológica basal.
Recomendaciones:
- En pacientes diagnosticados de TNAV no se recomienda el uso de ninguna medida farmacológica adyuvante al TAR (A-I).
5.6.2. INTERVENCIONES NO FARMACOLÓGICAS
Los estudios indican que nuestro cerebro y funciones cognitivas pueden ser influidos por factores modificables a través de mecanismos de neuroplasticidad sobre los que podemos intervenir con el objetivo de prevenir o tratar los TNAV. Dentro de estas intervenciones, que denominamos no farmacológicas, tenemos la prevención de las comorbilidades, la mejora del estilo de vida y la rehabilitación neurocognitiva (Figura 2). De forma general, el manejo de estos factores no difiere de forma sustancian entre los pacientes VIH y la población general.
5.6.2.1. PREVENCIÓN DE LAS COMORBILIDADES
Como ya se comentó en el punto 5.3, el virus no es la única condición capaz de favorecer el deterioro cognitivo de los pacientes infectados por VIH. Como veremos a continuación, actuar sobre aquellas de estas condiciones que son modificables podría prevenir el declinar de la función cognitiva en los pacientes con TNAV:
Prevención cardiovascular
La hipertensión arterial (HTA), la diabetes mellitus tipo 2 (DM) y la dislipemia (DL) son comorbilidades muy prevalentes en el VIH, asociadas con un aumento del riesgo de enfermedad microvascular cerebral y deterioro neurocognitivo. Por ejemplo, en pacientes VIH de edad avanzada, se ha identificado relación directa entre un mayor riesgo cardiovascular, estimado por ASCVD y Framingham, y una peor evolución cognitiva tras 4 años de seguimiento.
Respecto a la HTA, el control de la tensión arterial con hipotensores en pacientes hipertensos con y sin VIH se ha asociado con menores tasas de demencia y, en población general, con menos riesgo de desarrollo de declinar cognitivo, pero solo en pacientes sin enfermedad cerebrovascular previa. Para la DM, aunque no hay evidencia de que el control glucémico prevenga el deterioro cognitivo, sabemos que la hiperglucemia se ha asociado con un efecto deletéreo sobre el funcionamiento cognitivo, tanto en población general como en VIH. Finalmente, la DL se ha asociado tanto en población general como VIH con un riesgo aumentado de deterioro neurocognitivo. Como ya se ha comentado las estatinas podrían tener un papel tanto en el control de la DL como en la prevención de los TNAV.
Curación de la hepatitis C
En población general, la curación de la hepatitis C se ha asociado con mejorías a nivel del funcionamiento cognitivo y del metabolismo cerebral. En VIH, no disponemos de datos sobre el efecto neurocognitivo de curar la hepatitis C. Aunque la evidencia del papel de la hepatitis C sobre la función cognitiva es controvertida, sería de esperar que los efectos a nivel cognitivo de curar la hepatitis C fueran similares a los evidenciados en población general.
Trastornos mentales
En general, tanto los trastornos mentales como los fármacos utilizados para su tratamiento se han relacionado con tasas elevadas de deterioro neurocognitivo.
Por ejemplo, para la depresión, existe una clara asociación entre esta entidad y la presencia de diversas alteraciones cognitivas (velocidad de procesamiento, funciones ejecutivas, aprendizaje-memoria y motricidad) . Aunque no está claro el efecto cognitivo a largo plazo que tiene el control de la depresión, a corto plazo sabemos que la depresión va a disminuir el rendimiento cognitivo por lo que se recomienda su tratamiento antes de evaluar a un paciente de un TNAV.
Miscelánea
Existen otras comorbilidades en las que se ha señalado una posible asociación con los TNAV; dadas su menor prevalencia o el menor grado de evidencia solo las reseñamos: insuficiencia renal crónica, déficit de vitamina B12; déficit de vitamina D, deficiencia de testosterona, disfunción tiroidea subclínica, estrógenos, hipotiroidismo subclínico, síndrome metabólico, obesidad.
5.6.2.2. INTERVENCIONES SOBRE LOS FACTORES ASOCIADOS AL ESTILO DE VIDA
Existe una evidencia creciente de que nuestro estilo de vida contribuye a la capacidad del cerebro para afrontar las enfermedades y reaccionar a los desafíos. Diversos estudios, la mayoría realizados en población general, han demostrado que la modificación de los principales factores asociados al estilo de vida puede producir beneficios a nivel del funcionamiento cognitivo.
Dieta
Aunque no existe evidencia específica en población VIH, la llamada dieta mediterránea podría tener un efecto protector frente a los TNAV. Un estudio ha observado una reducción del riesgo de deterioro cognitivo leve del 28% tras 4,5 años de seguimiento en pacientes que seguían una dieta mediterránea. Respecto a los ácidos grasos omega-3, la última revisión Cochrane de 2016 sobre su valor en la prevención de la demencia no encontró pruebas suficientes para recomendar su uso.
Actividad física
En población general, el ejercicio físico regular se ha relacionado con menores tasas de deterioro neurocognitivo leve. En VIH, aunque no se dispone de estudios longitudinales que hayan evaluado el efecto cognitivo de la actividad física, la evidencia sugiere que el ejercicio regular mejora la salud general del cerebro.
Actividades de ocio
En población general, las actividades de ocio (leer, dibujar, jugar al ajedrez o a las cartas, visitar un museo, tocar música, jardinería, cocinar o realizar actividades sociales, etc…) a lo largo de la vida y especialmente durante la mediana edad y la vejez podrían ser beneficiosas para prevenir la demencia. Sin embargo, con la evidencia actual, que no incluye estudios específicos para VIH, no podemos establecer una relación causal directa entre ocio y función cognitiva.
Reducción del estrés
El estrés causa una serie de adaptaciones neuronales y endocrinas complejas que puede comprometer la supervivencia neuronal y disminuir la capacidad plástica del cerebro. En general, los pacientes infectados por VIH suelen tener un mayor distrés
psicológico, menor calidad de vida y mayor prevalencia de trastornos psiquiátricos. Aunque son numerosos los programas de reducción del estrés en pacientes VIH publicados con resultados positivos a nivel de cambios a nivel emocional y calidad de vida, ninguno ha analizado la repercusión de estas intervenciones sobre el funcionamiento cognitivo.
Tabaquismo
El consumo de tabaco parece asociarse en población general con aumento de riesgo de demencia. En VIH, disponemos de un estudio comparativo en el que los fumadores VIH (n=103) tuvieron peores resultados a nivel de la memoria de trabajo y de la velocidad de procesamiento. En cuanto a actuaciones, ningún estudio longitudinal ha valorado los efectos del abandono tabáquico sobre la cognición.
Consumo de alcohol
La evidencia disponible respecto al efecto del consumo de alcohol sobre la función cognitiva no es concluyente, pero sugiere que un consumo bajo – moderado (<12g de alcohol) podría tener un efecto protector sobre el rendimiento cognitivo, mientras que para consumos mayores el efecto sería negativo. En VIH, los pacientes con dependencia al alcohol tienen mayores tasas de TNAV.
Uso de sustancias tóxica
Respecto al consumo de sustancias, la evidencia es contradictoria y su efecto a nivel cognitivo va a depender del grado de consumo y del efecto neurotóxico directo e indirecto de cada sustancia (consultar punto 4.4). Con independencia de ello, se ha objetivado que el aumento de los niveles de dopamina que producen sustancias como la cocaína, la heroína o la metanfetamina produce una desregulación inmune de los monocitos y de la microglia que podría favorecer el desarrollo de los TNAV.
5.6.2.3. REHABILITACIÓN COGNITIVA
La neurorehabilitación se define como el proceso que se ocupa de la mejorar los déficits cognitivos, emocionales, psicosociales y conductuales causados por un daño en el cerebro. Los objetivos de estas estrategias son minimizar el impacto del deterioro cognitivo, optimizar las capacidades residuales, compensar la incapacidad ya instalada y promover un envejecimiento saludable preservando la dignidad del paciente.
Los programas de neurorehabilitación cognitiva han demostrado ser útiles en varias patologías que cursan con deterioro neurocognitivo como el daño cerebral adquirido o la esquizofrenia. Igualmente, estas técnicas han sido aplicadas con resultados menos claros, aunque alentadores, en la EA, en otras demencias y más recientemente en gente mayor sana y con deterioro cognitivo leve.
En el campo del VIH se han publicado muy pocos estudios que evalúen la eficacia de diferentes técnicas de intervención cognitiva. Todos estos trabajos aplican técnicas de entrenamiento cognitivo y muestran efectos positivos, aunque varían mucho en su metodología y la muestra (Tabla 11).
Recomendaciones:
- En el tratamiento de los TNAV:
- Se recomienda el manejo de todas las comorbilidades, susceptibles de ser
modificadas, que puedan afectar la función cognitiva del individuo (A-II).
- Se recomiendan las intervenciones encaminadas a favorecer hábitos de vida saludable como el ejercicio físico, la dieta mediterránea y el abandono de tóxicos (A-II). Otras medidas que podrían ser eficaces son favorecer las actividades de ocio y las estrategias de reducción del estrés (B-III).
- Podrían ser de utilidad los programas de rehabilitación y estimulación cognitiva (B-II).
6. Neuroenvejecimiento
6.1. Enfermedad de Alzheimer
6.2. Demencia vascular
6.3. Demencias que cursan con parkinsonismo
6.4. Demencias frontotemporales
El neuroenvejecimiento es un proceso fisiológico universal multifactorial e irreversible, asociado con fenómenos de senescencia neuronal y con el declinar progresivo de las funciones cognitivas375. En algunas personas, factores como el aumento del estrés oxidativo crónico cerebral se ha visto que pueden acelerar el neuroenvejecimiento, amplificar los déficits cognitivos y favorecer el desarrollo de demencia376. Estas demencias suelen tener un perfil de afectación cortical y afectan al 5-10% de los mayores de 65 años y al 50% de los mayores de 85377.
En las personas con VIH, la identificación de factores neurotóxicos secundarios a la infección y al TAR, como el deposito de beta-amiloide o el aumento del estrés oxidativo a nivel del SNC378, junto con la identificación de perfiles de deterioro cognitivo más corticales en mayores de 50 años ha llevado a algunos expertos a plantear la denominada hipótesis cortical. Esta hipótesis sugiere que los procesos neurotóxicos producidos por el VIH y el TAR van a potenciar los déficits cognitivos del neuroenvejecimiento y, por ende, aumentar la prevalencia y el desarrollo precoz de demencias corticales376. Aunque existen resultados contradictorios, en la mayoría de los estudios no se han identificado asociaciones significativas entre VIH y edad avanzada379. Una limitación importante de estos estudios es que consideraron como edad avanzada a partir de los 50 años, edad a la que los fenómenos de neuroenvejecimiento probablemente no sean aún clínicamente relevantes.
Con independencia de cual sea la prevalencia real de las demencias corticales, la realidad es que solo por el envejecimiento que está sufriendo la población VIH380, comentar el número de personas diagnosticadas de demencias asociadas con la edad van a aumentar de forma significativa en los próximos años, lo que va a suponer un reto para los profesionales encargados del cuidado de las personas con VIH. Por este motivo hemos creído indispensable incluir en esta guía aspectos clave sobre el diagnóstico y tratamiento de estas demencias.
Enfermedad de Alzheimer
La EA es el prototipo de demencia cortical y la causa más prevalente de demencia asociada a la edad en la población general67381. En el desarrollo de la EA sabemos que van a intervenir factores genéticos y adquiridos, muchos de los cuales aún desconocemos. Uno de los factores que se ha postulado podría favorecer la EA es la infección por VIH, al favorecer el depósito de amiloide y de proteína TAU a nivel cerebral382. Por el momento, la ausencia de estudios que demuestren claramente un aumento de la EA en las personas con VIH no permite confirmar que exista interacción entre ambos factores383384385.
Diagnóstico
El curso clínico de la EA suele ser insidioso y progresivo. Se debe sospechar en personas con VIH de edad avanzada con un declinar progresivo de la memoria y, al menos otro déficit cognitivo, que repercuta en su funcionalidad, en ausencia de delirium, psicosis o evidencia de otro tipo de demencia386. En 2011 el National Institute on Aging y la (NIA-AA) establecieron tres categorías diagnósticas:
- EA confirmada: Requiere confirmación histopatológica.
- EA probable: deterioro cognitivo, con repercusión funcional significativa, en>1 de los siguientes dominios (memoria, funciones ejecutivas, espacio-visual, lenguaje y cambios en la personalidad, el humor o el comportamiento), de inicio insidioso y progresivo, en ausencia de delirium o de un trastorno psiquiátrico mayor.
- EA posible: Cuadro con un curso atípico del deterioro cognitivo y/o cuadro típico con evidencia de otra etiología que pueda causar deterioro
La escala de Montreal (Montreal Cognitive Assessment - MoCA) (www.mocatest.org) puede ser útil para determinar la presencia y la progresión del cuadro clínico387. Como ocurre en los TNAV, la confirmación del deterioro cognitivo requerirá la realización de una evaluación neurocognitiva reglada que, a diferencia de lo que ocurre en el VIH, mostrará un patrón de afectación predominantemente cortical. Con el objeto de establecer el diagnóstico diferencial con los TNAV Tabla 1, se recomienda la realización de una RM cerebral y de una punción lumbar con determinación de beta-amiloide y de las proteínas TAU y fosfo-TAU388. En la RM sería esperable observar una reducción del volumen del hipocampo y atrofia a nivel medial de los lóbulos temporales y en el LCR niveles bajos de 42-beta-amiloide y aumentados de TAU y fosfo-TAU31. En casos atípicos, podría ser de utilidad la realización de un PET de 18-fluoroxiglucosa y/o un PET de fotón único (SPET) en los que se esperaría encontrar respectivamente hipometabolismo e hipoperfusión en el hipocampo y en los lóbulos parietales y temporales389.
Manejo y tratamiento
El uso de inhibidores de la colinesterasa (Galantamina, Donepezil, Rivastigmina), de Memantina y/o de vitamina E se han asociado con mejoras modestas en las evaluaciones cognitivas y en la funcionalidad de algunos pacientes con EA390391392. La seguridad y tolerabilidad de la vitamina E es excelente, siendo la de la Memantina mejor que la de los inhibidores de la colinesterasa. En pacientes con demencias avanzadas, el uso combinado de Donepezil y Memantina podría tener un beneficio modesto a nivel cognitivo y funcional393. En pacientes con cuadros más leves, se podría plantear, por su buena tolerabilidad, la asociación de Memantina + vitamina E.
Para el manejo de la sintomatología neuropsiquiátrica, siempre que sea posible, el tratamiento de primera línea sería la psicoterapia394. Desde el punto de vista farmacológico se recomienda el tratamiento con dosis bajas de ISRS, siendo de elección el Citalopram o la Sertralina395. Se recomienda monitorización del intervalo QT, especialmente en pacientes que tomen antirretrovirales que lo aumenten. El uso de antipsicóticos clásicos debe evitarse ya que se asocian con un aumento de la mortalidad. De ser necesarios, los antipsicóticos de elección serían Olanzapina o Risperidona396. El uso de benzodiacepinas solo estaría indicado si son de vida media corta y se usan de forma breve en periodos estresantes397.
Aunque la evidencia es limitada como para establecer una recomendación de uso fuerte, las siguientes medidas no farmacológicas podrían tener efectos beneficiosos en los pacientes con EA: Favorecer una nutrición adecuada398, el ejercicio regular399 y los programas de estimulación cognitiva397 y/o terapia ocupacional398. Igualmente, el control de los factores de riesgo cardiovascular se ha visto que puede ralentizar la progresión de la enfermedad400.
Demencia vascular
Se denomina demencia vascular (DV) a cualquier deterioro cognitivo cuyo origen sea la enfermedad cerebrovascular y cuya severidad altere de forma significativa la funcionalidad de una persona67401. La DV se relaciona con el envejecimiento y con los factores de riesgo cardiovascular (HTA, DM dislipemia, obesidad y tabaquismo)402403404. En población general, se estima que la DV es la segunda causa de demencia tras la EA, contribuyendo al 25- 50% de todas las demencias405. En las personas con VIH, aunque la evidencia es aún limitada, se estima que los cuadros de DV podrían ser más precoces y su prevalencia estar aumentada 4. La razón argumentada, la elevada prevalencia de factores de riesgo vascular que suelen asociarse a este colectivo277, 338, 406407408409410.
La expresividad clínica de la DV va a depender del tipo de territorio vascular afectado (macro o microvascular) y de su localización. En la DV macrovascular el deterioro aparece tras el accidente cerebrovascular agudo y se caracteriza por una marcada afectación de las funciones ejecutivas junto con signos de afectación cortical, como apraxia o afasia411. En la DV microvascular el cuadro clínico suele ser larvado y el perfil de deterioro cognitivo más leve y de predominio subcortical402. Este perfil hace que el diagnóstico diferencial con los TNAV en las personas con VIH sea extremadamente difícil por lo que en muchos casos se termina estableciendo un diagnóstico de demencia mixta.
Diagnóstico
Como ocurre con los TNAV, el diagnóstico se establece mediante una batería neurocognitiva, que debe evaluar al menos función ejecutiva, memoria, atención, lenguaje y función espacio-visual. Para el cribado se suele recomendar la escala de Montreal con un punto de corte de < 25 puntos387412. A la hora del diagnóstico diferencial, la escala de isquemia de Hachinski puede ser de utilidad a la hora de establecer la probabilidad de que un componente vascular esté contribuyendo en el cuadro de demencia Tabla 2412. De forma adicional, el diagnóstico de la DV requiere la confirmación mediante una técnica de imagen de lesiones vasculares cerebrales, siendo la RM cerebral la técnica de elección401y la clasificación standard la STRIVE413.
Manejo y tratamiento
El tratamiento de la DV es sintomático. Suele incluir el uso de inhibidores de la colinesterasa (Galantamina, Donepezil, Rivastigmina) o el antagonista de la N-metil-D- aspartato Memantina, aunque su indicación es controvertida por la escasa eficacia de estos fármacos sobre la función cognitiva402, siendo el Donepezil el único fármaco que ha demostrado beneficios en las escalas funcionales y de comportamiento414. Antes del inicio de cualquiera de estos tratamientos hay que tener en cuenta las posibles interacciones de estos con el TAR. La prevención de la DV es un tema controvertido. Existe poca evidencia derivada de ensayos clínicos randomizados del impacto del control de los factores de riesgo cardiovascular sobre la incidencia de DV y la que hay es contradictoria(339,415-420). A pesar de ello, la American Stroke Association (ASA), para prevenir la DV recomienda controlar siete aspectos relacionados con el estilo de vida: tabaquismo, sedentarismo, obesidad, HTA, hipercolesterolemia e intolerancia glucídica en ayunas418.
Demencias que cursan con parkinsonismo
Dentro del diagnóstico diferencial de los cuadros de demencia en las personas con VIH, además de los TNAV, la EA y la DV, existen otras demencias que tienen en común, además del deterioro cognitivo, un cuadro de parkinsonismo (temblor, bradicinesia, rigidez y/o inestabilidad postural). Las más relevantes son la demencia de cuerpos de Lewy421 y la demencia de la enfermedad de Parkinson422. La principal diferencia entre ambas es que la demencia de cuerpos de Lewy la demencia y el parkinsonismo aparecen más o menos a la vez, mientras en la demencia de la enfermedad de Parkinson, el parkinsonismo aparece 5-8 años antes que la demencia. Además, en la demencia de cuerpos de Lewy son características las alteraciones del sueño, las alucinaciones visuales, la fluctuación del nivel de alerta y una alteración espacio-visual muy marcada.
Demencias frontotemporales
Las demencias frontotemporales son un grupo heterogéneo de enfermedades neurodegenerativas caracterizadas por cambios en el comportamiento social y en la personalidad muy marcados o por afasia acompañada de degeneración de los lóbulos frontal y/o temporales423. En la Tabla 3 se presenta el diagnóstico diferencial entre esta entidad, la EA, la DV y la demencia por cuerpos de Lewy.
Recomendaciones:
- En pacientes mayores de 60 años con deterioro neurocognitivo será obligada la realización de pruebas complementarias (RM cerebral, niveles de beta-amiloide, TAU y fosfo-TAU en LCR +/- PET) que permitan descartar la existencia de una demencia asociada con la edad (A-III).
- El tratamiento farmacológico con inhibidores de la colinesterasa, Memantina y/o de vitamina E podría reducir la sintomatología cognitiva y funcional de las personas con EA (C-I).
- El tratamiento de elección de la sintomatología neuropsiquiátrica de la EA sería la psicoterapia (A-I). A nivel farmacológico se recomiendan las dosis bajas de ISRS (Citalopram o Sertralina) (B-I) y, cuando es necesario el uso de antipsicóticos, la Olanzapina o la Risperidona (C-I).
- En los pacientes con EA está contraindicado el uso de antipsicóticos clásicos (A-I) y debe evitarse el uso de benzodiacepinas (B-II).
- En el manejo de la EA podría ser de utilidad el mantenimiento de una dieta equilibrada, el ejercicio regular y los programas de estimulación cognitiva y/o terapia ocupacional (B-II).
- En pacientes con VIH y deterioro cognitivo compatible con un TNAV, que presenten factores de riesgo vascular y/o evidencia de patología vascular, la escala de isquemia de Hachinski y la clasificación STRIVE de las lesiones cerebrales vasculares son de utilidad para valorar la coexistencia de un cuadro de deterioro cognitivo vascular (C-III).
- En el manejo de la DV, el uso de Donepezil podría reducir la disfunción cognitiva y las alteraciones del comportamiento (C-I).
- Para la prevención de la DV se recomienda un control adecuado del tabaquismo, el sedentarismo, la obesidad, la HTA, la hipercolesterolemia y la intolerancia glucídica en ayunas (A-III).
Tablas:
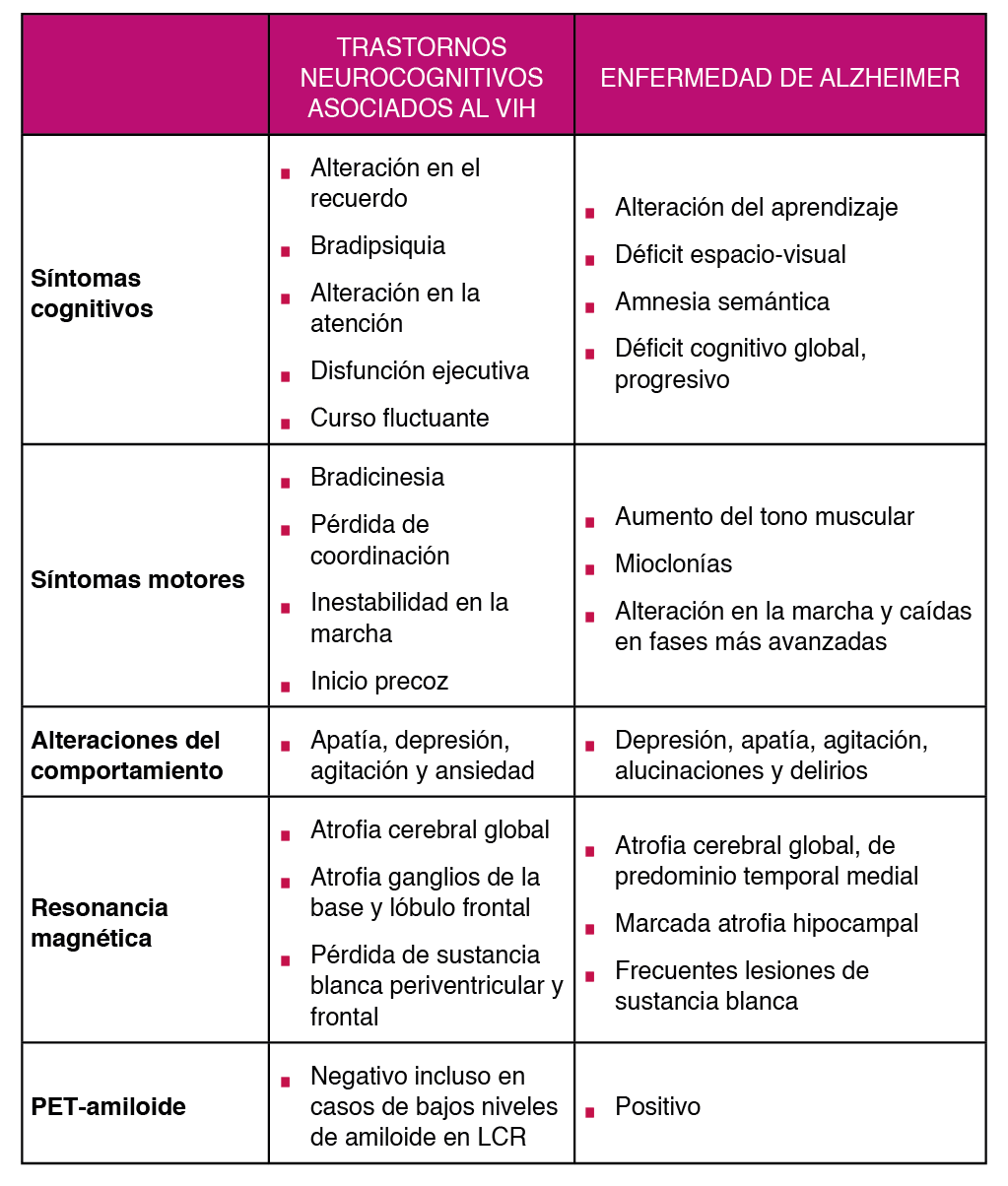

* Punto de corte: > 7 afectación vascular muy probable.
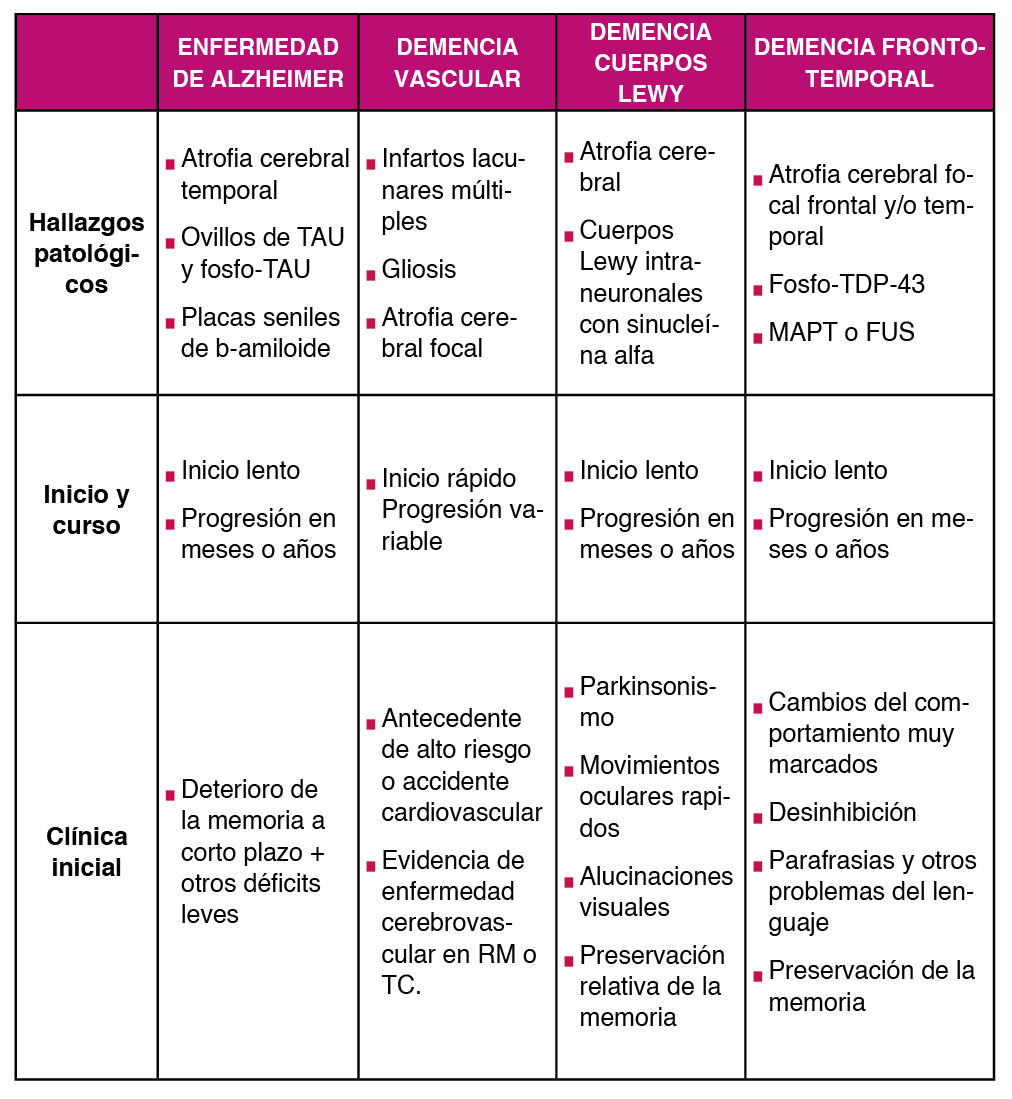
Bibliografía:
Cantú Guzmán R, Álvarez Bermúdez J, Torres López E, Martínez Sulvarán O. Impacto psicosocial asociado al diagnóstico de infección por vih/SIDA: apartados cualitativos de medición. Revista Electrónica Medicina, Salud y Published online 2012.
Flowers P, Davis MM, Larkin M, Church S, Marriott C. Understanding the impact of HIV diagnosis amongst gay men in Scotland: An interpretative phenomenological Psychology & Health. 2011;26(10):1378-1391. doi:10.1080/08870446.2010.551213
Zeligman M, Wood AW. Conceptualizing an HIV Diagnosis Through a Model of Grief and Adultspan Journal. 2017;16(1):18-30. doi:10.1002/adsp.12031
Richard Lazarus MVMSF. Estrés y Procesos Cognitivos. (Martinez Roca, ed.).; 1986.
Milena Gaviria A, Quiceno JM, Vinaccia S, Martínez LA, Otalvaro Estrategias de afrontamiento y ansiedad-depresión en pacientes diagnosticados con VIH/SIDA. Terapia Psicologica. 2009;27(1):5-13. doi:10.4067/s0718-48082009000100001
Carrobles JA, Remor E, Rodríguez-Alzamora Afrontamiento, apoyo social percibido y distrés emocional en pacientes con infección por VIH. [Relationshiop of coping and perceived social support to emotional distress in people living with HIV.]. Psicothema. 2003;15(3):420-426.
Chida Y, Vedhara Adverse psychosocial factors predict poorer prognosis in HIV disease: A meta- analytic review of prospective investigations. Brain, Behavior, and Immunity. 2009;23(4):434-445. doi:10.1016/j.bbi.2009.01.013
Ironson GH, O’Cleirigh C, Weiss A, Schneiderman N, Costa PT. Personality and HIV Disease Progression: Role of NEO-PI-R Openness, Extraversion, and Profiles of Psychosomatic Medicine. 2008;70(2):245-253. doi:10.1097/PSY.0b013e31816422fc
Lee RS, Kochman A, Sikkema Internalized Stigma Among People Living with HIV-AIDS. AIDS
Guevara-Sotelo Y, Hoyos-Hernández Vivir con VIH: experiencias de estigma sentido en
Chan RCH, Mak WWS. Cognitive, Regulatory, and Interpersonal Mechanisms of HIV Stigma on the Mental and Social Health of Men Who Have Sex With Men Living With HIV. American Journal of Men’s 2019;13(5):155798831987377. doi:10.1177/1557988319873778
Travaglini LE, Himelhoch SS, Fang LJ. HIV Stigma and Its Relation to Mental, Physical and Social Health Among Black Women Living with HIV/AIDS. AIDS and Behavior. 2018;22(12):3783-3794. doi:10.1007/s10461-018-2037-1
Atkinson JS, Nilsson Schönnesson L, Williams ML, Timpson Associations among correlates of schedule adherence to antiretroviral therapy (ART): A path analysis of a sample of crack cocaine using sexually active African–Americans with HIV infection. AIDS Care. 2008;20(2):253- 262. doi:10.1080/09540120701506788
Johnson CJ, Heckman TG, Hansen NB, Kochman A, Sikkema KJ. Adherence to antiretroviral medication in older adults living with HIV/AIDS: a comparison of alternative models. AIDS Care. 2009;21(5):541-551. doi:10.1080/09540120802385611
Santoro Pablo CF. Tipos de problemas de adherencia entre las personas con VIH y tendencias emergentes en la adherencia al tratamiento antirretroviral (TAR). Revista Multidisciplinar del 2013;1(1):41-58.
Dilla T, Valladares A, Lizán L, Sacristán JA. Adherencia y persistencia terapéutica: causas, consecuencias y estrategias de mejora. Atención Primaria. 2009;41(6):342-348. doi:10.1016/j. 2008.09.031
Owe-Larsson M, Säll L, Salamon E, Allgulander HIV infection and psychiatric illness. African
Dyer JG and Reducing HIV risk among people with serious mental illness. J
Parhami I, Fong TW, Siani A, Carlotti C, Khanlou H. Documentation of Psychiatric Disorders and Related Factors in a Large Sample Population of HIV-Positive Patients in California. AIDS and 2013;17(8):2792-2801. doi:10.1007/s10461-012-0386-8
Bing EG, Burnam MA, Longshore D, et al. Psychiatric Disorders and Drug Use Among Human Immunodeficiency Virus–Infected Adults in the United States. Archives of General Psychiatry. 2001;58(8):721. doi:10.1001/archpsyc.58.8.721
Lopes M, Olfson M, Rabkin J, et Gender, HIV Status, and Psychiatric Disorders. The Journal of
Brandt The mental health of people living with HIV/AIDS in Africa: A systematic review. African
Burnam MA, Bing EG, Morton SC, et Use of mental health and substance abuse treatment services among adults with HIV in the United States. Archives of General Psychiatry. 2001;58(8):729-736. doi:10.1001/archpsyc.58.8.729
Kessler RC, Chiu WT, Demler O, Walters EE. Prevalence, Severity, and Comorbidity of 12-Month DSM-IV Disorders in the National Comorbidity Survey Replication. Archives of General Psychiatry. 2005;62(6):617. doi:10.1001/archpsyc.62.6.617
Schadé A, van Grootheest G, Smit JH. HIV-infected mental health patients: Characteristics and comparison with HIV-infected patients from the general population and non-infected mental health BMC Psychiatry. 2013;13. doi:10.1186/1471-244X-13-35
Gallego L, Barreiro P, Lopez-Ibor Diagnosis and Clinical Features of Major Neuropsychiatric
Pence BW, O’Donnell JK, Gaynes Falling through the cracks. AIDS. 2012;26(5):656-658.
Beer L, Tie Y, Padilla M, Shouse Generalized anxiety disorder symptoms among persons with diagnosed HIV in the United States. AIDS. 2019;33(11):1781-1787. doi:10.1097/ QAD.0000000000002286
Rane MS, Hong T, Govere S, et al. Depression and Anxiety as Risk Factors for Delayed Care- Seeking Behavior in Human Immunodeficiency Virus–Infected Individuals in South Africa. Clinical Infectious 2018;67(9):1411-1418. doi:10.1093/cid/ciy309
Glynn TR, Safren SA, Carrico AW, et al. High Levels of Syndemics and Their Association with Adherence, Viral Non-suppression, and Biobehavioral Transmission Risk in Miami, a S. City with an HIV/AIDS Epidemic. AIDS and Behavior. 2019;23(11):2956-2965. doi:10.1007/s10461-019- 02619-0
Been SK, Schadé A, Bassant N, Kastelijns M, Pogány K, Verbon A. Anxiety, depression and treatment adherence among HIV-infected AIDS Care. 2019;31(8):979-987. doi:10.1080/ 09540121.2019.1601676
Zigmond AS, Snaith The Hospital Anxiety and Depression Scale. Acta Psychiatrica
Ferrando L, Bobes J Gibert M, Soto M, Soto M.I.N.I. Mini International Neuropsychiatric
Baldwin DS, Anderson IM, Nutt DJ, Evidence-basedguidelinesforthepharmacologicaltreatment of anxiety disorders: recommendations from the British Association for Psychopharmacology. Journal of Psychopharmacology. 2005;19(6):567-596. doi:10.1177/0269881105059253
Rabkin HIV and depression: 2008 review and update. Current HIV/AIDS Reports. 2008;5(4):163-
doi:10.1007/s11904-008-0025-1
Leserman HIV disease progression: depression, stress, and possible mechanisms. Biological
Mollan KR, Smurzynski M, Eron JJ, et Association Between Efavirenz as Initial Therapy for HIV- 1 Infection and Increased Risk for Suicidal Ideation or Attempted or Completed Suicide. Annals of Internal Medicine. 2014;161(1):1. doi:10.7326/M14-0293
Slot M, Sodemann M, Gabel C, Holmskov J, Laursen T, Rodkjaer Factors associated with risk of depression and relevant predictors of screening for depression in clinical practice: a cross- sectional study among HIV-infected individuals in Denmark. HIV Medicine. 2015;16(7):393-402. doi:10.1111/hiv.12223
Robertson K, Bayon C, Molina J-M, et al. Screening for neurocognitive impairment, depression, and anxiety in HIV-infected patients in Western Europe and AIDS Care. 2014;26(12):1555- 1561. doi:10.1080/09540121.2014.936813
Morrison MF, Petitto JM, Have T ten, et al. Depressive and Anxiety Disorders in Women With HIV
Rao D, Feldman BJ, Fredericksen RJ, et al. A Structural Equation Model of HIV-Related Stigma, Depressive Symptoms, and Medication Adherence. AIDS and Behavior. 2012;16(3):711-716. doi:10.1007/s10461-011-9915-0
Ciesla JA, Roberts JE. Meta-Analysis of the Relationship Between HIV Infection and Risk for Depressive Disorders. American Journal of Psychiatry. 2001;158(5):725-730. doi:10.1176/appi. 158.5.725
Tegger MK, Crane HM, Tapia KA, Uldall KK, Holte SE, Kitahata MM. The Effect of Mental Illness, Substance Use, and Treatment for Depression on the Initiation of Highly Active Antiretroviral Therapy among HIV-Infected Individuals. AIDS Patient Care and STDs. 2008;22(3):233-243. doi:10.1089/apc.2007.0092
Gonzalez JS, Batchelder AW, Psaros C, Safren Depression and HIV/AIDS Treatment Nonadherence: A Review and Meta-analysis. JAIDS Journal of Acquired Immune Deficiency Syndromes. 2011;58(2):181-187. doi:10.1097/QAI.0B013E31822D490A
Springer SA, Dushaj A, Azar MM. The Impact of DSM-IV Mental Disorders on Adherence to Combination Antiretroviral Therapy Among Adult Persons Living with HIV/AIDS: A Systematic AIDS and Behavior. 2012;16(8):2119-2143. doi:10.1007/s10461-012-0212-3
Sherr L, Clucas C, Harding R, Sibley E, Catalan J. HIV and Depression – a systematic review of Psychology, Health & Medicine. 2011;16(5):493-527. doi:10.1080/13548506.2011.5 79990
Leserman Role of Depression, Stress, and Trauma in HIV Disease Progression. Psychosomatic
So‐Armah K, Gupta S, Kundu S, et Depression and all‐cause mortality risk in HIV‐infected and HIV‐uninfected US veterans: a cohort study. HIV Medicine. 2019;20(5):317-329. doi:10.1111/ hiv.12726
European AIDS Clinical Society. EACS Guidelines version 10.0 — EACS. Published November Accessed June 25, 2020. https://www.eacsociety.org/files/2019_guidelines-10.0_final.pdf.
Treisman GJ, Soudry O. Neuropsychiatric Effects of HIV Antiviral Medications. Drug Safety. 2016;39(10):945-957. doi:10.1007/s40264-016-0440-y
Aragonès E, Roca M, Mora F. Abordaje Compartido de La Depresión: Consenso Multidisciplinar ; 2018. Accessed June 25, 2020. Ebook disponible en: www.semfyc.es/wp-content/ uploads/2018/05/ Consenso_depresion.pdf.
Laperriere A, Ironson GH, Antoni MH, et al. Decreased Depression Up to One Year Following CBSM+ Intervention in Depressed Women with AIDS: The Smart/EST Women’s Project. Journal of Health 2005;10(2):223-231. doi:10.1177/1359105305049772
Carrico AW, Antoni MH, Durán RE, et Reductions in depressed mood and denial coping during
Paulus DJ, Brandt CP, Lemaire C, Zvolensky MJ. Trajectory of change in anxiety sensitivity in relation to anxiety, depression, and quality of life among persons living with HIV/AIDS following transdiagnostic cognitive-behavioral therapy. Cognitive Behaviour Therapy. 2020;49(2):149-163. doi:10.1080/16506073.2019.1621929
Freudenreich O, Goforth HW, Cozza KL, et Psychiatric treatment of persons with HIV/AIDS: An HIV-psychiatry consensus survey of current practices. Psychosomatics. 2010;51(6):480-488. doi:10.1176/appi.psy.51.6.480
Ferrando SJ, Freyberg Treatment of depression in HIV positive individuals: A critical review.
Chandra PS, Desai G, Ranjan HIV & Psychiatric Disorders. Vol 121.; 2005.
de Sousa Gurgel W, da Silva Carneiro AH, Barreto Rebouças D, Negreiros de Matos KJ, do Menino Jesus Silva Leitão T, de Matos e Souza FG. Prevalence of bipolar disorder in a HIV- infected outpatient AIDS Care. 2013;25(12):1499-1503. doi:10.1080/09540121.2013.7 79625
Kieburtz K, Zettelmaier AE, Ketonen L, Tuite M, Caine Manic syndrome in AIDS. American
Ellen SR, Judd FK, Mijch AM, Cockram Secondary Mania in Patients with HIV Infection. Australian
Nakimuli-Mpungu E, Musisi S, Mpungu SK, Katabira Primary Mania Versus HIV-Related Secondary Mania in Uganda. American Journal of Psychiatry. 2006;163(8):1349-1354. doi:10.1176/ ajp.2006.163.8.1349
Robinson Primary Mania Versus Secondary Mania of HIV/AIDS in Uganda. American Journal
Nakimuli-Mpungu E, Musisi S, Kiwuwa Mpungu S, Katabira E. Clinical Presentation of Bipolar Mania in HIV-Positive Patients in Psychosomatics. 2009;50(4):325-330. doi:10.1176/appi. psy.50.4.325
Lyketsos CG, Hanson AL, Fishman M, Rosenblatt A, McHugh PR, Treisman GJ. Manic syndrome early and late in the course of HIV. American Journal of Psychiatry. 1993;150(2):326-327. doi:10.1176/ajp.150.2.326
Nakimuli-Mpungu, Mutamba Brian, Nshemerirwe Slyvia, Kiwuwa Mpungu Steven, Seggane Musisi. Effect of HIV infection on time to recovery from an acute manic HIV/AIDS - Research and Palliative Care. 2010;2:185. doi:10.2147/hiv.s9978
Soares Recent advances in the treatment of bipolar mania, depression, mixed states, and rapid cycling. International Clinical Psychopharmacology. 2000;15(4):183-196. doi:10.1097/00004850- 200015040-00001
American Psychiatric Diagnostic and Statistical Manual of Mental Disorders DSM-5
Stolar A. HIV and Psychiatry, Second Edition: A Training and Resource Manual . Cambridge University Press;
Newton PJ, Newsholme W, Brink NS, Manji H, Williams IG, Miller RF. Acute meningoencephalitis and meningitis due to primary HIV infection. BMJ (Clinical research ed). 2002;325(7374):1225- https://Pubmed.ncbi.nlm.nih.gov/12446542
Anguizola-Tamayo D, Bocos-Portillo J, Pardina-Vilella L, et al. Psychosis of dual origin in HIV infection: Viral escape syndrome and autoimmune encephalitis. Neurology Clinical practice. 2019;9(2):178-180. doi:10.1212/CPJ.0000000000000582
Laher A, Ariefdien N, Etlouba HIV prevalence among first-presentation psychotic patients. HIV
de Ronchi D, Faranca I, Forti P, et al. Development of Acute Psychotic Disorders and HIV-1 The International Journal of Psychiatry in Medicine. 2000;30(2):173-183. doi:10.2190/ PLGX-N48F-RBHJ-UF8K
Singh AN, Golledge H, Catalan Treatment of HIV-related psychotic disorders with risperidone: A series of 21 cases. Journal of Psychosomatic Research. 1997;42(5):489-493. doi:10.1016/S0022- 3999(96)00373-X
Fernandez F, Levy JK. The use of molindone in the treatment of psychotic and delirious patients infected with the human immunodeficiency virus. General Hospital Psychiatry. 1993;15(1):31-35. doi:10.1016/0163-8343(93)90088-6
Sewell DD, Jeste D , McAdams LA, et al. Neuroleptic Treatment of HIV-Associated Psychosis.
Millon Classifying Personality Disorders: An Evolution-Based Alternative to an Evidence-Based
Nanni MG, Caruso R, Mitchell AJ, Meggiolaro E, Grassi Depression in HIV Infected Patients: a
Low Y, Goforth H, Preud’homme X, Edinger J, Krystal A. Insomnia in HIV-infected patients: pathophysiologic . AIDS Reviews. 2014;16:3-13.
Omonuwa TS, Goforth HW, Preud’homme X, Krystal AD. The pharmacologic management of insomnia in patients with Journal of clinical sleep medicine : JCSM : official publication of the American Academy of Sleep Medicine. 2009;5(3):251-262. https://Pubmed.ncbi.nlm.nih. gov/19960648
Fekete EM, Williams SL, Skinta MD. Internalised HIV-stigma, loneliness, depressive symptoms and sleep quality in people living with Psychology & Health. 2018;33(3):398-415. doi:10.1080
Rogers BG, Lee JS, Bainter SA, Bedoya CA, Pinkston M, Safren A multilevel examination of sleep, depression, and quality of life in people living with HIV/AIDS. Journal of health psychology. Published online March 1, 2018:1359105318765632-1359105318765632. doi:10.1177/1359105318765632
Qaseem A, Kansagara D, Forciea MA, Cooke M, Denberg TD. Management of Chronic Insomnia Disorder in Adults: A Clinical Practice Guideline From the American College of Physicians. Annals of Internal 2016;165(2):125. doi:10.7326/M15-2175
Wilson S, Anderson K, Baldwin D, et al. British Association for Psychopharmacology consensus statement on evidence-based treatment of insomnia, parasomnias and circadian rhythm disorders: An Journal of Psychopharmacology. 2019;33(8):923-947. doi:10.1177/0269881119855343
Celesia M., Sofia S. A., Rapisarda L., et al. Anxiety, depression and sleep disturbances in hiv+ patients chronically treated with an Efavirenz-based regimen. Infectious Diseases & Tropical Medicine . 2017;3(2):e394.
Asboe D, Catalan J, Mandalia S, et Sexual dysfunction in HIV-positive men is multi-factorial: A study of prevalence and associated factors. AIDS Care - Psychological and Socio-Medical Aspects of AIDS/HIV. 2007;19(8):955-965. doi:10.1080/09540120701209847
Sandfort TGM, Collier KL, Grossberg R. Addressing sexual problems in HIV primary care: Experiences from patients. Archives of Sexual Behavior. 2013;42(7):1357-1368. doi:10.1007/ s10508-012-0009-5
Waters L, Fisher M, Winston A, et A phase IV, double-blind, multicentre, randomized, placebo- controlled, pilot study to assess the feasibility of switching individuals receiving Efavirenz with continuing central nervous system adverse events to etravirine. AIDS. 2011;25(1):65-71. doi:10.1097/QAD.0b013e328341685b
Pinzone MR, Gussio M, Bellissimo F, et Self-Reported Sexual Dysfunction in HIV-Positive
Laumann EO, Paik A, Rosen Sexual dysfunction in the United States: Prevalence and predictors.
Shamloul R, Ghanem Erectile dysfunction. The Lancet. 2013;381(9861):153-165. doi:10.1016/
Santi D, Brigante G, Zona S, Guaraldi G, Rochira Male sexual dysfunction and HIV-a clinical
Slag MF, Morley JE, Elson MK, et Impotence in Medical Clinic Outpatients. JAMA. 1983;249(13):1736-1740. doi:10.1001/jama.1983.03330370046029
Tsertsvadze A, Fink HA, Yazdi F, et al. Oral Phosphodiesterase-5 Inhibitors and Hormonal Treatments for Erectile Dysfunction: A Systematic Review and Meta-analysis. Annals of Internal 2009;151(9):650. doi:10.7326/0003-4819-151-9-200911030-00150
Brock G, Heiselman D, Maggi M, et al. Effect of Testosterone Solution 2% on Testosterone Concentration, Sex Drive and Energy in Hypogonadal Men: Results of a Placebo Controlled Journal of Urology. 2016;195(3):699-705. doi:10.1016/j.juro.2015.10.083
Cai T, Palumbo F, Liguori G, et al. The intra-meatal application of alprostadil cream (Vitaros®) improves drug efficacy and patient’s satisfaction: results from a randomized, two-administration route, cross-over clinical International Journal of Impotence Research. 2019;31(2):119-125. doi:10.1038/s41443-018-0087-6
Derouet H, Caspari D, Rohde V, Rommel G, Ziegler Treatment of erectile dysfunction with
Zhu Z, Zhao R, Hu Y. Symptom Clusters in People Living With HIV: A Systematic Review. Journal
Jong E, Oudhoff LA, Epskamp C, et Predictors and treatment strategies of HIV-related fatigue in the combined antiretroviral therapy era. AIDS. 2010;24(10):1387-1405. doi:10.1097/ QAD.0b013e328339d004
Bengtson AM, Pence BW, Crane HM, et Disparities in depressive symptoms and antidepressant treatment by gender and race/ethnicity among people living with HIV in the United States. PLoS ONE. 2016;11(8). doi:10.1371/journal.pone.0160738
Webel AR, Perazzo J, Decker M, Horvat-Davey C, Sattar A, Voss J. Physical activity is associated with reduced fatigue in adults living with HIV/AIDS. Journal of Advanced 2016;72(12):3104- 3112. doi:10.1111/jan.13084
Bertholet N, Cheng DM, Samet JH, Quinn E, Saitz R. Alcohol consumption patterns in HIV- infected adults with alcohol problems. Drug and Alcohol Dependence. 2010;112(1-2):160-163. doi:10.1016/j.drugalcdep.2010.05.009
Braithwaite RS, Conigliaro J, Roberts MS, et al. Estimating the impact of alcohol consumption on survival for HIV+ individuals. AIDS Care - Psychological and Socio-Medical Aspects of AIDS/HIV. 2007;19(4):459-466. doi:10.1080/09540120601095734
Lucas GM, Mullen BA, Weidle PJ, Hader S, McCaul ME, Moore RD. Directly Administered Antiretroviral Therapy in Methadone Clinics Is Associated with Improved HIV Treatment Outcomes, Compared with Outcomes among Concurrent Comparison Groups. Clinical Infectious Diseases. 2006;42(11):1628-1635. doi:10.1086/503905
Andersen R, Bozzette S, Shapiro M, et al. Access of vulnerable groups to antiretroviral therapy among persons in care for HIV disease in the United States. HCSUS Consortium. HIV Cost and Services Utilization Study. Health services research. 2000;35(2):389-416. https://Pubmed.ncbi. nih.gov/10857469
Cook RL, Sereika SM, Hunt SC, Woodward WC, Erlen JA, Conigliaro J. Problem drinking and medication adherence among persons with HIV infection. Journal of General Internal Medicine. 2001;16(2):83-88. doi:10.1111/j.1525-1497.2001.00122.x
Azar MM, Springer SA, Meyer JP, Altice FL. A systematic review of the impact of alcohol use disorders on HIV treatment outcomes, adherence to antiretroviral therapy and health care Drug and Alcohol Dependence. 2010;112(3):178-193. doi:10.1016/j.drugalcdep.2010.06.014
Wu ES, Metzger DS, Lynch KG, Douglas Association between alcohol use and HIV viral load. Journal of Acquired Immune Deficiency Syndromes. 2011;56(5). doi:10.1097/ QAI.0b013e31820dc1c8
Stein MD, Hanna L, Natarajan R, et al. Alcohol use patterns predict high-risk HIV behaviors among active injection drug users. Journal of Substance Abuse Treatment. 2000;18(4):359-363. doi:10.1016/S0740-5472(99)00070-7
Mathews WC, McCutchan JA, Asch S, et National estimates of HIV-related symptom prevalence from the HIV cost and services utilization study. Medical Care. 2000;38(7):750-761. doi:10.1097/00005650-200007000-00007
Shacham E, Agbebi A, Stamm K, Overton ET. Alcohol consumption is associated with poor health in HIV clinic patient population: A behavioral surveillance AIDS and Behavior. 2011;15(1):209- 213. doi:10.1007/s10461-009-9652-9
Palepu A, Horton NJ, Tibbetts N, Meli S, Samet Substance abuse treatment and hospitalization among a cohort of HIV-infected individuals with alcohol problems. Alcoholism: Clinical and Experimental Research. 2005;29(3):389-394. doi:10.1097/01.ALC.0000156101.84780.45
Korthuis PT, Tozzi MJ, Nandi V, et Improved quality of life for opioid-dependent patients receiving buprenorphine treatment in HIV clinics. Journal of Acquired Immune Deficiency Syndromes. 2011;56(SUPPL. 1). doi:10.1097/QAI.0b013e318209754c
Lucas GM, Griswold M, Gebo KA, Keruly J, Chaisson RE, Moore Illicit Drug Use and HIV- 1 Disease Progression: A Longitudinal Study in the Era of Highly Active Antiretroviral Therapy. American Journal of Epidemiology. 2006;163(5):412-420. doi:10.1093/aje/kwj059
Galvan FH, Bing EG, Fleishman JA, et al. The prevalence of alcohol consumption and heavy drinking among people with HIV in the United States: Results from the HIV cost and services utilization Journal of Studies on Alcohol. 2002;63(2):179-186. doi:10.15288/jsa.2002.63.179
Bagby GJ, Amedee AM, Siggins RW, Molina PE, Nelson S, Veazey Alcohol and HIV Effects on the Immune System. Alcohol research : current reviews. 2015;37(2):287-297. https://Pubmed. ncbi.nlm.nih.gov/26695751
Amedee A, Nichols W, Robichaux S, Bagby G, Nelson S. Chronic Alcohol Abuse and HIV Disease Progression: Studies with the Non-Human Primate Current HIV Research. 2014;12(4):243- 253. doi:10.2174/1570162x12666140721115717
Ludford KT, Vagenas P, Lama JR, et al. Screening for Drug and Alcohol Use Disorders and Their Association with HIV-Related Sexual Risk Behaviors among Men Who Have Sex with Men in PLoS ONE. 2013;8(8). doi:10.1371/journal.pone.0069966
Parry CD, Blank MB, Pithey AL. Responding to the threat of HIV among persons with mental illness and substance abuse. Current Opinion in Psychiatry. 2007;20(3):235-241. doi:10.1097/ 0b013e3280ebb5f0
Kader R, Govender R, Seedat S, Koch JR, Parry C. Understanding the impact of hazardous and harmful use of alcohol and/or other drugs on ARV adherence and disease progression. PLoS 2015;10(5). doi:10.1371/journal.pone.0125088
Pellowski JA, Kalichman SC, Kalichman MO, Cherry C. Alcohol-antiretroviral therapy interactive toxicity beliefs and daily medication adherence and alcohol use among people living with HIV. AIDS Care - Psychological and Socio-Medical Aspects of AIDS/HIV. 2016;28(8):963-970. doi:10. 1080/09540121.2016.1154134
Williams EC, Hahn JA, Saitz R, Bryant K, Lira MC, Samet Alcohol Use and Human Immunodeficiency Virus (HIV) Infection: Current Knowledge, Implications, and Future Directions. Alcoholism: Clinical and Experimental Research. 2016;40(10):2056-2072. doi:10.1111/acer.13204
Kelso NE, Sheps DS, Cook RL. The association between alcohol use and cardiovascular disease among people living with HIV: A systematic American Journal of Drug and Alcohol Abuse. 2015;41(6):479-488. doi:10.3109/00952990.2015.1058812
McGinnis KA, Fultz SL, Skanderson M, Conigliaro J, Bryant K, Justice Hepatocellular carcinoma and non-Hodgkin’s lymphoma: The roles of HIV, hepatitis C infection, and alcohol abuse. Journal of Clinical Oncology. 2006;24(31):5005-5009. doi:10.1200/JCO.2006.05.7984
Fein G, Biggins CA, MacKay S. Alcohol abuse and HIV infection have additive effects on frontal cortex function as measured by auditory evoked potential P3A latency. Biological Psychiatry. 1995;37(3):183-195. doi:10.1016/0006-3223(94)00119-N
Gongvatana A, Morgan EE, Iudicello JE, Letendre SL, Grant I, Woods SP. A history of alcohol dependence augments HIV-associated neurocognitive deficits in persons aged 60 and older. Journal of 2014;20(5):505-513. doi:10.1007/s13365-014-0277-z
Pérez-Molina JA, Polo R, López-Aldeguer J, et al. Executive summary of the GeSIDA/National AIDS Plan consensus document on antiretroviral therapy in adults infected by the human immunodeficiency virus (updated January 2018). Enfermedades Infecciosas y Microbiologia 2019;37(3):195-202. doi:10.1016/j.eimc.2018.02.010
Mcdowell JA, Chittick GE, Stevens CP, Edwards KD, Stein DS. Pharmacokinetic interaction of Abacavir (1592U89) and ethanol in human immunodeficiency virus-infected adults. Antimicrobial Agents and 2000;44(6):1686-1690. doi:10.1128/AAC.44.6.1686-1690.2000
McCance-Katz EF, Gruber VA, Beatty G, Lum PJ, Rainey Interactions between alcohol and the antiretroviral medications Ritonavir or Efavirenz. Journal of Addiction Medicine. 2013;7(4):264- 270. doi:10.1097/ADM.0b013e318293655a
Gruber VA, Rainey PM, Lum PJ, Beatty GW, Aweeka FT, McCance-Katz Interactions between
Lifson AR, Neuhaus J, Arribas JR, van Berg-Wolf M den, Labriola AM, Read TRH. Smoking- related health risks among persons with HIV in the strategies for management of antiretroviral therapy clinical trial. American Journal of Public Health. 2010;100(10):1896-1903. doi:10.2105/ 2009.188664
Lifson AR, Lando HA. Smoking and HIV: Prevalence, health risks, and cessation strategies. Current HIV/AIDS 2012;9(3):223-230. doi:10.1007/s11904-012-0121-0
Zyambo CM, Burkholder GA, Cropsey KL, et al. Predictors of smoking cessation among people living with HIV receiving routine clinical care. AIDS Care - Psychological and Socio-Medical Aspects of AIDS/HIV. 2019;31(11):1353-1361. doi:10.1080/09540121.2019.1619659
Helleberg M, May MT, Ingle SM, et Smoking and life expectancy among HIV-infected individuals on antiretroviral therapy in Europe and North America. AIDS. 2015;29(2):221-229. doi:10.1097/ QAD.0000000000000540
Petoumenos K, Worm S, Reiss P, et Rates of cardiovascular disease following smoking cessation in patients with HIV infection: Results from the D:A:D study. HIV Medicine. 2011;12(7):412-421. doi:10.1111/j.1468-1293.2010.00901.x
Shepherd L, Ryom L, Law M, et al. Cessation of Cigarette Smoking and the Impact on Cancer Incidence in Human Immunodeficiency Virus–infected Persons: The Data Collection on Adverse Events of Anti-HIV Drugs Clinical Infectious Diseases. 2018;68(4):650-657. doi:10.1093/cid/ ciy508
Vidrine DJ, Arduino RC, Gritz ER. The effects of smoking abstinence on symptom burden and quality of life among persons living with HIV/AIDS. AIDS Patient Care and 2007;21(9):659- 666. doi:10.1089/apc.2007.0022
Reddy KP, Parker RA, Losina E, et Impact of Cigarette Smoking and Smoking Cessation on Life Expectancy Among People With HIV: A US-Based Modeling Study. The Journal of Infectious Diseases. 2016;214(11):1672-1681. doi:10.1093/infdis/jiw430
Tait RJ, Caldicott D, Mountain D, Hill SL, Lenton S. A systematic review of adverse events arising from the use of synthetic cannabinoids and their associated treatment. Clinical Toxicology. 2016;54(1):1-13. doi:10.3109/15563650.2015.1110590
Fogarty A, Rawstorne P, Prestage G, Crawford J, Grierson J, Kippax S. Marijuana as therapy for people living with HIV/AIDS: Social and health aspects. AIDS Care - Psychological and Socio- Medical Aspects of AIDS/HIV. 2007;19(2):295-301. doi:10.1080/09540120600841930
Furler MD, Einarson TR, Millson M, Walmsley S, Bendayan R. Medicinal and Recreational Marijuana Use by Patients Infected with HIV. AIDS Patient Care and STDs. 2004;18(4):215-228. doi:10.1089/108729104323038892
Prentiss D, Power R, Balmas G, Tzuang G, Israelski Patterns of Marijuana Use among Patients with HIV/AIDS Followed in a Public Health Care Setting. Journal of Acquired Immune Deficiency Syndromes. 2004;35(1):38-45. doi:10.1097/00126334-200401010-00005
Woolridge E, Barton S, Samuel J, Osorio J, Dougherty A, Holdcroft A. Cannabis use in HIV for pain and other medical symptoms. Journal of Pain and Symptom Management. 2005;29(4):358- doi:10.1016/j.jpainsymman.2004.07.011
Bonn-Miller MO, Oser ML, Bucossi MM, Trafton Cannabis use and HIV antiretroviral therapy adherence and HIV-related symptoms. Journal of Behavioral Medicine. 2014;37(1):1-10. doi:10.1007/s10865-012-9458-5
Lake S, Kerr T, Capler R, Shoveller J, Montaner J, Milloy High-intensity cannabis use and HIV clinical outcomes among HIV-positive people who use illicit drugs in Vancouver, Canada. International Journal of Drug Policy. 2017;42:63-70. doi:10.1016/j.drugpo.2017.02.009
Sinha S, McCaul ME, Hutton HE, et al. Marijuana use and HIV treatment outcomes among PWH receiving care at an urban HIV clinic. Journal of Substance Abuse Treatment. 2017;82:102-106. doi:10.1016/j.jsat.2017.09.009
Fuster-RuizdeApodaca MJ, Castro-Granell V, Garin N, et al. Prevalence and patterns of illicit drug use in people living with HIV in Spain: A cross-sectional PLoS ONE. 2019;14(6). doi:10.1371/ journal.pone.0211252
Baum MK, Rafie C, Lai S, Sales S, Page B, Campa A. Crack-cocaine use accelerates HIV disease progression in a cohort of HIV-positive drug users. Journal of Acquired Immune Deficiency 2009;50(1):93-99. doi:10.1097/QAI.0b013e3181900129
Shoptaw S, Stall R, Bordon J, et al. Cumulative exposure to stimulants and immune function outcomes among HIV-positive and HIV-negative men in the Multicenter AIDS Cohort Study. International Journal of STD and 2012;23(8):576-580. doi:10.1258/ijsa.2012.011322
Mukerji S, Haghighat R, Misra V, et al. Longitudinal Modeling of Depressive Trajectories Among HIV-Infected Men Using AIDS and Behavior. 2017;21(7):1985-1995. doi:10.1007/s10461- 017-1801-y
European Monitoring Centre for Drugs and Drug Addiction (EMCDDA). Emergency health consequences of cocaine use in Europe. A review of the monitoring of drug-related acute emergencies in 30 European countries | emcdda.europa.eu. Published 2014. Accessed June 19, 2020. https://www.emcdda.europa.eu/publications/scientific-studies/2014/cocaine- emergencies_en
Informe Europeo sobre Drogas Tendencias y doi:10.2810/295940
Montain J, Ti L, Hayashi K, Nguyen P, Wood E, Kerr T. Impact of length of injecting career on HIV incidence among people who inject Addictive Behaviors. 2016;58:90-94. doi:10.1016/j. addbeh.2016.02.020
Peters PJ, Pontones P, Hoover KW, et HIV infection linked to injection use of oxymorphone in Indiana, 2014-2015. New England Journal of Medicine. 2016;375(3):229-239. doi:10.1056/ NEJMoa1515195
Bourne A, Reid D, Hickson F, Torres-Rueda S, Weatherburn P. Illicit drug use in sexual settings (‘chemsex’) and HIV/STI transmission risk behaviour among gay men in South London: Findings from a qualitative study. Sexually Transmitted Infections. 2015;91(8):564-568. doi:10.1136/ sextrans-2015-052052
Fernández Dávila “Sesión de sexo, morbo y vicio”: una aproximación holística para entender la aparición del fenómeno ChemSex entre hombres gais, bisexuales y otros hombres que tienen sexo con hombres en España. Revista Multidisciplinar del SIDA. 2016;4:41-65.
Payancé A, Scotto B, Perarnau JM, de Muret A, Bacq Y. Severe chronic hepatitis secondary to prolonged use of ecstasy and cocaine. Clinics and Research in Hepatology and Gastroenterology. 2013;37(5). doi:10.1016/j.clinre.2013.06.003
Rodríguez Salgado B. Fenetilaminas Clásicas: MDMA y Sus Análogos, p-Metoxianfetaminas y En: Nuevas Drogas Psicoactivas. . Entheos; 2015.
Dolengevich-Segal H, Rodríguez Salgado B, Ramírez JGA, Sánchez-Mateos D. Nuevas Drogas Vol Cap 5. Entheos; 2015. doi:10.20882/adicciones.709
Swanson Unifying theories of psychedelic drug effects. Frontiers in Pharmacology. 2018;9(MAR). doi:10.3389/fphar.2018.00172
Vollenweider Brain mechanisms of hallucinogens and entactogens. Dialogues in clinical neuroscience. 2001;3:265-279.
Nichols D, Grob Is LSD toxic? Forensic science international. 2018;284:141-145. doi:10.1016/j. forsciint.2018.01.006
Hildebrand M. The psychometric properties of the drug use disorders identification test (DUDIT): A review of recent Journal of Substance Abuse Treatment. 2015;53:52-59. doi:10.1016/j. jsat.2015.01.008
Saunders JB, Aasland OG, Babor TF, de La Fuente JR, Grant Development of the Alcohol Use Disorders Identification Test (AUDIT): WHO Collaborative Project on Early Detection of Persons with Harmful Alcohol Consumption‐II. Addiction. 1993;88(6):791-804. doi:10.1111/j.1360-0443.1993. tb02093.x
Gates PJ, Sabioni P, Copeland J, le Foll B, Gowing Psychosocial interventions for cannabis use disorder. Cochrane Database of Systematic Reviews. 2016;2016(5). doi:10.1002/14651858. CD005336.pub4
Wechsberg WM, Golin C, El-Bassel N, Hopkins J, Zule W. Current interventions to reduce sexual risk behaviors and crack cocaine use among HIV-infected individuals. Current HIV/AIDS Reports. 2012;9(4):385-393. doi:10.1007/s11904-012-0131-y
Gonzales D, Rennard SI, Nides M, et al. Varenicline, an α4β2 nicotinic acetylcholine receptor partial agonist, vs sustained-release Bupropion and placebo for smoking cessation: A randomized controlled trial. Journal of the American Medical Association. 2006;296(1):47-55. doi:10.1001/ 296.1.47
West R, Baker CL, Cappelleri JC, Bushmakin AG. Effect of varenicline and Bupropion SR on craving, nicotine withdrawal symptoms, and rewarding effects of smoking during a quit attempt. 2008;197(3):371-377. doi:10.1007/s00213-007-1041-3
Amodei N, Lamb RJ. The Role of Nicotine Replacement Therapy in Early Quitting Success. Nicotine & tobacco research : official journal of the Society for Research on Nicotine and 2010;12(1):1-10. doi:10.1093/NTR/NTP164
World Health Organisation. Consolidated ARV guidelines on the use of antiretroviral drugs for treating and preventing HIV infection: recommendations for a public health approach. Geneva: World Health Published 2013. Accessed June 19, 2020. http://www.who.int/hiv/pub/ guidelines/arv2013/
Beauverie P, Taburet AM, Dessalles MC, Furlan V, Touzeau D. Therapeutic Drug Monitoring of Methadone in HIV-infected Patients Receiving Protease AIDS . 1998;12(18):2510-2511.
Clarke S, Mulcahy F, Bergin C, et al. Absence of Opioid Withdrawal Symptoms in Patients Receiving Methadone and the Protease Inhibitor Lopinavir‐Ritonavir. Clinical Infectious Diseases. 2002;34(8):1143-1145. doi:10.1086/339541
Clarke SM, Mulcahy FM, Tjia J, et al. Pharmacokinetic Interactions of Nevirapine and Methadone and Guidelines for Use of Nevirapine to Treat Injection Drug Users. Clinical Infectious Diseases. 2001;33(9):1595-1597. doi:10.1086/322519
Ostrow DG, Plankey MW, Cox C, et al. Specific sex drug combinations contribute to the majority of recent HIV seroconversions among MSM in the MACS. Journal of Acquired Immune Deficiency 2009;51(3):349-355. doi:10.1097/QAI.0b013e3181a24b20
Kenyon C, Wouters K, Platteau T, Buyze J, Florence E. Increases in condomless chemsex associated with HIV acquisition in MSM but not heterosexuals attending a HIV testing center in Antwerp, AIDS Research and Therapy. 2018;15(1). doi:10.1186/s12981-018-0201-3
Dolengevich-Segal H, Gonzalez-Baeza A, Valencia J, et al. Drug-related and psychopathological symptoms in HIV-positive men who have sex with men who inject drugs during sex (slamsex): Data from the U-SEX GeSIDA 9416 PLoS ONE. 2019;14(12). doi:10.1371/journal.pone.0220272
World Federation for Mental Health SALUD MENTAL EN ATENCIÓN PRIMARIA: MEJORANDO LOS TRATAMIENTOS Y PROMOVIENDO LA SALUD MENTAL. Accessed June 25, 2020. http:// www.infocop.es/view_article.asp?id=2582
Forstein M, Cournos F, Douaihy A, Goodkin K, Wainberg ML, Wapenyi Guideline Watch:
Kendall CE, Shoemaker ES, Boucher L, et al. The organizational attributes of HIV care delivery models in Canada: A cross-sectional PLoS ONE. 2018;13(6). doi:10.1371/journal. pone.0199395
Haggerty JL, Roberge D, Freeman GK, Beaulieu C. Experienced continuity of care when patients see multiple clinicians: A qualitative metasummary. Annals of Family Medicine. 2013;11(3):262- doi:10.1370/afm.1499
Tran BX, Ho RCM, Ho CSH, et Depression among patients with HIV/AIDS: Research development and effective interventions (gapresearch). International Journal of Environmental Research and Public Health. 2019;16(10). doi:10.3390/ijerph16101772
Eshun-Wilson I, Siegfried N, Akena DH, Stein DJ, Obuku EA, Joska JA. Antidepressants for depression in adults with HIV Cochrane Database of Systematic Reviews. 2018;2018(1). doi:10.1002/14651858.CD008525.pub3
Hill L, Lee KC. Pharmacotherapy considerations in patients with HIV and psychiatric disorders: Focus on antidepressants and antipsychotics. Annals of Pharmacotherapy. 2013;47(1):75-89. doi:10.1345/aph.1R343
DeSilva KE, le Flore DB, Marston BJ, Rimland D. Serotonin syndrome in HIV-infected individuals receiving antiretroviral therapy and AIDS. 2001;15(10):1281-1285. doi:10.1097/00002030- 200107060-00010
Cettomai D, McArthur JC. Mirtazapine use in human immunodeficiency virus-infected patients with progressive multifocal leukoencephalopathy. Archives of Neurology. 2009;66(2):255-258. doi:10.1001/archneurol.2008.557
Jann MW, Spratlin V, Momary K, et al. Lack of a pharmacokinetic drug-drug interaction with venlafaxine extended-release/indinavir and desvenlafaxine extended-release/indinavir. European Journal of Clinical 2012;68(5):715-721. doi:10.1007/s00228-011-1180-7
Park J, Vousden M, Brittain C, et al. Dose-related reduction in Bupropion plasma concentrations by Journal of Clinical Pharmacology. 2010;50(10):1180-1187. doi:10.1177/0091270009359524
Pedrol-Clotet E, Deig-Comerma E, Ribell-Bachs M, Vidal-Castell I, García-Rodríguez P, Soler
Uso de bupropión en la deshabituación tabáquica en pacientes infectados por el VIH en tratamiento antirretroviral. Enfermedades Infecciosas y Microbiologia Clinica. 2006;24(8):509-511. doi:10.1157/13092468
Adams JL, Gaynes BN, McGuinness T, Modi R, Willig J, Pence BW. Treating depression within the HIV medical home: A guided algorithm for antidepressant management by HIV clinicians. AIDS Patient Care and 2012;26(11):647-654. doi:10.1089/apc.2012.0113
Pettersson A, Boström KB, Gustavsson P, Ekselius Which instruments to support diagnosis of depression have sufficient accuracy? A systematic review. Nordic Journal of Psychiatry. 2015;69(7):497-508. doi:10.3109/08039488.2015.1008568
Newville H, Roley J, Sorensen Prescription medication misuse among HIV-infected individuals taking antiretroviral therapy. Journal of Substance Abuse Treatment. 2015;48(1):56-61. doi:10.1016/j.jsat.2014.07.013
Johannessen Landmark C. Antiepileptic drugs in non-epilepsy disorders: Relations between mechanisms of action and clinical CNS Drugs. 2008;22(1):27-47. doi:10.2165/00023210- 200822010-00003
HIV Drug University of Liverpool. Accessed June 26, 2020. https://liverpool-hiv-hep. s3.amazonaws.com/prescribing_resources/pdfs/000/000/023/original/TS_Antipsychotic_2019_ Oct.pdf?1571043424
Owen-Smith A, Depadilla L, Diclemente R. The assessment of complementary and alternative medicine use among individuals with HIV: A systematic review and recommendations for future Journal of Alternative and Complementary Medicine. 2011;17(9):789-796. doi:10.1089/ acm.2010.0669
Panel de expertos de GeSIDA y Plan Nacional sobre el Documento de Consenso de GeSIDA/ Plan Nacional Sobre El SIDA Respecto al Tratamiento Antirretroviral En Adultos Infectados Por El Virus de La Inmunodeficiencia Humana.; 2019. Accessed June 25, 2020. http://GeSIDA-seimc. org/wp-content/uploads/2019/01/GeSIDA_DC_TAR_2019_v_final.pdf.
Thomas Mulet V, Aguado Taberna C, Fidalgo Gónzalez S, et La infección por el VIH/SIDA y atención primaria. Atención Primaria. 2004;33(1):3-5. Accessed June 23, 2020. http://www. elsevier.es/es-revista-atencion-primaria-27-articulo-la-infeccion-por-el-vih-SIDA-13056498
Gallego Deike L, Gordillo Álvarez-Valdés M v. Trastornos mentales en pacientes infectados por el
Gordillo V. Trastornos psicológicos y aspectos psicosociales. Manual del SIDA. Published online 1999:605-620.
Casanova Colominas JM, Carmen Rodríguez Fernández M, Gómez García Manejo del paciente con VIH en Atención Primaria. AMF. 2013;9:306-315.
Núñez Rojas AC, Tobón S, Vinaccia Diseño de Un Modelo de Intervención Psicoterapéutica En El Área de La Salud a Partir Del Enfoque Procesal Del Estrés. Vol 13. Universidad de los Andes.; 2006. Accessed June 23, 2020. http://www.scielo.org.co/scielo.php?script=sci_ arttext&pid=S0123-885X2004000200007&lng=en&nrm=iso&tlng=es
Jin Y, Potthoff A, Xu J, et al. Evaluation of Mental Status HIV-Infected Patients: Implications for Treatment. Current HIV Research. 2012;10(6):546-551. doi:10.2174/157016212802429857
Balfour L, Kowal J, Silverman A, et al. A randomized controlled psycho-education intervention trial: Improving psychological readiness for successful HIV medication adherence and reducing depression before initiating HAART. AIDS Care - Psychological and Socio-Medical Aspects of AIDS/HIV. 2006;18(7):830-838. doi:10.1080/09540120500466820
Hill S, Kavookjian J. Motivational interviewing as a behavioral intervention to increase HAART adherence in patients who are HIV-positive: A systematic review of the literature. AIDS Care - Psychological and Socio-Medical Aspects of AIDS/HIV. 2012;24(5):583-592. doi:10.1080/095401 2011.630354
Hollon SD, DeRubeis RJ, Shelton RC, et al. Prevention of relapse following cognitive therapy vs medications in moderate to severe depression. Archives of General Psychiatry. 2005;62(4):417- doi:10.1001/archpsyc.62.4.417
Parikh S v., Segal Z v., Grigoriadis S, et al. Canadian Network for Mood and Anxiety Treatments (CANMAT) Clinical guidelines for the management of major depressive disorder in adults. II. Psychotherapy alone or in combination with antidepressant medication. Journal of Affective 2009;117(SUPPL. 1). doi:10.1016/j.jad.2009.06.042
Spies G, Asmal L, Seedat S. Cognitive-behavioural interventions for mood and anxiety disorders in HIV: A systematic review. Journal of Affective Disorders. 2013;150(2):171-180. doi:10.1016/j. 2013.04.018
Brown JL, Vanable PA. Cognitive-behavioral stress management interventions for persons living with HIV: A review and critique of the Annals of Behavioral Medicine. 2008;35(1):26-40. doi:10.1007/s12160-007-9010-y
Markowitz JC, Kocsis JH, Fishman B, et al. Treatment of depressive symptoms in human immunodeficiency virus- positive patients. Archives of General Psychiatry. 1998;55(5):452-457. doi:10.1001/archpsyc.55.5.452
Markowitz J, Spielman L, Sullivan M, Fishman An Exploratory Study of Ethnicity and Psychotherapy Outcome Among HIV-Positive Patients With Depressive Symptoms. The Journal of psychotherapy practice and research. 2000;9:226-231.
Gayner B, Esplen MJ, de Roche P, et A randomized controlled trial of mindfulness-based stress reduction to manage affective symptoms and improve quality of life in gay men living with HIV. Journal of Behavioral Medicine. 2012;35(3):272-285. doi:10.1007/s10865-011-9350-8
Creswell JD, Myers HF, Cole SW, Irwin MR. Mindfulness meditation training effects on CD4+ T lymphocytes in HIV-1 infected adults: A small randomized controlled trial. Brain, Behavior, and 2009;23(2):184-188. doi:10.1016/j.bbi.2008.07.004
Seyedalinaghi S, Jam S, Foroughi M, et al. Randomized controlled trial of mindfulness-based stress reduction delivered to human immunodeficiency virus-positive patients in Iran: Effects on CD4 + T lymphocyte count and medical and psychological symptoms. Psychosomatic Medicine. 2012;74(6):620-627. doi:10.1097/PSY.0b013e31825abfaa
Gonzalez-Garcia M, Ferrer MJ, Borras X, et al. Effectiveness of mindfulness-based cognitive therapy on the quality of life, emotional status, and CD4 cell count of patients aging with HIV AIDS and Behavior. 2014;18(4):676-685. doi:10.1007/s10461-013-0612-z
World Health Risks to Mental Health : An Overview of Vulnerabilities and Risk
Vreeman RC, McCoy BM, Lee S. Mental health challenges among adolescents living with HIV. Journal of the International AIDS 2017;20(Suppl 3). doi:10.7448/IAS.20.4.21497
Donenberg GR, Pao Youths and HIV/AIDS: Psychiatry’s role in a changing epidemic. Journal of the American Academy of Child and Adolescent Psychiatry. 2005;44(8):728-747. doi:10.1097/01. chi.0000166381.68392.02
González-Scarano F, Martín-García The neuropathogenesis of AIDS. Nature Reviews Immunology. 2005;5(1):69-81. doi:10.1038/nri1527
Marhefka SL, Lyon M, Koenig LJ, et Emotional and behavioral problems and mental health service utilization of youth living with HIV acquired perinatally or later in life. AIDS Care - Psychological and Socio-Medical Aspects of AIDS/HIV. 2009;21(11):1447-1454. doi:10.1080/09540120902883085
García-Navarro C, García I, Medín G, et Aspectos psicosociales en una cohorte de adolescentes con infección por el virus de la inmunodeficiencia humana por transmisión vertical. NeuroCoRISpeS. Enfermedades Infecciosas y Microbiologia Clinica. 2014;32(10):631-637. doi:10.1016/j.eimc.2013.11.008
Mellins CA, Brackis-Cott E, Leu CS, et al. Rates and types of psychiatric disorders in perinatally human immunodeficiency virus-infected youth and Journal of Child Psychology and Psychiatry and Allied Disciplines. 2009;50(9):1131-1138. doi:10.1111/j.1469-7610.2009.02069.x
Mellins CA, Malee Understanding the mental health of youth living with perinatal HIV infection: Lessons learned and current challenges. Journal of the International AIDS Society. 2013;16(1). doi:10.7448/IAS.16.1.18593
le Prevost M, Arenas-Pinto A, Melvin D, et al. Anxiety and depression symptoms in young people with perinatally acquired HIV and HIV affected young people in AIDS Care - Psychological and Socio-Medical Aspects of AIDS/HIV. 2018;30(8):1040-1049. doi:10.1080/09540121.2018.144 1972
Kapetanovic S, Wiegand RE, Dominguez K, et Associations of medically documented psychiatric diagnoses and risky health behaviors in highly active antiretroviral therapy-experienced perinatally HIV-infected youth. AIDS Patient Care and STDs. 2011;25(8):493-501. doi:10.1089/apc.2011.0107
Woods SP, Moore DJ, Weber E, Grant I. Cognitive neuropsychology of HIV-associated neurocognitive Neuropsychology Review. 2009;19(2):152-168. doi:10.1007/s11065-009- 9102-5
van den Hof M, ter Haar AM, Scherpbier HJ, et al. Neurocognitive Development in Perinatally Human Immunodeficiency Virus–infected Adolescents on Long-term Treatment, Compared to Healthy Matched Controls: A Longitudinal Study. Clinical Infectious Diseases. 2020;32:21-29. doi:10.1093/cid/ciz386
Robbins RN, Zimmerman R, Korich R, et al. Longitudinal trajectories of neurocognitive test performance among individuals with perinatal HIV-infection and -exposure: adolescence through young adulthood. AIDS Care - Psychological and Socio-Medical Aspects of AIDS/HIV. 2020;32(1):21-29. doi:10.1080/09540121.2019.1626343
Williams PL, Storm D, Montepiedra G, et al. Predictors of adherence to antiretroviral medications in children and adolescents with HIV infection. Pediatrics. 2006;118(6). doi:10.1542/peds.2006- 0493
Murphy DA, Wilson CM, Durako SJ, Muenz LR, Belzer M. Antiretroviral medication adherence among the REACH HIV-infected adolescent cohort in the USA. AIDS Care - Psychological and Socio-Medical Aspects of AIDS/HIV. 2001;13(1):27-40. doi:10.1080/09540120020018161
Kang E, Delzell DAP, Chhabra M, Oberdorfer Factors associated with high rates of antiretroviral medication adherence among youth living with perinatal HIV in Thailand. International Journal of STD and AIDS. 2015;26(8):534-541. doi:10.1177/0956462414545524
Capilla M, Montes M, Gómez M, Barrio V. Primera adaptación del CDI-S a población española. Acción psicológica, ISSN 1578-908X, Vol 1, No 3, 2002, pags 263-272. 2002;1.
Masip A, Amador-Campos J, Cebollero M. Características psicométricas de la Reynolds Adolescent Depression Scale en población comunitaria y clínica. International Journal of Clinical and Health 2008;8.
Herrero MJ, Blanch J, Peri JM, de Pablo J, Pintor L, Bulbena A. A validation study of the hospital anxiety and depression scale (HADS) in a Spanish population. General Hospital Psychiatry. 2003;25(4):277-283. doi:10.1016/S0163-8343(03)00043-4
Richardson LP, Rockhill C, Russo JE, et Evaluation of the PHQ-2 as a brief screen for detecting major depression among adolescents. Pediatrics. 2010;125(5). doi:10.1542/peds.2009-2712
Berger BE, Ferrans CE, Lashley Measuring stigma in people with HIV: Psychometric assessment of the HIV stigma scale. Research in Nursing and Health. 2001;24(6):518-529. doi:10.1002/nur.10011
Bussing R, Fernandez M, Harwood M, et al. Parent and teacher SNAP-IV ratings of attention deficit hyperactivity disorder symptoms: Psychometric properties and normative ratings from a school district Assessment. 2008;15(3):317-328. doi:10.1177/1073191107313888
Duncan L, Georgiades K, Wang L, et al. Psychometric evaluation of the Mini International Neuropsychiatric Interview for Children and Adolescents (MINI-KID). Psychological Assessment. 2018;30(7):916-928. doi:10.1037/pas0000541
Malhotra S, Padhy SK. Challenges in Providing Child and Adolescent Psychiatric Services in Low Resource Countries. Child and Adolescent Psychiatric Clinics of North America. 2015;24(4):777- doi:10.1016/j.chc.2015.06.007
Philbin MM, Tanner AE, Chambers BD, et Transitioning HIV-infected adolescents to adult care
Skeen SA, Sherr L, Croome N, et al. Interventions to improve psychosocial well-being for children affected by HIV and AIDS: a systematic review. Vulnerable Children and Youth Studies. 2017;12(2):91-116. doi:10.1080/17450128.2016.1276656
McKay MM, Chasse KT, Paikoff R, et al. Family-level impact of the CHAMP family program: A community collaborative effort to support urban families and reduce youth HIV risk exposure. Family 2004;43(1):79-93. doi:10.1111/j.1545-5300.2004.04301007.x
Brown LK, Kennard BD, Emslie GJ, et al. Effective Treatment of Depressive Disorders in Medical Clinics for Adolescents and Young Adults Living with HIV: A Controlled Trial. Journal of Acquired Immune Deficiency 2016;71(1):38-46. doi:10.1097/QAI.0000000000000803
Kennard BD, Brown LT, Hawkins L, et Development and implementation of health and wellness CBT for individuals with depression and HIV. Cognitive and Behavioral Practice. 2014;21(2):237- 246. doi:10.1016/j.cbpra.2013.07.003
Bhana A, McKay MM, Mellins C, Petersen I, Bell C. Family-based HIV prevention and intervention services for youth living in poverty-affected contexts: The CHAMP model of collaborative, evidence- informed programme Journal of the International AIDS Society. 2010;13(SUPPL. 2). doi:10.1186/1758-2652-13-S2-S8
Belfer ML. Critical review of world policies for mental healthcare for children and adolescents. Current Opinion in 2007;20(4):349-352. doi:10.1097/YCO.0b013e3281bc0cf4
Transitioning HIV-infected youth into adult health Pediatrics. 2013;132(1):192-197. doi:10.1542/ peds.2013-1073
Valcour V, Chalermchai T, Sailasuta N, et Central Nervous System Viral Invasion and
doi:10.1093/infdis/jis326
Gras G, Kaul M. Molecular mechanisms of neuroinvasion by monocytes-macrophages in HIV-1 Retrovirology. 2010;7. doi:10.1186/1742-4690-7-30
Vitkovic L, Tardieu M. Neuropathogenesis of HIV-1 infection. Outstanding questions. Comptes Rendus de l’Academie des Sciences - Serie III. 1998;321(12):1015-1021. doi:10.1016/S0764- 4469(99)80057-2
Saylor D, Dickens AM, Sacktor N, et al. HIV-associated neurocognitive disorder - Pathogenesis and prospects for treatment. Nature Reviews Neurology. 2016;12(4):234-248. doi:10.1038/ 2016.27
Lindl KA, Marks DR, Kolson DL, Jordan-Sciutto KL. HIV-associated neurocognitive disorder: Pathogenesis and therapeutic Journal of Neuroimmune Pharmacology.
Vago L, Bonetto S, Nebuloni M, et al. Pathological findings in the central nervous system of AIDS patients on assumed antiretroviral therapeutic regimens: Retrospective study of 1597 autopsies. 2002;16(14):1925-1928. doi:10.1097/00002030-200209270-00009
Fois AF, Brew The Potential of the CNS as a Reservoir for HIV-1 Infection: Implications for HIV Eradication. Current HIV/AIDS Reports. 2015;12(2):299-303. doi:10.1007/s11904-015-0257-9
Canestri A, Lescure F, Jaureguiberry S, et al. Discordance Between Cerebral Spinal Fluid and Plasma HIV Replication in Patients with Neurological Symptoms Who Are Receiving Suppressive Antiretroviral Clinical Infectious Diseases. 2010;50(5):773-778. doi:10.1086/650538
Churchill MJ, Gorry PR, Cowley D, et al. Use of laser capture microdissection to detect integrated HIV-1 DNA in macrophages and astrocytes from autopsy brain tissues. Journal of NeuroVirology. 2006;12(2):146-152. doi:10.1080/13550280600748946
Cassol E, Misra V, Dutta A, Morgello S, Gabuzda D. Cerebrospinal fluid metabolomics reveals altered waste clearance and accelerated aging in HIV patients with neurocognitive impairment. 2014;28(11):1579-1591. doi:10.1097/QAD.0000000000000303
Ancuta P, Kamat A, Kunstman KJ, et al. Microbial translocation is associated with increased monocyte activation and dementia in AIDS patients. PLoS ONE. 2008;3(6). doi:10.1371/journal. 0002516
Fauci AS, Marston Ending the HIV-AIDS pandemic - Follow the science. New England Journal of Medicine. 2015;373(23):2197-2199. doi:10.1056/NEJMp1502020
Etherton MR, Lyons JL, Ard KL. HIV-associated Neurocognitive Disorders and Antiretroviral Therapy: Current Concepts and Controversies. Current Infectious Disease Reports. 2015;17(6). doi:10.1007/s11908-015-0485-6
Robertson K, Liner J, Meeker RB. Antiretroviral neurotoxicity. Journal of NeuroVirology. 2012;18(5):388-399. doi:10.1007/s13365-012-0120-3
Rojas-Celis V, Valiente-Echeverría F, Soto-Rifo R, Toro-Ascuy D. New Challenges of HIV-1 Infection: How HIV-1 Attacks and Resides in the Central Nervous Cells. 2019;8(10):1245. doi:10.3390/cells8101245
Antinori A, Arendt G, Becker JT, et Updated research nosology for HIV-associated neurocognitive disorders. Neurology. 2007;69(18):1789-1799. doi:10.1212/01.WNL.0000287431.88658.8b
Robertson KR, Smurzynski M, Parsons TD, et al. The prevalence and incidence of neurocognitive impairment in the HAART AIDS. 2007;21(14):1915-1921. doi:10.1097/QAD.0b013e32828e4e27
Pérez-Valero I, González-Baeza A, Estébanez M, et al. Neurocognitive Impairment in Patients Treated with Protease Inhibitor Monotherapy or Triple Drug Antiretroviral Therapy. PLoS ONE. 2013;8(7). doi:10.1371/journal.pone.0069493
Portilla I, Reus S, León R, et al. Neurocognitive Impairment in Well-Controlled HIV-Infected Patients: A Cross-Sectional AIDS Research and Human Retroviruses. 2019;35(7):634- 641. doi:10.1089/aid.2018.0279
Muñoz-Moreno JA, Pérez-Álvarez N, Muñoz-Murillo A, et Classification models for neurocognitive impairment in HIV infection based on demographic and clinical variables. PLoS ONE. 2014;9(9). doi:10.1371/journal.pone.0107625
CASADO JL, BAYÓN C, PÉREZ VALERO I, et Estudio transversal para evaluar y analizar la prevalencia de detección positiva de síntomas de ansiedad, depresión y deterioro neurocognitivo en pacientes infectados por el VIH-1: estudio CRANIum. Subanálisis por sexos de la población española. SIDA STUDI. Enfermedades Infecciosas y Microbiología Clínica. 2012;30:26-27. Accessed June 23, 2020. http://www.sidastudi.org/es/registro/ff8081813b4c32e8013bff80010100d6
Heaton RK, Franklin DR, Deutsch R, et al. Neurocognitive Change in the Era of HIV Combination Antiretroviral Therapy: The Longitudinal CHARTER Clinical Infectious Diseases. 2015;60(3):473-480. doi:10.1093/cid/ciu862
Pérez-Valero I, González-Baeza A, Estébanez M, et A prospective cohort study of neurocognitive function in aviremic HIV-infected patients treated with 1 or 3 antiretrovirals. Clinical infectious diseases : an official publication of the Infectious Diseases Society of America. 2014;59(11):1627- 1634. doi:10.1093/cid/ciu640
Langford D, Grigorian A, Hurford R, Adame A, Crews L, Masliah E. The role of mitochondrial alterations in the combined toxic effects of human immunodeficiency virus Tat protein and methamphetamine on calbindin positive-neurons. Journal of NeuroVirology. 2004;10(6):327-337. doi:10.1080/13550280490520961
Gandhi N, Saiyed ZM, Napuri J, et al. Interactive role of human immunodeficiency virus type 1 (HIV-1) clade-specific Tat protein and cocaine in blood-brain barrier dysfunction: Implications for HIV-1associated neurocognitive Journal of NeuroVirology. 2010;16(4):295-306. doi:10.3 109/13550284.2010.499891
Chen W, Tang Z, Fortina P, et al. Ethanol potentiates HIV-1 gp120-induced apoptosis in human neurons via both the death receptor and NMDA receptor Virology. 2005;334(1):59-73. doi:10.1016/j.virol.2005.01.014
Gaskill PJ, Calderon TM, Luers AJ, Eugenin EA, Javitch JA, Berman JW. Human immunodeficiency virus (HIV) infection of human macrophages is increased by dopamine: A bridge between HIV- associated neurologic disorders and drug American Journal of Pathology. 2009;175(3):1148- 1159. doi:10.2353/ajpath.2009.081067
Purohit V, Rapaka R, Shurtleff D. Drugs of abuse, dopamine, and HIV-associated neurocognitive disorders/HIV-associated dementia. Molecular Neurobiology. 2011;44(1):102-110. doi:10.1007/ s12035-011-8195-z
Aronow HA, Weston AJ, Pezeshki BB, Lazarus TS. Effects of coinfection with HIV and hepatitis C virus on the nervous The AIDS reader. 2008;18(1):43-48. http://europepmc.org/abstract/ MED/18240452
Morgello S, Estanislao L, Ryan E, et al. Effects of hepatic function and hepatitis C virus on the nervous system assessment of advanced-stage HIV-infected individuals. AIDS. 2005;19(SUPPL. 3). doi:10.1097/01.aids.0000192079.49185.f9
Cherner M, Letendre S, Heaton RK, et Hepatitis C augments cognitive deficits associated with HIV infection and methamphetamine. Neurology. 2005;64(8):1343-1347. doi:10.1212/01. WNL.0000158328.26897.0D
McCutchan JA, Marquie-Beck JA, FitzSimons CA, et al. Role of obesity, metabolic variables, and diabetes in HIV-associated neurocognitive Neurology. 2012;78(7):485-492. doi:10.1212/ WNL.0b013e3182478d64
Valcour VG, Sacktor NC, Paul RH, et al. Insulin resistance is associated with cognition among HIV-1-infected patients: The Hawaii aging with HIV Journal of Acquired Immune Deficiency Syndromes. 2006;43(4):405-410. doi:10.1097/01.qai.0000243119.67529.f5
Wright EJ, Grund B, Robertson K, et al. Cardiovascular risk factors associated with lower baseline cognitive performance in HIV-positive persons. Neurology. 2010;75(10):864-873. doi:10.1212/ 0b013e3181f11bd8
Livelli A, Vaida F, Ellis RJ, et al. Correlates of HIV RNA concentrations in cerebrospinal fluid during antiretroviral therapy: a longitudinal cohort study. The Lancet HIV. 2019;6(7):e456-e462. doi:10.1016/S2352-3018(19)30143-2
Ellis RJ, Badiee J, Vaida F, et CD4 nadir is a predictor of HIV neurocognitive impairment in the era of combination antiretroviral therapy. AIDS. 2011;25(14):1747-1751. doi:10.1097/ QAD.0b013e32834a40cd
Airoldi M, Bandera A, Trabattoni D, et al. Neurocognitive Impairment in HIV-Infected Naïve Patients with Advanced Disease: The Role of Virus and Intrathecal Immune Activation. Clinical & developmental 2012;2012:467154. doi:10.1155/2012/467154
Antinori A, Arendt G, Becker JT, et Updated research nosology for HIV-associated neurocognitive disorders. Neurology. 2007;69(18):1789-1799. doi:10.1212/01.WNL.0000287431.88658.8b
Watkins CC, Treisman GJ. Cognitive impairment in patients with Aids – Prevalence and severity. HIV/AIDS - Research and Palliative 2015;7:35-47. doi:10.2147/HIV.S39665
Heaton RK, Clifford DB, Franklin DR, et al. HIV-associated neurocognitive disorders persist in the era of potent antiretroviral therapy: Charter Study. Neurology. 2010;75(23):2087-2096. doi:10.1212/ 0b013e318200d727
Heaton RK, Franklin DR, Deutsch R, et al. Neurocognitive Change in the Era of HIV Combination Antiretroviral Therapy: The Longitudinal CHARTER Clinical Infectious Diseases. 2015;60(3):473-480. doi:10.1093/cid/ciu862
Cysique LA, Brew Comorbid depression and apathy in HIV-associated neurocognitive disorders in the era of chronic HIV infection. In: Handbook of Clinical Neurology. Vol 165. Elsevier B.V.; 2019:71-82. doi:10.1016/B978-0-444-64012-3.00006-X
Janssen RS, Cornblath DR, Epstein LG, et al. Nomenclature and research case definitions for neurologic manifestations of human immunodeficiency virus-type 1 (HIV-1) infection. Neurology. 1991;41(6):778-785. doi:10.1212/wnl.41.6.778
Antinori A, Arendt G, Grant I, et al. Assessment, Diagnosis, and Treatment of HIV-Associated Neurocognitive Disorder: A Consensus Report of the Mind Exchange Program. Clinical Infectious 2013;56. doi:10.1093/cid/cis975
Gisslén M, Price RW, Nilsson The definition of HIV-associated neurocognitive disorders: Are we overestimating the real prevalence? BMC Infectious Diseases. 2011;11. doi:10.1186/1471-2334- 11-356
Meyer ACL, John Boscardin W, Kwasa JK, Price RW. Is it time to rethink how neuropsychological tests are used to diagnose mild forms of HIV-associated neurocognitive disorders? Impact of false-positive rates on prevalence and Neuroepidemiology. 2013;41(3-4):208-216. doi:10.1159/000354629
Underwood J, de Francesco D, Leech R, Sabin CA, Winston Medicalising normality? Using a simulated dataset to assess the performance of different diagnostic criteria of HIV-associated cognitive impairment. PLoS ONE. 2018;13(4). doi:10.1371/journal.pone.0194760
Huizenga HM, Smeding H, Grasman RPPP, Schmand B. Multivariate normative comparisons. 2007;45(11):2534-2542. doi:10.1016/j.neuropsychologia.2007.03.011
Blackstone K, Moore DJ, Franklin DR, et al. Defining neurocognitive impairment in HIV: Deficit scores versus clinical ratings. Clinical Neuropsychologist. 2012;26(6):894-908. doi:10.1080/1385 2012.694479
Grant I, Franklin DR, Deutsch R, et al. Asymptomatic HIV-associated neurocognitive impairment increases risk for symptomatic Neurology. 2014;82(23):2055-2062. doi:10.1212/ WNL.0000000000000492
Zipursky AR, Gogolishvili D, Rueda S, et al. Evaluation of brief screening tools for neurocognitive impairment in HIV/AIDS: A systematic review of the literature. AIDS. 2013;27(15):2385-2401. doi:10.1097/QAD.0b013e328363bf56
López E, Steiner AJ, Smith K, et Diagnostic utility of the HIV dementia scale and the international HIV dementia scale in screening for HIV-associated neurocognitive disorders among Spanish- speaking adults. Applied Neuropsychology:Adult. 2017;24(6):512-521. doi:10.1080/23279095.20 16.1214835
Prats A, López-Masramon E, Pérez-Álvarez N, et al. NEU Screen Shows High Accuracy in Detecting Cognitive Impairment in Older Persons Living With HIV. The Journal of the Association of Nurses in AIDS Care : 2019;30(1):35-41. doi:10.1097/JNC.0000000000000003
Cherner M, Masliah E, Ellis RJ, et Neurocognitive dysfunction predicts postmortem findings of
Moore DJ, Masliah E, Rippeth JD, et Cortical and subcortical neurodegeneration is associated with HIV neurocognitive impairment. AIDS. 2006;20(6):879-887. doi:10.1097/01. aids.0000218552.69834.00
Cysique LA, Casaletto KB, Heaton Reliably Measuring Cognitive Change in the Era of Chronic HIV Infection and Chronic HIV-Associated Neurocognitive Disorders. In: Current Topics in Behavioral Neurosciences. Curr Top Behav Neurosci; 2019. doi:10.1007/7854_2019_116
Folstein MF, Folstein SE, McHugh PR. “Mini-mental state”. A practical method for grading the cognitive state of patients for the clinician. Journal of Psychiatric Research. 1975;12(3):189-198. doi:10.1016/0022-3956(75)90026-6
Ganesan A, Crum-Cianflone N, Higgins J, et al. High Dose Atorvastatin Decreases Cellular Markers of Immune Activation Without Affecting HIV-1 RNA Levels: Results of a Double-blind Randomized Placebo Controlled Clinical Trial. The Journal of infectious diseases. 2011;203:756- doi:10.1093/infdis/jiq115
Blackstone K, Moore DJ, Heaton RK, et Diagnosing symptomatic HIV-associated neurocognitive disorders: Self-report versus performance-based assessment of everyday functioning. Journal of the International Neuropsychological Society. 2012;18(1):79-88. doi:10.1017/S135561771100141X
Sevigny JJ, Albert SM, McDermott MP, et al. Evaluation of HIV RNA and markers of immune activation as predictors of HIV-associated Neurology. 2004;63(11):2084-2090. doi:10.1212/01.WNL.0000145763.68284.15
Vernazza P, Daneel S, Schiffer V, et al. The role of compartment penetration in PI-Monotherapy: The Atazanavir-Ritonavir Monomaintenance (ATARITMO) Trial. AIDS. 2007;21(10):1309-1315. doi:10.1097/QAD.0b013e32814e6b1c
Best BM, Letendre SL, Koopmans P, et Low cerebrospinal fluid concentrations of the nucleotide HIV reverse transcriptase inhibitor, Tenofovir. Journal of Acquired Immune Deficiency Syndromes. 2012;59(4):376-381. doi:10.1097/QAI.0b013e318247ec54
Bumpus S, Qing MA, Best Antiretroviral Concentrations in Brain Tissue Are Similar to or Exceed Those in CSF. - CROI Conference. Conference on Retroviruses ans Oppotunistic Infections (CROI) . Published 2015. Accessed June 24, 2020. https://www.croiconference.org/abstract/ antiretroviral-concentrations-brain-tissue-are-similar-or-exceed-those-csf/
Letendre S, Marquie-Beck J, Capparelli E, et al. Validation of the CNS penetration-effectiveness rank for quantifying antiretroviral penetration into the central nervous system. Archives of 2008;65(1):65-70. doi:10.1001/archneurol.2007.31
Letendre S, Ellis R, Everall I, Ances B, Bharti A, Mccutchan Neurologic Complications of HIV
Santos G, Locatelli I, Metral M, et Cross-Sectional and Cumulative Longitudinal Central Nervous System Penetration Effectiveness Scores Are Not Associated With Neurocognitive Impairment in a Well Treated Aging Human Immunodeficiency Virus-Positive Population in Switzerland. Open forum infectious diseases. 2019;6:ofz277. doi:10.1093/ofid/ofz277
Letendre S, FitzSimons C, Ellis R, Clifford D, Collier A, Gelman Correlates of CSF Viral Loads in 1,221 volunteers of the CHARTER cohort. CROI Conference. 17th Conference on Retroviruses ans Oppotunistic Infections (CROI) . Published 2010. Accessed June 24, 2020. https://charternntc. org/content/correlates-csf-viral-loads-1221-volunteers-charter-cohort
Perez-Valero I, Ellis R, Heaton R, et al. Cerebrospinal fluid viral escape in aviremic HIV-infected patients receiving antiretroviral therapy: Prevalence, risk factors and neurocognitive AIDS. 2019;33(3):475-481. doi:10.1097/QAD.0000000000002074
Ellis RJ, Letendre S, Vaida F, et al. Randomized Trial of Central Nervous System–Targeted Antiretrovirals for HIV-Associated Neurocognitive Clinical Infectious Diseases. 2014;58(7):1015-1022. doi:10.1093/cid/cit921
Tozzi V, Balestra P, Salvatori MF, et al. Changes in cognition during antiretroviral therapy: Comparison of 2 different ranking systems to measure antiretroviral drug efficacy on HIV-associated neurocognitive disorders. Journal of Acquired Immune Deficiency Syndromes. 2009;52(1):56-63. doi:10.1097/QAI.0b013e3181af83d6
Smurzynski M, Wu K, Letendre S, et Effects of central nervous system antiretroviral penetration on cognitive functioning in the ALLRT cohort. AIDS. 2011;25(3):357-365. doi:10.1097/ QAD.0b013e32834171f8
Cysique LA, Vaida F, Letendre S, et Dynamics of cognitive change in impaired HIV-
Marra CM, Zhao Y, Clifford DB, et Impact of combination antiretroviral therapy on cerebrospinal fluid HIV RNA and neurocognitive performance. AIDS. 2009;23(11):1359-1366. doi:10.1097/ QAD.0b013e32832c4152
Robertson KR, Su Z, Margolis DM, et Neurocognitive effects of treatment interruption in stable HIV-positive patients in an observational cohort. Neurology. 2010;74(16):1260-1266. doi:10.1212/ WNL.0b013e3181d9ed09
Simioni S, Cavassini M, Annoni JM, et Rivastigmine for HIV-associated neurocognitive disorders: A randomized crossover pilot study. Neurology. 2013;80(6):553-560. doi:10.1212/ WNL.0b013e3182815497
Muñoz-Moreno JA, Prats A, Moltó J, et al. Transdermal rivastigmine for HIV-associated cognitive impairment: A randomized pilot PLoS ONE. 2017;12(8). doi:10.1371/journal.pone.0182547
Sacktor N, Miyahara S, Deng L, et al. Minocycline treatment for HIV-associated cognitive impairment: results from a randomized trial. Neurology. 2011;77(12):1135-1142. doi:10.1212/ 0b013e31822f0412
Zhao Y, Navia BA, Marra CM, et al. Memantine for AIDS dementia complex: Open-label report of actg HIV Clinical Trials. 2010;11(1):59-67. doi:10.1310/hct1101-59
Schifitto G, Navia BA, Yiannoutsos CT, et Memantine and HIV-associated cognitive impairment: A neuropsychological and proton magnetic resonance spectroscopy study. AIDS. 2007;21(14):1877- 1886. doi:10.1097/QAD.0b013e32813384e8
Schifitto G, Zhang J, Evans SR, et al. A multicenter trial of selegiline transdermal system for HIV-associated cognitive Neurology. 2007;69(13):1314-1321. doi:10.1212/01. wnl.0000268487.78753.0f
Evans SR, Yeh TM, Sacktor N, et al. Selegiline Transdermal System (STS) for HIV-associated cognitive impairment: Open-label report of ACTG 5090. HIV Clinical Trials. 2007;8(6):437-446. doi:10.1310/hct0806-437
Letendre SL, Woods SP, Ellis RJ, et Lithium improves HIV-associated neurocognitive impairment. AIDS. 2006;20(14):1885-1888. doi:10.1097/01.aids.0000244208.49123.1b
Schifitto G, Zhong J, Gill D, et al. Lithium therapy for human immunodeficiency virus type 1-associated neurocognitive Journal of NeuroVirology. 2009;15(2):176-186. doi:10.1080/13550280902758973
Schifitto G, Peterson DR, Zhong J, et al. Valproic acid adjunctive therapy for HIV-associated cognitive impairment: A first Neurology. 2006;66(6):919-921. doi:10.1212/01. wnl.0000204294.28189.03
Digicaylioglu M, Kaul M, Fletcher L, Dowen R, Lipton Erythropoietin protects
Kang YJ, Digicaylioglu M, Russo R, et al. Erythropoietin plus insulin-like growth factor-I protects against neuronal damage in a murine model of human immunodeficiency virus-associated neurocognitive Annals of Neurology. 2010;68(3):342-352. doi:10.1002/ana.22070
Schifitto G, Sacktor N, Marder K, et Randomized trial of the platelet-activating factor antagonist lexipafant in HIV-associated cognitive impairment. Neurology. 1999;53(2):391-396. doi:10.1212/ wnl.53.2.391
Clifford DB, McArthur JC, Schifitto G, et al. A randomized clinical trial of CPI-1189 for HIV- associated cognitive-motor Neurology. 2002;59(10):1568-1573. doi:10.1212/01. WNL.0000034177.47015.DA
Navia BA, Dafni U, Simpson D, et al. A phase I/II trial of nimodipine for HIV-related neurologic Neurology. 1998;51(1):221-228. doi:10.1212/WNL.51.1.221
Letendre SL, Marquie-Beck J, Ellis RJ, et al. The role of cohort studies in drug development: Clinical evidence of antiviral activity of serotonin reuptake inhibitors and HMG-CoA reductase inhibitors in the central nervous system. Journal of Neuroimmune Pharmacology. 2007;2(1):120- doi:10.1007/s11481-006-9054-y
Heseltine PNR, Goodkin K, Atkinson JH, et Randomized double-blind placebo-controlled trial of peptide T for HIV- associated cognitive impairment. Archives of Neurology. 1998;55(1):41-51. doi:10.1001/archneur.55.1.41
Kleim JA, Jones TA. Principles of Experience-Dependent Neural Plasticity: Implications for Rehabilitation After Brain Damage. Journal of speech, language, and hearing research : JSLHR. 2008;51(1). doi:10.1044/1092-4388(2008/018)
Plassman BL, Williams JW, Burke JR, Holsinger T, Benjamin S. Systematic review: Factors associated with risk for and possible prevention of cognitive decline in later life. In: Annals of Internal Medicine. Vol 153. American College of Physicians; 2010:182-193. doi:10.7326/0003- 4819-153-3-201008030-00258
Chow FC, Lyass A, Mahoney TF, et Baseline 10-Year Cardiovascular Risk Scores Predict Cognitive Function in Older Persons, and Particularly Women, Living With Human Immunodeficiency Virus Infection. Clinical Infectious Diseases. Published online January 3, 2020. doi:10.1093/cid/ciz1214
Tzourio C, Anderson C, Chapman N, et Effects of blood pressure lowering with perindopril and indapamide therapy on dementia and cognitive decline in patients with cerebrovascular disease. Archives of Internal Medicine. 2003;163(9):1069-1075. doi:10.1001/archinte.163.9.1069
McGuinness B, Todd S, Passmore P, Bullock Blood pressure lowering in patients without prior cerebrovascular disease for prevention of cognitive impairment and dementia. Cochrane Database of Systematic Reviews. 2009;2009(4). doi:10.1002/14651858.CD004034.pub3
Cox DJ, Kovatchev BP, Gonder-Frederick LA, et al. Relationships between hyperglycemia and cognitive performance among adults with type 1 and type 2 Diabetes Care. 2005;28(1):71- 77. doi:10.2337/diacare.28.1.71
McCutchan A, Marquie-Beck J, Letendre Contributions of metabolic syndrome to neurocognitive impairment. . Program and abstracts of the 16th Conference on Retroviruses and Opportunistic Infections. Published February 2009. Accessed June 26, 2020. https://www.thebodypro.com/ article/croi-2009-highlights-review-cardiovascular-disease-hiv
Kivipelto M, Helkala E-L, Laakso MP, et al. Apolipoprotein E ϵ4 Allele, Elevated Midlife Total Cholesterol Level, and High Midlife Systolic Blood Pressure Are Independent Risk Factors for Late-Life Alzheimer Disease. Annals of Internal Medicine. 2002;137(3):149. doi:10.7326/0003- 4819-137-3-200208060-00006
Letendre S. Central nervous system complications in HIV disease: HIV-associated neurocognitive Topics in antiviral medicine. 2011;19(4):137-142. https://Pubmed.ncbi.nlm.nih. gov/22156215
Yadav A, Betts MR, Collman Statin modulation of monocyte phenotype and function: implications for HIV-1-associated neurocognitive disorders. Journal of NeuroVirology. 2016;22(5):584-596. doi:10.1007/s13365-016-0433-8
Byrnes V, Miller A, Lowry D, et al. Effects of anti-viral therapy and HCV clearance on
Clifford DB, Vaida F, Kao YT, et Absence of neurocognitive effect of hepatitis C infection in HIV- coinfected people. Neurology. 2015;84(3):241-250. doi:10.1212/WNL.0000000000001156
Rubin LH, Maki HIV, Depression, and Cognitive Impairment in the Era of Effective Antiretroviral Therapy. Current HIV/AIDS Reports. 2019;16(1):82-95. doi:10.1007/s11904-019-00421-0
Vance DE, Eagerton G, Harnish B, McKie P, Fazeli PL. Cognitive prescriptions: A nursing approach to increasing cognitive reserve. Journal of Gerontological Nursing. 2011;37(4):22-31. doi:10.3928/00989134-20101202-03
Féart C, Samieri C, Barberger-Gateau P. Mediterranean diet and cognitive function in older Current Opinion in Clinical Nutrition and Metabolic Care. 2010;13(1):14-18. doi:10.1097/ MCO.0b013e3283331fe4
Scarmeas N, Stern Y, Mayeux R, Manly JJ, Schupf N, Luchsinger JA. Mediterranean diet and mild cognitive Archives of Neurology. 2009;66(2):216-225. doi:10.1001/archneurol.2008.536
Burckhardt M, Herke M, Wustmann T, Watzke S, Langer G, Fink Omega-3 fatty acids for the treatment of dementia. Cochrane Database of Systematic Reviews. 2016;2016(4). doi:10.1002/14651858.CD009002.pub3
Smith PJ, Blumenthal JA, Hoffman BM, et Aerobic exercise and neurocognitive performance: A meta-analytic review of randomized controlled trials. Psychosomatic Medicine. 2010;72(3):239- 252. doi:10.1097/PSY.0b013e3181d14633
Monroe AK, Zhang L, Jacobson L, et The association between physical activity and cognition in men with and without HIV infection. HIV Medicine. 2017;18. doi:10.1111/hiv.12490
Kåreholt I, Lennartsson C, Gatz M, Parker MG. Baseline leisure time activity and cognition more than two decades International Journal of Geriatric Psychiatry. 2011;26(1):65-74. doi:10.1002/ gps.2490
Stern C, Munn Z. Cognitive leisure activities and their role in preventing dementia: a systematic International journal of evidence-based healthcare. 2010;8(1):2-17. doi:10.1111/j.1744- 1609.2010.00150.x
Catz SL, Gore-Felton C, McClure JB. Psychological distress among minority and low-income women living with Behavioral Medicine. 2002;28(2):53-60. doi:10.1080/08964280209596398
Duncan LG, Moskowitz JT, Neilands TB, Dilworth SE, Hecht FM, Johnson MO. Mindfulness-based stress reduction for HIV treatment side effects: A randomized, wait-list controlled Journal of
Anstey KJ, von Sanden C, Salim A, O’Kearney R. Smoking as a Risk Factor for Dementia and Cognitive Decline: A Meta-Analysis of Prospective Studies. American Journal of Epidemiology. 2007;166(4):367-378. doi:10.1093/aje/kwm116
Harrison JD, Dochney JA, Blazekovic S, et al. The nature and consequences of cognitive deficits among tobacco smokers with HIV: a comparison to tobacco smokers without HIV. Journal of 2017;23(4):550-557. doi:10.1007/s13365-017-0526-z
Kim JW, Lee DY, Lee BC, et al. Alcohol and cognition in the elderly: A review. Psychiatry 2012;9(1):8-16. doi:10.4306/pi.2012.9.1.8
Martin-Thormeyer EM, Paul Drug abuse and hepatitis C infection as comorbid features of HIV associated neurocognitive disorder: Neurocognitive and neuroimaging features. Neuropsychology Review. 2009;19(2):215-231. doi:10.1007/s11065-009-9101-6
Nath A. Human immunodeficiency virus-associated neurocognitive disorder: Pathophysiology in relation to drug addiction. Annals of the New York Academy of Sciences. 2010;1187:122-128. doi:10.1111/j.1749-6632.2009.05277.x
Byrd DA, Fellows RP, Morgello S, et Neurocognitive impact of substance use in HIV infection. Journal of Acquired Immune Deficiency Syndromes. 2011;58(2):154-162. doi:10.1097/ QAI.0b013e318229ba41
Gaskill PJ, Calderon TM, Coley JS, Berman JW. Drug induced increases in CNS dopamine alter monocyte, macrophage and T cell functions: Implications for HAND. Journal of Neuroimmune 2013;8(3):621-642. doi:10.1007/s11481-013-9443-y
Neuropsychological Routledge; 2017. doi:10.4324/9781315629537
Cicerone KD, Langenbahn DM, Braden C, et al. Evidence-based cognitive rehabilitation: Updated review of the literature from 2003 through Archives of Physical Medicine and Rehabilitation. 2011;92(4):519-530. doi:10.1016/j.apmr.2010.11.015
Dickinson D, Tenhula W, Morris S, et al. A randomized, controlled trial of computer-assisted cognitive remediation for schizophrenia. American Journal of Psychiatry. 2010;167(2):170-180. doi:10.1176/appi.ajp.2009.09020264
Yu F, Rose KM, Burgenr SC, et Cognitive training for early-stage Alzheimer’s disease and dementia. Journal of Gerontological Nursing. 2009;35(3):23-29. doi:10.3928/00989134- 20090301-10
Martin M, Clare L, Altgassen AM, Cameron MH, Zehnder F. Cognition-based interventions for healthy older people and people with mild cognitive Cochrane Database of Systematic Reviews. 2011;(1). doi:10.1002/14651858.cd006220.pub2
Becker JT, Dew MA, Aizenstein HJ, et al. A pilot study of the effects of internet-based cognitive stimulation on neuropsychological function in HIV Disability and Rehabilitation.
Muñoz-Moreno JA, Fumaz CR, Ferrer MJ, et Benefits of a Cognitive Rehabilitation Program on Neurocognitive Impairment in HIV-Infected Patients. Preliminary Findings. Journal of the International Neuropsychological Society. 2007;13(1 Suplement 1:19).
Guideline for Alzheimer`s Disease . California workgroup on Guidelines for Alzheimer`s Disease Management. Published 2008. Accessed June 26, 2020. http://caalz.org/ guidelines.htm.
Cognitive disorders and HIV/AIDS: HIV-associated dementia and delirium. . New York (NY): New York State Department of Published September 12, 2007. Accessed June 25, 2020. http:// guideline.gov/content.aspx?id=12561.
Kritsilis M, Rizou S v., Koutsoudaki PN, Evangelou K, Gorgoulis VG, Papadopoulos D. Ageing, cellular senescence and neurodegenerative disease. International Journal of Molecular Sciences. 2018;19(10). doi:10.3390/ijms19102937
Isaev NK, Genrikhs EE, Oborina M v., Stelmashook E v. Accelerated aging and aging process in the Reviews in the Neurosciences. 2018;29(3):233-240. doi:10.1515/revneuro-2017-0051
Alzheimer’s Association 2019 Alzheimer’s disease facts and figures. Alzheimer’s &
Fields JA, Swinton MK, Soontornniyomkij B, Carson A, Achim Beta amyloid levels in cerebrospinal fluid of HIV-infected people vary by exposure to antiretroviral therapy. AIDS (London, England). 2020;34(7):1001-1007. doi:10.1097/QAD.0000000000002506
Wendelken LA, Valcour V. Impact of HIV and aging on neuropsychological function. Journal of 2012;18(4):256-263. doi:10.1007/s13365-012-0094-1
Cohen J, Torres HIV-associated cellular senescence: A contributor to accelerated aging. Ageing Research Reviews. 2017;36:117-124. doi:10.1016/j.arr.2016.12.004
Arvanitakis Z, Shah RC, Bennett DA. Diagnosis and Management of Dementia: Review. JAMA - Journal of the American Medical 2019;322(16):1589-1599. doi:10.1001/jama.2019.4782
Xu J, Ikezu The comorbidity of HIV-associated neurocognitive disorders and alzheimer’s disease: A foreseeable medical challenge in post-HAART era. Journal of Neuroimmune Pharmacology. 2009;4(2):200-212. doi:10.1007/s11481-008-9136-0
Milanini B, Valcour V. Differentiating HIV-Associated Neurocognitive Disorders From Alzheimer’s Disease: an Emerging Issue in Geriatric NeuroHIV. Current HIV/AIDS Reports. 2017;14(4):123- doi:10.1007/s11904-017-0361-0
Kodidela S, Gerth K, Haque S, et Extracellular Vesicles: A Possible Link between HIV and Alzheimer’s Disease-Like Pathology in HIV Subjects? Cells. 2019;8(9):968. doi:10.3390/ cells8090968
Canet G, Dias C, Gabelle A, et al. HIV neuroinfection and Alzheimer’s disease: Similarities and potential links? Frontiers in Cellular 2018;12. doi:10.3389/fncel.2018.00307
McKhann GM, Knopman DS, Chertkow H, et al. The diagnosis of dementia due to Alzheimer’s disease: Recommendations from the National Institute on Aging-Alzheimer’s Association workgroups on diagnostic guidelines for Alzheimer’s Alzheimer’s and Dementia. 2011;7(3):263-269. doi:10.1016/j.jalz.2011.03.005
Pendlebury ST, Mariz J, Bull L, Mehta Z, Rothwell PM. MoCA, ACE-R, and MMSE versus the national institute of neurological disorders and stroke-canadian stroke network vascular cognitive impairment harmonization standards neuropsychological battery after TIA and stroke. Stroke. 2012;43(2):464-469. doi:10.1161/STROKEAHA.111.633586
Knopman DS, DeKosky ST, Cummings JL, et al. Practice parameter: Diagnosis of dementia (an evidence-based review): Report of the quality standards subcommittee of the american academy of Neurology. 2001;56(9):1143-1153. doi:10.1212/WNL.56.9.1143
Silverman DHS, Chen W, Czernin J, et Positron emission tomography in evaluation of dementia: Regional brain metabolism and long-term outcome. Journal of the American Medical Association. 2001;286(17):2120-2127. doi:10.1001/jama.286.17.2120
Birks J. Cholinesterase inhibitors for Alzheimer’s disease. Cochrane Database of Systematic 2006;(1). doi:10.1002/14651858.CD005593
Reisberg B, Doody R, Stöffler A, Schmitt F, Ferris S, Möbius Memantine in moderate-to-severe Alzheimer’s disease. New England Journal of Medicine. 2003;348(14):1333-1341. doi:10.1056/ NEJMoa013128
Dysken MW, Sano M, Asthana S, et Effect of vitamin E and memantine on functional decline in Alzheimer disease: The TEAM-AD VA cooperative randomized trial. JAMA - Journal of the American Medical Association. 2014;311(1):33-44. doi:10.1001/jama.2013.282834
Chen R, Chan PT, Chu H, et al. Treatment effects between monotherapy of Donepezil versus combination with memantine for Alzheimer disease: A meta-analysis. PLoS ONE. 2017;12(8). doi:10.1371/journal.pone.0183586
Livingston G, Kelly L, Lewis-Holmes E, et Non-pharmacological interventions for agitation in dementia: Systematic review of randomised controlled trials. British Journal of Psychiatry. 2014;205(6):436-442. doi:10.1192/bjp.bp.113.141119
Sink KM, Holden KF, Yaffe Pharmacological treatment of neuropsychiatric symptoms of dementia: A review of the evidence. Journal of the American Medical Association. 2005;293(5):596-608. doi:10.1001/jama.293.5.596
Reus VI, Fochtmann LJ, Eyler AE, et al. The American psychiatric association practice guideline on the use of antipsychotics to treat agitation or psychosis in patients with dementia. American Journal of 2016;173(5):543-546. doi:10.1176/appi.ajp.2015.173501
Borson S, Raskind MA. Clinical features and pharmacologic treatment of behavioral symptoms of Alzheimer’s Neurology. 1997;48(5 SUPPL. 6). doi:10.1212/wnl.48.5_suppl_6.17s
Lauque S, Arnaud-Battandier F, Gillette S, et al. Improvement of weight and fat-free mass with oral nutritional supplementation in patients with Alzheimer’s disease at risk of malnutrition: A prospective randomized Journal of the American Geriatrics Society. 2004;52(10):1702-1707. doi:10.1111/j.1532-5415.2004.52464.x
Forbes D, Forbes SC, Blake CM, Thiessen EJ, Forbes S. Exercise programs for people with Cochrane Database of Systematic Reviews. 2015;2015(4). doi:10.1002/14651858. CD006489.pub4
Snyder HM, Corriveau RA, Craft S, et al. Vascular contributions to cognitive impairment and dementia including Alzheimer’s Alzheimer’s and Dementia. 2015;11(6):710-717. doi:10.1016/j.jalz.2014.10.008
Skrobot OA, Black SE, Chen C, et Progress toward standardized diagnosis of vascular cognitive impairment: Guidelines from the Vascular Impairment of Cognition Classification Consensus Study. Alzheimer’s and Dementia. 2018;14(3):280-292. doi:10.1016/j.jalz.2017.09.007
Iadecola C, Duering M, Hachinski V, et al. Vascular Cognitive Impairment and Dementia: JACC Scientific Expert Panel. Journal of the American College of Cardiology. 2019;73(25):3326-3344. doi:10.1016/j.jacc.2019.04.034
Pendlebury ST, Rothwell PM. Incidence and prevalence of dementia associated with transient ischaemic attack and stroke: analysis of the population-based Oxford Vascular Study. The Lancet 2019;18(3):248-258. doi:10.1016/S1474-4422(18)30442-3
Diniz BS, Butters MA, Albert SM, Dew MA, Reynolds CF. Late-life depression and risk of vascular dementia and Alzheimer’s disease: Systematic review and meta-analysis of community-based cohort British Journal of Psychiatry. 2013;202(5):329-335. doi:10.1192/bjp.bp.112.118307
Schneider JA, Arvanitakis Z, Bang W, Bennett DA. Mixed brain pathologies account for most dementia cases in community-dwelling older Neurology. 2007;69(24):2197-2204. doi:10.1212/01.wnl.0000271090.28148.24
Valcour V, Rubin LH, Tien P, et Human immunodeficiency virus (HIV) modulates the associations between insulin resistance and cognition in the current combination antiretroviral therapy (cART) era: a study of the Women’s Interagency HIV Study (WIHS). Journal of NeuroVirology. 2015;21(4):415-421. doi:10.1007/s13365-015-0330-6
Sanford Ryan, Strain Jeremy, Dadar Mahsa, et al. Association of cerebral small vessel disease with the brain in HIV individuals CROI Conference. Conference on Retroviruses ans Oppotunistic Infections (CROI) . Published 2019. Accessed June 24, 2020. https://croiconference.org/ abstract/association-cerebral-small-vessel-disease-brain-hiv-individuals/
Chow FC, Makanjuola A, Wu K, et Physical Activity Is Associated With Lower Odds of Cognitive
Sattler FR, He J, Letendre S, et Abdominal obesity contributes to neurocognitive impairment in HIV-infected patients with increased inflammation and immune activation. Journal of Acquired Immune Deficiency Syndromes. 2015;68(3):281-288. doi:10.1097/QAI.0000000000000458
Rubin LH, Gustafson D, Hawkins KL, et al. Midlife adiposity predicts cognitive decline in the prospective Multicenter AIDS Cohort Study. Neurology. 2019;93(3):E261-E271. doi:10.1212/ 0000000000007779
Sachdev PS, Brodaty H, Valenzuela MJ, et The neuropsychological profile of vascular cognitive impairment in stroke and TIA patients. Neurology. 2004;62(6):912-919. doi:10.1212/01. WNL.0000115108.65264.4B
Hachinski VC, Iliff LD, Zilhka E, et al. Cerebral Blood Flow in Dementia. Archives of Neurology. 1975;32(9):632-637. doi:10.1001/archneur.1975.00490510088009
Wardlaw JM, Smith EE, Biessels GJ, et Neuroimaging standards for research into small vessel disease and its contribution to ageing and neurodegeneration. The Lancet Neurology. 2013;12(8):822-838. doi:10.1016/S1474-4422(13)70124-8
Gorelick PB, Scuteri A, Black SE, et Vascular contributions to cognitive impairment and dementia: A statement for healthcare professionals from the American Heart Association/American Stroke Association. Stroke. 2011;42(9):2672-2713. doi:10.1161/STR.0b013e3182299496
Forette F, Seux ML, Staessen JA, et al. Prevention of dementia in randomised double-blind placebo-controlled Systolic Hypertension in Europe (Syst-Eur) Lancet. 1998;352(9137):1347- 1351. doi:10.1016/S0140-6736(98)03086-4
Williamson JD, Pajewski NM, Auchus AP, et al. Effect of Intensive vs Standard Blood Pressure Control on Probable Dementia: A Randomized Clinical Trial. In: JAMA - Journal of the American Medical Vol 321. American Medical Association; 2019:553-561. doi:10.1001/ jama.2018.21442
Dichgans M, Zietemann Prevention of vascular cognitive impairment. Stroke. 2012;43(11):3137- 3146. doi:10.1161/STROKEAHA.112.651778
Gorelick PB, Furie KL, Iadecola C, et al. Defining Optimal Brain Health in Adults: A Presidential Advisory From the American Heart Association/American Stroke Stroke. 2017;48(10):e284-e303. doi:10.1161/STR.0000000000000148
Collins R, Armitage J, Parish S, Sleight P, Peto R. MRC/BHF Heart Protection Study of cholesterol lowering with simvastatin in 20 536 high-risk individuals: A randomised placebo-controlled trial. 2002;360(9326):7-22. doi:10.1016/S0140-6736(02)09327-3
Shepherd J, Blauw GJ, Murphy MB, et al. Pravastatin in elderly individuals at risk of vascular disease (PROSPER): A randomised controlled Lancet. 2002;360(9346):1623-1630.
McKeith IG, Boeve BF, DIckson DW, et al. Diagnosis and management of dementia with Lewy Neurology. 2017;89(1):88-100. doi:10.1212/WNL.0000000000004058
Svenningsson P, Westman E, Ballard C, Aarsland D. Cognitive impairment in patients with Parkinson’s disease: Diagnosis, biomarkers, and The Lancet Neurology. 2012;11(8):697- 707. doi:10.1016/S1474-4422(12)70152-7
Johnson JK, Diehl J, Mendez MF, et al. Frontotemporal lobar degeneration: Demographic characteristics of 353 Archives of Neurology. 2005;62(6):925-930. doi:10.1001/ archneur.62.6.925
7. Neurotoxicidad del tratamiento antirretroviral
La mayoría de las pautas de TAR actuales son efectivas suprimiendo la replicación del VIH de forma indefinida. Por ello, factores como la seguridad y tolerabilidad a largo plazo son cada vez más relevantes a la hora de iniciar o cambiar el TAR424 Aunque la mayoría de ARV son seguros y bien tolerados, prácticamente todos se han asociado con algún tipo de toxicidad425.
Dentro de las distintas toxicidades que se han documentado en relación con la toma de ARV, una que, al menos in-vitro, parece ser común a todos ellos es la neurotoxicidad. Diversos estudios han constatado alteraciones a nivel neuronal (arrosariamiento axonal, disminución de la conectividad detrítica y contracción neuronal) cuando añadimos cualquier ARV a un cultivo neuronal258. Aunque en general la neurotoxicidad de los distintos ARV a dosis terapéuticas suele ser modesta y subclínica, en algunos pacientes se puede manifestar en forma de síntomas neurológicos, psiquiátricos y/o cognitivos de intensidad variable.
Neurotoxicidad periférica
La neuropatía periférica, en especial la polineuropatía distal simétrica (PDS), es probablemente la complicación neurológica más frecuentemente reportada en los pacientes VIH. Se relaciona tanto con la acción citopática del VIH como con neurotoxicidad asociada al uso de ciertos ARV426427428429430431.
Etiopatogenia y fármacos implicados
Los factores que intervienen en la PDS son diversos y en general se asocian con el uso de análogos de nucleósidos, principalmente Didanosina, Estavudina y Zalcitabina y en menor medida la Zidovudina432433. La neurotoxicidad de estos fármacos se produce a nivel mitocondrial, con la inhibición de la gamma-polimerasa, una enzima necesaria para mantener la integridad del DNA mitocondrial en los axones y en las células de Schwann(426-431, 434-436). Igualmente se ha visto que la toxicidad mitocondrial inducida por los análogos de nucleósidos va a favorecer la depleción energética y el aumento a del estrés oxidativo, fenómenos que pueden condicionar la viabilidad neuronal.
Aunque clásicamente al resto de los análogos de nucleósidos, Emtricitabina, Lamivudina, Abacavir y Tenofovir, se les ha concedido un perfil prácticamente inocuo, un estudio reciente realizado en Sudáfrica ha sugerido que el uso Tenofovir disoproxil fumarato (TDF) podría asociarse con formas de PDS sintomáticas (8%) y asintomáticas (9%)437. Un aspecto todavía por esclarecer es cual va a ser el perfil de toxicidad mitocondrial de Tenofovir alafenamida (TAF), dado los altos niveles intracitoplasmáticos de Tenofovir que se alcanzan con este ARV.
Epidemiología
Su prevalencia se estimada que puede variar en función del fármaco utilizado, del grado de expresión clínica y de otros factores como la edad o el nivel inmunodepresión (1- 20%)(426,430,431,434,435,438).
Diagnóstico
El diagnóstico de sospecha se basa en la identificación de manifestaciones clínicas (hipostesia, parestesia de predominio distal y dolor en extremidades) y se confirmará con un electroneurograma433.
Tratamiento
La base del tratamiento es la retirada del ARV causante del cuadro. La mejoría suele observarse a las 3-6 semanas, pero no en todos los pacientes434. En los casos no reversibles se han ensayado diferentes fármacos como la lamotrigina a dosis de 200mg/12h439 o la L-acetil-carnitina440 Para el tratamiento del dolor neuropático se recomienda: Gabapentina, Pregabalina, Capsaicina tópica, Benzodiacepinas, Carbamacepina o los antidepresivos tricíclicos.
Neurotoxicidad central (SNC)
Debido a la complejidad de funcionamiento del SNC, la neurotoxicidad del TAR a este nivel, como ocurre con las manifestaciones neuropsiquiátricas asociadas con el VIH, puede manifestarse de forma heterogénea (alteraciones cognitivas, síntomas neuropsiquiátricos, insomnio, ansiedad, depresión).
Etiopatogenia
Los fármacos ARV pueden producir neurotoxicidad sobre el SNC de forma directa o a través de mecanismos indirectos como el aumento del riesgo vascular, asociado al uso de Abacavir, la dislipemia producida por algunos inhibidores de proteasa437, o el neuroenvejecimiento acelerado asociado una reducción de la actividad telomerasa inducida por algunos ARV441442443.
Dentro de los mecanismos de toxicidad directa, estudios recientes han demostrado que la toxicidad mitocondrial, asociada a la inhibición por los análogos de nucleósidos de la gamma-polimerasa mitocondrial y responsable de la PDS, también puede afectar a las neuronas del SNC, favoreciendo alteraciones cognitivas444445 Adicionalmente, se han descrito otros mecanismos de neurotoxicidad inducida por el uso de algunos ARV como la hiperreactividad neuronal inducible por glutamato446447, la alteración de los canales de calcio448 la reducción de los niveles cerebrales de creatinquinasa y secundariamente de ATP449 el aumento de los niveles de especies reactivas de oxígen450 o el aumento de la producción de beta-amiloide a nivel neuronal y la disminución de su fagocitosis a nivel microglia451. Todos estos procesos pueden entenderse como manifestaciones de un fenómeno común de estrés neuronal en respuesta a la exposición a ARV.
Desde el punto de vista histopatológico, la exposición directa a niveles terapéuticos de algunos ARV se ha visto in vitro que, en general, produce un daño neuronal moderado (pérdida y arrosariamiento de las dendritas). Solo la exposición a dosis elevadas de Efavirenz se ha relacionado con fenómenos de neurotoxicidad grave (muerte neuronal extensa).
Fármacos ARV implicados
La evidencia disponible hasta el momento sugiere que no todos los ARV tienen el mismo mecanismo de acción ni el mismo perfil de neurotoxicidad Figura 1.
En la Tabla 1 se recoge y gradúa la principal evidencia disponible.
Fármacos análogos de nucleósidos y nucleótidos
La toxicidad mitocondrial es la principal vía de neurotoxicidad directa que se ha asociado con esta familia de ARV452453 aunque no la única. Por ejemplo, Abacavir también puede inducir estrés a nivel del retículo endoplásmico de los astrocitos442. Desde el punto de la neurotoxicidad indirecta, la toxicidad renal por Tenofovir o la cerebrovascular por Abacavir podrían ambas favorecer el deterioro cognitivo.
Fármacos no análogos de nucleósidos
El rango de neurotoxicidad producida por esta familia es muy amplio. Mientras Efavirenz es el paradigma de la neurotoxicidad por ARV, otros fármacos como la Rilpivirina no se consideran neurotóxicos454 La toxicidad por Efavirenz se debe tanto a la exposición directa al fármaco como a alguno de sus metabolitos como el 8-OH-Efavirenz, cuya producción es regulada por el CYP2B6455 y que se considera 10 veces más neurotóxico.
Los mecanismos de neurotoxicidad directa por Efavirenz se deben principalmente a alteración de la homeostasis neuronal de los canales de calcio448, a disfunción mitocondrial aguda452, al aumento del estrés oxidativ456 y a un déficit energético por reducción de los niveles de ATP por inhibición de la creatinquinasa457459. Se han descrito también mecanismos de neurotoxicidad indirecta por Efavirenz a nivel de la microvasculatura del SNC460.
Desde el punto de vista clínico, la neurotoxicidad por Efavirenz se manifiesta generalmente en forma de efectos adversos (pesadillas, mareo, insomnio, nerviosismo, problemas de concentración, ideación suicida o psicosis)461 que desaparecen tras la retirada del fármaco. De forma adicional, el uso crónico de Efavirenz se ha relacionado con un peor rendimiento neurocognitivo462.
Fármacos inhibidores de la proteasa
El perfil de neurotoxicidad observado in vitro con los inhibidores de la proteasa es divergente. Mientras fármacos clásicos como lopinavir pueden inducir fenómenos de excitotoxicidad neuronal463, inhibir la maduración de los oligodendrocitos34 y alterar la homeostasis del glutamato a nivel astroglial464, otros fármacos como Darunavir parecen tener un papel neutro o incluso protector frente a los fenómenos de excitotoxicidad463. Darunavir podría asociarse también con un aumento leve del estrés oxidativo, sin significación clínica465.
Desde un punto de vista clínico, el uso de inhibidores de proteasa no se ha asociado con el desarrollo de efectos adversos o alteraciones cognitivas.
Inhibidores de la integrasa
La evidencia disponible in vitro, tanto para Raltegravir como para Dolutegravir, sugiere que ninguno de ellos va a inducir toxicidad mitocondrial459466 ni fenómenos muy relevantes excitotoxicidad463466. Se ha documentado que Dolutegravir puede inducir un sobrecrecimiento axonal anormal, similar al que produce Efavirenz, pero la relevancia clínica de este fenómeno es incierta466. También se ha reportado una posible asociación entre el uso de Dolutegravir durante el embarazo y defectos en el cierre del tubo neural467.
Respecto a Elvitegravir/Cobicistat se ha visto que in vitro puede inducir toxicidad mitocondrial, por despolarización del potencial de membrana y generación de radicales libres, y excitotoxicidad en forma de degeneración neuronal463466. Estos efectos parece que podrían verse mitigados, a nivel clínico, por la activación de mecanismos cerebrales de respuesta al estrés463. Finalmente, ningún estudio ha analizado aún el perfil in vitro de neurotoxicidad de Bictegravir.
A pesar de que la neurotoxicidad objetivada en los estudios in vitro disponibles es escasa, la asociación observada, tanto en ensayos clínicos como en vida real, entre la aparición efectos adversos neuropsiquiátricos y el uso de algunos inhibidores de la integrasa, sugiere que podrían existir fenómenos de neurotoxicidad asociados a los inhibidores de la integrasa aun no identificados.
A nivel clínico, todos los inhibidores de la integrasa se han asociado con la aparición de efectos adversos neuropsiquiátricos. Mientras Dolutegravir y en menor medida Raltegravir se han asociado con el desarrollo de cuadros de insomnio455468, y con alteraciones anímicas (ansiedad y depresión)469, Bictegravir y Elvitegravir/Cobicistat se han relacionado más con cefalea470 En general, estos efectos adversos suelen ser leves o moderados y tienden a autolimitarse con el paso del tiempo o al cambiar la administración del TAR a la mañana471. Sin embargo, en un número no despreciable de casos, la resolución del efecto adverso va a requerir la suspensión del inhibidor de la integrasa. Por ejemplo, en una cohorte alemana con 1704 pacientes, las tasas de discontinuación por efectos adversos neuropsiquiátricos fueron mayores con Dolutegravir (5,6%) que con Raltegravir (1,9%) o Elvitegravir (0,7%)472.
Miscelánea
La evidencia disponible es muy limitada y no sugiere que Enfuvirtide, Maraviroc o Fostemsavir vayan a inducir fenómenos de neurotoxicidad relevantes. Algunos estudios in vitro, no confirmados clínicamente, han sugerido que el uso de Maraviroc podría tener un efecto neuroprotector como modulador de la respuesta inflamatoria en el SNC473.
Epidemiología
A pesar de que sabemos que en nuestro medio la neurotoxicidad del TAR es probablemente la causa más frecuente de cambio del TAR durante el primer año de tratamiento (2%), desconocemos cual es la prevalencia e incidencia real de la neurotoxicidad del TAR en nuestro medio474 Del mismo modo, aunque en el caso de los inhibidores de la integrasa, algunos factores como ser mujer, tener >50 años, ser originario de áfrica subsahariana, tener un nivel de CD4 <350 cop/mm425 o el uso de Abacavir/Lamivudina se han relacionado (no en todos los estudios)475 con el riesgo de discontinuación del TAR por neurotoxicidad472476, no disponemos de modelos predictivos que nos permitan determinar que pacientes van a desarrollar cuadros de neurotoxicidad clínica y cuales no. Asumiendo esta limitación, una aproximación simplista sería asumir que los pacientes que a priori tendrían más riesgo de presentar neurotoxicidad por el TAR serían aquellos con comorbilidades neuropsiquiátricas concomitantes.
Diagnóstico
El diagnóstico de la neurotoxicidad del TAR es principalmente clínico. Mientras a corto plazo se identifican síntomas neuropsiquiátricos como el insomnio, la cefalea, el mareo o las alteraciones anímicas, a largo plazo se ha descrito declinar cognitivo y aumento del riesgo de suicidabilidad. La existencia de neurotoxicidad asociada al TAR se debe sospechar en todo paciente que reporte la aparición y/o el empeoramiento de síntomas neuropsiquiátricos y/o cognitivos tras el inicio de un nuevo TAR; siempre que no se identifiquen otras etiologías que los puedan justificar.
Existe controversia sobre si la identificación de estos síntomas debe de ser reactiva o proactiva. Los abordajes reactivos infraestiman la neurotoxicidad del TAR y, por ello, algunos expertos recomiendan un abordaje más proactivo en el que se incluya, además de la anamnesis, el uso de algunos cuestionarios de síntomas reportados por el paciente, como el cuestionario de calidad de sueño de Pittsburg o la escala hospitalaria de ansiedad y depresión. Respecto al uso de pruebas complementarias, hasta el momento ninguna ha demostrado ser de utilidad para el diagnóstico de la neurotoxicidad del TAR.
Tratamiento
Para el tratamiento de la neurotoxicidad asociada al TAR la única medida eficaz es la retirada de el o los ARV que la estén produciendo. En pacientes neurosintomáticos, cuatro ensayos clínicos con Efavirenz y uno con Abacavir/Lamivudina/Dolutegravir han demostrado mejorías sintomáticas (rango: 50-89%) tras el cambio del TAR a una pauta alternativa(87, 477-480). Una limitación importante de estos estudios es su limitado tamaño muestral.
En pacientes sin aparentes síntomas neuropsiquiátricos, tres ensayos clínicos, el 2014- 002284-15 (abierto), el Strategy-NNRTI (abierto) y el GS-1844 (doble-ciego), mostraron mejoría en la sintomatología autoreferida por los pacientes tras el cambio respectivamente de Efavirenz por Rilpivirina y por Elvitegravir/Cobicistat, y de Dolutegravir/Lamivudina/ Abacavir por Bictegravir/Emtricitabina/Tenofovir alafenamida481482483484. Estos resultados podrían sugerir beneficio en la retirada de fármacos potencialmente neurotóxicos, en pacientes que presenten síntomas neuropsiquiátricos aún cuando el paciente no los reporte de forma activa.
Un aspecto relevante respecto a estos estudios es que en todos ellos existen pacientes que no mejoran tras la retirada del fármaco que se creía responsable de la sintomatología del paciente. Esto sugiere que la neurotoxicidad del TAR no es el único factor responsable de la sintomatología neuropsiquiátrica que presentan los pacientes infectados por VIH484.
Recomendaciones:
- Se debe sospechar la existencia de neurotoxicidad asociada al TAR tras la aparición de sintomatología neuropsiquiátrica o el empeoramiento de la sintomatología preexistente (A-III).
- Siempre que se sospeche la existencia de neurotoxicidad asociada al TAR se recomienda interrumpir la exposición al agente neurotóxico sospechado y monitorizar la respuesta (A-II). De no objetivarse mejoría se podrá optar por continuar con el nuevo tratamiento o volver al previo (C-III).
- El uso de Efavirenz no se recomienda en personas con comorbilidades neuropsiquiátricas o cognitivas ni en personas que desempeñen trabajos que puedan requerir precisión o que puedan representar un riesgo para ellos mismos o terceros (uso de maquinaria, conducción por periodos prolongados o nocturnidad) (A-II).
- El uso de inhibidores de la integrasa, especialmente Dolutegravir, debería valorarse individualmente en personas con antecedentes de patología neuropsiquiátrica relevante (B-II).
- El uso de cuestionarios de síntomas autoreferidos por los pacientes podrían ser de utilidad para la identificación precoz y la monitorización de la neurotoxicidad asociada al TAR (B-II).
Gráficos:

Tablas:
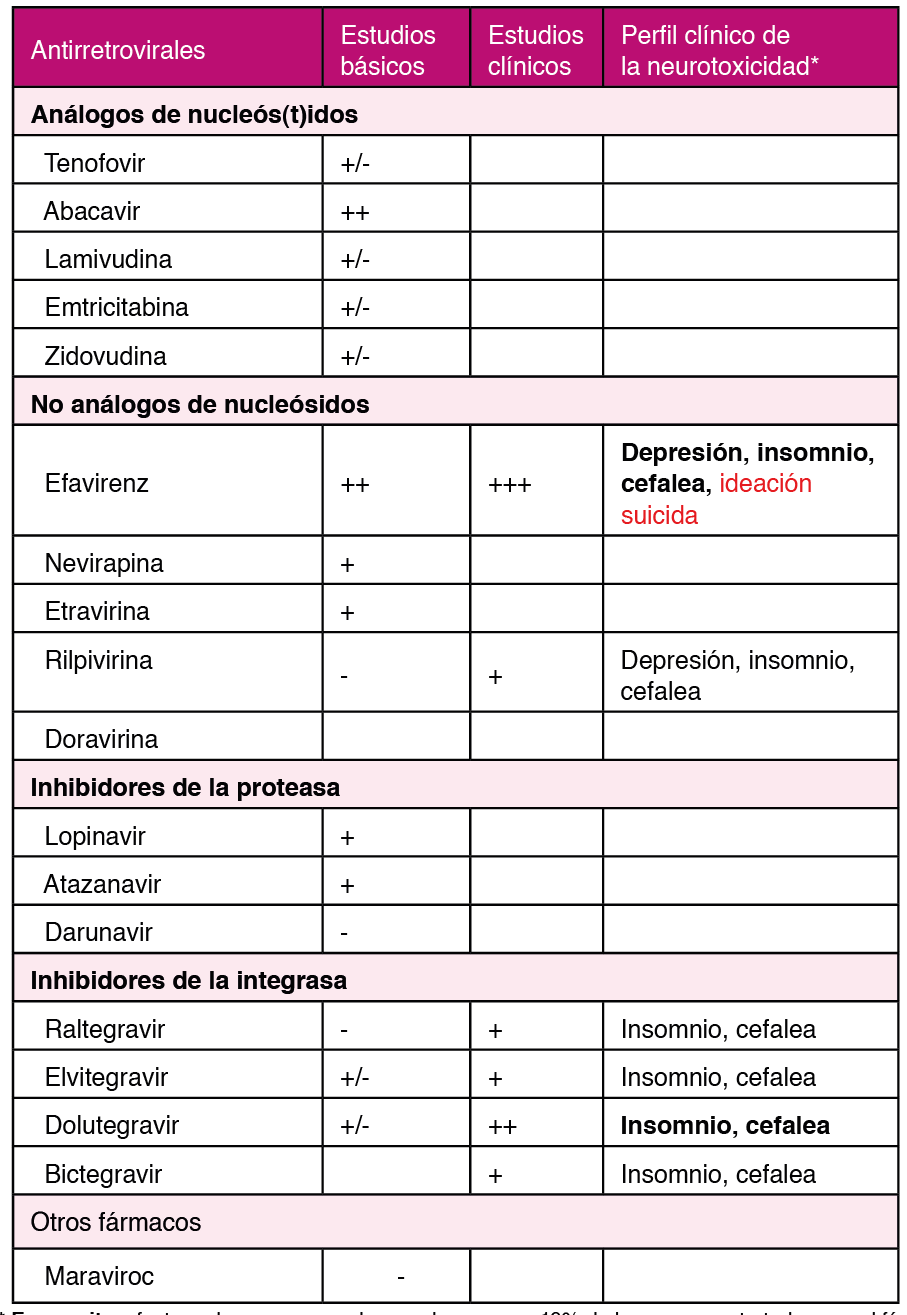
* En negrita: efectos adversos esperados en al menos un 10% de las personas tratadas con el fármaco.
En rojo: efectos adversos graves que pueden suponer un peligro vital y una emergencia médica. En letra normal: Efectos adversos poco frecuentes y por lo general leves.
Bibliografía:
Cantú Guzmán R, Álvarez Bermúdez J, Torres López E, Martínez Sulvarán O. Impacto psicosocial asociado al diagnóstico de infección por vih/SIDA: apartados cualitativos de medición. Revista Electrónica Medicina, Salud y Published online 2012.
Flowers P, Davis MM, Larkin M, Church S, Marriott C. Understanding the impact of HIV diagnosis amongst gay men in Scotland: An interpretative phenomenological Psychology & Health. 2011;26(10):1378-1391. doi:10.1080/08870446.2010.551213
Zeligman M, Wood AW. Conceptualizing an HIV Diagnosis Through a Model of Grief and Adultspan Journal. 2017;16(1):18-30. doi:10.1002/adsp.12031
Richard Lazarus MVMSF. Estrés y Procesos Cognitivos. (Martinez Roca, ed.).; 1986.
Milena Gaviria A, Quiceno JM, Vinaccia S, Martínez LA, Otalvaro Estrategias de afrontamiento y ansiedad-depresión en pacientes diagnosticados con VIH/SIDA. Terapia Psicologica. 2009;27(1):5-13. doi:10.4067/s0718-48082009000100001
Carrobles JA, Remor E, Rodríguez-Alzamora Afrontamiento, apoyo social percibido y distrés emocional en pacientes con infección por VIH. [Relationshiop of coping and perceived social support to emotional distress in people living with HIV.]. Psicothema. 2003;15(3):420-426.
Chida Y, Vedhara Adverse psychosocial factors predict poorer prognosis in HIV disease: A meta- analytic review of prospective investigations. Brain, Behavior, and Immunity. 2009;23(4):434-445. doi:10.1016/j.bbi.2009.01.013
Ironson GH, O’Cleirigh C, Weiss A, Schneiderman N, Costa PT. Personality and HIV Disease Progression: Role of NEO-PI-R Openness, Extraversion, and Profiles of Psychosomatic Medicine. 2008;70(2):245-253. doi:10.1097/PSY.0b013e31816422fc
Lee RS, Kochman A, Sikkema Internalized Stigma Among People Living with HIV-AIDS. AIDS
Guevara-Sotelo Y, Hoyos-Hernández Vivir con VIH: experiencias de estigma sentido en
Chan RCH, Mak WWS. Cognitive, Regulatory, and Interpersonal Mechanisms of HIV Stigma on the Mental and Social Health of Men Who Have Sex With Men Living With HIV. American Journal of Men’s 2019;13(5):155798831987377. doi:10.1177/1557988319873778
Travaglini LE, Himelhoch SS, Fang LJ. HIV Stigma and Its Relation to Mental, Physical and Social Health Among Black Women Living with HIV/AIDS. AIDS and Behavior. 2018;22(12):3783-3794. doi:10.1007/s10461-018-2037-1
Atkinson JS, Nilsson Schönnesson L, Williams ML, Timpson Associations among correlates of schedule adherence to antiretroviral therapy (ART): A path analysis of a sample of crack cocaine using sexually active African–Americans with HIV infection. AIDS Care. 2008;20(2):253- 262. doi:10.1080/09540120701506788
Johnson CJ, Heckman TG, Hansen NB, Kochman A, Sikkema KJ. Adherence to antiretroviral medication in older adults living with HIV/AIDS: a comparison of alternative models. AIDS Care. 2009;21(5):541-551. doi:10.1080/09540120802385611
Santoro Pablo CF. Tipos de problemas de adherencia entre las personas con VIH y tendencias emergentes en la adherencia al tratamiento antirretroviral (TAR). Revista Multidisciplinar del 2013;1(1):41-58.
Dilla T, Valladares A, Lizán L, Sacristán JA. Adherencia y persistencia terapéutica: causas, consecuencias y estrategias de mejora. Atención Primaria. 2009;41(6):342-348. doi:10.1016/j. 2008.09.031
Owe-Larsson M, Säll L, Salamon E, Allgulander HIV infection and psychiatric illness. African
Dyer JG and Reducing HIV risk among people with serious mental illness. J
Parhami I, Fong TW, Siani A, Carlotti C, Khanlou H. Documentation of Psychiatric Disorders and Related Factors in a Large Sample Population of HIV-Positive Patients in California. AIDS and 2013;17(8):2792-2801. doi:10.1007/s10461-012-0386-8
Bing EG, Burnam MA, Longshore D, et al. Psychiatric Disorders and Drug Use Among Human Immunodeficiency Virus–Infected Adults in the United States. Archives of General Psychiatry. 2001;58(8):721. doi:10.1001/archpsyc.58.8.721
Lopes M, Olfson M, Rabkin J, et Gender, HIV Status, and Psychiatric Disorders. The Journal of
Brandt The mental health of people living with HIV/AIDS in Africa: A systematic review. African
Burnam MA, Bing EG, Morton SC, et Use of mental health and substance abuse treatment services among adults with HIV in the United States. Archives of General Psychiatry. 2001;58(8):729-736. doi:10.1001/archpsyc.58.8.729
Kessler RC, Chiu WT, Demler O, Walters EE. Prevalence, Severity, and Comorbidity of 12-Month DSM-IV Disorders in the National Comorbidity Survey Replication. Archives of General Psychiatry. 2005;62(6):617. doi:10.1001/archpsyc.62.6.617
Schadé A, van Grootheest G, Smit JH. HIV-infected mental health patients: Characteristics and comparison with HIV-infected patients from the general population and non-infected mental health BMC Psychiatry. 2013;13. doi:10.1186/1471-244X-13-35
Gallego L, Barreiro P, Lopez-Ibor Diagnosis and Clinical Features of Major Neuropsychiatric
Pence BW, O’Donnell JK, Gaynes Falling through the cracks. AIDS. 2012;26(5):656-658.
Beer L, Tie Y, Padilla M, Shouse Generalized anxiety disorder symptoms among persons with diagnosed HIV in the United States. AIDS. 2019;33(11):1781-1787. doi:10.1097/ QAD.0000000000002286
Rane MS, Hong T, Govere S, et al. Depression and Anxiety as Risk Factors for Delayed Care- Seeking Behavior in Human Immunodeficiency Virus–Infected Individuals in South Africa. Clinical Infectious 2018;67(9):1411-1418. doi:10.1093/cid/ciy309
Glynn TR, Safren SA, Carrico AW, et al. High Levels of Syndemics and Their Association with Adherence, Viral Non-suppression, and Biobehavioral Transmission Risk in Miami, a S. City with an HIV/AIDS Epidemic. AIDS and Behavior. 2019;23(11):2956-2965. doi:10.1007/s10461-019- 02619-0
Been SK, Schadé A, Bassant N, Kastelijns M, Pogány K, Verbon A. Anxiety, depression and treatment adherence among HIV-infected AIDS Care. 2019;31(8):979-987. doi:10.1080/ 09540121.2019.1601676
Zigmond AS, Snaith The Hospital Anxiety and Depression Scale. Acta Psychiatrica
Ferrando L, Bobes J Gibert M, Soto M, Soto M.I.N.I. Mini International Neuropsychiatric
Baldwin DS, Anderson IM, Nutt DJ, Evidence-basedguidelinesforthepharmacologicaltreatment of anxiety disorders: recommendations from the British Association for Psychopharmacology. Journal of Psychopharmacology. 2005;19(6):567-596. doi:10.1177/0269881105059253
Rabkin HIV and depression: 2008 review and update. Current HIV/AIDS Reports. 2008;5(4):163-
doi:10.1007/s11904-008-0025-1
Leserman HIV disease progression: depression, stress, and possible mechanisms. Biological
Mollan KR, Smurzynski M, Eron JJ, et Association Between Efavirenz as Initial Therapy for HIV- 1 Infection and Increased Risk for Suicidal Ideation or Attempted or Completed Suicide. Annals of Internal Medicine. 2014;161(1):1. doi:10.7326/M14-0293
Slot M, Sodemann M, Gabel C, Holmskov J, Laursen T, Rodkjaer Factors associated with risk of depression and relevant predictors of screening for depression in clinical practice: a cross- sectional study among HIV-infected individuals in Denmark. HIV Medicine. 2015;16(7):393-402. doi:10.1111/hiv.12223
Robertson K, Bayon C, Molina J-M, et al. Screening for neurocognitive impairment, depression, and anxiety in HIV-infected patients in Western Europe and AIDS Care. 2014;26(12):1555- 1561. doi:10.1080/09540121.2014.936813
Morrison MF, Petitto JM, Have T ten, et al. Depressive and Anxiety Disorders in Women With HIV
Rao D, Feldman BJ, Fredericksen RJ, et al. A Structural Equation Model of HIV-Related Stigma, Depressive Symptoms, and Medication Adherence. AIDS and Behavior. 2012;16(3):711-716. doi:10.1007/s10461-011-9915-0
Ciesla JA, Roberts JE. Meta-Analysis of the Relationship Between HIV Infection and Risk for Depressive Disorders. American Journal of Psychiatry. 2001;158(5):725-730. doi:10.1176/appi. 158.5.725
Tegger MK, Crane HM, Tapia KA, Uldall KK, Holte SE, Kitahata MM. The Effect of Mental Illness, Substance Use, and Treatment for Depression on the Initiation of Highly Active Antiretroviral Therapy among HIV-Infected Individuals. AIDS Patient Care and STDs. 2008;22(3):233-243. doi:10.1089/apc.2007.0092
Gonzalez JS, Batchelder AW, Psaros C, Safren Depression and HIV/AIDS Treatment Nonadherence: A Review and Meta-analysis. JAIDS Journal of Acquired Immune Deficiency Syndromes. 2011;58(2):181-187. doi:10.1097/QAI.0B013E31822D490A
Springer SA, Dushaj A, Azar MM. The Impact of DSM-IV Mental Disorders on Adherence to Combination Antiretroviral Therapy Among Adult Persons Living with HIV/AIDS: A Systematic AIDS and Behavior. 2012;16(8):2119-2143. doi:10.1007/s10461-012-0212-3
Sherr L, Clucas C, Harding R, Sibley E, Catalan J. HIV and Depression – a systematic review of Psychology, Health & Medicine. 2011;16(5):493-527. doi:10.1080/13548506.2011.5 79990
Leserman Role of Depression, Stress, and Trauma in HIV Disease Progression. Psychosomatic
So‐Armah K, Gupta S, Kundu S, et Depression and all‐cause mortality risk in HIV‐infected and HIV‐uninfected US veterans: a cohort study. HIV Medicine. 2019;20(5):317-329. doi:10.1111/ hiv.12726
European AIDS Clinical Society. EACS Guidelines version 10.0 — EACS. Published November Accessed June 25, 2020. https://www.eacsociety.org/files/2019_guidelines-10.0_final.pdf.
Treisman GJ, Soudry O. Neuropsychiatric Effects of HIV Antiviral Medications. Drug Safety. 2016;39(10):945-957. doi:10.1007/s40264-016-0440-y
Aragonès E, Roca M, Mora F. Abordaje Compartido de La Depresión: Consenso Multidisciplinar ; 2018. Accessed June 25, 2020. Ebook disponible en: www.semfyc.es/wp-content/ uploads/2018/05/ Consenso_depresion.pdf.
Laperriere A, Ironson GH, Antoni MH, et al. Decreased Depression Up to One Year Following CBSM+ Intervention in Depressed Women with AIDS: The Smart/EST Women’s Project. Journal of Health 2005;10(2):223-231. doi:10.1177/1359105305049772
Carrico AW, Antoni MH, Durán RE, et Reductions in depressed mood and denial coping during
Paulus DJ, Brandt CP, Lemaire C, Zvolensky MJ. Trajectory of change in anxiety sensitivity in relation to anxiety, depression, and quality of life among persons living with HIV/AIDS following transdiagnostic cognitive-behavioral therapy. Cognitive Behaviour Therapy. 2020;49(2):149-163. doi:10.1080/16506073.2019.1621929
Freudenreich O, Goforth HW, Cozza KL, et Psychiatric treatment of persons with HIV/AIDS: An HIV-psychiatry consensus survey of current practices. Psychosomatics. 2010;51(6):480-488. doi:10.1176/appi.psy.51.6.480
Ferrando SJ, Freyberg Treatment of depression in HIV positive individuals: A critical review.
Chandra PS, Desai G, Ranjan HIV & Psychiatric Disorders. Vol 121.; 2005.
de Sousa Gurgel W, da Silva Carneiro AH, Barreto Rebouças D, Negreiros de Matos KJ, do Menino Jesus Silva Leitão T, de Matos e Souza FG. Prevalence of bipolar disorder in a HIV- infected outpatient AIDS Care. 2013;25(12):1499-1503. doi:10.1080/09540121.2013.7 79625
Kieburtz K, Zettelmaier AE, Ketonen L, Tuite M, Caine Manic syndrome in AIDS. American
Ellen SR, Judd FK, Mijch AM, Cockram Secondary Mania in Patients with HIV Infection. Australian
Nakimuli-Mpungu E, Musisi S, Mpungu SK, Katabira Primary Mania Versus HIV-Related Secondary Mania in Uganda. American Journal of Psychiatry. 2006;163(8):1349-1354. doi:10.1176/ ajp.2006.163.8.1349
Robinson Primary Mania Versus Secondary Mania of HIV/AIDS in Uganda. American Journal
Nakimuli-Mpungu E, Musisi S, Kiwuwa Mpungu S, Katabira E. Clinical Presentation of Bipolar Mania in HIV-Positive Patients in Psychosomatics. 2009;50(4):325-330. doi:10.1176/appi. psy.50.4.325
Lyketsos CG, Hanson AL, Fishman M, Rosenblatt A, McHugh PR, Treisman GJ. Manic syndrome early and late in the course of HIV. American Journal of Psychiatry. 1993;150(2):326-327. doi:10.1176/ajp.150.2.326
Nakimuli-Mpungu, Mutamba Brian, Nshemerirwe Slyvia, Kiwuwa Mpungu Steven, Seggane Musisi. Effect of HIV infection on time to recovery from an acute manic HIV/AIDS - Research and Palliative Care. 2010;2:185. doi:10.2147/hiv.s9978
Soares Recent advances in the treatment of bipolar mania, depression, mixed states, and rapid cycling. International Clinical Psychopharmacology. 2000;15(4):183-196. doi:10.1097/00004850- 200015040-00001
American Psychiatric Diagnostic and Statistical Manual of Mental Disorders DSM-5
Stolar A. HIV and Psychiatry, Second Edition: A Training and Resource Manual . Cambridge University Press;
Newton PJ, Newsholme W, Brink NS, Manji H, Williams IG, Miller RF. Acute meningoencephalitis and meningitis due to primary HIV infection. BMJ (Clinical research ed). 2002;325(7374):1225- https://Pubmed.ncbi.nlm.nih.gov/12446542
Anguizola-Tamayo D, Bocos-Portillo J, Pardina-Vilella L, et al. Psychosis of dual origin in HIV infection: Viral escape syndrome and autoimmune encephalitis. Neurology Clinical practice. 2019;9(2):178-180. doi:10.1212/CPJ.0000000000000582
Laher A, Ariefdien N, Etlouba HIV prevalence among first-presentation psychotic patients. HIV
de Ronchi D, Faranca I, Forti P, et al. Development of Acute Psychotic Disorders and HIV-1 The International Journal of Psychiatry in Medicine. 2000;30(2):173-183. doi:10.2190/ PLGX-N48F-RBHJ-UF8K
Singh AN, Golledge H, Catalan Treatment of HIV-related psychotic disorders with risperidone: A series of 21 cases. Journal of Psychosomatic Research. 1997;42(5):489-493. doi:10.1016/S0022- 3999(96)00373-X
Fernandez F, Levy JK. The use of molindone in the treatment of psychotic and delirious patients infected with the human immunodeficiency virus. General Hospital Psychiatry. 1993;15(1):31-35. doi:10.1016/0163-8343(93)90088-6
Sewell DD, Jeste D , McAdams LA, et al. Neuroleptic Treatment of HIV-Associated Psychosis.
Millon Classifying Personality Disorders: An Evolution-Based Alternative to an Evidence-Based
Nanni MG, Caruso R, Mitchell AJ, Meggiolaro E, Grassi Depression in HIV Infected Patients: a
Low Y, Goforth H, Preud’homme X, Edinger J, Krystal A. Insomnia in HIV-infected patients: pathophysiologic . AIDS Reviews. 2014;16:3-13.
Omonuwa TS, Goforth HW, Preud’homme X, Krystal AD. The pharmacologic management of insomnia in patients with Journal of clinical sleep medicine : JCSM : official publication of the American Academy of Sleep Medicine. 2009;5(3):251-262. https://Pubmed.ncbi.nlm.nih. gov/19960648
Fekete EM, Williams SL, Skinta MD. Internalised HIV-stigma, loneliness, depressive symptoms and sleep quality in people living with Psychology & Health. 2018;33(3):398-415. doi:10.1080
Rogers BG, Lee JS, Bainter SA, Bedoya CA, Pinkston M, Safren A multilevel examination of sleep, depression, and quality of life in people living with HIV/AIDS. Journal of health psychology. Published online March 1, 2018:1359105318765632-1359105318765632. doi:10.1177/1359105318765632
Qaseem A, Kansagara D, Forciea MA, Cooke M, Denberg TD. Management of Chronic Insomnia Disorder in Adults: A Clinical Practice Guideline From the American College of Physicians. Annals of Internal 2016;165(2):125. doi:10.7326/M15-2175
Wilson S, Anderson K, Baldwin D, et al. British Association for Psychopharmacology consensus statement on evidence-based treatment of insomnia, parasomnias and circadian rhythm disorders: An Journal of Psychopharmacology. 2019;33(8):923-947. doi:10.1177/0269881119855343
Celesia M., Sofia S. A., Rapisarda L., et al. Anxiety, depression and sleep disturbances in hiv+ patients chronically treated with an Efavirenz-based regimen. Infectious Diseases & Tropical Medicine . 2017;3(2):e394.
Asboe D, Catalan J, Mandalia S, et Sexual dysfunction in HIV-positive men is multi-factorial: A study of prevalence and associated factors. AIDS Care - Psychological and Socio-Medical Aspects of AIDS/HIV. 2007;19(8):955-965. doi:10.1080/09540120701209847
Sandfort TGM, Collier KL, Grossberg R. Addressing sexual problems in HIV primary care: Experiences from patients. Archives of Sexual Behavior. 2013;42(7):1357-1368. doi:10.1007/ s10508-012-0009-5
Waters L, Fisher M, Winston A, et A phase IV, double-blind, multicentre, randomized, placebo- controlled, pilot study to assess the feasibility of switching individuals receiving Efavirenz with continuing central nervous system adverse events to etravirine. AIDS. 2011;25(1):65-71. doi:10.1097/QAD.0b013e328341685b
Pinzone MR, Gussio M, Bellissimo F, et Self-Reported Sexual Dysfunction in HIV-Positive
Laumann EO, Paik A, Rosen Sexual dysfunction in the United States: Prevalence and predictors.
Shamloul R, Ghanem Erectile dysfunction. The Lancet. 2013;381(9861):153-165. doi:10.1016/
Santi D, Brigante G, Zona S, Guaraldi G, Rochira Male sexual dysfunction and HIV-a clinical
Slag MF, Morley JE, Elson MK, et Impotence in Medical Clinic Outpatients. JAMA. 1983;249(13):1736-1740. doi:10.1001/jama.1983.03330370046029
Tsertsvadze A, Fink HA, Yazdi F, et al. Oral Phosphodiesterase-5 Inhibitors and Hormonal Treatments for Erectile Dysfunction: A Systematic Review and Meta-analysis. Annals of Internal 2009;151(9):650. doi:10.7326/0003-4819-151-9-200911030-00150
Brock G, Heiselman D, Maggi M, et al. Effect of Testosterone Solution 2% on Testosterone Concentration, Sex Drive and Energy in Hypogonadal Men: Results of a Placebo Controlled Journal of Urology. 2016;195(3):699-705. doi:10.1016/j.juro.2015.10.083
Cai T, Palumbo F, Liguori G, et al. The intra-meatal application of alprostadil cream (Vitaros®) improves drug efficacy and patient’s satisfaction: results from a randomized, two-administration route, cross-over clinical International Journal of Impotence Research. 2019;31(2):119-125. doi:10.1038/s41443-018-0087-6
Derouet H, Caspari D, Rohde V, Rommel G, Ziegler Treatment of erectile dysfunction with
Zhu Z, Zhao R, Hu Y. Symptom Clusters in People Living With HIV: A Systematic Review. Journal
Jong E, Oudhoff LA, Epskamp C, et Predictors and treatment strategies of HIV-related fatigue in the combined antiretroviral therapy era. AIDS. 2010;24(10):1387-1405. doi:10.1097/ QAD.0b013e328339d004
Bengtson AM, Pence BW, Crane HM, et Disparities in depressive symptoms and antidepressant treatment by gender and race/ethnicity among people living with HIV in the United States. PLoS ONE. 2016;11(8). doi:10.1371/journal.pone.0160738
Webel AR, Perazzo J, Decker M, Horvat-Davey C, Sattar A, Voss J. Physical activity is associated with reduced fatigue in adults living with HIV/AIDS. Journal of Advanced 2016;72(12):3104- 3112. doi:10.1111/jan.13084
Bertholet N, Cheng DM, Samet JH, Quinn E, Saitz R. Alcohol consumption patterns in HIV- infected adults with alcohol problems. Drug and Alcohol Dependence. 2010;112(1-2):160-163. doi:10.1016/j.drugalcdep.2010.05.009
Braithwaite RS, Conigliaro J, Roberts MS, et al. Estimating the impact of alcohol consumption on survival for HIV+ individuals. AIDS Care - Psychological and Socio-Medical Aspects of AIDS/HIV. 2007;19(4):459-466. doi:10.1080/09540120601095734
Lucas GM, Mullen BA, Weidle PJ, Hader S, McCaul ME, Moore RD. Directly Administered Antiretroviral Therapy in Methadone Clinics Is Associated with Improved HIV Treatment Outcomes, Compared with Outcomes among Concurrent Comparison Groups. Clinical Infectious Diseases. 2006;42(11):1628-1635. doi:10.1086/503905
Andersen R, Bozzette S, Shapiro M, et al. Access of vulnerable groups to antiretroviral therapy among persons in care for HIV disease in the United States. HCSUS Consortium. HIV Cost and Services Utilization Study. Health services research. 2000;35(2):389-416. https://Pubmed.ncbi. nih.gov/10857469
Cook RL, Sereika SM, Hunt SC, Woodward WC, Erlen JA, Conigliaro J. Problem drinking and medication adherence among persons with HIV infection. Journal of General Internal Medicine. 2001;16(2):83-88. doi:10.1111/j.1525-1497.2001.00122.x
Azar MM, Springer SA, Meyer JP, Altice FL. A systematic review of the impact of alcohol use disorders on HIV treatment outcomes, adherence to antiretroviral therapy and health care Drug and Alcohol Dependence. 2010;112(3):178-193. doi:10.1016/j.drugalcdep.2010.06.014
Wu ES, Metzger DS, Lynch KG, Douglas Association between alcohol use and HIV viral load. Journal of Acquired Immune Deficiency Syndromes. 2011;56(5). doi:10.1097/ QAI.0b013e31820dc1c8
Stein MD, Hanna L, Natarajan R, et al. Alcohol use patterns predict high-risk HIV behaviors among active injection drug users. Journal of Substance Abuse Treatment. 2000;18(4):359-363. doi:10.1016/S0740-5472(99)00070-7
Mathews WC, McCutchan JA, Asch S, et National estimates of HIV-related symptom prevalence from the HIV cost and services utilization study. Medical Care. 2000;38(7):750-761. doi:10.1097/00005650-200007000-00007
Shacham E, Agbebi A, Stamm K, Overton ET. Alcohol consumption is associated with poor health in HIV clinic patient population: A behavioral surveillance AIDS and Behavior. 2011;15(1):209- 213. doi:10.1007/s10461-009-9652-9
Palepu A, Horton NJ, Tibbetts N, Meli S, Samet Substance abuse treatment and hospitalization among a cohort of HIV-infected individuals with alcohol problems. Alcoholism: Clinical and Experimental Research. 2005;29(3):389-394. doi:10.1097/01.ALC.0000156101.84780.45
Korthuis PT, Tozzi MJ, Nandi V, et Improved quality of life for opioid-dependent patients receiving buprenorphine treatment in HIV clinics. Journal of Acquired Immune Deficiency Syndromes. 2011;56(SUPPL. 1). doi:10.1097/QAI.0b013e318209754c
Lucas GM, Griswold M, Gebo KA, Keruly J, Chaisson RE, Moore Illicit Drug Use and HIV- 1 Disease Progression: A Longitudinal Study in the Era of Highly Active Antiretroviral Therapy. American Journal of Epidemiology. 2006;163(5):412-420. doi:10.1093/aje/kwj059
Galvan FH, Bing EG, Fleishman JA, et al. The prevalence of alcohol consumption and heavy drinking among people with HIV in the United States: Results from the HIV cost and services utilization Journal of Studies on Alcohol. 2002;63(2):179-186. doi:10.15288/jsa.2002.63.179
Bagby GJ, Amedee AM, Siggins RW, Molina PE, Nelson S, Veazey Alcohol and HIV Effects on the Immune System. Alcohol research : current reviews. 2015;37(2):287-297. https://Pubmed. ncbi.nlm.nih.gov/26695751
Amedee A, Nichols W, Robichaux S, Bagby G, Nelson S. Chronic Alcohol Abuse and HIV Disease Progression: Studies with the Non-Human Primate Current HIV Research. 2014;12(4):243- 253. doi:10.2174/1570162x12666140721115717
Ludford KT, Vagenas P, Lama JR, et al. Screening for Drug and Alcohol Use Disorders and Their Association with HIV-Related Sexual Risk Behaviors among Men Who Have Sex with Men in PLoS ONE. 2013;8(8). doi:10.1371/journal.pone.0069966
Parry CD, Blank MB, Pithey AL. Responding to the threat of HIV among persons with mental illness and substance abuse. Current Opinion in Psychiatry. 2007;20(3):235-241. doi:10.1097/ 0b013e3280ebb5f0
Kader R, Govender R, Seedat S, Koch JR, Parry C. Understanding the impact of hazardous and harmful use of alcohol and/or other drugs on ARV adherence and disease progression. PLoS 2015;10(5). doi:10.1371/journal.pone.0125088
Pellowski JA, Kalichman SC, Kalichman MO, Cherry C. Alcohol-antiretroviral therapy interactive toxicity beliefs and daily medication adherence and alcohol use among people living with HIV. AIDS Care - Psychological and Socio-Medical Aspects of AIDS/HIV. 2016;28(8):963-970. doi:10. 1080/09540121.2016.1154134
Williams EC, Hahn JA, Saitz R, Bryant K, Lira MC, Samet Alcohol Use and Human Immunodeficiency Virus (HIV) Infection: Current Knowledge, Implications, and Future Directions. Alcoholism: Clinical and Experimental Research. 2016;40(10):2056-2072. doi:10.1111/acer.13204
Kelso NE, Sheps DS, Cook RL. The association between alcohol use and cardiovascular disease among people living with HIV: A systematic American Journal of Drug and Alcohol Abuse. 2015;41(6):479-488. doi:10.3109/00952990.2015.1058812
McGinnis KA, Fultz SL, Skanderson M, Conigliaro J, Bryant K, Justice Hepatocellular carcinoma and non-Hodgkin’s lymphoma: The roles of HIV, hepatitis C infection, and alcohol abuse. Journal of Clinical Oncology. 2006;24(31):5005-5009. doi:10.1200/JCO.2006.05.7984
Fein G, Biggins CA, MacKay S. Alcohol abuse and HIV infection have additive effects on frontal cortex function as measured by auditory evoked potential P3A latency. Biological Psychiatry. 1995;37(3):183-195. doi:10.1016/0006-3223(94)00119-N
Gongvatana A, Morgan EE, Iudicello JE, Letendre SL, Grant I, Woods SP. A history of alcohol dependence augments HIV-associated neurocognitive deficits in persons aged 60 and older. Journal of 2014;20(5):505-513. doi:10.1007/s13365-014-0277-z
Pérez-Molina JA, Polo R, López-Aldeguer J, et al. Executive summary of the GeSIDA/National AIDS Plan consensus document on antiretroviral therapy in adults infected by the human immunodeficiency virus (updated January 2018). Enfermedades Infecciosas y Microbiologia 2019;37(3):195-202. doi:10.1016/j.eimc.2018.02.010
Mcdowell JA, Chittick GE, Stevens CP, Edwards KD, Stein DS. Pharmacokinetic interaction of Abacavir (1592U89) and ethanol in human immunodeficiency virus-infected adults. Antimicrobial Agents and 2000;44(6):1686-1690. doi:10.1128/AAC.44.6.1686-1690.2000
McCance-Katz EF, Gruber VA, Beatty G, Lum PJ, Rainey Interactions between alcohol and the antiretroviral medications Ritonavir or Efavirenz. Journal of Addiction Medicine. 2013;7(4):264- 270. doi:10.1097/ADM.0b013e318293655a
Gruber VA, Rainey PM, Lum PJ, Beatty GW, Aweeka FT, McCance-Katz Interactions between
Lifson AR, Neuhaus J, Arribas JR, van Berg-Wolf M den, Labriola AM, Read TRH. Smoking- related health risks among persons with HIV in the strategies for management of antiretroviral therapy clinical trial. American Journal of Public Health. 2010;100(10):1896-1903. doi:10.2105/ 2009.188664
Lifson AR, Lando HA. Smoking and HIV: Prevalence, health risks, and cessation strategies. Current HIV/AIDS 2012;9(3):223-230. doi:10.1007/s11904-012-0121-0
Zyambo CM, Burkholder GA, Cropsey KL, et al. Predictors of smoking cessation among people living with HIV receiving routine clinical care. AIDS Care - Psychological and Socio-Medical Aspects of AIDS/HIV. 2019;31(11):1353-1361. doi:10.1080/09540121.2019.1619659
Helleberg M, May MT, Ingle SM, et Smoking and life expectancy among HIV-infected individuals on antiretroviral therapy in Europe and North America. AIDS. 2015;29(2):221-229. doi:10.1097/ QAD.0000000000000540
Petoumenos K, Worm S, Reiss P, et Rates of cardiovascular disease following smoking cessation in patients with HIV infection: Results from the D:A:D study. HIV Medicine. 2011;12(7):412-421. doi:10.1111/j.1468-1293.2010.00901.x
Shepherd L, Ryom L, Law M, et al. Cessation of Cigarette Smoking and the Impact on Cancer Incidence in Human Immunodeficiency Virus–infected Persons: The Data Collection on Adverse Events of Anti-HIV Drugs Clinical Infectious Diseases. 2018;68(4):650-657. doi:10.1093/cid/ ciy508
Vidrine DJ, Arduino RC, Gritz ER. The effects of smoking abstinence on symptom burden and quality of life among persons living with HIV/AIDS. AIDS Patient Care and 2007;21(9):659- 666. doi:10.1089/apc.2007.0022
Reddy KP, Parker RA, Losina E, et Impact of Cigarette Smoking and Smoking Cessation on Life Expectancy Among People With HIV: A US-Based Modeling Study. The Journal of Infectious Diseases. 2016;214(11):1672-1681. doi:10.1093/infdis/jiw430
Tait RJ, Caldicott D, Mountain D, Hill SL, Lenton S. A systematic review of adverse events arising from the use of synthetic cannabinoids and their associated treatment. Clinical Toxicology. 2016;54(1):1-13. doi:10.3109/15563650.2015.1110590
Fogarty A, Rawstorne P, Prestage G, Crawford J, Grierson J, Kippax S. Marijuana as therapy for people living with HIV/AIDS: Social and health aspects. AIDS Care - Psychological and Socio- Medical Aspects of AIDS/HIV. 2007;19(2):295-301. doi:10.1080/09540120600841930
Furler MD, Einarson TR, Millson M, Walmsley S, Bendayan R. Medicinal and Recreational Marijuana Use by Patients Infected with HIV. AIDS Patient Care and STDs. 2004;18(4):215-228. doi:10.1089/108729104323038892
Prentiss D, Power R, Balmas G, Tzuang G, Israelski Patterns of Marijuana Use among Patients with HIV/AIDS Followed in a Public Health Care Setting. Journal of Acquired Immune Deficiency Syndromes. 2004;35(1):38-45. doi:10.1097/00126334-200401010-00005
Woolridge E, Barton S, Samuel J, Osorio J, Dougherty A, Holdcroft A. Cannabis use in HIV for pain and other medical symptoms. Journal of Pain and Symptom Management. 2005;29(4):358- doi:10.1016/j.jpainsymman.2004.07.011
Bonn-Miller MO, Oser ML, Bucossi MM, Trafton Cannabis use and HIV antiretroviral therapy adherence and HIV-related symptoms. Journal of Behavioral Medicine. 2014;37(1):1-10. doi:10.1007/s10865-012-9458-5
Lake S, Kerr T, Capler R, Shoveller J, Montaner J, Milloy High-intensity cannabis use and HIV clinical outcomes among HIV-positive people who use illicit drugs in Vancouver, Canada. International Journal of Drug Policy. 2017;42:63-70. doi:10.1016/j.drugpo.2017.02.009
Sinha S, McCaul ME, Hutton HE, et al. Marijuana use and HIV treatment outcomes among PWH receiving care at an urban HIV clinic. Journal of Substance Abuse Treatment. 2017;82:102-106. doi:10.1016/j.jsat.2017.09.009
Fuster-RuizdeApodaca MJ, Castro-Granell V, Garin N, et al. Prevalence and patterns of illicit drug use in people living with HIV in Spain: A cross-sectional PLoS ONE. 2019;14(6). doi:10.1371/ journal.pone.0211252
Baum MK, Rafie C, Lai S, Sales S, Page B, Campa A. Crack-cocaine use accelerates HIV disease progression in a cohort of HIV-positive drug users. Journal of Acquired Immune Deficiency 2009;50(1):93-99. doi:10.1097/QAI.0b013e3181900129
Shoptaw S, Stall R, Bordon J, et al. Cumulative exposure to stimulants and immune function outcomes among HIV-positive and HIV-negative men in the Multicenter AIDS Cohort Study. International Journal of STD and 2012;23(8):576-580. doi:10.1258/ijsa.2012.011322
Mukerji S, Haghighat R, Misra V, et al. Longitudinal Modeling of Depressive Trajectories Among HIV-Infected Men Using AIDS and Behavior. 2017;21(7):1985-1995. doi:10.1007/s10461- 017-1801-y
European Monitoring Centre for Drugs and Drug Addiction (EMCDDA). Emergency health consequences of cocaine use in Europe. A review of the monitoring of drug-related acute emergencies in 30 European countries | emcdda.europa.eu. Published 2014. Accessed June 19, 2020. https://www.emcdda.europa.eu/publications/scientific-studies/2014/cocaine- emergencies_en
Informe Europeo sobre Drogas Tendencias y doi:10.2810/295940
Montain J, Ti L, Hayashi K, Nguyen P, Wood E, Kerr T. Impact of length of injecting career on HIV incidence among people who inject Addictive Behaviors. 2016;58:90-94. doi:10.1016/j. addbeh.2016.02.020
Peters PJ, Pontones P, Hoover KW, et HIV infection linked to injection use of oxymorphone in Indiana, 2014-2015. New England Journal of Medicine. 2016;375(3):229-239. doi:10.1056/ NEJMoa1515195
Bourne A, Reid D, Hickson F, Torres-Rueda S, Weatherburn P. Illicit drug use in sexual settings (‘chemsex’) and HIV/STI transmission risk behaviour among gay men in South London: Findings from a qualitative study. Sexually Transmitted Infections. 2015;91(8):564-568. doi:10.1136/ sextrans-2015-052052
Fernández Dávila “Sesión de sexo, morbo y vicio”: una aproximación holística para entender la aparición del fenómeno ChemSex entre hombres gais, bisexuales y otros hombres que tienen sexo con hombres en España. Revista Multidisciplinar del SIDA. 2016;4:41-65.
Payancé A, Scotto B, Perarnau JM, de Muret A, Bacq Y. Severe chronic hepatitis secondary to prolonged use of ecstasy and cocaine. Clinics and Research in Hepatology and Gastroenterology. 2013;37(5). doi:10.1016/j.clinre.2013.06.003
Rodríguez Salgado B. Fenetilaminas Clásicas: MDMA y Sus Análogos, p-Metoxianfetaminas y En: Nuevas Drogas Psicoactivas. . Entheos; 2015.
Dolengevich-Segal H, Rodríguez Salgado B, Ramírez JGA, Sánchez-Mateos D. Nuevas Drogas Vol Cap 5. Entheos; 2015. doi:10.20882/adicciones.709
Swanson Unifying theories of psychedelic drug effects. Frontiers in Pharmacology. 2018;9(MAR). doi:10.3389/fphar.2018.00172
Vollenweider Brain mechanisms of hallucinogens and entactogens. Dialogues in clinical neuroscience. 2001;3:265-279.
Nichols D, Grob Is LSD toxic? Forensic science international. 2018;284:141-145. doi:10.1016/j. forsciint.2018.01.006
Hildebrand M. The psychometric properties of the drug use disorders identification test (DUDIT): A review of recent Journal of Substance Abuse Treatment. 2015;53:52-59. doi:10.1016/j. jsat.2015.01.008
Saunders JB, Aasland OG, Babor TF, de La Fuente JR, Grant Development of the Alcohol Use Disorders Identification Test (AUDIT): WHO Collaborative Project on Early Detection of Persons with Harmful Alcohol Consumption‐II. Addiction. 1993;88(6):791-804. doi:10.1111/j.1360-0443.1993. tb02093.x
Gates PJ, Sabioni P, Copeland J, le Foll B, Gowing Psychosocial interventions for cannabis use disorder. Cochrane Database of Systematic Reviews. 2016;2016(5). doi:10.1002/14651858. CD005336.pub4
Wechsberg WM, Golin C, El-Bassel N, Hopkins J, Zule W. Current interventions to reduce sexual risk behaviors and crack cocaine use among HIV-infected individuals. Current HIV/AIDS Reports. 2012;9(4):385-393. doi:10.1007/s11904-012-0131-y
Gonzales D, Rennard SI, Nides M, et al. Varenicline, an α4β2 nicotinic acetylcholine receptor partial agonist, vs sustained-release Bupropion and placebo for smoking cessation: A randomized controlled trial. Journal of the American Medical Association. 2006;296(1):47-55. doi:10.1001/ 296.1.47
West R, Baker CL, Cappelleri JC, Bushmakin AG. Effect of varenicline and Bupropion SR on craving, nicotine withdrawal symptoms, and rewarding effects of smoking during a quit attempt. 2008;197(3):371-377. doi:10.1007/s00213-007-1041-3
Amodei N, Lamb RJ. The Role of Nicotine Replacement Therapy in Early Quitting Success. Nicotine & tobacco research : official journal of the Society for Research on Nicotine and 2010;12(1):1-10. doi:10.1093/NTR/NTP164
World Health Organisation. Consolidated ARV guidelines on the use of antiretroviral drugs for treating and preventing HIV infection: recommendations for a public health approach. Geneva: World Health Published 2013. Accessed June 19, 2020. http://www.who.int/hiv/pub/ guidelines/arv2013/
Beauverie P, Taburet AM, Dessalles MC, Furlan V, Touzeau D. Therapeutic Drug Monitoring of Methadone in HIV-infected Patients Receiving Protease AIDS . 1998;12(18):2510-2511.
Clarke S, Mulcahy F, Bergin C, et al. Absence of Opioid Withdrawal Symptoms in Patients Receiving Methadone and the Protease Inhibitor Lopinavir‐Ritonavir. Clinical Infectious Diseases. 2002;34(8):1143-1145. doi:10.1086/339541
Clarke SM, Mulcahy FM, Tjia J, et al. Pharmacokinetic Interactions of Nevirapine and Methadone and Guidelines for Use of Nevirapine to Treat Injection Drug Users. Clinical Infectious Diseases. 2001;33(9):1595-1597. doi:10.1086/322519
Ostrow DG, Plankey MW, Cox C, et al. Specific sex drug combinations contribute to the majority of recent HIV seroconversions among MSM in the MACS. Journal of Acquired Immune Deficiency 2009;51(3):349-355. doi:10.1097/QAI.0b013e3181a24b20
Kenyon C, Wouters K, Platteau T, Buyze J, Florence E. Increases in condomless chemsex associated with HIV acquisition in MSM but not heterosexuals attending a HIV testing center in Antwerp, AIDS Research and Therapy. 2018;15(1). doi:10.1186/s12981-018-0201-3
Dolengevich-Segal H, Gonzalez-Baeza A, Valencia J, et al. Drug-related and psychopathological symptoms in HIV-positive men who have sex with men who inject drugs during sex (slamsex): Data from the U-SEX GeSIDA 9416 PLoS ONE. 2019;14(12). doi:10.1371/journal.pone.0220272
World Federation for Mental Health SALUD MENTAL EN ATENCIÓN PRIMARIA: MEJORANDO LOS TRATAMIENTOS Y PROMOVIENDO LA SALUD MENTAL. Accessed June 25, 2020. http:// www.infocop.es/view_article.asp?id=2582
Forstein M, Cournos F, Douaihy A, Goodkin K, Wainberg ML, Wapenyi Guideline Watch:
Kendall CE, Shoemaker ES, Boucher L, et al. The organizational attributes of HIV care delivery models in Canada: A cross-sectional PLoS ONE. 2018;13(6). doi:10.1371/journal. pone.0199395
Haggerty JL, Roberge D, Freeman GK, Beaulieu C. Experienced continuity of care when patients see multiple clinicians: A qualitative metasummary. Annals of Family Medicine. 2013;11(3):262- doi:10.1370/afm.1499
Tran BX, Ho RCM, Ho CSH, et Depression among patients with HIV/AIDS: Research development and effective interventions (gapresearch). International Journal of Environmental Research and Public Health. 2019;16(10). doi:10.3390/ijerph16101772
Eshun-Wilson I, Siegfried N, Akena DH, Stein DJ, Obuku EA, Joska JA. Antidepressants for depression in adults with HIV Cochrane Database of Systematic Reviews. 2018;2018(1). doi:10.1002/14651858.CD008525.pub3
Hill L, Lee KC. Pharmacotherapy considerations in patients with HIV and psychiatric disorders: Focus on antidepressants and antipsychotics. Annals of Pharmacotherapy. 2013;47(1):75-89. doi:10.1345/aph.1R343
DeSilva KE, le Flore DB, Marston BJ, Rimland D. Serotonin syndrome in HIV-infected individuals receiving antiretroviral therapy and AIDS. 2001;15(10):1281-1285. doi:10.1097/00002030- 200107060-00010
Cettomai D, McArthur JC. Mirtazapine use in human immunodeficiency virus-infected patients with progressive multifocal leukoencephalopathy. Archives of Neurology. 2009;66(2):255-258. doi:10.1001/archneurol.2008.557
Jann MW, Spratlin V, Momary K, et al. Lack of a pharmacokinetic drug-drug interaction with venlafaxine extended-release/indinavir and desvenlafaxine extended-release/indinavir. European Journal of Clinical 2012;68(5):715-721. doi:10.1007/s00228-011-1180-7
Park J, Vousden M, Brittain C, et al. Dose-related reduction in Bupropion plasma concentrations by Journal of Clinical Pharmacology. 2010;50(10):1180-1187. doi:10.1177/0091270009359524
Pedrol-Clotet E, Deig-Comerma E, Ribell-Bachs M, Vidal-Castell I, García-Rodríguez P, Soler
Uso de bupropión en la deshabituación tabáquica en pacientes infectados por el VIH en tratamiento antirretroviral. Enfermedades Infecciosas y Microbiologia Clinica. 2006;24(8):509-511. doi:10.1157/13092468
Adams JL, Gaynes BN, McGuinness T, Modi R, Willig J, Pence BW. Treating depression within the HIV medical home: A guided algorithm for antidepressant management by HIV clinicians. AIDS Patient Care and 2012;26(11):647-654. doi:10.1089/apc.2012.0113
Pettersson A, Boström KB, Gustavsson P, Ekselius Which instruments to support diagnosis of depression have sufficient accuracy? A systematic review. Nordic Journal of Psychiatry. 2015;69(7):497-508. doi:10.3109/08039488.2015.1008568
Newville H, Roley J, Sorensen Prescription medication misuse among HIV-infected individuals taking antiretroviral therapy. Journal of Substance Abuse Treatment. 2015;48(1):56-61. doi:10.1016/j.jsat.2014.07.013
Johannessen Landmark C. Antiepileptic drugs in non-epilepsy disorders: Relations between mechanisms of action and clinical CNS Drugs. 2008;22(1):27-47. doi:10.2165/00023210- 200822010-00003
HIV Drug University of Liverpool. Accessed June 26, 2020. https://liverpool-hiv-hep. s3.amazonaws.com/prescribing_resources/pdfs/000/000/023/original/TS_Antipsychotic_2019_ Oct.pdf?1571043424
Owen-Smith A, Depadilla L, Diclemente R. The assessment of complementary and alternative medicine use among individuals with HIV: A systematic review and recommendations for future Journal of Alternative and Complementary Medicine. 2011;17(9):789-796. doi:10.1089/ acm.2010.0669
Panel de expertos de GeSIDA y Plan Nacional sobre el Documento de Consenso de GeSIDA/ Plan Nacional Sobre El SIDA Respecto al Tratamiento Antirretroviral En Adultos Infectados Por El Virus de La Inmunodeficiencia Humana.; 2019. Accessed June 25, 2020. http://GeSIDA-seimc. org/wp-content/uploads/2019/01/GeSIDA_DC_TAR_2019_v_final.pdf.
Thomas Mulet V, Aguado Taberna C, Fidalgo Gónzalez S, et La infección por el VIH/SIDA y atención primaria. Atención Primaria. 2004;33(1):3-5. Accessed June 23, 2020. http://www. elsevier.es/es-revista-atencion-primaria-27-articulo-la-infeccion-por-el-vih-SIDA-13056498
Gallego Deike L, Gordillo Álvarez-Valdés M v. Trastornos mentales en pacientes infectados por el
Gordillo V. Trastornos psicológicos y aspectos psicosociales. Manual del SIDA. Published online 1999:605-620.
Casanova Colominas JM, Carmen Rodríguez Fernández M, Gómez García Manejo del paciente con VIH en Atención Primaria. AMF. 2013;9:306-315.
Núñez Rojas AC, Tobón S, Vinaccia Diseño de Un Modelo de Intervención Psicoterapéutica En El Área de La Salud a Partir Del Enfoque Procesal Del Estrés. Vol 13. Universidad de los Andes.; 2006. Accessed June 23, 2020. http://www.scielo.org.co/scielo.php?script=sci_ arttext&pid=S0123-885X2004000200007&lng=en&nrm=iso&tlng=es
Jin Y, Potthoff A, Xu J, et al. Evaluation of Mental Status HIV-Infected Patients: Implications for Treatment. Current HIV Research. 2012;10(6):546-551. doi:10.2174/157016212802429857
Balfour L, Kowal J, Silverman A, et al. A randomized controlled psycho-education intervention trial: Improving psychological readiness for successful HIV medication adherence and reducing depression before initiating HAART. AIDS Care - Psychological and Socio-Medical Aspects of AIDS/HIV. 2006;18(7):830-838. doi:10.1080/09540120500466820
Hill S, Kavookjian J. Motivational interviewing as a behavioral intervention to increase HAART adherence in patients who are HIV-positive: A systematic review of the literature. AIDS Care - Psychological and Socio-Medical Aspects of AIDS/HIV. 2012;24(5):583-592. doi:10.1080/095401 2011.630354
Hollon SD, DeRubeis RJ, Shelton RC, et al. Prevention of relapse following cognitive therapy vs medications in moderate to severe depression. Archives of General Psychiatry. 2005;62(4):417- doi:10.1001/archpsyc.62.4.417
Parikh S v., Segal Z v., Grigoriadis S, et al. Canadian Network for Mood and Anxiety Treatments (CANMAT) Clinical guidelines for the management of major depressive disorder in adults. II. Psychotherapy alone or in combination with antidepressant medication. Journal of Affective 2009;117(SUPPL. 1). doi:10.1016/j.jad.2009.06.042
Spies G, Asmal L, Seedat S. Cognitive-behavioural interventions for mood and anxiety disorders in HIV: A systematic review. Journal of Affective Disorders. 2013;150(2):171-180. doi:10.1016/j. 2013.04.018
Brown JL, Vanable PA. Cognitive-behavioral stress management interventions for persons living with HIV: A review and critique of the Annals of Behavioral Medicine. 2008;35(1):26-40. doi:10.1007/s12160-007-9010-y
Markowitz JC, Kocsis JH, Fishman B, et al. Treatment of depressive symptoms in human immunodeficiency virus- positive patients. Archives of General Psychiatry. 1998;55(5):452-457. doi:10.1001/archpsyc.55.5.452
Markowitz J, Spielman L, Sullivan M, Fishman An Exploratory Study of Ethnicity and Psychotherapy Outcome Among HIV-Positive Patients With Depressive Symptoms. The Journal of psychotherapy practice and research. 2000;9:226-231.
Gayner B, Esplen MJ, de Roche P, et A randomized controlled trial of mindfulness-based stress reduction to manage affective symptoms and improve quality of life in gay men living with HIV. Journal of Behavioral Medicine. 2012;35(3):272-285. doi:10.1007/s10865-011-9350-8
Creswell JD, Myers HF, Cole SW, Irwin MR. Mindfulness meditation training effects on CD4+ T lymphocytes in HIV-1 infected adults: A small randomized controlled trial. Brain, Behavior, and 2009;23(2):184-188. doi:10.1016/j.bbi.2008.07.004
Seyedalinaghi S, Jam S, Foroughi M, et al. Randomized controlled trial of mindfulness-based stress reduction delivered to human immunodeficiency virus-positive patients in Iran: Effects on CD4 + T lymphocyte count and medical and psychological symptoms. Psychosomatic Medicine. 2012;74(6):620-627. doi:10.1097/PSY.0b013e31825abfaa
Gonzalez-Garcia M, Ferrer MJ, Borras X, et al. Effectiveness of mindfulness-based cognitive therapy on the quality of life, emotional status, and CD4 cell count of patients aging with HIV AIDS and Behavior. 2014;18(4):676-685. doi:10.1007/s10461-013-0612-z
World Health Risks to Mental Health : An Overview of Vulnerabilities and Risk
Vreeman RC, McCoy BM, Lee S. Mental health challenges among adolescents living with HIV. Journal of the International AIDS 2017;20(Suppl 3). doi:10.7448/IAS.20.4.21497
Donenberg GR, Pao Youths and HIV/AIDS: Psychiatry’s role in a changing epidemic. Journal of the American Academy of Child and Adolescent Psychiatry. 2005;44(8):728-747. doi:10.1097/01. chi.0000166381.68392.02
González-Scarano F, Martín-García The neuropathogenesis of AIDS. Nature Reviews Immunology. 2005;5(1):69-81. doi:10.1038/nri1527
Marhefka SL, Lyon M, Koenig LJ, et Emotional and behavioral problems and mental health service utilization of youth living with HIV acquired perinatally or later in life. AIDS Care - Psychological and Socio-Medical Aspects of AIDS/HIV. 2009;21(11):1447-1454. doi:10.1080/09540120902883085
García-Navarro C, García I, Medín G, et Aspectos psicosociales en una cohorte de adolescentes con infección por el virus de la inmunodeficiencia humana por transmisión vertical. NeuroCoRISpeS. Enfermedades Infecciosas y Microbiologia Clinica. 2014;32(10):631-637. doi:10.1016/j.eimc.2013.11.008
Mellins CA, Brackis-Cott E, Leu CS, et al. Rates and types of psychiatric disorders in perinatally human immunodeficiency virus-infected youth and Journal of Child Psychology and Psychiatry and Allied Disciplines. 2009;50(9):1131-1138. doi:10.1111/j.1469-7610.2009.02069.x
Mellins CA, Malee Understanding the mental health of youth living with perinatal HIV infection: Lessons learned and current challenges. Journal of the International AIDS Society. 2013;16(1). doi:10.7448/IAS.16.1.18593
le Prevost M, Arenas-Pinto A, Melvin D, et al. Anxiety and depression symptoms in young people with perinatally acquired HIV and HIV affected young people in AIDS Care - Psychological and Socio-Medical Aspects of AIDS/HIV. 2018;30(8):1040-1049. doi:10.1080/09540121.2018.144 1972
Kapetanovic S, Wiegand RE, Dominguez K, et Associations of medically documented psychiatric diagnoses and risky health behaviors in highly active antiretroviral therapy-experienced perinatally HIV-infected youth. AIDS Patient Care and STDs. 2011;25(8):493-501. doi:10.1089/apc.2011.0107
Woods SP, Moore DJ, Weber E, Grant I. Cognitive neuropsychology of HIV-associated neurocognitive Neuropsychology Review. 2009;19(2):152-168. doi:10.1007/s11065-009- 9102-5
van den Hof M, ter Haar AM, Scherpbier HJ, et al. Neurocognitive Development in Perinatally Human Immunodeficiency Virus–infected Adolescents on Long-term Treatment, Compared to Healthy Matched Controls: A Longitudinal Study. Clinical Infectious Diseases. 2020;32:21-29. doi:10.1093/cid/ciz386
Robbins RN, Zimmerman R, Korich R, et al. Longitudinal trajectories of neurocognitive test performance among individuals with perinatal HIV-infection and -exposure: adolescence through young adulthood. AIDS Care - Psychological and Socio-Medical Aspects of AIDS/HIV. 2020;32(1):21-29. doi:10.1080/09540121.2019.1626343
Williams PL, Storm D, Montepiedra G, et al. Predictors of adherence to antiretroviral medications in children and adolescents with HIV infection. Pediatrics. 2006;118(6). doi:10.1542/peds.2006- 0493
Murphy DA, Wilson CM, Durako SJ, Muenz LR, Belzer M. Antiretroviral medication adherence among the REACH HIV-infected adolescent cohort in the USA. AIDS Care - Psychological and Socio-Medical Aspects of AIDS/HIV. 2001;13(1):27-40. doi:10.1080/09540120020018161
Kang E, Delzell DAP, Chhabra M, Oberdorfer Factors associated with high rates of antiretroviral medication adherence among youth living with perinatal HIV in Thailand. International Journal of STD and AIDS. 2015;26(8):534-541. doi:10.1177/0956462414545524
Capilla M, Montes M, Gómez M, Barrio V. Primera adaptación del CDI-S a población española. Acción psicológica, ISSN 1578-908X, Vol 1, No 3, 2002, pags 263-272. 2002;1.
Masip A, Amador-Campos J, Cebollero M. Características psicométricas de la Reynolds Adolescent Depression Scale en población comunitaria y clínica. International Journal of Clinical and Health 2008;8.
Herrero MJ, Blanch J, Peri JM, de Pablo J, Pintor L, Bulbena A. A validation study of the hospital anxiety and depression scale (HADS) in a Spanish population. General Hospital Psychiatry. 2003;25(4):277-283. doi:10.1016/S0163-8343(03)00043-4
Richardson LP, Rockhill C, Russo JE, et Evaluation of the PHQ-2 as a brief screen for detecting major depression among adolescents. Pediatrics. 2010;125(5). doi:10.1542/peds.2009-2712
Berger BE, Ferrans CE, Lashley Measuring stigma in people with HIV: Psychometric assessment of the HIV stigma scale. Research in Nursing and Health. 2001;24(6):518-529. doi:10.1002/nur.10011
Bussing R, Fernandez M, Harwood M, et al. Parent and teacher SNAP-IV ratings of attention deficit hyperactivity disorder symptoms: Psychometric properties and normative ratings from a school district Assessment. 2008;15(3):317-328. doi:10.1177/1073191107313888
Duncan L, Georgiades K, Wang L, et al. Psychometric evaluation of the Mini International Neuropsychiatric Interview for Children and Adolescents (MINI-KID). Psychological Assessment. 2018;30(7):916-928. doi:10.1037/pas0000541
Malhotra S, Padhy SK. Challenges in Providing Child and Adolescent Psychiatric Services in Low Resource Countries. Child and Adolescent Psychiatric Clinics of North America. 2015;24(4):777- doi:10.1016/j.chc.2015.06.007
Philbin MM, Tanner AE, Chambers BD, et Transitioning HIV-infected adolescents to adult care
Skeen SA, Sherr L, Croome N, et al. Interventions to improve psychosocial well-being for children affected by HIV and AIDS: a systematic review. Vulnerable Children and Youth Studies. 2017;12(2):91-116. doi:10.1080/17450128.2016.1276656
McKay MM, Chasse KT, Paikoff R, et al. Family-level impact of the CHAMP family program: A community collaborative effort to support urban families and reduce youth HIV risk exposure. Family 2004;43(1):79-93. doi:10.1111/j.1545-5300.2004.04301007.x
Brown LK, Kennard BD, Emslie GJ, et al. Effective Treatment of Depressive Disorders in Medical Clinics for Adolescents and Young Adults Living with HIV: A Controlled Trial. Journal of Acquired Immune Deficiency 2016;71(1):38-46. doi:10.1097/QAI.0000000000000803
Kennard BD, Brown LT, Hawkins L, et Development and implementation of health and wellness CBT for individuals with depression and HIV. Cognitive and Behavioral Practice. 2014;21(2):237- 246. doi:10.1016/j.cbpra.2013.07.003
Bhana A, McKay MM, Mellins C, Petersen I, Bell C. Family-based HIV prevention and intervention services for youth living in poverty-affected contexts: The CHAMP model of collaborative, evidence- informed programme Journal of the International AIDS Society. 2010;13(SUPPL. 2). doi:10.1186/1758-2652-13-S2-S8
Belfer ML. Critical review of world policies for mental healthcare for children and adolescents. Current Opinion in 2007;20(4):349-352. doi:10.1097/YCO.0b013e3281bc0cf4
Transitioning HIV-infected youth into adult health Pediatrics. 2013;132(1):192-197. doi:10.1542/ peds.2013-1073
Valcour V, Chalermchai T, Sailasuta N, et Central Nervous System Viral Invasion and
doi:10.1093/infdis/jis326
Gras G, Kaul M. Molecular mechanisms of neuroinvasion by monocytes-macrophages in HIV-1 Retrovirology. 2010;7. doi:10.1186/1742-4690-7-30
Vitkovic L, Tardieu M. Neuropathogenesis of HIV-1 infection. Outstanding questions. Comptes Rendus de l’Academie des Sciences - Serie III. 1998;321(12):1015-1021. doi:10.1016/S0764- 4469(99)80057-2
Saylor D, Dickens AM, Sacktor N, et al. HIV-associated neurocognitive disorder - Pathogenesis and prospects for treatment. Nature Reviews Neurology. 2016;12(4):234-248. doi:10.1038/ 2016.27
Lindl KA, Marks DR, Kolson DL, Jordan-Sciutto KL. HIV-associated neurocognitive disorder: Pathogenesis and therapeutic Journal of Neuroimmune Pharmacology.
Vago L, Bonetto S, Nebuloni M, et al. Pathological findings in the central nervous system of AIDS patients on assumed antiretroviral therapeutic regimens: Retrospective study of 1597 autopsies. 2002;16(14):1925-1928. doi:10.1097/00002030-200209270-00009
Fois AF, Brew The Potential of the CNS as a Reservoir for HIV-1 Infection: Implications for HIV Eradication. Current HIV/AIDS Reports. 2015;12(2):299-303. doi:10.1007/s11904-015-0257-9
Canestri A, Lescure F, Jaureguiberry S, et al. Discordance Between Cerebral Spinal Fluid and Plasma HIV Replication in Patients with Neurological Symptoms Who Are Receiving Suppressive Antiretroviral Clinical Infectious Diseases. 2010;50(5):773-778. doi:10.1086/650538
Churchill MJ, Gorry PR, Cowley D, et al. Use of laser capture microdissection to detect integrated HIV-1 DNA in macrophages and astrocytes from autopsy brain tissues. Journal of NeuroVirology. 2006;12(2):146-152. doi:10.1080/13550280600748946
Cassol E, Misra V, Dutta A, Morgello S, Gabuzda D. Cerebrospinal fluid metabolomics reveals altered waste clearance and accelerated aging in HIV patients with neurocognitive impairment. 2014;28(11):1579-1591. doi:10.1097/QAD.0000000000000303
Ancuta P, Kamat A, Kunstman KJ, et al. Microbial translocation is associated with increased monocyte activation and dementia in AIDS patients. PLoS ONE. 2008;3(6). doi:10.1371/journal. 0002516
Fauci AS, Marston Ending the HIV-AIDS pandemic - Follow the science. New England Journal of Medicine. 2015;373(23):2197-2199. doi:10.1056/NEJMp1502020
Etherton MR, Lyons JL, Ard KL. HIV-associated Neurocognitive Disorders and Antiretroviral Therapy: Current Concepts and Controversies. Current Infectious Disease Reports. 2015;17(6). doi:10.1007/s11908-015-0485-6
Robertson K, Liner J, Meeker RB. Antiretroviral neurotoxicity. Journal of NeuroVirology. 2012;18(5):388-399. doi:10.1007/s13365-012-0120-3
Rojas-Celis V, Valiente-Echeverría F, Soto-Rifo R, Toro-Ascuy D. New Challenges of HIV-1 Infection: How HIV-1 Attacks and Resides in the Central Nervous Cells. 2019;8(10):1245. doi:10.3390/cells8101245
Antinori A, Arendt G, Becker JT, et Updated research nosology for HIV-associated neurocognitive disorders. Neurology. 2007;69(18):1789-1799. doi:10.1212/01.WNL.0000287431.88658.8b
Robertson KR, Smurzynski M, Parsons TD, et al. The prevalence and incidence of neurocognitive impairment in the HAART AIDS. 2007;21(14):1915-1921. doi:10.1097/QAD.0b013e32828e4e27
Pérez-Valero I, González-Baeza A, Estébanez M, et al. Neurocognitive Impairment in Patients Treated with Protease Inhibitor Monotherapy or Triple Drug Antiretroviral Therapy. PLoS ONE. 2013;8(7). doi:10.1371/journal.pone.0069493
Portilla I, Reus S, León R, et al. Neurocognitive Impairment in Well-Controlled HIV-Infected Patients: A Cross-Sectional AIDS Research and Human Retroviruses. 2019;35(7):634- 641. doi:10.1089/aid.2018.0279
Muñoz-Moreno JA, Pérez-Álvarez N, Muñoz-Murillo A, et Classification models for neurocognitive impairment in HIV infection based on demographic and clinical variables. PLoS ONE. 2014;9(9). doi:10.1371/journal.pone.0107625
CASADO JL, BAYÓN C, PÉREZ VALERO I, et Estudio transversal para evaluar y analizar la prevalencia de detección positiva de síntomas de ansiedad, depresión y deterioro neurocognitivo en pacientes infectados por el VIH-1: estudio CRANIum. Subanálisis por sexos de la población española. SIDA STUDI. Enfermedades Infecciosas y Microbiología Clínica. 2012;30:26-27. Accessed June 23, 2020. http://www.sidastudi.org/es/registro/ff8081813b4c32e8013bff80010100d6
Heaton RK, Franklin DR, Deutsch R, et al. Neurocognitive Change in the Era of HIV Combination Antiretroviral Therapy: The Longitudinal CHARTER Clinical Infectious Diseases. 2015;60(3):473-480. doi:10.1093/cid/ciu862
Pérez-Valero I, González-Baeza A, Estébanez M, et A prospective cohort study of neurocognitive function in aviremic HIV-infected patients treated with 1 or 3 antiretrovirals. Clinical infectious diseases : an official publication of the Infectious Diseases Society of America. 2014;59(11):1627- 1634. doi:10.1093/cid/ciu640
Langford D, Grigorian A, Hurford R, Adame A, Crews L, Masliah E. The role of mitochondrial alterations in the combined toxic effects of human immunodeficiency virus Tat protein and methamphetamine on calbindin positive-neurons. Journal of NeuroVirology. 2004;10(6):327-337. doi:10.1080/13550280490520961
Gandhi N, Saiyed ZM, Napuri J, et al. Interactive role of human immunodeficiency virus type 1 (HIV-1) clade-specific Tat protein and cocaine in blood-brain barrier dysfunction: Implications for HIV-1associated neurocognitive Journal of NeuroVirology. 2010;16(4):295-306. doi:10.3 109/13550284.2010.499891
Chen W, Tang Z, Fortina P, et al. Ethanol potentiates HIV-1 gp120-induced apoptosis in human neurons via both the death receptor and NMDA receptor Virology. 2005;334(1):59-73. doi:10.1016/j.virol.2005.01.014
Gaskill PJ, Calderon TM, Luers AJ, Eugenin EA, Javitch JA, Berman JW. Human immunodeficiency virus (HIV) infection of human macrophages is increased by dopamine: A bridge between HIV- associated neurologic disorders and drug American Journal of Pathology. 2009;175(3):1148- 1159. doi:10.2353/ajpath.2009.081067
Purohit V, Rapaka R, Shurtleff D. Drugs of abuse, dopamine, and HIV-associated neurocognitive disorders/HIV-associated dementia. Molecular Neurobiology. 2011;44(1):102-110. doi:10.1007/ s12035-011-8195-z
Aronow HA, Weston AJ, Pezeshki BB, Lazarus TS. Effects of coinfection with HIV and hepatitis C virus on the nervous The AIDS reader. 2008;18(1):43-48. http://europepmc.org/abstract/ MED/18240452
Morgello S, Estanislao L, Ryan E, et al. Effects of hepatic function and hepatitis C virus on the nervous system assessment of advanced-stage HIV-infected individuals. AIDS. 2005;19(SUPPL. 3). doi:10.1097/01.aids.0000192079.49185.f9
Cherner M, Letendre S, Heaton RK, et Hepatitis C augments cognitive deficits associated with HIV infection and methamphetamine. Neurology. 2005;64(8):1343-1347. doi:10.1212/01. WNL.0000158328.26897.0D
McCutchan JA, Marquie-Beck JA, FitzSimons CA, et al. Role of obesity, metabolic variables, and diabetes in HIV-associated neurocognitive Neurology. 2012;78(7):485-492. doi:10.1212/ WNL.0b013e3182478d64
Valcour VG, Sacktor NC, Paul RH, et al. Insulin resistance is associated with cognition among HIV-1-infected patients: The Hawaii aging with HIV Journal of Acquired Immune Deficiency Syndromes. 2006;43(4):405-410. doi:10.1097/01.qai.0000243119.67529.f5
Wright EJ, Grund B, Robertson K, et al. Cardiovascular risk factors associated with lower baseline cognitive performance in HIV-positive persons. Neurology. 2010;75(10):864-873. doi:10.1212/ 0b013e3181f11bd8
Livelli A, Vaida F, Ellis RJ, et al. Correlates of HIV RNA concentrations in cerebrospinal fluid during antiretroviral therapy: a longitudinal cohort study. The Lancet HIV. 2019;6(7):e456-e462. doi:10.1016/S2352-3018(19)30143-2
Ellis RJ, Badiee J, Vaida F, et CD4 nadir is a predictor of HIV neurocognitive impairment in the era of combination antiretroviral therapy. AIDS. 2011;25(14):1747-1751. doi:10.1097/ QAD.0b013e32834a40cd
Airoldi M, Bandera A, Trabattoni D, et al. Neurocognitive Impairment in HIV-Infected Naïve Patients with Advanced Disease: The Role of Virus and Intrathecal Immune Activation. Clinical & developmental 2012;2012:467154. doi:10.1155/2012/467154
Antinori A, Arendt G, Becker JT, et Updated research nosology for HIV-associated neurocognitive disorders. Neurology. 2007;69(18):1789-1799. doi:10.1212/01.WNL.0000287431.88658.8b
Watkins CC, Treisman GJ. Cognitive impairment in patients with Aids – Prevalence and severity. HIV/AIDS - Research and Palliative 2015;7:35-47. doi:10.2147/HIV.S39665
Heaton RK, Clifford DB, Franklin DR, et al. HIV-associated neurocognitive disorders persist in the era of potent antiretroviral therapy: Charter Study. Neurology. 2010;75(23):2087-2096. doi:10.1212/ 0b013e318200d727
Heaton RK, Franklin DR, Deutsch R, et al. Neurocognitive Change in the Era of HIV Combination Antiretroviral Therapy: The Longitudinal CHARTER Clinical Infectious Diseases. 2015;60(3):473-480. doi:10.1093/cid/ciu862
Cysique LA, Brew Comorbid depression and apathy in HIV-associated neurocognitive disorders in the era of chronic HIV infection. In: Handbook of Clinical Neurology. Vol 165. Elsevier B.V.; 2019:71-82. doi:10.1016/B978-0-444-64012-3.00006-X
Janssen RS, Cornblath DR, Epstein LG, et al. Nomenclature and research case definitions for neurologic manifestations of human immunodeficiency virus-type 1 (HIV-1) infection. Neurology. 1991;41(6):778-785. doi:10.1212/wnl.41.6.778
Antinori A, Arendt G, Grant I, et al. Assessment, Diagnosis, and Treatment of HIV-Associated Neurocognitive Disorder: A Consensus Report of the Mind Exchange Program. Clinical Infectious 2013;56. doi:10.1093/cid/cis975
Gisslén M, Price RW, Nilsson The definition of HIV-associated neurocognitive disorders: Are we overestimating the real prevalence? BMC Infectious Diseases. 2011;11. doi:10.1186/1471-2334- 11-356
Meyer ACL, John Boscardin W, Kwasa JK, Price RW. Is it time to rethink how neuropsychological tests are used to diagnose mild forms of HIV-associated neurocognitive disorders? Impact of false-positive rates on prevalence and Neuroepidemiology. 2013;41(3-4):208-216. doi:10.1159/000354629
Underwood J, de Francesco D, Leech R, Sabin CA, Winston Medicalising normality? Using a simulated dataset to assess the performance of different diagnostic criteria of HIV-associated cognitive impairment. PLoS ONE. 2018;13(4). doi:10.1371/journal.pone.0194760
Huizenga HM, Smeding H, Grasman RPPP, Schmand B. Multivariate normative comparisons. 2007;45(11):2534-2542. doi:10.1016/j.neuropsychologia.2007.03.011
Blackstone K, Moore DJ, Franklin DR, et al. Defining neurocognitive impairment in HIV: Deficit scores versus clinical ratings. Clinical Neuropsychologist. 2012;26(6):894-908. doi:10.1080/1385 2012.694479
Grant I, Franklin DR, Deutsch R, et al. Asymptomatic HIV-associated neurocognitive impairment increases risk for symptomatic Neurology. 2014;82(23):2055-2062. doi:10.1212/ WNL.0000000000000492
Zipursky AR, Gogolishvili D, Rueda S, et al. Evaluation of brief screening tools for neurocognitive impairment in HIV/AIDS: A systematic review of the literature. AIDS. 2013;27(15):2385-2401. doi:10.1097/QAD.0b013e328363bf56
López E, Steiner AJ, Smith K, et Diagnostic utility of the HIV dementia scale and the international HIV dementia scale in screening for HIV-associated neurocognitive disorders among Spanish- speaking adults. Applied Neuropsychology:Adult. 2017;24(6):512-521. doi:10.1080/23279095.20 16.1214835
Prats A, López-Masramon E, Pérez-Álvarez N, et al. NEU Screen Shows High Accuracy in Detecting Cognitive Impairment in Older Persons Living With HIV. The Journal of the Association of Nurses in AIDS Care : 2019;30(1):35-41. doi:10.1097/JNC.0000000000000003
Cherner M, Masliah E, Ellis RJ, et Neurocognitive dysfunction predicts postmortem findings of
Moore DJ, Masliah E, Rippeth JD, et Cortical and subcortical neurodegeneration is associated with HIV neurocognitive impairment. AIDS. 2006;20(6):879-887. doi:10.1097/01. aids.0000218552.69834.00
Cysique LA, Casaletto KB, Heaton Reliably Measuring Cognitive Change in the Era of Chronic HIV Infection and Chronic HIV-Associated Neurocognitive Disorders. In: Current Topics in Behavioral Neurosciences. Curr Top Behav Neurosci; 2019. doi:10.1007/7854_2019_116
Folstein MF, Folstein SE, McHugh PR. “Mini-mental state”. A practical method for grading the cognitive state of patients for the clinician. Journal of Psychiatric Research. 1975;12(3):189-198. doi:10.1016/0022-3956(75)90026-6
Ganesan A, Crum-Cianflone N, Higgins J, et al. High Dose Atorvastatin Decreases Cellular Markers of Immune Activation Without Affecting HIV-1 RNA Levels: Results of a Double-blind Randomized Placebo Controlled Clinical Trial. The Journal of infectious diseases. 2011;203:756- doi:10.1093/infdis/jiq115
Blackstone K, Moore DJ, Heaton RK, et Diagnosing symptomatic HIV-associated neurocognitive disorders: Self-report versus performance-based assessment of everyday functioning. Journal of the International Neuropsychological Society. 2012;18(1):79-88. doi:10.1017/S135561771100141X
Sevigny JJ, Albert SM, McDermott MP, et al. Evaluation of HIV RNA and markers of immune activation as predictors of HIV-associated Neurology. 2004;63(11):2084-2090. doi:10.1212/01.WNL.0000145763.68284.15
Vernazza P, Daneel S, Schiffer V, et al. The role of compartment penetration in PI-Monotherapy: The Atazanavir-Ritonavir Monomaintenance (ATARITMO) Trial. AIDS. 2007;21(10):1309-1315. doi:10.1097/QAD.0b013e32814e6b1c
Best BM, Letendre SL, Koopmans P, et Low cerebrospinal fluid concentrations of the nucleotide HIV reverse transcriptase inhibitor, Tenofovir. Journal of Acquired Immune Deficiency Syndromes. 2012;59(4):376-381. doi:10.1097/QAI.0b013e318247ec54
Bumpus S, Qing MA, Best Antiretroviral Concentrations in Brain Tissue Are Similar to or Exceed Those in CSF. - CROI Conference. Conference on Retroviruses ans Oppotunistic Infections (CROI) . Published 2015. Accessed June 24, 2020. https://www.croiconference.org/abstract/ antiretroviral-concentrations-brain-tissue-are-similar-or-exceed-those-csf/
Letendre S, Marquie-Beck J, Capparelli E, et al. Validation of the CNS penetration-effectiveness rank for quantifying antiretroviral penetration into the central nervous system. Archives of 2008;65(1):65-70. doi:10.1001/archneurol.2007.31
Letendre S, Ellis R, Everall I, Ances B, Bharti A, Mccutchan Neurologic Complications of HIV
Santos G, Locatelli I, Metral M, et Cross-Sectional and Cumulative Longitudinal Central Nervous System Penetration Effectiveness Scores Are Not Associated With Neurocognitive Impairment in a Well Treated Aging Human Immunodeficiency Virus-Positive Population in Switzerland. Open forum infectious diseases. 2019;6:ofz277. doi:10.1093/ofid/ofz277
Letendre S, FitzSimons C, Ellis R, Clifford D, Collier A, Gelman Correlates of CSF Viral Loads in 1,221 volunteers of the CHARTER cohort. CROI Conference. 17th Conference on Retroviruses ans Oppotunistic Infections (CROI) . Published 2010. Accessed June 24, 2020. https://charternntc. org/content/correlates-csf-viral-loads-1221-volunteers-charter-cohort
Perez-Valero I, Ellis R, Heaton R, et al. Cerebrospinal fluid viral escape in aviremic HIV-infected patients receiving antiretroviral therapy: Prevalence, risk factors and neurocognitive AIDS. 2019;33(3):475-481. doi:10.1097/QAD.0000000000002074
Ellis RJ, Letendre S, Vaida F, et al. Randomized Trial of Central Nervous System–Targeted Antiretrovirals for HIV-Associated Neurocognitive Clinical Infectious Diseases. 2014;58(7):1015-1022. doi:10.1093/cid/cit921
Tozzi V, Balestra P, Salvatori MF, et al. Changes in cognition during antiretroviral therapy: Comparison of 2 different ranking systems to measure antiretroviral drug efficacy on HIV-associated neurocognitive disorders. Journal of Acquired Immune Deficiency Syndromes. 2009;52(1):56-63. doi:10.1097/QAI.0b013e3181af83d6
Smurzynski M, Wu K, Letendre S, et Effects of central nervous system antiretroviral penetration on cognitive functioning in the ALLRT cohort. AIDS. 2011;25(3):357-365. doi:10.1097/ QAD.0b013e32834171f8
Cysique LA, Vaida F, Letendre S, et Dynamics of cognitive change in impaired HIV-
Marra CM, Zhao Y, Clifford DB, et Impact of combination antiretroviral therapy on cerebrospinal fluid HIV RNA and neurocognitive performance. AIDS. 2009;23(11):1359-1366. doi:10.1097/ QAD.0b013e32832c4152
Robertson KR, Su Z, Margolis DM, et Neurocognitive effects of treatment interruption in stable HIV-positive patients in an observational cohort. Neurology. 2010;74(16):1260-1266. doi:10.1212/ WNL.0b013e3181d9ed09
Simioni S, Cavassini M, Annoni JM, et Rivastigmine for HIV-associated neurocognitive disorders: A randomized crossover pilot study. Neurology. 2013;80(6):553-560. doi:10.1212/ WNL.0b013e3182815497
Muñoz-Moreno JA, Prats A, Moltó J, et al. Transdermal rivastigmine for HIV-associated cognitive impairment: A randomized pilot PLoS ONE. 2017;12(8). doi:10.1371/journal.pone.0182547
Sacktor N, Miyahara S, Deng L, et al. Minocycline treatment for HIV-associated cognitive impairment: results from a randomized trial. Neurology. 2011;77(12):1135-1142. doi:10.1212/ 0b013e31822f0412
Zhao Y, Navia BA, Marra CM, et al. Memantine for AIDS dementia complex: Open-label report of actg HIV Clinical Trials. 2010;11(1):59-67. doi:10.1310/hct1101-59
Schifitto G, Navia BA, Yiannoutsos CT, et Memantine and HIV-associated cognitive impairment: A neuropsychological and proton magnetic resonance spectroscopy study. AIDS. 2007;21(14):1877- 1886. doi:10.1097/QAD.0b013e32813384e8
Schifitto G, Zhang J, Evans SR, et al. A multicenter trial of selegiline transdermal system for HIV-associated cognitive Neurology. 2007;69(13):1314-1321. doi:10.1212/01. wnl.0000268487.78753.0f
Evans SR, Yeh TM, Sacktor N, et al. Selegiline Transdermal System (STS) for HIV-associated cognitive impairment: Open-label report of ACTG 5090. HIV Clinical Trials. 2007;8(6):437-446. doi:10.1310/hct0806-437
Letendre SL, Woods SP, Ellis RJ, et Lithium improves HIV-associated neurocognitive impairment. AIDS. 2006;20(14):1885-1888. doi:10.1097/01.aids.0000244208.49123.1b
Schifitto G, Zhong J, Gill D, et al. Lithium therapy for human immunodeficiency virus type 1-associated neurocognitive Journal of NeuroVirology. 2009;15(2):176-186. doi:10.1080/13550280902758973
Schifitto G, Peterson DR, Zhong J, et al. Valproic acid adjunctive therapy for HIV-associated cognitive impairment: A first Neurology. 2006;66(6):919-921. doi:10.1212/01. wnl.0000204294.28189.03
Digicaylioglu M, Kaul M, Fletcher L, Dowen R, Lipton Erythropoietin protects
Kang YJ, Digicaylioglu M, Russo R, et al. Erythropoietin plus insulin-like growth factor-I protects against neuronal damage in a murine model of human immunodeficiency virus-associated neurocognitive Annals of Neurology. 2010;68(3):342-352. doi:10.1002/ana.22070
Schifitto G, Sacktor N, Marder K, et Randomized trial of the platelet-activating factor antagonist lexipafant in HIV-associated cognitive impairment. Neurology. 1999;53(2):391-396. doi:10.1212/ wnl.53.2.391
Clifford DB, McArthur JC, Schifitto G, et al. A randomized clinical trial of CPI-1189 for HIV- associated cognitive-motor Neurology. 2002;59(10):1568-1573. doi:10.1212/01. WNL.0000034177.47015.DA
Navia BA, Dafni U, Simpson D, et al. A phase I/II trial of nimodipine for HIV-related neurologic Neurology. 1998;51(1):221-228. doi:10.1212/WNL.51.1.221
Letendre SL, Marquie-Beck J, Ellis RJ, et al. The role of cohort studies in drug development: Clinical evidence of antiviral activity of serotonin reuptake inhibitors and HMG-CoA reductase inhibitors in the central nervous system. Journal of Neuroimmune Pharmacology. 2007;2(1):120- doi:10.1007/s11481-006-9054-y
Heseltine PNR, Goodkin K, Atkinson JH, et Randomized double-blind placebo-controlled trial of peptide T for HIV- associated cognitive impairment. Archives of Neurology. 1998;55(1):41-51. doi:10.1001/archneur.55.1.41
Kleim JA, Jones TA. Principles of Experience-Dependent Neural Plasticity: Implications for Rehabilitation After Brain Damage. Journal of speech, language, and hearing research : JSLHR. 2008;51(1). doi:10.1044/1092-4388(2008/018)
Plassman BL, Williams JW, Burke JR, Holsinger T, Benjamin S. Systematic review: Factors associated with risk for and possible prevention of cognitive decline in later life. In: Annals of Internal Medicine. Vol 153. American College of Physicians; 2010:182-193. doi:10.7326/0003- 4819-153-3-201008030-00258
Chow FC, Lyass A, Mahoney TF, et Baseline 10-Year Cardiovascular Risk Scores Predict Cognitive Function in Older Persons, and Particularly Women, Living With Human Immunodeficiency Virus Infection. Clinical Infectious Diseases. Published online January 3, 2020. doi:10.1093/cid/ciz1214
Tzourio C, Anderson C, Chapman N, et Effects of blood pressure lowering with perindopril and indapamide therapy on dementia and cognitive decline in patients with cerebrovascular disease. Archives of Internal Medicine. 2003;163(9):1069-1075. doi:10.1001/archinte.163.9.1069
McGuinness B, Todd S, Passmore P, Bullock Blood pressure lowering in patients without prior cerebrovascular disease for prevention of cognitive impairment and dementia. Cochrane Database of Systematic Reviews. 2009;2009(4). doi:10.1002/14651858.CD004034.pub3
Cox DJ, Kovatchev BP, Gonder-Frederick LA, et al. Relationships between hyperglycemia and cognitive performance among adults with type 1 and type 2 Diabetes Care. 2005;28(1):71- 77. doi:10.2337/diacare.28.1.71
McCutchan A, Marquie-Beck J, Letendre Contributions of metabolic syndrome to neurocognitive impairment. . Program and abstracts of the 16th Conference on Retroviruses and Opportunistic Infections. Published February 2009. Accessed June 26, 2020. https://www.thebodypro.com/ article/croi-2009-highlights-review-cardiovascular-disease-hiv
Kivipelto M, Helkala E-L, Laakso MP, et al. Apolipoprotein E ϵ4 Allele, Elevated Midlife Total Cholesterol Level, and High Midlife Systolic Blood Pressure Are Independent Risk Factors for Late-Life Alzheimer Disease. Annals of Internal Medicine. 2002;137(3):149. doi:10.7326/0003- 4819-137-3-200208060-00006
Letendre S. Central nervous system complications in HIV disease: HIV-associated neurocognitive Topics in antiviral medicine. 2011;19(4):137-142. https://Pubmed.ncbi.nlm.nih. gov/22156215
Yadav A, Betts MR, Collman Statin modulation of monocyte phenotype and function: implications for HIV-1-associated neurocognitive disorders. Journal of NeuroVirology. 2016;22(5):584-596. doi:10.1007/s13365-016-0433-8
Byrnes V, Miller A, Lowry D, et al. Effects of anti-viral therapy and HCV clearance on
Clifford DB, Vaida F, Kao YT, et Absence of neurocognitive effect of hepatitis C infection in HIV- coinfected people. Neurology. 2015;84(3):241-250. doi:10.1212/WNL.0000000000001156
Rubin LH, Maki HIV, Depression, and Cognitive Impairment in the Era of Effective Antiretroviral Therapy. Current HIV/AIDS Reports. 2019;16(1):82-95. doi:10.1007/s11904-019-00421-0
Vance DE, Eagerton G, Harnish B, McKie P, Fazeli PL. Cognitive prescriptions: A nursing approach to increasing cognitive reserve. Journal of Gerontological Nursing. 2011;37(4):22-31. doi:10.3928/00989134-20101202-03
Féart C, Samieri C, Barberger-Gateau P. Mediterranean diet and cognitive function in older Current Opinion in Clinical Nutrition and Metabolic Care. 2010;13(1):14-18. doi:10.1097/ MCO.0b013e3283331fe4
Scarmeas N, Stern Y, Mayeux R, Manly JJ, Schupf N, Luchsinger JA. Mediterranean diet and mild cognitive Archives of Neurology. 2009;66(2):216-225. doi:10.1001/archneurol.2008.536
Burckhardt M, Herke M, Wustmann T, Watzke S, Langer G, Fink Omega-3 fatty acids for the treatment of dementia. Cochrane Database of Systematic Reviews. 2016;2016(4). doi:10.1002/14651858.CD009002.pub3
Smith PJ, Blumenthal JA, Hoffman BM, et Aerobic exercise and neurocognitive performance: A meta-analytic review of randomized controlled trials. Psychosomatic Medicine. 2010;72(3):239- 252. doi:10.1097/PSY.0b013e3181d14633
Monroe AK, Zhang L, Jacobson L, et The association between physical activity and cognition in men with and without HIV infection. HIV Medicine. 2017;18. doi:10.1111/hiv.12490
Kåreholt I, Lennartsson C, Gatz M, Parker MG. Baseline leisure time activity and cognition more than two decades International Journal of Geriatric Psychiatry. 2011;26(1):65-74. doi:10.1002/ gps.2490
Stern C, Munn Z. Cognitive leisure activities and their role in preventing dementia: a systematic International journal of evidence-based healthcare. 2010;8(1):2-17. doi:10.1111/j.1744- 1609.2010.00150.x
Catz SL, Gore-Felton C, McClure JB. Psychological distress among minority and low-income women living with Behavioral Medicine. 2002;28(2):53-60. doi:10.1080/08964280209596398
Duncan LG, Moskowitz JT, Neilands TB, Dilworth SE, Hecht FM, Johnson MO. Mindfulness-based stress reduction for HIV treatment side effects: A randomized, wait-list controlled Journal of
Anstey KJ, von Sanden C, Salim A, O’Kearney R. Smoking as a Risk Factor for Dementia and Cognitive Decline: A Meta-Analysis of Prospective Studies. American Journal of Epidemiology. 2007;166(4):367-378. doi:10.1093/aje/kwm116
Harrison JD, Dochney JA, Blazekovic S, et al. The nature and consequences of cognitive deficits among tobacco smokers with HIV: a comparison to tobacco smokers without HIV. Journal of 2017;23(4):550-557. doi:10.1007/s13365-017-0526-z
Kim JW, Lee DY, Lee BC, et al. Alcohol and cognition in the elderly: A review. Psychiatry 2012;9(1):8-16. doi:10.4306/pi.2012.9.1.8
Martin-Thormeyer EM, Paul Drug abuse and hepatitis C infection as comorbid features of HIV associated neurocognitive disorder: Neurocognitive and neuroimaging features. Neuropsychology Review. 2009;19(2):215-231. doi:10.1007/s11065-009-9101-6
Nath A. Human immunodeficiency virus-associated neurocognitive disorder: Pathophysiology in relation to drug addiction. Annals of the New York Academy of Sciences. 2010;1187:122-128. doi:10.1111/j.1749-6632.2009.05277.x
Byrd DA, Fellows RP, Morgello S, et Neurocognitive impact of substance use in HIV infection. Journal of Acquired Immune Deficiency Syndromes. 2011;58(2):154-162. doi:10.1097/ QAI.0b013e318229ba41
Gaskill PJ, Calderon TM, Coley JS, Berman JW. Drug induced increases in CNS dopamine alter monocyte, macrophage and T cell functions: Implications for HAND. Journal of Neuroimmune 2013;8(3):621-642. doi:10.1007/s11481-013-9443-y
Neuropsychological Routledge; 2017. doi:10.4324/9781315629537
Cicerone KD, Langenbahn DM, Braden C, et al. Evidence-based cognitive rehabilitation: Updated review of the literature from 2003 through Archives of Physical Medicine and Rehabilitation. 2011;92(4):519-530. doi:10.1016/j.apmr.2010.11.015
Dickinson D, Tenhula W, Morris S, et al. A randomized, controlled trial of computer-assisted cognitive remediation for schizophrenia. American Journal of Psychiatry. 2010;167(2):170-180. doi:10.1176/appi.ajp.2009.09020264
Yu F, Rose KM, Burgenr SC, et Cognitive training for early-stage Alzheimer’s disease and dementia. Journal of Gerontological Nursing. 2009;35(3):23-29. doi:10.3928/00989134- 20090301-10
Martin M, Clare L, Altgassen AM, Cameron MH, Zehnder F. Cognition-based interventions for healthy older people and people with mild cognitive Cochrane Database of Systematic Reviews. 2011;(1). doi:10.1002/14651858.cd006220.pub2
Becker JT, Dew MA, Aizenstein HJ, et al. A pilot study of the effects of internet-based cognitive stimulation on neuropsychological function in HIV Disability and Rehabilitation.
Muñoz-Moreno JA, Fumaz CR, Ferrer MJ, et Benefits of a Cognitive Rehabilitation Program on Neurocognitive Impairment in HIV-Infected Patients. Preliminary Findings. Journal of the International Neuropsychological Society. 2007;13(1 Suplement 1:19).
Guideline for Alzheimer`s Disease . California workgroup on Guidelines for Alzheimer`s Disease Management. Published 2008. Accessed June 26, 2020. http://caalz.org/ guidelines.htm.
Cognitive disorders and HIV/AIDS: HIV-associated dementia and delirium. . New York (NY): New York State Department of Published September 12, 2007. Accessed June 25, 2020. http:// guideline.gov/content.aspx?id=12561.
Kritsilis M, Rizou S v., Koutsoudaki PN, Evangelou K, Gorgoulis VG, Papadopoulos D. Ageing, cellular senescence and neurodegenerative disease. International Journal of Molecular Sciences. 2018;19(10). doi:10.3390/ijms19102937
Isaev NK, Genrikhs EE, Oborina M v., Stelmashook E v. Accelerated aging and aging process in the Reviews in the Neurosciences. 2018;29(3):233-240. doi:10.1515/revneuro-2017-0051
Alzheimer’s Association 2019 Alzheimer’s disease facts and figures. Alzheimer’s &
Fields JA, Swinton MK, Soontornniyomkij B, Carson A, Achim Beta amyloid levels in cerebrospinal fluid of HIV-infected people vary by exposure to antiretroviral therapy. AIDS (London, England). 2020;34(7):1001-1007. doi:10.1097/QAD.0000000000002506
Wendelken LA, Valcour V. Impact of HIV and aging on neuropsychological function. Journal of 2012;18(4):256-263. doi:10.1007/s13365-012-0094-1
Cohen J, Torres HIV-associated cellular senescence: A contributor to accelerated aging. Ageing Research Reviews. 2017;36:117-124. doi:10.1016/j.arr.2016.12.004
Arvanitakis Z, Shah RC, Bennett DA. Diagnosis and Management of Dementia: Review. JAMA - Journal of the American Medical 2019;322(16):1589-1599. doi:10.1001/jama.2019.4782
Xu J, Ikezu The comorbidity of HIV-associated neurocognitive disorders and alzheimer’s disease: A foreseeable medical challenge in post-HAART era. Journal of Neuroimmune Pharmacology. 2009;4(2):200-212. doi:10.1007/s11481-008-9136-0
Milanini B, Valcour V. Differentiating HIV-Associated Neurocognitive Disorders From Alzheimer’s Disease: an Emerging Issue in Geriatric NeuroHIV. Current HIV/AIDS Reports. 2017;14(4):123- doi:10.1007/s11904-017-0361-0
Kodidela S, Gerth K, Haque S, et Extracellular Vesicles: A Possible Link between HIV and Alzheimer’s Disease-Like Pathology in HIV Subjects? Cells. 2019;8(9):968. doi:10.3390/ cells8090968
Canet G, Dias C, Gabelle A, et al. HIV neuroinfection and Alzheimer’s disease: Similarities and potential links? Frontiers in Cellular 2018;12. doi:10.3389/fncel.2018.00307
McKhann GM, Knopman DS, Chertkow H, et al. The diagnosis of dementia due to Alzheimer’s disease: Recommendations from the National Institute on Aging-Alzheimer’s Association workgroups on diagnostic guidelines for Alzheimer’s Alzheimer’s and Dementia. 2011;7(3):263-269. doi:10.1016/j.jalz.2011.03.005
Pendlebury ST, Mariz J, Bull L, Mehta Z, Rothwell PM. MoCA, ACE-R, and MMSE versus the national institute of neurological disorders and stroke-canadian stroke network vascular cognitive impairment harmonization standards neuropsychological battery after TIA and stroke. Stroke. 2012;43(2):464-469. doi:10.1161/STROKEAHA.111.633586
Knopman DS, DeKosky ST, Cummings JL, et al. Practice parameter: Diagnosis of dementia (an evidence-based review): Report of the quality standards subcommittee of the american academy of Neurology. 2001;56(9):1143-1153. doi:10.1212/WNL.56.9.1143
Silverman DHS, Chen W, Czernin J, et Positron emission tomography in evaluation of dementia: Regional brain metabolism and long-term outcome. Journal of the American Medical Association. 2001;286(17):2120-2127. doi:10.1001/jama.286.17.2120
Birks J. Cholinesterase inhibitors for Alzheimer’s disease. Cochrane Database of Systematic 2006;(1). doi:10.1002/14651858.CD005593
Reisberg B, Doody R, Stöffler A, Schmitt F, Ferris S, Möbius Memantine in moderate-to-severe Alzheimer’s disease. New England Journal of Medicine. 2003;348(14):1333-1341. doi:10.1056/ NEJMoa013128
Dysken MW, Sano M, Asthana S, et Effect of vitamin E and memantine on functional decline in Alzheimer disease: The TEAM-AD VA cooperative randomized trial. JAMA - Journal of the American Medical Association. 2014;311(1):33-44. doi:10.1001/jama.2013.282834
Chen R, Chan PT, Chu H, et al. Treatment effects between monotherapy of Donepezil versus combination with memantine for Alzheimer disease: A meta-analysis. PLoS ONE. 2017;12(8). doi:10.1371/journal.pone.0183586
Livingston G, Kelly L, Lewis-Holmes E, et Non-pharmacological interventions for agitation in dementia: Systematic review of randomised controlled trials. British Journal of Psychiatry. 2014;205(6):436-442. doi:10.1192/bjp.bp.113.141119
Sink KM, Holden KF, Yaffe Pharmacological treatment of neuropsychiatric symptoms of dementia: A review of the evidence. Journal of the American Medical Association. 2005;293(5):596-608. doi:10.1001/jama.293.5.596
Reus VI, Fochtmann LJ, Eyler AE, et al. The American psychiatric association practice guideline on the use of antipsychotics to treat agitation or psychosis in patients with dementia. American Journal of 2016;173(5):543-546. doi:10.1176/appi.ajp.2015.173501
Borson S, Raskind MA. Clinical features and pharmacologic treatment of behavioral symptoms of Alzheimer’s Neurology. 1997;48(5 SUPPL. 6). doi:10.1212/wnl.48.5_suppl_6.17s
Lauque S, Arnaud-Battandier F, Gillette S, et al. Improvement of weight and fat-free mass with oral nutritional supplementation in patients with Alzheimer’s disease at risk of malnutrition: A prospective randomized Journal of the American Geriatrics Society. 2004;52(10):1702-1707. doi:10.1111/j.1532-5415.2004.52464.x
Forbes D, Forbes SC, Blake CM, Thiessen EJ, Forbes S. Exercise programs for people with Cochrane Database of Systematic Reviews. 2015;2015(4). doi:10.1002/14651858. CD006489.pub4
Snyder HM, Corriveau RA, Craft S, et al. Vascular contributions to cognitive impairment and dementia including Alzheimer’s Alzheimer’s and Dementia. 2015;11(6):710-717. doi:10.1016/j.jalz.2014.10.008
Skrobot OA, Black SE, Chen C, et Progress toward standardized diagnosis of vascular cognitive impairment: Guidelines from the Vascular Impairment of Cognition Classification Consensus Study. Alzheimer’s and Dementia. 2018;14(3):280-292. doi:10.1016/j.jalz.2017.09.007
Iadecola C, Duering M, Hachinski V, et al. Vascular Cognitive Impairment and Dementia: JACC Scientific Expert Panel. Journal of the American College of Cardiology. 2019;73(25):3326-3344. doi:10.1016/j.jacc.2019.04.034
Pendlebury ST, Rothwell PM. Incidence and prevalence of dementia associated with transient ischaemic attack and stroke: analysis of the population-based Oxford Vascular Study. The Lancet 2019;18(3):248-258. doi:10.1016/S1474-4422(18)30442-3
Diniz BS, Butters MA, Albert SM, Dew MA, Reynolds CF. Late-life depression and risk of vascular dementia and Alzheimer’s disease: Systematic review and meta-analysis of community-based cohort British Journal of Psychiatry. 2013;202(5):329-335. doi:10.1192/bjp.bp.112.118307
Schneider JA, Arvanitakis Z, Bang W, Bennett DA. Mixed brain pathologies account for most dementia cases in community-dwelling older Neurology. 2007;69(24):2197-2204. doi:10.1212/01.wnl.0000271090.28148.24
Valcour V, Rubin LH, Tien P, et Human immunodeficiency virus (HIV) modulates the associations between insulin resistance and cognition in the current combination antiretroviral therapy (cART) era: a study of the Women’s Interagency HIV Study (WIHS). Journal of NeuroVirology. 2015;21(4):415-421. doi:10.1007/s13365-015-0330-6
Sanford Ryan, Strain Jeremy, Dadar Mahsa, et al. Association of cerebral small vessel disease with the brain in HIV individuals CROI Conference. Conference on Retroviruses ans Oppotunistic Infections (CROI) . Published 2019. Accessed June 24, 2020. https://croiconference.org/ abstract/association-cerebral-small-vessel-disease-brain-hiv-individuals/
Chow FC, Makanjuola A, Wu K, et Physical Activity Is Associated With Lower Odds of Cognitive
Sattler FR, He J, Letendre S, et Abdominal obesity contributes to neurocognitive impairment in HIV-infected patients with increased inflammation and immune activation. Journal of Acquired Immune Deficiency Syndromes. 2015;68(3):281-288. doi:10.1097/QAI.0000000000000458
Rubin LH, Gustafson D, Hawkins KL, et al. Midlife adiposity predicts cognitive decline in the prospective Multicenter AIDS Cohort Study. Neurology. 2019;93(3):E261-E271. doi:10.1212/ 0000000000007779
Sachdev PS, Brodaty H, Valenzuela MJ, et The neuropsychological profile of vascular cognitive impairment in stroke and TIA patients. Neurology. 2004;62(6):912-919. doi:10.1212/01. WNL.0000115108.65264.4B
Hachinski VC, Iliff LD, Zilhka E, et al. Cerebral Blood Flow in Dementia. Archives of Neurology. 1975;32(9):632-637. doi:10.1001/archneur.1975.00490510088009
Wardlaw JM, Smith EE, Biessels GJ, et Neuroimaging standards for research into small vessel disease and its contribution to ageing and neurodegeneration. The Lancet Neurology. 2013;12(8):822-838. doi:10.1016/S1474-4422(13)70124-8
Gorelick PB, Scuteri A, Black SE, et Vascular contributions to cognitive impairment and dementia: A statement for healthcare professionals from the American Heart Association/American Stroke Association. Stroke. 2011;42(9):2672-2713. doi:10.1161/STR.0b013e3182299496
Forette F, Seux ML, Staessen JA, et al. Prevention of dementia in randomised double-blind placebo-controlled Systolic Hypertension in Europe (Syst-Eur) Lancet. 1998;352(9137):1347- 1351. doi:10.1016/S0140-6736(98)03086-4
Williamson JD, Pajewski NM, Auchus AP, et al. Effect of Intensive vs Standard Blood Pressure Control on Probable Dementia: A Randomized Clinical Trial. In: JAMA - Journal of the American Medical Vol 321. American Medical Association; 2019:553-561. doi:10.1001/ jama.2018.21442
Dichgans M, Zietemann Prevention of vascular cognitive impairment. Stroke. 2012;43(11):3137- 3146. doi:10.1161/STROKEAHA.112.651778
Gorelick PB, Furie KL, Iadecola C, et al. Defining Optimal Brain Health in Adults: A Presidential Advisory From the American Heart Association/American Stroke Stroke. 2017;48(10):e284-e303. doi:10.1161/STR.0000000000000148
Collins R, Armitage J, Parish S, Sleight P, Peto R. MRC/BHF Heart Protection Study of cholesterol lowering with simvastatin in 20 536 high-risk individuals: A randomised placebo-controlled trial. 2002;360(9326):7-22. doi:10.1016/S0140-6736(02)09327-3
Shepherd J, Blauw GJ, Murphy MB, et al. Pravastatin in elderly individuals at risk of vascular disease (PROSPER): A randomised controlled Lancet. 2002;360(9346):1623-1630.doi:10.1016/S0140-6736(02)11600-X
McKeith IG, Boeve BF, DIckson DW, et al. Diagnosis and management of dementia with Lewy Neurology. 2017;89(1):88-100. doi:10.1212/WNL.0000000000004058
Svenningsson P, Westman E, Ballard C, Aarsland D. Cognitive impairment in patients with Parkinson’s disease: Diagnosis, biomarkers, and The Lancet Neurology. 2012;11(8):697- 707. doi:10.1016/S1474-4422(12)70152-7
Johnson JK, Diehl J, Mendez MF, et al. Frontotemporal lobar degeneration: Demographic characteristics of 353 Archives of Neurology. 2005;62(6):925-930. doi:10.1001/ archneur.62.6.925
Cantú Guzmán R, Álvarez Bermúdez J, Torres López E, Martínez Sulvarán O. Impacto psicosocial asociado al diagnóstico de infección por vih/SIDA: apartados cualitativos de medición. Revista Electrónica Medicina, Salud y Published online 2012.
Flowers P, Davis MM, Larkin M, Church S, Marriott C. Understanding the impact of HIV diagnosis amongst gay men in Scotland: An interpretative phenomenological Psychology & Health. 2011;26(10):1378-1391. doi:10.1080/08870446.2010.551213
Zeligman M, Wood AW. Conceptualizing an HIV Diagnosis Through a Model of Grief and Adultspan Journal. 2017;16(1):18-30. doi:10.1002/adsp.12031
Richard Lazarus MVMSF. Estrés y Procesos Cognitivos. (Martinez Roca, ed.).; 1986.
Milena Gaviria A, Quiceno JM, Vinaccia S, Martínez LA, Otalvaro Estrategias de afrontamiento y ansiedad-depresión en pacientes diagnosticados con VIH/SIDA. Terapia Psicologica. 2009;27(1):5-13. doi:10.4067/s0718-48082009000100001
Carrobles JA, Remor E, Rodríguez-Alzamora Afrontamiento, apoyo social percibido y distrés emocional en pacientes con infección por VIH. [Relationshiop of coping and perceived social support to emotional distress in people living with HIV.]. Psicothema. 2003;15(3):420-426.
Chida Y, Vedhara Adverse psychosocial factors predict poorer prognosis in HIV disease: A meta- analytic review of prospective investigations. Brain, Behavior, and Immunity. 2009;23(4):434-445. doi:10.1016/j.bbi.2009.01.013
Ironson GH, O’Cleirigh C, Weiss A, Schneiderman N, Costa PT. Personality and HIV Disease Progression: Role of NEO-PI-R Openness, Extraversion, and Profiles of Psychosomatic Medicine. 2008;70(2):245-253. doi:10.1097/PSY.0b013e31816422fc
Lee RS, Kochman A, Sikkema Internalized Stigma Among People Living with HIV-AIDS. AIDS
Guevara-Sotelo Y, Hoyos-Hernández Vivir con VIH: experiencias de estigma sentido en
Chan RCH, Mak WWS. Cognitive, Regulatory, and Interpersonal Mechanisms of HIV Stigma on the Mental and Social Health of Men Who Have Sex With Men Living With HIV. American Journal of Men’s 2019;13(5):155798831987377. doi:10.1177/1557988319873778
Travaglini LE, Himelhoch SS, Fang LJ. HIV Stigma and Its Relation to Mental, Physical and Social Health Among Black Women Living with HIV/AIDS. AIDS and Behavior. 2018;22(12):3783-3794. doi:10.1007/s10461-018-2037-1
Atkinson JS, Nilsson Schönnesson L, Williams ML, Timpson Associations among correlates of schedule adherence to antiretroviral therapy (ART): A path analysis of a sample of crack cocaine using sexually active African–Americans with HIV infection. AIDS Care. 2008;20(2):253- 262. doi:10.1080/09540120701506788
Johnson CJ, Heckman TG, Hansen NB, Kochman A, Sikkema KJ. Adherence to antiretroviral medication in older adults living with HIV/AIDS: a comparison of alternative models. AIDS Care. 2009;21(5):541-551. doi:10.1080/09540120802385611
Santoro Pablo CF. Tipos de problemas de adherencia entre las personas con VIH y tendencias emergentes en la adherencia al tratamiento antirretroviral (TAR). Revista Multidisciplinar del 2013;1(1):41-58.
Dilla T, Valladares A, Lizán L, Sacristán JA. Adherencia y persistencia terapéutica: causas, consecuencias y estrategias de mejora. Atención Primaria. 2009;41(6):342-348. doi:10.1016/j. 2008.09.031
Owe-Larsson M, Säll L, Salamon E, Allgulander HIV infection and psychiatric illness. African
Dyer JG and Reducing HIV risk among people with serious mental illness. J
Parhami I, Fong TW, Siani A, Carlotti C, Khanlou H. Documentation of Psychiatric Disorders and Related Factors in a Large Sample Population of HIV-Positive Patients in California. AIDS and 2013;17(8):2792-2801. doi:10.1007/s10461-012-0386-8
Bing EG, Burnam MA, Longshore D, et al. Psychiatric Disorders and Drug Use Among Human Immunodeficiency Virus–Infected Adults in the United States. Archives of General Psychiatry. 2001;58(8):721. doi:10.1001/archpsyc.58.8.721
Lopes M, Olfson M, Rabkin J, et Gender, HIV Status, and Psychiatric Disorders. The Journal of
Brandt The mental health of people living with HIV/AIDS in Africa: A systematic review. African
Burnam MA, Bing EG, Morton SC, et Use of mental health and substance abuse treatment services among adults with HIV in the United States. Archives of General Psychiatry. 2001;58(8):729-736. doi:10.1001/archpsyc.58.8.729
Kessler RC, Chiu WT, Demler O, Walters EE. Prevalence, Severity, and Comorbidity of 12-Month DSM-IV Disorders in the National Comorbidity Survey Replication. Archives of General Psychiatry. 2005;62(6):617. doi:10.1001/archpsyc.62.6.617
Schadé A, van Grootheest G, Smit JH. HIV-infected mental health patients: Characteristics and comparison with HIV-infected patients from the general population and non-infected mental health BMC Psychiatry. 2013;13. doi:10.1186/1471-244X-13-35
Gallego L, Barreiro P, Lopez-Ibor Diagnosis and Clinical Features of Major Neuropsychiatric
Pence BW, O’Donnell JK, Gaynes Falling through the cracks. AIDS. 2012;26(5):656-658.
Beer L, Tie Y, Padilla M, Shouse Generalized anxiety disorder symptoms among persons with diagnosed HIV in the United States. AIDS. 2019;33(11):1781-1787. doi:10.1097/ QAD.0000000000002286
Rane MS, Hong T, Govere S, et al. Depression and Anxiety as Risk Factors for Delayed Care- Seeking Behavior in Human Immunodeficiency Virus–Infected Individuals in South Africa. Clinical Infectious 2018;67(9):1411-1418. doi:10.1093/cid/ciy309
Glynn TR, Safren SA, Carrico AW, et al. High Levels of Syndemics and Their Association with Adherence, Viral Non-suppression, and Biobehavioral Transmission Risk in Miami, a S. City with an HIV/AIDS Epidemic. AIDS and Behavior. 2019;23(11):2956-2965. doi:10.1007/s10461-019- 02619-0
Been SK, Schadé A, Bassant N, Kastelijns M, Pogány K, Verbon A. Anxiety, depression and treatment adherence among HIV-infected AIDS Care. 2019;31(8):979-987. doi:10.1080/ 09540121.2019.1601676
Zigmond AS, Snaith The Hospital Anxiety and Depression Scale. Acta Psychiatrica
Ferrando L, Bobes J Gibert M, Soto M, Soto M.I.N.I. Mini International Neuropsychiatric
Baldwin DS, Anderson IM, Nutt DJ, Evidence-basedguidelinesforthepharmacologicaltreatment of anxiety disorders: recommendations from the British Association for Psychopharmacology. Journal of Psychopharmacology. 2005;19(6):567-596. doi:10.1177/0269881105059253
Rabkin HIV and depression: 2008 review and update. Current HIV/AIDS Reports. 2008;5(4):163-
doi:10.1007/s11904-008-0025-1
Leserman HIV disease progression: depression, stress, and possible mechanisms. Biological
Mollan KR, Smurzynski M, Eron JJ, et Association Between Efavirenz as Initial Therapy for HIV- 1 Infection and Increased Risk for Suicidal Ideation or Attempted or Completed Suicide. Annals of Internal Medicine. 2014;161(1):1. doi:10.7326/M14-0293
Slot M, Sodemann M, Gabel C, Holmskov J, Laursen T, Rodkjaer Factors associated with risk of depression and relevant predictors of screening for depression in clinical practice: a cross- sectional study among HIV-infected individuals in Denmark. HIV Medicine. 2015;16(7):393-402. doi:10.1111/hiv.12223
Robertson K, Bayon C, Molina J-M, et al. Screening for neurocognitive impairment, depression, and anxiety in HIV-infected patients in Western Europe and AIDS Care. 2014;26(12):1555- 1561. doi:10.1080/09540121.2014.936813
Morrison MF, Petitto JM, Have T ten, et al. Depressive and Anxiety Disorders in Women With HIV
Rao D, Feldman BJ, Fredericksen RJ, et al. A Structural Equation Model of HIV-Related Stigma, Depressive Symptoms, and Medication Adherence. AIDS and Behavior. 2012;16(3):711-716. doi:10.1007/s10461-011-9915-0
Ciesla JA, Roberts JE. Meta-Analysis of the Relationship Between HIV Infection and Risk for Depressive Disorders. American Journal of Psychiatry. 2001;158(5):725-730. doi:10.1176/appi. 158.5.725
Tegger MK, Crane HM, Tapia KA, Uldall KK, Holte SE, Kitahata MM. The Effect of Mental Illness, Substance Use, and Treatment for Depression on the Initiation of Highly Active Antiretroviral Therapy among HIV-Infected Individuals. AIDS Patient Care and STDs. 2008;22(3):233-243. doi:10.1089/apc.2007.0092
Gonzalez JS, Batchelder AW, Psaros C, Safren Depression and HIV/AIDS Treatment Nonadherence: A Review and Meta-analysis. JAIDS Journal of Acquired Immune Deficiency Syndromes. 2011;58(2):181-187. doi:10.1097/QAI.0B013E31822D490A
Springer SA, Dushaj A, Azar MM. The Impact of DSM-IV Mental Disorders on Adherence to Combination Antiretroviral Therapy Among Adult Persons Living with HIV/AIDS: A Systematic AIDS and Behavior. 2012;16(8):2119-2143. doi:10.1007/s10461-012-0212-3
Sherr L, Clucas C, Harding R, Sibley E, Catalan J. HIV and Depression – a systematic review of Psychology, Health & Medicine. 2011;16(5):493-527. doi:10.1080/13548506.2011.5 79990
Leserman Role of Depression, Stress, and Trauma in HIV Disease Progression. Psychosomatic
So‐Armah K, Gupta S, Kundu S, et Depression and all‐cause mortality risk in HIV‐infected and HIV‐uninfected US veterans: a cohort study. HIV Medicine. 2019;20(5):317-329. doi:10.1111/ hiv.12726
European AIDS Clinical Society. EACS Guidelines version 10.0 — EACS. Published November Accessed June 25, 2020. https://www.eacsociety.org/files/2019_guidelines-10.0_final.pdf.
Treisman GJ, Soudry O. Neuropsychiatric Effects of HIV Antiviral Medications. Drug Safety. 2016;39(10):945-957. doi:10.1007/s40264-016-0440-y
Aragonès E, Roca M, Mora F. Abordaje Compartido de La Depresión: Consenso Multidisciplinar ; 2018. Accessed June 25, 2020. Ebook disponible en: www.semfyc.es/wp-content/ uploads/2018/05/ Consenso_depresion.pdf.
Laperriere A, Ironson GH, Antoni MH, et al. Decreased Depression Up to One Year Following CBSM+ Intervention in Depressed Women with AIDS: The Smart/EST Women’s Project. Journal of Health 2005;10(2):223-231. doi:10.1177/1359105305049772
Carrico AW, Antoni MH, Durán RE, et Reductions in depressed mood and denial coping during
Paulus DJ, Brandt CP, Lemaire C, Zvolensky MJ. Trajectory of change in anxiety sensitivity in relation to anxiety, depression, and quality of life among persons living with HIV/AIDS following transdiagnostic cognitive-behavioral therapy. Cognitive Behaviour Therapy. 2020;49(2):149-163. doi:10.1080/16506073.2019.1621929
Freudenreich O, Goforth HW, Cozza KL, et Psychiatric treatment of persons with HIV/AIDS: An HIV-psychiatry consensus survey of current practices. Psychosomatics. 2010;51(6):480-488. doi:10.1176/appi.psy.51.6.480
Ferrando SJ, Freyberg Treatment of depression in HIV positive individuals: A critical review.
Chandra PS, Desai G, Ranjan HIV & Psychiatric Disorders. Vol 121.; 2005.
de Sousa Gurgel W, da Silva Carneiro AH, Barreto Rebouças D, Negreiros de Matos KJ, do Menino Jesus Silva Leitão T, de Matos e Souza FG. Prevalence of bipolar disorder in a HIV- infected outpatient AIDS Care. 2013;25(12):1499-1503. doi:10.1080/09540121.2013.7 79625
Kieburtz K, Zettelmaier AE, Ketonen L, Tuite M, Caine Manic syndrome in AIDS. American
Ellen SR, Judd FK, Mijch AM, Cockram Secondary Mania in Patients with HIV Infection. Australian
Nakimuli-Mpungu E, Musisi S, Mpungu SK, Katabira Primary Mania Versus HIV-Related Secondary Mania in Uganda. American Journal of Psychiatry. 2006;163(8):1349-1354. doi:10.1176/ ajp.2006.163.8.1349
Robinson Primary Mania Versus Secondary Mania of HIV/AIDS in Uganda. American Journal
Nakimuli-Mpungu E, Musisi S, Kiwuwa Mpungu S, Katabira E. Clinical Presentation of Bipolar Mania in HIV-Positive Patients in Psychosomatics. 2009;50(4):325-330. doi:10.1176/appi. psy.50.4.325
Lyketsos CG, Hanson AL, Fishman M, Rosenblatt A, McHugh PR, Treisman GJ. Manic syndrome early and late in the course of HIV. American Journal of Psychiatry. 1993;150(2):326-327. doi:10.1176/ajp.150.2.326
Nakimuli-Mpungu, Mutamba Brian, Nshemerirwe Slyvia, Kiwuwa Mpungu Steven, Seggane Musisi. Effect of HIV infection on time to recovery from an acute manic HIV/AIDS - Research and Palliative Care. 2010;2:185. doi:10.2147/hiv.s9978
Soares Recent advances in the treatment of bipolar mania, depression, mixed states, and rapid cycling. International Clinical Psychopharmacology. 2000;15(4):183-196. doi:10.1097/00004850- 200015040-00001
American Psychiatric Diagnostic and Statistical Manual of Mental Disorders DSM-5
Stolar A. HIV and Psychiatry, Second Edition: A Training and Resource Manual . Cambridge University Press;
Newton PJ, Newsholme W, Brink NS, Manji H, Williams IG, Miller RF. Acute meningoencephalitis and meningitis due to primary HIV infection. BMJ (Clinical research ed). 2002;325(7374):1225- https://Pubmed.ncbi.nlm.nih.gov/12446542
Anguizola-Tamayo D, Bocos-Portillo J, Pardina-Vilella L, et al. Psychosis of dual origin in HIV infection: Viral escape syndrome and autoimmune encephalitis. Neurology Clinical practice. 2019;9(2):178-180. doi:10.1212/CPJ.0000000000000582
Laher A, Ariefdien N, Etlouba HIV prevalence among first-presentation psychotic patients. HIV
de Ronchi D, Faranca I, Forti P, et al. Development of Acute Psychotic Disorders and HIV-1 The International Journal of Psychiatry in Medicine. 2000;30(2):173-183. doi:10.2190/ PLGX-N48F-RBHJ-UF8K
Singh AN, Golledge H, Catalan Treatment of HIV-related psychotic disorders with risperidone: A series of 21 cases. Journal of Psychosomatic Research. 1997;42(5):489-493. doi:10.1016/S0022- 3999(96)00373-X
Fernandez F, Levy JK. The use of molindone in the treatment of psychotic and delirious patients infected with the human immunodeficiency virus. General Hospital Psychiatry. 1993;15(1):31-35. doi:10.1016/0163-8343(93)90088-6
Sewell DD, Jeste D , McAdams LA, et al. Neuroleptic Treatment of HIV-Associated Psychosis.
Millon Classifying Personality Disorders: An Evolution-Based Alternative to an Evidence-Based
Nanni MG, Caruso R, Mitchell AJ, Meggiolaro E, Grassi Depression in HIV Infected Patients: a
Low Y, Goforth H, Preud’homme X, Edinger J, Krystal A. Insomnia in HIV-infected patients: pathophysiologic . AIDS Reviews. 2014;16:3-13.
Omonuwa TS, Goforth HW, Preud’homme X, Krystal AD. The pharmacologic management of insomnia in patients with Journal of clinical sleep medicine : JCSM : official publication of the American Academy of Sleep Medicine. 2009;5(3):251-262. https://Pubmed.ncbi.nlm.nih. gov/19960648
Fekete EM, Williams SL, Skinta MD. Internalised HIV-stigma, loneliness, depressive symptoms and sleep quality in people living with Psychology & Health. 2018;33(3):398-415. doi:10.1080
Rogers BG, Lee JS, Bainter SA, Bedoya CA, Pinkston M, Safren A multilevel examination of sleep, depression, and quality of life in people living with HIV/AIDS. Journal of health psychology. Published online March 1, 2018:1359105318765632-1359105318765632. doi:10.1177/1359105318765632
Qaseem A, Kansagara D, Forciea MA, Cooke M, Denberg TD. Management of Chronic Insomnia Disorder in Adults: A Clinical Practice Guideline From the American College of Physicians. Annals of Internal 2016;165(2):125. doi:10.7326/M15-2175
Wilson S, Anderson K, Baldwin D, et al. British Association for Psychopharmacology consensus statement on evidence-based treatment of insomnia, parasomnias and circadian rhythm disorders: An Journal of Psychopharmacology. 2019;33(8):923-947. doi:10.1177/0269881119855343
Celesia M., Sofia S. A., Rapisarda L., et al. Anxiety, depression and sleep disturbances in hiv+ patients chronically treated with an Efavirenz-based regimen. Infectious Diseases & Tropical Medicine . 2017;3(2):e394.
Asboe D, Catalan J, Mandalia S, et Sexual dysfunction in HIV-positive men is multi-factorial: A study of prevalence and associated factors. AIDS Care - Psychological and Socio-Medical Aspects of AIDS/HIV. 2007;19(8):955-965. doi:10.1080/09540120701209847
Sandfort TGM, Collier KL, Grossberg R. Addressing sexual problems in HIV primary care: Experiences from patients. Archives of Sexual Behavior. 2013;42(7):1357-1368. doi:10.1007/ s10508-012-0009-5
Waters L, Fisher M, Winston A, et A phase IV, double-blind, multicentre, randomized, placebo- controlled, pilot study to assess the feasibility of switching individuals receiving Efavirenz with continuing central nervous system adverse events to etravirine. AIDS. 2011;25(1):65-71. doi:10.1097/QAD.0b013e328341685b
Pinzone MR, Gussio M, Bellissimo F, et Self-Reported Sexual Dysfunction in HIV-Positive
Laumann EO, Paik A, Rosen Sexual dysfunction in the United States: Prevalence and predictors.
Shamloul R, Ghanem Erectile dysfunction. The Lancet. 2013;381(9861):153-165. doi:10.1016/
Santi D, Brigante G, Zona S, Guaraldi G, Rochira Male sexual dysfunction and HIV-a clinical
Slag MF, Morley JE, Elson MK, et Impotence in Medical Clinic Outpatients. JAMA. 1983;249(13):1736-1740. doi:10.1001/jama.1983.03330370046029
Tsertsvadze A, Fink HA, Yazdi F, et al. Oral Phosphodiesterase-5 Inhibitors and Hormonal Treatments for Erectile Dysfunction: A Systematic Review and Meta-analysis. Annals of Internal 2009;151(9):650. doi:10.7326/0003-4819-151-9-200911030-00150
Brock G, Heiselman D, Maggi M, et al. Effect of Testosterone Solution 2% on Testosterone Concentration, Sex Drive and Energy in Hypogonadal Men: Results of a Placebo Controlled Journal of Urology. 2016;195(3):699-705. doi:10.1016/j.juro.2015.10.083
Cai T, Palumbo F, Liguori G, et al. The intra-meatal application of alprostadil cream (Vitaros®) improves drug efficacy and patient’s satisfaction: results from a randomized, two-administration route, cross-over clinical International Journal of Impotence Research. 2019;31(2):119-125. doi:10.1038/s41443-018-0087-6
Derouet H, Caspari D, Rohde V, Rommel G, Ziegler Treatment of erectile dysfunction with
Zhu Z, Zhao R, Hu Y. Symptom Clusters in People Living With HIV: A Systematic Review. Journal
Jong E, Oudhoff LA, Epskamp C, et Predictors and treatment strategies of HIV-related fatigue in the combined antiretroviral therapy era. AIDS. 2010;24(10):1387-1405. doi:10.1097/ QAD.0b013e328339d004
Bengtson AM, Pence BW, Crane HM, et Disparities in depressive symptoms and antidepressant treatment by gender and race/ethnicity among people living with HIV in the United States. PLoS ONE. 2016;11(8). doi:10.1371/journal.pone.0160738
Webel AR, Perazzo J, Decker M, Horvat-Davey C, Sattar A, Voss J. Physical activity is associated with reduced fatigue in adults living with HIV/AIDS. Journal of Advanced 2016;72(12):3104- 3112. doi:10.1111/jan.13084
Bertholet N, Cheng DM, Samet JH, Quinn E, Saitz R. Alcohol consumption patterns in HIV- infected adults with alcohol problems. Drug and Alcohol Dependence. 2010;112(1-2):160-163. doi:10.1016/j.drugalcdep.2010.05.009
Braithwaite RS, Conigliaro J, Roberts MS, et al. Estimating the impact of alcohol consumption on survival for HIV+ individuals. AIDS Care - Psychological and Socio-Medical Aspects of AIDS/HIV. 2007;19(4):459-466. doi:10.1080/09540120601095734
Lucas GM, Mullen BA, Weidle PJ, Hader S, McCaul ME, Moore RD. Directly Administered Antiretroviral Therapy in Methadone Clinics Is Associated with Improved HIV Treatment Outcomes, Compared with Outcomes among Concurrent Comparison Groups. Clinical Infectious Diseases. 2006;42(11):1628-1635. doi:10.1086/503905
Andersen R, Bozzette S, Shapiro M, et al. Access of vulnerable groups to antiretroviral therapy among persons in care for HIV disease in the United States. HCSUS Consortium. HIV Cost and Services Utilization Study. Health services research. 2000;35(2):389-416. https://Pubmed.ncbi. nih.gov/10857469
Cook RL, Sereika SM, Hunt SC, Woodward WC, Erlen JA, Conigliaro J. Problem drinking and medication adherence among persons with HIV infection. Journal of General Internal Medicine. 2001;16(2):83-88. doi:10.1111/j.1525-1497.2001.00122.x
Azar MM, Springer SA, Meyer JP, Altice FL. A systematic review of the impact of alcohol use disorders on HIV treatment outcomes, adherence to antiretroviral therapy and health care Drug and Alcohol Dependence. 2010;112(3):178-193. doi:10.1016/j.drugalcdep.2010.06.014
Wu ES, Metzger DS, Lynch KG, Douglas Association between alcohol use and HIV viral load. Journal of Acquired Immune Deficiency Syndromes. 2011;56(5). doi:10.1097/ QAI.0b013e31820dc1c8
Stein MD, Hanna L, Natarajan R, et al. Alcohol use patterns predict high-risk HIV behaviors among active injection drug users. Journal of Substance Abuse Treatment. 2000;18(4):359-363. doi:10.1016/S0740-5472(99)00070-7
Mathews WC, McCutchan JA, Asch S, et National estimates of HIV-related symptom prevalence from the HIV cost and services utilization study. Medical Care. 2000;38(7):750-761. doi:10.1097/00005650-200007000-00007
Shacham E, Agbebi A, Stamm K, Overton ET. Alcohol consumption is associated with poor health in HIV clinic patient population: A behavioral surveillance AIDS and Behavior. 2011;15(1):209- 213. doi:10.1007/s10461-009-9652-9
Palepu A, Horton NJ, Tibbetts N, Meli S, Samet Substance abuse treatment and hospitalization among a cohort of HIV-infected individuals with alcohol problems. Alcoholism: Clinical and Experimental Research. 2005;29(3):389-394. doi:10.1097/01.ALC.0000156101.84780.45
Korthuis PT, Tozzi MJ, Nandi V, et Improved quality of life for opioid-dependent patients receiving buprenorphine treatment in HIV clinics. Journal of Acquired Immune Deficiency Syndromes. 2011;56(SUPPL. 1). doi:10.1097/QAI.0b013e318209754c
Lucas GM, Griswold M, Gebo KA, Keruly J, Chaisson RE, Moore Illicit Drug Use and HIV- 1 Disease Progression: A Longitudinal Study in the Era of Highly Active Antiretroviral Therapy. American Journal of Epidemiology. 2006;163(5):412-420. doi:10.1093/aje/kwj059
Galvan FH, Bing EG, Fleishman JA, et al. The prevalence of alcohol consumption and heavy drinking among people with HIV in the United States: Results from the HIV cost and services utilization Journal of Studies on Alcohol. 2002;63(2):179-186. doi:10.15288/jsa.2002.63.179
Bagby GJ, Amedee AM, Siggins RW, Molina PE, Nelson S, Veazey Alcohol and HIV Effects on the Immune System. Alcohol research : current reviews. 2015;37(2):287-297. https://Pubmed. ncbi.nlm.nih.gov/26695751
Amedee A, Nichols W, Robichaux S, Bagby G, Nelson S. Chronic Alcohol Abuse and HIV Disease Progression: Studies with the Non-Human Primate Current HIV Research. 2014;12(4):243- 253. doi:10.2174/1570162x12666140721115717
Ludford KT, Vagenas P, Lama JR, et al. Screening for Drug and Alcohol Use Disorders and Their Association with HIV-Related Sexual Risk Behaviors among Men Who Have Sex with Men in PLoS ONE. 2013;8(8). doi:10.1371/journal.pone.0069966
Parry CD, Blank MB, Pithey AL. Responding to the threat of HIV among persons with mental illness and substance abuse. Current Opinion in Psychiatry. 2007;20(3):235-241. doi:10.1097/ 0b013e3280ebb5f0
Kader R, Govender R, Seedat S, Koch JR, Parry C. Understanding the impact of hazardous and harmful use of alcohol and/or other drugs on ARV adherence and disease progression. PLoS 2015;10(5). doi:10.1371/journal.pone.0125088
Pellowski JA, Kalichman SC, Kalichman MO, Cherry C. Alcohol-antiretroviral therapy interactive toxicity beliefs and daily medication adherence and alcohol use among people living with HIV. AIDS Care - Psychological and Socio-Medical Aspects of AIDS/HIV. 2016;28(8):963-970. doi:10. 1080/09540121.2016.1154134
Williams EC, Hahn JA, Saitz R, Bryant K, Lira MC, Samet Alcohol Use and Human Immunodeficiency Virus (HIV) Infection: Current Knowledge, Implications, and Future Directions. Alcoholism: Clinical and Experimental Research. 2016;40(10):2056-2072. doi:10.1111/acer.13204
Kelso NE, Sheps DS, Cook RL. The association between alcohol use and cardiovascular disease among people living with HIV: A systematic American Journal of Drug and Alcohol Abuse. 2015;41(6):479-488. doi:10.3109/00952990.2015.1058812
McGinnis KA, Fultz SL, Skanderson M, Conigliaro J, Bryant K, Justice Hepatocellular carcinoma and non-Hodgkin’s lymphoma: The roles of HIV, hepatitis C infection, and alcohol abuse. Journal of Clinical Oncology. 2006;24(31):5005-5009. doi:10.1200/JCO.2006.05.7984
Fein G, Biggins CA, MacKay S. Alcohol abuse and HIV infection have additive effects on frontal cortex function as measured by auditory evoked potential P3A latency. Biological Psychiatry. 1995;37(3):183-195. doi:10.1016/0006-3223(94)00119-N
Gongvatana A, Morgan EE, Iudicello JE, Letendre SL, Grant I, Woods SP. A history of alcohol dependence augments HIV-associated neurocognitive deficits in persons aged 60 and older. Journal of 2014;20(5):505-513. doi:10.1007/s13365-014-0277-z
Pérez-Molina JA, Polo R, López-Aldeguer J, et al. Executive summary of the GeSIDA/National AIDS Plan consensus document on antiretroviral therapy in adults infected by the human immunodeficiency virus (updated January 2018). Enfermedades Infecciosas y Microbiologia 2019;37(3):195-202. doi:10.1016/j.eimc.2018.02.010
Mcdowell JA, Chittick GE, Stevens CP, Edwards KD, Stein DS. Pharmacokinetic interaction of Abacavir (1592U89) and ethanol in human immunodeficiency virus-infected adults. Antimicrobial Agents and 2000;44(6):1686-1690. doi:10.1128/AAC.44.6.1686-1690.2000
McCance-Katz EF, Gruber VA, Beatty G, Lum PJ, Rainey Interactions between alcohol and the antiretroviral medications Ritonavir or Efavirenz. Journal of Addiction Medicine. 2013;7(4):264- 270. doi:10.1097/ADM.0b013e318293655a
Gruber VA, Rainey PM, Lum PJ, Beatty GW, Aweeka FT, McCance-Katz Interactions between
Lifson AR, Neuhaus J, Arribas JR, van Berg-Wolf M den, Labriola AM, Read TRH. Smoking- related health risks among persons with HIV in the strategies for management of antiretroviral therapy clinical trial. American Journal of Public Health. 2010;100(10):1896-1903. doi:10.2105/ 2009.188664
Lifson AR, Lando HA. Smoking and HIV: Prevalence, health risks, and cessation strategies. Current HIV/AIDS 2012;9(3):223-230. doi:10.1007/s11904-012-0121-0
Zyambo CM, Burkholder GA, Cropsey KL, et al. Predictors of smoking cessation among people living with HIV receiving routine clinical care. AIDS Care - Psychological and Socio-Medical Aspects of AIDS/HIV. 2019;31(11):1353-1361. doi:10.1080/09540121.2019.1619659
Helleberg M, May MT, Ingle SM, et Smoking and life expectancy among HIV-infected individuals on antiretroviral therapy in Europe and North America. AIDS. 2015;29(2):221-229. doi:10.1097/ QAD.0000000000000540
Petoumenos K, Worm S, Reiss P, et Rates of cardiovascular disease following smoking cessation in patients with HIV infection: Results from the D:A:D study. HIV Medicine. 2011;12(7):412-421. doi:10.1111/j.1468-1293.2010.00901.x
Shepherd L, Ryom L, Law M, et al. Cessation of Cigarette Smoking and the Impact on Cancer Incidence in Human Immunodeficiency Virus–infected Persons: The Data Collection on Adverse Events of Anti-HIV Drugs Clinical Infectious Diseases. 2018;68(4):650-657. doi:10.1093/cid/ ciy508
Vidrine DJ, Arduino RC, Gritz ER. The effects of smoking abstinence on symptom burden and quality of life among persons living with HIV/AIDS. AIDS Patient Care and 2007;21(9):659- 666. doi:10.1089/apc.2007.0022
Reddy KP, Parker RA, Losina E, et Impact of Cigarette Smoking and Smoking Cessation on Life Expectancy Among People With HIV: A US-Based Modeling Study. The Journal of Infectious Diseases. 2016;214(11):1672-1681. doi:10.1093/infdis/jiw430
Tait RJ, Caldicott D, Mountain D, Hill SL, Lenton S. A systematic review of adverse events arising from the use of synthetic cannabinoids and their associated treatment. Clinical Toxicology. 2016;54(1):1-13. doi:10.3109/15563650.2015.1110590
Fogarty A, Rawstorne P, Prestage G, Crawford J, Grierson J, Kippax S. Marijuana as therapy for people living with HIV/AIDS: Social and health aspects. AIDS Care - Psychological and Socio- Medical Aspects of AIDS/HIV. 2007;19(2):295-301. doi:10.1080/09540120600841930
Furler MD, Einarson TR, Millson M, Walmsley S, Bendayan R. Medicinal and Recreational Marijuana Use by Patients Infected with HIV. AIDS Patient Care and STDs. 2004;18(4):215-228. doi:10.1089/108729104323038892
Prentiss D, Power R, Balmas G, Tzuang G, Israelski Patterns of Marijuana Use among Patients with HIV/AIDS Followed in a Public Health Care Setting. Journal of Acquired Immune Deficiency Syndromes. 2004;35(1):38-45. doi:10.1097/00126334-200401010-00005
Woolridge E, Barton S, Samuel J, Osorio J, Dougherty A, Holdcroft A. Cannabis use in HIV for pain and other medical symptoms. Journal of Pain and Symptom Management. 2005;29(4):358- doi:10.1016/j.jpainsymman.2004.07.011
Bonn-Miller MO, Oser ML, Bucossi MM, Trafton Cannabis use and HIV antiretroviral therapy adherence and HIV-related symptoms. Journal of Behavioral Medicine. 2014;37(1):1-10. doi:10.1007/s10865-012-9458-5
Lake S, Kerr T, Capler R, Shoveller J, Montaner J, Milloy High-intensity cannabis use and HIV clinical outcomes among HIV-positive people who use illicit drugs in Vancouver, Canada. International Journal of Drug Policy. 2017;42:63-70. doi:10.1016/j.drugpo.2017.02.009
Sinha S, McCaul ME, Hutton HE, et al. Marijuana use and HIV treatment outcomes among PWH receiving care at an urban HIV clinic. Journal of Substance Abuse Treatment. 2017;82:102-106. doi:10.1016/j.jsat.2017.09.009
Fuster-RuizdeApodaca MJ, Castro-Granell V, Garin N, et al. Prevalence and patterns of illicit drug use in people living with HIV in Spain: A cross-sectional PLoS ONE. 2019;14(6). doi:10.1371/ journal.pone.0211252
Baum MK, Rafie C, Lai S, Sales S, Page B, Campa A. Crack-cocaine use accelerates HIV disease progression in a cohort of HIV-positive drug users. Journal of Acquired Immune Deficiency 2009;50(1):93-99. doi:10.1097/QAI.0b013e3181900129
Shoptaw S, Stall R, Bordon J, et al. Cumulative exposure to stimulants and immune function outcomes among HIV-positive and HIV-negative men in the Multicenter AIDS Cohort Study. International Journal of STD and 2012;23(8):576-580. doi:10.1258/ijsa.2012.011322
Mukerji S, Haghighat R, Misra V, et al. Longitudinal Modeling of Depressive Trajectories Among HIV-Infected Men Using AIDS and Behavior. 2017;21(7):1985-1995. doi:10.1007/s10461- 017-1801-y
European Monitoring Centre for Drugs and Drug Addiction (EMCDDA). Emergency health consequences of cocaine use in Europe. A review of the monitoring of drug-related acute emergencies in 30 European countries | emcdda.europa.eu. Published 2014. Accessed June 19, 2020. https://www.emcdda.europa.eu/publications/scientific-studies/2014/cocaine- emergencies_en
Informe Europeo sobre Drogas Tendencias y doi:10.2810/295940
Montain J, Ti L, Hayashi K, Nguyen P, Wood E, Kerr T. Impact of length of injecting career on HIV incidence among people who inject Addictive Behaviors. 2016;58:90-94. doi:10.1016/j. addbeh.2016.02.020
Peters PJ, Pontones P, Hoover KW, et HIV infection linked to injection use of oxymorphone in Indiana, 2014-2015. New England Journal of Medicine. 2016;375(3):229-239. doi:10.1056/ NEJMoa1515195
Bourne A, Reid D, Hickson F, Torres-Rueda S, Weatherburn P. Illicit drug use in sexual settings (‘chemsex’) and HIV/STI transmission risk behaviour among gay men in South London: Findings from a qualitative study. Sexually Transmitted Infections. 2015;91(8):564-568. doi:10.1136/ sextrans-2015-052052
Fernández Dávila “Sesión de sexo, morbo y vicio”: una aproximación holística para entender la aparición del fenómeno ChemSex entre hombres gais, bisexuales y otros hombres que tienen sexo con hombres en España. Revista Multidisciplinar del SIDA. 2016;4:41-65.
Payancé A, Scotto B, Perarnau JM, de Muret A, Bacq Y. Severe chronic hepatitis secondary to prolonged use of ecstasy and cocaine. Clinics and Research in Hepatology and Gastroenterology. 2013;37(5). doi:10.1016/j.clinre.2013.06.003
Rodríguez Salgado B. Fenetilaminas Clásicas: MDMA y Sus Análogos, p-Metoxianfetaminas y En: Nuevas Drogas Psicoactivas. . Entheos; 2015.
Dolengevich-Segal H, Rodríguez Salgado B, Ramírez JGA, Sánchez-Mateos D. Nuevas Drogas Vol Cap 5. Entheos; 2015. doi:10.20882/adicciones.709
Swanson Unifying theories of psychedelic drug effects. Frontiers in Pharmacology. 2018;9(MAR). doi:10.3389/fphar.2018.00172
Vollenweider Brain mechanisms of hallucinogens and entactogens. Dialogues in clinical neuroscience. 2001;3:265-279.
Nichols D, Grob Is LSD toxic? Forensic science international. 2018;284:141-145. doi:10.1016/j. forsciint.2018.01.006
Hildebrand M. The psychometric properties of the drug use disorders identification test (DUDIT): A review of recent Journal of Substance Abuse Treatment. 2015;53:52-59. doi:10.1016/j. jsat.2015.01.008
Saunders JB, Aasland OG, Babor TF, de La Fuente JR, Grant Development of the Alcohol Use Disorders Identification Test (AUDIT): WHO Collaborative Project on Early Detection of Persons with Harmful Alcohol Consumption‐II. Addiction. 1993;88(6):791-804. doi:10.1111/j.1360-0443.1993. tb02093.x
Gates PJ, Sabioni P, Copeland J, le Foll B, Gowing Psychosocial interventions for cannabis use disorder. Cochrane Database of Systematic Reviews. 2016;2016(5). doi:10.1002/14651858. CD005336.pub4
Wechsberg WM, Golin C, El-Bassel N, Hopkins J, Zule W. Current interventions to reduce sexual risk behaviors and crack cocaine use among HIV-infected individuals. Current HIV/AIDS Reports. 2012;9(4):385-393. doi:10.1007/s11904-012-0131-y
Gonzales D, Rennard SI, Nides M, et al. Varenicline, an α4β2 nicotinic acetylcholine receptor partial agonist, vs sustained-release Bupropion and placebo for smoking cessation: A randomized controlled trial. Journal of the American Medical Association. 2006;296(1):47-55. doi:10.1001/ 296.1.47
West R, Baker CL, Cappelleri JC, Bushmakin AG. Effect of varenicline and Bupropion SR on craving, nicotine withdrawal symptoms, and rewarding effects of smoking during a quit attempt. 2008;197(3):371-377. doi:10.1007/s00213-007-1041-3
Amodei N, Lamb RJ. The Role of Nicotine Replacement Therapy in Early Quitting Success. Nicotine & tobacco research : official journal of the Society for Research on Nicotine and 2010;12(1):1-10. doi:10.1093/NTR/NTP164
World Health Organisation. Consolidated ARV guidelines on the use of antiretroviral drugs for treating and preventing HIV infection: recommendations for a public health approach. Geneva: World Health Published 2013. Accessed June 19, 2020. http://www.who.int/hiv/pub/ guidelines/arv2013/
Beauverie P, Taburet AM, Dessalles MC, Furlan V, Touzeau D. Therapeutic Drug Monitoring of Methadone in HIV-infected Patients Receiving Protease AIDS . 1998;12(18):2510-2511.
Clarke S, Mulcahy F, Bergin C, et al. Absence of Opioid Withdrawal Symptoms in Patients Receiving Methadone and the Protease Inhibitor Lopinavir‐Ritonavir. Clinical Infectious Diseases. 2002;34(8):1143-1145. doi:10.1086/339541
Clarke SM, Mulcahy FM, Tjia J, et al. Pharmacokinetic Interactions of Nevirapine and Methadone and Guidelines for Use of Nevirapine to Treat Injection Drug Users. Clinical Infectious Diseases. 2001;33(9):1595-1597. doi:10.1086/322519
Ostrow DG, Plankey MW, Cox C, et al. Specific sex drug combinations contribute to the majority of recent HIV seroconversions among MSM in the MACS. Journal of Acquired Immune Deficiency 2009;51(3):349-355. doi:10.1097/QAI.0b013e3181a24b20
Kenyon C, Wouters K, Platteau T, Buyze J, Florence E. Increases in condomless chemsex associated with HIV acquisition in MSM but not heterosexuals attending a HIV testing center in Antwerp, AIDS Research and Therapy. 2018;15(1). doi:10.1186/s12981-018-0201-3
Dolengevich-Segal H, Gonzalez-Baeza A, Valencia J, et al. Drug-related and psychopathological symptoms in HIV-positive men who have sex with men who inject drugs during sex (slamsex): Data from the U-SEX GeSIDA 9416 PLoS ONE. 2019;14(12). doi:10.1371/journal.pone.0220272
World Federation for Mental Health SALUD MENTAL EN ATENCIÓN PRIMARIA: MEJORANDO LOS TRATAMIENTOS Y PROMOVIENDO LA SALUD MENTAL. Accessed June 25, 2020. http:// www.infocop.es/view_article.asp?id=2582
Forstein M, Cournos F, Douaihy A, Goodkin K, Wainberg ML, Wapenyi Guideline Watch:
Kendall CE, Shoemaker ES, Boucher L, et al. The organizational attributes of HIV care delivery models in Canada: A cross-sectional PLoS ONE. 2018;13(6). doi:10.1371/journal. pone.0199395
Haggerty JL, Roberge D, Freeman GK, Beaulieu C. Experienced continuity of care when patients see multiple clinicians: A qualitative metasummary. Annals of Family Medicine. 2013;11(3):262- doi:10.1370/afm.1499
Tran BX, Ho RCM, Ho CSH, et Depression among patients with HIV/AIDS: Research development and effective interventions (gapresearch). International Journal of Environmental Research and Public Health. 2019;16(10). doi:10.3390/ijerph16101772
Eshun-Wilson I, Siegfried N, Akena DH, Stein DJ, Obuku EA, Joska JA. Antidepressants for depression in adults with HIV Cochrane Database of Systematic Reviews. 2018;2018(1). doi:10.1002/14651858.CD008525.pub3
Hill L, Lee KC. Pharmacotherapy considerations in patients with HIV and psychiatric disorders: Focus on antidepressants and antipsychotics. Annals of Pharmacotherapy. 2013;47(1):75-89. doi:10.1345/aph.1R343
DeSilva KE, le Flore DB, Marston BJ, Rimland D. Serotonin syndrome in HIV-infected individuals receiving antiretroviral therapy and AIDS. 2001;15(10):1281-1285. doi:10.1097/00002030- 200107060-00010
Cettomai D, McArthur JC. Mirtazapine use in human immunodeficiency virus-infected patients with progressive multifocal leukoencephalopathy. Archives of Neurology. 2009;66(2):255-258. doi:10.1001/archneurol.2008.557
Jann MW, Spratlin V, Momary K, et al. Lack of a pharmacokinetic drug-drug interaction with venlafaxine extended-release/indinavir and desvenlafaxine extended-release/indinavir. European Journal of Clinical 2012;68(5):715-721. doi:10.1007/s00228-011-1180-7
Park J, Vousden M, Brittain C, et al. Dose-related reduction in Bupropion plasma concentrations by Journal of Clinical Pharmacology. 2010;50(10):1180-1187. doi:10.1177/0091270009359524
Pedrol-Clotet E, Deig-Comerma E, Ribell-Bachs M, Vidal-Castell I, García-Rodríguez P, Soler
Uso de bupropión en la deshabituación tabáquica en pacientes infectados por el VIH en tratamiento antirretroviral. Enfermedades Infecciosas y Microbiologia Clinica. 2006;24(8):509-511. doi:10.1157/13092468
Adams JL, Gaynes BN, McGuinness T, Modi R, Willig J, Pence BW. Treating depression within the HIV medical home: A guided algorithm for antidepressant management by HIV clinicians. AIDS Patient Care and 2012;26(11):647-654. doi:10.1089/apc.2012.0113
Pettersson A, Boström KB, Gustavsson P, Ekselius Which instruments to support diagnosis of depression have sufficient accuracy? A systematic review. Nordic Journal of Psychiatry. 2015;69(7):497-508. doi:10.3109/08039488.2015.1008568
Newville H, Roley J, Sorensen Prescription medication misuse among HIV-infected individuals taking antiretroviral therapy. Journal of Substance Abuse Treatment. 2015;48(1):56-61. doi:10.1016/j.jsat.2014.07.013
Johannessen Landmark C. Antiepileptic drugs in non-epilepsy disorders: Relations between mechanisms of action and clinical CNS Drugs. 2008;22(1):27-47. doi:10.2165/00023210- 200822010-00003
HIV Drug University of Liverpool. Accessed June 26, 2020. https://liverpool-hiv-hep. s3.amazonaws.com/prescribing_resources/pdfs/000/000/023/original/TS_Antipsychotic_2019_ Oct.pdf?1571043424
Owen-Smith A, Depadilla L, Diclemente R. The assessment of complementary and alternative medicine use among individuals with HIV: A systematic review and recommendations for future Journal of Alternative and Complementary Medicine. 2011;17(9):789-796. doi:10.1089/ acm.2010.0669
Panel de expertos de GeSIDA y Plan Nacional sobre el Documento de Consenso de GeSIDA/ Plan Nacional Sobre El SIDA Respecto al Tratamiento Antirretroviral En Adultos Infectados Por El Virus de La Inmunodeficiencia Humana.; 2019. Accessed June 25, 2020. http://GeSIDA-seimc. org/wp-content/uploads/2019/01/GeSIDA_DC_TAR_2019_v_final.pdf.
Thomas Mulet V, Aguado Taberna C, Fidalgo Gónzalez S, et La infección por el VIH/SIDA y atención primaria. Atención Primaria. 2004;33(1):3-5. Accessed June 23, 2020. http://www. elsevier.es/es-revista-atencion-primaria-27-articulo-la-infeccion-por-el-vih-SIDA-13056498
Gallego Deike L, Gordillo Álvarez-Valdés M v. Trastornos mentales en pacientes infectados por el
Gordillo V. Trastornos psicológicos y aspectos psicosociales. Manual del SIDA. Published online 1999:605-620.
Casanova Colominas JM, Carmen Rodríguez Fernández M, Gómez García Manejo del paciente con VIH en Atención Primaria. AMF. 2013;9:306-315.
Núñez Rojas AC, Tobón S, Vinaccia Diseño de Un Modelo de Intervención Psicoterapéutica En El Área de La Salud a Partir Del Enfoque Procesal Del Estrés. Vol 13. Universidad de los Andes.; 2006. Accessed June 23, 2020. http://www.scielo.org.co/scielo.php?script=sci_ arttext&pid=S0123-885X2004000200007&lng=en&nrm=iso&tlng=es
Jin Y, Potthoff A, Xu J, et al. Evaluation of Mental Status HIV-Infected Patients: Implications for Treatment. Current HIV Research. 2012;10(6):546-551. doi:10.2174/157016212802429857
Balfour L, Kowal J, Silverman A, et al. A randomized controlled psycho-education intervention trial: Improving psychological readiness for successful HIV medication adherence and reducing depression before initiating HAART. AIDS Care - Psychological and Socio-Medical Aspects of AIDS/HIV. 2006;18(7):830-838. doi:10.1080/09540120500466820
Hill S, Kavookjian J. Motivational interviewing as a behavioral intervention to increase HAART adherence in patients who are HIV-positive: A systematic review of the literature. AIDS Care - Psychological and Socio-Medical Aspects of AIDS/HIV. 2012;24(5):583-592. doi:10.1080/095401 2011.630354
Hollon SD, DeRubeis RJ, Shelton RC, et al. Prevention of relapse following cognitive therapy vs medications in moderate to severe depression. Archives of General Psychiatry. 2005;62(4):417- doi:10.1001/archpsyc.62.4.417
Parikh S v., Segal Z v., Grigoriadis S, et al. Canadian Network for Mood and Anxiety Treatments (CANMAT) Clinical guidelines for the management of major depressive disorder in adults. II. Psychotherapy alone or in combination with antidepressant medication. Journal of Affective 2009;117(SUPPL. 1). doi:10.1016/j.jad.2009.06.042
Spies G, Asmal L, Seedat S. Cognitive-behavioural interventions for mood and anxiety disorders in HIV: A systematic review. Journal of Affective Disorders. 2013;150(2):171-180. doi:10.1016/j. 2013.04.018
Brown JL, Vanable PA. Cognitive-behavioral stress management interventions for persons living with HIV: A review and critique of the Annals of Behavioral Medicine. 2008;35(1):26-40. doi:10.1007/s12160-007-9010-y
Markowitz JC, Kocsis JH, Fishman B, et al. Treatment of depressive symptoms in human immunodeficiency virus- positive patients. Archives of General Psychiatry. 1998;55(5):452-457. doi:10.1001/archpsyc.55.5.452
Markowitz J, Spielman L, Sullivan M, Fishman An Exploratory Study of Ethnicity and Psychotherapy Outcome Among HIV-Positive Patients With Depressive Symptoms. The Journal of psychotherapy practice and research. 2000;9:226-231.
Gayner B, Esplen MJ, de Roche P, et A randomized controlled trial of mindfulness-based stress reduction to manage affective symptoms and improve quality of life in gay men living with HIV. Journal of Behavioral Medicine. 2012;35(3):272-285. doi:10.1007/s10865-011-9350-8
Creswell JD, Myers HF, Cole SW, Irwin MR. Mindfulness meditation training effects on CD4+ T lymphocytes in HIV-1 infected adults: A small randomized controlled trial. Brain, Behavior, and 2009;23(2):184-188. doi:10.1016/j.bbi.2008.07.004
Seyedalinaghi S, Jam S, Foroughi M, et al. Randomized controlled trial of mindfulness-based stress reduction delivered to human immunodeficiency virus-positive patients in Iran: Effects on CD4 + T lymphocyte count and medical and psychological symptoms. Psychosomatic Medicine. 2012;74(6):620-627. doi:10.1097/PSY.0b013e31825abfaa
Gonzalez-Garcia M, Ferrer MJ, Borras X, et al. Effectiveness of mindfulness-based cognitive therapy on the quality of life, emotional status, and CD4 cell count of patients aging with HIV AIDS and Behavior. 2014;18(4):676-685. doi:10.1007/s10461-013-0612-z
World Health Risks to Mental Health : An Overview of Vulnerabilities and Risk
Vreeman RC, McCoy BM, Lee S. Mental health challenges among adolescents living with HIV. Journal of the International AIDS 2017;20(Suppl 3). doi:10.7448/IAS.20.4.21497
Donenberg GR, Pao Youths and HIV/AIDS: Psychiatry’s role in a changing epidemic. Journal of the American Academy of Child and Adolescent Psychiatry. 2005;44(8):728-747. doi:10.1097/01. chi.0000166381.68392.02
González-Scarano F, Martín-García The neuropathogenesis of AIDS. Nature Reviews Immunology. 2005;5(1):69-81. doi:10.1038/nri1527
Marhefka SL, Lyon M, Koenig LJ, et Emotional and behavioral problems and mental health service utilization of youth living with HIV acquired perinatally or later in life. AIDS Care - Psychological and Socio-Medical Aspects of AIDS/HIV. 2009;21(11):1447-1454. doi:10.1080/09540120902883085
García-Navarro C, García I, Medín G, et Aspectos psicosociales en una cohorte de adolescentes con infección por el virus de la inmunodeficiencia humana por transmisión vertical. NeuroCoRISpeS. Enfermedades Infecciosas y Microbiologia Clinica. 2014;32(10):631-637. doi:10.1016/j.eimc.2013.11.008
Mellins CA, Brackis-Cott E, Leu CS, et al. Rates and types of psychiatric disorders in perinatally human immunodeficiency virus-infected youth and Journal of Child Psychology and Psychiatry and Allied Disciplines. 2009;50(9):1131-1138. doi:10.1111/j.1469-7610.2009.02069.x
Mellins CA, Malee Understanding the mental health of youth living with perinatal HIV infection: Lessons learned and current challenges. Journal of the International AIDS Society. 2013;16(1). doi:10.7448/IAS.16.1.18593
le Prevost M, Arenas-Pinto A, Melvin D, et al. Anxiety and depression symptoms in young people with perinatally acquired HIV and HIV affected young people in AIDS Care - Psychological and Socio-Medical Aspects of AIDS/HIV. 2018;30(8):1040-1049. doi:10.1080/09540121.2018.144 1972
Kapetanovic S, Wiegand RE, Dominguez K, et Associations of medically documented psychiatric diagnoses and risky health behaviors in highly active antiretroviral therapy-experienced perinatally HIV-infected youth. AIDS Patient Care and STDs. 2011;25(8):493-501. doi:10.1089/apc.2011.0107
Woods SP, Moore DJ, Weber E, Grant I. Cognitive neuropsychology of HIV-associated neurocognitive Neuropsychology Review. 2009;19(2):152-168. doi:10.1007/s11065-009- 9102-5
van den Hof M, ter Haar AM, Scherpbier HJ, et al. Neurocognitive Development in Perinatally Human Immunodeficiency Virus–infected Adolescents on Long-term Treatment, Compared to Healthy Matched Controls: A Longitudinal Study. Clinical Infectious Diseases. 2020;32:21-29. doi:10.1093/cid/ciz386
Robbins RN, Zimmerman R, Korich R, et al. Longitudinal trajectories of neurocognitive test performance among individuals with perinatal HIV-infection and -exposure: adolescence through young adulthood. AIDS Care - Psychological and Socio-Medical Aspects of AIDS/HIV. 2020;32(1):21-29. doi:10.1080/09540121.2019.1626343
Williams PL, Storm D, Montepiedra G, et al. Predictors of adherence to antiretroviral medications in children and adolescents with HIV infection. Pediatrics. 2006;118(6). doi:10.1542/peds.2006- 0493
Murphy DA, Wilson CM, Durako SJ, Muenz LR, Belzer M. Antiretroviral medication adherence among the REACH HIV-infected adolescent cohort in the USA. AIDS Care - Psychological and Socio-Medical Aspects of AIDS/HIV. 2001;13(1):27-40. doi:10.1080/09540120020018161
Kang E, Delzell DAP, Chhabra M, Oberdorfer Factors associated with high rates of antiretroviral medication adherence among youth living with perinatal HIV in Thailand. International Journal of STD and AIDS. 2015;26(8):534-541. doi:10.1177/0956462414545524
Capilla M, Montes M, Gómez M, Barrio V. Primera adaptación del CDI-S a población española. Acción psicológica, ISSN 1578-908X, Vol 1, No 3, 2002, pags 263-272. 2002;1.
Masip A, Amador-Campos J, Cebollero M. Características psicométricas de la Reynolds Adolescent Depression Scale en población comunitaria y clínica. International Journal of Clinical and Health 2008;8.
Herrero MJ, Blanch J, Peri JM, de Pablo J, Pintor L, Bulbena A. A validation study of the hospital anxiety and depression scale (HADS) in a Spanish population. General Hospital Psychiatry. 2003;25(4):277-283. doi:10.1016/S0163-8343(03)00043-4
Richardson LP, Rockhill C, Russo JE, et Evaluation of the PHQ-2 as a brief screen for detecting major depression among adolescents. Pediatrics. 2010;125(5). doi:10.1542/peds.2009-2712
Berger BE, Ferrans CE, Lashley Measuring stigma in people with HIV: Psychometric assessment of the HIV stigma scale. Research in Nursing and Health. 2001;24(6):518-529. doi:10.1002/nur.10011
Bussing R, Fernandez M, Harwood M, et al. Parent and teacher SNAP-IV ratings of attention deficit hyperactivity disorder symptoms: Psychometric properties and normative ratings from a school district Assessment. 2008;15(3):317-328. doi:10.1177/1073191107313888
Duncan L, Georgiades K, Wang L, et al. Psychometric evaluation of the Mini International Neuropsychiatric Interview for Children and Adolescents (MINI-KID). Psychological Assessment. 2018;30(7):916-928. doi:10.1037/pas0000541
Malhotra S, Padhy SK. Challenges in Providing Child and Adolescent Psychiatric Services in Low Resource Countries. Child and Adolescent Psychiatric Clinics of North America. 2015;24(4):777- doi:10.1016/j.chc.2015.06.007
Philbin MM, Tanner AE, Chambers BD, et Transitioning HIV-infected adolescents to adult care
Skeen SA, Sherr L, Croome N, et al. Interventions to improve psychosocial well-being for children affected by HIV and AIDS: a systematic review. Vulnerable Children and Youth Studies. 2017;12(2):91-116. doi:10.1080/17450128.2016.1276656
McKay MM, Chasse KT, Paikoff R, et al. Family-level impact of the CHAMP family program: A community collaborative effort to support urban families and reduce youth HIV risk exposure. Family 2004;43(1):79-93. doi:10.1111/j.1545-5300.2004.04301007.x
Brown LK, Kennard BD, Emslie GJ, et al. Effective Treatment of Depressive Disorders in Medical Clinics for Adolescents and Young Adults Living with HIV: A Controlled Trial. Journal of Acquired Immune Deficiency 2016;71(1):38-46. doi:10.1097/QAI.0000000000000803
Kennard BD, Brown LT, Hawkins L, et Development and implementation of health and wellness CBT for individuals with depression and HIV. Cognitive and Behavioral Practice. 2014;21(2):237- 246. doi:10.1016/j.cbpra.2013.07.003
Bhana A, McKay MM, Mellins C, Petersen I, Bell C. Family-based HIV prevention and intervention services for youth living in poverty-affected contexts: The CHAMP model of collaborative, evidence- informed programme Journal of the International AIDS Society. 2010;13(SUPPL. 2). doi:10.1186/1758-2652-13-S2-S8
Belfer ML. Critical review of world policies for mental healthcare for children and adolescents. Current Opinion in 2007;20(4):349-352. doi:10.1097/YCO.0b013e3281bc0cf4
Transitioning HIV-infected youth into adult health Pediatrics. 2013;132(1):192-197. doi:10.1542/ peds.2013-1073
Valcour V, Chalermchai T, Sailasuta N, et Central Nervous System Viral Invasion and
doi:10.1093/infdis/jis326
Gras G, Kaul M. Molecular mechanisms of neuroinvasion by monocytes-macrophages in HIV-1 Retrovirology. 2010;7. doi:10.1186/1742-4690-7-30
Vitkovic L, Tardieu M. Neuropathogenesis of HIV-1 infection. Outstanding questions. Comptes Rendus de l’Academie des Sciences - Serie III. 1998;321(12):1015-1021. doi:10.1016/S0764- 4469(99)80057-2
Saylor D, Dickens AM, Sacktor N, et al. HIV-associated neurocognitive disorder - Pathogenesis and prospects for treatment. Nature Reviews Neurology. 2016;12(4):234-248. doi:10.1038/ 2016.27
Lindl KA, Marks DR, Kolson DL, Jordan-Sciutto KL. HIV-associated neurocognitive disorder: Pathogenesis and therapeutic Journal of Neuroimmune Pharmacology.
Vago L, Bonetto S, Nebuloni M, et al. Pathological findings in the central nervous system of AIDS patients on assumed antiretroviral therapeutic regimens: Retrospective study of 1597 autopsies. 2002;16(14):1925-1928. doi:10.1097/00002030-200209270-00009
Fois AF, Brew The Potential of the CNS as a Reservoir for HIV-1 Infection: Implications for HIV Eradication. Current HIV/AIDS Reports. 2015;12(2):299-303. doi:10.1007/s11904-015-0257-9
Canestri A, Lescure F, Jaureguiberry S, et al. Discordance Between Cerebral Spinal Fluid and Plasma HIV Replication in Patients with Neurological Symptoms Who Are Receiving Suppressive Antiretroviral Clinical Infectious Diseases. 2010;50(5):773-778. doi:10.1086/650538
Churchill MJ, Gorry PR, Cowley D, et al. Use of laser capture microdissection to detect integrated HIV-1 DNA in macrophages and astrocytes from autopsy brain tissues. Journal of NeuroVirology. 2006;12(2):146-152. doi:10.1080/13550280600748946
Cassol E, Misra V, Dutta A, Morgello S, Gabuzda D. Cerebrospinal fluid metabolomics reveals altered waste clearance and accelerated aging in HIV patients with neurocognitive impairment. 2014;28(11):1579-1591. doi:10.1097/QAD.0000000000000303
Ancuta P, Kamat A, Kunstman KJ, et al. Microbial translocation is associated with increased monocyte activation and dementia in AIDS patients. PLoS ONE. 2008;3(6). doi:10.1371/journal. 0002516
Fauci AS, Marston Ending the HIV-AIDS pandemic - Follow the science. New England Journal of Medicine. 2015;373(23):2197-2199. doi:10.1056/NEJMp1502020
Etherton MR, Lyons JL, Ard KL. HIV-associated Neurocognitive Disorders and Antiretroviral Therapy: Current Concepts and Controversies. Current Infectious Disease Reports. 2015;17(6). doi:10.1007/s11908-015-0485-6
Robertson K, Liner J, Meeker RB. Antiretroviral neurotoxicity. Journal of NeuroVirology. 2012;18(5):388-399. doi:10.1007/s13365-012-0120-3
Rojas-Celis V, Valiente-Echeverría F, Soto-Rifo R, Toro-Ascuy D. New Challenges of HIV-1 Infection: How HIV-1 Attacks and Resides in the Central Nervous Cells. 2019;8(10):1245. doi:10.3390/cells8101245
Antinori A, Arendt G, Becker JT, et Updated research nosology for HIV-associated neurocognitive disorders. Neurology. 2007;69(18):1789-1799. doi:10.1212/01.WNL.0000287431.88658.8b
Robertson KR, Smurzynski M, Parsons TD, et al. The prevalence and incidence of neurocognitive impairment in the HAART AIDS. 2007;21(14):1915-1921. doi:10.1097/QAD.0b013e32828e4e27
Pérez-Valero I, González-Baeza A, Estébanez M, et al. Neurocognitive Impairment in Patients Treated with Protease Inhibitor Monotherapy or Triple Drug Antiretroviral Therapy. PLoS ONE. 2013;8(7). doi:10.1371/journal.pone.0069493
Portilla I, Reus S, León R, et al. Neurocognitive Impairment in Well-Controlled HIV-Infected Patients: A Cross-Sectional AIDS Research and Human Retroviruses. 2019;35(7):634- 641. doi:10.1089/aid.2018.0279
Muñoz-Moreno JA, Pérez-Álvarez N, Muñoz-Murillo A, et Classification models for neurocognitive impairment in HIV infection based on demographic and clinical variables. PLoS ONE. 2014;9(9). doi:10.1371/journal.pone.0107625
CASADO JL, BAYÓN C, PÉREZ VALERO I, et Estudio transversal para evaluar y analizar la prevalencia de detección positiva de síntomas de ansiedad, depresión y deterioro neurocognitivo en pacientes infectados por el VIH-1: estudio CRANIum. Subanálisis por sexos de la población española. SIDA STUDI. Enfermedades Infecciosas y Microbiología Clínica. 2012;30:26-27. Accessed June 23, 2020. http://www.sidastudi.org/es/registro/ff8081813b4c32e8013bff80010100d6
Heaton RK, Franklin DR, Deutsch R, et al. Neurocognitive Change in the Era of HIV Combination Antiretroviral Therapy: The Longitudinal CHARTER Clinical Infectious Diseases. 2015;60(3):473-480. doi:10.1093/cid/ciu862
Pérez-Valero I, González-Baeza A, Estébanez M, et A prospective cohort study of neurocognitive function in aviremic HIV-infected patients treated with 1 or 3 antiretrovirals. Clinical infectious diseases : an official publication of the Infectious Diseases Society of America. 2014;59(11):1627- 1634. doi:10.1093/cid/ciu640
Langford D, Grigorian A, Hurford R, Adame A, Crews L, Masliah E. The role of mitochondrial alterations in the combined toxic effects of human immunodeficiency virus Tat protein and methamphetamine on calbindin positive-neurons. Journal of NeuroVirology. 2004;10(6):327-337. doi:10.1080/13550280490520961
Gandhi N, Saiyed ZM, Napuri J, et al. Interactive role of human immunodeficiency virus type 1 (HIV-1) clade-specific Tat protein and cocaine in blood-brain barrier dysfunction: Implications for HIV-1associated neurocognitive Journal of NeuroVirology. 2010;16(4):295-306. doi:10.3 109/13550284.2010.499891
Chen W, Tang Z, Fortina P, et al. Ethanol potentiates HIV-1 gp120-induced apoptosis in human neurons via both the death receptor and NMDA receptor Virology. 2005;334(1):59-73. doi:10.1016/j.virol.2005.01.014
Gaskill PJ, Calderon TM, Luers AJ, Eugenin EA, Javitch JA, Berman JW. Human immunodeficiency virus (HIV) infection of human macrophages is increased by dopamine: A bridge between HIV- associated neurologic disorders and drug American Journal of Pathology. 2009;175(3):1148- 1159. doi:10.2353/ajpath.2009.081067
Purohit V, Rapaka R, Shurtleff D. Drugs of abuse, dopamine, and HIV-associated neurocognitive disorders/HIV-associated dementia. Molecular Neurobiology. 2011;44(1):102-110. doi:10.1007/ s12035-011-8195-z
Aronow HA, Weston AJ, Pezeshki BB, Lazarus TS. Effects of coinfection with HIV and hepatitis C virus on the nervous The AIDS reader. 2008;18(1):43-48. http://europepmc.org/abstract/ MED/18240452
Morgello S, Estanislao L, Ryan E, et al. Effects of hepatic function and hepatitis C virus on the nervous system assessment of advanced-stage HIV-infected individuals. AIDS. 2005;19(SUPPL. 3). doi:10.1097/01.aids.0000192079.49185.f9
Cherner M, Letendre S, Heaton RK, et Hepatitis C augments cognitive deficits associated with HIV infection and methamphetamine. Neurology. 2005;64(8):1343-1347. doi:10.1212/01. WNL.0000158328.26897.0D
McCutchan JA, Marquie-Beck JA, FitzSimons CA, et al. Role of obesity, metabolic variables, and diabetes in HIV-associated neurocognitive Neurology. 2012;78(7):485-492. doi:10.1212/ WNL.0b013e3182478d64
Valcour VG, Sacktor NC, Paul RH, et al. Insulin resistance is associated with cognition among HIV-1-infected patients: The Hawaii aging with HIV Journal of Acquired Immune Deficiency Syndromes. 2006;43(4):405-410. doi:10.1097/01.qai.0000243119.67529.f5
Wright EJ, Grund B, Robertson K, et al. Cardiovascular risk factors associated with lower baseline cognitive performance in HIV-positive persons. Neurology. 2010;75(10):864-873. doi:10.1212/ 0b013e3181f11bd8
Livelli A, Vaida F, Ellis RJ, et al. Correlates of HIV RNA concentrations in cerebrospinal fluid during antiretroviral therapy: a longitudinal cohort study. The Lancet HIV. 2019;6(7):e456-e462. doi:10.1016/S2352-3018(19)30143-2
Ellis RJ, Badiee J, Vaida F, et CD4 nadir is a predictor of HIV neurocognitive impairment in the era of combination antiretroviral therapy. AIDS. 2011;25(14):1747-1751. doi:10.1097/ QAD.0b013e32834a40cd
Airoldi M, Bandera A, Trabattoni D, et al. Neurocognitive Impairment in HIV-Infected Naïve Patients with Advanced Disease: The Role of Virus and Intrathecal Immune Activation. Clinical & developmental 2012;2012:467154. doi:10.1155/2012/467154
Antinori A, Arendt G, Becker JT, et Updated research nosology for HIV-associated neurocognitive disorders. Neurology. 2007;69(18):1789-1799. doi:10.1212/01.WNL.0000287431.88658.8b
Watkins CC, Treisman GJ. Cognitive impairment in patients with Aids – Prevalence and severity. HIV/AIDS - Research and Palliative 2015;7:35-47. doi:10.2147/HIV.S39665
Heaton RK, Clifford DB, Franklin DR, et al. HIV-associated neurocognitive disorders persist in the era of potent antiretroviral therapy: Charter Study. Neurology. 2010;75(23):2087-2096. doi:10.1212/ 0b013e318200d727
Heaton RK, Franklin DR, Deutsch R, et al. Neurocognitive Change in the Era of HIV Combination Antiretroviral Therapy: The Longitudinal CHARTER Clinical Infectious Diseases. 2015;60(3):473-480. doi:10.1093/cid/ciu862
Cysique LA, Brew Comorbid depression and apathy in HIV-associated neurocognitive disorders in the era of chronic HIV infection. In: Handbook of Clinical Neurology. Vol 165. Elsevier B.V.; 2019:71-82. doi:10.1016/B978-0-444-64012-3.00006-X
Janssen RS, Cornblath DR, Epstein LG, et al. Nomenclature and research case definitions for neurologic manifestations of human immunodeficiency virus-type 1 (HIV-1) infection. Neurology. 1991;41(6):778-785. doi:10.1212/wnl.41.6.778
Antinori A, Arendt G, Grant I, et al. Assessment, Diagnosis, and Treatment of HIV-Associated Neurocognitive Disorder: A Consensus Report of the Mind Exchange Program. Clinical Infectious 2013;56. doi:10.1093/cid/cis975
Gisslén M, Price RW, Nilsson The definition of HIV-associated neurocognitive disorders: Are we overestimating the real prevalence? BMC Infectious Diseases. 2011;11. doi:10.1186/1471-2334- 11-356
Meyer ACL, John Boscardin W, Kwasa JK, Price RW. Is it time to rethink how neuropsychological tests are used to diagnose mild forms of HIV-associated neurocognitive disorders? Impact of false-positive rates on prevalence and Neuroepidemiology. 2013;41(3-4):208-216. doi:10.1159/000354629
Underwood J, de Francesco D, Leech R, Sabin CA, Winston Medicalising normality? Using a simulated dataset to assess the performance of different diagnostic criteria of HIV-associated cognitive impairment. PLoS ONE. 2018;13(4). doi:10.1371/journal.pone.0194760
Huizenga HM, Smeding H, Grasman RPPP, Schmand B. Multivariate normative comparisons. 2007;45(11):2534-2542. doi:10.1016/j.neuropsychologia.2007.03.011
Blackstone K, Moore DJ, Franklin DR, et al. Defining neurocognitive impairment in HIV: Deficit scores versus clinical ratings. Clinical Neuropsychologist. 2012;26(6):894-908. doi:10.1080/1385 2012.694479
Grant I, Franklin DR, Deutsch R, et al. Asymptomatic HIV-associated neurocognitive impairment increases risk for symptomatic Neurology. 2014;82(23):2055-2062. doi:10.1212/ WNL.0000000000000492
Zipursky AR, Gogolishvili D, Rueda S, et al. Evaluation of brief screening tools for neurocognitive impairment in HIV/AIDS: A systematic review of the literature. AIDS. 2013;27(15):2385-2401. doi:10.1097/QAD.0b013e328363bf56
López E, Steiner AJ, Smith K, et Diagnostic utility of the HIV dementia scale and the international HIV dementia scale in screening for HIV-associated neurocognitive disorders among Spanish- speaking adults. Applied Neuropsychology:Adult. 2017;24(6):512-521. doi:10.1080/23279095.20 16.1214835
Prats A, López-Masramon E, Pérez-Álvarez N, et al. NEU Screen Shows High Accuracy in Detecting Cognitive Impairment in Older Persons Living With HIV. The Journal of the Association of Nurses in AIDS Care : 2019;30(1):35-41. doi:10.1097/JNC.0000000000000003
Cherner M, Masliah E, Ellis RJ, et Neurocognitive dysfunction predicts postmortem findings of
Moore DJ, Masliah E, Rippeth JD, et Cortical and subcortical neurodegeneration is associated with HIV neurocognitive impairment. AIDS. 2006;20(6):879-887. doi:10.1097/01. aids.0000218552.69834.00
Cysique LA, Casaletto KB, Heaton Reliably Measuring Cognitive Change in the Era of Chronic HIV Infection and Chronic HIV-Associated Neurocognitive Disorders. In: Current Topics in Behavioral Neurosciences. Curr Top Behav Neurosci; 2019. doi:10.1007/7854_2019_116
Folstein MF, Folstein SE, McHugh PR. “Mini-mental state”. A practical method for grading the cognitive state of patients for the clinician. Journal of Psychiatric Research. 1975;12(3):189-198. doi:10.1016/0022-3956(75)90026-6
Ganesan A, Crum-Cianflone N, Higgins J, et al. High Dose Atorvastatin Decreases Cellular Markers of Immune Activation Without Affecting HIV-1 RNA Levels: Results of a Double-blind Randomized Placebo Controlled Clinical Trial. The Journal of infectious diseases. 2011;203:756- doi:10.1093/infdis/jiq115
Blackstone K, Moore DJ, Heaton RK, et Diagnosing symptomatic HIV-associated neurocognitive disorders: Self-report versus performance-based assessment of everyday functioning. Journal of the International Neuropsychological Society. 2012;18(1):79-88. doi:10.1017/S135561771100141X
Sevigny JJ, Albert SM, McDermott MP, et al. Evaluation of HIV RNA and markers of immune activation as predictors of HIV-associated Neurology. 2004;63(11):2084-2090. doi:10.1212/01.WNL.0000145763.68284.15
Vernazza P, Daneel S, Schiffer V, et al. The role of compartment penetration in PI-Monotherapy: The Atazanavir-Ritonavir Monomaintenance (ATARITMO) Trial. AIDS. 2007;21(10):1309-1315. doi:10.1097/QAD.0b013e32814e6b1c
Best BM, Letendre SL, Koopmans P, et Low cerebrospinal fluid concentrations of the nucleotide HIV reverse transcriptase inhibitor, Tenofovir. Journal of Acquired Immune Deficiency Syndromes. 2012;59(4):376-381. doi:10.1097/QAI.0b013e318247ec54
Bumpus S, Qing MA, Best Antiretroviral Concentrations in Brain Tissue Are Similar to or Exceed Those in CSF. - CROI Conference. Conference on Retroviruses ans Oppotunistic Infections (CROI) . Published 2015. Accessed June 24, 2020. https://www.croiconference.org/abstract/ antiretroviral-concentrations-brain-tissue-are-similar-or-exceed-those-csf/
Letendre S, Marquie-Beck J, Capparelli E, et al. Validation of the CNS penetration-effectiveness rank for quantifying antiretroviral penetration into the central nervous system. Archives of 2008;65(1):65-70. doi:10.1001/archneurol.2007.31
Letendre S, Ellis R, Everall I, Ances B, Bharti A, Mccutchan Neurologic Complications of HIV
Santos G, Locatelli I, Metral M, et Cross-Sectional and Cumulative Longitudinal Central Nervous System Penetration Effectiveness Scores Are Not Associated With Neurocognitive Impairment in a Well Treated Aging Human Immunodeficiency Virus-Positive Population in Switzerland. Open forum infectious diseases. 2019;6:ofz277. doi:10.1093/ofid/ofz277
Letendre S, FitzSimons C, Ellis R, Clifford D, Collier A, Gelman Correlates of CSF Viral Loads in 1,221 volunteers of the CHARTER cohort. CROI Conference. 17th Conference on Retroviruses ans Oppotunistic Infections (CROI) . Published 2010. Accessed June 24, 2020. https://charternntc. org/content/correlates-csf-viral-loads-1221-volunteers-charter-cohort
Perez-Valero I, Ellis R, Heaton R, et al. Cerebrospinal fluid viral escape in aviremic HIV-infected patients receiving antiretroviral therapy: Prevalence, risk factors and neurocognitive AIDS. 2019;33(3):475-481. doi:10.1097/QAD.0000000000002074
Ellis RJ, Letendre S, Vaida F, et al. Randomized Trial of Central Nervous System–Targeted Antiretrovirals for HIV-Associated Neurocognitive Clinical Infectious Diseases. 2014;58(7):1015-1022. doi:10.1093/cid/cit921
Tozzi V, Balestra P, Salvatori MF, et al. Changes in cognition during antiretroviral therapy: Comparison of 2 different ranking systems to measure antiretroviral drug efficacy on HIV-associated neurocognitive disorders. Journal of Acquired Immune Deficiency Syndromes. 2009;52(1):56-63. doi:10.1097/QAI.0b013e3181af83d6
Smurzynski M, Wu K, Letendre S, et Effects of central nervous system antiretroviral penetration on cognitive functioning in the ALLRT cohort. AIDS. 2011;25(3):357-365. doi:10.1097/ QAD.0b013e32834171f8
Cysique LA, Vaida F, Letendre S, et Dynamics of cognitive change in impaired HIV-
Marra CM, Zhao Y, Clifford DB, et Impact of combination antiretroviral therapy on cerebrospinal fluid HIV RNA and neurocognitive performance. AIDS. 2009;23(11):1359-1366. doi:10.1097/ QAD.0b013e32832c4152
Robertson KR, Su Z, Margolis DM, et Neurocognitive effects of treatment interruption in stable HIV-positive patients in an observational cohort. Neurology. 2010;74(16):1260-1266. doi:10.1212/ WNL.0b013e3181d9ed09
Simioni S, Cavassini M, Annoni JM, et Rivastigmine for HIV-associated neurocognitive disorders: A randomized crossover pilot study. Neurology. 2013;80(6):553-560. doi:10.1212/ WNL.0b013e3182815497
Muñoz-Moreno JA, Prats A, Moltó J, et al. Transdermal rivastigmine for HIV-associated cognitive impairment: A randomized pilot PLoS ONE. 2017;12(8). doi:10.1371/journal.pone.0182547
Sacktor N, Miyahara S, Deng L, et al. Minocycline treatment for HIV-associated cognitive impairment: results from a randomized trial. Neurology. 2011;77(12):1135-1142. doi:10.1212/ 0b013e31822f0412
Zhao Y, Navia BA, Marra CM, et al. Memantine for AIDS dementia complex: Open-label report of actg HIV Clinical Trials. 2010;11(1):59-67. doi:10.1310/hct1101-59
Schifitto G, Navia BA, Yiannoutsos CT, et Memantine and HIV-associated cognitive impairment: A neuropsychological and proton magnetic resonance spectroscopy study. AIDS. 2007;21(14):1877- 1886. doi:10.1097/QAD.0b013e32813384e8
Schifitto G, Zhang J, Evans SR, et al. A multicenter trial of selegiline transdermal system for HIV-associated cognitive Neurology. 2007;69(13):1314-1321. doi:10.1212/01. wnl.0000268487.78753.0f
Evans SR, Yeh TM, Sacktor N, et al. Selegiline Transdermal System (STS) for HIV-associated cognitive impairment: Open-label report of ACTG 5090. HIV Clinical Trials. 2007;8(6):437-446. doi:10.1310/hct0806-437
Letendre SL, Woods SP, Ellis RJ, et Lithium improves HIV-associated neurocognitive impairment. AIDS. 2006;20(14):1885-1888. doi:10.1097/01.aids.0000244208.49123.1b
Schifitto G, Zhong J, Gill D, et al. Lithium therapy for human immunodeficiency virus type 1-associated neurocognitive Journal of NeuroVirology. 2009;15(2):176-186. doi:10.1080/13550280902758973
Schifitto G, Peterson DR, Zhong J, et al. Valproic acid adjunctive therapy for HIV-associated cognitive impairment: A first Neurology. 2006;66(6):919-921. doi:10.1212/01. wnl.0000204294.28189.03
Digicaylioglu M, Kaul M, Fletcher L, Dowen R, Lipton Erythropoietin protects
Kang YJ, Digicaylioglu M, Russo R, et al. Erythropoietin plus insulin-like growth factor-I protects against neuronal damage in a murine model of human immunodeficiency virus-associated neurocognitive Annals of Neurology. 2010;68(3):342-352. doi:10.1002/ana.22070
Schifitto G, Sacktor N, Marder K, et Randomized trial of the platelet-activating factor antagonist lexipafant in HIV-associated cognitive impairment. Neurology. 1999;53(2):391-396. doi:10.1212/ wnl.53.2.391
Clifford DB, McArthur JC, Schifitto G, et al. A randomized clinical trial of CPI-1189 for HIV- associated cognitive-motor Neurology. 2002;59(10):1568-1573. doi:10.1212/01. WNL.0000034177.47015.DA
Navia BA, Dafni U, Simpson D, et al. A phase I/II trial of nimodipine for HIV-related neurologic Neurology. 1998;51(1):221-228. doi:10.1212/WNL.51.1.221
Letendre SL, Marquie-Beck J, Ellis RJ, et al. The role of cohort studies in drug development: Clinical evidence of antiviral activity of serotonin reuptake inhibitors and HMG-CoA reductase inhibitors in the central nervous system. Journal of Neuroimmune Pharmacology. 2007;2(1):120- doi:10.1007/s11481-006-9054-y
Heseltine PNR, Goodkin K, Atkinson JH, et Randomized double-blind placebo-controlled trial of peptide T for HIV- associated cognitive impairment. Archives of Neurology. 1998;55(1):41-51. doi:10.1001/archneur.55.1.41
Kleim JA, Jones TA. Principles of Experience-Dependent Neural Plasticity: Implications for Rehabilitation After Brain Damage. Journal of speech, language, and hearing research : JSLHR. 2008;51(1). doi:10.1044/1092-4388(2008/018)
Plassman BL, Williams JW, Burke JR, Holsinger T, Benjamin S. Systematic review: Factors associated with risk for and possible prevention of cognitive decline in later life. In: Annals of Internal Medicine. Vol 153. American College of Physicians; 2010:182-193. doi:10.7326/0003- 4819-153-3-201008030-00258
Chow FC, Lyass A, Mahoney TF, et Baseline 10-Year Cardiovascular Risk Scores Predict Cognitive Function in Older Persons, and Particularly Women, Living With Human Immunodeficiency Virus Infection. Clinical Infectious Diseases. Published online January 3, 2020. doi:10.1093/cid/ciz1214
Tzourio C, Anderson C, Chapman N, et Effects of blood pressure lowering with perindopril and indapamide therapy on dementia and cognitive decline in patients with cerebrovascular disease. Archives of Internal Medicine. 2003;163(9):1069-1075. doi:10.1001/archinte.163.9.1069
McGuinness B, Todd S, Passmore P, Bullock Blood pressure lowering in patients without prior cerebrovascular disease for prevention of cognitive impairment and dementia. Cochrane Database of Systematic Reviews. 2009;2009(4). doi:10.1002/14651858.CD004034.pub3
Cox DJ, Kovatchev BP, Gonder-Frederick LA, et al. Relationships between hyperglycemia and cognitive performance among adults with type 1 and type 2 Diabetes Care. 2005;28(1):71- 77. doi:10.2337/diacare.28.1.71
McCutchan A, Marquie-Beck J, Letendre Contributions of metabolic syndrome to neurocognitive impairment. . Program and abstracts of the 16th Conference on Retroviruses and Opportunistic Infections. Published February 2009. Accessed June 26, 2020. https://www.thebodypro.com/ article/croi-2009-highlights-review-cardiovascular-disease-hiv
Kivipelto M, Helkala E-L, Laakso MP, et al. Apolipoprotein E ϵ4 Allele, Elevated Midlife Total Cholesterol Level, and High Midlife Systolic Blood Pressure Are Independent Risk Factors for Late-Life Alzheimer Disease. Annals of Internal Medicine. 2002;137(3):149. doi:10.7326/0003- 4819-137-3-200208060-00006
Letendre S. Central nervous system complications in HIV disease: HIV-associated neurocognitive Topics in antiviral medicine. 2011;19(4):137-142. https://Pubmed.ncbi.nlm.nih. gov/22156215
Yadav A, Betts MR, Collman Statin modulation of monocyte phenotype and function: implications for HIV-1-associated neurocognitive disorders. Journal of NeuroVirology. 2016;22(5):584-596. doi:10.1007/s13365-016-0433-8
Byrnes V, Miller A, Lowry D, et al. Effects of anti-viral therapy and HCV clearance on
Clifford DB, Vaida F, Kao YT, et Absence of neurocognitive effect of hepatitis C infection in HIV- coinfected people. Neurology. 2015;84(3):241-250. doi:10.1212/WNL.0000000000001156
Rubin LH, Maki HIV, Depression, and Cognitive Impairment in the Era of Effective Antiretroviral Therapy. Current HIV/AIDS Reports. 2019;16(1):82-95. doi:10.1007/s11904-019-00421-0
Vance DE, Eagerton G, Harnish B, McKie P, Fazeli PL. Cognitive prescriptions: A nursing approach to increasing cognitive reserve. Journal of Gerontological Nursing. 2011;37(4):22-31. doi:10.3928/00989134-20101202-03
Féart C, Samieri C, Barberger-Gateau P. Mediterranean diet and cognitive function in older Current Opinion in Clinical Nutrition and Metabolic Care. 2010;13(1):14-18. doi:10.1097/ MCO.0b013e3283331fe4
Scarmeas N, Stern Y, Mayeux R, Manly JJ, Schupf N, Luchsinger JA. Mediterranean diet and mild cognitive Archives of Neurology. 2009;66(2):216-225. doi:10.1001/archneurol.2008.536
Burckhardt M, Herke M, Wustmann T, Watzke S, Langer G, Fink Omega-3 fatty acids for the treatment of dementia. Cochrane Database of Systematic Reviews. 2016;2016(4). doi:10.1002/14651858.CD009002.pub3
Smith PJ, Blumenthal JA, Hoffman BM, et Aerobic exercise and neurocognitive performance: A meta-analytic review of randomized controlled trials. Psychosomatic Medicine. 2010;72(3):239- 252. doi:10.1097/PSY.0b013e3181d14633
Monroe AK, Zhang L, Jacobson L, et The association between physical activity and cognition in men with and without HIV infection. HIV Medicine. 2017;18. doi:10.1111/hiv.12490
Kåreholt I, Lennartsson C, Gatz M, Parker MG. Baseline leisure time activity and cognition more than two decades International Journal of Geriatric Psychiatry. 2011;26(1):65-74. doi:10.1002/ gps.2490
Stern C, Munn Z. Cognitive leisure activities and their role in preventing dementia: a systematic International journal of evidence-based healthcare. 2010;8(1):2-17. doi:10.1111/j.1744- 1609.2010.00150.x
Catz SL, Gore-Felton C, McClure JB. Psychological distress among minority and low-income women living with Behavioral Medicine. 2002;28(2):53-60. doi:10.1080/08964280209596398
Duncan LG, Moskowitz JT, Neilands TB, Dilworth SE, Hecht FM, Johnson MO. Mindfulness-based stress reduction for HIV treatment side effects: A randomized, wait-list controlled Journal of
Anstey KJ, von Sanden C, Salim A, O’Kearney R. Smoking as a Risk Factor for Dementia and Cognitive Decline: A Meta-Analysis of Prospective Studies. American Journal of Epidemiology. 2007;166(4):367-378. doi:10.1093/aje/kwm116
Harrison JD, Dochney JA, Blazekovic S, et al. The nature and consequences of cognitive deficits among tobacco smokers with HIV: a comparison to tobacco smokers without HIV. Journal of 2017;23(4):550-557. doi:10.1007/s13365-017-0526-z
Kim JW, Lee DY, Lee BC, et al. Alcohol and cognition in the elderly: A review. Psychiatry 2012;9(1):8-16. doi:10.4306/pi.2012.9.1.8
Martin-Thormeyer EM, Paul Drug abuse and hepatitis C infection as comorbid features of HIV associated neurocognitive disorder: Neurocognitive and neuroimaging features. Neuropsychology Review. 2009;19(2):215-231. doi:10.1007/s11065-009-9101-6
Nath A. Human immunodeficiency virus-associated neurocognitive disorder: Pathophysiology in relation to drug addiction. Annals of the New York Academy of Sciences. 2010;1187:122-128. doi:10.1111/j.1749-6632.2009.05277.x
Byrd DA, Fellows RP, Morgello S, et Neurocognitive impact of substance use in HIV infection. Journal of Acquired Immune Deficiency Syndromes. 2011;58(2):154-162. doi:10.1097/ QAI.0b013e318229ba41
Gaskill PJ, Calderon TM, Coley JS, Berman JW. Drug induced increases in CNS dopamine alter monocyte, macrophage and T cell functions: Implications for HAND. Journal of Neuroimmune 2013;8(3):621-642. doi:10.1007/s11481-013-9443-y
Neuropsychological Routledge; 2017. doi:10.4324/9781315629537
Cicerone KD, Langenbahn DM, Braden C, et al. Evidence-based cognitive rehabilitation: Updated review of the literature from 2003 through Archives of Physical Medicine and Rehabilitation. 2011;92(4):519-530. doi:10.1016/j.apmr.2010.11.015
Dickinson D, Tenhula W, Morris S, et al. A randomized, controlled trial of computer-assisted cognitive remediation for schizophrenia. American Journal of Psychiatry. 2010;167(2):170-180. doi:10.1176/appi.ajp.2009.09020264
Yu F, Rose KM, Burgenr SC, et Cognitive training for early-stage Alzheimer’s disease and dementia. Journal of Gerontological Nursing. 2009;35(3):23-29. doi:10.3928/00989134- 20090301-10
Martin M, Clare L, Altgassen AM, Cameron MH, Zehnder F. Cognition-based interventions for healthy older people and people with mild cognitive Cochrane Database of Systematic Reviews. 2011;(1). doi:10.1002/14651858.cd006220.pub2
Becker JT, Dew MA, Aizenstein HJ, et al. A pilot study of the effects of internet-based cognitive stimulation on neuropsychological function in HIV Disability and Rehabilitation.
Muñoz-Moreno JA, Fumaz CR, Ferrer MJ, et Benefits of a Cognitive Rehabilitation Program on Neurocognitive Impairment in HIV-Infected Patients. Preliminary Findings. Journal of the International Neuropsychological Society. 2007;13(1 Suplement 1:19).
Guideline for Alzheimer`s Disease . California workgroup on Guidelines for Alzheimer`s Disease Management. Published 2008. Accessed June 26, 2020. http://caalz.org/ guidelines.htm.
Cognitive disorders and HIV/AIDS: HIV-associated dementia and delirium. . New York (NY): New York State Department of Published September 12, 2007. Accessed June 25, 2020. http:// guideline.gov/content.aspx?id=12561.
Kritsilis M, Rizou S v., Koutsoudaki PN, Evangelou K, Gorgoulis VG, Papadopoulos D. Ageing, cellular senescence and neurodegenerative disease. International Journal of Molecular Sciences. 2018;19(10). doi:10.3390/ijms19102937
Isaev NK, Genrikhs EE, Oborina M v., Stelmashook E v. Accelerated aging and aging process in the Reviews in the Neurosciences. 2018;29(3):233-240. doi:10.1515/revneuro-2017-0051
Alzheimer’s Association 2019 Alzheimer’s disease facts and figures. Alzheimer’s &
Fields JA, Swinton MK, Soontornniyomkij B, Carson A, Achim Beta amyloid levels in cerebrospinal fluid of HIV-infected people vary by exposure to antiretroviral therapy. AIDS (London, England). 2020;34(7):1001-1007. doi:10.1097/QAD.0000000000002506
Wendelken LA, Valcour V. Impact of HIV and aging on neuropsychological function. Journal of 2012;18(4):256-263. doi:10.1007/s13365-012-0094-1
Cohen J, Torres HIV-associated cellular senescence: A contributor to accelerated aging. Ageing Research Reviews. 2017;36:117-124. doi:10.1016/j.arr.2016.12.004
Arvanitakis Z, Shah RC, Bennett DA. Diagnosis and Management of Dementia: Review. JAMA - Journal of the American Medical 2019;322(16):1589-1599. doi:10.1001/jama.2019.4782
Xu J, Ikezu The comorbidity of HIV-associated neurocognitive disorders and alzheimer’s disease: A foreseeable medical challenge in post-HAART era. Journal of Neuroimmune Pharmacology. 2009;4(2):200-212. doi:10.1007/s11481-008-9136-0
Milanini B, Valcour V. Differentiating HIV-Associated Neurocognitive Disorders From Alzheimer’s Disease: an Emerging Issue in Geriatric NeuroHIV. Current HIV/AIDS Reports. 2017;14(4):123- doi:10.1007/s11904-017-0361-0
Kodidela S, Gerth K, Haque S, et Extracellular Vesicles: A Possible Link between HIV and Alzheimer’s Disease-Like Pathology in HIV Subjects? Cells. 2019;8(9):968. doi:10.3390/ cells8090968
Canet G, Dias C, Gabelle A, et al. HIV neuroinfection and Alzheimer’s disease: Similarities and potential links? Frontiers in Cellular 2018;12. doi:10.3389/fncel.2018.00307
McKhann GM, Knopman DS, Chertkow H, et al. The diagnosis of dementia due to Alzheimer’s disease: Recommendations from the National Institute on Aging-Alzheimer’s Association workgroups on diagnostic guidelines for Alzheimer’s Alzheimer’s and Dementia. 2011;7(3):263-269. doi:10.1016/j.jalz.2011.03.005
Pendlebury ST, Mariz J, Bull L, Mehta Z, Rothwell PM. MoCA, ACE-R, and MMSE versus the national institute of neurological disorders and stroke-canadian stroke network vascular cognitive impairment harmonization standards neuropsychological battery after TIA and stroke. Stroke. 2012;43(2):464-469. doi:10.1161/STROKEAHA.111.633586
Knopman DS, DeKosky ST, Cummings JL, et al. Practice parameter: Diagnosis of dementia (an evidence-based review): Report of the quality standards subcommittee of the american academy of Neurology. 2001;56(9):1143-1153. doi:10.1212/WNL.56.9.1143
Silverman DHS, Chen W, Czernin J, et Positron emission tomography in evaluation of dementia: Regional brain metabolism and long-term outcome. Journal of the American Medical Association. 2001;286(17):2120-2127. doi:10.1001/jama.286.17.2120
Birks J. Cholinesterase inhibitors for Alzheimer’s disease. Cochrane Database of Systematic 2006;(1). doi:10.1002/14651858.CD005593
Reisberg B, Doody R, Stöffler A, Schmitt F, Ferris S, Möbius Memantine in moderate-to-severe Alzheimer’s disease. New England Journal of Medicine. 2003;348(14):1333-1341. doi:10.1056/ NEJMoa013128
Dysken MW, Sano M, Asthana S, et Effect of vitamin E and memantine on functional decline in Alzheimer disease: The TEAM-AD VA cooperative randomized trial. JAMA - Journal of the American Medical Association. 2014;311(1):33-44. doi:10.1001/jama.2013.282834
Chen R, Chan PT, Chu H, et al. Treatment effects between monotherapy of Donepezil versus combination with memantine for Alzheimer disease: A meta-analysis. PLoS ONE. 2017;12(8). doi:10.1371/journal.pone.0183586
Livingston G, Kelly L, Lewis-Holmes E, et Non-pharmacological interventions for agitation in dementia: Systematic review of randomised controlled trials. British Journal of Psychiatry. 2014;205(6):436-442. doi:10.1192/bjp.bp.113.141119
Sink KM, Holden KF, Yaffe Pharmacological treatment of neuropsychiatric symptoms of dementia: A review of the evidence. Journal of the American Medical Association. 2005;293(5):596-608. doi:10.1001/jama.293.5.596
Reus VI, Fochtmann LJ, Eyler AE, et al. The American psychiatric association practice guideline on the use of antipsychotics to treat agitation or psychosis in patients with dementia. American Journal of 2016;173(5):543-546. doi:10.1176/appi.ajp.2015.173501
Borson S, Raskind MA. Clinical features and pharmacologic treatment of behavioral symptoms of Alzheimer’s Neurology. 1997;48(5 SUPPL. 6). doi:10.1212/wnl.48.5_suppl_6.17s
Lauque S, Arnaud-Battandier F, Gillette S, et al. Improvement of weight and fat-free mass with oral nutritional supplementation in patients with Alzheimer’s disease at risk of malnutrition: A prospective randomized Journal of the American Geriatrics Society. 2004;52(10):1702-1707. doi:10.1111/j.1532-5415.2004.52464.x
Forbes D, Forbes SC, Blake CM, Thiessen EJ, Forbes S. Exercise programs for people with Cochrane Database of Systematic Reviews. 2015;2015(4). doi:10.1002/14651858. CD006489.pub4
Snyder HM, Corriveau RA, Craft S, et al. Vascular contributions to cognitive impairment and dementia including Alzheimer’s Alzheimer’s and Dementia. 2015;11(6):710-717. doi:10.1016/j.jalz.2014.10.008
Skrobot OA, Black SE, Chen C, et Progress toward standardized diagnosis of vascular cognitive impairment: Guidelines from the Vascular Impairment of Cognition Classification Consensus Study. Alzheimer’s and Dementia. 2018;14(3):280-292. doi:10.1016/j.jalz.2017.09.007
Iadecola C, Duering M, Hachinski V, et al. Vascular Cognitive Impairment and Dementia: JACC Scientific Expert Panel. Journal of the American College of Cardiology. 2019;73(25):3326-3344. doi:10.1016/j.jacc.2019.04.034
Pendlebury ST, Rothwell PM. Incidence and prevalence of dementia associated with transient ischaemic attack and stroke: analysis of the population-based Oxford Vascular Study. The Lancet 2019;18(3):248-258. doi:10.1016/S1474-4422(18)30442-3
Diniz BS, Butters MA, Albert SM, Dew MA, Reynolds CF. Late-life depression and risk of vascular dementia and Alzheimer’s disease: Systematic review and meta-analysis of community-based cohort British Journal of Psychiatry. 2013;202(5):329-335. doi:10.1192/bjp.bp.112.118307
Schneider JA, Arvanitakis Z, Bang W, Bennett DA. Mixed brain pathologies account for most dementia cases in community-dwelling older Neurology. 2007;69(24):2197-2204. doi:10.1212/01.wnl.0000271090.28148.24
Valcour V, Rubin LH, Tien P, et Human immunodeficiency virus (HIV) modulates the associations between insulin resistance and cognition in the current combination antiretroviral therapy (cART) era: a study of the Women’s Interagency HIV Study (WIHS). Journal of NeuroVirology. 2015;21(4):415-421. doi:10.1007/s13365-015-0330-6
Sanford Ryan, Strain Jeremy, Dadar Mahsa, et al. Association of cerebral small vessel disease with the brain in HIV individuals CROI Conference. Conference on Retroviruses ans Oppotunistic Infections (CROI) . Published 2019. Accessed June 24, 2020. https://croiconference.org/ abstract/association-cerebral-small-vessel-disease-brain-hiv-individuals/
Chow FC, Makanjuola A, Wu K, et Physical Activity Is Associated With Lower Odds of Cognitive
Sattler FR, He J, Letendre S, et Abdominal obesity contributes to neurocognitive impairment in HIV-infected patients with increased inflammation and immune activation. Journal of Acquired Immune Deficiency Syndromes. 2015;68(3):281-288. doi:10.1097/QAI.0000000000000458
Rubin LH, Gustafson D, Hawkins KL, et al. Midlife adiposity predicts cognitive decline in the prospective Multicenter AIDS Cohort Study. Neurology. 2019;93(3):E261-E271. doi:10.1212/ 0000000000007779
Sachdev PS, Brodaty H, Valenzuela MJ, et The neuropsychological profile of vascular cognitive impairment in stroke and TIA patients. Neurology. 2004;62(6):912-919. doi:10.1212/01. WNL.0000115108.65264.4B
Hachinski VC, Iliff LD, Zilhka E, et al. Cerebral Blood Flow in Dementia. Archives of Neurology. 1975;32(9):632-637. doi:10.1001/archneur.1975.00490510088009
Wardlaw JM, Smith EE, Biessels GJ, et Neuroimaging standards for research into small vessel disease and its contribution to ageing and neurodegeneration. The Lancet Neurology. 2013;12(8):822-838. doi:10.1016/S1474-4422(13)70124-8
Gorelick PB, Scuteri A, Black SE, et Vascular contributions to cognitive impairment and dementia: A statement for healthcare professionals from the American Heart Association/American Stroke Association. Stroke. 2011;42(9):2672-2713. doi:10.1161/STR.0b013e3182299496
Forette F, Seux ML, Staessen JA, et al. Prevention of dementia in randomised double-blind placebo-controlled Systolic Hypertension in Europe (Syst-Eur) Lancet. 1998;352(9137):1347- 1351. doi:10.1016/S0140-6736(98)03086-4
Williamson JD, Pajewski NM, Auchus AP, et al. Effect of Intensive vs Standard Blood Pressure Control on Probable Dementia: A Randomized Clinical Trial. In: JAMA - Journal of the American Medical Vol 321. American Medical Association; 2019:553-561. doi:10.1001/ jama.2018.21442
Dichgans M, Zietemann Prevention of vascular cognitive impairment. Stroke. 2012;43(11):3137- 3146. doi:10.1161/STROKEAHA.112.651778
Gorelick PB, Furie KL, Iadecola C, et al. Defining Optimal Brain Health in Adults: A Presidential Advisory From the American Heart Association/American Stroke Stroke. 2017;48(10):e284-e303. doi:10.1161/STR.0000000000000148
Collins R, Armitage J, Parish S, Sleight P, Peto R. MRC/BHF Heart Protection Study of cholesterol lowering with simvastatin in 20 536 high-risk individuals: A randomised placebo-controlled trial. 2002;360(9326):7-22. doi:10.1016/S0140-6736(02)09327-3
Shepherd J, Blauw GJ, Murphy MB, et al. Pravastatin in elderly individuals at risk of vascular disease (PROSPER): A randomised controlled Lancet. 2002;360(9346):1623-1630.
McKeith IG, Boeve BF, DIckson DW, et al. Diagnosis and management of dementia with Lewy Neurology. 2017;89(1):88-100. doi:10.1212/WNL.0000000000004058
Svenningsson P, Westman E, Ballard C, Aarsland D. Cognitive impairment in patients with Parkinson’s disease: Diagnosis, biomarkers, and The Lancet Neurology. 2012;11(8):697- 707. doi:10.1016/S1474-4422(12)70152-7
Johnson JK, Diehl J, Mendez MF, et al. Frontotemporal lobar degeneration: Demographic characteristics of 353 Archives of Neurology. 2005;62(6):925-930. doi:10.1001/ archneur.62.6.925
Miners A, Phillips A, Kreif N, et al. Health-related quality-of-life of people with HIV in the era of combination antiretroviral treatment: A cross-sectional comparison with the general population. The Lancet 2014;1(1):e32-e40. doi:10.1016/S2352-3018(14)70018-9
O’Brien ME, Clark RA, Besch CL, Myers L, Kissinger P. Patterns and Correlates of Discontinuation of the Initial HAART Regimen in an Urban Outpatient Cohort. Journal of Acquired Immune Deficiency 2003;34(4):407-414. doi:10.1097/00126334-200312010-00008
Dalakas Peripheral neuropathy and antiretroviral drugs. In: Journal of the Peripheral Nervous System. Vol 6. J Peripher Nerv Syst; 2001:14-20. doi:10.1046/j.1529-8027.2001.006001014.x
McArthur JC, Brew BJ, Nath A. Neurological complications of HIV infection. Lancet Neurology. 2005;4(9):543-555. doi:10.1016/S1474-4422(05)70165-4
Wulff EA, Wang AK, Simpson HIV-associated peripheral neuropathy: Epidemiology, pathophysiology and treatment. Drugs. 2000;59(6):1251-1260. doi:10.2165/00003495-200059060- 00005
Meeker R, Robertson K, Power C. Neurotoxic Consequences of Antiretroviral Therapies. In: ; 2014:1-7. doi:10.1007/978-1-4614-9610-6_223-1
Dragovic G, Jevtovic D. Nucleoside reverse transcriptase inhibitor usage and the incidence of peripheral neuropathy in HIV/AIDS Antiviral Chemistry and Chemotherapy. 2003;14(5):281- 284. doi:10.1177/095632020301400507
Zheng X, Ouyang H, Liu S, Mata M, Fink DJ, Hao TNFα is involved in neuropathic pain induced by nucleoside reverse transcriptase inhibitor in rats. Brain, Behavior, and Immunity. 2011;25(8):1668- 1676. doi:10.1016/j.bbi.2011.06.010
van Dyke RB, Wang L, Williams Toxicities Associated with Dual Nucleoside Reverse‐ Transcriptase Inhibitor Regimens in HIV‐Infected Children. The Journal of Infectious Diseases. 2008;198(11):1599-1608. doi:10.1086/593022
Simpson DM, Kitch D, Evans SR, et HIV neuropathy natural history cohort study: Assessment measures and risk factors. Neurology. 2006;66(11):1679-1687. doi:10.1212/01. wnl.0000218303.48113.5d
Keswani SC, Pardo CA, Cherry CL, Hoke A, McArthur HIV-associated sensory neuropathies. AIDS. 2002;16(16):2105-2117. doi:10.1097/00002030-200211080-00002
Venhoff N, Lebrecht D, Deveaud C, et al. Oral uridine supplementation antagonizes the peripheral neuropathy and encephalopathy induced by antiretroviral nucleoside analogues. AIDS. 2010;24(3):345-352. doi:10.1097/QAD.0b013e328335cdea
Guidelines for the Use of Antiretroviral Agents in Adults and Adolescents with U.S. Department of Health and Human Services. Published 2019. Accessed June 24, 2020. https://aidsinfo.nih.gov/ guidelines/html/1/adult-and-adolescent-arv/0
Pillay P, Wadley AL, Cherry CL, Karstaedt AS, Kamerman PR. Clinical diagnosis of sensory neuropathy in HIV patients treated with Tenofovir: A 6-month follow-up study. Journal of the Peripheral Nervous 2019;24(4):304-313. doi:10.1111/jns.12349
Villelabeitia Jaureguizar K, Rivas González P, Ibarra Luzar JI, et al. Neuropatía clínica y subclínica de pacientes con virus de inmunodeficiencia humana en tratamiento antirretroviral. Revista de Neurología. 2006;42(09):513. doi:10.33588/rn.4209.2005328
Simpson DM, McArthur JC, Olney R, et al. Lamotrigine for HIV-associated painful sensory neuropathies: A placebo-controlled Neurology. 2003;60(9):1508-1514. doi:10.1212/01. WNL.0000063304.88470.D9
Valcour V, Yeh TM, Bartt R, et Acetyl-L-carnitine and nucleoside reverse transcriptase inhibitor- associated neuropathy in HIV infection. HIV Medicine. 2009;10(2):103-110. doi:10.1111/j.1468- 1293.2008.00658.x
High KP, Brennan-Ing M, Clifford DB, et HIV and aging: State of knowledge and areas of critical need for research. a report to the NIH office of AIDS research by the HIV and aging working group. Journal of Acquired Immune Deficiency Syndromes. 2012;60(SUPPL.1). doi:10.1097/ QAI.0b013e31825a3668
Pathai S, Lawn SD, Gilbert CE, et Accelerated biological ageing in HIV-infected individuals in South Africa: A case-control study. AIDS. 2013;27(15):2375-2384. doi:10.1097/QAD.0b013e328363bf7f
Leeansyah E, Cameron PU, Solomon A, et al. Inhibition of Telomerase Activity by Human Immunodeficiency Virus (HIV) Nucleos(t)ide Reverse Transcriptase Inhibitors: A Potential Factor Contributing to HIV-Associated Accelerated Aging. The Journal of Infectious Diseases. 2013;207(7):1157-1165. doi:10.1093/infdis/jit006
Zhang Y, Song F, Gao Z, et al. Long-term exposure of mice to nucleoside analogues disrupts mitochondrial DNA maintenance in cortical neurons. PLoS ONE. 2014;9(1). doi:10.1371/journal. 0085637
White Mitochondrial toxicity and HIV therapy. Sexually Transmitted Infections. 2001;77(3):158- 173. doi:10.1136/sti.77.3.158
Mehta A, Prabhakar M, Kumar P, Deshmukh R, Sharma Excitotoxicity: Bridge to various
Vázquez-Santiago FJ, Noel RJ, Porter JT, Rivera-Amill Glutamate metabolism and HIV- associated neurocognitive disorders. Journal of NeuroVirology. 2014;20(4):315-331. doi:10.1007/ s13365-014-0258-2
Tovar-y-Romo LB, Bumpus NN, Pomerantz D, et al. Dendritic spine injury induced by the 8-hydroxy metabolite of Efavirenz. Journal of Pharmacology and Experimental Therapeutics. 2012;343(3):696-703. doi:10.1124/jpet.112.195701
Streck EL, Scaini G, Rezin GT, Moreira J, Fochesato CM, Romão Effects of the HIV treatment drugs nevirapine and Efavirenz on brain creatine kinase activity. Metabolic Brain Disease. 2008;23(4):485-492. doi:10.1007/s11011-008-9109-2
Akay C, Cooper M, Odeleye A, et al. Antiretroviral drugs induce oxidative stress and neuronal damage in the central nervous Journal of NeuroVirology. 2014;20(1):39-53. doi:10.1007/ s13365-013-0227-1
Giunta B, Ehrhart J, Obregon DF, et Antiretroviral medications disrupt microglial phagocytosis of
Hung KM, Chen PC, Hsieh HC, Calkins MJ. Mitochondrial defects arise from nucleoside/nucleotide reverse transcriptase inhibitors in neurons: Potential contribution to HIV-associated neurocognitive Biochimica et Biophysica Acta - Molecular Basis of Disease. 2017;1863(2):406-413. doi:10.1016/j.bbadis.2016.11.017
Finsterer J. Cognitive dysfunction in mitochondrial disorders. Acta Neurologica Scandinavica. 2012;126(1):1-11. doi:10.1111/j.1600-0404.2012.01649.x
Sanchez AB, Kaul M. Neuronal stress and injury caused by HIV-1, cART and drug abuse: Converging contributions to Brain Sciences. 2017;7(3). doi:10.3390/brainsci7030025
Gray J, Young B. Acute onset insomnia associated with the initiation of Raltegravir: A report of two cases and literature review. AIDS Patient Care and STDs. 2009;23(9):689-690. doi:10.1089/ 2009.0012
Brown LAM, Jin J, Ferrell D, et al. Efavirenz promotes β-secretase expression and increased Aβ1- 40,42 via oxidative stress and reduced microglial phagocytosis: Implications for HIV Associated Neurocognitive Disorders (HAND). PLoS 2014;9(4). doi:10.1371/journal.pone.0095500
Decloedt EH, Maartens G. Neuronal toxicity of Efavirenz: A systematic review. Expert Opinion on Drug 2013;12(6):841-846. doi:10.1517/14740338.2013.823396
Purnell PR, Fox Efavirenz induces neuronal autophagy and mitochondrial alterations. Journal
Blas-Garcia A, Polo M, Alegre F, et Lack of mitochondrial toxicity of Darunavir, Raltegravir
Bertrand L, Toborek M. Dysregulation of endoplasmic reticulum stress and autophagic responses by the antiretroviral drug Efavirenz. Molecular Pharmacology. 2015;88(2):304-315. doi:10.1124/ 115.098590
Apostolova N, Funes HA, Blas-Garcia A, Galindo MJ, Alvarez A, Esplugues J Efavirenz and the CNS: what we already know and questions that need to be answered. Journal of Antimicrobial Chemotherapy. 2015;70(10):2693-2708. doi:10.1093/jac/dkv183
Ciccarelli N, Fabbiani M, di Giambenedetto S, et al. Efavirenz associated with cognitive disorders in otherwise asymptomatic HIV-infected Neurology. 2011;76(16):1403-1409. doi:10.1212/ WNL.0b013e31821670fb
Stern AL, Lee RN, Panvelker N, et Differential Effects of Antiretroviral Drugs on Neurons In Vitro: Roles for Oxidative Stress and Integrated Stress Response. Journal of Neuroimmune Pharmacology. 2018;13(1):64-76. doi:10.1007/s11481-017-9761-6
Vivithanaporn P, Asahchop EL, Acharjee S, Baker GB, Power C. HIV protease inhibitors disrupt astrocytic glutamate transporter function and neurobehavioral AIDS. 2016;30(4):543- 552. doi:10.1097/QAD.0000000000000955
Latronico T, Pati I, Ciavarella R, et al. In vitro effect of antiretroviral drugs on cultured primary astrocytes: analysis of neurotoxicity and matrix metalloproteinase Journal of Neurochemistry. 2018;144(3):271-284. doi:10.1111/jnc.14269
Hinckley Sandy, Sherman Sean, Best Brookie M., et al. Neurotoxicity Screening of Antiretroviral Drugs With Human iPSC-Derived Neurons - CROI Conference on Retroviruses ans Oppotunistic Infections (CROI) . Published 2016. Accessed June 24, 2020. https://www. croiconference.org/abstract/neurotoxicity-screening-antiretroviral-drugs-human-ipsc-derived- neurons/
Zash R, Makhema J, Shapiro RL. Neural-tube defects with Dolutegravir treatment from the time of New England Journal of Medicine. 2018;379(10):979-981. doi:10.1056/NEJMc1807653
Elzi L, Erb S, Furrer H, et Adverse events of Raltegravir and Dolutegravir. AIDS. 2017;31(13):1853- 1858. doi:10.1097/QAD.0000000000001590
Harris M, Larsen G, Montaner Exacerbation of depression associated with starting Raltegravir: A report of four cases. AIDS. 2008;22(14):1890-1892. doi:10.1097/QAD.0b013e32830e0169
Daar ES, DeJesus E, Ruane P, et al. Efficacy and safety of switching to fixed-dose Bictegravir, emtricitabine, and Tenofovir alafenamide from boosted protease inhibitor-based regimens in virologically suppressed adults with HIV-1: 48 week results of a randomised, open-label, multicentre, phase 3, non-inferiority trial. The Lancet HIV. 2018;5(7):e347-e356. doi:10.1016/ S2352-3018(18)30091-2
Capetti AF, di Giambenedetto S, Latini A, et al. Morning dosing for Dolutegravir-related insomnia and sleep HIV Medicine. 2018;19(5):e62-e63. doi:10.1111/hiv.12540
Hoffmann C, Welz T, Sabranski M, et al. Higher rates of neuropsychiatric adverse events leading to Dolutegravir discontinuation in women and older patients. HIV Medicine. 2017;18(1):56-63. doi:10.1111/hiv.12468
Martin-Blondel G, Brassat D, Bauer J, Lassmann H, Liblau CCR5 blockade for neuroinflammatory diseases-beyond control of HIV. Nature Reviews Neurology. 2016;12(2): 95-105. doi:10.1038/nrneurol.2015.248
Jarrin I, Suarez-Garcia I, Moreno C, et al. Durability of first-line antiretroviral regimens in the era of integrase inhibitors: A cohort of HIV-positive individuals in Spain, 2014-2015. Antiviral 2019;24(3):167-175. doi:10.3851/IMP3297
Cuzin L, Pugliese P, Katlama C, et al. Integrase strand transfer inhibitors and neuropsychiatric adverse events in a large prospective Journal of Antimicrobial Chemotherapy. 2019;74(3):754-760. doi:10.1093/jac/dky497
Nasreddine R, Florence E, Vandercam B, et al. Effectiveness of Dolutegravir-based antiretroviral therapy in a real-world setting in a Belgian cohort of 4101 HIV AIDS (London, England). 2020;34(8):1151-1159. doi:10.1097/QAD.0000000000002533
Rowlands Multi-centre open-label study of switching from Atripla to Eviplera for CNS toxicity. Third Joint of the conference of the British HIV Association. Published 2014. Accessed June 24, 2020. https://www.bhiva.org/file/KOJYgWSNvPpMj/JaneRowlands.pdf
Fabbiani M, Mondi A, Colafigli M, et Safety and efficacy of treatment switch to Raltegravir plus Tenofovir/emtricitabine or Abacavir/lamivudine in patients with optimal virological control: 48-week results from a randomized pilot study (Raltegravir Switch for Toxicity or Adverse Events, RASTA Study). Scandinavian Journal of Infectious Diseases. 2014;46(1):34-45. doi:10.3109/00365548.2 013.840920
Bracchi M, Pagani N, Clarke Multicentre open-label pilot study of switching from Efavirenz to Dolutegravir for central nervous system (CNS) toxicity. Journal of International AIDS Society. 2016;19(8S7).
Perez-Valero I, Cabello A, Ryan P. Reversibility of Dolutegravir/lamivudine/Abacavir FDC neuropsychiatric toxicity after 24 weeks of switching to Elvitegravir/Cobicistat/ emtricitabine/Tenofovir-alafenamide. The DREAM Clinical Trial (GeSIDA 9016). . HIV 2019;20(S9):90-91.
Vera JH, Bracchi M, Alagaratnam J, et al. Improved central nervous system symptoms in people with HIV without objective neuropsychiatric complaints switching from Efavirenz to rilpivirine containing Brain Sciences. 2019;9(8). doi:10.3390/brainsci9080195
Pozniak A, Flamm J, Antinori A, et al. Switching to the single-tablet regimen of Elvitegravir, cobicistat, emtricitabine, and Tenofovir DF from non-nucleoside reverse transcriptase inhibitor plus coformulated emtricitabine and Tenofovir DF regimens: Week 96 results of STRATEGY-NNRTI. HIV Clinical 2017;18(4):141-148. doi:10.1080/15284336.2017.1338844
Wohl D, Clarke A, Maggiolo F, et al. Patient-Reported Symptoms Over 48 Weeks Among Participants in Randomized, Double-Blind, Phase III Non-inferiority Trials of Adults with HIV on Co- formulated Bictegravir, Emtricitabine, and Tenofovir Alafenamide versus Co-formulated Abacavir, Dolutegravir, and Patient. 2018;11(5):561-573. doi:10.1007/s40271-018-0322-8
Cevik M, Campbell R, Raha D, O’Shea Discontinuation of Dolutegravir (DTG) containing therapy and adverse events in a Scottish cohort. HIV Medicine. Published online April 17, 2018.
Cantú Guzmán R, Álvarez Bermúdez J, Torres López E, Martínez Sulvarán O. Impacto psicosocial asociado al diagnóstico de infección por vih/SIDA: apartados cualitativos de medición. Revista Electrónica Medicina, Salud y Published online 2012.
Flowers P, Davis MM, Larkin M, Church S, Marriott C. Understanding the impact of HIV diagnosis amongst gay men in Scotland: An interpretative phenomenological Psychology & Health. 2011;26(10):1378-1391. doi:10.1080/08870446.2010.551213
Zeligman M, Wood AW. Conceptualizing an HIV Diagnosis Through a Model of Grief and Adultspan Journal. 2017;16(1):18-30. doi:10.1002/adsp.12031
Richard Lazarus MVMSF. Estrés y Procesos Cognitivos. (Martinez Roca, ed.).; 1986.
Milena Gaviria A, Quiceno JM, Vinaccia S, Martínez LA, Otalvaro Estrategias de afrontamiento y ansiedad-depresión en pacientes diagnosticados con VIH/SIDA. Terapia Psicologica. 2009;27(1):5-13. doi:10.4067/s0718-48082009000100001
Carrobles JA, Remor E, Rodríguez-Alzamora Afrontamiento, apoyo social percibido y distrés emocional en pacientes con infección por VIH. [Relationshiop of coping and perceived social support to emotional distress in people living with HIV.]. Psicothema. 2003;15(3):420-426.
Chida Y, Vedhara Adverse psychosocial factors predict poorer prognosis in HIV disease: A meta- analytic review of prospective investigations. Brain, Behavior, and Immunity. 2009;23(4):434-445. doi:10.1016/j.bbi.2009.01.013
Ironson GH, O’Cleirigh C, Weiss A, Schneiderman N, Costa PT. Personality and HIV Disease Progression: Role of NEO-PI-R Openness, Extraversion, and Profiles of Psychosomatic Medicine. 2008;70(2):245-253. doi:10.1097/PSY.0b013e31816422fc
Lee RS, Kochman A, Sikkema Internalized Stigma Among People Living with HIV-AIDS. AIDS
Guevara-Sotelo Y, Hoyos-Hernández Vivir con VIH: experiencias de estigma sentido en
Chan RCH, Mak WWS. Cognitive, Regulatory, and Interpersonal Mechanisms of HIV Stigma on the Mental and Social Health of Men Who Have Sex With Men Living With HIV. American Journal of Men’s 2019;13(5):155798831987377. doi:10.1177/1557988319873778
Travaglini LE, Himelhoch SS, Fang LJ. HIV Stigma and Its Relation to Mental, Physical and Social Health Among Black Women Living with HIV/AIDS. AIDS and Behavior. 2018;22(12):3783-3794. doi:10.1007/s10461-018-2037-1
Atkinson JS, Nilsson Schönnesson L, Williams ML, Timpson Associations among correlates of schedule adherence to antiretroviral therapy (ART): A path analysis of a sample of crack cocaine using sexually active African–Americans with HIV infection. AIDS Care. 2008;20(2):253- 262. doi:10.1080/09540120701506788
Johnson CJ, Heckman TG, Hansen NB, Kochman A, Sikkema KJ. Adherence to antiretroviral medication in older adults living with HIV/AIDS: a comparison of alternative models. AIDS Care. 2009;21(5):541-551. doi:10.1080/09540120802385611
Santoro Pablo CF. Tipos de problemas de adherencia entre las personas con VIH y tendencias emergentes en la adherencia al tratamiento antirretroviral (TAR). Revista Multidisciplinar del 2013;1(1):41-58.
Dilla T, Valladares A, Lizán L, Sacristán JA. Adherencia y persistencia terapéutica: causas, consecuencias y estrategias de mejora. Atención Primaria. 2009;41(6):342-348. doi:10.1016/j. 2008.09.031
Owe-Larsson M, Säll L, Salamon E, Allgulander HIV infection and psychiatric illness. African
Dyer JG and Reducing HIV risk among people with serious mental illness. J
Parhami I, Fong TW, Siani A, Carlotti C, Khanlou H. Documentation of Psychiatric Disorders and Related Factors in a Large Sample Population of HIV-Positive Patients in California. AIDS and 2013;17(8):2792-2801. doi:10.1007/s10461-012-0386-8
Bing EG, Burnam MA, Longshore D, et al. Psychiatric Disorders and Drug Use Among Human Immunodeficiency Virus–Infected Adults in the United States. Archives of General Psychiatry. 2001;58(8):721. doi:10.1001/archpsyc.58.8.721
Lopes M, Olfson M, Rabkin J, et Gender, HIV Status, and Psychiatric Disorders. The Journal of
Brandt The mental health of people living with HIV/AIDS in Africa: A systematic review. African
Burnam MA, Bing EG, Morton SC, et Use of mental health and substance abuse treatment services among adults with HIV in the United States. Archives of General Psychiatry. 2001;58(8):729-736. doi:10.1001/archpsyc.58.8.729
Kessler RC, Chiu WT, Demler O, Walters EE. Prevalence, Severity, and Comorbidity of 12-Month DSM-IV Disorders in the National Comorbidity Survey Replication. Archives of General Psychiatry. 2005;62(6):617. doi:10.1001/archpsyc.62.6.617
Schadé A, van Grootheest G, Smit JH. HIV-infected mental health patients: Characteristics and comparison with HIV-infected patients from the general population and non-infected mental health BMC Psychiatry. 2013;13. doi:10.1186/1471-244X-13-35
Gallego L, Barreiro P, Lopez-Ibor Diagnosis and Clinical Features of Major Neuropsychiatric
Pence BW, O’Donnell JK, Gaynes Falling through the cracks. AIDS. 2012;26(5):656-658.
Beer L, Tie Y, Padilla M, Shouse Generalized anxiety disorder symptoms among persons with diagnosed HIV in the United States. AIDS. 2019;33(11):1781-1787. doi:10.1097/ QAD.0000000000002286
Rane MS, Hong T, Govere S, et al. Depression and Anxiety as Risk Factors for Delayed Care- Seeking Behavior in Human Immunodeficiency Virus–Infected Individuals in South Africa. Clinical Infectious 2018;67(9):1411-1418. doi:10.1093/cid/ciy309
Glynn TR, Safren SA, Carrico AW, et al. High Levels of Syndemics and Their Association with Adherence, Viral Non-suppression, and Biobehavioral Transmission Risk in Miami, a S. City with an HIV/AIDS Epidemic. AIDS and Behavior. 2019;23(11):2956-2965. doi:10.1007/s10461-019- 02619-0
Been SK, Schadé A, Bassant N, Kastelijns M, Pogány K, Verbon A. Anxiety, depression and treatment adherence among HIV-infected AIDS Care. 2019;31(8):979-987. doi:10.1080/ 09540121.2019.1601676
Zigmond AS, Snaith The Hospital Anxiety and Depression Scale. Acta Psychiatrica
Ferrando L, Bobes J Gibert M, Soto M, Soto M.I.N.I. Mini International Neuropsychiatric
Baldwin DS, Anderson IM, Nutt DJ, Evidence-basedguidelinesforthepharmacologicaltreatment of anxiety disorders: recommendations from the British Association for Psychopharmacology. Journal of Psychopharmacology. 2005;19(6):567-596. doi:10.1177/0269881105059253
Rabkin HIV and depression: 2008 review and update. Current HIV/AIDS Reports. 2008;5(4):163-
doi:10.1007/s11904-008-0025-1
Leserman HIV disease progression: depression, stress, and possible mechanisms. Biological
Mollan KR, Smurzynski M, Eron JJ, et Association Between Efavirenz as Initial Therapy for HIV- 1 Infection and Increased Risk for Suicidal Ideation or Attempted or Completed Suicide. Annals of Internal Medicine. 2014;161(1):1. doi:10.7326/M14-0293
Slot M, Sodemann M, Gabel C, Holmskov J, Laursen T, Rodkjaer Factors associated with risk of depression and relevant predictors of screening for depression in clinical practice: a cross- sectional study among HIV-infected individuals in Denmark. HIV Medicine. 2015;16(7):393-402. doi:10.1111/hiv.12223
Robertson K, Bayon C, Molina J-M, et al. Screening for neurocognitive impairment, depression, and anxiety in HIV-infected patients in Western Europe and AIDS Care. 2014;26(12):1555- 1561. doi:10.1080/09540121.2014.936813
Morrison MF, Petitto JM, Have T ten, et al. Depressive and Anxiety Disorders in Women With HIV
Rao D, Feldman BJ, Fredericksen RJ, et al. A Structural Equation Model of HIV-Related Stigma, Depressive Symptoms, and Medication Adherence. AIDS and Behavior. 2012;16(3):711-716. doi:10.1007/s10461-011-9915-0
Ciesla JA, Roberts JE. Meta-Analysis of the Relationship Between HIV Infection and Risk for Depressive Disorders. American Journal of Psychiatry. 2001;158(5):725-730. doi:10.1176/appi. 158.5.725
Tegger MK, Crane HM, Tapia KA, Uldall KK, Holte SE, Kitahata MM. The Effect of Mental Illness, Substance Use, and Treatment for Depression on the Initiation of Highly Active Antiretroviral Therapy among HIV-Infected Individuals. AIDS Patient Care and STDs. 2008;22(3):233-243. doi:10.1089/apc.2007.0092
Gonzalez JS, Batchelder AW, Psaros C, Safren Depression and HIV/AIDS Treatment Nonadherence: A Review and Meta-analysis. JAIDS Journal of Acquired Immune Deficiency Syndromes. 2011;58(2):181-187. doi:10.1097/QAI.0B013E31822D490A
Springer SA, Dushaj A, Azar MM. The Impact of DSM-IV Mental Disorders on Adherence to Combination Antiretroviral Therapy Among Adult Persons Living with HIV/AIDS: A Systematic AIDS and Behavior. 2012;16(8):2119-2143. doi:10.1007/s10461-012-0212-3
Sherr L, Clucas C, Harding R, Sibley E, Catalan J. HIV and Depression – a systematic review of Psychology, Health & Medicine. 2011;16(5):493-527. doi:10.1080/13548506.2011.5 79990
Leserman Role of Depression, Stress, and Trauma in HIV Disease Progression. Psychosomatic
So‐Armah K, Gupta S, Kundu S, et Depression and all‐cause mortality risk in HIV‐infected and HIV‐uninfected US veterans: a cohort study. HIV Medicine. 2019;20(5):317-329. doi:10.1111/ hiv.12726
European AIDS Clinical Society. EACS Guidelines version 10.0 — EACS. Published November Accessed June 25, 2020. https://www.eacsociety.org/files/2019_guidelines-10.0_final.pdf.
Treisman GJ, Soudry O. Neuropsychiatric Effects of HIV Antiviral Medications. Drug Safety. 2016;39(10):945-957. doi:10.1007/s40264-016-0440-y
Aragonès E, Roca M, Mora F. Abordaje Compartido de La Depresión: Consenso Multidisciplinar ; 2018. Accessed June 25, 2020. Ebook disponible en: www.semfyc.es/wp-content/ uploads/2018/05/ Consenso_depresion.pdf.
Laperriere A, Ironson GH, Antoni MH, et al. Decreased Depression Up to One Year Following CBSM+ Intervention in Depressed Women with AIDS: The Smart/EST Women’s Project. Journal of Health 2005;10(2):223-231. doi:10.1177/1359105305049772
Carrico AW, Antoni MH, Durán RE, et Reductions in depressed mood and denial coping during
Paulus DJ, Brandt CP, Lemaire C, Zvolensky MJ. Trajectory of change in anxiety sensitivity in relation to anxiety, depression, and quality of life among persons living with HIV/AIDS following transdiagnostic cognitive-behavioral therapy. Cognitive Behaviour Therapy. 2020;49(2):149-163. doi:10.1080/16506073.2019.1621929
Freudenreich O, Goforth HW, Cozza KL, et Psychiatric treatment of persons with HIV/AIDS: An HIV-psychiatry consensus survey of current practices. Psychosomatics. 2010;51(6):480-488. doi:10.1176/appi.psy.51.6.480
Ferrando SJ, Freyberg Treatment of depression in HIV positive individuals: A critical review.
Chandra PS, Desai G, Ranjan HIV & Psychiatric Disorders. Vol 121.; 2005.
de Sousa Gurgel W, da Silva Carneiro AH, Barreto Rebouças D, Negreiros de Matos KJ, do Menino Jesus Silva Leitão T, de Matos e Souza FG. Prevalence of bipolar disorder in a HIV- infected outpatient AIDS Care. 2013;25(12):1499-1503. doi:10.1080/09540121.2013.7 79625
Kieburtz K, Zettelmaier AE, Ketonen L, Tuite M, Caine Manic syndrome in AIDS. American
Ellen SR, Judd FK, Mijch AM, Cockram Secondary Mania in Patients with HIV Infection. Australian
Nakimuli-Mpungu E, Musisi S, Mpungu SK, Katabira Primary Mania Versus HIV-Related Secondary Mania in Uganda. American Journal of Psychiatry. 2006;163(8):1349-1354. doi:10.1176/ ajp.2006.163.8.1349
Robinson Primary Mania Versus Secondary Mania of HIV/AIDS in Uganda. American Journal
Nakimuli-Mpungu E, Musisi S, Kiwuwa Mpungu S, Katabira E. Clinical Presentation of Bipolar Mania in HIV-Positive Patients in Psychosomatics. 2009;50(4):325-330. doi:10.1176/appi. psy.50.4.325
Lyketsos CG, Hanson AL, Fishman M, Rosenblatt A, McHugh PR, Treisman GJ. Manic syndrome early and late in the course of HIV. American Journal of Psychiatry. 1993;150(2):326-327. doi:10.1176/ajp.150.2.326
Nakimuli-Mpungu, Mutamba Brian, Nshemerirwe Slyvia, Kiwuwa Mpungu Steven, Seggane Musisi. Effect of HIV infection on time to recovery from an acute manic HIV/AIDS - Research and Palliative Care. 2010;2:185. doi:10.2147/hiv.s9978
Soares Recent advances in the treatment of bipolar mania, depression, mixed states, and rapid cycling. International Clinical Psychopharmacology. 2000;15(4):183-196. doi:10.1097/00004850- 200015040-00001
American Psychiatric Diagnostic and Statistical Manual of Mental Disorders DSM-5
Stolar A. HIV and Psychiatry, Second Edition: A Training and Resource Manual . Cambridge University Press;
Newton PJ, Newsholme W, Brink NS, Manji H, Williams IG, Miller RF. Acute meningoencephalitis and meningitis due to primary HIV infection. BMJ (Clinical research ed). 2002;325(7374):1225- https://Pubmed.ncbi.nlm.nih.gov/12446542
Anguizola-Tamayo D, Bocos-Portillo J, Pardina-Vilella L, et al. Psychosis of dual origin in HIV infection: Viral escape syndrome and autoimmune encephalitis. Neurology Clinical practice. 2019;9(2):178-180. doi:10.1212/CPJ.0000000000000582
Laher A, Ariefdien N, Etlouba HIV prevalence among first-presentation psychotic patients. HIV
de Ronchi D, Faranca I, Forti P, et al. Development of Acute Psychotic Disorders and HIV-1 The International Journal of Psychiatry in Medicine. 2000;30(2):173-183. doi:10.2190/ PLGX-N48F-RBHJ-UF8K
Singh AN, Golledge H, Catalan Treatment of HIV-related psychotic disorders with risperidone: A series of 21 cases. Journal of Psychosomatic Research. 1997;42(5):489-493. doi:10.1016/S0022- 3999(96)00373-X
Fernandez F, Levy JK. The use of molindone in the treatment of psychotic and delirious patients infected with the human immunodeficiency virus. General Hospital Psychiatry. 1993;15(1):31-35. doi:10.1016/0163-8343(93)90088-6
Sewell DD, Jeste D , McAdams LA, et al. Neuroleptic Treatment of HIV-Associated Psychosis.
Millon Classifying Personality Disorders: An Evolution-Based Alternative to an Evidence-Based
Nanni MG, Caruso R, Mitchell AJ, Meggiolaro E, Grassi Depression in HIV Infected Patients: a
Low Y, Goforth H, Preud’homme X, Edinger J, Krystal A. Insomnia in HIV-infected patients: pathophysiologic . AIDS Reviews. 2014;16:3-13.
Omonuwa TS, Goforth HW, Preud’homme X, Krystal AD. The pharmacologic management of insomnia in patients with Journal of clinical sleep medicine : JCSM : official publication of the American Academy of Sleep Medicine. 2009;5(3):251-262. https://Pubmed.ncbi.nlm.nih. gov/19960648
Fekete EM, Williams SL, Skinta MD. Internalised HIV-stigma, loneliness, depressive symptoms and sleep quality in people living with Psychology & Health. 2018;33(3):398-415. doi:10.1080
Rogers BG, Lee JS, Bainter SA, Bedoya CA, Pinkston M, Safren A multilevel examination of sleep, depression, and quality of life in people living with HIV/AIDS. Journal of health psychology. Published online March 1, 2018:1359105318765632-1359105318765632. doi:10.1177/1359105318765632
Qaseem A, Kansagara D, Forciea MA, Cooke M, Denberg TD. Management of Chronic Insomnia Disorder in Adults: A Clinical Practice Guideline From the American College of Physicians. Annals of Internal 2016;165(2):125. doi:10.7326/M15-2175
Wilson S, Anderson K, Baldwin D, et al. British Association for Psychopharmacology consensus statement on evidence-based treatment of insomnia, parasomnias and circadian rhythm disorders: An Journal of Psychopharmacology. 2019;33(8):923-947. doi:10.1177/0269881119855343
Celesia M., Sofia S. A., Rapisarda L., et al. Anxiety, depression and sleep disturbances in hiv+ patients chronically treated with an Efavirenz-based regimen. Infectious Diseases & Tropical Medicine . 2017;3(2):e394.
8. ANEXO I: Escala Hospitalaria de Ansiedad y Depresión (HADS).
Este cuestionario32 se ha construido para ayudar a quien le trate a saber cómo se siente usted. Lea cada frase y marque la respuesta que más se ajusta a cómo se sintió usted durante la semana pasada. No piense mucho las respuestas. Lo más seguro es que, si contesta deprisa, sus respuestas podrán reflejar mejor cómo se encontraba usted durante la semana pasada. (Mire la página siguiente para realizar el cuestionario).
Interpretación
La escala está formada por catorce ítems, siete de los cuales miden la ansiedad y los otros siete la depresión (los ítems que miden la depresión están marcados con un asterisco). Cada ítem puntúa de 0 a 3 (de menos a más patología). Las respuestas de las preguntas 1, 3, 5, 6, 8, 10, 11, y 13 se puntúan de la siguiente forma: 3 puntos la primera respuesta, 2 puntos la segunda, 1 punto la tercera y 0 puntos la cuarta. Las respuestas de las preguntas 2, 4, 7, 9, 12, y 14 se puntúan de la siguiente forma: 0 puntos la primera respuesta, 1 punto la segunda, 2 puntos la tercera y 3 puntos la cuarta. Se considera que por debajo de 7 puntos no hay patología, entre 8 y 10 es dudosa, y si es mayor de 10 es indicativa de patología ansiosa o depresiva.
Ver (Tabla 1).
Bibliografía:
Cantú Guzmán R, Álvarez Bermúdez J, Torres López E, Martínez Sulvarán O. Impacto psicosocial asociado al diagnóstico de infección por vih/SIDA: apartados cualitativos de medición. Revista Electrónica Medicina, Salud y Published online 2012.
Flowers P, Davis MM, Larkin M, Church S, Marriott C. Understanding the impact of HIV diagnosis amongst gay men in Scotland: An interpretative phenomenological Psychology & Health. 2011;26(10):1378-1391. doi:10.1080/08870446.2010.551213
Zeligman M, Wood AW. Conceptualizing an HIV Diagnosis Through a Model of Grief and Adultspan Journal. 2017;16(1):18-30. doi:10.1002/adsp.12031
Richard Lazarus MVMSF. Estrés y Procesos Cognitivos. (Martinez Roca, ed.).; 1986.
Milena Gaviria A, Quiceno JM, Vinaccia S, Martínez LA, Otalvaro Estrategias de afrontamiento y ansiedad-depresión en pacientes diagnosticados con VIH/SIDA. Terapia Psicologica. 2009;27(1):5-13. doi:10.4067/s0718-48082009000100001
Carrobles JA, Remor E, Rodríguez-Alzamora Afrontamiento, apoyo social percibido y distrés emocional en pacientes con infección por VIH. [Relationshiop of coping and perceived social support to emotional distress in people living with HIV.]. Psicothema. 2003;15(3):420-426.
Chida Y, Vedhara Adverse psychosocial factors predict poorer prognosis in HIV disease: A meta- analytic review of prospective investigations. Brain, Behavior, and Immunity. 2009;23(4):434-445. doi:10.1016/j.bbi.2009.01.013
Ironson GH, O’Cleirigh C, Weiss A, Schneiderman N, Costa PT. Personality and HIV Disease Progression: Role of NEO-PI-R Openness, Extraversion, and Profiles of Psychosomatic Medicine. 2008;70(2):245-253. doi:10.1097/PSY.0b013e31816422fc
Lee RS, Kochman A, Sikkema Internalized Stigma Among People Living with HIV-AIDS. AIDS
Guevara-Sotelo Y, Hoyos-Hernández Vivir con VIH: experiencias de estigma sentido en
Chan RCH, Mak WWS. Cognitive, Regulatory, and Interpersonal Mechanisms of HIV Stigma on the Mental and Social Health of Men Who Have Sex With Men Living With HIV. American Journal of Men’s 2019;13(5):155798831987377. doi:10.1177/1557988319873778
Travaglini LE, Himelhoch SS, Fang LJ. HIV Stigma and Its Relation to Mental, Physical and Social Health Among Black Women Living with HIV/AIDS. AIDS and Behavior. 2018;22(12):3783-3794. doi:10.1007/s10461-018-2037-1
Atkinson JS, Nilsson Schönnesson L, Williams ML, Timpson Associations among correlates of schedule adherence to antiretroviral therapy (ART): A path analysis of a sample of crack cocaine using sexually active African–Americans with HIV infection. AIDS Care. 2008;20(2):253- 262. doi:10.1080/09540120701506788
Johnson CJ, Heckman TG, Hansen NB, Kochman A, Sikkema KJ. Adherence to antiretroviral medication in older adults living with HIV/AIDS: a comparison of alternative models. AIDS Care. 2009;21(5):541-551. doi:10.1080/09540120802385611
Santoro Pablo CF. Tipos de problemas de adherencia entre las personas con VIH y tendencias emergentes en la adherencia al tratamiento antirretroviral (TAR). Revista Multidisciplinar del 2013;1(1):41-58.
Dilla T, Valladares A, Lizán L, Sacristán JA. Adherencia y persistencia terapéutica: causas, consecuencias y estrategias de mejora. Atención Primaria. 2009;41(6):342-348. doi:10.1016/j. 2008.09.031
Owe-Larsson M, Säll L, Salamon E, Allgulander HIV infection and psychiatric illness. African
Dyer JG and Reducing HIV risk among people with serious mental illness. J
Parhami I, Fong TW, Siani A, Carlotti C, Khanlou H. Documentation of Psychiatric Disorders and Related Factors in a Large Sample Population of HIV-Positive Patients in California. AIDS and 2013;17(8):2792-2801. doi:10.1007/s10461-012-0386-8
Bing EG, Burnam MA, Longshore D, et al. Psychiatric Disorders and Drug Use Among Human Immunodeficiency Virus–Infected Adults in the United States. Archives of General Psychiatry. 2001;58(8):721. doi:10.1001/archpsyc.58.8.721
Lopes M, Olfson M, Rabkin J, et Gender, HIV Status, and Psychiatric Disorders. The Journal of
Brandt The mental health of people living with HIV/AIDS in Africa: A systematic review. African
Burnam MA, Bing EG, Morton SC, et Use of mental health and substance abuse treatment services among adults with HIV in the United States. Archives of General Psychiatry. 2001;58(8):729-736. doi:10.1001/archpsyc.58.8.729
Kessler RC, Chiu WT, Demler O, Walters EE. Prevalence, Severity, and Comorbidity of 12-Month DSM-IV Disorders in the National Comorbidity Survey Replication. Archives of General Psychiatry. 2005;62(6):617. doi:10.1001/archpsyc.62.6.617
Schadé A, van Grootheest G, Smit JH. HIV-infected mental health patients: Characteristics and comparison with HIV-infected patients from the general population and non-infected mental health BMC Psychiatry. 2013;13. doi:10.1186/1471-244X-13-35
Gallego L, Barreiro P, Lopez-Ibor Diagnosis and Clinical Features of Major Neuropsychiatric
Pence BW, O’Donnell JK, Gaynes Falling through the cracks. AIDS. 2012;26(5):656-658.
Beer L, Tie Y, Padilla M, Shouse Generalized anxiety disorder symptoms among persons with diagnosed HIV in the United States. AIDS. 2019;33(11):1781-1787. doi:10.1097/ QAD.0000000000002286
Rane MS, Hong T, Govere S, et al. Depression and Anxiety as Risk Factors for Delayed Care- Seeking Behavior in Human Immunodeficiency Virus–Infected Individuals in South Africa. Clinical Infectious 2018;67(9):1411-1418. doi:10.1093/cid/ciy309
Glynn TR, Safren SA, Carrico AW, et al. High Levels of Syndemics and Their Association with Adherence, Viral Non-suppression, and Biobehavioral Transmission Risk in Miami, a S. City with an HIV/AIDS Epidemic. AIDS and Behavior. 2019;23(11):2956-2965. doi:10.1007/s10461-019- 02619-0
Been SK, Schadé A, Bassant N, Kastelijns M, Pogány K, Verbon A. Anxiety, depression and treatment adherence among HIV-infected AIDS Care. 2019;31(8):979-987. doi:10.1080/ 09540121.2019.1601676
Zigmond AS, Snaith The Hospital Anxiety and Depression Scale. Acta Psychiatrica
9. ANEXO II: ÍNDICE DE CALIDAD DE SUEÑO DE PITTSBURGH (PSQI)
INSTRUCCIONES: Las siguientes preguntas tratan sobre sus hábitos generales de sueño solamente durante el último mes (los últimos 30 días). Sus respuestas deberán ser lo más precisas posible para la mayoría de los días y noches del último mes. Por favor, conteste a todas las preguntas.
Ver (Tabla 1) y (Tabla 2).
10. ANEXO III-A: ESCALA PARA LA IDENTIFICACIÓN DE TRASTORNOS ASOCIADOS CON EL USO DE DROGAS – (DUDIT).
Ver (Tabla 1) y (Tabla 2).
11. ANEXO III-B: ESCALA PARA LA IDENTIFICACIÓN DE TRASTORNOS ASOCIADOS CON EL CONSUMO DE ALCOHOL – (AUDIT)
Ver (Tabla1).
12. ANEXO IV: Cuestionario sobre la salud del paciente – 9 (PHQ-9)
Ver (Tabla 1).
Interpretación
Si hay >4 respuestas en las columnas “mas de la mitad de los días” o “casi todos los días” (incluyendo las preguntas 1 y 2) o >5 (incluyendo la pregunta 1 o la 2), considerar un trastorno depresivo mayor. Sumar las puntuaciones para valorar la severidad (<10 leve, 10- 14 moderado, 15-19 moderado-severo y >20 severo). Considerar otro trastorno depresivo cuando el número de respuestas en las columnas “más de la mitad de los días” o “casi todos los días” sea entre 2-4 (cuando una de esas respuestas corresponde a las preguntas 1 o 2).