Documento de consenso de GeSIDA para la evaluación y el tratamiento de las enfermedades renales en pacientes con infección por el virus de la inmunodeficiencia humana
Marzo 2020
Notas de la Versión:
Antes de comenzar
Félix Gutiérrez
COORDINADORES
Unidad de Enfermedades Infecciosas, Hospital General de Elche y Universidad Miguel Hernández, Alicante.
Ana Barrios
REDACTORES Y REVISORES
Servicio de Medicina Interna, Hospital de la Princesa, Madrid
Antonia Calvo
REDACTORES Y REVISORES
Servicio de Patología Infecciosa, Hospital Universitario de Badajoz.
Auxiliadora Mazuecos
REDACTORES Y REVISORES
Servicio de Nefrología, Hospital Universitario Puerta del Mar, Cádiz.
Eugenia Negredo
REDACTORES Y REVISORES
Fundación de la Lluita contra la SIDA, Hospital Universitario Germans Trias i Pujol, Badalona, Barcelona.
Hernando Knobel
REDACTORES Y REVISORES
Servicio Enfermedades Infecciosas. Hospital del Mar, Barcelona. Universidad Autónoma de Barcelona.
Joan C. Trullàs
REDACTORES Y REVISORES
Servicio de Medicina Interna, Hospital de Olot i Comarcal de la Garrotxa, Universitat de Vic - Universitat Central de Catalunya, Girona.
José M. Miró
REDACTORES Y REVISORES
Servicio de Enfermedades infecciosas, Hospital Clínic - IDIBAPS. Universidad de Barcelona, Barcelona.
José Sanz
REDACTORES Y REVISORES
Servicio de Medicina Interna, Hospital Universitario Príncipe de Asturias, Alcalá de Henares, Madrid.
Marta Montero
REDACTORES Y REVISORES
Servicio de Medicina Interna. Hospital Universitario La Fe, Valencia
Pere Domingo
REDACTORES Y REVISORES
Sección de VIH-SIDA, Hospital de la Santa Creu i Sant Pau, Universidad Autónoma de Barcelona, Barcelona.
Xavier Fulladosa
REDACTORES Y REVISORES
Servicio de Nefrología, Hospital Universitari de Bellvitge – IDIBELL, Universidad de Barcelona, L’Hospitalet de Llobregat, Barcelona.
AGRADECIMIENTOS
La Junta Directiva de GeSIDA agradece las aportaciones y opiniones de los socios que han contribuido a mejorar la redacción y enriquecer el contenido del documento de consenso:
LISTADO DE ABREVIATURAS
3TC |
Lamivudina |
AAD |
Antivirales de acción directa |
ABC |
Abacavir |
AEE |
Agentes estimulantes de la eritropoyesis |
AINES |
Antiinflamatorios no esteroideos |
APV |
Amprenavir |
ATV |
Atazanavir |
ARA-II |
Antagonistas de los receptores AT1 de la angiotensina II |
BIC |
Bictegravir |
CAC |
Cociente albúmina / creatinina en orina |
CAP |
Cociente albúmina / proteína en orina |
CG |
Cockcroft-Gault |
CKD-EPI |
Chronic Kidney Disease Epidemiology Collaboration |
COB |
Cobicistat |
CPC |
Cociente proteína / creatinina en orina |
d4T |
Estavudina |
ddI |
Didanosina |
DM |
Diabetes mellitus |
DRV |
Darunavir |
DTG |
Dolutegravir |
DOR |
Doravirina |
ECV |
Enfermedad cardiovascular |
EFF |
Excreción fraccional de fosfato |
EHT |
Enfermedad hepática terminal |
ERC |
Enfermedad renal crónica |
ERT |
Enfermedad renal crónica terminal |
EFV |
Efavirenz |
EMA |
European Medicines Agency |
ENF |
Enfuvirtida |
ERC |
Enfermedad renal crónica |
ETR |
Etravirina |
EVG |
Elvitegravir |
FG |
Filtrado glomerular |
FGe |
Filtrado glomerular estimado |
FPV |
Fosamprenavir |
FRA |
Fracaso Renal Agudo |
FTC |
Emtricitabina |
GeSIDA |
Grupo de Estudio del SIDA |
GN |
Glomerulonefritis |
GRADE |
Grading of Recommendations of Assesment Development and Evaluations |
Hb |
Hemoglobina |
HbA1c |
Hemoglobina glicada |
IBA |
Ibalizumab |
HTA |
Hipertensión arterial |
IDMS |
Isotope dilution mass spectrometry (dilución isotópica – espectrometría de masas) |
IDV |
Indinavir |
IECA |
Inhibidores del enzima convertidor de la angiotensina |
IF |
Inhibidores de la fusión |
IFN |
Interferón |
INI |
Inhibidores de la integrasa |
IP |
Inhibidores de la proteasa |
IRA |
Insuficiencia renal aguda |
ISAT |
Índice de saturación de transferrina |
ITIAN |
Inhibidor/es transcriptasa inversa análogos nucleósido o nucleótido |
ITINAN |
Inhibidor/es transcriptasa inversa no análogos de nucleósidos |
Iv |
Intravenoso |
KDIGO |
Kidney Disease Improving Global Outcomes |
K/DOQI |
National Kidney Foundation Kidney/Disease Outcomes Quality Initiative |
LPV |
Lopinavir |
LPV/rtv |
Lopinavir/ritonavir |
MAT |
Microangiopatía trombótica |
MDRD |
Modification of Diet in Renal Disease |
MVC |
Maraviroc |
NAG |
n-acetil β-glucosaminidasa |
NAVIH |
Nefropatía asociada al HIV |
NFV |
Nelfinavir |
NGAL |
Lipocalina asociada a la gelatinasa de neutrófilos |
NVP |
Nevirapina |
PA |
Presión Arterial |
PAs |
Presión Arterial Sistólica |
PAd |
Presión Arterial Diastólica |
PEG |
Polietilenglicol |
PTH |
Hormona paratiroidea |
PTH-i |
Hormona paratiroidea intacta |
RBP |
Proteína enlazante del retinol |
RAL |
Raltegravir |
RCV |
Riesgo cardiovascular |
RPV |
Rilpivirina |
RTF |
Reabsorción tubular de fosfato |
RTV |
Ritonavir |
SEIMC |
Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica |
SEN |
Sociedad Española de Nefrología |
SEQC |
Sociedad Española de Bioquímica Clínica y Patología Molecular |
SIDA |
Síndrome de inmunodeficiencia adquirida |
SQV |
Saquinavir |
TAF |
Tenofovir alafenamida |
TARV |
Tratamiento antirretroviral; ídem. de alta eficacia |
TDF |
Tenofovir (disoproxil fumarato) |
TFV |
Tenofovir |
TLOVR |
Tiempo hasta la pérdida de la eficacia virológica |
THR |
Trasplante hepato-renal |
TOH |
Trasplante ortotópico hepático |
TPV |
Tipranavir |
TR |
Trasplante renal |
TRP |
Trasplante de riñón y páncreas |
VHB |
Virus de la hepatitis B |
VHC |
Virus de la hepatitis C |
Vo |
Vía oral |
VIH |
Virus de la inmunodeficiencia humana |
ZDV, AZT |
Zidovudina |
1. INTRODUCCIÓN
Desde finales de la década de los 90 se ha producido un cambio progresivo de la historia natural de la infección por el VIH de forma que en la actualidad, la mayoría de los pacientes con buena adherencia al tratamiento antirretroviral (TAR) tienen una larga esperanza de vida que se aproxima a la de la población general 1. Con la generalización del TAR y el descenso de la mortalidad por procesos relacionados con la inmunodeficiencia se ha observado un aumento de otras comorbilidades, como las enfermedades cardiovasculares y el cáncer 2.
Las enfermedades renales constituyen el prototipo de enfermedades cuya prevalencia aumenta progresivamente con el proceso de envejecimiento. En diversos estudios epidemiológicos se ha puesto de manifiesto que son más frecuentes en los pacientes con infección por el VIH que en la población general sobre todo en los de más edad 345. Además de las nefropatías asociadas específicamente con el VIH o la co-infección por el virus de la hepatitis C (VHC), la mayor prevalencia de alteraciones metabólicas y la acumulación de riesgo vascular con el envejecimiento está favoreciendo el desarrollo de enfermedad renal crónica (ERC) en las personas que viven con VIH. El reconocimiento de que determinados fármacos antirretrovirales pueden producir daño renal en algunos pacientes constituye una preocupación añadida.
Existe acuerdo general en la necesidad de desarrollar estrategias de prevención y control del daño renal en los pacientes infectados con el VIH. La ERC tiene una repercusión multiorgánica considerable, con connotaciones especiales en los pacientes que además están infectados por el VIH. La detección de la ERC oculta o subclínica es esencial ya que existen algunas medidas eficaces para retrasar su progresión, entre ellas el control estricto de la hipertensión arterial, la dislipemia y la diabetes, y evitar el uso de fármacos nefrotóxicos. Por otro lado, el desarrollo de insuficiencia renal obliga a adaptar las pautas de TAR y a ajustar las dosis de muchos fármacos antirretrovirales y de otros medicamentos necesarios para el tratamiento de las comorbilidades asociadas. Finalmente las estrategias de tratamiento renal sustitutivo (diálisis y trasplante) tienen connotaciones especiales en los pacientes con VIH. Por esta complejidad y por la rapidez con la que cambia la terapia antirretroviral es conveniente desarrollar guías específicas para el manejo de la patología renal en los pacientes con VIH y actualizarlas periódicamente.
El objetivo de este documento es proporcionar recomendaciones basadas en la evidencia científica para el manejo de la patología renal en los pacientes con infección por el VIH, actualizando las publicadas en 2009 y revisadas en 2014 por GeSIDA en colaboración con la Sociedad Española de Nefrología y la Sociedad de Análisis Clínicas 67. En este documento se han consensuado estrategias para la vigilancia, el control y la prevención del daño renal en pacientes infectados por el VIH y el TAR y renal sustitutivo en pacientes con VIH con insuficiencia renal.
El documento se dirige a todos aquellos profesionales de diferentes especialidades que atienden a pacientes con infección por el VIH.
Bibliografía:
Antiretroviral Therapy Cohort Survival of HIV-positivepatients starting antiretroviral therapy between 1996 and 2013: a collaborativeanalysis of cohort studies. Lancet HIV. 2017 Aug;4(8):e349-e356.
Masiá M, Padilla S, Álvarez D, et al. Risk, predictors, andmortality associated with non-AIDS events in newly diagnosed HIV-infectedpatients: role of antiretroviral AIDS. 2013 Jan 14;27(2):181-9.
Islam FM, Wu J, Jansson J, Wilson DP. Relative risk of renal disease among people living with HIV. A systematic review and meta-analysis. BMC Public Health 2012, 12:234.
Knobel H, Domingo P, Suarez-Lozano I, et Rate of cardiovascular, renal and bone disease and their major risks factors in HIV-infected individuals on antiretroviral therapy in Spain.Enferm Infecc Microbiol Clin. 2019; 37: 373-9.
Domingo P, Suarez-Lozano I, Gutiérrez F, et al. Predictive factors of renal impairment in HIV-infected patients on antiretroviral therapy: Results from the VACH longitudinal cohort Nefrologia. 2019 Apr
pii: S0211-6995(19)30056-6. doi: 10.1016/j.nefro.2019.01.009.
Panel de expertos del Grupo de Estudio de SIDA(GeSIDA) y del Plan Nacional sobre el SIDA(PNS). Diagnosis, treatment and prevention of renal diseases in HIV infected patients. Recommendations of the Spanish AIDS Study Group/National AIDS Plan. Enferm Infecc Microbiol Clin. 2010 Oct;28(8):520. e1-22.
Górriz JL, Gutiérrez F, Trullas JC, et al. Consensus document on the management of renal disease in HIV-infected patients. Nefrologia. 2014;34 Suppl 2:1-81.
2. METODOLOGÍA
El Panel redactor del documento está integrado por expertos en infección por el VIH/ SIDA y especialistas en Nefrología designados por la Junta Directiva de GeSIDA que han aceptado participar de forma voluntaria y altruista.Estos expertos se distribuyeron en grupos formados por dos redactores/as y un consultor/a que se encargaron de actualizar cada una de las secciones del documento. Los redactores revisaron la literatura y analizaron la evidencia científica disponible de cada uno de los apartados y redactaron un borrador con la propuesta de modificaciones a realizar en el documento previo, que fue sido revisado y aprobado por el consultor. Posteriormente, el documento fue revisado por el coordinador y el resto de los redactores/as y consultores/as, y se sometió a una revisión externa exponiéndose durante un periodo de tiempo en la web de GeSIDA. Durante este período, los profesionales a los que va dirigido el documento y otras partes interesadas tuvieron la oportunidad de sugerir cambios que fueron sometidos a consideración por el grupo y eventualmente incluidos.
En este documento la fuerza de la recomendación y la calidad de la evidencia que la sustentan se basan en el sistema GRADE (Grading of Recommendations of Assessment Development and Evaluations) 1. En términos de fuerza de recomendación se distinguen recomendaciones fuertes y débiles. En la categoría “fuerte”, el grupo recomienda firmemente seguir la pauta propuesta y en la categoría “débil” lo sugiere. La calidad de la evidencia se clasifica como alta, moderada, baja y muy baja. En aquellas situaciones en las que existía consenso en una recomendación por considerarla “de buena práctica clínica” en ausencia de evidencia científica, se utilizó el término: “Recomendación de buena práctica clínica basada en consenso”. GeSIDA, se compromete a actualizar estas guías en el futuro en función de la evolución de los conocimientos sobre este tema.
Bibliografía:
Guyatt GH, Oxman AD, Kunz R et Going from evidence to recommendations. BMJ. 2008;336:1049– 51.
Guyatt GH, Oxman AD, Vist GE, et al. GRADE: an emerging consensus on rating quality of evidence and strength of recommendations. BMJ. 2008;336:924–6.
Jaeschke R, Guyatt GH, Dellinger P et al. Use of GRADE grid to reach decisions on clinical practice guidelines when consensus is elusive. BMJ. 2008;337:744.
Guyatt GH, Oxman AD, Kunz R, et Incorporating considerations of resources use into grading recommendations. BMJ. 2008;336:1170–3.
Guyatt GH, Oxman AD, Kunz R et What is “quality of evidence” and why is it important to clinicians? BMJ. 2008;336:995–8.
3. RIESGO RENAL EN PACIENTES CON VIH
3.1. FACTORES DE RIESGO RENAL. NEFROTOXICIDAD DEL TRATAMIENTO ANTIRRETROVIRAL
3.2. ENFERMEDADES RENALES MÁS FRECUENTES EN PACIENTES CON VIH
3.3. EVALUACIÓN DEL RIESGO RENAL Y ESTRATEGIAS DE PREVENCIÓN
FACTORES DE RIESGO RENAL. NEFROTOXICIDAD DEL TRATAMIENTO ANTIRRETROVIRAL
La ERC, definida como un filtrado glomerular estimado (FGe)< 60 mL/min o lesión renal (presencia de proteinuria, albuminuria, alteraciones histológicas en la biopsia, en el sedimento urinario o en técnicas de imagen) durante ≥ 3 meses, es un problema de salud pública de importancia creciente. Su prevalencia en pacientes con VIH es muy variable, dependiendo de las poblaciones estudiadas y de las definiciones empleadas, siendo mayor en individuos de raza negra y en entornos con menor acceso al TAR. En un metaanálisis reciente la prevalencia global de ERC fue del 4,8 % (FGe< 60 mL/min/1,73 m², usando la fórmula CKD-EPI), con grandes diferencias regionales 1.En una cohorte española, que incluyó a casi 9.000 pacientes, la prevalencia fue del 5,1 % 2, siendo del 26,2 % en mayores de 65 años.
Los principales factores de riesgo para la aparición de ERC en pacientes con infección por el VIH descritos en la literatura son los siguientes: hipertensión arterial (HTA), diabetes mellitus (DM), edad avanzada, factores genéticos, raza negra, historia familiar de ERC, coinfección por virus de la hepatitis B (VHB) o VHC, nadir de CD4 bajo, elevada carga viral del VIH, uso de medicación potencialmente nefrotóxica y haber presentado previamente un evento cardiovascular Tabla 1. Utilizando la escala de riesgo de ERC de la cohorte D:A:D 3 en población española, el 53,3% de los pacientes mayores de 55 años tendrían un riesgo elevado de ERC en los próximos 5 años 4. Es previsible que la frecuencia de ERC aumente en relación con el aumento en la esperanza de vida de los pacientes infectados por el VIH que reciben TAR.
Algunos fármacos antirretrovirales pueden producir toxicidad renal debido principalmente a alteraciones funcionales de las proteínas transportadoras en las células epiteliales del túbulo contorneado proximal, toxicidad mitocondrial, lesión vascular y precipitación de cristales a nivel tubular Tabla 1. Los fármacos implicados en la mayoría de los casos de toxicidad renal son el tenofovir (TFV), sobre todo la formulación disoproxil fumarato (TDF), y los inhibidores de la proteasa (IP). Aunque TDF es un fármaco en general seguro y bien tolerado, es el principal antirretroviral implicado en casos de nefrotoxicidad, siendo la manifestación más frecuente la tubulopatía proximal subclínica (discreta proteinuria y fosfaturia), si bien entre el 1% y el 2% de los pacientes desarrollará toxicidad clínicamente relevante que obligará a retirar el fármaco (ver más adelante). La toxicidad de TDF suele ser reversible al retirar el fármaco, aunque la recuperación puede no ser completa, principalmente cuando coexisten otros factores de riesgo renal. Los factores de riesgo de toxicidad del TDF son los mismos que los de ERC Tabla 1, a los que hay que añadir el uso concomitante de potenciadores farmacocinéticos, como ritonavir (RTV) o cobicistat (COBI) que incrementan las concentraciones de tenofovir por interacción a nivel de los transportadores renales. La nefrotoxicidad de TDF es particularmente baja cuando se usa en combinación con FTC en profilaxis pre-exposición (PrEP) 5.A diferencia de TDF, tenofovir alafenamida (TAF) tiene una semivida plasmática extraordinariamente corta, mientras que sus concentraciones intracelulares en células monucleares multiplican por seis las de TDF 6. A este respecto, resulta esencial la pobre afinidad del receptor de TFV en la célula epitelial tubular proximal renal, lo que limita su acumulación en su interior y eventualmente su acción mitocondriotóxica por acumulación. TAF se ha coformulado con emtricitabina (FTC), elvitegravir (EVG)/COBI, rilpivirina (RPV), darunavir (DRV)/COBI y bictegravir (BIC). En todos los ensayos pivotales con estas co-formulaciones se ha evidenciado de forma consistente un menor efecto sobre el filtrado glomerular (FG) y sobre los biomarcadores de daño tubular que con TDF 6. De forma adicional, en los ensayos de switch desde TDF a TAF, se ha observado una mejoría de la función renal 6.
Debe recordarse que algunos fármacos antirretrovirales interfieren con la secreción tubular activa de creatinina, provocando elevaciones espurias de la misma con descenso ligero del FGe a partir de la creatinina durante las primeras semanas de tratamiento, sin que esto signifique un descenso real del FG. Se han identificado interacciones con el transporte de la creatinina con RPV, dolutegravir (DTG) y COBI. Mientras que RPV y DTG inhiben principalmente el transportador renal de cationes orgánicos tipo 2 (OCT2), COBI inhibe sobre todo el transportador de expulsión de tóxicos y fármacos tipo 1 (MATE1).
ENFERMEDADES RENALES MÁS FRECUENTES EN PACIENTES CON VIH
El espectro de nefropatías relacionadas con la infección por VIH es muy diverso, abarcando aquellas asociadas directamente con la propia infección vírica (nefropatía asociada al VIH, NAVIH), las atribuidas a la reacción inmunológica sistémica que provoca, a coinfecciones, y las relacionadas con la toxicidad de los fármacos Tabla 2. En el momento de plantear el diagnóstico diferencial hay una serie de factores clave a considerar como la raza, el estado de control del VIH, la presencia o no de coinfecciones, como el VHC, y el tratamiento recibido, tanto el TAR como otros fármacos concomitantes. La prevalencia de las diversas nefropatías ha variado considerablemente a lo largo de los años, fruto principalmente del inicio cada vez más precoz del TAR y del uso de pautas más eficaces y menos tóxicas. Es destacable la menor incidencia de NAVIH, con un mayor predominio actualmente de la hialinosis segmentaria y focal clásica, asociada al envejecimiento y a los factores de riesgo cardiovascular, como la HTA y la DM, entre otros 7.
NEFROPATÍA ASOCIADA AL VIH
La NAVIH es una nefropatía fruto de la infección directa del VIH sobre las células epiteliales renales, principalmente los podocitos y las células tubulares7, por lo que para que aparezca debe haber viremia detectable. Es mucho más frecuente en pacientes de raza negra (12:1) 8, y predominantemente, aunque no de forma exclusiva,en aquellos que presentan determinadas variantes genéticas en APOL1 9. La manifestación central de la NAVIH es la proteinuria, habitualmente severa, con síndrome nefrótico e insuficiencia renal progresiva, con un sedimento urinario generalmente normal, y raramente acompañada de HTA. Ecográficamente los riñones son de tamaño normal o aumentado y característicamente con marcada hiperecogenicidad. Su sustrato histológico es una glomeruloesclerosis segmentaria y focal de tipo colapsante, junto con una intensa afectación tubulointersticial y dilatación de los túbulos renales, que en ocasiones forman auténticos pseudoquistes.
Es una podocitopatía, sin presencia de depósito de inmunocomplejos, por lo que la inmunofluorescencia es negativa o muestra solamente depósitos glomerulares inespecíficos de IgM y C3, dato importante para el diagnóstico diferencial 10. La evolución de la NAVIH sin TAR es desfavorable, con un rápido desarrollo de la insuficiencia renal que requiere diálisis dentro del primer año del diagnóstico, y con una elevada mortalidad. Desde la introducción y generalización del TAR, el curso clínico de la NAVIH es considerablemente más lento y su incidencia ha descendido drásticamente. El diagnóstico de NAVIH es una indicación absoluta de inicio de TAR 11, que debe asociarse, si no hay contraindicación, al bloqueo del sistema renina-angiotensina mediante inhibidores de la enzima convertidora de la angiotensina (IECA) o antagonistas de los receptores de la angiotensina-2 (ARA- 2) 12. El tratamiento con corticoides se reserva para pacientes con enfermedad renal progresiva a pesar del TAR y ARA II o IECAs y que presenten un marcado componente inflamatorio intersticial o semilunas en la biopsia renal, siempre sopesando el balance riesgo/beneficio en los enfermos con mayor deterioro de la inmunidad.
GLOMERULOPATÍAS POR DEPÓSITO DE INMUNOCOMPLEJOS
No es una sola entidad, sino que engloba un variado grupo de glomerulopatías con patogenia, presentación clínica e histología diversa, que se caracterizan por el depósito glomerular de inmunocomplejos, generados a partir de antígenos propios del VIH o de otras infecciones concomitantes, como pueden ser el VHB o el VHC. En este grupo no existe una clara predisposición por la raza, aunque se han descrito sobretodo en caucásicos y asiáticos 13. Clínica e histológicamente es difícil determinar si la glomerulopatía está relacionada con el propio virus o con otras coinfecciones, o si realmente es una nefropatía “primaria” coincidente.
Para caracterizar el tipo de glomerulopatía debe realizarse una biopsia renal. Se han identificado en este grupo la nefropatía IgA asociada al VIH, glomerulonefritis postinfecciosa, glomerulonefritis tipo lupus-like, glomerulonefritis membranoproliferativa, glomerulonefritis crioglobulinémica, glomerulonefritis proliferativa mesangial y nefropatía membranosa 13. Debido a que la presentación y la evolución clínica es diferente en función del substrato histológico, la tendencia actual es a denominarlas por el tipo histológico específico seguido por “en el contexto de infección por VIH” y abandonar la nomenclatura genérica de “Nefropatía por inmunocomplejos asociada al VIH (HIVICK en su acrónimo inglés, “HIV immune complex kidney disease”)” 14.
Las manifestaciones clínicas son diversas y dependen en gran medida del substrato histológico subyacente Tabla 3. Son nefropatías proteinúricas, aunque suele predominar en muchas de ellas el perfil nefrítico con hematuria y disfunción renal variables, HTA y retención hidrosalina. Los datos disponibles sobre el tratamiento de estas nefropatías en pacientes con infección por el VIH son muy limitados. El tratamiento se basa, como en la NAVIH, en el inicio del TAR y el bloqueo del sistema renina-angiotensina mediante IECA o ARA-II, además del tratamiento específico de la infección subyacente si la hubiera y si se considerara implicada en su patogenia. El tratamiento inmunosupresor se reserva para aquellos casos con una presentación clínica o histológica agresiva, siempre tras el inicio de TAR, y sopesando el balance riesgo-beneficio.
Mención aparte merece el tratamiento de la glomerulonefritis membranoproliferativa o crioglobulinémica asociada al VHC ya que en estos casos además hay indicación absoluta de inicio de tratamiento dirigido frente al VHC.
MICROANGIOPATÍA TROMBÓTICA
Es uno de los procesos directamente relacionados con el VIH que puede aparecer en pacientes con cargas virales elevadas y recuentos de CD4 bajos 7. La incidencia sin embargo se ha reducido notablemente en la era del TAR. Clínicamente se presenta como una insuficiencia renal progresiva con HTA, que puede ser severa, proteinuria y hematuria variables, asociada a signos de anemia hemolítica microangiopática, con o sin afectación neurológica. La evolución suele ser agresiva, con insuficiencia renal irreversible y elevada mortalidad. El tratamiento se basa en la instauración de plasmaféresis con infusión de plasma fresco y TAR. En casos refractarios se puede considerar la utilización de eculizumab, un inhibidor específico de la fracción C5 del complemento 15.
NEFROPATÍAS TUBULOINTERSTICIALES
Los pacientes con infección por el VIH pueden presentar una amplia variedad de nefropatías tubulointersticiales, la gran mayoría de ellas relacionadas con los tratamientos farmacológicos recibidos.
TUBULOPATÍA PROXIMAL
En los pacientes con infección por el VIH la causa más frecuente de tubulopatía proximal es el uso de algunos fármacos antirretrovirales, principalmente TFV, sobre todo la formulación TDF 16 y con menor frecuencia otros análogos de nucleósidos como didanosina (ddI) y estavudina (d4T) 17. Habitualmente se presenta de forma incompleta y subclínica, con fosfaturia e hipofosfatemia variable, glucosuria normoglucémica y proteinuria leve o moderada, aunque pueden desarrollarse formas más severas. El síndrome de Fanconi es la expresión clínica más florida de la disfunción tubular proximal, caracterizado por un defecto generalizado en la capacidad de reabsorción a este nivel.
Se manifiesta con fosfaturia y uricosuria desproporcionadas, con desarrollo de hipofosfatemia e hipouricemia, aminoaciduria, glucosuria normoglucémica, hipopotasemia y acidosis tubular renal tipo II, así como proteinuria de tipo tubular, habitualmente menor de 2 g/día. La lesión puede progresar a necrosis tubular e insuficiencia renal, que puede cronificarse. Los pacientes clínicamente refieren astenia, poliuria y polidipsia por incapacidad de concentrar la orina, y si el proceso lleva tiempo de evolución llegan a presentar dolores óseos por el desarrollo de osteomalacia hipofosfatémica.
La retirada del fármaco causante tiende a resolver lentamente el proceso, aunque no siempre la recuperación es completa. En algunos pacientes que habían desarrollado tubulopatía con TDF, se ha descrito mejoría de los parámetros renales tras el cambio a TAF 19, aunque también se han publicado casos esporádicos de síndrome de Fanconi relacionados con el uso de TAF 20.
NEFRITIS INTERSTICIAL INMUNOALÉRGICA
Es un proceso inflamatorio tubulointersticial secundario a una reacción inmunoalérgica a diversos fármacos. Debe sospecharse en todo paciente con insuficiencia renal aguda o subaguda de causa no evidente, particularmente en presencia de proteinuria leve o moderada (con escasa albuminuria), leucocituria estéril y ante el inicio reciente de un tratamiento con un nuevo fármaco. La asociación de eosinofilia periférica, rash cutáneo y febrícula debe sugerir este diagnóstico, aunque este cortejo sindrómico aparece en un bajo porcentaje de casos 21. Los antibióticos (penicilinas, cefalosporinas, rifampicina, trimetoprim/sulfametoxazol), los antiinflamatorios no esteroideos (AINEs) y los inhibidores de la bomba de protones son los fármacos que con más frecuencia se relacionan con nefritis intersticial. Entre los fármacos antirretrovirales, aunque con baja frecuencia, se han descrito casos con el uso de abacavir [ABC], indinavir [IDV], atazanavir [ATV] o efavirenz 22. La biopsia renal es la única forma de establecer el diagnóstico definitivo, objetivando un infiltrado intersticial difuso habitualmente rico en eosinófilos 21. La rápida retirada del fármaco causante es la base principal del tratamiento. Junto a ello, un ciclo corto de corticoides (de 4-6 semanas) favorece la recuperación completa de la función renal 23, aunque en ocasiones puede permanecer como secuela cierto grado de insuficiencia renal crónica.
NEFROPATÍA OBSTRUCTIVA INTRARRENAL POR DEPÓSITO DE CRISTALES
Se produce por el depósito tubular masivo de cristales tras el tratamiento con fármacos con baja solubilidad en orina, sobre todo ante elevadas concentraciones y determinados pH urinarios 24. Los fármacos implicados en los pacientes con infección por el VIH pueden ser la sulfadiazina, IDV, ATV, foscarnet y aciclovir a dosis altas. Con IDV y ATV se ha descrito también nefrolitiasis por acúmulo de los mismos cristales excretados. Se ha descrito la presencia de cristaluria en pacientes tratados con DRV aunque no se ha documentado repercusión clínica significativa 22. Una buena hidratación es importante para prevenir y tratar esta complicación, que suele ser reversible.
NECROSIS TUBULAR AGUDA
La lesión de la célula tubular por isquemia o toxicidad directa de determinados fármacos genera un cuadro de insuficiencia renal aguda, habitualmente reversible en días o semanas pero que, en determinadas circunstancias, puede comportar una recuperación incompleta y una situación de ERC residual. Los pacientes con infección por el VIH son una población de riesgo por la pluripatología que a menudo tienen, los procesos sépticos intercurrentes que pueden padecer y la eventual exposición a múltiples fármacos nefrotóxicos. La rabdomiólisis también es una potencial causa de lesión tubular aguda en esta población.
INSUFICIENCIA RENAL CRÓNICA INESPECÍFICA
Además de los procesos glomerulares y tubulointersticiales, cuyas manifestaciones clínicas son en general más evidentes, diversos pacientes con infección por el VIH presentan ERC caracterizada por un descenso del FG de severidad variable, con proteinuria leve o negativa y sin alteraciones significativas del sedimento. La causa de la ERC en estos casos es probablemente multifactorial, difícil de filiar, posiblemente como secuela de episodios previos de fracaso renal agudo resueltos de manera incompleta, o por el efecto nefrotóxico de determinados tratamientos mantenidos durante años, incluidos ciertos fármacos antirretrovirales.
NEFROPATÍA DIABÉTICAY NEFROPATÍA HIPERTENSIVA
En cohortes de nuestro entorno, la HTA estaba presente en un 22% y la DM en un 16% de los pacientes con infección por el VIH 4. Esto implica que, al igual que en la población general, es esperable que aumente de forma progresiva el riesgo de daño renal asociado a estos procesos. Series de biopsias renales de pacientes con infección por el VIH reflejaban la presencia de nefropatía diabética como diagnóstico histológico en el 6%, y nefropatía hipertensiva con nefroangioesclerosis en el 4% de los casos 25.El tratamiento de estas entidades se basa en el control de la DM y la HTA, con la utilización de IECA o ARA-II si no hay contraindicación.
EVALUACIÓN DEL RIESGO RENAL Y ESTRATEGIAS DE PREVENCIÓN
La presencia de ERC afecta la elección y dosificación de los fármacos antirretrovirales de eliminación renal. Antes de iniciar el TAR debe medirse la función renal y estimar el riesgo de que se desarrolle enfermedad renal o, si ya existe daño renal, se produzca una progresión. Los principales factores de riesgo renal en pacientes con VIH se detallan en la Tabla 1. Se han desarrollado escalas que estratifican el riesgo de desarrollar ERC 327, que pueden ayudar en la toma de decisiones. En general se considera que el riesgo renal es elevado ante la presencia de alguno o varios de los factores siguientes: a) FGe ≤ 70 mL/min; b) proteinuria (cociente proteína/creatinina en orina [CPC]> 50 mg/L); c) edad> 60 años; d) linfocitos CD4 < 200 cels/mL; e) coinfección por VHC; f) DM; g) HTA, y h) enfermedad cardiovascular. En estos casos debe evitarse el uso de fármacos nefrotóxicos como el TDF, lopinavir/ritonavir (LPV/r) y el ATV 14. Se consideran criterios de progresión: a) el cambio hacia un estadio de ERC más avanzado acompañado de una disminución del FGe>25 % respecto al valor basal, o b) el descenso mantenido del FGe>5 mL/min/1.73m²/año. Así mismo, el cambio hacia una categoría superior de albuminuria o un aumento de más del 50 % del cociente albúmina/creatinina en orina [CAC] respecto al valor basal, pueden ser indicadores de progresión.
Los factores de riesgo de progresión y las estrategias de intervención para prevenir o frenar el desarrollo de la ERC se muestran en la Tabla 4. Se pueden resumir en tres intervenciones: a) fomentar un estilo de vida saludable (dieta, tabaquismo, reducir peso si existe sobrepeso u obesidad, ejercicio físico) y evitar el uso de fármacos nefrotóxicos; b) tratar adecuadamente la dislipemia y la DM; c) iniciar IECAS o ARAII si existe HTA o proteinuria; d) modificar el TAR retirando los fármacos antirretrovirales potencialmente nefrotóxicos si el riesgo renal es elevado o hay indicadores de progresión de daño renal: FGe ≤ 60 mL/min, CPC > 50 mg/L, tubulopatía renal proximal, FGe> 60 mL/min pero con disminución del FGe en 5 mL/min por año durante al menos 3 años consecutivos o disminución del FGe del 25% desde el inicio, presencia de comorbilidades con alto riesgo de nefrotoxicidad (DM, HTA) y/o uso de inhibidores de la proteasa o de la integrasa potenciados con RTV o COBI.
Recomendaciones
- Se recomienda estratificar el riesgo de ERC antes de iniciar el TAR con el objetivo de identificar a los pacientes con mayor probabilidad de desarrollar ERC. Recomendación de buena práctica clínica basada en consenso.
- Para la prevención de la ERC se recomienda un estilo de vida saludable: dieta, tabaquismo, reducción del peso si sobrepeso u obesidad y ejercicio físico. Recomendación de buena práctica clínica basada en consenso.
- En pacientes con alto riesgo de ERC, se recomienda no usar fármacos nefrotóxicos, especialmente TDF. Grado de recomendación: Fuerte; Calidad de la evidencia: Alta.
- Se recomienda retirar los antirretrovirales nefrotóxicos en cualquiera las siguientes circunstancias: FGe ≤ 60 mL/min; CPC≥50 mg/L; tubulopatía renal proximal; descenso del FGe≥ 25% respecto al inicial y/o caída anual≥ 5 mL/min/año durante 3 años consecutivos; comorbilidades con alto riesgo de nefrotoxicidad (diabetes, HTA); uso de IP o de la integrasa potenciados con RTV o COBI. Grado de recomendación: Fuerte; Calidad de la evidencia: Moderada.
- Se recomienda tratar adecuadamente la dislipemia y la DM. Grado de recomendación: Fuerte; Calidad de la evidencia: Alta.
- Se recomienda iniciar IECAS o ARAII si HTA o proteinuria. Grado de recomendación: Fuerte; Calidad de la evidencia: Alta.
Tablas:

VHC, virus de la hepatitis C; VHB, virus de la hepatitis B; IECAs, inhibidores del enzima convertidor de la angiotensina; ARA-2, antagonistas del receptor de la angiotensina 2.
a Nefrotoxicidad directa; b Cristaluria; c Alteración hemodinámica glomerular.
*Requieren ajuste de dosis en situación de insuficiencia renal


NAVIH, nefropatía asociada al VIH; GNMP, glomerulonefritis membranoproliferativa; IgA, nefropatía IgA; GSF, glomeruloesclerosis segmentaria y focal no colapsante; GNM, glomerulonefritis membranosa; GNA, glomerulonefritis agudas postinfecciosas. VHC, virus de la hepatitis C; VHB, virus de la hepatitis B ; (+), la característica o marcador se presenta generalmente en la nefropatía con mayor o menor intensidad; (-), la característica no se presenta generalmente en esa nefropatía
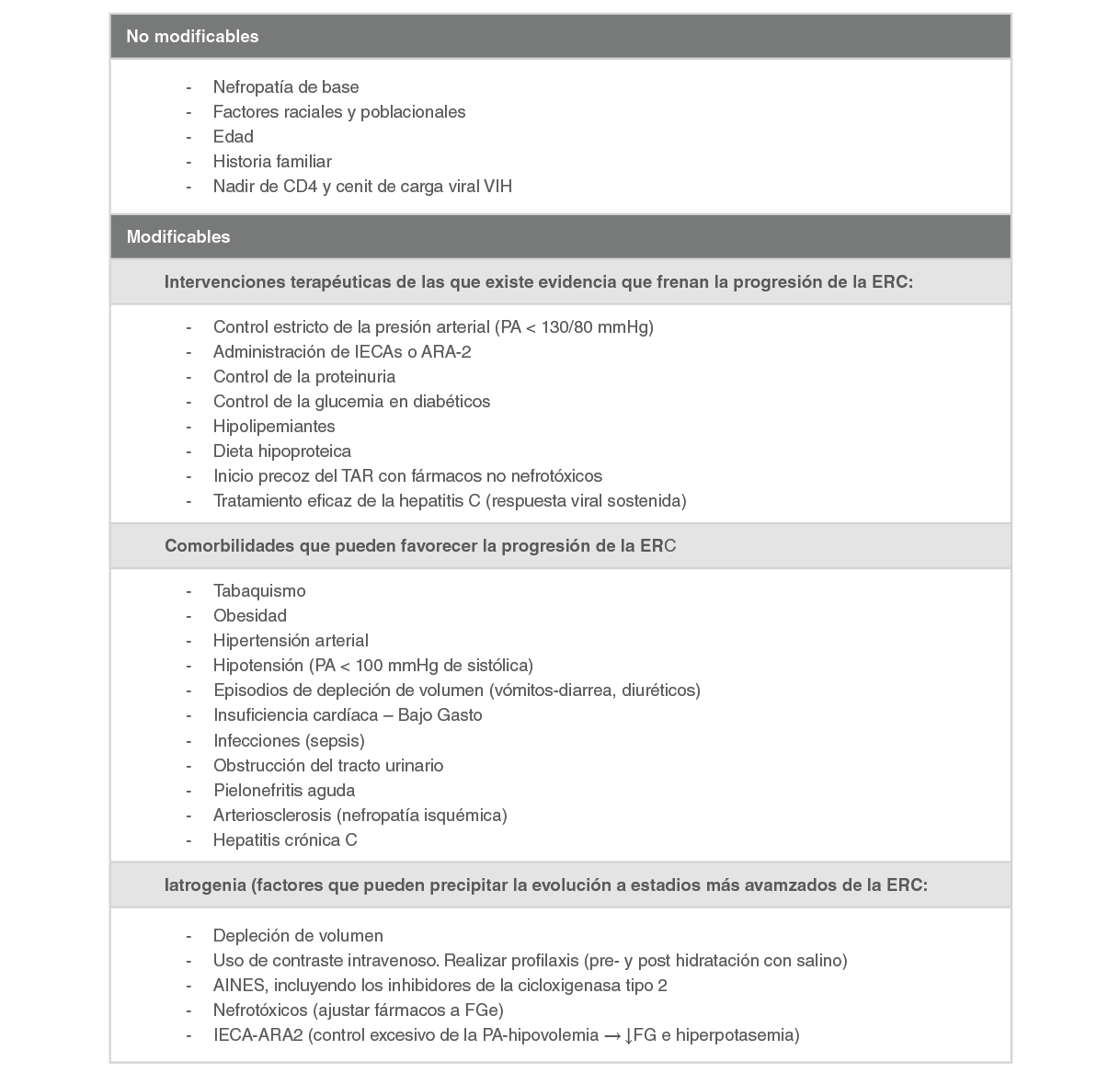
PA, presión arterial; ERC, enfermedad renal crónica; IECAs, inhibidores del enzima convertidor de la angiotensina; ARA-2, antagonistas del receptor de la angiotensina 2; AINES, antiinflamatorios no esteroideos; FGe, filtrado glomerular estimado.
Bibliografía:
Ekrikpo UE, Kengne AP, Bello AK, et al. Chronic kidney disease in the global adult HIV-infected population: A systematic review and meta-analysis. PLoS ONE 2018; 13(4): e0195443.
Knobel H, Domingo P, Suarez-Lozano I, et al. Rate of cardiovascular, renal and bone disease and their major risks factors in HIV-infected individuals on antiretroviral therapy in Spain.Enferm Infecc Microbiol Clin. 2019; 37: 373-9
Mocroft, A., Lundgren, J.D., Ross, M. et al. Development and validation of a risk score for chronic kidney disease in HIV infection using prospective cohort data from the D:A:D study. PLoS Med. 2015;12: e1001809
Domingo P, Suarez-Lozano I, Gutierrez F, et al. Predictive factors of renal impairment in HIV-infected patients on antiretroviral therapy: Results from the VACH longitudinal cohort study. Nefrologia. 2019 Apr
24. pii: S0211-6995(19)30056-6. doi: 10.1016/j.nefro.2019.01.009Pilkington V, Hill A, Hughes S, Nwokolo N, Pozniak A. How safe is TDF/FTC as PrEP? A systematic review and meta-analysis of the risk of adverse events in 13 randomised trials of PrEP.J Virus Erad. 2018 Oct 1;4(4):215-24.
Wang H, Lu X, Yang X, Xu N. The efficacy and safety of tenofovir alafenamide versus tenofovir disoproxil fumarate in antiretroviral regimens for HIV-1 therapy: Meta-analysis.Medicine (Baltimore). 2016;95:e5146.
Cohen SD, Kopp JB, Kimmel PL. Kidney Diseases Associated with Human Immunodeficiency Virus Infection. N Engl J Med. 2017 Dec 14;377(24):2363-74.
Rosenberg AZ, Naicker S, Winkler CA, Kopp JB. HIV-associated nephropathies: epidemiology, pathology, mechanisms and treatment. Nat Rev Nephrol. 2015 Mar;11(3):150-60.
Fine DM, Wasser WG, Estrella MM, et al.. APOL1 risk variants predict histopathology and progression to ESRD in HIV-related kidney disease. J Am Soc Nephrol 2012;23:343-50.
D'Agati V, Appel GB. Renal pathology of human immunodeficiency virus infection. Semin Nephrol 1998;18(4):406-21
Atta MG, Gallant JE, Rahman MH, et al. Antiretroviral therapy in the treatment of HIV-associated nephropathy. Nephrol Dial Transplant 2006;21(10):2809-2813.
Wei A, Burns GC, Williams BA, Mohammed NB, Visintainer P, Sivak SL. Long-term renal survival in HIV- associated nephropathy with angiotensin-converting enzyme inhibition. Kidney Int 2003;64(4):1462-71
Nobakht E, Cohen SD, Rosenberg AZ, et al. HIV-associated immunecomplex kidney disease. Nat Rev Nephrol. 2016;12:291–300.
Swanepoel CR, Atta MG, D’Agati VD, et al. Kidney disease in the setting of HIV infection: conclusions from a kidney disease: improving global outcomes (KDIGO) controversies conference. Kidney Int. 2018;93(3):545–59.
Jin A, Boroujerdi-Rad L, Shah G, Chen JL. Thrombotic microangiopathy and human immunodeficiency virus in the era of eculizumab. Clin Kidney J 2016; 9: 576-9.
Gupta SK. Tenofovir-associated Fanconi syndrome: review of the FDA adverse event reporting system. AIDS Patient Care STDS 2008;22(2):99-103.
Nelson M, Azwa A, Sokwala A, Harania RS, Stebbing J. Fanconi syndrome and lactic acidosis associated with stavudine and lamivudine therapy. AIDS 2008; 22(11):1374-6.
D'Ythurbide G, Goujard C, Mechai F, Blanc A, Charpentier B, Snanoudj R. Fanconi syndrome and nephrogenic diabetes insipidus associated with didanosine therapy in HIV infection: a case report and literature review. Nephrol Dial Transplant 2007; 22(12):3656- 9.
Mothobi NZ, Masters J, Marriott DJ. Fanconi syndrome due to tenofovir disoproxil fumarate reversed by switching to tenofovir alafenamide fumarate in an HIV-infected patient. Ther Adv Infect Dis. 2018 Jul 10;5(5):91-5
Bahr NC, Yarlagadda SG. Fanconi Syndrome and Tenofovir Alafenamide: A Case Report. Ann Intern Med 2019;170(11):814–5
Praga M, González E. Acute interstitial nephritis. Kidney Int 2010;77:956-61.
Renal effects of non-tenofovir antiretroviral therapy in patients living with HIV. Drugs Context. 2018 Mar 21;7:212519.
Fernández Juárez GM, Villacorta Pérez J, Caravaca Fontán F, Cases Corona C, Sánchez Alamo B, Tato Ribera AM. New challenges in tubulointerstitial nephritis induced by drugs. Nefrologia. 2019 May 7. pii: S0211-6995(19)30059-1. doi:10.1016/j.nefro.2019.02.003
de Lastours V, Ferrari Rafael De Silva E, Daudon M, et al. High levels of atazanavir and darunavir in urine and crystalluria in asymptomatic patients. J Antimicrob Chemother. 2013;68(8):1850-6
Szczech LA, Gupta SK, Habash R, et al. The clinical epidemiology and course of the spectrum of renal diseases associated with HIV infection. Kidney Int 2004;66(3):1145-52.
Wyatt CM, Morgello S, Katz-Malamed R, et al. The spectrum of kidney disease in patients with AIDS in the era of antiretroviral therapy. Kidney Int 2009;75:428-34.
Scherzer, R., Gandhi, M., Estrella, M.M. et al. A chronic kidney disease risk score to determine tenofovir safety in a prospective cohort of HIV-positive male veterans. AIDS. 2014; 28: 1289–95.
Hill A, Hughes SL, Gotham D, Pozniak AL. Tenofovir alafenamide versus tenofovir disoproxil fumarate: is there a true difference in efficacy and safety? J Virus Erad. 2018 Apr 1;4(2):72-9.
4. CRIBADO Y MONITORIZACIÓN RENAL
La evaluación periódica de la función renal y de los marcadores de lesión renal tiene como principales objetivos la detección precoz de ERC y su seguimiento, así como el ajuste de dosis de fármacos potencialmente nefrotóxicos o de eliminación renal.
En estas recomendaciones las pruebas empleadas para evaluar la lesión renal se han clasificado en “estudio renal básico o cribado”, que se recomienda efectuar a todos los pacientes con infección por el VIH, y “estudio renal ampliado”, que debe realizarse en pacientes seleccionados. Conviene recordar la importancia de recoger en la anamnesis los antecedentes personales o familiares de nefropatías y los factores que implican un mayor riesgo para su desarrollo Tabla 1, así como el registro de la tensión arterial (TA) y el peso corporal.
El estudio renal básico incluirá la medida de la creatinina sérica y el FGe, el CPC (y CAC en caso de DM o HTA) en la primera orina de la mañana, el sedimento urinario y una evaluación básica de la función tubular (concentración sérica de fosfato, CPCy glucosuria mediante tira reactiva) Tabla 5.
El estudio renal ampliado se realizará cuando se haya detectado una alteración en el estudio básico, ya sea por alteración del FGe, presencia de proteinuria, glucosuria o hematuria, o descenso del fosfato sérico. Debe tratar de identificarse la causa y determinar el pronóstico, por lo que puede requerirse marcadores adicionales en sangre y orina Tabla 5 y eventualmente pruebas de imagen y biopsia renal.
EVALUACIÓN DE LA FUNCIÓN RENAL
Para la evaluación de la función renal se utiliza la concentración de creatinina sérica y el FGe.Aunque la creatinina sérica por su simplicidad sigue siendo la magnitud biológica más utilizada, es un biomarcador impreciso a causa de su manifiesta variabilidad biológica interindividual, condicionada por la edad, el sexo y la masa muscular, lo que limita la utilidad de los valores de referencia poblacionales en la detección precoz de alteraciones de la función renal.
Actualmente, para evaluar la función renal en la práctica clínica se recomienda el FGe mediante la ecuación CKD-EPI (Chronic Kidney Disease Epidemiology Collaboration) 1 que tiene en consideración, además de la creatinina sérica, otras variables como la edad, el sexo y la raza. La ecuación CKD-EPI permite estimar con una precisión aceptable filtrados glomerularesde hasta 90 mL/min/1.73m² 2 y sus resultados se correlacionan mejor con el FG medido que los obtenidos con otras ecuaciones; esto es particularmente importante para valores de FG < 60 mL/min/1,73m², que son los más susceptibles de requerir ajuste de dosis de fármacos 3456.
La medida de la concentración sérica de cistatina C se había propuesto como un marcador útil para valorar la función renal ya que su concentración es independiente de la masa muscular, es filtrada por el glomérulo y completamente reabsorbida por el túbulo renal 7. Sin embargo, en pacientes con VIH se ha observado que puede elevarse en pacientes con concentraciones altas de proteína C reactiva, cargas virales elevadas y recuentos bajos de linfocitos CD4+ 8. Los escasos estudios realizados, la heterogeneidad en los resultados obtenidos y su elevado coste, no permiten hoy por hoy, la recomendación de inclusión de la cistatina C como marcador de función renal en el cribado y seguimiento de los pacientes con infección por el VIH.
La medida del aclaramiento de creatinina (utilizando orina de 24 horas), no aporta ninguna ventaja sobre la estimación del FG mediante la ecuación CKD-EPI, ya que está sujeto a una mayor variabilidad, además de los inconvenientes que presenta para los pacientes la recogida de orina de 24 horas. Su uso quedaría restringido a aquellas situaciones en las que la utilización de una ecuación de estimación del FG no es adecuada, como en el caso de individuos que siguen dietas especiales, pesos extremos (índice de masa corporal
< 19 kg/m² o > 35 kg/m²), alteraciones importantes en la masa muscular o hepatopatía grave 9, situaciones no excepcionales en la población con infección por el VIH.
Es importante recordar que existen determinados fármacos que pueden provocar una elevación de la concentración de creatinina por inhibición de su secreción activa tubular. Este efecto provoca un descenso espurio del FGe por las ecuaciones que se basan en las concentraciones séricas de creatinina o en el cálculo del aclaramiento de creatinina en orina de 24 horas, sin que exista una verdadera disminución del FG real. Los principales fármacos implicados son el trimetoprim (habitualmente coformulado con sulfametoxazol), la cimetidina (antiácido poco prescrito en la actualidad) y diversos fármacos antirretrovirales como RPV, DTG, BIC o COB 10. Esta característica puede generar preocupación al clínico sobre todo si se administra juntamente con fármacos potencialmente nefrotóxicos, como TFV. En estos casos sólo la estimación del FG a partir de la cistatina C o la utilización de métodos isotópicos más complejos, si se requiere una medida precisa del FG, podrían ser suficientemente fiables. Estos métodos, sin embargo, además de ser costosos y no estar exentos de limitaciones, no están al alcance de todos los centros.
Para poder diferenciar entre una elevación de la creatinina debida a un bloqueo de su secreción tubular o un deterioro real del FG deberán tenerse en cuenta las siguientes consideraciones:
- Debe conocerse el potencial efecto de los fármacos referidos sobre la concentración sérica de creatinina.
- El incremento de la concentración sérica de creatinina debido al bloqueo de su secreción tubular debe ser leve, habitualmente < 30% de la concentración de creatinina inicial, y aparecer de forma precoz tras la administración del fármaco, frecuentemente durante los primeros días,y posteriormente mantenerse estable si la situación clínica y metabólica del paciente no Para confirmar la estabilidad se recomienda repetir la medición en un plazo máximo de 4 semanas.
- Tras la retirada del fármaco la concentración sérica de creatinina vuelve a sus valores basales.
- No se acompañará de otros datos de nefropatía: la concentración sérica de urea se mantendrá invariable a diferencia de lo que ocurre con la creatinina, y no se acompañará de proteinuria, glucosuria normoglicémica ni alteraciones del sedimento
Otros fármacos como los fibratos pueden también asociarse a un aumento de la concentración sérica de creatinina por mecanismos no bien esclarecidos 12.
MARCADORES URINARIOS DE DAÑO RENAL
LA MEDIDA DEL COCIENTE PROTEÍNAS/CREATININA Y/O ALBÚMINA/CREATININA EN LA PRIMERA ORINA DE LA MAÑANA.
La concentración persistentemente elevada de proteínas o de albúmina en orina es un signo de lesión renal y junto con el descenso del FG constituyen los criterios más utilizados para el diagnóstico y clasificación en estadios de la ERC. La proteinuria es un mejor marcador de progresión a enfermedad renal terminal que la disminución del FG 14 y es un factor de riesgo cardiovascular y de mortalidad 15.
Para la selección de la magnitud biológica a utilizar en la evaluación de la proteinuria deben considerarse tanto el contexto clínico del paciente como aspectos metodológicos relacionados con la medida de albúmina y proteínas en orina.
Debe conocerse la existencia de diversos tipos de proteinuria: glomerular y tubular. La proteinuria glomerular, secundaria a diversas glomerulopatías o a la presencia de nefropatía diabética o hipertensiva, se produce como consecuencia de un daño en el glomérulo que ocasiona un aumento de la permeabilidad de la pared del capilar glomerular al paso de proteínas. Está constituida predominantemente por albúmina. La proteinuria tubular, secundaria a nefropatías tubulointersticiales o a la toxicidad asociada al tratamiento con antirretrovirales, se produce como consecuencia de un daño en el túbulo proximal de manera que las proteínas que se filtran fisiológicamente no se reabsorben y se eliminan proteínas procedentes de las células dañadas. Está constituida mayoritariamente por proteínas de bajo peso molecular como α1-microglobulina, β2-microglobulina, proteína transportadora del retinol (RBP), n-acetil β-glucosaminidasa (NAG) o lipocalina asociada a la gelatinasa de neutrófilos (NGAL). Puede producirse proteinuria mixta (glomerular y tubular) por la coexistencia de los procesos anteriormente descritos.
Desde el punto de vista metodológico hay una serie de aspectos que deben tenerse en cuenta:
- Los procedimientos de medida de proteínas en orina reconocen mayoritariamentealbúmina y son menos sensibles en la detección de otras proteínas como las globulinas y las proteínas de bajo peso molecular, las cuales deben hallarse en concentraciones relativamente elevadas para poder ser detectadas.
- Los procedimientos de medida de albúmina presentan una mayor sensibilidad analítica y mejor estandarización que los de proteínas 1617.
- El uso de la tira reactiva de orina para la determinación de la proteinuria en pacientes con infección por el VIH es un método semicuantitativo de cribado y está desaconsejado debido a que su sensibilidad analítica es inferior a la de los métodos Es especialmente sensible a la albúmina y menos a globulinas y proteínas de bajo peso molecular, pueden existir resultados falsos negativos en orinas diluidas y falsos positivos en orinas concentradas, alcalinas (pH>7), hematúricas o con presencia de componentes coloreados. La tira reactiva de orina puede ser útil en cambio para valorar la presencia de hematuria, leucocituria y glucosuria.
- El espécimen de elección es una orina aleatoria, de preferencia la primera de la mañana, ya que ha mostrado una buena correlación y concordancia con los valores obtenidos en orina de 24 horas, a excepción de la proteinuria de rango nefrótico (> 3 g/día) donde el espécimen recomendado es la orina de 24 horas 18.
- La expresión de los resultados como cocientes CAC o CPC, en lugar de concentración, evita los errores derivados de una mayor o menor dilución de la muestra de orina en relación con la diuresis.
- Los métodos que miden específicamente proteínas de bajo peso molecular no están disponibles en la mayoría de los laboratorios clínicos.
Debe tenerse en cuenta que la determinación de albuminuria y proteinuria puede estar influida por algunas condiciones clínicas que pueden modificar sus valores. Algunas situaciones elevan la cifra de albuminuria detectada: ejercicio físico intenso, infección activa, fiebre, descompensación hiperglucémica o insuficiencia cardiaca. Además, la excreción de albuminuria determinada mediante el CAC o CPC puede estar sobrestimada en pacientes con masa muscular disminuida. Por el contrario, en personas muy musculadas o en la raza negra puede estar infraestimada 19. En estos casos extremos (peso y masa muscular) la determinación de proteinuria y albuminuria en orina de 24 horas puede ayudar a una mejor interpretación de la evaluación renal.
La utilización del cociente albúmina/proteína (CAP) en una muestra aislada de orina puede ayudar a diferenciar la proteinuria de origen glomerular de la de origen tubular. Un CAP en orina >0,4 es sugerente de proteinuria glomerular, mientras que un CAP < 0,4 es sugerente de proteinuria tubular, ya que la mayoría de la proteinuria está compuesta de proteínas diferentes de la albúmina. El punto de corte del cociente de 0,4 mostró una sensibilidad del 88 % y una especificidad del 99 % 20 para diferenciar el origen de la proteinuria, y los datos se confirmaron en un estudio en pacientes con infección por el VIH 21.
EL ESTUDIO DEL SEDIMENTO URINARIO
La presencia de células tubulares renales, hematíes dismórficos y cilindros eritrocitarios es patognomónica de lesión renal y puede orientar al diagnóstico de determinadas patologias.
EVALUACIÓN DE LA FUNCIÓN TUBULAR
La disfunción tubular predominante en pacientes con infección por el VIH es la proximal, relacionada habitualmente con toxicicidad por tenofovir.
Debe sospecharse lesión tubular ante la presencia de disminución progresiva del FGe, aumento del valor del CPC, hipofosfatemia y/o glucosuria normoglicémica. En estos casos se recomienda ampliar el estudio, incluyendo la determinación de la concentración de fosfato y urato séricos y urinarios y el cálculo de las respectivas excreciones fraccionadas, de bicarbonato sérico medido o calculado a partir del equilibrio ácido base, y de potasio sérico y urinario Tabla 5. Se recomienda medir también la excreción urinaria de proteínas y la albúmina y se calculará el CAP para diferenciar entre proteinuria tubular y glomerular.
La hipofosfatemia aislada es frecuente en pacientes con VIH y debe ser interpretada con cautela ya que puede ser debida a múltiples causas diferentes de la tubulopatía proximal (ver apartado hipofosfatemia). En estos casos la determinación de la excreción fraccional de fosfato (EFF) o de ácido úrico puede ayudar al diagnóstico. Una EFF normal (< 20 %) con excreción fraccional normal de ácido úrico, puede indicar que el túbulo está indemne y no afectado por toxicidad por tenofovir. En cambio,una EFF elevada(> 20 %) no es tan específica porque puede estar influida por la presencia de hiperparatiroidismo primario o secundario, niveles bajos de 25 OH vitamina D u otras causas.Para calcular la EFF se puede recurrir a calculadoras accesibles desde las páginas web. No obstante, en muchas de ellas no se dispone de la EFF, pero sí de la reabsorción tubular de fosfato (RTF), de donde puede deducirse la EFF (equivalente a 1- RTP; Tabla 6).
En casos seleccionados puede considerarse la medida de proteínas específicas de función tubular, como la concentración urinaria de RBP o de β2-microglobulina. Debe tenerse en cuenta, sin embargo, su limitada estandarización y posible variabilidad y la escasa disponibilidad de las técnicas en la mayoría de los laboratorios clínicos.
Recomendaciones
- Para la evaluación renal global se recomienda determinar la creatinina sérica y el FGe mediante la ecuación CKD-EPI, y el CPC en orina, preferentemente de la primera micción de la mañana (en su defecto una orina aleatoria es aceptable). En pacientes con DM y/o HTA se realizará también el CAC. Recomendación de buena práctica clínica basada en consenso.
- Para la evaluación de la función tubular, además de las mediciones anteriores, se recomienda medir también la concentración sérica de fosfato y determinar la existencia de glucosuria mediante tira reactiva de orina preferentemente en la primera orina de la mañana. Recomendación de buena práctica clínica basada en consenso.
- Ante la presencia de alteraciones confirmadas en cualquiera de las pruebas indicadoras de función tubular se aconseja la realización de estudios analíticos adicionales: concentración sérica y urinaria de fosfato y urato, acompañados del cálculo de las respectivas excreciones fraccionadas, estudio del equilibrio ácido-básico en sangre y de la concentración de potasio sérico y urinario. Recomendación de buena práctica clínica basada en consenso.
- En caso de sospecha de enfermedad glomerular se realizarán estudios específicos según se sospeche una glomerulopatía primaria o secundaria. Se considerará la realización de pruebas de imagen, o consulta a Nefrología según los criterios de derivación que se describen en otra sección de este documento. Recomendación de buena práctica clínica basada en consenso.
- La tira reactiva de orina no debe ser utilizada para la valoración de la proteinuria. Recomendación de buena práctica clínica basada en consenso.
PERIODICIDAD DE LAS MEDICIONES
El estudio renal básico debe realizarse en todos los pacientes infectados por el VIH, ya que los factores que pueden favorecer el desarrollo de nefropatía son múltiples y frecuentes. El bajo coste de este estudio y el hecho de que no suponga visitas adicionales para los pacientes, apoya la recomendación de hacerlo de forma general y periódica.
Este estudio básico debe llevarse a cabo en la primera visita tras el diagnóstico de la infección por VIH, inmediatamente antes de iniciar el TAR, y durante el seguimiento posterior. La periodicidad con la que debe repetirse durante el seguimiento puede depender de la existencia o no de factores de riesgo para el desarrollo de nefropatía (Tablas 1 y 7). Dada la sencillez y bajo coste, este grupo recomienda que se realice al menos una vez al año en todos las personas con VIH. En los pacientes con algún factor de riesgo de enfermedad renal deberá realizarse el seguimiento de forma semestral (Algoritmo 1), y en los que presentan DM o HTA debe añadirse la determinación de albuminuria (CAC).
En los pacientes tratados con TDF, por su potencial efecto tóxico sobre el túbulo renal, deben realizar controles de función renal y proteinuria al mes del inicio del fármaco y posteriormente de forma semestral, añadiendo además la determinación del fosfato sérico y de glucosa mediante tira reactiva de orina, preferentemente en la orina de la primera micción, aunque puede ser también válida en una muestra de orina aleatoria (con control de glucemia). Ante la presencia de alteraciones confirmadas en cualquiera de las pruebas anteriores se aconseja la realización de un estudio ampliado. En caso de deterioro de la función renal, proteinuria y/o hematuria, deberá valorarse según se describe en los apartados correspondientes.
Recomendaciones
- En todos los pacientes con infección por el VIH debe realizarse un estudio renal básico para la detección de ERC al inicio del diagnóstico de la infección por el VIH, y de forma periódica en el seguimiento posterior. Recomendación de buena práctica clínica basada en consenso.
- En ausencia de alteraciones en el estudio básico se recomienda un seguimiento anual que incluya creatinina sérica, FGe mediante la ecuación CKD-EPI, CPC en orina de la primera micción y sedimento urinario.Recomendación de buena práctica clínica basada en consenso.
- En los pacientes tratados con TDF se debe aumentar la frecuencia de los controles: a)en pacientes sin factores de riesgo para ERC, se recomienda efectuar los controles coincidiendo con los realizados para valorar la eficacia del TAR (al mes y posteriormente cada 6 meses); b)en los pacientes con ERC o factores de riesgo para la misma, se recomienda añadir la determinación del fosfato y glucosa séricos, y la tira reactiva de orina preferentemente en la orina de la primera micción (glucosuria no hiperglucémica).Recomendación de buena práctica clínica basada en consenso.
- En los pacientes que no reciben TAR el estudio renal básico debe realizarse una vez al año si no presentan factores de riesgo para el desarrollo de nefropatía y cada seis meses cuando uno o más de dichos factores están presentes. Recomendación de buena práctica clínica basada en consenso.
Gráficos:

TDF = Tenofovir disoproxil fumarato; ATV = Atazanavir; IDV = Indinavir; FGe = filtrado glomerular estimado; CPCo = cociente proteína/creatinina en orina; CACo = cociente albúmina/creatinina en orina; DM: diabetes mellitus; HTA: hipertensión arterial
Tablas:

VHC, virus de la hepatitis C; VHB, virus de la hepatitis B; IECAs, inhibidores del enzima convertidor de la angiotensina; ARA-2, antagonistas del receptor de la angiotensina 2.
a Nefrotoxicidad directa; b Cristaluria; c Alteración hemodinámica glomerular.
*Requieren ajuste de dosis en situación de insuficiencia renal
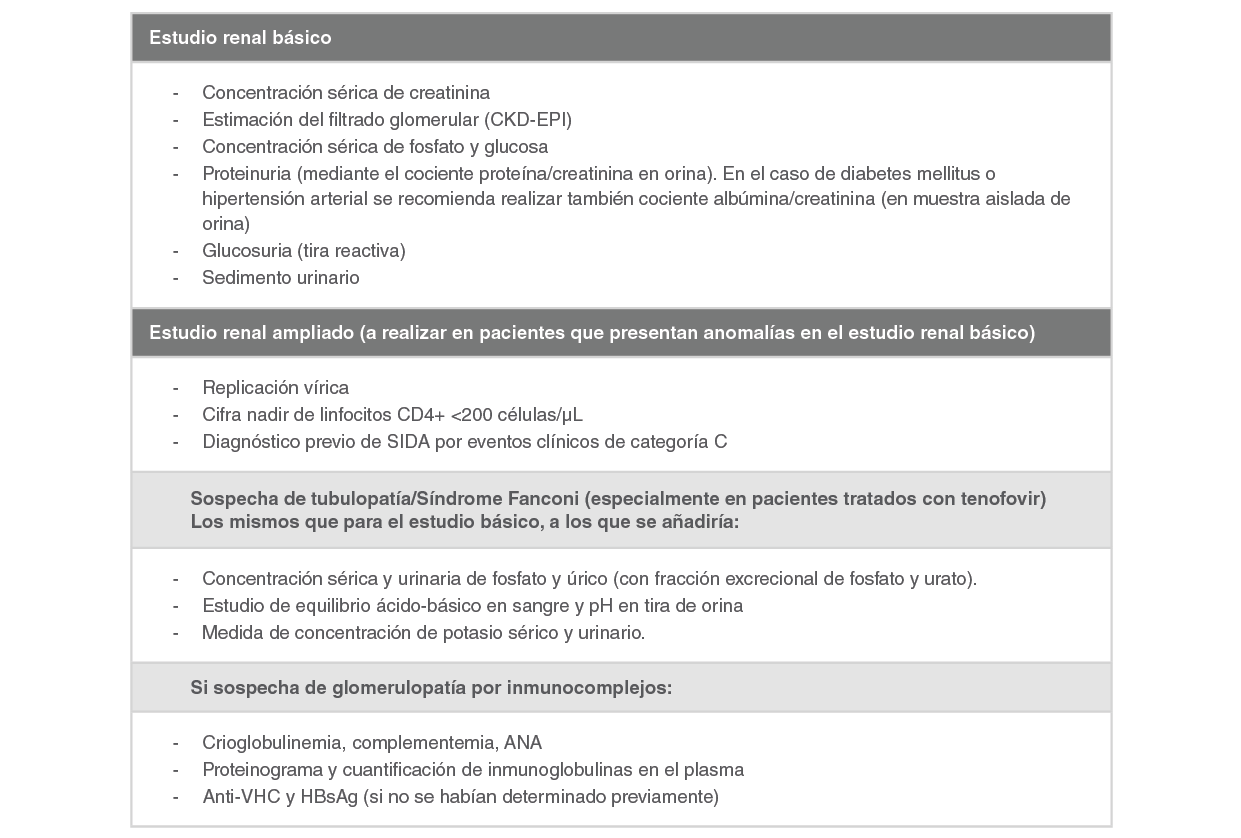
CKD-EPI: Chronic Kidney Disease Epidemiological Collaboration. ANA, anticuerpos antinucleares
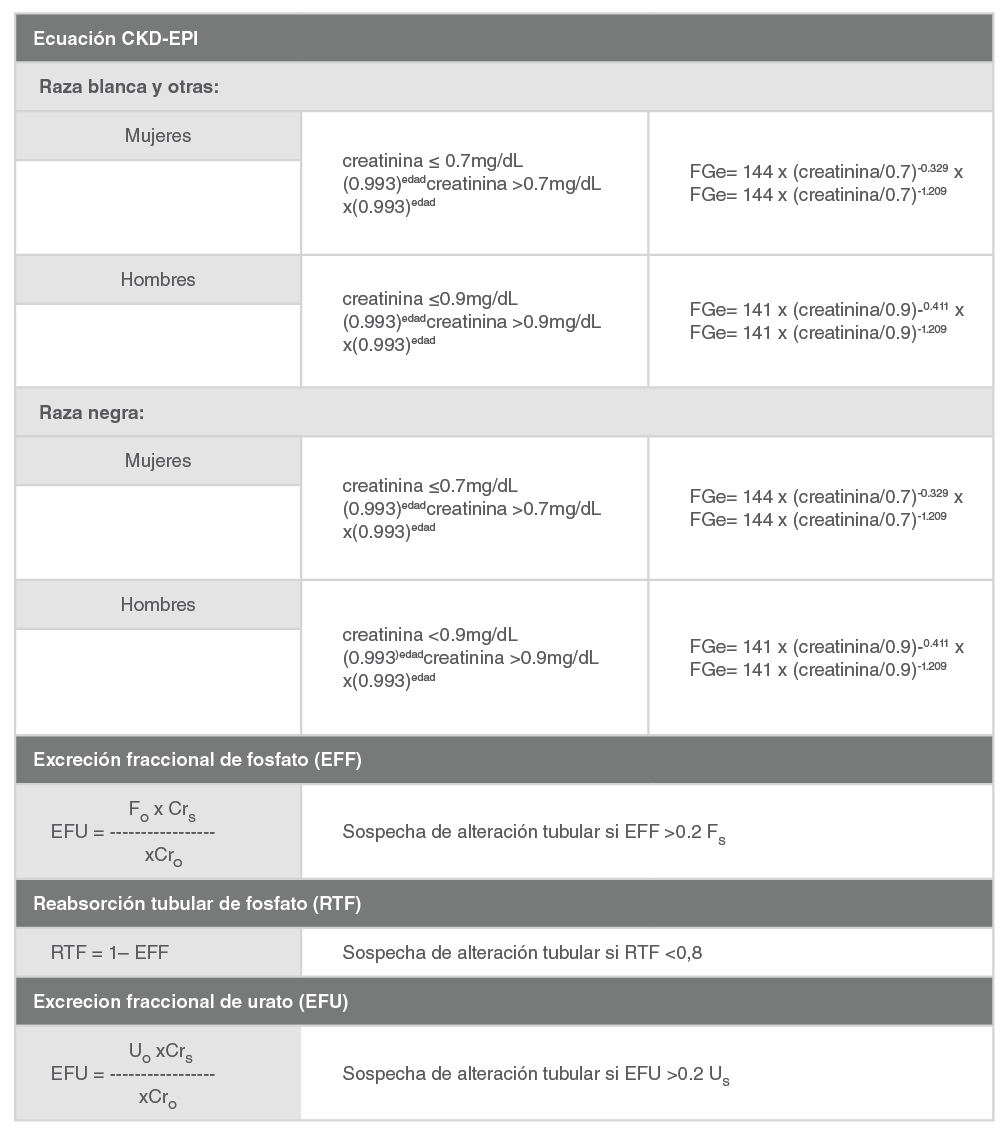
IDMS: dilución isotópica-espectrometría de masas; FGe: filtrado glomerular estimado; Creatinina: concentración sérica de creatinina en mg/dL; FO= concentración de fosfato en orina aleatoria; FS= concentración sérica de fosfato; CrO= concentración de creatinina en orina aleatoria; CrS= concentración sérica de creatinina UO= concentración de urato en orina aleatoria; US= concentración sérica de urato.
Para el cálculo de la excreción fraccional de fosfato y urato las concentraciones de un mismo analito, en suero y en orina, deben expresarse en las mismas unidades.

TAR, tratamiento antirretroviral; ERC, enfermedad renal crónica; TDF, tenofovir (disoproxil fumarato).
Bibliografía:
Levey AS, Stevens LA, Schmid CH et al. A new equation to estimate glomerular filtration rate. Ann InternMed 2009;150:604-12.
Stevens LA, Schmid CH, Greene T et al. Comparative performance of the CKD Epidemiology Collaboration (CKD-EPI) and the Modification of Diet in Renal Disease (MDRD) study equations for estimating GFR levels above 60 mL/min/1.73 m². Am J Kidney Dis 2010;56:486-95.
Cockcroft DW, Gault Prediction of creatinine clearance from serum creatinine. Nephron 1976;16:31- 41.
Montañés-Bermúdez R, Gràcia-Garcia S. Utilización de las ecuaciones de estimación del filtrado glomerular para el ajuste de dosis de fármacos. Nefrologia 2012;32:253-5.
Jones Estimating renal function for drug dosing decisions. Clin Biochem Rev 2011;32:81-8.
Stevens LA, Nolin TD, Richardson MM et al. Comparison of drug dosing recommendations based on measured GFR and kidney function estimating equations. Am J Kidney Dis 2009;54:33-42.
Inker LA, Okparavero Cystatin C as a marker of glomerular filtration rate: prospects and limitations. CurrOpinNephrolHypertens 2011;20:631-9.
Gagneux-Brunon A, Mariat C, Delanaye P. Cystatin C in HIV-infected patients: promising but not yet ready for prime time. Nephrol Dial Transplant 2012;27:1305-13.
Gràcia S, Montañés R, Bover J et al. Documento de consenso: Recomendaciones sobre la utilización de ecuaciones para la estimación del filtrado glomerular en adultos. Nefrologia 2006;26:658-65.
Gutiérrez F, Fulladosa X, Barril G, Domingo P. Renal tubular transporter-mediated interactions of HIV drugs: implications for patient management. AIDS Rev2014;16: 199-212.
Deeks ED. Bictegravir/Emtricitabine/Tenofovir Alafenamide: A Review in HIV-1 Infection.Drugs2018; 78: 1817-28.
Ncube V, Starkey B, Wang Effect of fenofibrate treatment for hyperlipidaemia on serum creatinine and cystatin C. Ann Clin Biochem 2012;49:491-3.
Polanco N, Hernandez E, Gonzalez E et al. Fibrate-induced deterioration of renal function. Nefrologia 2009;29:208-13.
Jotwani V, Li Y, Grunfeld C et Risk factors for ESRD in HIV-infected individuals: traditional and HIV- related factors. Am J Kidney Dis 2012;59:628-35.
Gupta SK, Eustace JA, Winston JA et Guidelines for the management of chronic kidney disease in HIV-infected patients: recommendations of the HIV Medicine Associationof the Infectious Diseases Society of America. Clin Infect Dis 2005;40:1559-85.
Itoh Y, Ichihara K, Kishi K et al. Preparation of highly purified monomeric human serum albumin as secondary reference material for standardization of urinary albumin immunoassays. Clin Chim Acta 2012;413:175-81.
Miller WG, Bruns DE, Hortin GL et al. Current issues in measurement and reporting of urinary albumin excretion. Clin Chem 2009;55:24-38.
Montero N, Mojal S, Pascual J, Soler MJ. Protein/creatinine ratio in spot urine versus 24-hour urine protein. Nefrologia. 2013;33:134-5.
KDIGO (Kidney Disease: Improving Global Outcomes) 2012 Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease. Kidney Int. 2013;(Suppl 3):1-163.
Smith E, Cai MMX, McMahon LP, Wright DA, Holt SG. The value of simultaneous measurements of urinary albumin and total protein in proteinuric patients. Nephrol Dial Transplant 2012;27:1534-41.
Reynes J, Cournil A, Peyriere H, et al. Tubular and glomerular proteinuria in HIV-infected adults with estimated glomerular filtration rate ≥ 60ml/min per 1.73m². AIDS 2013;27:1295-1302.
European AIDS Clinical Society, Version 9.1 Guidelines October 2018. Disponible on line en: http:// www.eacsociety.org/Guidelines.aspx
5. EVALUACIÓN Y TRATAMIENTO DE LAS ALTERACIONES RENALESY LOS FACTORES DE PROGRESIÓN DE LA ERC Y DE LAS COMORBILIDADES RELACIONADAS
5.1. DETERIORO DE LA FUNCIÓN RENAL
5.2. HEMATURIA
5.3. PROTEINURIA
5.4. DISFUNCIÓN TUBULAR
5.5. INDICACIONES DE CONSULTA AL NEFRÓLOGO Y BIOPSIA RENAL
5.6. MANEJO DE LOS FACTORES DE PROGRESIÓN DE LA ERC
5.7. MANEJO DE LOS FACTORES DE RIESGO CARDIOVASCULAR EN LOS PACIENTES CON VIH Y ERC
5.8. MANEJO DE LAS ALTERACIONES EN EL METABOLISMO MINERAL Y ÓSEO
5.9. MANEJO DE OTRAS COMORBILIDADES RELACIONADAS CON LA ERC
DETERIORO DE LA FUNCIÓN RENAL
Para una correcta orientación diagnóstica debe obtenerse información sobre síntomas y signos de enfermedad renal, exposición a fármacos o sustancias nefrotóxicas, y revisar los valores de creatinina sérica previos, realizar un estudio de orina con sedimento y determinación de proteinuria y realizar una ecografía renal para descartar uropatía obstructiva y valorar características ecográficas en los riñones que sugieran cronicidad (tamaño renal y cortical disminuidos, ecogenicidad aumentada). La determinación de sodio, creatinina y osmolaridad en orina aportará información adicional para el diagnóstico diferencial entre deterioro prerrenal o daño renal parenquimatoso.
Recomendación
- Ante un deterioro de la función renal debe determinarse si se trata de un trastorno agudo o crónico y si es prerrenal, parenquimatoso u obstructivo. Debe realizarse un estudio de orina con sedimento y proteinuria, y una ecografía renal. Recomendación de buena práctica clínica basada en consenso.
HEMATURIA
Puede deberse a causas urológicas o glomerulares. Cuando la hematuria es macroscópica, la de origen urológico se suele acompañar de coágulos en tanto que la glomerular es típicamente sin coágulos y de color rojo oscuro.
La presencia de microhematuria en el sedimento puede también indicar patología renal o de la vía urinaria. Si se acompaña de proteinuria así como de cilindros hemáticos, hematíes dismórficos o cilindros céreos en el sedimento sugiere patología parenquimatosa.
Recomendaciones
- En pacientes con hematuria, debe realizarse el diagnóstico diferencial entre causas urológicas o glomerulares. Debe realizarse un estudio de orina con sedimento y proteinuria, y una ecografía renal. Recomendación de buena práctica clínica basada en consenso.
- Si se considera que la hematuria procede de las vías urinarias el paciente debe ser valorado por Urología y si se trata de una hematuria no urológica con proteinuria debe sospecharse una enfermedad glomerular y solicitar consulta a Nefrología. Recomendación de buena práctica clínica basada en consenso.
PROTEINURIA
La presencia de concentraciones elevadas de proteínas en orina de modo persistente es un signo de lesión renal e identifica a un grupo de pacientes con mayor riesgo de progresión de la enfermedad renal. La evaluación del paciente con proteinuria, como en otras alteraciones urinarias, debe acompañarse siempre de sedimento y estudio ecográfico (Algoritmo 2). La proteinuria puede clasificarse según su origen y según la cantidad de proteínas eliminadas. Según su origen se clasifica en glomerular y tubular.La proteinuria glomerular se produce como consecuencia de un daño en el glomérulo que ocasiona un aumento de la permeabilidad de la pared del capilar glomerular al paso de proteínas. Está constituida mayoritariamente por albúmina. La proteinuria tubular se produce como consecuencia de un daño en el túbulo proximal de manera que las proteínas que se filtran fisiológicamente no se reabsorben y se eliminan proteínas procedentes de las células dañadas. Está constituida mayoritariamente por proteínas de bajo peso molecular, como la β-2 microglobulina, y una menor proporción de albúmina. Un cociente albúmina/ proteínas totales en una muestra de orina <0,4 indica proteinuria de origen tubular.
Según la cantidad de proteínas eliminada, la proteinuria se clasifica en ligera cuando la excreción urinaria de proteínas se sitúa entre 0,15-1 g/24 horas (valores de CPC entre 0,15-1 g/g), moderada entre 1-3 g/24 horas (CPC, 1-3 g/g) y en rango nefrótico si es mayor de 3-3,5 g/24 horas (3-3,5 g/g); se clasifica como síndrome nefrótico cuando se acompaña de hipoalbuminemia, generalmente con edemas e hiperlipemia. Se considera que existe microalbuminuria cuando la excreción de albúmina se sitúa entre 30-299 mg/24 horas (CAC, 30-299 mg/g) y albuminuria franca (macroalbuminuria) cuando la excreción de albúmina supera los 300 mg/24h (CAC>300 mg/g).
Si la proteinuria se acompaña de hematuria (especialmente si existen cilindros hemáticos) debe sospecharse glomerulopatía y el estudio debe incluir complemento, inmunoglobulinas, serología para VHB y VHC, crioglobulinas y, si hay datos que sugieran enfermedad sistémica, determinación de autoanticuerpos. Asimismo, deberá plantearse la biopsia renal.
Cuando la proteinuria es ligera-moderada y se acompaña de otros signos de disfunción tubular (acidosis tubular, hipofosfatemia, hipouricemia, pH urinario > 5,5 y/o glucosuria normoglucémica) debe sospecharse lesión tubular. En estos casos se aconseja la realización de pruebas más específicas como la medida de la concentración de fosfato y urato séricos y urinarios y el cálculo de las respectivas excreciones fraccionadas, de bicarbonato sérico medido, o calculado a partir del equilibrio ácido base, y de potasio sérico y urinario.
La reducción de la proteinuria enlentece la progresión de la ERC. El tratamiento con IECA o ARA-II es el que más ampliamente ha demostrado un efecto antiproteinúrico. Otras medidas terapéuticas antiproteinúricas son: antialdosterónico en casos de pobre respuesta a IECA/ARA-II (en pacientes con función renal conservada y sin hiperpotasemia); control adecuado de las cifras de presión arterial (<130/80 mmHg) con el uso de otros hipotensores si es necesario; reducción de peso en pacientes con sobrepeso/obesidad y dieta hiposódica y con moderada restricción proteica
Recomendaciones
- En pacientes con proteinuria debe determinarse si se trata de una proteinuria glomerular o tubular mediante el CAC y el CPC. Cuando la proteinuria es moderada y se acompaña de hematuria o deterioro de función renal debe sospecharse glomerulopatía y ampliar el estudio valorando la realización de una biopsia renal. Recomendación de buena práctica clínica basada en consenso.
- En pacientes con proteinuria ligera-moderada, la presencia de hipofosfatemia, hipouricemia, acidosis tubular y/o glucosuria normoglicémica debe hacer sospechar tubulopatía y realizar pruebas específicas. Recomendación de buena práctica clínica basada en consenso.
- El tratamiento antiproteinúrico se basará principalmente en el bloqueo del sistema renina-angiotensina-aldosterona, con IECA, ARA-II o diuréticos antialdosterónicos, vigilando frecuentemente la función renal y la concentración de potasio sérico. Grado de recomendación: Fuerte; Calidad de la evidencia: Alta.
DISFUNCIÓN TUBULAR
La disfunción tubular en pacientes con VIH puede ser debida a numerosas causas pero la más frecuente es la toxicidad por tenofovir, en la mayoría de los casos causada por la formulación TDF Tabla 8. Como consecuencia de la misma se alteran las funciones fisiológicas del túbulo proximal (reabsorción de proteínas, fósforo, glucosa, ácido úrico, aminoácidos y bicarbonato) produciéndose, en los casos más graves, el síndrome de Fanconi que puede ser completo o, más habitualmente, incompleto.
Recomendación
- Debe sospecharse disfunción tubular ante la presencia de proteinuria ligera-moderada, hipofosfatemia, hipouricemia, acidosis tubular y/o glucosuria normoglicémica y realizar pruebas específicas de función tubular (V. secciones anteriores). Recomendación de buena práctica clínica basada en consenso.
INDICACIONES DE CONSULTA AL NEFRÓLOGO Y BIOPSIA RENAL
La valoración y/o seguimiento por Nefrología es necesaria cuando se trata de problemas complejos que requieren asesoramiento y/o estrategias diagnósticas o terapéuticas especializadas, sobre todo cuando se considera que puede ser necesaria una biopsia renal, una técnica invasiva que debe ser realizada exclusivamente cuando sea imprescindible para establecer un diagnóstico definitivo que tenga implicaciones terapéuticas o aporte información sobre el pronóstico o progresión de la enfermedad. La indicación será siempre individualizada, en función del balance entre el riesgo de la biopsia y los beneficios que nos pueda aportar. Las potenciales complicaciones de la técnica y las indicaciones de la misma en el paciente con infección por el VIH son similares alas del paciente con enfermedad renal en general.
Recomendaciones
- Se recomienda remitir a Nefrología en las siguientes situaciones: a) CPC > 0.5 g/g o CAC > 300 mg/g; b) hematuria no urológica, especialmente cuando se acompaña de proteinuria y/o elevación de creatinina sérica; c) deterioro agudo de función renal o deterioro progresivo de etiología no aclarada; d) ERC cuando el FGe sea inferior a 45 ml/min/1.73 m²) para seguimiento, y e) cuando se considere que pueda estar indicada la biopsia renal. Recomendación de buena práctica clínica basada en consenso.
- Las indicaciones y complicaciones de la biopsia renal en pacientes con infección por el VIH son las mismas que para los pacientes no infectados. Se consideran indicaciones de biopsia renal lassiguientes: a) hematuria no urológica con proteinuria y/o elevación de creatinina sérica; b) proteinuria significativa (CPC > 0.5-1 g/g), especialmente si se acompaña de alteraciones del sedimento urinario y/o deterioro de función renal; c) insuficiencia renal aguda de etiología incierta o con sospecha de origen glomerular o inmunoalérgico, y d) microangiopatía trombótica con deterioro agudo de la función renal. Recomendación de buena práctica clínica basada en consenso.
- En los pacientes diabéticos con proteinuria lentamente progresiva y otros signos sugerentes de microangiopatía diabética, la biopsia no se considera necesaria, salvo si se asocia a datos que sugieran una etiología diferente de la nefropatía diabética. Recomendación de buena práctica clínica basada en consenso.
MANEJO DE LOS FACTORES DE PROGRESIÓN DE LA ERC
En la población general con ERC, los dos factores de progresión modificables que han demostrado mayor impacto son el control de la enfermedad de base, especialmente la diabetes, y el control de la proteinuria y de la presión arterial, como factores secundarios. En las personas con VIH, la información sobre los factores de progresión es limitada Tabla 4 y no hay estudios que hayan evaluado el efecto del control de la presión arterial y de la proteinuria en la progresión de la ERC. Se han generado datos observacionales sobre el impacto del inicio precoz del TAR cuando la nefropatía de base es la asociada al VIH 1, sobre la validación del score D:A:D 2, y sobre los factores de riesgo de aparición de insuficiencia renal crónica 3. En la cohorte española VACH se identificaron como factores de riesgo independientes los ya conocidos en la población general (HTA, índice de masa corporal, eventos cardiovasculares, diabetes y dislipemia) y, en relación con la propia infección VIH y el TAR, el uso de IP 3.
Aunque la evidencia sobre el valor de las intervenciones sobre los factores de progresión de la ERC en pacientes con VIH es limitada, en vista del beneficio demostrado en la población general, se considera razonable extrapolar las recomendaciones para el control de la proteinuria y de la presión arterial en la población con VIH. El tratamiento de las coinfecciones con potencial impacto renal (p.ej. sífilis, hepatitis B y C) es también una intervención recomendable 45.
PROTEINURIA
La evaluación y el manejo del paciente con proteinuria han sido tratados en la sección 5.3.
HIPERTENSIÓN ARTERIAL
La HTA está presente en el 80-85% de los pacientes con ERC, especialmente en estadios avanzados de disfunción renal. En pacientes con VIH se ha estimado una prevalencia de HTA en torno al 25%, y puede ser mayor en las personas de más edad 5. Hay datos observacionales que indican que los pacientes con ERC y una tensión arterial normal preservan mejor la función renal que los pacientes con tensión arterial elevada. La intervención para reducir la tensión arterial a <130/80mmHg se asocia con mejoría de la función renal si la ERC cursa con proteinuria (>0,5-1g/día). Los datos son más limitados en pacientes con ERC no proteinúrica. El control de la tensión arterial puede ser importante en pacientes con ERC tanto para proteger de la progresión como para reducir el riesgo cardiovascular. A falta de datos específicos en pacientes con VIH, parece razonable adoptar las recomendaciones de la población general con el objetivo de alcanzar una tensión arterial ≤130/80mmHg 678.
Las estrategias terapéuticas para conseguir el objetivo marcado incluyen medidas no farmacológicas (dieta y ejercicio) y farmacológicas. Los fármacos antihipertensivos se adaptarán a las características individuales de cada caso, aunque el bloqueo del sistema renina-angiotensina-aldosterona constituirá la base fundamental del tratamiento, particularmente en los casos con albuminuria/proteinuria. En la Tabla 9 se describen los fármacos antihipertensivos con sus posibles interacciones con TAR y ajuste para función renal. Los IECA y ARA II son los mejor tolerados y con menor riesgo de interacciones 9. Los pacientes con ERC y disminución del FG suelen requerir una media de 2-3 fármacos para el control de la HTA.
Recomendaciones
- Las medidas no farmacológicas para el control de la tensión arterial son las mismas que las recomendadas en la población general: restricción de sal (<6 gr/día), control del exceso de peso, ejercicio físico aeróbico (caminar a paso vivo al menos 30 minutos 4 días por semana). Recomendación de buena práctica clínica basada en consenso.
- El tratamiento farmacológico debe iniciarse con IECA, o ARA-II en caso de intolerancia, recomendado en los casos de ERC estadio ≥ 3 o ≤3 con albuminuria (CAC > 30 mg/g). Grado de recomendación: Fuerte; Calidad de la evidencia: Alta.
- Si se requiere añadir un segundo fármaco, se recomienda emplear un antagonista de los canales del calcio o un diurético. Los antagonistas del calcio deberán utilizarse con precaución en pacientes que reciben IPs o ITINAN debido a la posibilidad de interacciones medicamentosas. Si se requiere administrar antagonistas de los canales del calcio, se recomiendan pautas basadas en RAL o DTG. Recomendación de buena práctica clínica basada en consenso.
- No se recomienda la combinación de IECAs y ARA II por asociarse a un mayor riesgo de hiperpotasemia y deterioro de la función renal. Grado de recomendación: Fuerte; Calidad de la evidencia: Alta.
MANEJO DE LOS FACTORES DE RIESGO CARDIOVASCULAR EN LOS PACIENTES CON VIH Y ERC
DISLIPEMIA
En los pacientes con VIH es frecuente que exista una dislipemia aterogénica, caracterizada por colesterol HDL (c-HDL) bajo y triglicéridos (TG) elevados. Además, algunos fármacos antirretrovirales inducen alteraciones lipídicas características. El patrón lipídico típico en la ERC también consiste en una elevación de la concentración de TG con descenso de c-HDL. Por otro lado, en los pacientes con VIH pueden coexistir otras comorbilidades o tratamientos concomitantes que pueden causar hiperlipemia secundaria Tabla 10.
Las estatinas ayudan a reducir las complicaciones cardiovasculares en pacientes con estadios de ERC 2-5 1011121314. La Sociedad Europea de Arterioesclerosis y la Sociedad Europea de Cardiología consideran a los pacientes con infección por VIH como pacientes con alto riesgo cardiovascular (RCV), y en los que el objetivo terapéutico a conseguir es una concentración de colesterol LDL (c-LDL)<100 mg/ dl (2.5 mmol/L). La presencia de ERC con FGe<30 ml/min reclasificaría a estos pacientes como de muy alto RCV con un objetivo todavía más exigente (c-LDL <70 mg/dl) 12.
En cuanto a la hipertrigliceridemia, en adultos con ERC, una vez descartadas causas secundarias, se recomiendan cambios en el estilo de vida (dieta, ejercicio físico y abstinencia en la ingesta de alcohol). El tratamiento farmacológico con fibratos se recomienda si los TG son > 800-1000 mg/dl. 12 (Tabla 11A y 11B).
Recomendaciones
- En pacientes con VIH y ERC se recomienda realizar un perfil lipídico completo (colesterol total, c-HDL y c-LDL y TG) cada 6 meses. Recomendación de buena práctica clínica basada en consenso.
- Se debe controlar estrictamente la dislipemia asociada a la ERC por su probado efecto protector sobre las complicaciones cardiovasculares. Los objetivos terapéuticos son los recomendados para pacientes con elevado riesgo cardiovascular. Grado de recomendación: Fuerte; Calidad de la evidencia: Alta.
- Los pacientes con VIH y ERC con FG<30 mL/min se consideran de muy alto riesgo cardiovascular, sin necesidad de aplicar escalas de riesgo. El objetivo terapéutico a conseguir es un colesterol c-LDL<70 mg/dl o una reducción del 50% si el objetivo previo no es alcanzable. El tratamiento incluirá una dieta pobre en grasas y tratamiento farmacológico con estatinas, asociadas o no a ezetimiba. Grado de recomendación: Débil; Calidad de la evidencia: Moderada.
- La elección de estatinas estará en función de su metabolización (CYP3A4, CYP2C9) e interacción con cada antirretroviral, y del grado de insuficiencia renal y la dosis máxima de cada estatina. Serían recomendables pitavastatina, atorvastatina, pravastatina y rosuvastatina, ajustadas al grado de insuficiencia renal. Recomendación de buena práctica clínica basada en consenso.
- Se recomienda tratamiento farmacológico con fibratos en casos de hipertrigliceridemia intensa (TG> 800-1000 mg/dl) con el fin de prevenir la aparición de pancreatitis. Grado de recomendación: Débil; Calidad de la evidencia: Baja.
- Si se utilizan fibratos en combinación con estatinas, se recomienda fenofibrato ajustado al grado de insuficiencia renal, vigilando estrechamente la posibilidad de rabdomiolisis y deterioro de función renal. Recomendación de buena práctica clínica basada en consenso.
- El tratamiento combinado con fibratos y estatinas se desaconseja en el trasplante renal. Grado de recomendación: Débil; Calidad de la evidencia: Muy baja.
HIPERTENSIÓN ARTERIAL
La evaluación y el manejo del paciente con HTA han sido tratados en la sección 5.6.2.
DIABETES MELLITUS
La DM tipo 2 es un problema creciente en los pacientes con VIH que envejecen. La presencia de diabetes se ha asociado con los factores de riesgo típicos de la población en general, con una mayor duración de la infección por el VIH, un nadir de CD4 más bajo y con el TAR 15. El diagnóstico y el manejo de la DM tipo 2 en los pacientes con VIH se basa en los mismos criterios y recomendaciones que en la población general 16. Se recomienda también la detección precoz de nefropatía diabética (determinaciones periódicas de CAC) y su tratamiento con las medidas antiproteinúricas y de control de la tensión arterial (resumidas en los apartados previos). La hemoglobina glicada A1c (HbA1c) es el parámetro de referencia para valorar el control metabólico en el paciente con ERC, pero conviene tener presente que la uremia puede dar lugar a concentraciones falsamente elevadas. El objetivo de control de la diabetes, en general, debe ser una HbA1c<7%. En pacientes con ERC y diabetes de larga evolución, con historia previa de difícil control glucémico o condiciones que disminuyan su expectativa de vida, se deben evitar concentraciones de HbA1c>8% así como la hipoglucemia. En los últimos años se han comercializado nuevos fármacos con mecanismo de acción mediado por incretinas: los inhibidores de dipeptidil peptidasa-4 (IDPP4) (orales) y los agonistas del receptor del GLP-1 (aGLP-1, en inyección subcutánea). A pesar de la escasa experiencia con ellos en pacientes con VIH, pueden constituir una buena opción de tratamiento por su mejor perfil de seguridad y su posibilidad de uso en insuficiencia renal ajustando dosis 16] (Algoritmo 3 y Tabla 12).
Recomendaciones
- El objetivo de HbA1c en pacientes con VIH y ERC es el mismo que en la población general (HbA1c<7%). En ERC avanzada (FG<30 mL/min) y en diálisis, el objetivo de HbA1c será < 8 %, evitando episodios de hipoglucemia. Grado de recomendación: Fuerte; Calidad de la evidencia: Moderada.
- La utilización de hipoglucemiantes orales (metformina, sulfonilureas, inhibidores de DDP-4 y agonistas de GLP-1) e insulina se ajustará al grado de función renal y seguirá las mismas recomendaciones que para la población general. Recomendación de buena práctica clínica basada en consenso.
- El tratamiento del resto de los factores de riesgo cardiovascular asociados (dislipemia, HTA) ha demostrado ser de igual o mayor importancia que el control glucémico para la prevención de eventos cardiovasculares. Grado de recomendación: Fuerte; Calidad de la evidencia: Alta.
MANEJO DE LAS ALTERACIONES EN EL METABOLISMO MINERAL Y ÓSEO
Al hiperparatiroidismo secundario relacionado con la ERC se suman las alteraciones del metabolismo mineral y óseo de los pacientes con infección por el VIH: el déficit de vitamina D, el tratamiento con algunos fármacos antirretrovirales y la pérdida renal de fosfato por toxicidad tubular Tabla 13 17. Esta alteración metabólica es compleja e implica cambios del calcio, fósforo, hormona paratiroidea (PTH), vitamina D y factores fosfatúricos. Todas estas alteraciones son más marcadas a medida que disminuye la función renal, siendo más graves en el paciente en diálisis. Su control no preserva la función renal pero sí previene el riesgo aumentado de fracturas y otras complicaciones óseas. La mayoría de recomendaciones se han establecido por consenso y son en gran medida extrapoladas de las realizadas en los pacientes con ERC sin infección por el VIH 19 (Algoritmo 4).
Recomendaciones
- En los pacientes con VIH con FGe<60 mL/min se determinará al menos una vez al año la concentración de calcio, fosfato y calcidiol (25-OH vitamina D) séricos, y la PTH plasmática. Recomendación de buena práctica clínica basada en consenso.
- El tratamiento de las alteraciones del metabolismo óseo mineral en pacientes con VIH y ERC deberá ser idéntico al de los pacientes no infectados por VIH: mantener la concentración sérica de fosfato en el intervalo de referencia, evitar el déficit de calcidiol (25-OH vitamina D) y corregir la concentración de PTH en caso de que estén por encima del intervalo de referencia. Recomendación de buena práctica clínica basada en consenso.
- Cuando la concentración sérica de PTH sea superior al límite recomendado se corregirán los factores previamente mencionados y se iniciará tratamiento con calcitriol (1,25-OH vitamina D) o con activadores selectivos de los receptores de la vitamina D (paricalcitol); preferentemente estos últimos, por mostrar una menor incidencia de hipercalcemia, hiperfosfatemia e hipercalciuria. Grado de recomendación: Débil; Calidad de la evidencia: Moderada.
- La hipofosfatemia debe confirmarse siempre con más de una determinación. Recomendación de buena práctica clínica basada en consenso.
- Ante una hipofosfatemia confirmada deben investigarse otros marcadores renales de tubulopatía proximal, en particular la presencia de proteinuria y glucosuria y las concentraciones plasmáticas de potasio, uratos y bicarbonato. Si no existe alteración de otros marcadores de disfunción tubular, deben analizarse las hormonas reguladoras del metabolismo fosfo-cálcico: PTH y vitamina D en sangre. Recomendación de buena práctica clínica basada en consenso.
- La hipofosfatemia grave (<1 mg/dL) requiere una actuación inmediata, en algunos casos con administración endovenosa de fósforo. Grado de recomendación: Fuerte; Calidad de la evidencia: Moderada.
- La hipofosfatemia leve o moderada puede resolverse con el tratamiento de la etiología (vitamina D en el déficit de la misma, resección quirúrgica en el caso del hiperparatiroidismo primario y retirada del fármaco o el tóxico en los casos de disfunción tubular proximal secundaria a nefrotóxicos). En algunos casos puede emplearse aporte oral de fosfato. Grado de recomendación: Débil; Calidad de la evidencia: Moderada.
MANEJO DE OTRAS COMORBILIDADES RELACIONADAS CON LA ERC
ANEMIA
La prevalencia de anemia y su intensidad puede ser mayor en los pacientes con VIH y ERC que en los no infectados, y en algunos estudios se ha observado que puede ser un predictor independiente de peor supervivencia.Ante la ausencia de ensayos randomizados, se recomienda seguir las mismas estrategias de tratamiento que en las personas no infectadas 202122: hierro oral o intravenoso (hierro-carboximaltosa, hierro-dextrano y hierro-sacarosa) y estimulantes de la eritropoyesis (eritropoyetina α, β, darbepoetinα o eritropoyetina βpegilada), cuando no se consiguen las concentraciones deseables de hemoglobina con hierro.
Recomendaciones
- En pacientes con VIH y ERC se realizará un estudio de anemia cuando la concentración de hemoglobina sea <11 g/dl en mujeres premenopáusicas y pacientesprepúbereso <12 g/dl en hombres adultos ymujerespostmenopáusicas. Recomendación de buena práctica clínica basada en consenso.
- El tratamiento de la anemia de origen renal debe incluir hierro oral o intravenoso y estimulantes de la eritropoyesis si no se consiguen las concentraciones deseables de hemoglobina solo con hierro.Grado de recomendación: Fuerte; Calidad de la evidencia: Moderada.
- El objetivo del tratamiento con hierro es conseguir un índice de saturación de la transferrina entre 20-50% y una concentración sérica de ferritina entre 100- 500 ng/ml en pacientes en pre-diálisis o <800 ng/ml en diálisis. Se recomienda el tratamiento con estimulantes de la eritropoyesis si la concentración de hemoglobina es <10 g/dl y/o la saturación de transferrina es <25% y/o la ferritina es >200 ng/ml, hasta lograr una Hb de 10-11,5 g/dl, teniendo en cuenta los riesgos (ictus, neoplasia) y beneficios del tratamiento.Recomendación de buena práctica clínica basada en consenso.
PREVENCIÓN DE LA NEFROTOXICIDAD POR CONTRASTE
Los contrastes yodados empleados en algunas pruebas radiológicas pueden ser nefrotóxicos y contribuir al deterioro de la función renal en pacientes con ERC 2223.
Recomendaciones
- Se recomienda el uso de contrastes de baja osmolalidad, a dosis bajas y evitando administraciones repetidas en un corto espacio de tiempo.Grado de recomendación: Fuerte; Calidad de la evidencia: Alta.
- Debe asegurarse una hidratación previa y posterior a la administración de contraste con salino isotónico y evitar el uso de fármacos nefrotóxicos, principalmente AINES. Se recomienda una infusión se suero salino isotónico de100 ml/h durante las 6-12 horas previas al contraste y durante 4-12 horas posteriores. Para pacientes ambulatorios o procedimientos urgentes se recomienda llevarlo a cabo 1-3 horas antes del procedimiento y durante las 6 horas posteriores. Grado de recomendación: Fuerte; Calidad de la evidencia: Moderada.
- No se recomienda el uso de n-acetil-cysteina ni oral ni intravenosa. Recomendación de buena práctica clínica basada en consenso.
COINFECCIÓN POR VHC Y VHB
La generalización de la terapia antivírica con fármacos antivirales de acción directa de elevada eficacia ha cambiado el paradigma de tratamiento de la coinfección por el VHC. Algunos de estos fármacos tienen indicación en pacientes con ERC avalada por datos en ensayos clínicos que incluían a pacientes con ERC estadio 4-5 e incluso trasplantados renales. 242526. La indicación y recomendaciones de tratamiento antiviral directo para la co-infección por VHC en pacientes con VIH son las mismas que en los no infectados, teniendo en consideración las interacciones con los medicamentos antirretrovirales. Se recomienda consultar las recomendaciones de tratamiento para la coinfección por VHC en pacientes con VIH y ERC en las guías de la AEEH/SEIMC 27.
La coinfección por el VHB es mucho menos frecuente que la causada por el VHC. En todo paciente con VIH y coinfección por el VHB (con DNA del VHB detectable), el TAR debe incluir fármacos con actividad frente al VHB con la finalidad de lograr que la carga viral en plasma sea indetectable. En estos pacientes, tenofovir (TDF o TAF) ha demostrado ser muy eficaz para el control de la replicación del virus y la selección de resistencias. Se recomienda consultar las recomendaciones de tratamiento en las guías específicas 29.
Gráficos:
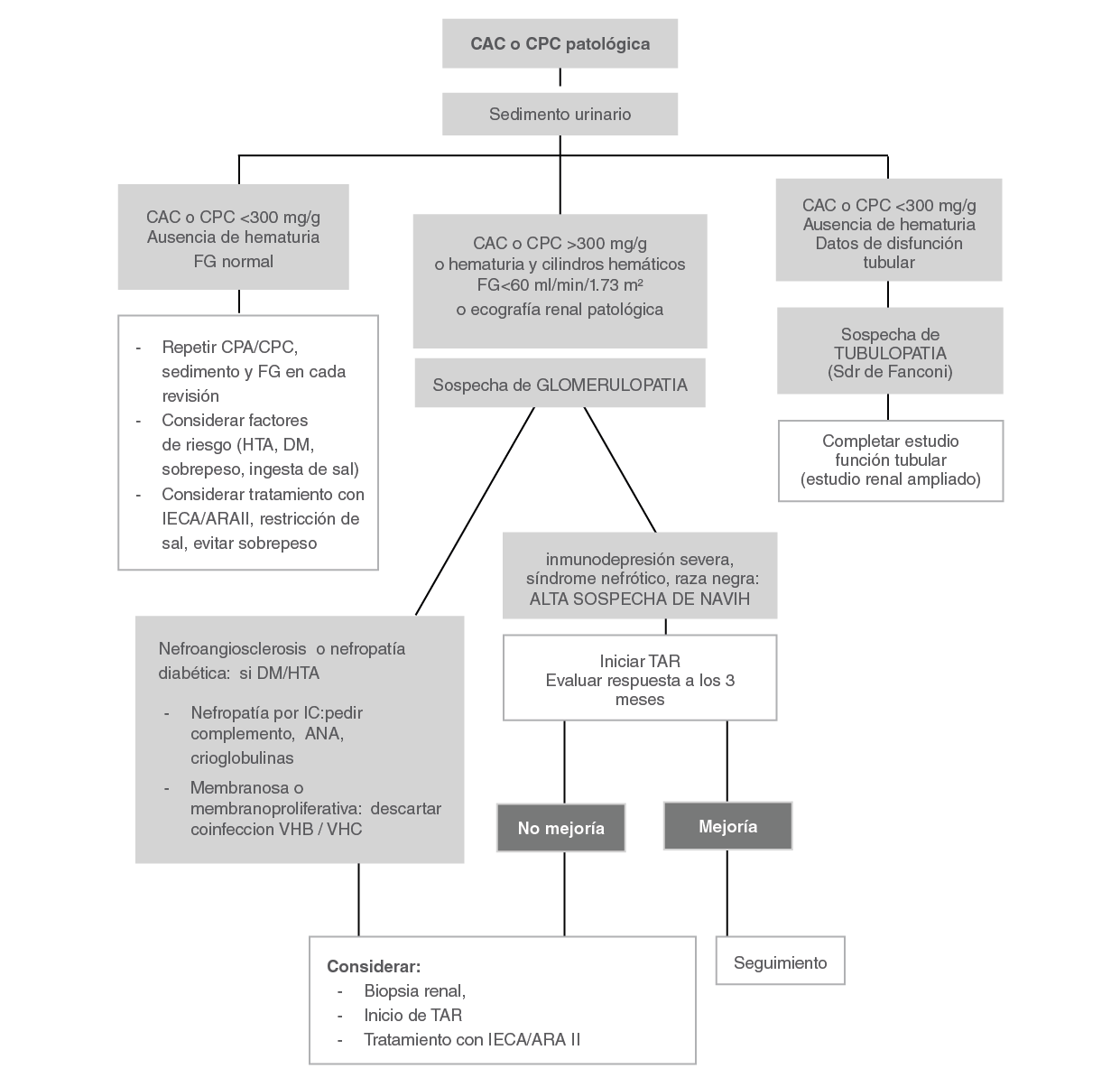
CAC: cociente albúmina/creatinina en orina; CPC: cociente proteínas/creatinina en orina. FG, filtrado glomerular; VHB/VHC, virus de la hepatitis B/C; TAR, tratamiento antirretroviral; HTA, hipertensión arterial; IECA, inhibidores de la enzima convertidora de angiotensina ; ARA II fármacos bloqueadores de angiotensina II, NAVIH, nefropatía asociada al VIH, DM, diabetes mellitus, IC, inmunocomplejos.

1Evitar glibenclamida. Usar gliclazida, glipizida o gliquidona. Usar glimepirida sólo si el FGe es >60 mL/ min/1,73m².
2 Ajustar dosis, salvo linagliptina. 3 Con precaución. 4 Liraglutide, Exenatide: ajustar dosis. Indicado si FGe>60 mL/min/1,73m².
FG: filttrado glomerular. SU: sulfonilureas. IDPP-4: inhibidores de la DPP-4. TZD: tiazolidinodionas.
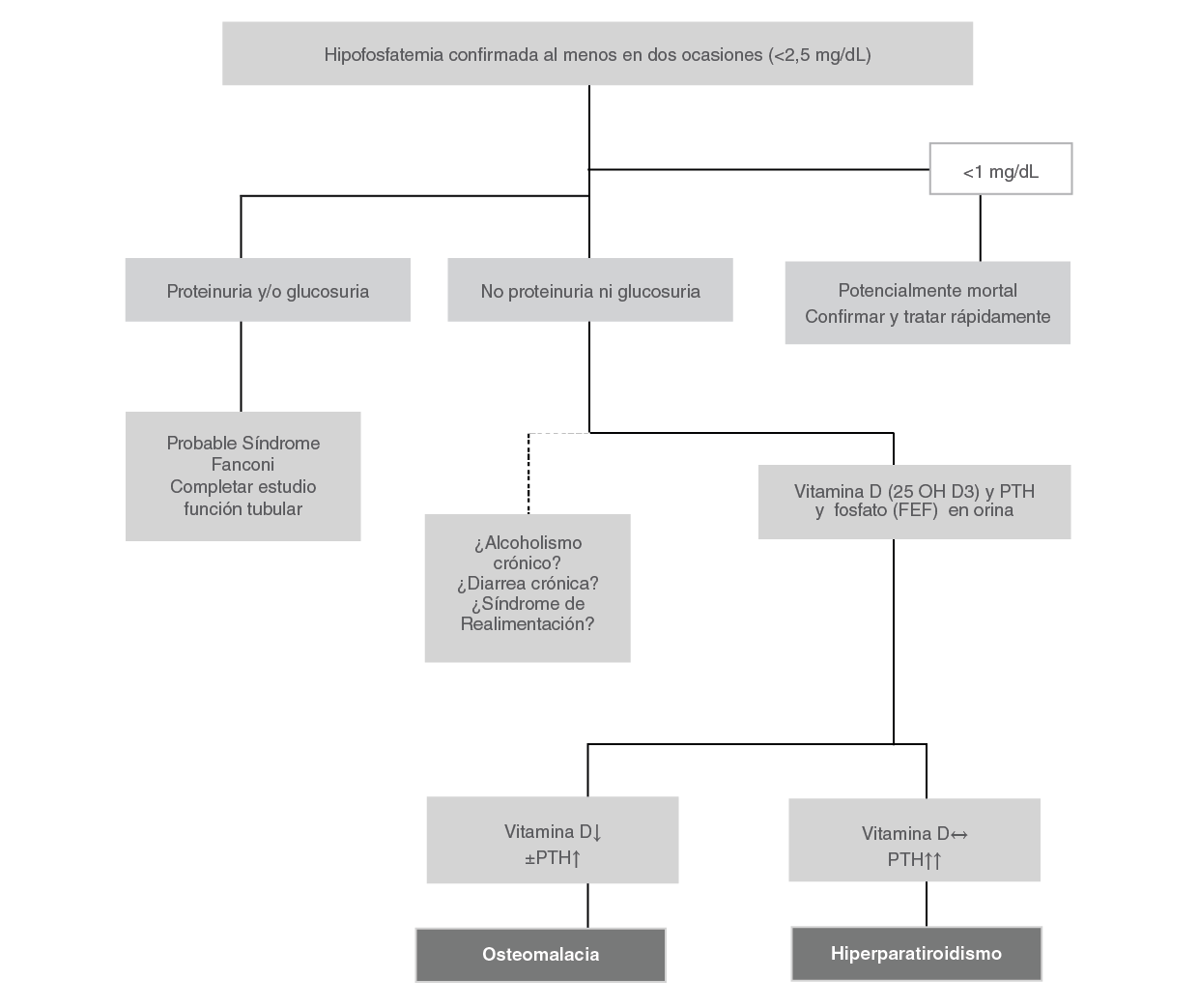
Tablas:

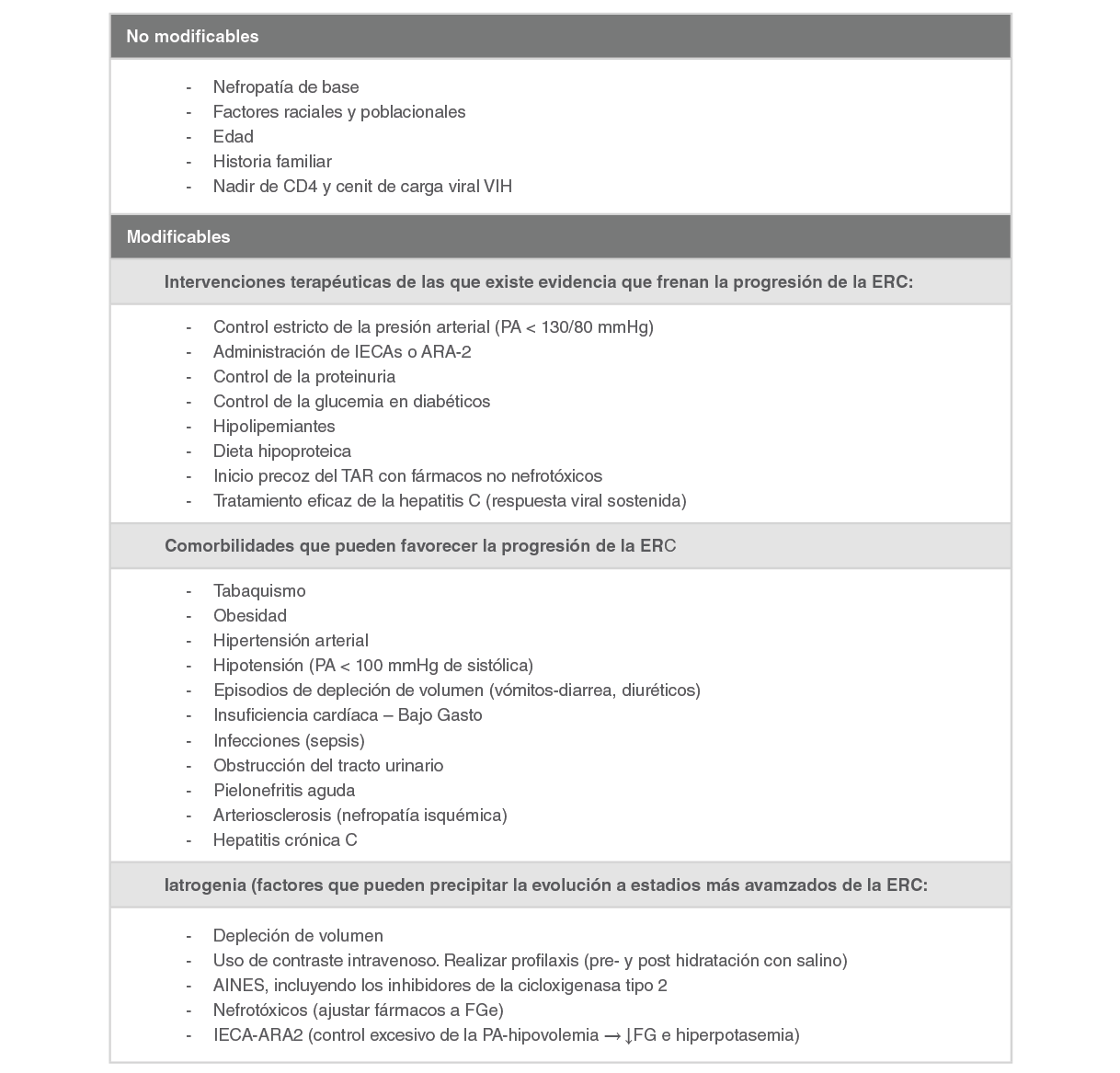
PA, presión arterial; ERC, enfermedad renal crónica; IECAs, inhibidores del enzima convertidor de la angiotensina; ARA-2, antagonistas del receptor de la angiotensina 2; AINES, antiinflamatorios no esteroideos; FGe, filtrado glomerular estimado.

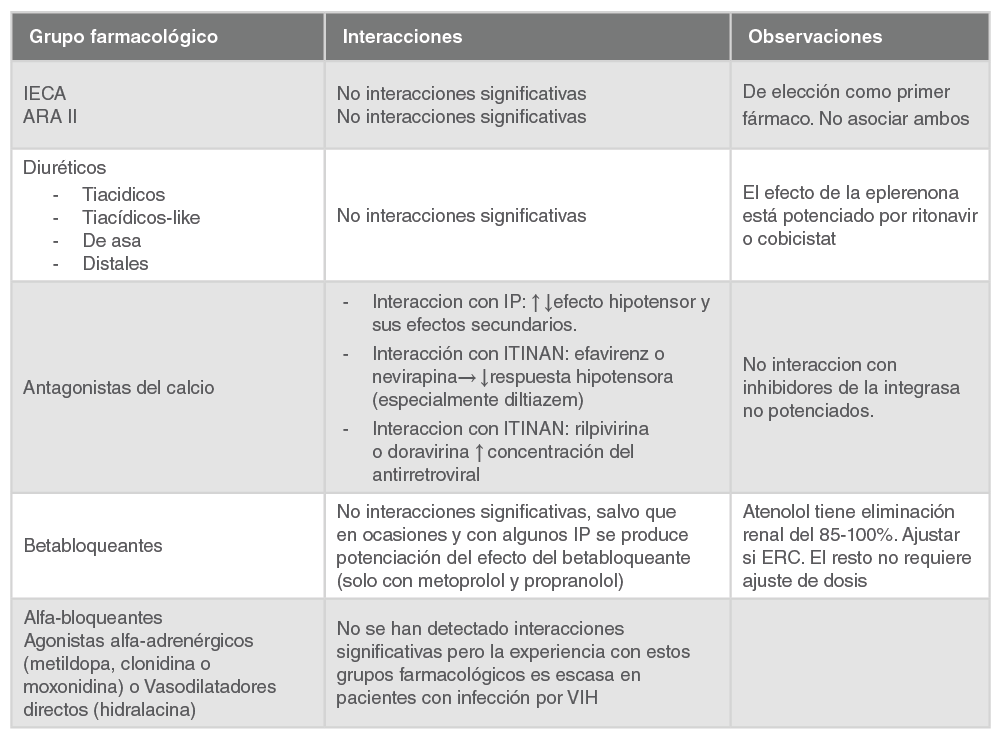
IECA, inhibidores del enzima conversiva de la angiotensina; ARA II, antagonistas de los receptores de la angiotensina II; IP, inhibidores de la proteasa; ITINAN, inhibidores de la transcriptasa inversa no análogos de nucleósidos; ERC, enfermedad renal crónica.

(*) Sobre todo con pautas basadas en inhibidores de la proteasa con ritonavir o efavirenz
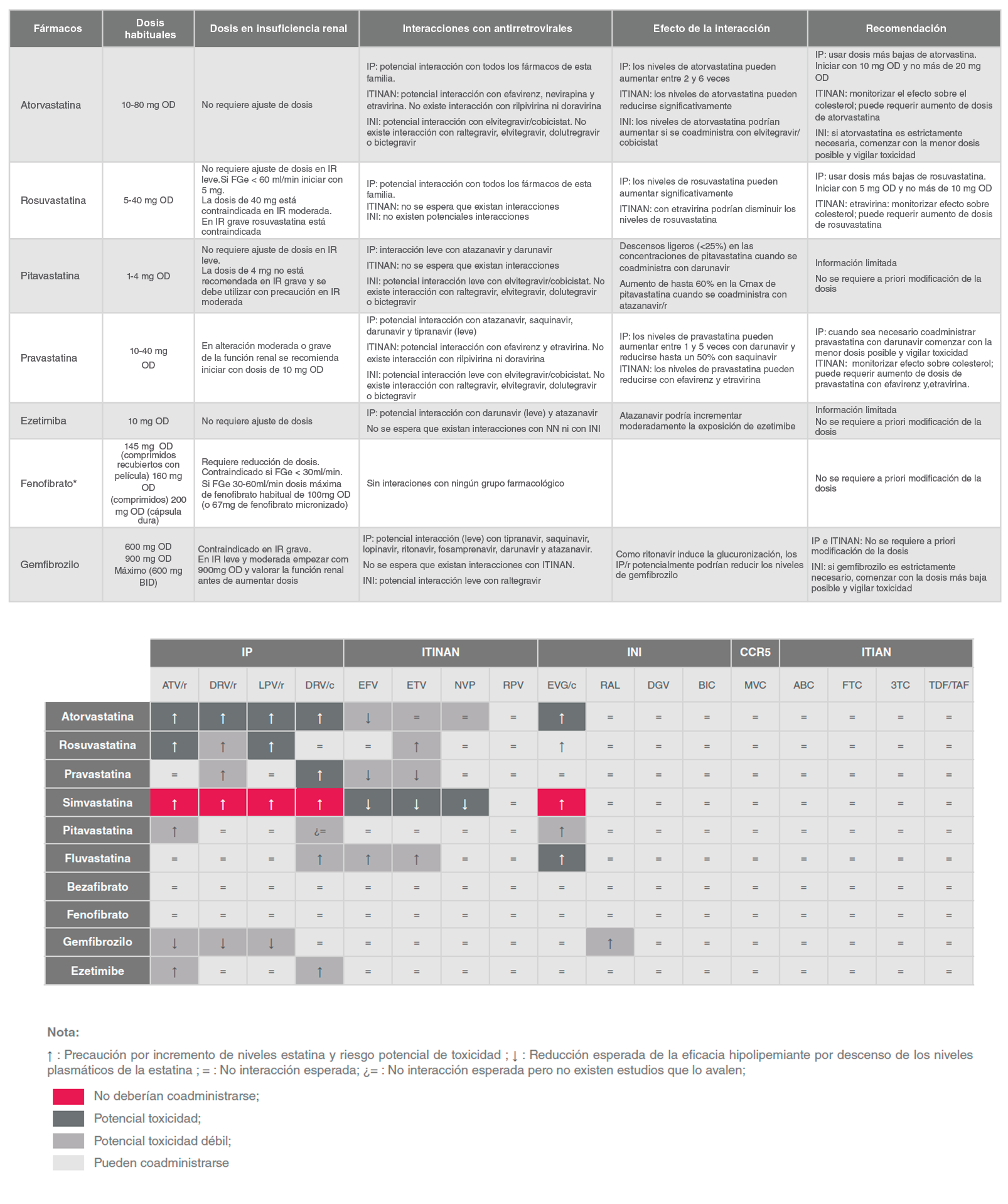
Abreviaturas:
BID: dos veces al día; FGe: filtrado glomerular estimado; IP: inhibidores de la proteasa; IP/r: inhibidores de la proteasa potenciados con ritonavir; ITINAN: no nucleósidos; INI: inhibidores de la integrasa; OD: una vez al día; IR: insuficiencia renal. *Fenofibrato puede producir un aumento reversible de la creatinina sérica
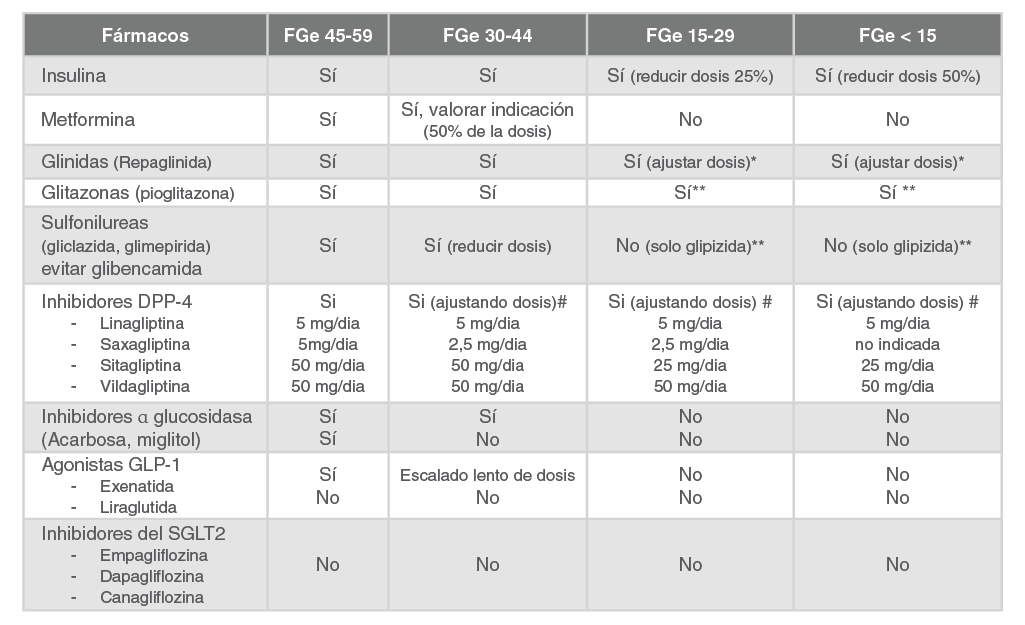
FGe, filtrado glomerular estimado (en ml/min/1,73 m²); DPP-4: dipeptidil peptidasa-4; SGLT2: cotransportador sodio-glucosa tipo 2
*Riesgo de hipoglucemias
**precaución por posibilidad de retención hídrica e insuficiencia cardiaca
***Riesgo muy alto de hipoglucemias con glicazida en estadios 4-5 #: Linagliptina no requiere ajuste de dosis.
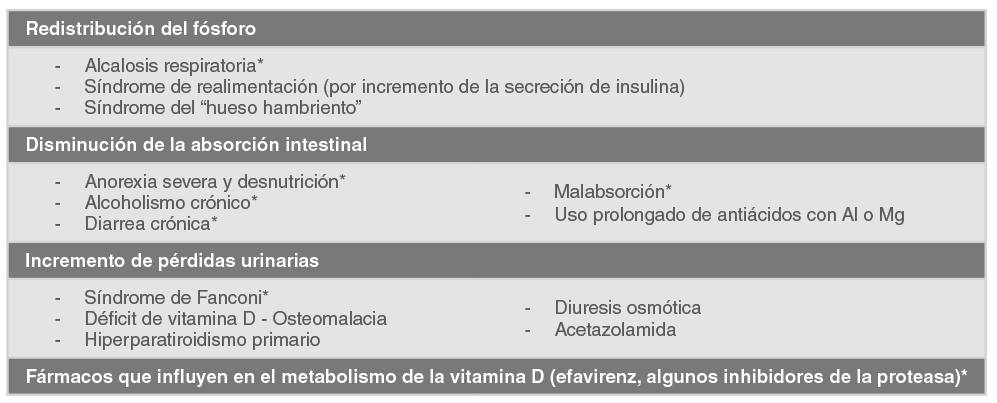
*Causas más frecuentes en pacientes con infección por el VIH.
Bibliografía:
Yahaya I, Uthman AO, Uthman Interventions for HIV-associated nephropathy. Cochrane Database Syst Rev. 2009 Oct 7; (4):CD007183.
Woolnough EL, Hoy JF, Cheng AC et Predictors of chronic kidney disease and utility of risk prediction scores in HIV-positive individuals. AIDS 2018 Aug 24;32(13): 1829-30
Domingo P, Suarez-Lozano I, Gutierrez F, et al. Predictive factors of renal impairment in HIV-infected patients on antiretroviral therapy: Results from the VACH longitudinal cohort study. Nefrologia. 2019;39(5):497-505.
Swanepoel CR, Atta MG, DAgati VD et al. Kidney disease in the setting of HIV infection: conclusions from a Kidney Disease: Improving Global Outcomes (KDIGO) Controversies Conference. Kidney Int. 2018 Mar;93(3):545-59.
Xu Y, Chen X, Wang K et al. Global prevalence of hypertension among people living with HIV: a systematic review and meta-analysis. J Am Soc Hypertens. 2017 Aug;11(8):530-40.
KDIGO Blood Pressure Work Group. KDIGO clinical practice guideline for the management of blood pressure in chronic kidney disease. Kidney Int. 2012; 2: 337–414.
- Whelton PK, Carey RM., Wilbert S. et al. 2017 ACC/AHA/AAPA/ABC/ACPM/AGS/APhA/ASH/ ASPC/NMA/PCNA Guideline for the Prevention, Detection, Evaluation, and Management of High Blood Pressure in Adults: Executive Summary: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. Hypertension. 2018;71:1269–324
Williams B, Mancia G, Spiering W et al.2018 ESC/ESH Guidelines for the management of arterial hypertension. European Heart Journal, 2018; 39 (33):3021–104.
Grupo de expertos del Grupo de Estudio sobre Alteraciones Metabólicas (GEAM), de la Secretaría del Plan Nacional sobre el SIDA(SPNS) y del Grupo de Estudio de SIDA(GeSIDA). Documento de consenso sobre alteraciones metabólicas y riesgo cardiovascular en pacientes con infección por el virus de la inmunodeficiencia humana. Enferm Infecc Microbiol Clin. 2015 Jan;33(1):40.e16.
Grundy SM, Stone NJ, Bailey AL et al. 2018 AHA/ACC/AACVPR/AAPA/ABC/ACPM/ADA/AGS/ APhA/ASPC/NLA/PCNA Guideline on the Management of Blood Cholesterol. Circulation. 2018 Nov 10:CIR0000000000000625.
Grünfeld Dyslipidemia and its Treatment in HIV Infection. Top HIV Med. 2010;18:112–118.
Catapano AL, Graham I, De Backer G et al. 2016 ESC/EAS Guidelines for the Management of Dyslipidaemias. Eur Heart J. 2016 Oct 14;37(39):2999-3058.
Strippoli G, Navaneethan SD, Johnson DW et al. Effects of statins in patients with chronic kidney disease: meta-analysis and meta-regression of randomised controlled trials. BMJ 2008; 336:645–51.
Baigent C, Landray MJ, Reith C et al. The effects of lowering LDL cholesterol with simvastatin plus ezetimibe in patients with chronic kidney disease (Study of Heart and Renal Protection): a randomised placebo-controlled trial. Lancet 2011;377:2181-92.
Galli L, Salpietro S, Pellicciotta G et Risk of type 2 diabetes among HIV-infected and healthy subjects in Italy. Eur J Epidemiol. 2012;27:657-65.
Gómez-Huelgas R, Martínez-Castelao A, Artola S, et Documento de Consenso sobre el tratamiento de la diabetes tipo 2 en el paciente con enfermedad renal crónica.Nefrologia 2014;34(1) 34–45.
Bañon S, Del Palacio M, Pérez Elías M et Secondary hyperparathyroidism in HIV-infected patients: relationship with bone remodeling and response to vitamin D supplementation. J Int AIDS Soc 2012;15:18319.
Dao CN, Patel P, Overton ET et al. Low vitamin D among HIV-infected adults: prevalence of and risk factors for low vitamin D Levels in a cohort of HIV-infected adults and comparison to prevalence among adults in the US general population. Clin Infect Dis 2011;52:396-405.
Moe SM, Drüeke TB, Block GA et al on behalf of Kidney Disease: Improving Global Outcomes (KDIGO) CKD-MBD Work Group. KDIGO clinical practice guideline for the diagnosis, evaluation, prevention, and treatment of Chronic Kidney Disease-Mineral and Bone Disorder (CKD-MBD). Kidney Int2009;(Suppl.113):S1-130.
KDIGO Clinical Practice Guideline for Anemia in Chronic Kidney Disease. Kidney Int. 2012;(Suppl 4):331–5.
Mikhail A, Brown Renal association clinical practice guideline on Anaemia of Chronic Kidney Disease. BMC Nephrol. 2017 Nov 30;18(1):345.
Mehran R, Dangas GD, Weisbord SD. Contrast-Associated Acute Kidney Injury. N Engl J Med 2019 May 30;380(22):2146-55.
American College of Radiology (ACR) Committee on Drugs and Contrast Media. Manual on contrast media, version 10.2. 2016.
Roth D, Nelson DR, Bruchfeld A, et al. Grazoprevir plus elbasvir in treatment-naive and treatment- experienced patients with hepatitis C virus genotype 1 infection and stage 4-5 chronic kidney disease (the C- SURFER study): a combination phase 3 study. Lancet 2015;386:1537–45.
Reau N, Kwo PY, Rhee S, et al. Glecaprevir/Pibrentasvir Treatment in Liver or Kidney Transplant Patients With Hepatitis C Virus Infection. Hepatology. 2018 Oct;68(4):1298-307.
Gane E, Lawitz E, Pugatch D, Papatheodoridis G, Bräu N, Brown Aet Glecaprevir and Pibrentasvir in Patients with HCV and Severe Renal Impairment. N Engl J Med 2017; 377:1448-55.
Calleja JL, Macias J, Forns X et al. Guidelines on treatment of hepatitis C virus infection. Spanish Association for the Study of the Liver (AEEH). GastroenterolHepatol. 2018 Nov;41(9):597-608
Executive summary of the GeSIDA/National AIDS Plan consensus document on antiretroviral therapy in adults infected by the human immunodeficiency virus (updated January 2018). EnfermInfeccMicrobiolClin. 2019 Mar;37(3):195-202.
EASL 2017 Clinical Practice Guidelines on the management of hepatitis B virus infection. J Hepatol. 2017 Aug;67(2):370-98
AASLD guidelines for treatment of chronic hepatitis Hepatology. 2016 Jan;63(1):261-83.
6. TRATAMIENTO RENAL SUSTITUTIVO CON DIÁLISIS EN PACIENTES CON INFECCIÓN POR EL VIH
La supervivencia de los pacientes con infección por el VIH en diálisis ha mejorado de forma muy significativa en los últimos años. En relación con esta mejoría, y aunque la incidencia de ERC terminal parece estabilizarse, la prevalencia de pacientes con VIH en diálisis en EE.UU. y en algunos países europeos tiende a experimentar un ligero incremento en los últimos años 12. En España, los datos más recientes recogidos a partir de los registros de las CC.AA. muestran una prevalencia de 0.5% 3. En la mayoría de estudios, la supervivencia en diálisis continúa siendo inferior a la de los pacientes sin infección VIH. No obstante, estudios recientes, ajustados según comorbilidad, observan esta mayor mortalidad solo en pacientes no caucasianos y en coinfectados con VHC, en tanto que entre caucasianos la infección VIH aislada no se asocia con mayor riesgo de muerte 4. En nuestro país la prevalencia de coinfección VIH-VHC en los pacientes en tratamiento renal sustitutivo es todavía muy elevada 3. Los nuevos antivirales de acción directa han demostrado su eficacia en la erradicación del VHC en la población en diálisis, y, por tanto, los pacientes coinfectados deben ser tratados de forma similar a los monoinfectados con VHC 5. La prevalencia de coinfección por el VHB en España es mucho menor (7.8% coinfectados con VHB, 53% coinfectados por VHC) 3.
La modalidad de terapia sustitutiva renal más utilizada en pacientes con infección por el VIH es la hemodiálisis, aunque esto ocurre también en los pacientes no infectados por VIH 34. Algunos trabajos reportan mayor supervivencia en hemodiálisis que en diálisis peritoneal, en tanto que otros comunican mejores resultados con esta última técnica 4. En general la evolución parece similar en ambas modalidades de diálisis. La elección de uno u otro tipo de tratamiento renal sustitutivo debe basarse, por tanto, en las características y preferencias del paciente siguiendo las mismas recomendaciones que para la población sin infección por el VIH 12.
En relación al riesgo de contagio del virus en las unidades de hemodiálisis, el estricto cumplimiento de las precauciones universales de control de las infecciones es suficiente para prevenir la transmisión de la infección VIH en diálisis sin requerir unidades especiales 12. Sin embargo, es preciso resaltar, dada la alta prevalencia en estos pacientes, que en caso de coinfección por el VHB o por el VHC son obligatorias medidas de aislamiento de acuerdo con lo recogido en las guías clínicas para pacientes con estas infecciones víricas 56. El virus se ha detectado en el efluente peritoneal incluso en pacientes con carga viral plasmática suprimida, por lo que el efluente y el material de diálisis peritoneal deben ser manejados como fluido corporal y material contaminados 7. Los pacientes deben ser informados y entrenados en el manejo de material contaminante. El riesgo de transmisión accidental por exposición percutánea o de mucosas es muy pequeño pero puede ocurrir, por lo que en caso de accidente deben ponerse en marcha lo antes posible medidas de profilaxis postexposición 126.
En relación con el acceso vascular, tampoco la infección por el VIH condiciona recomendaciones específicas en el paciente con ERC. Como primera opción, el acceso vascular de elección es la fístula arteriovenosa autóloga, seguido por la fístula con prótesis y, por último, el catéter tunelizado, de forma similar al paciente sin infección VIH. Para facilitar la realización de la fístula arteriovenosa, en los pacientes con ERC avanzada se debe procurar conservar la red venosa superficial de ambas extremidades superiores, evitando en lo posible punciones y canulaciones. La derivación temprana al nefrólogo del paciente con ERC avanzada para preparar el acceso vascular mejora la tasa de éxito de inicio de diálisis mediante fístula arteriovenosa, disminuyendo la necesidad de catéteres. Como en la población general con ERC, se estima conveniente realizar la fístula arteriovenosa nativa con una antelación previa al inicio de la hemodiálisis de 6 meses y la fístula arteriovenosa protésica con una antelación entre 3 y 6 semanas 8. En el caso de la diálisis peritoneal, la elección del catéter y la técnica de implante no precisa tampoco de recomendaciones especiales en estos pacientes.
El tiempo en tratamiento renal sustitutivo es un factor de riesgo reconocido para la supervivencia del injerto renal. Aún hoy el acceso al trasplante renal es más tardío y limitado en los pacientes con infección por el VIH añadiendo un riesgo innecesario al procedimiento del trasplante. Como el resto de los pacientes con ERC, el paciente con VIH debe ser evaluado y preparado para el acceso al trasplante renal desde estadios avanzados de ERC, si no existe contraindicación para ello 12.
Recomendaciones
- En los pacientes en diálisis infectados por el VIH, se deben cumplir estrictamente las medidas universales de prevención y de desinfección tanto en hemodiálisis como en diálisis peritoneal, de la misma forma que en los pacientes no infectados por el VIH. Grado de recomendación: Fuerte; Calidad de la evidencia: Alta.
- No existe contraindicación para que estos pacientes se dialicen en una unidad general de diálisis con las precauciones universales recomendadas en las Guías. Grado de recomendación: Fuerte; Calidad de la evidencia: Alta.
- En caso de coinfección por VHB o VHC se deberán aplicar medidas de aislamiento similares a las aconsejadas para pacientes monoinfectados con estos virus. Grado de recomendación: Fuerte; Calidad de la evidencia: Alta.
- La modalidad de diálisis en los pacientes con infección por el VIH se seleccionará siguiendo las mismas recomendaciones que para la población sin infección por el VIH. El paciente decidirá la modalidad una vez haya sido informado sobre las ventajas e inconvenientes de cada una de ellas, y siempre que el especialista de Nefrología no considere que una modalidad pueda estar contraindicada. Grado de recomendación: Fuerte; Calidad de la evidencia: Moderada.
- La indicación del tipo de acceso vascular y de catéter de diálisis peritoneal es similar a la población general con ERC. Recomendación de buena práctica clínica basada en consenso.
- En caso de realizar diálisis peritoneal, el paciente debe ser entrenado para el manejo de efluente y material contaminados. Se recomienda que tras eliminar el dializado al inodoro se añada un desinfectante tipo lejía, esperando 30 minutos antes de evacuarlo hacia la red general. Asimismo, las líneas y bolsas del líquido peritoneal deben depositarse tras su uso en contenedores para material contaminante que el paciente pueda llevar al centro sanitario para su eliminación. Recomendación de buena práctica clínica basada en consenso.
- Ante una exposición accidental percutánea o a través de mucosa se iniciará lo antes posible profilaxis postexposición. Grado de recomendación: Fuerte; Calidad de la evidencia: Moderada.
- Los pacientes con ERC e infección por el VIH deben ser vacunados frente a la hepatitis A y hepatitis B, si no están inmunizados, preferiblemente antes del inicio de la diálisis. Recomendación de buena práctica clínica basada en consenso.
- Los pacientes deben ser evaluados para su inclusión en lista de espera de trasplante renal con prontitud, a ser posible antes de su entrada en diálisis, de modo similar a los pacientes sin infección por VIH. Grado de recomendación: Fuerte; Calidad de la evidencia: Moderada.
Bibliografía:
Cohen SD, Kopp JB, Kimmel PL. Kidney Diseases Associated with Human Immunodeficiency Virus Infection.N Engl J Med 2017;377(24):2363-74.
Swanepoel CR, Atta MG, D'Agati VD, et al. Kidney disease in the setting of HIV infection: conclusions from a Kidney Disease: Improving Global Outcomes (KDIGO) Controversies Kidney Int 2018;93(3):545-59.
Saracho R, Martín Escobar E, Comas Farnés J, et Evolución clínica de los enfermos renales crónicos en tratamiento sustitutivo con infección por VIH. Nefrologia 2015;35(5):457-64.
Sawinski D, Forde KA, Locke JE, et al.. Race but not Hepatitis C co-infection affects survival of HIV+ individuals on dialysis in contemporary practice. Kidney Int 2018;93(3):706-15.
Kidney Disease: Improving Global Outcomes (KDIGO) Hepatitis C WorkGroup. KDIGO 2018 clinical practice guideline for the prevention, diagnosis, evaluation, and treatment of hepatitis C in chronic kidney disease. Kidney Int Suppl. 2018;8:91–165.
Panel de Expertos del Grupo de Estudio de SIDA (GeSIDA) de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (SEIMC), la Sociedad Española de Nefrología (SEN) y la Sociedad Española de Bioquímica Clínica Y patología Molecular (SEQC). Documento de consenso sobre el manejo de la patología renal en pacientes con infección VIH. Nefrologia 2014;34 Suppl 2:1-81.
Ndlovu KC, Sibanda W, Assounga A. Detection of human immunodeficiency virus-1 ribonucleicacid in the peritoneal effluent of renal failurepatientsonhighly active antiretroviral therapy.Nephrol Dial Transplant 2017;32(4):714-21.
Ibeas J, Roca-Tey R, Vallespín J, et Guía Clínica Española del Acceso Vascular para Hemodiálisis. Nefrologia 2017;37 Suppl 1:1-191.
Cohen JB, Locke JE, Shelton B, Reed RD, Mustian M, MacLennan P, Forde KA, Reese PP, Disparity in access to kidney allograft offers among transplant candidates with human immunodeficiency virus.ClinTransplant 2019;33(2):e13466. doi: 10.1111/ctr.13466.
7. TRASPLANTE RENAL EN PACIENTES CON INFECCIÓN POR EL VIH
7.1. CRITERIOS PARA INCLUSIÓN EN LISTA DE ESPERA DE TRASPLANTE RENAL A PACIENTES CON VIH
7.2. CRITERIOS PARA INCLUSIÓN EN LISTA DE ESPERA DE DOBLE TRASPLANTE HEPATORRENAL A PACIENTES CON VIH Y ENFERMEDAD HEPÁTICA TERMINAL
7.3. CRITERIOS PARA INCLUSIÓN EN LISTA DE ESPERA DE DOBLE TRASPLANTE DE RIÑÓN Y PÁNCREAS A PACIENTES CON VIH Y DIABETES MELLITUS
7.4. MANEJO DEL PACIENTE CON VIH RECEPTOR DE UN TRASPLANTE RENAL
CRITERIOS PARA INCLUSIÓN EN LISTA DE ESPERA DE TRASPLANTE RENAL A PACIENTES CON VIH
PACIENTES CON INFECCIÓN POR EL VIH SIN COINFECCIÓN POR VHC NI VHB
Los criterios de trasplante renal en pacientes con VIH son los mismos que para la población general, pero además se deben cumplir unos criterios relacionados con la infección por el VIH. Se recomienda que sean dirigidos a una Unidad de Trasplante Renal con experiencia en este tipo de trasplantes. En nuestro país, estos criterios están basados en las recomendaciones de GeSIDA/GESITRA/ONT y son muy similares a los utilizados por otras sociedades científicas.
Los criterios específicos relacionados con la infección por el VIH han sido definidos en los países occidentales y se basan en la opinión de expertos 12345:
- Criterios clínicos: Lo ideal es que el paciente no haya tenido ningún evento definitorio de SIDA. A pesar de ello, algunas infecciones oportunistas potencialmente prevenibles o tratables (tuberculosis, candidiasis esofágica y neumonía por Pneumocystis jiroveci) ya no se consideran criterio de exclusión, y se recomienda una evaluación individualizada de cada caso [5]. En el caso de los tumores, si existe historia de sarcoma de Kaposi cutáneo, carcinoma in situ anogenital, carcinoma cutáneo basocelular y espinocelular y tumores sólidos tratados con intención curativa, el paciente debe permanecer un periodo de 5 años libre de enfermedad. No obstante este periodo se podrá individualizar en función del estadio del tumor. Se ha sugerido ampliar este criterio a todos los eventos definitorios de SIDA con algunas excepciones: leucoencefalopatía multifocal progresiva, criptosporidiasis crónica, linfoma y sarcoma de Kaposi
- Criterios immunológicos: el recuento de linfocitos CD4+ debe ser superior a 200 células/ml.
- Criterios virológicos: la carga viral plasmática del VIH debe ser indetectable por técnicas ultrasensibles (< 50 copias/ml) antes del trasplante y los pacientes deben tener posibilidades de realizar una pauta de TAR que sea efectiva a largo plazo en el periodo post-trasplante.
- Otros criterios: todos los pacientes deben tener una evaluación psiquiátrica favorable. Se excluirá a todos los pacientes con consumo activo de Se recomienda un periodo libre de consumo de 2 años para heroína y cocaína y de 6 meses para otras drogas incluyendo el alcohol. Los pacientes incluidos en programa de metadona de forma estable no deben ser excluidos. Finalmente, los pacientes deben tener un grado adecuado de estabilidad social.
Recomendación
- Los pacientes con VIH y ERC en diálisis o en pre- diálisis (FG<20 mL/ min/1.73m²) que cumplan los criterios generales y los específicos relacionados con la infección por el VIH para trasplante renal deben incluirse en la lista de espera. Grado de recomendación: Fuerte; Calidad de la evidencia: Moderada.
PACIENTES CON INFECCIÓN POR EL VIH COINFECTADOS POR VHC O VHB
La coinfección por el VHB y, sobre todo, por el VHC es muy prevalente al compartir vías de transmisión con el VIH. La infección por el VHC además constituye un problema importante en los pacientes con VIH que necesitan un trasplante renal ya que se asocia a un mayor riesgo de infecciones y es un factor de riesgo de mortalidad y de pérdida del injerto 678.
En los pacientes coinfectados por VHB y/o VHC se recomienda realizar una evaluación hepática completa y tratamiento antivírico del virus de la hepatitis. Para la infección por el VHB existen diferentes fármacos (TDF, TAF, entecavir) que consiguen frenar eficazmente la replicación vírica. Para el VHC los antivirales de acción directa (AAD) tienen una eficacia excelente alcanzando tasa de respuesta viral sostenida por encima del 90% prácticamente en todos los grupos de población, tanto en monoinfectados por el VHC como en coinfectados por el VHC y el VIH 9101112131415. Se recomienda que el tratamiento antiviral sea previo al trasplante con el fin de minimizar la progresión del daño hepático y evitar las interacciones de los AAD con los inmunosupresores.En pacientes con ERC leve o moderada (FG ≥ 30ml/min/1.73 m²), se recomienda tratar la infección por el VHC con las pautas preferentes para cada genotipo, sin que sea necesario ningún ajuste de dosis. Por el contrario, en pacientes con ERC grave (FG < 30ml/min/1.73 m²), y ERC terminal en hemodiálisis se recomiendan regímenes de AAD que no incluyan sofosbuvir pues diferentes estudios han demostrado incrementos relevantes de las concentraciones plasmáticas del fármaco, así como deterioro progresivo de la función renal con manifestaciones clínicas asociadas 161718192021. Para genotipos 1A,1B ó 4 puede emplearse elbasvir 50 mg/grazoprevir 100 mg durante 12 semanas 19. Los genotipos 1, 2, 3, 4, 5 y 6 pueden tratarse con glecaprevir 300 mg/pibrentasvir 120 mg durante 8-12 semanas dependiendo de si existe cirrosis y/o el paciente ha recibido tratamiento previo 21.
Recomendaciones
- En los pacientes con VIH que cumplen los criterios generales y específicos para recibir un trasplante de órgano y tienen coinfección por el VHC y/o VHB se debe realizar una evaluación previa de la situación de su hepatopatía que inlcuya pruebas de imagen. Recomendación de buena práctica clínica basada en consenso.
- En los pacientes coinfectados por VHC que sean candidatos a trasplante renal aislado se recomienda el tratamiento antiviral antes de realizar el trasplante. Grado de recomendación: Recomendación de buena práctica clínica basada en consenso.
- En los pacientes coinfectados por VHB que sean candidatos a trasplante renal aislado se recomienda tratamiento antiviral antes y después del trasplante. Grado de recomendación: Fuerte; Calidad de la evidencia: Alta.
- En pacientes con hepatopatía crónica avanzada se desaconseja el trasplante renal aislado y se evaluará para trasplante hepatorrenal combinado, aunque la experiencia es muy limitada y su indicación deberá individualizarse. Recomendación de buena práctica clínica basada en consenso.
- En pacientes con ERC leve o moderada se recomienda tratamiento antivírico para el VHC con las mismas pautas que en la población general. Grado de recomendación: Fuerte; Calidad de la evidencia: Alta.
- En pacientes con ERC grave en hemodiálisis se recomiendan pautas sin sofosbuvir. Grado de recomendación: Fuerte; Calidad de la evidencia: Moderada.
CRITERIOS PARA INCLUSIÓN EN LISTA DE ESPERA DE DOBLE TRASPLANTE HEPATORRENAL A PACIENTES CON VIH Y ENFERMEDAD HEPÁTICA TERMINAL
Existe consenso en que la hepatopatía avanzada es una contraindicación para el trasplante renal aislado y, viceversa, la insuficiencia renal crónica es una contraindicación para el trasplante hepático aislado. El problema radica en que en el doble hepatorrenal (THR), en ocasiones se trasplanta el hígado prematuramente en pacientes con ERC terminal, y en otras ocasiones se trasplanta el riñón en pacientes con insuficiencia renal no demasiado evolucionada.
La insuficiencia renal previa al trasplante ortotópico hepático (TOH) es un factor de riesgo independiente de supervivencia, por lo que desde la adopción del modelo MELD en el año 2002, se ha incrementado sustancialmente la indicación del doble THR. El doble THR mejora la supervivencia del paciente con indicación de trasplante hepático cuando éste se encuentra en diálisis o con insuficiencia renal avanzada. Sin embargo, no está demostrado que este modelo aporte beneficios en la supervivencia del paciente respecto al TOH aislado en pacientes con insuficiencia renal ligera-moderada 2223242526.
En el síndrome hepatorrenal es muy importante poder establecer la potencial reversibilidad del fracaso renal agudo para poder indicar un doble THR o un TOH aislado. Existen datos que sugieren que el THR ofrece beneficios en la supervivencia sobre el TOH, sólo en aquellos pacientes con síndrome hepatorrenal con necesidad de diálisis durante un mínimo de 6-8 semanas pre-trasplante. De los pacientes sometidos a TOH, el 89% de ellos recuperaron la función renal sin necesidad de diálisis más allá del mes post TOH, y la creatinina sérica media a los 265 días de evolución disminuyó hasta 1.55 mg/dl, dato que confirma la reversibilidad de la función renal en los pacientes con síndrome hepatorrenal después del TOH, y sólo 3 de los 80 pacientes necesitaron hemodiálisis crónica (3,5%) 27.
La biopsia renal también es muy útil para establecer la irreversibilidad de la insuficiencia renal y poder indicar el doble THR o el TOH aislado. El grado de fibrosis intersticial en la biopsia es un marcador de progresión hacia la ERC terminal, por lo que se ha estimado que por encima del 30% se debe valorar la indicación para THR. La glomeruloesclerosis también es un marcador de progresión hacia la ERC terminal, aunque no tan potente como el anterior. Por este motivo, se ha sugerido que los pacientes con un FGe<30 mL/ min/1.73m² deberían disponer de una biopsia renal. Sin embargo, no siempre es posible dado el riesgo de complicaciones por sangrado en este tipo de pacientes 25.
En el año 2008, expertos de la Sociedad Americana de Cirujanos de Trasplante (ASTS), de la Sociedad Americana de Trasplante (AST), del United Network for Organ Sharing (UNOS) y de la Sociedad Americana de Nefrologia (ASN), elaboraron un documento de consenso sobre las indicaciones para THR . Se establecieron las siguientes indicaciones:(a) enfermedad hepática terminal (EHT) y ERC en diálisis; (b) EHT e IRA en diálisis durante un mínimo de 8 semanas; (c) EHT y ERC con FG < 30 mL/min/1.73m²; (d) EHT e IRA de causa no aclarada con FG < 30 mL/min/1.73m² y con fibrosis y/o glomeruloesclerosis >30% en la biopsia, también se recomienda la realización de THR 25.
En un esfuerzo para evitar un trasplante renal innecesario en pacientes con EHT la Sociedad Internacional de Trasplante de Hígado posteriormente incluyó también el doble THR en los pacientes con EHT y ERC con FG < 30 mL/min/1.73m² y proteinuria > 3 gramos/dia; y en los pacientes con EHT e IRA con necesidad de diálisis durante más de 6 semanas 2628.
Recientemente la Sociedad Española de Trasplante Hepático ha publicado un documento de consenso sobre la indicación de THR simultáneo en pacientes con EHT e insuficiencia renal 29. Estas recomendaciones, detalladas en la Tabla 14, se basan en la información generada en población sin infección por el VIH. La experiencia del THR en pacientes infectados por el VIH es muy limitada.
Recomendaciones
- Se deben valorar para THR combinado los pacientes con ERC y hepatopatía crónica que cumplan los criterios generales de trasplante renal, los específicos de la infección por el VIH y los de THR. Recomendación de buena práctica clínica basada en consenso.
- La experiencia del THR combinado en pacientes con infección por el VIH es muy limitada, por lo que su indicación debe individualizarse. Recomendación de buena práctica clínica basada en consenso.
CRITERIOS PARA INCLUSIÓN EN LISTA DE ESPERA DE DOBLE TRASPLANTE DE RIÑÓN Y PÁNCREAS A PACIENTES CON VIH Y DIABETES MELLITUS
Se considera que el doble trasplante de riñón y páncreas (TRP) está indicado en pacientes con DM tipo 1 con ERC en diálisis o pre-diálisis, menores de 55 años y en ausencia de enfermedad vascular severa, neuropatía motora o autonómica incapacitante y/o trastornos psiquiátricos o psicológicos graves con capacidad para entender lo que supone un trasplante y que cumplan criterios de trasplante renal; se evaluará individualmente a los pacientes mayores de 55 años y cuando la ERC se da en DM tipo 2 30. El trasplante de páncreas puede realizarse de forma simultánea o posterior al renal 31. Los resultados del TRP han ido mejorando siendo las tasas de supervivencia del injerto renal comparables al trasplante renal en pacientes sin DM (85% y 68% a los 5 años y los 10 años, respectivamente). La supervivencia del páncreas es mejor en el trasplante simultáneo y han conseguido también cifras muy significativas (73% y 55% a los 5 y 10 años, respectivamente) 32333435. El principal riesgo del TRP son las complicaciones quirúrgicas (trombosis, fístula, pancreatitis), las infecciones y el mayor riesgo de rechazo pancreático y renal, que en el paciente con VIH está incrementado. Las principales ventajas del TRP son la remisión de la polineuropatía diabética, un mejor control metabólico, una estabilidad de la retinopatía y que evita la recidiva de la nefropatía diabética sobre el riñón trasplantado. La modificación de la macroangiopatía establecida es discreta 34. La experiencia con el TRP en pacientes con infección por el VIH es limitada y los criterios para la inclusión en lista de espera se exponen en la Tabla 15.
Recomendaciones
- Se deben valorar para doble trasplante de riñón y páncreas todos los pacientes con infección por el VIH con DM tipo 1 y ERC avanzada que cumplan los criterios generales de trasplante renal, los criterios específicos de la infección por el VIH y los criterios de TRP. Recomendación de buena práctica clínica basada en consenso.
- La experiencia en doble trasplante de riñón y páncreas en pacientes con infección por el VIH es muy limitada y su indicación debe individualizarse. Recomendación de buena práctica clínica basada en consenso.
MANEJO DEL PACIENTE CON VIH RECEPTOR DE UN TRASPLANTE RENAL
Hasta hace unos años, la infección por el VIH suponía una contraindicación absoluta para cualquier tipo de trasplante. El temor a que la inmunosupresión necesaria en el período postrasplante pudiera acelerar la progresión a SIDA y el desarrollo de infecciones oportunistas, unido además al mal pronóstico de la infección VIH, hacía desestimar esta medida. A pesar de ello, en los pocos casos en que, por la razón que fuera, se practicaron trasplantes renales en la era pre-TAR, el resultado no fue malo 36. La generalización del TAR a partir del año 1996 y la eficacia y tolerancia de los fármacos disponibles en la actualidad ha cambiado radicalmente el pronóstico de los pacientes, de forma que se ha convertido en una enfermedad crónica manejable y controlable.
SUPERVIVENCIA DEL PACIENTE CON VIH RECEPTOR DE UN TRASPLANTE RENAL
En los últimos años se ha incrementado de forma notable la experiencia en trasplante renal en pacientes con infección por el VIH. En una serie de 150 trasplantes renales realizados entre 2003 y 2009 en 19 centros de Estados Unidos 7, la supervivencia del paciente y del injerto fue del 95% y 90%en el primer año y del 88% y 74% en el tercer año, respectivamente. Se consideró que los resultados de supervivencia fueron intermedios entre los obtenidos en la población general trasplantada de EE.UU. y los de un grupo de trasplantes renales de alto riesgo. En una revisión reciente de 36 pacientes con infección VIH que recibieron un TR en 13 hospitales españoles, los resultados fueron muy similares, con una supervivencia del injerto del 91.6% y 86.2% en el primer y tercer año postrasplante 37.
De la experiencia existente en la era del TAR y con los modernos tratamientos inmunosupresores podemos extraer las siguientes conclusiones: a) la supervivencia a medio plazo (de paciente e injerto) en pacientes con VIH adecuadamente seleccionados puede alcanzar tasas similares a las de los pacientes sin infección por el VIH; b) en el periodo post-trasplante los pacientes pueden mantener un buen control virológico e inmunológico bajo TAR; y c) no se ha demostrado que el tratamiento inmunosupresor en el periodo postrasplante condicione una evolución desfavorable de la infección por el VIH ni que haya mayor progresión a SIDA, ni mayor número de infecciones oportunistas o tumores relacionados con el SIDA 38.
Un estudio reciente en el que se recoge la experiencia del trasplante renal en pacientes con VIH en EEUU entre 2008 a 2011 ha puesto de manifiesto la mejoría en la supervivencia en los últimos años, probablemente en relación a la disponibilidad de TAR basados en inhibidores de la integrasa y los cambios en la terapia inmunosupresora, lo que ha supuesto una reducción en el riesgo de interacciones medicamentosas y de rechazo agudo 41. Los datos del registro de trasplantes de EE.UU. indican que en pacientes con VIH y ERC terminal en diálisis, el trasplante renal puede reducir en un 79% la mortalidad a los 5 años frente a permanecer en diálisis, y este beneficio en la supervivencia se demuestra ya apartir de los 7 meses del trasplante renal 42.
Recomendaciones
- Debe considerarse el trasplante renal como un tratamiento adecuado en pacientes con VIH bien seleccionados, ya que la supervivencia del paciente y del injerto renal es similar a la de los pacientes sin VIH y no existe evidencia de evolución desfavorable de la infección por el VIH en el periodo post-trasplante. Grado de recomendación: Fuerte; Calidad de la evidencia: Alta.
- Es recomendable la creación de equipos multidisciplinares en trasplante renal y enfermedades infecciosas-VIH para el seguimiento clínico de estos pacientes. Recomendación de buena práctica clínica basada en consenso.
CONSIDERACIONES ESPECÍFICAS SOBRE EL TRASPLANTE RENAL EN PACIENTES CON VIH
La complejidad del tratamiento del paciente con VIH que se somete a un trasplante renal requiere la colaboración multidisciplinar de nefrólogos, especialistas en enfermedades infecciosas y expertos en trasplante, además de otros especialistas de soporte (farmacéuticos, psicólogos, psiquiatras, trabajadores sociales). Presenta además una serie de peculiaridades, tanto en el período pretrasplante como postrasplante, que es imprescindible comprender y evaluar para poder obtener los mejores resultados. En cualquier caso, todo paciente con VIH que pueda beneficiarse de un trasplante renal, debe ser considerado para inclusión en lista de espera siempre que cumplan los criterios detallados en las secciones anteriores. En este sentido, conviene señalar que, en una estudio llevado a cabo en EE.UU. sólo el 20% de los teóricos candidatos a trasplante VIH (+) habían sido incluidos en lista de espera, frente al 70% de los VIH (-) en el mismo período de tiempo 43. En España, un estudio de casos y controles de GeSIDA/Sociedad Española de Nefrología demostró que mientras el 62% de los 66 pacientes VIH (-) en diálisis había sido admitido a lista de espera de trasplante renal, solo se habían incluido el 17% de los 66 pacientes VIH (+) 44.
Periodo pre-trasplante
Tipo de donante
Los pacientes con VIH que se encuentran en lista de espera de trasplante pueden recibir un injerto renal procedente de un donante cadáver o un donante vivo seronegativo para VIH. En estudios previos, la pérdida del injerto ha sido significativamente menos frecuente cuando el órgano procedía de donante vivo 7. En los últimos años se ha explorado la posibilidad de emplear órganos procedentes de donantes infectados por el VIH 464748. En 2016 se comunicaron los resultados del seguimiento a 5 años de 27 pacientes con VIH que habían recibido un trasplante renal de un donante también infectado por el VIH en Sudáfrica con tasas de supervivencia global de 74% y del injerto de 84%, estando todos los pacientes con carga viral plasmática del VIH indetectable 49. En 2013 en EEUU se modificaron las normas sobre trasplante de órganos en pacientes con VIH (HIV Organ Policy Equity Act, HOPE, Public Law 113-510) para aprobar el inicio de un programa de trasplante con donantes VIH-positivos. Dentro de los criterios de los donantes infectados por el VIH vivos se incluyó presentar un recuento de CD4 > 500 células/mm3 y tener una carga viral <50 copias/ml durante al menos 6 meses antes de la donación, conocer la historia completa del TAR y el perfil de resistencias y disponer de una biopsia renal predonación 50. Datos comunicados en 2018 ponen de manifiesto un incremento de los trasplantes de donantesVIH- positivos entre 2016 a 2018, de 21 a 60 casos.
Si bien los resultados preliminares de los trasplantes renales procedentes de donantes con infección por el VIH son prometedores, la información sobre la seguridad y eficacia a largo plazo es todavía limitada y actualmente esta modalidad de trasplante no se contempla en nuestro entorno.
Recomendaciones
- Los criterios de elección del donante de riñón para implante en personas con infección por el VIH son similares a los de la población general (donante cadáver o donante vivo). Grado de recomendación: Fuerte; Calidad de la evidencia: Moderada.
- La utilización de injertos renales procedentes de donantes con infección por el VIH no se recomienda actualmente en nuestro entorno. Recomendación de buena práctica clínica basada en consenso.
Pautas de TAR en el receptor de trasplante renal
Es importante ajustar la pauta y dosis de los antirretrovirales a la situación de insuficiencia renal avanzada del paciente. Las necesidades de ajuste de dosis en insuficiencia renal avanzada y en diálisis pueden consultarse en este documento, en el documento de tratamiento antirretroviral de GeSIDA/PNS periódicamente actualizado (www.gesida.seimc.org) y en otras fuentes acreditadas (http:// www.interaccioneshiv.com/, http://www.hiv-druginteractions.org; http://www. interaccionesvih.com; http://hivinsite.ucsf.edu)
No hay evidencia científica en la que basar la elección del TAR en receptores de trasplante renal. La pauta elegida debería idealmente tener las siguientes características: 1) suficiente potencia para mantener una carga viral del VIH suprimida; 2) escasas interacciones farmacológicas con los inmunosupresores que son metabolizados por enzimas del citocromo p450: inhibidores de la calcineurina (ciclosporina y tacrolimus), inhibidores de la m-TOR (sirolimus, everolimus) y corticoides; 3) escasa toxicidad renal; 4) perfil de seguridad cardiovascular favorable; y 5) baja probabilidad de desarrollar dislipemia o insulinoresistencia (ambos efectos secundarios de los inmunosupresores).
En cuanto a la selección de los fármacos a emplear, las recomendaciones en receptores de trasplante renal son las mismas que en el conjunto de los pacientes con VIH pero con algunas consideraciones que se describen en la sección 7 y se resumen en la Tabla 16.
Si no existe ninguna contraindicación, la pauta de TAR en receptores de trasplante renal podría incluir la combinación de ABC (o TAF como alternativa) y 3TC o FTC junto a un inhibidor de la integrasa no potenciado, RAL o DTG (en la actualidad no se dispone de experiencia con BIC) o bien la combinación de 3TC y DTG con las mismas indicaciones que en el conjunto de los pacientes con infección por el VIH (www.gesida.seimc.org). En general, las combinaciones a dosis fijas de fármacos antirretrovirales no deben emplearse en pacientes con ERC avanzada ya que no permiten el ajuste individual de la dosis de los fármacos. Es recomendable realizar controles frecuentes de carga viral en el periodo post-trasplante más temprano.
Recomendaciones
- Debe realizarse la tipificación del HLA B57-01 en el donante y el receptor de trasplante. En caso de resultar positivo, se evitará el tratamiento con ABC en el receptor del órgano por riesgo de hipersensibilidad al fármaco. Grado de recomendación: Fuerte; Calidad de evidencia: Baja.
- Se recomienda iniciar el TAR lo antes posible tras la realización del trasplante. Recomendación de buena práctica clínica basada en consenso.
- Si no existe contraindicación o riesgo de fracaso virológico, en receptores de trasplante renal se recomienda una pauta de TAR que incluya una combinación de ABC (o TAF como alternativa) y 3TC (o FTC) con RAL o DTG, o bien una combinación de 3TC y DTG.Grado de Recomendación: Fuerte; Calidad de la evidencia: Moderada.
- Si se utilizan ITINAN, debido a que son inductores del citocromo CYP450, debe considerarse un aumento de la dosis de los inmunosupresores: ciclosporina, tacrolimus, sirolimus y everolimus. Recomendación de buena práctica clínica basada en consenso.
- Si se utilizan IP/r, potentes inhibidores del citocromo P4503A4, debe considerarse una reducción de la dosis de los inmunosupresores: ciclosporina, tacrolimus, sirolimus y everolimus. Recomendación de buena práctica clínica basada en consenso.
- Es recomendable realizar controles más frecuentes de carga viral del VIH en el periodo post-trasplante inicial (3-6 meses). Recomendación de buena práctica clínica basada en consenso.
Vacunas pretrasplante
Debido al mayor riesgo de infecciones postransplante, se recomiendan las siguientes inmunizaciones (además de las habituales del calendario vacunal): Haemophilus influenzae b, hepatitis B (en todos los pacientes sin inmunidad), Streptococcus pneumoniae (en no vacunados o vacunados hace más de tres años), gripe (anual, a principios de otoño), varicela en pacientes seronegativos (demorando un mes el trasplante) y hepatitis A. El momento óptimo de administración de las vacunas es antes de comenzar la diálisis, pero en caso de no haber podido hacerlo entonces se intentará completar el calendario vacunal antes de la realización del trasplante. Las pautas pueden consultarse en la web del Grupo de estudio de infección en el paciente trasplantado (GESITRA) de la SEIMC http://www.seimc.org/grupodeestudio.php?Grupo=GESITRA&mn_Grupoid=12. Además, es importante el diagnóstico y tratamiento de las infecciones latentes (incluida la tuberculosis). Se debe recomendar la vacunación anual de la gripe y revisar necesidad de vacunación de triple vírica y varicela en convivientes de la persona trasplantada 5152.
Recomendaciones
Los pacientes con ERC e infección por el VIH candidatos a recibir un trasplante renal, deberán ser vacunados frente a Haemophilus influenzae b, hepatitis B (en todos los pacientes sin inmunidad), Streptococcus pneumoniae (en no vacunados o vacunados hace más de tres años), gripe (anual, a principios de otoño), varicela en pacientes seronegativos (demorando un mes el trasplante) y hepatitis A.Recomendación de buena práctica clínica basada en consenso.
Periodo post-trasplante
Pautas de inmunosupresores de elección en el receptor de trasplante renal
En los inicios del trasplante en los pacientes con infección por el VIH existía el temor de que el uso de fármacos inmunosupresores pudiera acelerar el deterioro inmunológico de estos pacientes y progresión hacia SIDA y muerte. A pesar de este temor, la experiencia acumulada hasta la fecha ha puesto de manifiesto que el uso de inmunosupresores en pacientes con infección por el VIH bien controlados no ha conllevado un incremento de la susceptibilidad a infecciones oportunistas o tumores. Además, es conocido que algunos de estos fármacos han mostrado un efecto beneficioso sobre la replicación del VIH in vitro y un posible efecto beneficioso sobre la reconstitución inmune 53.
No existen regímenes de tratamiento inmunosupresor específicos para los pacientes con infección por el VIH y las pautas de tratamiento inmunosupresor utilizadas en receptores de trasplante renal en la era del TAR no son significativamente diferentes a las utilizadas en los pacientes sin infección por el VIH. El tratamiento inmunosupresor de elección en pacientes con infección por el VIH son los anticuerpos anti-linfocitarios monoclonales (basiliximab) como tratamiento de inducción y la combinación de tacrolimus con micofenolato mofetil y corticoides como tratamiento de mantenimiento 38. Basándose en esta experiencia clínica se pueden realizar algunas recomendaciones específicas para los pacientes con infección por el VIH:
- Inhibidores de la calcineurina (ciclosporina neoral y tacrolimus / tacrolimus de liberación retardada): no existen estudios que hayan comparado de forma directa el efecto de ciclosporina con el de tacrolimus en el curso de la infección por el VIH. Ciclosporina ha sido el fármaco más utilizado hasta el momento actual probablemente por existir evidencias de sus efectos antivirales e inmunomoduladores 53, pero en el momento actual existe preferencia para utilizar tacrolimus de primera elección por su mayor potencia inmunosupresora y menor tasa de rechazo agudo 7. Son fármacos nefrotóxicos que requieren una estrecha monitorización de sus niveles y hay que vigilar las interacciones con los antirretrovirales. Los IP son inhibidores de su metabolismo por lo que aumentan de forma muy importante sus niveles (riesgo de nefrotoxicidad). Por el contrario los ITINAN son inductores por lo que reducen sus niveles (riesgo de rechazo agudo).
- Derivados del ácido micofenólico (micofenolato mofetilo y micofenolato sódico): Tienen efectos inhibidores sobre la replicación del VIH y son sinérgicos con algunos ITIAN( ABC, ddI y tenofovir ) 54. Los efectos secundarios más frecuentes son diarrea y molestias digestivas, leucopenia y anemia. Es necesaria una monitorización de la cifra de leucocitos.
- Inhibidores de la m-TOR (sirolimus, everolimus): estudios experimentales 56 sugieren que sirolimus no parece tener efectos negativos en pacientes con infección por el VIH. Sirolimus reduce los niveles de CCR5 en células CD4, inhibe la replicación del VIH vía R5e incrementa la actividad antiviral de los inhibidores de fusión y antagonistas CCR5. Se dispone de menos experiencia en comparación con ciclosporina o tacrolimus. Los efectos secundarios más frecuentes son leucopenia, anemia, acné, proteinuria, edemas, aftas cutáneos, hipercolesterolemia, retraso en la cicatrización de las heridas o neumonitis farmacológica. Su efecto anti-proliferativo puede ser útil en pacientes con antecedentes de sarcoma de Kaposi pre-trasplante o en el periodo post-trasplante 57. Son fármacos que se metabolizan por el citocromo P450 y son sustratos de la glicoproteína-P y su perfil de interacciones farmacológicas con los antirretrovirales es similar al de ciclosporina y tacrolimus.
- Anticuerpos antilinfocitarios monoclonales anti-CD25 (basiliximab): este anticuerpo con actividad anti-receptor de la interleukina 2 ha demostrado incrementar el recuento de linfocitos CD4+ 58 y la experiencia clínica no ha mostrado efectos negativos en los pacientes con infección por el VIH.
- Anticuerpos antilinfocitarios policlonales (globulina anti-timocito o timoglobulina): Es un potente fármaco inmunosupresor cuya utilización es controvertida debido a que se ha asociado a una severa y prolongada linfopenia con una mayor incidencia de complicaciones infecciosas graves y de pérdida de injerto 7. En otros estudios los resultados no han sido tan desfavorables 60. Se aconseja utilizarlos en pacientes de elevado riesgo inmunológico a dosis reducidas y con estrecha monitorización linfocitaria (CD3) para ajustar la dosis.
- Anticuerpos antilinfocitarios monoclonales anti-CD20 (rituximab): La experiencia en receptores de trasplante renal con infección por el VIH es muy limitada 61. Están indicados en el tratamiento de desensibilización pre- trasplante renal (trasplante renal en pacientes hipersensibilizados o ABO- incompatibles) y en el tratamiento del rechazo humoral agudo. El uso de rituximab en pacientes con infección por el VIH y linfoma no ha puesto de manifiesto un efecto negativo sobre la evolución del Su uso conlleva un riesgo añadido de desarrollo de tuberculosis.
- Corticoides: son inductores del CYP 450 por lo que es necesario vigilar de forma estrecha sus interacciones con IP potenciados e ITINAN. Pueden aumentar los linfocitos CD4+ e inhibir la citoquina CCL2 62.
Recomendaciones
- La terapia inmunosupresora de elección en pacientes con infección por el VIH es con anticuerpos anti-linfocitarios monoclonales anti-CD25 (basiliximab) como tratamiento de inducción y la combinación de tacrolimus con micofenolato mofetil (o ácido micofenólico) y corticoides como tratamiento de mantenimiento. Grado de Recomendación: Fuerte; Calidad de la evidencia: Alta.
- Los anticuerpos antilinfocitarios policlonales deben utilizarse con precaución, a dosis bajas y ajustadas por las cifras de CD3, por el mayor riesgo de desarrollar linfopenia prolongada e infecciones. Asimismo, deben valorarse de forma individualizada en el trasplante renal de alto riesgo inmunológico o en el tratamiento del rechazo agudo severo o cortico-resistente. Recomendación de buena práctica clínica basada en consenso.
Interacciones farmacológicas entre los antirretrovirales y los fármacos inmunosupresores
Algunos antirretrovirales pueden inhibir o inducir el metabolismo de algunos inmunosupresores por interferencia del sistema enzimático P450 isoenzima CYP3A4 (empleado en el metabolismo de ciclosporina, tacrolimus, sirolimus o everolimus). Es primordial la monitorización estrecha de las concentraciones plasmáticas de los inmunosupresores en pacientes trasplantados renales en TAR. Cualquier cambio en la dosificación de estos fármacos o la introducción de un nuevo tratamiento obliga a monitorizar los niveles de los fármacos inmunosupresores.
La utilización de fármacos no inmunosupresores que sean también inductores o inhibidores del sistema enzimático P450 pueden influir en la biodisponibilidad de los antirretrovirales con la consiguiente pérdida de eficacia o toxicidad. Es recomendable consultar las potenciales interacciones de un nuevo tratamiento en pacientes con infección por el VIH en TAR. Para ello existen diferentes portales electrónicos, de acceso gratuito, que analizan estas interacciones, y que se actualizan continuamente (http://www.hiv-druginteractions.org;http://www. interaccionesvih.com; http://hivinsite.ucsf.edu).
La complejidad de las posibles interacciones entre los fármacos antirretrovirales e inmunosupresores, aconseja crear equipos de especialistas en Nefrología y Enfermedades Infecciosas-VIH que evalúen conjuntamente las posibles repercusiones farmacocinéticas y clínicas de cualquier modificación del tratamiento, tanto en el campo de la eficacia antiviral como en el de la inmunosupresión. En relación al TAR en el postrasplante inmediato, se recomienda iniciarlo lo antes posible tras la realización del trasplante.
Recomendaciones
- Los IP son inhibidores enzimáticos muy potentes del metabolismo de ciclosporina, tacrolimus, sirolimus y everolimus, aumentando de forma significativa sus concentraciones plasmáticas con lo que existe un mayor riesgo de toxicidad. Se recomienda un ajuste de la dosis de estos inmunosupresores. Recomendación de buena práctica clínica basada en consenso.
- Los ITINAN son inductores enzimáticos moderados del metabolismo de ciclosporina, tacrolimus, sirolimus y everolimus, reduciendo de forma significativa sus concentraciones plasmáticas con lo que existe un mayor riesgo de rechazo agudo. Se recomienda un ajuste de la dosis de estos inmunosupresores. Recomendación de buena práctica clínica basada en consenso.
- En caso de utilizar ITINAN o IP se recomienda monitorizar los niveles plasmáticos de los inmunosupresores durante el tratamiento o ante cualquier cambio de dosis o suspensión de tratamiento. Recomendación de buena práctica clínica basada en consenso.
- Se recomienda consultar en fuentes electrónicas actualizadas las posibles interacciones farmacocinéticas existentes entre el tratamiento inmunosupresor, antirretroviral u otros fármacos que se prescriban al paciente trasplantado. Recomendación de buena práctica clínica basada en consenso.
Adherencia al tratamiento
Tras el trasplante renal, los pacientes deben recibir una gran cantidad de medicamentos (inmunosupresores, antirretrovirales, profilaxis de infecciones oportunistas) lo que puede comprometer la adherencia. En este sentido es fundamental haber informado y educado al paciente convenientemente, antes del trasplante.
Rechazo agudo del injerto renal en pacientes con infección por el VIH
Clásicamente se ha descrito una frecuencia elevada de rechazo agudo tras el trasplante renal en pacientes con infección por el VIH (30-40%) en comparación con los no infectados (15-20%). El mecanismo exacto no se conoce aunque se han sugerido diferentes causas, entre ellas la disfunción del sistema inmune asociada al VIH, una inmunosupresión inadecuada por la interacción farmacológica con los antirretrovirales, factores raciales, uso de ciclosporina e injerto procedente de donante cadáver. En las series recientes, el empleo de inducción con basiliximab en combinación con tacrolimus, micofenolato y corticoides se ha asociado a frecuencias reducidas de rechazo agudo similares a las de la población general (7, 8, 37, 63, 64).
En algunos estudios europeos y americanos se ha observado también una mayor incidencia de función renal del injerto retardada 37 a la que podrían contribuir diversos factores, incluyendo un mayor tiempo en diálisis antes del trasplante, mayor prevalencia de infección por VHC, mayor frecuencia de interacciones medicamentosas y toxicidad farmacológica y al estado pro-inflamatorio asociado al VIH.
Coinfección por el VHC en el período postrasplante
El VIH y el VHC comparten las mismas vías de transmisión, lo que explicala elevada prevalencia de coinfección por ambos virus. Los pacientes con infección por el VIH que están en diálisis en España tienen también una elevada prevalencia de coinfección por el VHC que se ha asociado con una mayor comorbilidad, mayor dificultad en el manejo y menor acceso al trasplante renal 3839.
En los casos de coinfección por VHC y VIH, el trasplante renal supone el principal factor de riesgo de evolución de la hepatopatía por VHC en pacientes en hemodiálisis, siendo la insuficiencia hepática una de las principales causas de muerte a largo plazo de estos pacientes 68. Se cree que es debido a que el tratamiento inmunosupresor postrasplante modifica la historia natural de la hepatopatía, activa la replicación viral y acelera el desarrollo de la hepatopatía crónica. Además, el VHC facilita la aparición de algunos tipos de glomerulopatías en el receptor de trasplante que pueden condicionar la función y supervivencia del injerto. Todos estos motivos justifican la necesidad de planificar el tratamiento del VHC antes del trasplante.
Tablas:
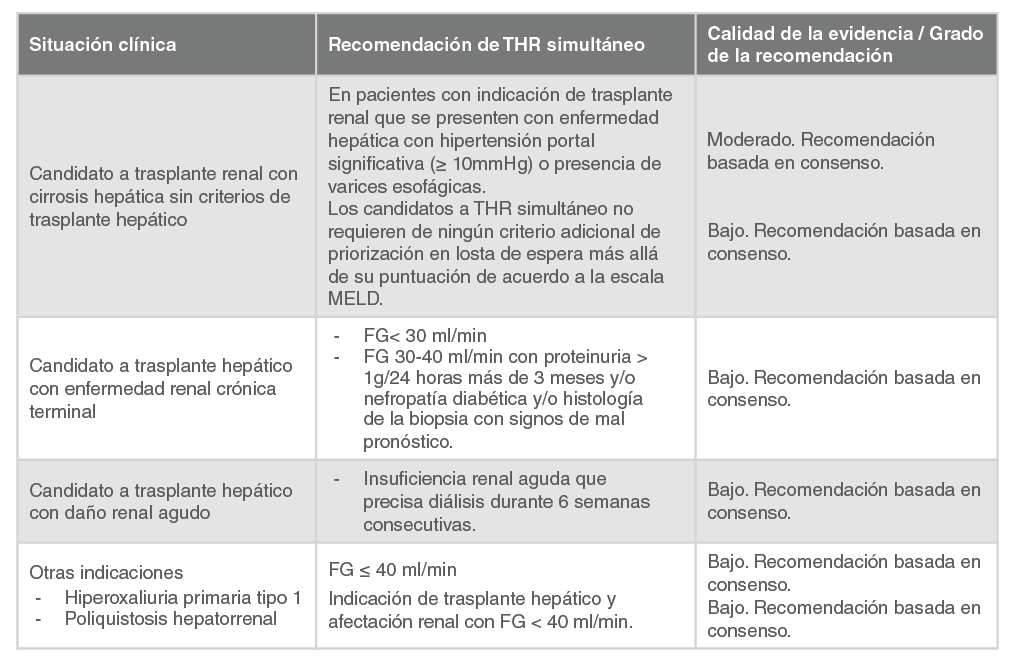
FG, filtrado glomerular (*) Ref. 29. Pardo F, Pons JA, Castells Ll, Colmenero J, Gómez MA, Lladó L, et al. VI documento de consenso de la sociedad española de trasplante hepático (SETH). Cir Esp 2018; 96 6: 326-341.


*Todas las pautas recomendadas deberán de tener en cuenta la potencial nefrotoxicidad de cada régimen, así como las recomendaciones de GeSIDA/Plan Nacional sobre el Sida respecto al tratamiento antirretroviral en adultos infectados por el virus de la inmunodeficiencia humana.
Bibliografía:
Bhagani S, Sweny P, Brook G. Guidelines for kidney transplantation in patients with HIV disease. HIV Med. 2006;7:133–9.
Miro JM, Torre-Cisneros J, Moreno A, et al. GeSIDA/GESITRA-SEIMC, PNS and ONT consensus document on solid organ transplant (SOT) in HIV-infected patients in Spain (March, 2005). Enferm Infecc Microbiol Clin. 2005;23:353–62.
Grossi P, Tumietto F, Costigliola P, et Liver transplantation in HIV-infected individuals: results of the Italian national program. Transplantation. 2006;82 Suppl 2:446.
Solid organ transplantation in the HIVinfected patient. Am J Transplant. 2004;4(Suppl 10):83-8.
Roland ME, Barin B, Carlson L, et HIV-infected liver and kidney transplant recipients: 1- and 3-year outcomes. Am J Transplant 2008;8(2):355-65.
Mazuecos A, Pascual J, Gomez E, et al. Renal transplantation in HIV-infected patients in Spain. Nefrologia 2006;26(1):113-20.
Stock PG, Barin B, Murphy B, et al. Outcomes of kidney transplantation in HIV-infected recipients. N Engl J Med 2010;363(21):2004-14.
Mazuecos A, Fernandez A, Andres A, et al. HIV infection and renal transplantation. Nephrol Dial Transplant 2011;26(4):1401-7.
Wyles DL, Ruane PJ, Sulkowski MS, et al. Daclatasvir plus sofosbuvir for HCV in patients coinfected with HIV-1. N Engl J Med 2015;373(8):714-25.
Naggie S, Cooper C, Saag M, et Ledipasvir and sofosbuvir for HCV in patients coinfected with HIV-1. N Engl J Med 2015 20;373(8):705-13.
Kwo P, Gane EJ, Peng C-Y, et al. Effectiveness of elbasvir and grazoprevir combination, with or without ribavirin, for treatment-experienced patients with chronic hepatitis C Gastroenterology 2017;152(1):164-75.e4.
Calleja JL, Crespo J, Rincon D, et al. Effectiveness, safety and clinical outcomes of direct-acting antiviral therapy in HCV genotype 1 infection: Results from a Spanish real-world cohort. J Hepatol 2017;66(6):1138-48.
Marino Z, Pascasio-Acevedo JM, Gallego A, et High efficacy of sofosbuvir plus simeprevir in a large cohort of Spanish cirrhotic patients infected with genotypes 1 and 4. Liver Int 2017;37(12):1823-32.
Crespo J, Calleja JL, Fernández I, et Real-world effectiveness and safety of oral combination antiviral therapy for hepatitis C virus genotype 4 infection. Clin Gastroenterol Hepatol 2017;15(6):945-9.e1.
Menard A, Colson P, Catherine D, et al. First real life evidence of new direct-acting antivirals (DAA) in co-infected HIV HCV patients: Better than ever. Clin Infect Dis 2016;62(7):947-9.
Guía AEEH/SEIMC de manejo de la Hepatits 2018.
EASL Recomendations on Treatment of Hepatitis C J Hepatol 2018 ;69 :461-511.
Lawitz E, Landis CS, Maliakkal BJ, et al. Safety and efficacy of treatment with once-daily ledipasvir/ sofosbuvir (90/400 mg) for 34 12 weeks in genotype 1 HCV-infected patients with severe renal impairment. Hepatology 2017;66:848A.
Bruchfeld A, Roth D, Martin P, et Elbasvir plus grazoprevir in patients with hepatitis C virus infection and stage 4–5 chronic kidney disease: clinical, virological, and health related quality-of-life outcomes from a phase 3, multicentre, randomised, double-blind, placebo-controlled trial. Lancet Gastroenterol Hepatol 2017;2:585–94.
Kramer JR, Puenpatom A, Erickson K, et al. Effectiveness of elbasvir/grazoprevir in patients with chronic hepatitis C and chronic kidney disease: results from the Veterans Affairs system. Hepatology 2017;66:597A.
Gane E, Lawitz E, Pugatch D, et Glecaprevir and pibrentasvir in patients with HCV and severe renal impairment. N Engl J Med 2017;377:1448–55.
Bloom RD, Bleicher Simultaneous liver-kidney transplantation in the MELD era. Adv Chronic Kidney Dis 2009,16(4):268-77.
Locke JE, Warren DS, Singer AL et Declining outcome in simultaneous liver-kidney transplantation in the MELD era: ineffective usage of renal allografts. Transplantation 2008;(85):935-42.
Schmitt TM, Kumer SC, Al-Osaimi A et Combinedliver-kidney and liver transplantation in patients with renal failure outcomes in the MELD era. Transpl Int. 2009;22(9):876-83.
Eason JD, Gonwa TA, Davis CL et al. Proceedings of consensus conference on simultaneous liver kidney transplantation (SLK). Am J Transplant2008;8:2243.
L. Mindikoglu, J.P. Raufman, S.L. Seliger et al. Simultaneous Liver-Kidney Versus Liver Transplantation Alone in Patients with End-Stage Liver Disease and Kidney Dysfunction Not on Dialysis. Transplant Proc 2011;43(7):2669-77.
Ruiz R. Kunitake H, Wilkinson AH et al. ong-term análisis of combined liver and kidney transplantation at a single center. Arch Surg 2006;141:1-8.
MR Charlton, WJ pared, AO Ojo et Report of the first international liver transplantation society expert panel consensus conference on renal insufficiency in liver transplantation. Liver Transpl 2009; 15:S1- S34.
Pardo F, Pons JA, Castells Ll, et VI documento de consenso de la sociedad española de trasplante hepático (SETH). Cir Esp 2018; 96 (6): 326-41.
Documento de consenso sobre criterios de selección de donante y receptor en trasplante de páncreas. Actualización del documento de consenso sobre Trasplante de Páncreas e Islotes Grupo Español de Trasplante de Páncreas y Organización Nacional de Trasplantes.
Gruessner AC, Sutherland DE, Gruessner Pancreas transplantation in the United States: a review. Curr Opin Organ Transplant 2010;15:93-101.
White SA, Shaw JA, Sutherland Pancreas transplantation. Lancet 2009;373:1808-17.
Ollinger R, Margreiter C, Bösmüller C, Weissenbacher A, Frank F, Schneeberger S, Mark W, Margreiter R, Pratschke J.Evolution of pancreas transplantation: long-term results and perspectives from a high- volume center. Ann Surg 2012;256:780-6.
Boggi U, Vistoli F, Egidi FM, Marchetti P, De Lio N, Perrone V, Caniglia F, Signori S, Barsotti M, Bernini M, Occhipinti M, Focosi D, Amorese Transplantation of the pancreas. Curr Diab Rep 2012;12:568-79.
Kuo PC, Stock Transplantation in the HIV+ patient. Am J Transplant 2001;1(1):13-17.
Roland ME, Stock PG. Review of solid-organ transplantation in HIV-infected patients. Transplantation 2003;75(4):425-9.
Mazuecos A, Fernandez A, Zarraga S et al. High incidence of delayed graft function in HIV-infected kidney transplant recipients. Transpl Int. 2013; 26: 893-902.
Trullas JC, Cofan F, Tuset M et Renal transplantation in HIV-infected patients: 2010 update. Kidney Int 2011;79(8):825-42.
Trullas JC, Mocroft A, Cofan F et al. Dialysis and renal transplantation in HIV-infected patients: a European survey.J Acquir Immune Defic Syndr. 2010;55(5):582-9.
Swanson SJ, Kirk AD, Ko CW et al. Impact of HIV seropositivity on graft and patient survival after cadaveric renal transplantation in the United States in the pre highly active antiretroviral therapy (HAART) era: an historical cohort analysis of the United States Renal Data System. Transpl Infect Dis 2002; 4: 144–7.
Locke JE, Reed RD, Mehta SG, et al. Center-level Experience and Kidney Transplant Outcomes in HIVinfected Recipients. AM J Transplant. 2015; 15(8):2096-104.
Locke JE, Gustafson S, Metha S, et al. Survival Benefit of Kidney Transplantation in HIV-Infected Patients. Ann Surg 2017; 265(3):604-8.
Sawinski D, Wyatt CM, Casagrande L, et al. Factors associated with failure to list HIV-positive kidney transplant candidates. Am J Transplant 2009;9(6):1467-71.
Trullàs JC, Cofan F, Barril G, et Outcome and prognostic factors in HIV-1-infected patients on dialysis in the cART era: a GeSIDA/SEN cohort study. J Acquir Immune Defic Syndr. 2011 Aug 1;57(4):276-8.
Locke JE, Montgomery RA, Warren DS, Subramanian A, Segev DL. Renal transplant in HIV-positive patients: long-term outcomes and risk factors for graft loss. Arch Surg 2009;144(1):83-6.
Muller E, Barday Z, Mendelson M, Kahn D. Renal transplantation between HIV-positive donors and recipients justified. S Afr Med J 2012;102:497-8.
Cofan F, Trullas JC, Cervera C et al. Are HIV-infected donors suitable for renal transplantation? Transplantation 2011;91:e22-3.
BoyarsKy BJ, Durand CM, Palella FJ, Segev DL. Challenges and Clinical Decision-Making in HIV-to- HIV Transplantation: Insights From the HIV Literature. Am J Transplant 2015;15(8):2023-30.
Muller E, Barday Z, Mendeksin M y Kahn D. HIV-Positive-to-HIV-Positive Kidney Transplantation – Results at 3 to 5 Years. N Engl J Med 2015; 337:613-20.
Federal 2015;80: 73785–73796.
http://www.seimc.org/grupodeestudio.php?Grupo=GESITRA&mn_Grupoid=12.
Vacunación en grupos de riesgo de todas las edades y en determinadas Ponencia de Programa y Registro de Vacunaciones Julio 2018. https://www.mscbs.gob.es/profesionales/ saludPublica/prevPromocion/vacunaciones/VacGruposRiesgo/docs/VacGruposRiesgo_todas_las_ edades.pdf.
Ciuffreda D, Pantaleo G, Pascual Effects of immunosuppressive drugs on HIV infection: implications for solid-organ transplantation. Transpl Int 2007;20:649–58.
Hossain MM, Coull JJ, Drusano GL et Dose proportional inhibition of HIV-1 replication by mycophenolic acid and synergistic inhibition in combination with abacavir, didanosine, and tenofovir. Antiviral Res 2002;55:41–52.
Chapuis A, Paolo Rizzardi G, D´Agostino et al. Effects of mycophenolic acido on human immunodeficiency virus infection in vitro and in vivo. Nat Med 2000;6:762-8.
Gilliam BL, Heredia A, Devico A et al. Rapamycin reduces CCR5 mRNA levels in macaques: potential applications in HIV-1 prevention and treatment. AIDS 2007;21:2108–10.
Stallone G, Schena A, Infante B et al. Sirolimus for Kaposi’s sarcoma in renal-transplant recipients. N Engl J Med 2005;352:1317–23.
Bosch RJ, Pollard RB, Landay A et al. Continuing or adding IL-2 in patients treated with antiretroviral therapy (ACTG Protocol A5051, a rollover trial of ACTG Protocol A328). AIDS Res Ther 2010;7:30.
Carter JT, Melcher ML, Carlson LL et Thymoglobulin-associated CD4+ T-cell depletion and infection risk in HIV-infected renal transplant recipients. Am J Transplant 2006;6:753–60.
Trullas JC, Cofan F, Cocchi S et al. Effect of thymoglobulin induction on HIVinfected renal transplant recipients: differences between HIV-positive and HIV-negative patients. AIDS Res Hum Retroviruses 2007;23:1161-5.
Moscoso-Solorzano GT, Baltar JM, Seco M et Single dose of rituximab plus plasmapheresis in an HIV patient with acute humoral kidney transplant rejection: a case report. Transplant Proc 2007;39:3460–2.
Nashar K, Sureshkumar KK. Update on Kidney transplantation in human immunodeficiency virus infected recipients. World J Nephrol 2016; 5(4): 300-7.
Cohen EA, Mulligan D, Kulkarni S, Tichy, De Novo Belatacept in a Human Immunodeficiency Virus- Positive Kidney Transplant Recipient. Am J Transplant 2016;16(9):2753–7.
Norman SP, Kommareddi M, Kaul Update on Kidney Transplantation in HIV-infected recipients. AIDS Rev 2012;14:195-207.
Tricot L, Teicher E, Peytavin G et Safety and efficacy of raltegravir in HIV-infected transplant patients cotreated with immunosuppressive drugs. Am J Transplant. 2009;9(8):1946-52.
Soriano V, Martín-Carbonero L, Maida I et al. New paradigms in the management of HIV and hepatitis C virus Coinfection. Curr Opin Infect Dis. 2005;18(6):550-60.
Knoll GA, Tankersley MR, Lee JY, Julian BA, Curtis The impact of renal transplantation on survival in hepatitis C-positive end-stage renal disease patients. Am J Kidney Dis 1997;29(4):608-14.
Locke JE, Mehta S, Reed RD, MacLennan P et al. A National Study of Outcomes among HIV-infected Kidney Transplant Recipients. J Am Soc Nephrol 2015 ; 26 :2222-9.
8. USO DE FÁRMACOS EN PACIENTES CON INFECCIÓN POR EL VIH QUE PRESENTAN INSUFICIENCIA RENAL O RECIBEN TRATAMIENTO RENAL SUSTITUTIVO CON DIÁLISIS O TRASPLANTE
Existen fármacos que, si bien pueden ser nefrotóxicos tanto en personas con función renal normal como en las que tienen ERC, en los pacientes con función renal alterada tienen un riesgo mayor de toxicidad y cuyo uso debe evitarse en la medida de lo posible. Este es el caso, por ejemplo, de los aminoglucósidos. Otros fármacos, aunque no sean estrictamente nefrotóxicos, pueden tener efectos farmacológicos que en un paciente con ERC serían deletéreos. En esta categoría estarían los diuréticos ahorradores de potasio, que en pacientes con ERC pueden inducir hiperpotasemia, o los AINE, que al inhibir la síntesis de prostaglandinas reducen el flujo renal y pueden empeorar la función renal en estos pacientes 1.También los fármacos de eliminación por vía hepática pueden acumularse en la ERC grave (ClCr<30ml/min), debido a que se puede alterar la expresión genética de las enzimas del citocromo P450 o inhibirse estas por toxinas urémicas 2.
Como norma general, en los pacientes con infección por VIH y ERC se debe extremar al máximo la indicación de cualquier fármaco, intentando evitar los que sean nefrotóxicos y, si se decide utilizar un fármaco, es obligatorio conocer la necesidad o no de ajuste de la dosis, valorar a fondo el perfil farmacocinético (biodisponibilidad, vía de eliminación, metabolismo, unión a proteínas) y analizar la situación del paciente al que se le va a administrar (edad, sexo, peso, talla, función hepática, función renal, concentración de albúmina, estado de hidratación, equilibrio ácido-base y otros fármacos administrados). Los ajustes de dosificación se pueden realizar reduciendo la dosis, alargando el intervalo de administración o de ambas maneras. En los pacientes en diálisis se debe conocer el grado de eliminación del fármaco durante la diálisis y dar una dosis suplementaria tras cada sesión si se elimina por esta vía.Para el ajuste de fármacos se ha venido utilizando el aclaramiento de creatinina estimado mediante la fórmula de Cockcroft-Gault. Sin embargo, la ecuación CKD-EPI, estima mejor que MDRD el FGe en pacientes con valores superiores a 60 ml/min/1.73 m², y se considera actualmente el método de elección, tal como se recomienda en las guías españolas y europeas de manejo de pacientes con infección por VIH 345.
FÁRMACOS Y PAUTAS DE TAR
Es importante recordar que varios antirretrovirales, incluyendo RPV, RAL, DTG y BIC, así como RTV y COB, inhiben la secreción tubular de creatinina, lo que se manifiesta por un aumento ligero en la concentración sérica de creatinina y disminución del ClCr estimado (5-20 ml/min) desde el inicio de tratamiento, que no traduce disfunción renal 6. Además, TDF y ATV se han asociado con ERC y progresión de nefropatía.En el caso de TDF, el riesgo aumenta en presencia de IP potenciado, edad avanzada e inmunodeficiencia avanzada.
En los pacientes en diálisis se debe conocer el grado de eliminación del fármaco durante la diálisis y dar una dosis suplementaria tras cada sesión si se elimina por esta vía. En las (Tablas 17 y 18) se muestra la dosificación de fármacos antirretrovirales en ERC y diálisis (hemodiálisis y diálisis peritoneal). En el trasplante renal, además, los fármacos antirretrovirales deben tener escasas interacciones farmacológicas con los inmunosupresores que son metabolizados por enzimas del citocromo p450 (inhibidores de la calcineurina-tacrolimus y ciclosporina-, inhibidores de la m-TOR -sirolimus, everolimus- y corticoides) y baja probabilidad de desarrollar dislipemia o insulinorresistencia.
INHIBIDORES DE LA TRANSCRIPTASA INVERSA ANÁLOGOS DE LOS NUCLEÓSIDOS/NUCLEÓTIDOS
Los ITIANs se excretan principalmente por vía renal, en muchos casos no sólo por filtración glomerular, sino también por secreción tubular. El ajuste de dosis es especialmente importante en los fármacos en los que la sobredosificación conllevaría un aumento en el riesgo de toxicidad renal, como es el caso de TDF, o en los que con más frecuencia producen toxicidad mitocondrial, sobre todo d4Ty ddI, que hoy en día prácticamente no se usan. Se ha constatado que existe un mayor riesgo de desarrollar acidosis láctica en pacientes con insuficiencia renal. Otra de las características comunes a los ITIANs es su baja unión a proteínas y su bajo peso molecular, por lo que son fácilmente eliminados por la diálisis. Debido a ello se recomienda dar la dosis tras la diálisis; en general, no es necesario administrar dosis extras. El único fármaco de la clase que se diferencia del resto es ABC; su metabolismo principal es por vía hepática y no requiere ningún ajuste en la insuficiencia renal, si bien sí se recomienda su administración tras la hemodiálisis para reducir la posible eliminación de fármaco durante el procedimiento. En pacientes con ERC que reciben 3TC es necesario reducir la dosis, hasta 25-50 mg/24 h en pacientes con insuficiencia renal avanzada, aunque en ciertas circunstancias se pueden usar dosis algo mayores (comprimidos de 100 mg) para evitar la formulación líquida, ya que no se ha observado toxicidad. En un estudio, dosis de 300 mg al día con Clcr >30 ml/min y 100-150 mg al día con ClCr <30 ml/min o en hemodiálisis fueron bien toleradas. Estas dosis mejorarían la adherencia dado que se podrían emplear coformulaciones con Clcr >30 ml/min y evitaría el uso de formulaciones líquidas 7. En pacientes con ERC estable se deben seguir las recomendaciones de dosificación de TDF establecidas en la ficha técnica.
La información disponible sobre la seguridad y la eficacia de TDF en pacientes con función renal alterada es limitada. En general no se recomienda su uso en pacientes con Clcr <50 ml/min, excepto cuando no existan otras alternativas. No pueden darse recomendaciones de dosis para pacientes que no están en hemodiálisis con aclaramiento de creatinina < 10 ml/min o que reciben diálisis peritoneal. En todo caso, en aquellos pacientes en los que el deterioro de la función renal esté directamente relacionado con el TDF o se trate de un trastorno agudo, no se recomienda usar este fármaco. Además se recomienda la vigilancia estrecha del FG y de los marcadores de disfunción tubular. TAF, profármaco de tenofovir, se elimina mínimamente por la orina y tiene un perfil renal y óseo más favorable que TDF 8. Se puede emplear a la dosis habitual en pacientes con ERC moderada con Clcr >30 ml/min 9. En un estudio farmacocinético en sujetos con ERC grave (Clcr 15-29 ml/min) TAF produjo una concentración plasmática máxima y un área bajo la curva de tenofovir 2,8 y 5,7 veces mayor que en pacientes con función renal normal, aunque menores que las que suelen alcanzarse con TDF en sujetos sin ERC 10.
No se recomienda el uso de TAF en pacientes con ClCr estimado≥ 15 ml/min y < 30 ml/min, o <15 ml/min que no estén recibiendo hemodiálisis. En los días de hemodiálisis se debe administrar tras completar esta. FTC también se elimina por FG y secreción activa tubular en un 85%. Se une muy poco a proteínas (<4%) y precisa ajuste de dosis en pacientes con insuficiencia renal con Clcr < 30 ml/min. La hemodiálisis aclara un 30% de la dosis, por lo que se debe administrar tras esta.
En la actualidad existen en el mercado varias coformulaciones de ITIANs a dosis fijas; todas ellas contienen 3TC o FTC, fármacos que precisan ajustes de dosis cuando existe un descenso significativo del FG, por lo que en general se desaconseja el uso de coformulaciones en pacientes con insuficiencia renal. En principio, Kivexa® (3TC/ABC), Dovato® (DTG/3TC), Trizivir® (ABC/3TC/AZT) y Combivir® (3TC/AZT) no deben administrarse a pacientes con Clcr <50 ml/min. Sin embargo, con los datos de un estudio reciente sobre 3TC, se podría mantener la dosis habitual con Clcr >30 ml/min, pudiéndose emplear coformulaciones hasta esta cifra de Clcr 7. Como se ha mencionado, existe escasa información sobre la seguridad de TDF en pacientes con CICr <50 mL/min y en general se desaconseja el uso de coformulaciones con este fármaco (p.ej. Truvada®, Atripla®, Eviplera®, Delstrigo®). Cuando se considere imprescindible emplear Truvada® (FTC/TDF) y no haya alternativas terapéuticas en pacientes con Clcr< 50 ml/min se debe aumentar el intervalo de dosificación de una vez al día a cada 48h en personas con Clcr de 30 a 49 ml/min; debe evitarse en pacientes con Clcr <30 ml/min, o en los que se sospeche toxicidad por TDF o tengan una función renal inestable. En el caso de la coformulación que contiene TDF, FTC, EVG y COB (un nuevo inhibidor del citocromo CYP3A4)(Stribild®), además hay que tener en cuenta el efecto inhibidor de COB sobre la secreción tubular de creatinina, que suele traducirse en un incremento de la creatinina plasmática (< 0.3 mg/dL en relación con la basal) y por tanto un menor ClCr estimado (~10 mL/min). No existe todavía suficiente información para determinar si la coadministración de COB incrementa el riesgo de desarrollar toxicidad tubular con tenofovir. En este momento, en la ficha técnica de la EMA se recomienda no iniciar un tratamiento con esta coformulación en pacientes con Clcr <90 ml/min, a menos que se considere que esta es la pauta preferente para el paciente, en cuyo caso se podría iniciar con Clcr≥70 ml/min. Se recomienda suspender TDF/FTC/EVG/COB si el Clcr desciende por debajo de 50 ml/min, ya que es necesario realizar ajuste de la dosis de TDF. Las coformulaciones de TAF (p.ej. Descovy®, Odefsey®, Symtuza®, Genvoya® y Biktarvy®) deben evitarse en pacientes con Clcr <30 ml/min (Tabla 18).
INHIBIDORES DE LA TRANSCRIPTASA INVERSA NO ANÁLOGOS DE LOS NUCLEÓSIDOS
Los ITINAN se metabolizan por vía hepática y la excreción por vía renal es mínima. NVP se une a proteínas en un 60%; este porcentaje es mayor para EFV, que alcanzan el 99%. NVP, con <3% de excreción urinaria, no precisa ajuste de dosis en los pacientes con ERC. En los pacientes en hemodiálisis puede existir cierta eliminación del fármaco durante el procedimiento (mínima), por lo que se recomienda que el día de la diálisis la dosis correspondiente de NVP se administre después de haber finalizado la diálisis. NVP también sufre aclaramiento a través de la diálisis peritoneal, aunque no parece que tenga ningún efecto sobre las concentraciones plasmáticasTabla 17.
Los datos farmacocinéticos sobre EFV en pacientes con ERC que no reciben tratamiento con diálisis son limitados, pero se asume que no precisa ajuste de dosis ya que se excreta menos de un 1% en la orina. El aclaramiento de EFV tanto por hemodiálisis como por diálisis peritoneal es bajo, por lo que no se recomiendan ajustes de dosis. ETR se elimina fundamentalmente a nivel hepático y menos del 1,2% se elimina por vía renal, por lo que no se espera que exista necesidad de ajuste en ERC; tampoco es esperable su eliminación por hemodiálisis o diálisis peritoneal dada su alta unión a proteínas. RPV se metaboliza y elimina fundamentalmente por vía hepática (CYP 450) y digestiva (85% por heces) y en menor medida por vía renal (<6%); no se precisan ajustes de dosis en la insuficiencia renal leve o moderada. Se recomienda vigilar estrechamente en pacientes con ERC más avanzada debido al potencial aumento de las concentraciones plasmáticas. Es improbable que se elimine durante la hemodiálisis o la diálisis peritoneal por su fuerte unión a proteínas. La doravirina (DOR) se elimina principalmente por vía hepática (CYP3A4), con <10% de eliminación por vía renal. No es necesario ajustar la dosis en los pacientes con insuficiencia renal leve, moderada o grave. No hay estudios en pacientes con enfermedad renal terminal ni en pacientes sometidos a diálisis 11.
Las coformulaciones de ITINAN que contienen TDF (Atripla®, Eviplera®, Delstrigo®) o TAF (Odefsey®) no se recomiendan en pacientes con ClCr <50 o <30 mL/min, respectivamente, ya que no se pueden realizar los ajustes de dosis requeridos (Tabla 18).
INHIBIDORES DE LA PROTEASA
Los IPs se metabolizan fundamentalmente en el hígado. La excreción urinaria supone alrededor de un 10% para IDV y ≤ 7,5% para el resto.Ninguno de los IPs actualmente disponibles precisa ajuste de dosis en pacientes con ERC. La mayoría de los IPs tienen volúmenes de distribución amplios y se unen en gran medida a las proteínas plasmáticas (IDV ~ 60% y resto de IPs de un 90% a >98%). Esta afinidad por las proteínas plasmáticas impide que se aclaren por hemodiálisis, a excepción de LPV/r que mostró niveles de ambos fármacos un 44% inferiores a los encontrados en controles históricos. Con ATV y DRVno existen recomendaciones especiales de ajuste de dosis en los distintos grados de ERC ni en terapia renal sustitutiva Tabla 17.En cuanto a los potenciadores, el aclaramiento renal de RTV y COB es inapreciable, por lo que no se requiere ajuste de dosis en los pacientes con insuficiencia renal, incluida la ERC grave. Sin embargo, dado que disminuye el aclaramiento de creatinina, no se debe iniciar COB (incluyendo coformulaciones, como Rezolsta® o Evotaz®) en pacientes con Clcr < 70 ml/min si se administra junto a algún medicamento que requiere ajuste de dosis en función del Clcr, como TDF. La combinación de DRV, COB, FTC, TAF (Symtuza®) se debe evitar en pacientes con Clcr < 30 ml/min.
INHIBIDORES DE LA INTEGRASA
RAL se elimina en un 32 % por vía renal. La vía principal de metabolización es la hepática a través de la glucuronización, por la UDP-glucuroniltransferasa; por este motivo se esperan pocas interacciones con los fármacos metabolizados a través del sistema del citocromo P-450. No se han encontrado diferencias significativas en los parámetros farmacocinéticos entre los pacientes con ERC y los sujetos sanos. No es necesario por tanto realizar ningún ajuste de dosis. Al no conocerse en qué medida se dializa, se recomienda administrar la dosis después de la diálisis Tabla 17. EVG se metaboliza principalmente por la vía del citocromo P-450, particularmente por el CYP3A4. Por este motivo las concentraciones en estado estacionario y mínima de EVG aumentan sustancialmente al administrar RTV o COB; la vida media plasmática también se ve incrementada, lo que permite la administración una vez al día. En pacientes con ERC grave (Clcr<30 ml/min) se ha realizado un estudio de la farmacocinética de EVG potenciado con COB, sin encontrarse diferencias frente a los sujetos sanos. No existe todavía información sobre EVG en pacientes en diálisis, aunque por su metabolismo fundamentalmente hepático y la escasa eliminación renal (6%), no se espera que sea necesario realizar ajustes importantes en la dosis. En el caso de la coformulación de TDF, FTC, EVG y COB, no se recomienda su utilización en pacientes con Clcr <90 mL/min y debe suspenderse si el Clcr disminuye por debajo de 50 mL/min. Sin embargo,la coformulación con TAF en vez de TDF (Genvoya®) se puede administrar con Clcr ≥ 30 ml/min. DTG experimenta metabolismo fundamentalmente hepático por la vía de la glucuronización a través de la UGT1A1. La excreción renal es <1%, por lo que no precisa ajuste de dosis en insuficiencia renal. No se dispone de datos en sujetos que reciben diálisis, aunque no se esperan diferencias farmacocinéticas en esta población. Aunque en pacientes con ClCr<30 ml/min se ha observado una reducción en los niveles plasmáticos de DTG de hasta el 40% (quizá por interacción con cationes), no se considera clínicamente significativa. Sin embargo, podrían no alcanzarse niveles adecuados en caso de resistencia a RAL (pues se precisa mayor exposición a DTG) o junto a inductores metabólicos como EFV y TPV/RTV (pueden disminuir la concentración de DTG) 12. La coformulación reciente de RPV con DTG (Juluca®) no requiere ajuste de dosis en pacientes con insuficiencia renal leve o moderada. En los pacientes con insuficiencia renal grave, se debe utilizar con precaución, ya que la concentración plasmática de rilpivirina puede aumentar. No hay datos disponibles en sujetos que reciben diálisis, pero dado que DTG y RPV presentan gran afinidad por las proteínas plasmáticas, no es probable que la hemodiálisis o la diálisis peritoneal incrementen su eliminación de forma significativa. Bictegravir (BIC) ha sido comercializado coformulado con TAF/FTC (Biktarvy®). Se elimina principalmente por metabolismo hepático (CYP3A y UGT1A1), siendo la excreción renal una vía menor (~ 1 % de la dosis). No requiere ajuste de dosis en pacientes con Clcr ≥ 30 ml/min. No se recomienda emplearlo con CrCl inferior a 30 ml/min. La alta unión de BIC a las proteínas plasmáticas hace presuponer su escasa eliminación por diálisis 13.
INHIBIDORES DE LA FUSIÓN
Enfuvirtida (T-20), el único inhibidor de la fusión (IF) disponible actualmente, se une fuertemente a proteínas (≅92%). En los estudios realizados en pacientes con ERC se ha observado que el aclaramiento no está alterado y que no es necesario realizar ajuste de dosis; además no es probable que se aclare a través de la diálisis Tabla 17.
INHIBIDORES DEL CORRECEPTOR CCR5
Maraviroc (MVC) sufre fundamentalmente metabolismo hepático a través del CYP3A4. Solo un 25% de su excreción se realiza por la orina. Aunque no existen datos sobre el comportamiento del fármaco en pacientes con distintos grados de ERC, se han realizado estudios de simulación y en la actualidad sólo se recomienda un ajuste de dosis en pacientes con insuficiencia renal que están recibiendo inhibidores potentes del CYP3A4, como los IPs (excepto TPV/RTV). En presencia de estos inhibidores metabólicos, el aclaramiento renal puede llegar a representar hasta el 70% del aclaramiento total de MVC y, por lo tanto, en este caso, se puede producir un incremento significativo de la exposición a MVC 14 Tabla 17 y de sus efectos secundarios, entre otros mareo e hipotensión postural, por lo que se recomienda su uso sólo en caso de que los beneficios superen los riesgos y bajo estrecha vigilancia.
INHIBIDORES DE LA ENTRADA
Ibalizumab (IBA) es un anticuerpo monoclonal humanizado que se une al receptor CD4, bloqueándolo. Ha sido ya aprobado por la FDA y la EMA para su administración intravenosa. Según los estudios disponibles, no se recomienda ajuste de dosis en insuficiencia renal 15.
PAUTAS PREFERENTES DE TAR Y SU AJUSTE DE DOSIS EN PACIENTES CON ERC
Las recomendaciones generales para seleccionar el TAR en pacientes con ERC se resumen en la Tabla 16. La evidencia en la que basar la elección de una pauta concreta en esta situación es débil.
Los ITIAN se eliminan por vía renal, por lo que es necesario reducir la dosis en pacientes con alteración de la función renal. Una sobre- o infra-dosificación puede conllevar toxicidad o fracaso virológico, respectivamente 297. Una excepción es ABC, cuya excreción urinaria es baja, por lo que no es necesario ajuste de dosis. Los ITINAN, los IP, los inhibidores de la integrasa y los inhibidores de la entrada no requieren ajuste de dosis en pacientes con alteración de la función renal.
En general, deben evitarse todos los fármacos potencialmente nefrotóxicos y las coformulaciones que contienen fármacos que requieren ajuste de dosis en los pacientes con insuficiencia renal avanzada por las dificultades para la dosificación. Las coformulaciones de RPV/DTG y las que contienen TAF y FTC (TAF/FTC/RPV, TAF/FTC/DRV/c, TAF/FTC/EVG/c y TAF/FTC/BIC) pueden emplearse con Clcr ≥ 30 ml/min. Respecto a la coformulación de 3TC/DTG, basándose en los datos de lamivudina, en ficha técnica no se recomienda su uso en pacientes con Clcr < 50 ml/min aunque la experiencia en vida real con este fármaco sugiere que se podría mantener la dosis habitual con Clcr >30 ml/min 7.
PAUTAS PREFERENTES DE TAR Y SU AJUSTE DE DOSIS EN DIÁLISIS
Las pautas de TAR de elección en pacientes en diálisis son las mismas que para los pacientes con ERC con algunas consideraciones (Tablas 17 y 18). Los ITIANs son eliminados por vía renal y no se unen mucho a proteínas; por tanto son eliminados por la diálisis, por lo que deben ser administrados después de la misma. En un pequeño estudio las concentraciones alcanzadas de TDF y FTC con las dosis de una y dos veces en semana, respectivamente, fueron superiores a las de pacientes con función renal normal y dosificación diaria 16. No se conoce si se podría reducir la dosis o sustituir TDF por TAF. Hasta ahora no hay datos con TAF, por lo que no se recomienda su uso si hay otras alternativas.
Es importante remarcar que la información sobre dosificación y administración de TAR en pacientes en diálisis peritoneal es muy escasa. TDF podría administrarse dos veces a la semana en pacientes en diálisis peritoneal, según un estudio reciente 17.
Como se ha comentado previamente, los ITINAN no requieren ajuste de dosis, pero en el caso particular de NVP está indicada una dosis adicional de 200mg después de cada sesión de diálisis. RPV se une en un 99,7% a las proteínas plasmáticas y, aunque no hay estudios, no es esperable que se elimine en HD. Los IPs, por su muy alta unión a proteínas (>90%), salvo IDV y ATV (65-85%), no es esperable que se eliminen por diálisis. ATV debe ser administrado potenciado con RTV en pacientes en diálisis, al tener estos pacientes bajas concentraciones de ATV (se reducen un 30-50%); no se recomienda en pacientes pretratados. No se ha estudiado el tratamiento con DRV, COB o la combinación de ambos en pacientes sometidos a diálisis, y por lo tanto no se puede hacer ninguna recomendación.
Los inhibidores de integrasa, por su alta unión a proteínas (80% RAL, >99% DTG y EVG), no se espera que se eliminen significativamente por diálisis. RAL es eliminado mínimamente por diálisis y la dosis de 400 mg cada 12 h es segura en pacientes sometidos a HD 18. DTG también se elimina mínimamente por HD (7%), por lo que no se precisa ajuste de dosis 1920. EVG sólo está disponible coformulado, no recomendándose con Clcr < 50 ml/min si la coformulación incluye TDF o con Clcr < 30 mil/min si incluye TAF; existen muy pocos datos en HD.
La pauta de TAR en pacientes con infección por el VIH que están en diálisis podría incluir una triple terapia basada en ABC con 3TC/FTC, en combinación con un tercer fármaco que puede ser un inhibidor de la integrasa, un IP potenciado o un ITINAN, o bien una pauta de dos fármacos: 3TC y DTG, RPV y DTG, o 3TC y DRV/c, siempre que la situación inmunovirológica lo permita y no exista coinfeción por VHB.
Ninguna de las coformulaciones de antirretrovirales ha sido aprobada para su uso en pacientes con ERC terminal en HD. Aunque en la ficha técnica no se recomienda usar 3TC con Clcr <50 ml/min, la experiencia en vida real ha hecho que muchos clínicos prescriban dosis más altas de las recomendadas (hasta la dosis habitual de 300 mg/día) en pacientes con ERC, evitando la solución oral. La coformulación ABC/3TC/DTG podría ser una opción segura y eficaz, como ha demostrado un pequeño estudio con 6 pacientes 21. De igual manera, la administración post-HD de la coformulación TAF/FTC/EVG/c, en un estudio con 55 pacientes, resultó ser eficaz y bien tolerada 22. En ambos casos son necesarios estudios de seguridad a más largo plazo.
En aquellos pacientes que requieran una pauta de TAR sin ITIAN, puede considerarse la combinación de RAL o DTG con DRV/c o la monoterapia con DRV/c. En pacientes con fracaso virológico, el tratamiento de rescate debe basarse en los resultados de los test de resistencia.
PAUTAS PREFERENTES DE TAR Y SU AJUSTE DE DOSIS EN EL TRASPLANTE RENAL
En los pacientes que estén en lista de espera próximos a recibir un trasplante renal podría utilizarse una de las pautas recomendadas en el apartado anterior priorizando las basadas en inhibidores de la integrasa no potenciados teniendo en cuenta que que deben evitarse interacciones farmacológicas con los inmunosupresores y toxicidad renal del injerto.
Es importante ajustar el tipo y dosis de antirretrovirales a la situación de insuficiencia renal avanzada del paciente. Siempre que sea posible se evitará administrar antirretrovirales nefrotóxicos.
En los pacientes ya trasplantados no está establecida cual debe ser la pauta ideal de TAR pero el régimen de tratamiento recomendado debería tener las siguientes características: 1) suficiente potencia para mantener la supresión vírica; 2) escasas interacciones farmacológicas con los inmunosupresores que son metabolizados por enzimas del citocromo p450: inhibidores de la calcineurina (ciclosporina y tacrolimus), inhibidores de la m-TOR (sirolimus, everolimus) y corticoides; 3) escasa toxicidad renal; 4) perfil de seguridad cardiovascular favorable, y 5) baja probabilidad de desarrollar dislipemia o insulinoresistencia (ambos efectos secundarios de los inmunosupresores). Cuando existe deterioro de la función renal deben tenerse en cuenta las limitaciones para el uso de las coformulaciones que contienen fármacos que requieren ajuste de dosis.
Las recomendaciones generales de tratamiento de la infección por el VIH en receptores de trasplante renal deben ser las mismas que las de la población general pero con algunas consideraciones que se resumen en la Tabla 16 7:
- Inhibidores de la transcriptasa inversa análogos de nucleósidos/nucleótidos: la combinación de dos ITIAN (por ejemplo, TAF con FTC o ABC con lamivudina) se puede utilizar de forma segura en receptores de trasplante renal. ABC no debe utilizarse en receptores de un injerto renal procedente de un donante HLA-B57*01 positivo por riesgo de hipersensibilidad al fármaco. Los análogos de la timidina, AZT o d4T, estarían contraindicados por su elevada toxicidad y por su potencial pérdida de eficacia viral cuando se administran conjuntamente con micofenolato. Por el contrario, podría existir un efecto sinérgico antiviral de micofenolato con ABC.
- Inhibidores de la transcriptasa inversa no análogos de nucleósidos e inhibidores de la proteasa: se pueden utilizar de forma segura en combinación con dos ITIAN pero debe tenerse en cuenta sus potenciales interacciones farmacológicas con los inmunosupresores. En general los ITINAN son moderados inductores del citocromo P4503A4 (riesgo de rechazo agudo) lo que obliga a aumentar la dosis de los inmunosupresores: (Ciclosporina, tacrolimus, sirolimus y everolimus). Por el contrario, los IPs son potentes inhibidores del citocromo P4503A4 (riesgo de nefrotoxicidad), lo que obliga a una importante reducción de dosis de los Los potenciadores RTV y COB en particular aumentan marcadamente los niveles de tacrolimus, con el consiguiente riesgo de toxicidad 27. RPV es sustrato e inductor débil de las enzimas del CYP450, por ello es esperable que las interacciones con los inmunosupresores sean clínicamente menos relevantes. Por el momento no existen datos sobre seguridad y eficacia de RPV o ETR en pacientes receptores de trasplante. La utilización de cualquier IP o ITINAN en estos pacientes obliga a la monitorización frecuente de las concentraciones plasmáticas de los inhibidores de la calcineurina y de sirolimus, ya que también son sustratos del CYP450 y de la glicoproteína-P. Con regímenes que incluyen IP potenciados se ha observado mayor riesgo de rechazo , pérdida del injerto y muerte 23. La suspensión de los IPs en un paciente que recibe inhibidores de la calcineurina o sirolimus puede ocasionar un rechazo agudo del injerto renal si no se aumentan las dosis de inmunosupresores 25.
- La mayoría de los inhibidores de la integrasa (RAL, DTG, BIC) se metabolizan principalmente por la vía de la UDGT-1 y por lo tanto no presentan interacciones con inmunosupresores a nivel del citocromo p450. La experiencia en TR del uso combinado de RAL con dos ITIAN ha sido satisfactoria hasta el momento , y su uso se ha asociado con baja tasa de rechazo del injerto renal (8% a 12 meses, en un estudio con 26 pacientes) 26.A diferencia del resto de los inhibidores de la integrasa, elvitegravir (EVG), es metabolizado por el CYP450 y se administra con COB, un potente inhibidor del citocromo P450, por lo que tendrá las mismas interacciones farmacocinéticas que los IP Hay que tener en cuenta el efecto de estos fármacos inhibiendo la secreción tubular de creatinina, por lo que pueden producirse elevaciones leves de creatinina, que podrían confundirse con rechazo.
- Inhibidores de la entrada. Enfuvirtide (o T20) puede ser también una alternativa en combinación con dos ITIAN, pero su administración por vía subcutánea, muy mal tolerada por el paciente, es una limitación.
- Antagonistas del co-receptor MVC es un sustrato del citocromo p450 y sus niveles pueden ser modificados por fármacos inductores o inhibidores. MVC no altera los niveles plasmáticos de los inmunosupresores. Estudios experimentales sugieren que MVC podría tener un papel como fármaco anti- rechazo del injerto y en la actualidad existen ensayos clínicos en marcha que intentan evaluar esta hipótesis.
Es recomendable realizar controles frecuentes de carga viral en el periodo post- trasplante más temprano y una monitorización estrecha de los niveles plasmáticos de los fármacos inmunosupresores, especialmente si se hacen cambios en los tratamientos.
La complejidad de las posibles interacciones entre los fármacos antirretrovirales e inmunosupresores, aconseja crear equipos de especialistas en Nefrología y Enfermedades Infecciosas-VIH que evalúen conjuntamente las posibles repercusiones farmacocinéticas y clínicas de cualquier modificación del tratamiento, tanto en el campo de la eficacia antiviral como en el de la inmunosupresión. Es recomendable consultar las potenciales interacciones en los portales electrónicos de acceso gratuito que se actualizan continuamente (http://www.hiv-druginteractions. org; http://www.interaccionesvih.com; http://hivinsite.ucsf.edu).
En relación al TAR en el postrasplante inmediato, se recomienda iniciarlo lo antes posible tras el trasplante 28.
Recomendaciones
- El TAR en los pacientes con ERC debe seguir las mismas directrices de los pacientes sin afectación renal. Si no existen contraindicaciones, se puede utilizar una triple terapia basada en la combinación de ABC (o TAF como alternativa) con 3TC (o FTC) con un tercer fármaco, preferentemente un inhibidor de la integrasa no potenciado ( DTG o RAL) o bien una pauta dual con 3TC y DTG siempre que no exista coinfección por VHB. Grado de Recomendación: Fuerte; Calidad de la evidencia: Alta.
- En caso de que no pudieran darse las pautas preferentes, se podría utilizar una triple terapia con DRV potenciado o un ITINAN, o bien una terapia dual con RPV y DTG o RAL y DRV potenciado, siempre que la situación inmunovirológica lo permita y no exista coinfeción por VHB. En casos muy seleccionados se podría simplificar a monoterapia con DRV potenciado. Grado de Recomendación: Fuerte; Calidad de la evidencia: Moderada.
- Deben evitarse las combinaciones a dosis fijas de fármacos por las dificultades en la dosificación de los ITIAN en pacientes con insuficiencia renal avanzada. Las que contienen TAF/FTC, RPV/DTG y 3TC/DTG pueden administrarse con Clcr≥ 30 ml/min. Recomendación de buena práctica clínica basada en el consenso.
- La pauta de TAR en pacientes que están en diálisis podría incluir una triple terapia basada en ABC con 3TC, en combinación con un tercer fármaco que puede ser un inhibidor de la integrasa, un IP potenciado o un ITINAN, o bien una pauta de dos fármacos con 3TC y DTG, RPV y DTG, o 3TC y DRV/c siempre que no exista coinfeción por VHB. Grado de Recomendación: Fuerte; Calidad de la evidencia: Baja.
- En los pacientes que estén en lista de espera de trasplante renal, debe realizarse la tipificación del HLA B57-01 en el donante y el receptor de trasplante. En caso de resultar positivo, se evitará el tratamiento con ABC en el paciente receptor del órgano, por riesgo de hipersensibilidad al fármaco. Recomendación de buena práctica clínica basada en el consenso.
- En pacientes candidatos a trasplante renal, se deben evitar fármacos antirretrovirales con interacciones con los inmunosupresores (ej. IPs, ITINAN y COB), para facilitar la transición al período post-trasplante. Recomendación de buena práctica clínica basada en el consenso.
- Si no existe contraindicación o riesgo de fracaso virológico, las pautas de tratamiento antirretroviral recomendadas en los receptores de trasplante renal son las mismas que se describen en la ERC, priorizando siempre las basadas en inhibidores de la integrasa no potenciados para evitar interacciones farmacológicas con los inmunosupresores y toxicidad renal del injerto. Grado de Recomendación: Fuerte; Calidad de la evidencia: Moderada.
- Si se utilizan ITINAN, debido a que son inductores del citocromo CYP450, debe considerarse un aumento la dosis de los inmunosupresores: ciclosporina, tacrolimus, sirolimus y everolimus. Recomendación de buena práctica clínica basada en consenso.
- Se debe evitar el uso de IPs. Si se utilizan, debido a que son potentes inhibidores del citocromo P4503A4, debe considerarse una reducción de la dosis de los inmunosupresores: ciclosporina, tacrolimus, sirolimus y everolimus. Recomendación de buena práctica clínica basada en consenso.
- Es recomendable realizar controles más frecuentes de carga viral en el periodo post-trasplante inicial (3-6 meses). Recomendación de buena práctica clínica basada en consenso.
- En caso de utilizar ITINAN o IP/r deben monitorizarse los niveles plasmáticos de los inmunosupresores durante el tratamiento o ante cualquier cambio de dosis o suspensión de tratamiento. Recomendación de buena práctica clínica basada en consenso.
- Deben consultarse en fuentes electrónicas acreditadas y actualizadas las posibles interacciones farmacocinéticas existentes entre el tratamiento inmunosupresor, antirretroviral u otros fármacos que se prescriban al paciente trasplantado. Recomendación de buena práctica clínica basada en consenso.
FÁRMACOS NO ANTIRRETROVIRALES
ANTIMICROBIANOS (ANTIBIÓTICOS, ANTIVÍRICOS Y ANTIFÚNGICOS)
En la Tabla 19 se muestran las recomendaciones de dosificación de antimicrobianos de uso habitual en pacientes con infección por el VIH en situación de ERC y/o diálisis (hemodiálisis y diálisis peritoneal).
HIPOLIPEMIANTES
La dislipemia en pacientes con infección por el VIH es frecuente y comporta un incremento todavía mayor en el riesgo cardiovascular de estos pacientes. La decisión de iniciar tratamiento hipolipemiante se hará de forma individualizada y en función del riesgo cardiovascular estimado. Como norma general se recomienda iniciar tratamiento cuando exista enfermedad cardiovascular establecida o cuando el riesgo cardiovascular sea superior a 7.5% a los 10 años, pero estas recomendaciones tienen poca evidencia científica en los pacientes con infección por el VIH al ser una población con mayor riesgo cardiovascular que la población general. Atorvastatina es la estatina de primera elección en pacientes con infección por el VIH, si bien otras estatinas (p.ej. pitavastatina) pueden tener un mejor perfil de seguridad. Puede considerase añadir ezetimiba cuando no se consiguen los objetivos terapéuticos con monoterapia con estatinas. Los fibratos son de elección para el tratamiento de la hipertrigliciridemia pero, en general, no se deben administrar conjuntamente con estatinas por incremento de la toxicidad 29.
En la Tabla 11 se muestran las recomendaciones de dosificación de los hipolipemiantes de elección en pacientes con infección por el VIH con insuficiencia renal y sus posibles interacciones farmacológicas con antirretrovirales 3. Sería razonable utilizar hipolipemiantes sin potenciales interacciones con los antirretrovirales y que no requieran ajuste de dosis en caso de insuficiencia renal.
INSULINA E HIPOGLUCEMIANTES ORALES
En términos generales, los objetivos de tratamiento así como las recomendaciones terapéuticas para la diabetes mellitus en los pacientes con infección por el VIH son las mismas que para la población general, teniendo siempre en cuenta las potenciales interacciones farmacológicas.
Existe menos experiencia con los antidiabéticos orales en pacientes con infección por el VIH que en la población general, excepto con metformina y sulfonilureas.
Metformina es el fármaco de elección excepto en pacientes con marcada lipoatrofia, pacientes con riesgo de acidosis láctica y en caso de insuficiencia renal avanzada. Después de la metformina (o en caso de estar contraindicada) se deben utilizar (con precaución) algunas sulfonilureas, la repaglinida o la pioglitazona (especialmente si existe marcada lipoatrofia). Existe mucha menos experiencia con los otros grupos farmacológicos en pacientes con infección por el VIH (incretinas e inhibidores del SGLT2). Cuando no existe un buen control con fármacos orales (y en caso de diabetes tipo 1) se debe iniciar tratamiento con insulina, cuyo manejo y ajuste de dosis es similar al de la población general 29.
En la Tabla 12 se resumen las indicaciones de fármacos hipoglicemiantes orales y su necesidad de ajuste de dosis en pacientes con insuficiencia renal 30.
La metformina se elimina principalmente por la orina sin metabolizarse, por eso los pacientes con alteración de la función renal son más susceptibles a su acumulación y a la acidosis láctica. Por este motivo está contraindicada cuando el FGe es inferior a 30ml/min/1.73m² y debe utilizarse con precaución y reduciendo la dosis ante menores grados de ERC (FGe entre 30 y 60ml/min/1.73m²). Existen potenciales interacciones entre metformina y algunos antirretrovirales como atazanavir/ cobicistat, darunavir/cobicistat y dolutegravir 30.
Respecto a las sulfonilureas, de forma general, su uso no es recomendable en pacientes con ERC por riesgo de hipoglucemia. Su empleo debería limitarse a pacientes con FG > 45ml/min/1.73m² y, en caso de utilizarlas, se recomienda el uso (ajustando dosis y vigilando potenciales interacciones con algunos IP y algunos ITINAN) de gliclazida, glipizida o (sin necesidad de ajuste de dosis) de gliquidona. No se recomienda el uso de glibenclamida y glimepirida al ser metabolizadas en el hígado a metabolitos activos que conservan acción hipoglucemiante y, al ser eliminados por la orina, se acumulan en caso de insuficiencia renal y pueden producir hipoglucemias graves de duración prolongada. Además ambas tienen potenciales interacciones farmacológicas con los IP y los ITINAN 30.
La repaglinida es el secretagogo más recomendable en los pacientes con insuficiencia renal crónica y puede utilizarse con cualquier grado de insuficiencia renal, incluso en pacientes en diálisis. A pesar de ello, es recomendable iniciar el tratamiento con una dosis baja (0,5 mg). Repaglinida interacciona con atazanavir (solo o asociado a ritonavir o cobicistat) por lo que no deben administrarse conjuntamente. También tiene potenciales interacciones con otros IP y con los ITINAN. La nateglinida, pese a tener metabolismo hepático, se degrada a metabolitos activos que se excretan a nivel renal, por lo que no está recomendada en insuficiencia renal crónica 30.
La insulina, junto con la metformina y las sulfonilureas, son los tratamientos con más experiencia en pacientes con infección por el VIH. La insuficiencia renal crónica se asocia a resistencia a la insulina, pero la insuficiencia renal crónica avanzada produce una disminución en la degradación de insulina, con la consiguiente reducción de las necesidades de esta, e incluso su cese. La diálisis revierte en parte tanto la resistencia a la insulina como el aumento en su degradación. Así, las necesidades de insulina en un paciente determinado dependerán del balance entre la mejora de la sensibilidad a insulina y la normalización del metabolismo hepático de la insulina, por lo que la individualización del tratamiento con insulina es esencial, siendo normalmente necesario reducir las dosis a menor filtrado glomerular. No existen potenciales interacciones entre insulina y antirretrovirales 30.
Pioglitazona (la única glitazona comercializada en la actualidad) tiene metabolismo hepático y su excreción por la orina es inferior al 2%, por lo que no hay acumulación de metabolitos activos en insuficiencia renal y no requiere ajuste de dosis, ni siquiera en pacientes en diálisis, si bien la experiencia clínica en estos pacientes es muy limitada. Su uso se asocia a retención hidrosalina, edemas e incremento del riesgo de insuficiencia cardíaca, lo que limita su empleo en pacientes con ERC. Es por ello que se recomienda emplearla con precaución cuando el FG es < 60 ml/ min/1.73m² y evitarla cuando el FG sea <30 ml/min/1.73m². Hay que vigilar también las potenciales interacciones con algunos IP e ITINAN 30.
Los inhibidores de alfaglucosidasa (acarbosa y miglitol) y sus metabolitos se acumulan en la insuficiencia renal, por lo que, aunque no se ha documentado que aumenten el riesgo de hipoglucemia, su uso no está recomendado, dada su potencial toxicidad, especialmente a nivel hepático y sus efectos adversos gastrointestinales 30.
Los inhibidores de la dipeptidil peptidasa-4 (gliptinas) tienen un muy bajo riesgo de hipoglucemias, por lo que su empleo es especialmente atractivo en pacientes con ERC. Las diferentes gliptinas presentan importantes diferencias farmacocinéticas que condicionan su forma de utilización en presencia de insuficiencia renal. La linagliptina tiene eliminación hepatobiliar y no precisa ajuste de dosis, ni siquiera en pacientes con ERC avanzada, pudiendo emplearse también en pacientes en diálisis. Por el contrario, sitagliptina,vildagliptina y saxagliptina se eliminan en su mayor parte mediante excreción renal por lo que requerirán ajuste de dosis cuando el FGe sea < 50ml/min/1.73m². Respecto a las interacciones, con la excepción de vildagliptina, las gliptinas tienen potenciales interacciones con algunos IP y con los ITINAN 30.
Respecto a los análogos del GLP-1, al no sufrir un metabolismo específico hepático ni renal, ni eliminarse por las heces o la orina, podrían ser seguros y sin necesidad de ajuste de dosis en pacientes con ERC, pero su uso está limitado por los potenciales efectos adversos y la falta de experiencia clínica en estos casos. Así, dada la falta de experiencia clínica, los GLP-1 no deben utilizarse en pacientes con FG < 30 ml/min/1.73m² y por el momento su uso está limitado a pacientes con ERC leve- moderada. Exenatida y liraglutida tienen potenciales interacciones con atazanavir (solo y asociado a ritonavir o cobicistat) y rilpivirina 30.
Finalmente, los inhibidores del cotransportador sodio-glucosa tipo 2 (iSGLT2), actúan inhibiendo la reabsorción de glucosa en el túbulo proximal. Su eficacia depende de la función renal, por lo que se reduce en pacientes con ERC moderada y es prácticamente nula en la ERC avanzada. No se deben iniciar en pacientes con FGe < 60 ml/min/1.73m². Dapaglifozina no tiene interacciones con antirretrovirales, pero empaglifozina tiene potenciales interacciones con tenofovir y canaglifozina, además de tenofovir, también con algunos IP 30.
ANTIHIPERTENSIVOS
Las recomendaciones de manejo para diagnóstico y tratamiento de la hipertensión arterial en pacientes con infección por el VIH son los mismos que para la población general. Para seleccionar los fármacos antihipertensivos se deben tener en cuenta las potenciales interacciones farmacológicas y el perfil de seguridad de los fármacos Tabla 9.
Los inhibidores del eje renina-angiotensina, especialmente los inhibidores del enzima conversor de la angiotensina (IECA) y en segundo lugar los antagonistas del receptor de la angiotensina II (ARA-II) son los fármacos de primera elección en pacientes con infección por el VIH (especialmente cuando existe proteinuria). Ello es debido a su eficacia, su buena tolerancia y la práctica ausencia de interacciones con los antirretrovirales (especialmente con los IECA, pues sí existen interacciones con algunos ARA-II). Ambos grupos farmacológicos se deben prescribir con precaución cuando el FG es < 30ml/min/1.73m², por el riesgo de deterioro de la función renal e hiperkalemia.
En un segundo escalón de tratamiento se pueden añadir diuréticos, especialmente diuréticos de asa (furosemida, torasemida y bumetadina) pues son los únicos que mantienen potencia diurética cuando existe deterioro de la función renal (los diuréticos tiazídicos tienen menor potencia diurética cuando el FG es < 30ml/ min/1.73m²). Por otro lado los antagonistas de la aldosterona (espironolactona y eplerenona) se deben evitar cuando el FG es < 30ml/min/1.73m² por riesgo de hiperkalemia. No existen interacciones significativas entre diuréticos y antirretrovirales, con la excepción de eplerenona cuyo efecto puede ser potenciado por los inhibidores del CYP34A.
El tercer escalón terapéutico incluye beta-bloqueantes o antagonistas del calcio, pero deben ser utilizados con precaución por su perfil de interacciones farmacológicas.
ANTIINFLAMATORIOS NO ESTEROIDEOS Y ANALGÉSICOS
Todos los antiinflamatorios no esteroideos (AINE), incluyendo los inhibidores de la ciclooxigenasa 2, pueden ocasionar diferentes tipos de daño renal agudo: necrosis tubular aguda, nefritis intersticial aguda, necrosis papilar, síndrome nefrótico (cambios mínimos o glomerulonefritis membranosa) y alteraciones electrolíticas. Existe mayor riesgo en pacientes con otros procesos concomitantes como ERC, insuficiencia cardíaca, cirrosis o depleción de volumen. Por otro lado, el uso diario de AINE durante un período prolongado de tiempo puede estar asociado con un mayor riesgo de ERC, tal vez debido a necrosis papilar o nefritis intersticial crónica 32. Es por ello que no se recomienda el uso prolongado de AINE y se debe monitorizar la función renal cada 2-4 semanas al inicio del tratamiento.
En pacientes con disfunción renal avanzada deben evitarse (o se deben reducir las dosis) de muchos fármacos analgésicos. Esto se debe a que la farmacocinética y la farmacodinamia de muchos analgésicos y la mayoría de los opioides están alterados en este tipo de pacientes, siendo elevado el riesgo de toxicidad por la acumulación de fármacos excretados por vía renal y sus metabolitos. Es por ello que el tratamiento analgésico en pacientes con ERC es algo distinto a la clásica escala terapéutica del dolor recomendada por la OMS. En primera línea se recomienda paracetamol, que no requiere ajuste de dosis. En pacientes con ERC estadíos 4 y 5 se recomienda evitar el uso de AINE, codeína, dextropropoxifeno, morfina y meperidina y utilizar con precaución (y ajustando dosis) tramadol y oxicodona. En segunda línea de tratamiento analgésico es más recomendable utilizar otros opioides como hidromorfona, fentanilo, metadona o buprenorfina 33.
Gráficos:
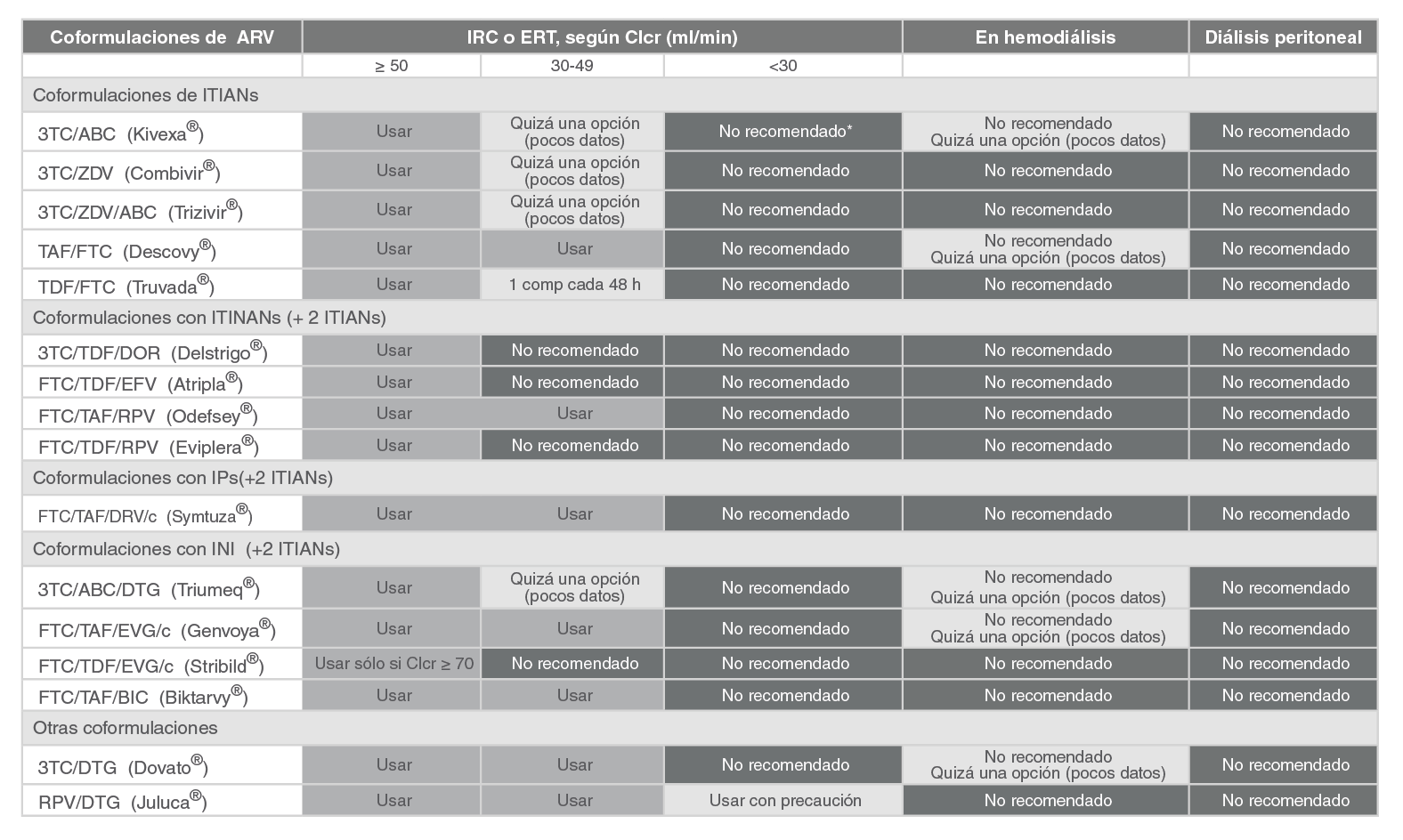
IRC: insuficiencia renal crónica; ERT: enfermedad renal terminal (*) No recomendado: Usar fármacos individuales ajustando la dosis adecuadamente
Tablas:
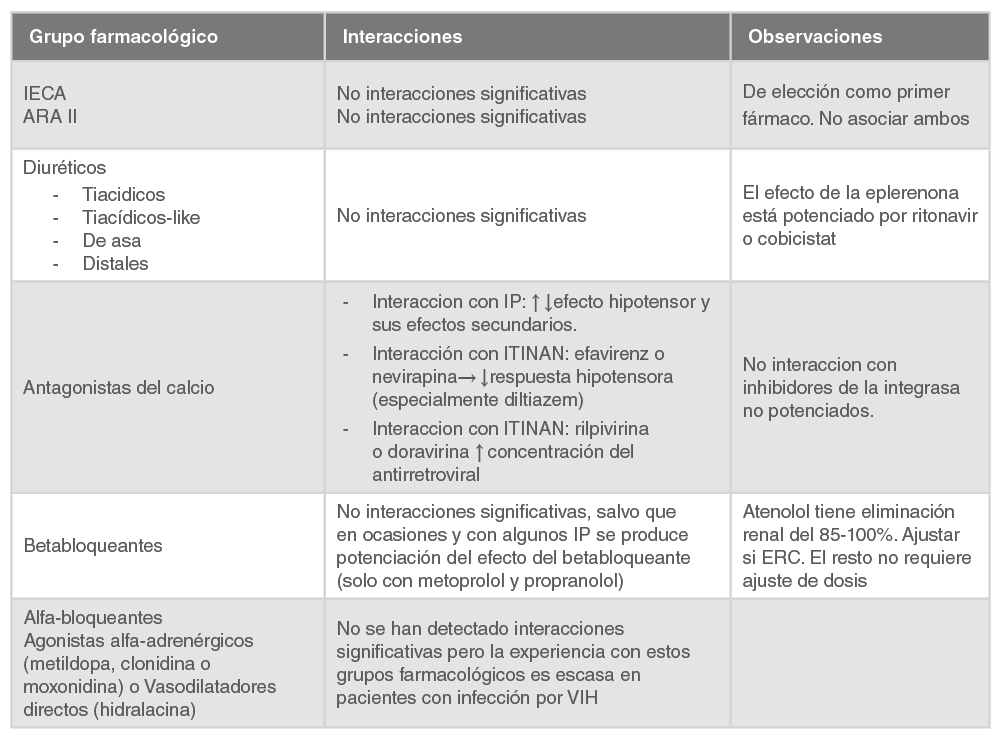
IECA, inhibidores del enzima conversiva de la angiotensina; ARA II, antagonistas de los receptores de la angiotensina II; IP, inhibidores de la proteasa; ITINAN, inhibidores de la transcriptasa inversa no análogos de nucleósidos; ERC, enfermedad renal crónica.

Abreviaturas:
BID: dos veces al día; FGe: filtrado glomerular estimado; IP: inhibidores de la proteasa; IP/r: inhibidores de la proteasa potenciados con ritonavir; ITINAN: no nucleósidos; INI: inhibidores de la integrasa; OD: una vez al día; IR: insuficiencia renal. *Fenofibrato puede producir un aumento reversible de la creatinina sérica

FGe, filtrado glomerular estimado (en ml/min/1,73 m²); DPP-4: dipeptidil peptidasa-4; SGLT2: cotransportador sodio-glucosa tipo 2
*Riesgo de hipoglucemias
**precaución por posibilidad de retención hídrica e insuficiencia cardiaca
***Riesgo muy alto de hipoglucemias con glicazida en estadios 4-5 #: Linagliptina no requiere ajuste de dosis.

*Todas las pautas recomendadas deberán de tener en cuenta la potencial nefrotoxicidad de cada régimen, así como las recomendaciones de GeSIDA/Plan Nacional sobre el Sida respecto al tratamiento antirretroviral en adultos infectados por el virus de la inmunodeficiencia humana.
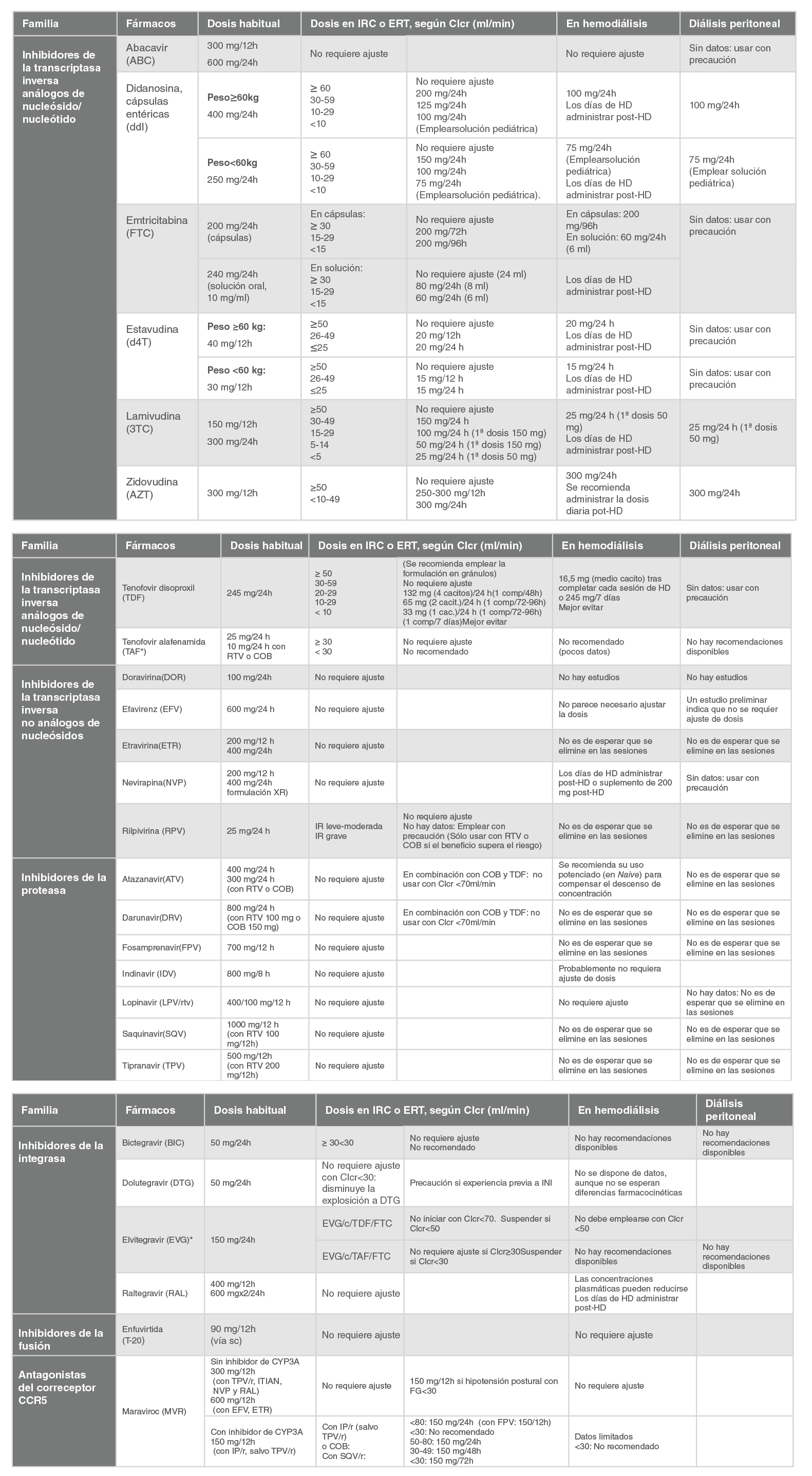
IRC: insuficiencia renal crónica; ERT: enfermedad renal terminal; Clcr: Aclaramiento de creatinina; sc: subcutánea
(* ) TAF y EVG: Sólo están disponibles coformulados.
Los potenciadores farmacocinéticos RTV y COB no requieren ajuste de dosis en insuficiencia renal ni es de esperar que se eliminen en HD.

aDebido a los efectos adversos (especialmente toxicidad renal) con la administración de anfotericina B desoxicolato IV, ésta ha sido sustituida por las formulaciones lipídicas (complejo lipídico y liposomal)
IRC: insuficiencia renal crónica; OD: cada 24 horas, BID: cada 12 horas, TID: cada 8 horas; VO: vía oral, IV: vía intravenosa; FGe: filtrado glomerular estimado; PCP: Pneumocystis jiroveci
Bibliografía:
Mitra PK, Tasker PR, Ell Chronic kidney disease. BMJ 2007;334(7606):1273.
Ladda MA, Goralski KB. The effects of CKD on cytochrome P450 mediated drug metabolism. Adv Chronic Kidney Dis 2016; 23:67–75.
Cristelli MP, Cofán F, Rico N, et Estimation of renal function by CKD-EPI versus MDRD in a cohort of HIV-infected patients: a cross-sectional analysis. BMC Nephrol 2017; 18:58.
Panel de expertos del Grupo de Estudio de SIDA (GeSIDA) y del Plan Nacional sobre el SIDA (PNS). Documento de Consenso del Grupo de Estudio de SIDA / Plan Nacional sobre el SIDA respecto al tratamiento antiretroviral en adultos infectados por el virus de la immunodeficiencia humana (actualización enero 2019).
European AIDS Clinical Society. Guidelines for the clinical management and treatment of HIV-infected adults in Europe. (Version 9.1, Octubre 2018). http://www.eacsociety.org/guidelines/eacs-guidelines/
Maggi P, Montinaro V, Mussini C, et Novel antirretroviral drugs and renal function monitoring oh HIV patients. AIDS Rev 2014; 16: 144-51.
Fischetti B, Shah K, Taft DR, Berkowitz L, Bakshi A, Cha Real-World Experience With Higher-Than- Recommended Doses of Lamivudine in Patients With Varying Degrees of Renal Impairment. Open Forum Infect Dis 2018; 5(10): ofy225.
Arribas JR, Thompson M, Sax PE, Haas B, McDonald C, Wohl DA, et al. Randomized, Double-Blind Comparison of Tenofovir Alafenamide (TAF) vs Tenofovir Disoproxil Fumarate (TDF), Each Coformulated With Elvitegravir, Cobicistat, and Emtricitabine (E/C/F) for Initial HIV-1 Treatment: Week 144 J Acquir Immune Defic Syndr. 2017 Jun 1;75(2):211-218.
Pozniak A, Arribas JR, Gathe J, et al; GS-US-292-0112 Study Switching to tenofovir alafenamide, coformulated with elvitegravir, cobicistat, and emtricitabine, in HIV-infected patiens with renal impairment: 48-week results from a single-arm, multicenter, open-label phase 3 study. J Acquir Immune Defic Syndr 2016; 71 (5): 530-7.
Custodio JM, Fordyce M, Garner W, et al. Pharmacokinetics and Safety of Tenofovir Alafenamide in HIV-Uninfected Subjects with Severe Renal Antimicrob Agents Chemother 2016; 60:5135– 5140.
Ankrom Web, Yee KL, Sanchez RI, et al. Severe Renal Impairment Has Minimal Impact on Doravirine Pharmacokinetics. Antimicrob Agents Chemother 2018;62(8). pii: e00326-18.
Weller S, Borland J, Chen S, et al. Pharmacokinetics of dolutegravir in HIV-seronegative subjects with severe renal impairment. Eur J Clin Pharmacol 2014; 70:29–35.
Biktarvy, Ficha Técnica (Revisada EMA 05/19) (Consultado 03/06/2019).
Vourvahis M, Fang J, Checchio T, et Pharmacokinetics, Safety, and Tolerability of Maraviroc in HIV- Negative Subjects with Impaired Renal Function. HIV Clin Trials 2013;14(3):99–109.
Ibalizumab [package insert]. Food and Drug 2018. Available at: https://www.accessdata. fda.gov/drugsatfda_docs/label/2018/761065lbl.pdf.
Slaven JE, Decker BS, Kashub ADM, Atta MG, Wyatt CM, Gupta SK. Plasma and Intracellular Concentrations in HIV-infected Patients Requiring Hemodialysis Dosed with Tenofovir Disoproxil Fumarate and Emtricitabine: TDF and FTC in HD. J Acquir Immune Defic Syndr 2016 September 1; 73(1): e8–e10.
Aleman J, van den Berk GEL, Franssen EJFm de Fijter Tenofovir disoproxil treatment for a HIV- hepatitis B virus coinfected patient undergoing peritoneal dialysis: wich dose we need? AIDS 2015; 29: 1579-80.
Yanagisawa K, Nagano D, Ogawa Y, et Raltegravir is safely used with long-term viral suppression for HIV-infected patients on hemodialysis: a pharmacokinetic study. AIDS 2016; 30:970-972.
Moltó J, Graterol F, Miranda C, et Removal of Dolutegravir by Hemodialysis in HIV-Infected Patients with End-Stage Renal Disease. Antimicrob Agents Chemother 2016; 60: 2564 –2566.
Kreft KN, Spencer CA, Raghuram Safety and efficacy of dolutegravir in hemodialysis. International Journal of STD & AIDS 2019; 0(0) 1–6.
Michienzi SM, Schriever CA, Badowski ME. Abacavir/lamivudine/dolutegravir single tablet regimen in patients with human immunodeficiency virus and end-stage renal disease on International Journal of STD & AIDS 2018; 0(0) 1–7.
Eron JJ Jr, Lelievre JD, Kalayjian R, et al. Safety of elvitegravir, cobicistat, emtricitabine, and tenofovir alafenamide in HIV-1-infected adults with end-stage renal disease on chronic haemodialysis: an open- label, single-arm, multicentre, phase 3b trial. Lancet HIV 2019; 6: e15–24.
Sawinski D, Shelton BA, Mehta S, et al. Impact of protease inhibitor-based antiretroviral therapy on outcomes for HIV+ kidney transplant recipients. Am J Transplant 2017; 17: 3114-22.
Rollins B, Farouk S, DeBoccardo G, et Higher Rates of Rejection in HIV-infected Kidney Transplant Recipients on Ritonavir-Boosted Protease Inhibitors: Three-Year Follow Up Study. Clin Transplant 2019 Mar 12:e13534.
Jimenez HR, Natali KM, Zahran Drug interaction after ritonavir discontinuation: considerations for antiretroviral therapy changes in renal transplant recipients. International Journal of STD & AIDS 2019; 0(0) 1–5.
Matignon M, Lelievre JD, Lahiani A, et al. Low incidence of acute rejection within 6 months of kidney transplantation in HIV-infected recipients treated with raltegravir: the Agence Nationale de Recherche sur le Sida et les Hepatites Virales (ANRS) 153 TREVE trial. HIV Med 2019;20(3):202-213.
Meaney CJ, O’Connor M, McGowan M, Hamid M, Su W. Treatment of prolonged tacrolimus toxicity using phenytoin in a haemodialysis patient. J Clin Pharm Ther. 2019;1–4.
Malat GE, Boyle SM, Jindal RM, et Kidney Transplantation in HIV-Positive Patients: A Single-Center, 16-Year Experience Am J Kidney Dis 2019; 73(1):112-118.
Panel of Experts from the Metabolic Disorders and Comorbilities Study Group (GEAM); Aids Study Group (GeSIDA); National Aids Plan (PNS). Executive summary of the consensus document on metabolic disorders and cardiovascular risk in patients with HIV Enferm Infecc Microbiol Clin. 2019;37:50-55.
Gómez-Huelgas R, Martínez-Castelao A, Artola S, Górriz JL, Menéndez E. Consensus document on treatment of type 2 diabetes in patients with chronic kidney disease. Nefrologia. 2014;34:34-45.
HIV Drug Interactions. The University of Liverpool. Last review: May 30, 2019. Disponible en: https:// hiv-druginteractions.org/
Zhang X, Donnan PT, Bell S, Guthrie B. Non-steroidal anti-inflammatory drug induced acute kidney injury in the community dwelling general population and people with chronic kidney disease: systematic review and meta-analysis. BMC Nephrol 2017; 18:256.
Davison SN, Koncicki H, Brennan F. Pain in chronic kidney disease: a scoping review. Semin Dial 2014;27:188.