Documento de consenso de GeSIDA/Plan Nacional sobre el SIDA respecto al tratamiento antirretroviral en adultos infectados por el virus de la inmunodeficiencia humana
ACTUALIZACIÓN 2023
Notas de la Versión:
LISTADO DE ABREVIATURAS
| ART | Antirretrovirales |
| CAB | Cabotegravir |
| cis | Cisgénero |
| EMA | Agencia Europea de Medicamentos/ European Medicines Agency |
| ECDC | European Centre for Disease Prevention and Control |
| FGe | Función Glomerular estimada |
| FTC | Emtricitabina |
| GBHSH | Gays, bisexuales y otros hombres que tienen sexo con hombres |
| HSH | Infecciones de transmisión sexual |
| LEN | Lenacapavir |
| MVC | Maraviroc |
| NNT | Número de personas que es necesario tratar |
| ONUSIDA | Programa conjunto de las Naciones Unidas sobre el VIH/ SIDA |
| p-a | Personas-año |
| PID | Personas que se inyectan drogas |
| PPE | Profilaxis post-exposición |
| PrEP | Profilaxis pre-exposición |
| PVVIH | Personas que viven con infección por VIH |
| RR | Riesgo relativo |
| RRR | Reducción del riesgo relativo |
| SINIVIH | Sistema de información sobre nuevos diagnósticos de VIH |
| TAF | Tenofovir alafenamida fumarato |
| TAR | Tratamiento antirretroviral |
| TDF | Tenofovir disoproxil fumarato |
COMITÉ DE REDACCIÓN Y AGRADECIMIENTOS
COMITÉ DE REDACCIÓN*
COORDINADORES/AS
REDACTORES/AS GENERALES
REDACTORES/AS Y REVISORES/AS
AGRADECIMIENTOS
COMITÉ DE REDACCIÓN*
COORDINADORES/AS
Esteban Martínez (GeSIDA) Hospital Clinic Universitari / IDIBAPS. UB. Barcelona.
José Ramón Arribas (GeSIDA) Hospital Universitario La Paz. IdiPAZ. Madrid.
Rosa Polo (PNS) DCVIHT. Plan Nacional sobre el Sida. MS. Madrid.
REDACTORES/AS GENERALES
Juan González García Hospital Universitario La Paz. IdiPAZ. Madrid
Rosario Palacios Hospital Universitario Virgen de la Victoria. IBIMA. Málaga.
REDACTORES/AS Y REVISORES/AS
Antonio Antela (GeSIDA) Complejo Hospitalario Universitario de Santiago. Santiago de Compostela.
Juan Ambrosioni (GeSIDA) Hospital Clinic Universitari. IDIBAPS. Universidad de Barcelona. Barcelona.
Victor Asensi (GeSIDA) Hospital Central de Asturias. Universidad de Oviedo. Oviedo.
Enrique Bernal (GeSIDA) Hospital General Universitario Reina Sofía. Murcia.
José Luis Blanco (GeSIDA) Hospital Clinic Universitari. IDIBAPS. Universidad de Barcelona. Barcelona.
José Ramón Blanco (PNS) Hospital San Pedro-CIBIR. Logroño.
Alfonso Cabello (PNS) Hospital Fundación Jiménez Díaz. Madrid.
José Luis Casado (GeSIDA) Hospital Ramón y Cajal. IRYCIS. Madrid.
Carmen de Mendoza (GeSIDA) Hospital Universitario Puerta de Hierro/IDIPHIM. Madrid.
Carlos Dueñas (PNS) Hospital Clínico Universitario de Valladolid.
Ana González-Cordón (GeSIDA) Hospital Clinic Universitari. IDIBAPS. UB. Barcelona.
Carmen Hidalgo (PNS) Hospital Universitario Virgen de las Nieves. Granada.
Juan Emilio Losa (PNS) Hospital Universitario Fundación Alcorcón. Madrid.
Josep Mallolas (GeSIDA) Hospital Clinic Universitari. IDIBAPS. Universidad de Barcelona. Barcelona.
Ana Mariño (PNS) Mar Masià (GeSIDA) Complexo Hospitalario Universitario de Ferrol. El Ferrol.
Mar Masià (GeSIDA) Hospital General Universitario de Elche. Universidad Miguel Hernández. Alicante.
Celia Miralles (PNS) Hospital Álvaro Cunqueiro. Vigo.
Rocío Montejano (GeSIDA) Hospital Universitario La Paz. IdiPAZ. Madrid.
Marta Montero (PNS) Hospital Universitario La Fe. Valencia.
María Luisa Montes (GeSIDA) Hospital Universitario La Paz. IdiPAZ. Madrid.
Roger Paredes (GeSIDA) Hospital Germans Trias i Pujol. IGTP. Badalona.
Jose Antonio Pérez Molina (GeSIDA) Hospital Ramón y Cajal. IRYCIS. Madrid.
Jose Antonio Pineda (GeSIDA) Hospital Universitario de Valme. Sevilla.
Daniel Podzamczer (GeSIDA) Hospital Universitari de Bellvitge. IDIBELL. L’Hospitaletde Llobregat. Barcelona.
Eva Poveda (GeSIDA) Complexo Hospitalario Universitario de Vigo. IISGS. Vigo.
Federico Pulido (GeSIDA) Hospital Universitario 12 Octubre-Instituto de Investigación 1+12. Madrid.
Antonio Rivero (GeSIDA) Jesús Santos (GeSIDA) Hospital Universitario Reina Sofía. IMIBIC. Córdoba.
Jesús Santos (GeSIDA)Hospital Universitario Virgen de la Victoria. IBIMA. Málaga.
Jesús Sanz Sanz (PNS) Hospital Universitario de la Princesa. IIS La Princesa. Madrid.
Sergio Serrano (PNS) Hospital Ramón y Cajal. IRYCIS. Madrid.
Inés Suárez (GeSIDA) Hospital Infanta Sofía. Madrid.
Miguel Torralba (GeSIDA) Hospital Universitario de Guadalajara. Guadalajara.
Jesús Troya (GeSIDA) Hospital Universitario Infanta Leonor. Universidad Complutense. Madrid.
Montserrat Tuset (GeSIDA) Hospital Clínic Universitari. IDIBAPS. Barcelona.
María Velasco (GeSIDA) Hospital Universitario Fundación Alcorcón. Madrid.
Isabel Viciana (GeSIDA) Hospital Universitario Virgen de la Victoria. Málaga.
María J. Vivancos (GeSIDA) Hospital Ramón y Cajal. IRYCIS. Madrid.
Miguel A. von Wichmann (PNS) Hospital Universitario Donostia. Instituto Biodonostia. San Sebastián.
AGRADECIMIENTOS
La Junta Directiva de GeSIDA y el Plan Nacional sobre el Sida agradecen las aportaciones y opiniones para mejorar el texto de: Hortensia Alvarez, Mª Jesús Pérez Elías, Jara Llenas García, Rafael Rubio García, Pablo Bachiller Luque, del departamento médico de Gilead Sciences (enviado por Raquel Garijo Olmo), del equipo médico MSD-España (enviado por Pedro Ferrer, Itxaso Aguirregabiria, Manuel Cotarelo, Inmaculada Clotet, Fernando Chacón, Oscar Rincón, Nuria Sánchez y Enrique Vacas ), del departamento mádico de ViiV Healthcare (enviado por Jose E Martín Herrero, Beatriz Novoa y Silvia Esteban), del departamento médico de la unidad de enfermedades infecciosas de Janssen España (enviado por Ana Cáceres Núñez) y del departamento médico de Theratechnologies (enviado por Macarena Sierra García).
1. INTRODUCCIÓN
JUSTIFICACIÓN, OBJETIVO Y ALCANCE
El uso de los fármacos antirretrovirales (FAR) ha adquirido gran complejidad por la aparición de seis familias, incluyendo más de 40 fármacos y combinaciones, y por sus diferentes características en cuanto a eficacia, toxicidad, resistencias, barrera genética, tropismo, interacciones y uso en situaciones clínicas especiales. Esta complejidad hace necesaria la elaboración y actualización frecuente de guías y recomendaciones sobre el tratamiento antirretroviral (TAR).
El Grupo de Estudio de SIDA (GeSIDA) de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (SEIMC) y la División de Control de VIH, ITS, Hepatitis virales y Tuberculosis (DCVIHT) del Ministerio de Sanidad, antes Plan Nacional sobre el SIDA (PNS), editan anualmente un documento de consenso sobre el TAR en adultos.
El objetivo de este documento es transmitir el estado actual del conocimiento sobre el TAR a los profesionales que tratan a adultos con infección por el VIH y proporcionarles recomendaciones que puedan guiar sus decisiones terapéuticas.
GeSIDA y la DCVIHT, junto con otras sociedades científicas elaboran otras recomendaciones referentes a la infección por el VIH donde se incluyen aspectos específicos del TAR. En este documento estos aspectos se tratan de forma somera y se remite al lector a las publicaciones específicas.
en adultos infectados por el virus de la inmunodeficiencia humana.
METODOLOGÍA
El panel redactor del documento está integrado por clínicos expertos en la infección por el VIH y el TAR, distribuidos por grupos encargados de actualizar cada sección del documento. Tres miembros del panel actúan como coordinadores y dos como redactores generales, con apoyo, desde esta edición, de una redactora novel. Cada grupo revisa los datos más relevantes de las publicaciones científicas y comunicaciones a congresos más recientes, en el caso de esta actualización hasta el 30 de noviembre de 2022, elaboran el texto de cada sección y generan preguntas sobre aspectos no suficientemente consensuados que se someten a votación de todo el panel. El borrador del documento se discute y consensua en una reunión presencial del panel y su redacción provisional se expone durante 15 días en las páginas web de GeSIDA y de la DCVIHT del Ministerio de Sanidad para que profesionales, pacientes o quien esté interesado pueda hacer sugerencias que, si procede, son integradas en el documento final.
Cada recomendación de estas guías se califica con una letra que indica su fuerza [A (debe ofrecerse siempre), B (en general debe ofrecerse) o C (debe ofrecerse opcionalmente)] y un número que expresa las pruebas que sustentan dicha recomendación [I (resultados de uno o más ensayos clínicos aleatorizados de aspectos clínicos o de laboratorio o de un metaanálisis), II (de uno o más ensayos no aleatorizados o datos observacionales de cohortes) y III (opinión de expertos)].
2. EVALUACION INICIAL Y SEGUIMIENTO DE LA PERSONA CON VIH
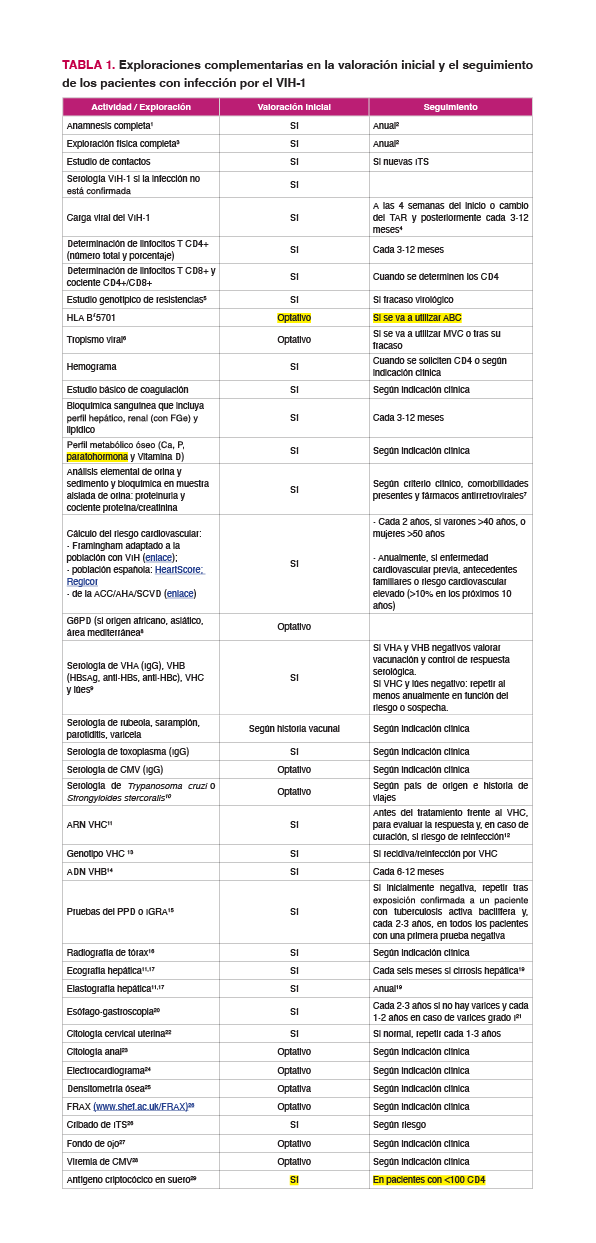
En la Tabla 1 se sistematizan las exploraciones complementarias en la valoración inicial y en el seguimiento de los pacientes con infección por el VIH-1.
Recomendaciones
- Realizar una anamnesis detallada y un examen físico completo que se repetirán siempre que el paciente lo requiera y como mínimo anualmente. (A-III)1-2
- Realizar un estudio voluntario de contactos del caso índice en todos los nuevos diagnósticos de VIH-1, garantizando la confidencialidad. (A-III)
- En la visita inicial, realizar una serología del VIH-1/2 en los casos en los que no se haya confirmado la infección o la carga viral plasmática (CVP) sea indetectable. (A-I)
- Determinar la CVP antes del inicio del TAR, cuando se cambie de TAR y periódicamente durante el tratamiento, con una técnica con un límite de detección de al menos 50 copias/mL, para confirmar y monitorizar la supresión virológica. La frecuencia dependerá del motivo del cambio, si lo hubiere, y del TAR empleado (A-I)
- Determinar la cifra absoluta y el porcentaje de linfocitos T CD4+ antes de iniciar el TAR y, una vez iniciado, como parámetro de monitorización periódica de la respuesta inmunológica al mismo. (A-I)
- Determinar la cifra de linfocitos CD8+ y el cociente CD4+/CD8+ cuando se determine la cifra de linfocitos CD4+ en sangre. (B-II)
- Realizar un estudio genotípico de resistencias del VIH-1 en todos los pacientes antes del inicio del TAR. (A-II)3
- Esperar a conocer el resultado del estudio genotípico de resistencias si se va a iniciar TAR con una pauta basada en Inhibidor de transcriptasa inversa no nucleósido (ITNN) para los que existe mayor prevalencia de resistencias transmitidas, como efavirenz (EFV) y rilpivirina (RPV) (A-II) y cuando se vaya a iniciar con dolutegravir (DTG)/lamivudina (3TC) en un paciente con historia de uso de profilaxis pre-exposición (PrEP)4 (A-III). En los demás casos, revisar la prueba en cuanto esté disponible especialmente si se ha utilizado una pauta de baja barrera genética. (A-III)5
- Realizar un estudio genotípico de resistencias del VIH-1 a todos los pacientes en fracaso virológico, incluyendo resistencias en la integrasa si el régimen incluye un INI5. (A-I)
- Determinar el tropismo del VIH-1 cuando se vaya a utilizar un antagonista del receptor de CCR5 (A-I) y cuando fracase un régimen con un antagonista del receptor CCR5. (A-I)
- Determinar el HLA-B*5701 en todos los pacientes antes de iniciar un régimen de TAR que contenga abacavir (ABC). (A-I)
- No prescribir ABC si la prueba del HLA-B*5701 es positiva. (A-I)
- Incluir en la evaluación inicial de laboratorio: hemograma, bioquímica general, estudio básico de coagulación, serologías y pruebas específicas. (A-II)
Tablas:
Bibliografía:
Panel de expertos de GeSIDA. Documento de consenso de GeSIDA/Plan Nacional sobre el SIDA respecto al tratamiento antirretroviral en adultos infectados por el virus de la inmunodeficiencia humana. (Actualización enero 2022). https://gesida-seimc.org/wp-content/uploads/2022/05/GuiaGeSIDAPlanNacionalSobreElSidaRespectoAlTratamientoAntirretroviralEnAdultosInfectadosPorElVirusDeLaInmunodeficienciaHumanaActualizacionEnero2022.pdf
Grupo de Estudio de Sida de la Sociedad Española de Enfermedades Infecciosas. Documento consenso de GeSIDA sobre control y monitorización de la infección por el VIH. (Actualización abril 2018). https://gesida-seimc.org/wp-content/uploads/2018/02/gesida_DC_Control_Monitorizacion_VIH.pdf
Viñuela-González L, Fuentes-López A, de Salazar A, et al. Resistencias transmitidas en pacientes NAÏVE. Actualización 2019-2021. GeSIDA 2022. Abstract PO-24. Disponible en: https://congresogesida.es/images/site/ponencias/PO-24.pdf
Girometti N, McCormack S, Tittle V, McOwan A, & Whitlock G. Rising rates of recent preexposure prophylaxis exposure among men having sex with men newly diagnosed with HIV: antiviral resistance patterns and treatment outcomes. AIDS 2022; 36: 561-566.
Grupo de Estudio de Sida de la Sociedad Española de Enfermedades Infecciosas. Documento sobre la utilidad clínica de las resistencias a antirretrovirales. (Actualización octubre 2018). https://gesida-seimc.org/wp-content/uploads/2019/03/14_DOCUMENTO_SOBRE_UTILIDAD_CLINICA_RESISTENCIAS_A_ANTIRRETROVIRALES.pdf
3. TRATAMIENTO ANTIRRETROVIRAL INICIAL
Los objetivos del TAR son conseguir la máxima y más duradera supresión de la CVP, restablecer y preservar la función inmunológica, reducir la morbilidad asociada a la replicación del VIH-1 y su efecto sobre otras comorbilidades, aumentar la supervivencia y prevenir la transmisión del VIH-1. El TAR debe iniciarse tan pronto como sea posible, y existen en la actualidad combinaciones que permiten el inicio inmediato del TAR sin esperar a ninguno de los resultados de la visita basal. La situación clínica del paciente, así como su disposición y motivación son factores críticos a la hora de decidir el momento para iniciar el TAR.
RECOMENDACIONES GENERALES
3.1.1. CUANDO INICIAR EL TAR
El TAR debe iniciarse en todas las personas que viven con VIH (PVV), con o sin sintomatología, y con independencia del número de linfocitos T CD4+ Tabla 2. Como excepción se consideran las PVV que mantienen CVP indetectable de forma mantenida sin TAR (controladores de élite). La recomendación de inicio en todos los pacientes, con la excepción mencionada, se sustenta sobre todo en dos grandes ensayos clínicos aleatorizados12.
En el ensayo START (Strategic Timing of AntiRetroviral Treatment)1, se incluyeron 4.685 PVV infectadas por el VIH-1 con una cifra de linfocitos CD4+ >500 células/µL, y fueron seguidas durante un tiempo medio de 3 años. Se aleatorizaron a iniciar TAR de forma inmediata o a diferirlo hasta que el recuento de linfocitos CD4+ fuera <350 células/µL. La variable principal fue la proporción de pacientes que presentaban un evento definitorio de síndrome de inmunodeficiencia adquirida (SIDA), una complicación grave no asociada a SIDA o muerte por cualquier motivo. Este criterio ocurrió en el 1,8% de los pacientes que iniciaron TAR de forma inmediata y en el 4,1% de los que lo difirieron (una reducción de riesgo del 57% [IC95%: 38% - 70%]).
En el estudio TEMPRANO2 se incluyeron 2.056 pacientes sin TAR previo y una cifra de linfocitos CD4+ inferior a 800 células/µL que se asignaron aleatoriamente a recibir TAR de forma inmediata o a diferirlo hasta presentar criterios de tratamiento de acuerdo con las recomendaciones de la Organización Mundial de la Salud (OMS) vigentes en cada momento. La variable principal fue el desarrollo de SIDA, de cáncer no asociado a SIDA, de enfermedad bacteriana invasiva, o muerte por cualquier causa en un periodo de 30 meses. El inicio inmediato de TAR se relacionó con una disminución de eventos principales del 44% (IC95%: 24 - 59%). Cuando se analizaron por separado los pacientes que entraron en el estudio con una cifra de linfocitos CD4+ superior a 500 células/µL (n=849), el inicio inmediato se asoció con un descenso del riesgo de presentar alguno de los eventos primarios en los 30 meses siguientes del 44% (IC95%: 6 - 67%), a pesar de que durante el estudio un 41% de los pacientes asignados a diferir el TAR lo iniciaron igualmente, y la mediana de linfocitos CD4+ no fue en ningún momento del seguimiento inferior a 500 células/µL.
Por otra parte, se ha demostrado que el inicio del TAR se asocia con un menor riesgo de transmisión del VIH-1 y reducción de nuevas infecciones3.
Varios ensayos clínicos realizados en países con recursos económicos limitados4 y algunas experiencias observacionales en Londres5, San Diego6 y San Francisco7, han mostrado que el inicio rápido del TAR (el mismo día del diagnóstico o en la primera semana) favorece la retención de los pacientes en la asistencia e incrementa la proporción de pacientes con supresión virológica, lo que podría tener implicaciones de salud pública al disminuir la transmisibilidad. En países desarrollados con sistemas sanitarios públicos como el español no existe evidencia de que el inicio temprano tenga un impacto positivo sobre la retención en los cuidados.
En el estudio DIAMOND, no comparativo, se evaluó en 109 pacientes la eficacia de darunavir potenciado con cobicistat (DRV/c)/emtricitabina (FTC)/tenofovir alafenamida (TAF) iniciado en los primeros 14 días tras el diagnóstico, antes de disponer de las determinaciones basales de laboratorio. A las 48 semanas, el 84% de los pacientes tenían CVP <50 copias/mililitro (cop/mL) en el análisis snapshot y 96% en el análisis de datos observados (n=96), sin discontinuaciones por fracaso.En el estudio STAT9, 131 pacientes sin tratamiento previo fueron incluidos en un estudio de brazo único, con la combinación DTG/3TC en los primeros 14 días tras el diagnóstico de infección por VIH-1 sin resultados analíticos previos. A lo largo de las primeras 24 semanas, el tratamiento se modificó en 8 pacientes (5 con infección por virus de hepatitis B (VHB), uno con la mutación M184V al inicio, uno por evento adverso y uno por decisión del paciente). A las 24 semanas, endpoint primario, el 78% estaban con CVP <50 cop/mL en el análisis snapshot. A las 48 semanas, el porcentaje de pacientes con CVP <50 cop/mL fue del 82%10. En los escasos FV, no se detectó emergencia de mutaciones asociadas a resistencias (MR).
En el estudio FAST11, se evaluó la combinación bictegravir (BIC)/FTC/TAF en una estrategia de inicio rápido. Se incluyeron 117 participantes. En el análisis snapshot, a las 24 semanas, el 80,4% estaban con CVP <50 cop/mL, 9,8% con CVP >50 cop/mL, 1,8% habían abandonado por evento adverso o muerte y 8% por otras causas. No se detectaron MR en los pacientes con CVP detectable a las 24 semanas.
En caso de plantearse el inicio del TAR de forma inmediata, sin disponer de toda la información, la selección adecuada de la pauta de TAR es esencial. Debe cumplir: facilidad de toma, buena tolerabilidad, no requerir estudio previo de HLA-B*5701, mínimo riesgo de interacciones farmacológicas, alta probabilidad de mantener actividad antiviral en presencia de CVP elevadas, cifras bajas de linfocitos CD4+ o de virus con mutaciones de resistencia basales y capacidad de suprimir la replicación del VHB en caso de coinfección por el mismo.
Recomendaciones
- Se recomienda la administración de TAR a todos los pacientes con infección por el VIH-1 confirmada y tras valoración médica (A-I). Como excepción se consideran los pacientes que mantienen CVP indetectable de forma mantenida sin TAR (controladores de élite).
- Se recomienda iniciar el TAR tan pronto como sea posible. (A-II)
- El inicio del TAR debe valorarse siempre individualmente (A-III).
- Se debe realizar siempre una determinación de linfocitos CD4+ y CVP previa al inicio del tratamiento, aunque no es imprescindible esperar hasta disponer de los resultados si se utiliza una pauta cuya recomendación no esté condicionada a sus valores (A-III).
- Además, siempre debe prepararse al paciente, proporcionándole información sobre los objetivos del tratamiento y las distintas opciones, seleccionando el esquema terapéutico que mejor se adapte al estilo de vida, comorbilidades, posibles interacciones y valorando el riesgo de mala adherencia. (A-III)
3.1.2. QUE COMBINACIÓN DE ANTIRRETROVIRALES DEBE UTILIZARSE
Las pautas recomendadas para el TAR inicial en el momento actual consisten en una combinación de dos o tres fármacos basados en un inhibidor de la integrasa (INI) de segunda generación (DTG o BIC) Tabla 3. La única pauta doble recomendada en el momento actual como TAR de inicio consiste en DTG/3TC. Con estas combinaciones se consigue una CVP <50 cop/mL a las 48 semanas de tratamiento en más del 85% de los casos.
En el caso de PVV embarazadas, con tuberculosis (TB), coinfección por VHB o virus de hepatitis C (VHC) o con historia de PrEP se debe utilizar la información existente en los apartados correspondientes de este documento y en las guías específicas.
Recomendación
- El TAR de inicio consiste en una combinación de dos o tres FAR, en alguna de las combinaciones que se detallan en la Tabla 3. (A-I)
3.1.2.1. INHIBIDORES DE LA TRANSCRIPTASA INVERSA ANÁLOGOS DE NUCLEÓSIDOS/NUCLEÓTIDOS (ITIAN)
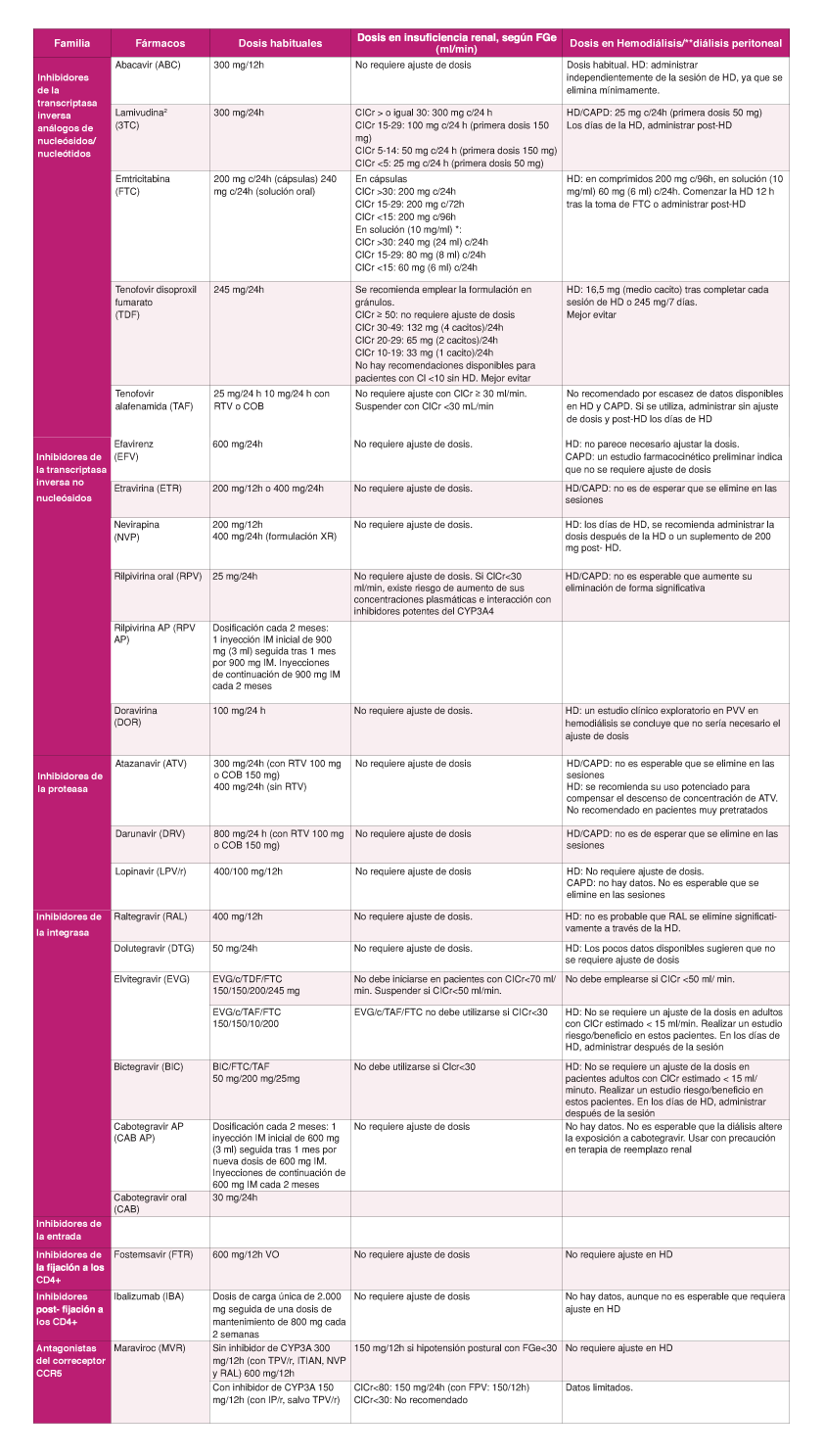
En España se utilizan tres ITIAN: 3TC, FTC y ABC. También se dispone de un análogo de nucleótido, tenofovir (TFV). A efectos prácticos, la abreviatura ITIAN en esta guía incluye también a TFV. Se consideran como combinaciones de ITIAN de elección las formadas por FTC/TAF y por ABC/3TC, que deberían administrase siempre que sea posible en preparados coformulados. La utilización de TFV como tenofovir disoproxil (TDx) puede considerarse una alternativa a TAF en regímenes que no incluyan un potenciador, siempre que se excluya la presencia de alteración renal o de alteración de la densidad mineral ósea y no existan otros factores que aumenten el riesgo de desarrollarlas.
No existe evidencia clínica que permita afirmar diferente eficacia de 3TC y FTC, por lo que el uso de uno u otro ITIAN en los regímenes seleccionados depende fundamentalmente de la experiencia disponible en su uso conjunto con los otros FAR de la combinación.
Combinaciones con FTC/TFV frente a combinaciones con ABC/3TC
Hasta este momento, TAF frente a ABC en el TAR de inicio sólo se ha comparado en el estudio GS-US-380-1489, aunque en regímenes diferentes (BIC/FTC/TAF vs DTG/ABC/3TC, doble ciego)12. En este estudio la eficacia de la combinación con TAF fue no inferior a la de ABC, aunque en el grupo que recibió la pauta con ABC la frecuencia de efectos adversos (EA) (náuseas) fue mayor (10% vs 22%).
Varios estudios han comparado TDF frente a ABC. En el ensayo clínico ACTG 520213 se comparó de forma ciega el inicio de TAR con ABC/3TC o FTC/TDF en 1.857 pacientes. Los participantes fueron aleatorizados además a recibir atazanavir potenciado con ritonavir (ATV/r) o EFV de forma abierta. Entre los pacientes con CVP basal igual o mayor de 100.000 cop/mL, tanto el tiempo hasta el FV como el tiempo hasta el primer efecto adverso de grado 3-4 fueron significativamente más cortos en el brazo de ABC/3TC que en el brazo de FTC/TDF. En los pacientes con CVP <100.000 cop/mL no hubo diferencias en eficacia virológica entre ABC/3TC y FTC/TDF, independientemente de que se administraran con ATV/r o EFV14.
Tres estudios en fase III diseñados para comparar el TAR de inicio con DTG, frente a otros FAR recomendados (EFV en el estudio SINGLE16, raltegravir (RAL) en el estudio SPRING-217 o DRV/r en el estudio FLAMINGO18) han mostrado una eficacia similar de ABC/3TC o FTC/TDF. Sin embargo, dichos ensayos clínicos no permiten establecer comparaciones formales ya que, o bien la elección del ITIAN no fue aleatorizada, quedando a criterio del investigador1718, o las distintas combinaciones de ITIAN iban asociadas a un tercer fármaco también distinto16.
Recomendaciones
- Las combinaciones de ITIAN de elección para regímenes de inicio son FTC/TAF o ABC/3TC (A-I). Se recomienda su uso en coformulación. (A-II)
- TDF puede utilizarse como alternativa a TAF en regímenes que no incluyan un potenciador, ritonavir (RTV) o cobicistat (COBI), siempre que se excluya la presencia de alteración renal u ósea y no existan otros factores que aumenten el riesgo de desarrollarlas. (C-I)
- La combinación ABC/3TC sólo está incluida en una pauta considerada de elección, cuando se asocia a DTG. (A-I)
3.1.2.2. INHIBIDORES DE LA INTEGRASA (INI)
Existen cuatro INI con aprobación para su uso como TAR de inicio: RAL, elvitegravir (EVG), DTG y BIC.
Este panel recomienda de forma preferente 2 INI (BIC y DTG), como parte del TAR de inicio.
Pese a su eficacia, buena tolerabilidad, seguridad y excelente perfil de interacciones, este panel considera que RAL debe ser considerado una alternativa debido a su peor perfil de resistencias en el FV, en comparación con los INI de segunda generación (DTG, BIC) y por no poder administrarse en un comprimido único.
EVG no se incluye entre las pautas preferentes ni alternativas debido a su mayor potencial de interacciones con respecto a los otros INI no potenciados, su menor barrera genética que otros INI también administrados junto a TAF/FTC y por no tener ninguna ventaja sobre las recomendadas.
DTG se administra como un comprimido de 50 mg QD en pacientes sin TAR previo y no necesita potenciación. Se ha comparado en ensayos clínicos fase III con FAR de las tres familias que en algún momento han sido recomendados en el TAR de inicio.
El ensayo clínico aleatorizado y doble ciego SINGLE16demostró la superioridad de DTG/3TC/ABC frente a EFV/FTC/TDF a las 48 semanas, que se mantuvo en la semana 144. La proporción de FV fue similar en ambos brazos de tratamiento, pero la proporción de interrupciones por EA fue mayor en el brazo de EFV/FTC/TDF.
En el ensayo SPRING-217, aleatorizado y doble ciego, se incluyeron 822 pacientes naïve, que recibieron TAR con DTG o RAL 400 mg/12 horas, junto con dos ITIAN, demostrando la no inferioridad de DTG a las 48 semanas. No se desarrollaron MR y la tolerabilidad fue excelente en ambas ramas de tratamiento.
DTG ha demostrado eficacia superior a DRV/r, ambos en combinación con 2 ITIAN, en un ensayo clínico aleatorizado abierto (FLAMINGO)1820. Aunque no se observaron diferencias en cuanto a FV, el porcentaje de EA y discontinuaciones por causas no relacionadas con el fármaco fue mayor en los tratados con DRV/r.
Dos ensayos clínicos aleatorizados con el mismo diseño (GEMINI-1 y GEMINI-2)21, han comparado la biterapia DTG+3TC con el TAR triple DTG+TDF/FTC en un total de 1.433 PVV sin tratamiento previo y con CVP <500.000 cop/mL. DTG+3TC demostró la no inferioridad frente al tratamiento triple, manteniendo una alta eficacia a las 48 semanas (CVP <50 cop/mL 91%, análisis snapshot). La no inferioridad de DTG+3TC se mantuvo en el análisis a las 96 semanas22. En el análisis planificado de subgrupos, no se observaron diferencias en función de la CVP basal mayor o menor de 100.000 cop/mL. En cambio, los pacientes que iniciaron DTG+3TC con una cifra basal de CD4+ <200 células/µL mostraron una menor eficacia en el análisis por snapshot, aunque la causa de esta menor eficacia no se debió a un mayor porcentaje de FV, sino a discontinuaciones no relacionadas directamente con el tratamiento. Además, el número de pacientes en este subgrupo, como sucede en la mayoría de los ensayos clínicos, fue pequeño (n=65, 9%) y no permite extraer conclusiones definitivas. Recientemente se han publicado los resultados a 144 semanas23, en los que se mantenía la no inferioridad de DTG+3TC, tanto global como en el análisis pormenorizado por subgrupos. Sin embargo, seguía existiendo una menor eficacia en pacientes con una cifra basal de linfocitos CD4+ <200 células/µL (67% vs 76%).
En un metaanálisis en red de 14 ensayos clínicos aleatorizados y doble ciego con pautas de TAR de inicio se ha mostrado que la eficacia y seguridad de DTG+3TC a las 48 semanas de tratamiento es comparable a las combinaciones de TAR triples analizadas, incluso en aquellos pacientes con CVP basal >100.000 cop/mL24.
Con la información disponible actualmente, el Panel se reafirma en que se necesita disponer de mayor información sobre la eficacia de DTG+3TC en pacientes con una cifra de CD4+ <200 células/µL antes de que pueda recomendarse en este escenario clínico.
Es importante destacar que DTG presenta una barrera a las resistencias superior a RAL y EVG, siendo excepcional la selección de MR tras un FV a una pauta de TAR de inicio con DTG, tanto en asociación con 2 ITIAN como con la biterapia DTG+3TC.
BIC se encuentra disponible en coformulación con FTC y TAF en un único comprimido que se administra en una pauta una vez al día (QD) (BIC/FTC/TAF).
BIC/FTC/TAF en pacientes sin TAR previo se ha estudiado en dos ensayos clínicos fase III aleatorizados y doble ciego, ambos en comparación con DTG. En el estudio GS-US-380-148925 BIC/FTC/TAF demostró una eficacia no inferior a DTG/3TC/ABC y en el estudio GS-US-380-149026, BIC/FTC/TAF se mostró no inferior a DTG+FTC/TAF. En ambos estudios, BIC/FTC/TAF ha mantenido la no inferioridad frente a las pautas con DTG a los 4 años27. El porcentaje de discontinuaciones por EA fue bajo (2%) y similar a los grupos de tratamiento con DTG. No se observó selección de MR a los fármacos utilizados en ningún paciente, hasta los 5 años de seguimiento.
Recomendaciones
- Se recomiendan como pautas preferentes de TAR de inicio las siguientes combinaciones: BIC/FTC/TAF, DTG/ABC/3TC, DTG+FTC/TAF y DTG/3TC. (A-I)
3.1.2.3. INHIBIDORES DE LA TRANSCRIPTASA INVERSA NO NUCLEÓSIDOS (ITINN)
En España hay cinco ITINN comercializados, nevirapina (NVP), EFV, etravirina (ETR), RPV y doravirina (DOR).
Actualmente no se recomienda el uso de NVP en pautas de TAR de inicio debido a su mayor riesgo de toxicidad y a no haber demostrado la no inferioridad con respecto a EFV28.
ETR (1 comprimido de 200 mg/12 h), no está aprobada por la EMA para el TAR de inicio.
EFV ha sido comparado con INI en diversos ensayos clínicos aleatorizados de TAR de inicio que han puesto en evidencia una menor eficacia de EFV respecto a RAL (estudio STARTMRK29) y DTG (estudio SINGLE1619).
RPV se ha comparado con EFV en tres ensayos clínicos aleatorizados en pacientes sin TAR previo303132. Los estudios ECHO30 y THRIVE31 incluyeron adultos con infección por el VIH sin TAR previo y sin MR en el estudio genotípico basal. Los participantes fueron aleatorizados a recibir de forma ciega RPV o EFV junto a dos ITIAN (FTC/TDF coformulado en el estudio ECHO y una pareja de ITIAN seleccionada por los investigadores en el estudio THRIVE, que en el 60% de los casos fue también FTC/TDF). El análisis combinado de ambos estudios a las 96 semanas demostró la no inferioridad de RPV con respecto a EFV. La tolerabilidad fue mejor con RPV, con un menor número de discontinuaciones por EA y sobre todo los relacionados con el sistema nervioso central (SNC). Sin embargo, en el subgrupo de pacientes con CVP inicial >100.000 cop/mL, la frecuencia de FV fue superior con RPV (17,6 vs. 7,6%), por lo que no se recomienda el uso de RPV/FTC/TDF en estos pacientes. El FV con RPV se asoció, además, con mayor frecuencia a resistencia genotípica a otros ITINN y a ITIAN (especialmente por la selección de las mutaciones M184I y M184V)32.
En el ensayo clínico STaR33 se compararon de forma abierta las combinaciones en un comprimido único de RPV/FTC/TDF frente a EFV/FTC/TDF como pautas de TAR de inicio. Se demostró la no inferioridad de RPV/FTC/TDF frente a EFV/FTC/TDF tanto a las 48 como a las 96 semanas. En el análisis de subgrupos la eficacia de RPV/FTC/TDF fue superior a EFV/FTC/TDF en los pacientes con CVP basal igual o menor de 100.000 cop/mL, no inferior en los pacientes con CVP >100.000 cop/mL e inferior en pacientes con CVP >500.000 cop/mL. La retirada del tratamiento por EA, así como la incidencia de EA neuropsiquiátricos fue menor en los pacientes tratados con RPV en comparación con los tratados con EFV.
No existen ensayos clínicos que hayan comparado RPV con otros FAR en TAR de inicio.
La combinación RPV/FTC/TAF no ha sido evaluada de forma específica como TAR de inicio. Sin embargo, este panel considera que las ventajas en seguridad mostradas en las comparaciones directas de TAF con TDF en pacientes sin tratamiento previo12, así como en los ensayos clínicos que han comparado la eficacia y seguridad del cambio a RPV/FTC/TAF en pacientes pretratados34 son suficientes para recomendar esta combinación como alternativa a las pautas preferentes.
DOR es un ITINN que se ha estudiado como tratamiento de inicio en ensayos clínicos aleatorizados comparándose con EFV, ambos en coformulación con 3TC/TDF o con FTC/TDF, respectivamente (Estudio DRIVE-AHEAD)35, y con DRV/r, en combinación con FTC/TDF o 3TC/ABC (Estudio DRIVE-FORWARD)36. En ambos estudios, DOR ha mostrado una eficacia no inferior a sus comparadores en el análisis primario a las 48 semanas. El porcentaje de pacientes con EA sobre el SNC fue significativamente inferior en los tratados con DOR en comparación con EFV. En un análisis con 96 semanas de seguimiento ciego37, DOR ha demostrado eficacia superior a DRV/r con mejor evolución del perfil lipídico.
Hasta el momento DOR no se ha comparado con INI en ensayos clínicos.
Aunque no existe evidencia directa del uso de DOR con FTC/TAF, este Panel considera que las ventajas en seguridad mostradas en las comparaciones directas de TAF frente a TDF, junto con otros FAR, en pacientes sin tratamiento previo12 son suficientes para recomendar el uso de esta combinación como alternativa a las pautas preferentes.
Recomendaciones
- Actualmente no se considera preferente ninguna pauta basada en ITINN. (A-III)
- DOR+FTC/TAF o DOR/3TC/TDF se considera una alternativa a las pautas preferentes en el TAR de inicio. (C-I)
- En pacientes con CVP <100.000 cop/mL la combinación RPV/FTC/TAF se considera una alternativa a las pautas preferentes en el TAR de inicio. (C-I)
- RPV no debe utilizarse en pacientes con CVP >100.000 cop/mL. (A-I)
3.1.2.4. INHIBIDORES DE LA PROTEASA POTENCIADOS (IP/p)
En el TAR de inicio sólo se pueden usar IP cuando van potenciados con RTV o COBI. En la práctica clínica, el único IP/p usado hoy en día en el TAR inicial es DRV/p, por lo que en este apartado sólo nos referiremos a este fármaco.
DRV/p puede utilizarse en el TAR de inicio en dosis QD, bien en forma de un comprimido de 800 mg potenciado con 100 mg de RTV, coformulado con 150 mg de COBI (DRV/c) o en un comprimido único con FTC/TAF (DRV/c/FTC/TAF).
El estudio ARTEMIS38 comparó DRV/r (800/100 mg, QD) frente a lopinavir potenciado con ritonavir (LPV/r) en 689 pacientes que recibieron además FTC/TDF coformulados. A las 96 semanas, DRV/r resultó superior a LPV/r en el análisis con el algoritmo del tiempo hasta la pérdida de la respuesta virológica (TLOVR), aunque no en el algoritmo snapshot. Un 4% de los pacientes de la rama de DRV/r y un 9% de la rama de LPV/r abandonaron el tratamiento asignado.
DRV/r se comparó con RAL en el estudio ACTG 525739 sin objetivar diferencias en el porcentaje de FV. En el análisis snapshot y en el análisis conjunto de la respuesta virológica y tolerabilidad DRV/r fue inferior a RAL.
DRV/r también se mostró inferior a DTG en el ensayo clínico FLAMINGO18, debido fundamentalmente a una mayor tasa de EA y discontinuaciones por causas no relacionadas con el fármaco.
DRV/c se ha comparado frente a ABC/3TC/DTG en el estudio abierto SYMTRI40. Un total de 316 pacientes naïve fueron aleatorizados a DRV/c/FTC/TAF o DTG/ABC/3TC. La mayoría de los pacientes eran hombres con relaciones sexuales con hombres (HSH), con una media de linfocitos CD4+ alrededor de 400 células/µL (14% tenían un recuento de CD4+ <200 células/µL) y una mediana de CVP alrededor de 60.000 cop/mL (40% tenían CVP basal >100.000 cop/mL, sin diferencias entre los dos grupos). Tras 48 semanas, DRV/c/FTC/TAF tuvo similares resultados de eficacia que DTG/ABC/3TC,79% vs 82% en el análisis por intención de tratar (ITT), pero no alcanzó la no inferioridad (IC 95%: -11,3 a 6,6, p=0,706).
En el ensayo clínico aleatorizado y doble ciego AMBER se comparó DRV/c administrado junto con FTC/TDF o coformulado con FTC/TAF en comprimido único, en PVV sin tratamiento previoy con CD4+ >50 células/µL. La combinación DRV/c/FTC/TAF demostró una eficacia no inferior a las 48 semanas, aunque el estudio incluyó muy pocas PVV con infección en fase avanzada (sólo 6% con linfocitos CD4+ <200 células/µL).
Debido al mayor riesgo de interacciones farmacológicas y no haber demostrado la no inferioridad respecto a las combinaciones de TAR consideradas preferentes, las combinaciones con DRV/p sólo se recomiendan como alternativas en pautas de inicio.
Recomendaciones
- Actualmente no se considera preferente para TAR de inicio ninguna pauta basada en IP/p. (A-III)
- Cuando se considere conveniente iniciar un tratamiento basado en IP se recomienda utilizar DRV/c/FTC/TAF (A-I) o DRV/r+FTC/TAF (QD). (A-III)
SITUACIONES ESPECIALES
3.2.1. INFECCIÓN AGUDA POR EL VIH-1
La primoinfección incluye la infección aguda (<30 días post-infección) y la infección reciente (<180 días). Puede ser asintomática o presentar síntomas inespecíficos (fiebre, cefalea y/o malestar general) similar a una mononucleosis infecciosa u otra viriasis.4243 Las pruebas serológicas, que detectan simultáneamente anticuerpos y antígeno p24 del VIH-1, se positivizan 2 a 3 semanas post-infección. En caso de estar disponible, una detección del ARN del VIH-1 será positiva a partir de 7-10 días. El TAR durante la primoinfección acorta la duración y gravedad de los síntomas, reduce la diversidad viral y el reservorio, mejora la reconstitución inmunológica y reduce la transmisión. Una vez iniciado el TAR durante la primoinfección, no se recomienda su interrupción, ya que ninguna estrategia evaluada (tratamiento intermitente, vacunas terapéuticas o imunomoduladores adyuvantes) ha permitido evitar el rebote viral en la gran mayoría de pacientes44. Se debe valorar la inclusión de personas con primoinfección, en especial los más precoces, en ensayos clínicos de erradicación o cura funcional.
Recomendaciones
- El TAR debe iniciarse tan pronto como sea posible en toda infección aguda, independientemente de los síntomas, gravedad y duración (A-II), y no debe interrumpirse.
- El tipo de TAR será el mismo que en la infección crónica, basado en un INI de alta barrera genética (DTG o BIC). (A-I)
- TDF o TAF/FTC serán los ITIAN recomendados si no se cuenta con serología de VHB y HLA-B*5701. (A-I)
3.2.2. INFECCIÓN POR EL VIH EN SUJETO EN PROFILAXIS PRE-EXPOSICION
Las personas en PrEP, aunque infrecuentemente, pueden presentar una infección por el VIH y tener riesgo de emergencia de resistencias al estar sometidas a la presión del TAR (actualmente TDF/FTC) especialmente en los casos que inician la PrEP con una infección aguda por VIH no diagnosticada45. La infección primaria por VIH en este escenario se caracteriza por menor pico de CVP y prolongación de las etapas de seroconversión lo que pueden provocar resultados ambiguos en las pruebas serológicas retrasando el diagnóstico4647. Por ello se aconseja el uso de la CVP junto con las pruebas serológicas, a ser posible ELISA de 4ª generación (Ag/Ac)48. En caso de dudas se deben realizar las pruebas en una nueva muestra y confirmar la infección por el VIH antes de iniciar el TAR. El estudio de resistencias es obligado48.
Recomendaciones
- Verificar correctamente el diagnóstico de infección por el VIH. (A-III)
- Realizar un test genotípico antes de iniciar el TAR. (A-II)
- Iniciar el TAR siempre con triple terapia con fármacos de alta barrera a la resistencia (TAF/FTC +DTG o BIC o DRV/c) en espera del test genotípico. (A-III)
3.2.3. PACIENTE CON EVENTO OPORTUNISTA
Los pacientes con infección oportunista (IO) al diagnóstico deben iniciar TAR lo antes posible. El ensayo clínico aleatorizado ACTG A5164 (n=282, excluida TB), demostró una menor tasa de progresión a SIDA o muerte en pacientes que iniciaban TAR dentro de una mediana de 12 días tras el inicio del tratamiento de la IO frente a demorarlo hasta una mediana de 45 días. No se observaron diferencias en EA ni en la incidencia de síndrome inflamatorio de reconstitución inmune (SIRI), la cual no se asoció con el uso o no de esteroides para el tratamiento de la IO49.
En la meningitis criptocócica, en una revisión sistemática que incluye 4 estudios (n=294 pacientes), el riesgo de muerte se incrementaba en un 42% cuando se iniciaba el TAR de forma precoz (< 4 semanas desde el inicio del tratamiento antifúngico) vs tardía (> 4 semanas desde el inicio del tratamiento antifúngico), especialmente en pacientes con menos de 5 células/μL en el LCR o incremento de la presión intracraneal, y no parecía estar claramente relacionado con el SIRI50. La mortalidad aumenta con el uso de esteroides y se reduce con la realización de punciones lumbares descompresoras.
En caso de coincidir dos o más IO simultáneamente, sólo la presencia de meningitis criptocócica o tuberculosa justifica aplazar el inicio del TAR. En este sentido, se recomienda consultar el “Documento de prevención y tratamiento de infecciones oportunistas y otras coinfecciones en pacientes con infección por el VIH” recientemente actualizado51.
A pesar de que no existen ensayos cínicos que comparen pautas de TAR preferentes actuales en pacientes con IO, la elección del régimen antirretroviral puede ser similar que en sujetos sin IO, teniendo en cuenta potenciales interacciones farmacológicas.
Recomendaciones
- Sin considerar la TB y la meningitis criptocócica, en la mayoría de las IO se debe iniciar el TAR lo antes posible (dos primeras semanas tras el inicio del tratamiento de la IO). (A-II)
- En pacientes con neumonía por Pneumocystis jirovecii (NPJ) que no reciben TAR, éste se debería comenzar en las dos primeras semanas tras el diagnóstico de la NPJ. (A-I)
- En pacientes con meningitis criptocócica se recomienda diferir el inicio del TAR 4-6 semanas. (A-I)
- Sin considerar la TB, la pauta de tratamiento antirretroviral inicial empleada en pacientes con IO no tiene por qué diferir de los sujetos sin IO. (A-III)
Tablas:

Bibliografía:
Lundgren JD, Babiker AG, Gordin F, et al. Initiation of antiretroviral therapy in early asymptomatic HIV infection. N Engl J Med 2015; 373:795-807.
https://www.nejm.org/doi/10.1056/NEJMoa1506816
Danel C, Moh R, Gabillard D, et al. A trial of early antiretrovirals and isoniazid preventive therapy in Africa. N Engl J Med 2015; 373:808-22.
https://www.nejm.org/doi/10.1056/NEJMoa1507198
Cohen MS, Chen YQ, McCauley M, et al. Antiretroviral therapy for the prevention of HIV-1 transmission. N Engl J Med 2016; 375:830-9.
https://www.nejm.org/doi/10.1056/NEJMoa1600693
Ford N, Migone C, Calmy A, et al. Benefits and risks of rapid initiation of antiretroviral therapy. AIDS 2018; 32:17-23.
Girometti N, Nwokolo N, McOwan A, Whitlock G. Outcomes of acutely HIV-1- infected individuals following rapid antiretroviral therapy initiation. Antivir Ther 2017; 22:77-80.
Hoenigl M, Chaillon A, Moore DJ, et al. Rapid HIV viral load suppression in those initiating antiretroviral therapy at first visit after HIV diagnosis. Sci Rep 2016; 6: 32947.
Pilcher CD, Ospina-Norvell C, Dasgupta A, et al. The effect of same-day observed initiation of antiretroviral therapy on HIV viral load and treatment outcomes in a US Public Health Setting. J Acquir Immune Defic Syndr 2017; 74:44-51.
Huhn GD, Crofoot G, Ramgopal M, et al. Darunavir/Cobicistat/Emtricitabine/Tenofovir Alafenamide in a rapid-initiation model of care for human immunodeficiency virus type 1 infection: primary analysis of the DIAMOND Study. Clin Infect Dis 2020; 71:3110-7.
https://academic.oup.com/cid/article/71/12/3110/5687816?login=false
Rolle Ch-P, Berhe M, Singh T, et al. Dolutegravir/lamivudine as a first-line regimen in a test-and-treat setting for newly diagnosed people living with HIV. AIDS 2021; 35:1957-65.
Rolle Ch-P, Berhe M, Singh T, et al. Feasibility, efficacy and safety of Dolutegravir/lamivudine (DTG/3TC) as a first-line regimen in a test-and-treat setting for newly diagnosed people living with HIV (PLWH): 48-week results of STAT study. 11th IAS Conference on HIV Science; July 18-21, 2021; Virtual.
Bachelard A, Isernia V, Vallois D, et al. Efficacy and tolerability of combined antiretroviral treatment with bictegravir/emtrcitabine/tenofovir alafenamide initiated at the time of primary HIV infection. J Antimicrob Chemother 2021; 76:2484-5.
https://academic.oup.com/jac/article/76/9/2484/6295675?login=false
Gallant J, Lazzarin A, Mills A, et al. Bictegravir, emtricitabine, and tenofovir alafenamide versus dolutegravir, abacavir, and lamivudine for initial treatment of HIV-1 infection (GS-US-380-1489): a double-blind, multicentre, phase 3, randomised controlled non-inferiority trial. Lancet 2017; 390:2063-72.
https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(17)32299-7/fulltext
Sax PE, Tierney C, Collier AC, et al. Abacavir-lamivudine versus tenofovir-emtricitabine for initial HIV-1 therapy. N Engl J Med 2009; 361:2230-40.
Sax PE, Tierney C, Collier AC, et al. Abacavir/lamivudine versus tenofovir DF/emtricitabine as part of combination regimens for initial treatment of HIV: final results. J Infect Dis 2011; 204:1191-201.
https://academic.oup.com/jid/article/204/8/1191/815453?login=false
Daar ES, Tierney C, Fischl MA, et al. Atazanavir plus ritonavir or efavirenz as part of a 3-drug regimen for initial treatment of HIV-1. Ann Intern Med 2011; 154:445-56.
https://www.acpjournals.org/doi/10.7326/0003-4819-154-7-201104050-00316
Walmsley SL, Antela A, Clumeck N, et al. Dolutegravir plus abacavir-lamivudine for the treatment of HIV-1 infection. N Engl J Med 2013; 369:1807-18.
Raffi F, Rachlis A, Stellbrink HJ, et al. Once-daily dolutegravir versus raltegravir in antiretroviral-naive adults with HIV-1 infection: 48 week results from the randomised, double-blind, non-inferiority SPRING-2 study. Lancet 2013; 381:735-43.
https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(12)61853-4/fulltext
Clotet B, Feinberg J, van Lunzen J, et al. Once-daily dolutegravir versus darunavir plus ritonavir in antiretroviral-naive adults with HIV-1 infection (FLAMINGO): 48 week results from the randomised open-label phase 3b study. Lancet 2014; 383:2222-31.
https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(14)60084-2/fulltext
Walmsley S, Baumgarten A, Berenguer J, et al. Dolutegravir plus abacavir/lamivudine for the treatment of HIV-1 infection in antiretroviral therapy-naive patients: week 96 and week 144 results from the SINGLE randomized clinical trial. J Acquir Immune Defic Syndr 2015; 70:515-9.
https://journals.lww.com/jaids/Fulltext/2015/12150/Brief_Report__Dolutegravir_Plus.8.aspx
Molina JM, Clotet B, van Lunzen J, et al. Once-daily dolutegravir versus darunavir plus ritonavir for treatment-naive adults with HIV-1 infection (FLAMINGO): 96 week results from a randomised, open- label, phase 3b study. Lancet HIV 2015; 2:e127-36.
https://www.thelancet.com/journals/lanhiv/article/PIIS2352-3018(15)00027-2/fulltext
Cahn P, Sierra Madero J, Arribas JR, et al. Dolutegravir plus lamivudine versus dolutegravir plus tenofovir disoproxil fumarate and emtricitabine in antiretroviral-naive adults with HIV-1 infection (GEMINI-1 and GEMINI-2): week 48 results from two multicentre, double-blind, randomised, non-inferiority, phase 3 trials. Lancet 2019; 393:143-55.
https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(18)32462-0/fulltext
Cahn P, Sierra Madero J, Arribas J, et al. Durable efficacy of dolutegravir (DTG) plus lamivudine (3TC) in antiretroviral treatment-naive adults with HIV-1 infection--96-week results from the GEMINI studies. 10th IAS Conference on HIV Science (IAS 2019), July 21-24, 2019, Mexico City. Abstract WEAB0404LB.
Cahn P, Sierra Madero J, Arribas JR, et al. Three-year durable efficacy of dolutegravir plus lamivudine in antiretroviral therapy-naïve adults with HIV-1 infection. AIDS 2022; 36:39-48.
Radford M, Parks DC, Ferrante S, Punekar Y. Comparative efficacy and safety and dolutegravir and lamivudine in treatment naive HIV patients. AIDS 2019; 33:1739-49.
Gallant L, Lazzarin A, Mills A, et al. Bictegravir, emtricitabine, and tenofovir alafenamide versus dolutegravir, abacavir, and lamivudine for initial treatment of HIV-1 infection (GS-US-380-1489): a double-blind, multicentre, phase 3, randomised controlled non-inferiority trial. Lancet 2017; 390:2063-72.
https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(17)32299-7/fulltext
Sax PE, Pozniak A, Montes ML, et al. Coformulated bictegravir, emtricitabine, and tenofovir alafenamide versus dolutegravir with emtricitabine and tenofovir alafenamide, for initial treatment of HIV-1 infection (GS-US-380-1490): a randomised, double-blind, multicentre, phase 3, non-inferiority trial. Lancet 2017; 390:2073-82.
https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(17)32340-1/fulltext
Workowski K, Orkin C, Sax P, et al. Four-year outcomes of B/F/TAF in treatment-naïve adults. HIV Med2021; 22(Suppl 2):32‐3.
Van Leth F, Phanuphak P, Stroes E, et al. Nevirapine and efavirenz elicit different changes in lipid profiles in antiretroviral-therapy-naive patients infected with HIV-1. PLoS Medicine 2004; 1:e19.
https://journals.plos.org/plosmedicine/article?id=10.1371/journal.pmed.0010019
Rockstroh JK, DeJesus E, Lennox JL, et al. Durable efficacy and safety of raltegravir versus efavirenz when combined with tenofovir/emtricitabine in treatment-naive HIV-1-infected patients: final 5-year results from STARTMRK. J Acquir Immune Defic Syndr 2013; 63:77-85.
Molina JM, Cahn P, Grinsztejn B, et al. Rilpivirine versus efavirenz with tenofovir and emtricitabine in treatment-naive adults infected with HIV-1 (ECHO): a phase 3 randomised double-blind active-controlled trial. Lancet 2011; 378:238-46.
https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(11)60936-7/fulltext
Cohen CJ, Andrade-Villanueva J, Clotet B, et al. Rilpivirine versus efavirenz with two background nucleoside or nucleotide reverse transcriptase inhibitors in treatment-naive adults infected with HIV-1 (THRIVE): a phase 3, randomised, non-inferiority trial. Lancet 2011; 378:229-37.
https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(11)60983-5/fulltext
Nelson MR, Elion RA, Cohen CJ, et al. Rilpivirine versus efavirenz in HIV-1-infected subjects receiving emtricitabine/tenofovir DF: pooled 96-week data from ECHO and THRIVE Studies. HIV Clin Trials 2013; 14:81-91.
https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(11)60983-5/fulltext
Cohen C, Wohl D, Arribas JR, et al. Week 48 results from a randomized clinical trial of rilpivirine/ emtricitabine/tenofovir disoproxil fumarate vs. efavirenz/emtricitabine/tenofovir disoproxil fumarate in treatment-naive HIV-1-infected adults. AIDS 2014; 28:989-97.
Hagins D, Orkin C, Daar ES, et al. Switching to coformulated rilpivirine (RPV), emtricitabine (FTC) and tenofovir alafenamide from either RPV,FTC and tenofovir disoproxil fumarate (TDF) or efavirenz, FTC and TDF: 96-week results from two randomized clinical trials. HIV Med 2018; 19:724-33.
Orkin C, Squires KE, Molina JM, et al. Doravirine/Lamivudine/Tenofovir Disoproxil Fumarate is Non- inferior to Efavirenz/Emtricitabine/ Tenofovir Disoproxil Fumarate in Treatment-naive Adults With Human Immunodeficiency Virus-1 Infection: Week 48 Results of the DRIVE-AHEAD Trial. Clin Infect Dis 2019; 68:535-44.
https://academic.oup.com/cid/article/68/4/535/5088828?login=false
Molina JM, Squires K, Sax PE, et al. Doravirine versus ritonavir-boosted darunavir in antiretroviral-naive adults with HIV-1 (DRIVE-FORWARD): 48-week results of a randomised, double-blind, phase 3, non- inferiority trial. Lancet HIV 2018; 5:e211-e220.
https://www.thelancet.com/journals/lanhiv/article/PIIS2352-3018(18)30021-3/fulltext
Molina JM, Squires K, Sax PE, et al. Doravirine versus ritonavir-boosted darunavir in antirretroviral-naive adults with HIV-1 (DRIVE-FORWARD): 96-week results of a randomized, double-blind, non-inferiority, phase 3 trial. Lancet HIV 2020; 7:e16-e26.
https://onlinelibrary.wiley.com/doi/10.1111/j.1468-1293.2012.01060.x
Orkin C, DeJesus E, Khanlou H, et al. Final 192-week efficacy and safety of once-daily darunavir/ ritonavir compared with lopinavir/ritonavir in HIV-1-infected treatment-naive patients in the ARTEMIS trial. HIV Med 2013; 14:49-59.
https://onlinelibrary.wiley.com/doi/10.1111/j.1468-1293.2012.01060.x
Lennox JL, Landovitz RJ, Ribaudo HJ, et al. Efficacy and tolerability of 3 nonnucleoside reverse transcriptase inhibitor-sparing antiretroviral regimens for treatment-naive volunteers infected with HIV- 1: A randomized, controlled equivalence trial. Ann Intern Med 2014; 161:461-71.
Podzamczer D, Micán R, Tiraboschi J, et al. Darunavir/Cobicistat/Emtricitabine/Tenofovir Alafenamide versus Dolutegravir/AbacaCVPir/Lamivudine in antiretroviral-naive adults (SYMTRI): a multicenter randomized open-label study (PReEC/RIS-57). Open Forum Infect Dis 2022 Mar; 9(3): ofab595. Publicado online 25 de noviembre de 2021 https://doi.org/10.1093/ofid/ofab595.
Eron JJ, Orkin C, Gallant J, et al. A week-48 randomized phase-3 trial of darunavir/cobicistat/ emtricitabine/tenofovir alafenamide in treatment-naive HIV-1 patients. AIDS 2018; 32:1431-42.
https://academic.oup.com/ofid/article/9/3/ofab595/6439785?login=false
Henn A, Flateau C, Gallien S. Primary HIV infection: clinical presentation, testing, and treatment. Curr Infect Dis Rep 2017; 19:37.
Robb ML, Eller LA, Kibuuka H, et al. Prospective study of acute HIV-1 infection in adults in east Africa and Thailand. N Engl J Med 2016; 374:2120-30.
Colby DJ, Trautmann L, Pinyakorn S, et al. Rapid HIV RNA rebound after antiretroviral treatment interruption in persons durably supressed in Fiebig I acute HIV infection. Nat Med 2018; 24:923-6.
Gibas KM, van den Berg P, Powell VE, Krakower DS. Drug resistance during HIV pre-exposure prophylaxis. Drugs 2019; 79:609-19.
https://link.springer.com/article/10.1007/s40265-019-01108-x
Ambrosioni J, Petit E, Liegeon G, Laguno M, Miró JM. Primary HIV-1 infection in users of pre-exposure prophylaxis. Lancet HIV 2021; 8:e166-e174.
https://www.thelancet.com/journals/lanhiv/article/PIIS2352-3018(20)30271-X/fulltext
Donnell D, Ramos E, Celum C, et al. Partners PrEP Study Team. The effect of oral preexposure prophylaxis on the progression of HIV-1 seroconversion. AIDS 2017 10;31: 2007-16.
Smith DK, Switzer WM, Peters P, et al. A Strategy for PrEP Clinicians to Manage Ambiguous HIV Test Results During Follow-up Visits. Open Forum Infect Dis 2018; 5:ofy180.
https://academic.oup.com/ofid/article/5/8/ofy180/5056925?login=false
Zolopa A, Andersen J, Powderly W, et al. Early antiretroviral therapy reduces AIDS progression/death in individuals with acute opportunistic infections: a multicenter randomized strategy trial. PLoS One 2009; 4:e5575.
https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0005575
Eshun-Wilson I, Okwen MP, Richardson M, Bicanic T. Early versus delayed antiretroviral treatment in HIV-positive people with cryptococcal meningitis. Cochrane Database Syst Rev 2018; 7:CD009012.
Documento de Prevención y Tratamiento de infecciones oportunistas y otras coinfecciones en pacientes con infección por VIH (Actualización 2021). https://gesida-seimc.org/category/guias-clinicas/otras-guias-vigentes/
4. CAMBIO DEL TAR EN PACIENTES CON REPLICACIÓN VIRAL SUPRIMIDA
CONSIDERACIONES GENERALES
En la Tabla 2 se resumen las recomendaciones sobre modificaciones del TAR en pacientes con CVP suprimida.
Las causas más comunes para el cambio de un TAR eficaz son la simplificación del tratamiento, la prevención y el control de toxicidades o comorbilidades, el ajuste por interacciones medicamentosas así como la conveniencia y calidad de vida del paciente.
En pacientes coinfectados por VIH/VHB no se han establecido criterios de interrupción del tratamiento frente al VHB y pueden producirse rebrotes virales del VHB que pueden ser graves al suspender el tratamiento1.
Recomendaciones
- Antes del cambio debe revisarse la historia previa de TAR, qué cambios ha habido previamente y sus motivos (intolerancia, toxicidad o fracaso virológico), además de los resultados de las pruebas de resistencia, por si influyeran en la selección de los nuevos fármacos. (A-III)
- Los pacientes con infección crónica por VHB deberán mantener un tratamiento con antivirales eficaces frente al VHB en caso de cambios en el TAR. (AII)
- Tras el cambio de un TAR es recomendable evaluar en un plazo de 4 semanas, antes de volver al régimen de visitas habituales, el mantenimiento de la supresión virológica, la tolerancia a la nueva pauta y en su caso la desaparición de toxicidades previas mediante evolución clínica o pruebas complementarias. (B-III)
MOTIVOS DE CAMBIO Y PAUTAS RECOMENDADAS
4.2.1 Simplificación
Se considera simplificación del TAR la reducción del número de dosis diarias, de comprimidos o de fármacos, el ajuste de requerimientos de toma con o sin alimentos o el cambio a una pauta que requiera menor necesidad de controles. La simplificación del TAR tiene como objetivo mejorar la adherencia, la comodidad de la toma y la calidad de vida, manteniendo la eficacia. La simplificación puede suponer una reducción del coste del TAR.
Los escenarios de simplificación incluyen cambios de fármacos dentro de una misma clase de ARV, cambio de un fármaco por otro de diferente clase o cambios a pautas con solo dos fármacos.
En pacientes en TAR sin historia de FV o evidencia de MR el número de pautas para el cambio son muy variadas, pudiendo utilizarse tanto aquellas que han demostrado su eficacia en pacientes naïve como las estudiadas específicamente en el escenario de cambio de tratamiento. La disponibilidad de combinaciones de 2 ITIAN + INI en formulaciones de un solo comprimido diario y sin potenciadores son una opción segura y eficaz en un gran número de casos. Permiten la simplificación tanto desde otras pautas con INI como desde regímenes basados en ITINN o IP/p2,3. Las pautas de TAR duales con DTG/3TC o DTG/RPV son asimismo opciones de simplificación de primera línea en PVV tratadas con IP/p, ITINN o INI + 2 ITIAN, sin historia de FV previo ni evidencia o sospecha de resistencia a los fármacos de la pauta o presencia de infección activa por VHB4-6. Otras opciones que también han demostrado ser útiles en simplificación son las combinaciones en comprimido único basadas en ITINN o IP/p7-9. La combinación de DRV/p+3TC es también una posible opción de simplificación en PVV tratadas con combinaciones triples basadas en IP/p o ITINN10. Otra alternativa en simplificación consistiría en la administración de un TAR dual de cabotegravir (CAB)+RPV por vía intramuscular (IM) cada 8 semanas11.
En los pacientes con MR a ITIAN previas se ha comprobado que los cambios a BIC/FTC/TAF, DTG+FTC/TAF o DTG/3TC/ABC pueden mantener la eficacia virológica, especialmente en PVV con CVP suprimida previa al cambio durante más de seis meses12,13. Las combinaciones de TAF/FTC/DRV/c + DTG o TAF/FTC/BIC + DRV/c 14, con las que la información existente es muy limitada, o la pauta de dos fármacos DTG + DRV/p15, son opciones de simplificación de pautas más complejas en PPV con antecedentes de FV y selección de MR, siempre que se mantenga preservada la actividad de DRV y los INI.
Recomendaciones:
- En pacientes sin MR y/o FV previos se recomienda, al igual que en pacientes naïve, utilizar las pautas más simples, eficaces y convenientes para el paciente. Las simplificaciones a BIC/FTC/TAF, DTG/3TC/ABC, DTG/3TC, DTG/RPV o DRV/p+3TC son seguras y eficaces. (A-I)
- En los pacientes con MR a ITIAN previas no se recomienda el cambio a pautas con un tercer fármaco de baja barrera genética como un ITINN o RAL. (A-I)
- En los pacientes con MR a ITIAN previas se puede considerar la simplificación a BIC/FTC/TAF, DTG/3TC/ABC o DTG+FTC/TAF, individualizando según fracasos previos y MR y asegurando que la nueva pauta contiene al menos 2 fármacos activos. (B-I)
- En pacientes con pautas complejas debido a fracasos previos, con actividad preservada a DRV, DTG y/o BIC, se puede simplificar a pautas basadas en estos fármacos. (A-I)
4.2.2 Prevención de toxicidades
A pesar del excelente perfil de seguridad y tolerancia de los nuevos ARVs, sigue habiendo EA potenciales (inmediatos o tardíos) que pueden anticiparse en función de las condiciones del paciente (comorbilidades o hábitos de vida) y de los propios ARVs. A la hora de plantear un cambio preventivo del TAR en una persona con la CVP suprimida Tabla 3, se deben tener en cuenta el nivel de la evidencia, el historial de tratamiento, las características individuales de la persona, así como sus comorbilidades, considerando el mayor o menor riesgo de toxicidades y teniendo en cuenta los aspectos descritos en el apartado 4.2.3. Hay evidencia contrastada en la mejora de parámetros óseos y renales de pacientes que cambian de TDF a TAF o ABC8,16, de mejora en el perfil lipídico y en la resolución de eventos neuropsiquiátricos en pacientes que cambian de EFV a RPV17 o DOR18 y de la dislipidemia asociada a IP/p que cambian a RPV, DOR, RAL, DTG o BIC2,18-21. En relación con las terapias duales, el cambio a DTG/RPV desde pautas basadas en IP/p, ITINN o INI + 2 ITIAN que incluían TDF ha demostrado mejor evolución de parámetros de metabolismo óseo y de la densidad mineral ósea (DMO)9 y el cambio a DTG/3TC desde terapias que incluían TAF ha demostrado mejor evolución de parámetros del perfil lipídico, sobre todo en pacientes procedentes de pautas potenciadas22.
4.2.3 Gestión de las toxicidades activas
El cambio de TAR debido a toxicidad es un cambio reactivo, generalmente obligado y, en consecuencia, se espera una mejoría o desaparición de dicha toxicidad en la medida en que está sea reversible.
Las toxicidades pueden ser sintomáticas y asociarse con un sobreesfuerzo del paciente para mantener la adherencia (por ej. los EA del SNC) o pueden ser asintomáticas y asociarse con una adherencia excelente a fármacos tóxicos (por ej. las toxicidades renales).
Recomendaciones
- No se debe asumir que un TAR no causa efectos secundarios solamente porque la CV esté suprimida y es necesario su evaluación en todas las visitas. (A-III)
- Se debe individualizar el cambio de TAR por toxicidad teniendo en cuenta la gravedad del efecto adverso (leve vs grave, subclínico vs clínico), su riesgo de empeoramiento si continúa el fármaco o régimen (toxicidad acumulativa vs transitoria), su repercusión en la calidad de vida del paciente (aún con efectos secundarios leves), las alternativas terapéuticas que permitan mantener la eficacia y la existencia de información sobre dicho escenario de cambio. (A-III)
- Previo al cambio de TAR debido a toxicidad o prevención de ésta se debe valorar siempre si los nuevos fármacos o familias pueden compartir efectos secundarios y asegurar que se mantendrá la eficacia virológica. (A-III)
4.2.4 Gestión de las interacciones
La mayoría de los ARVs utilizados en la actualidad, especialmente los INI y el ITINN DOR, tienen un riesgo muy bajo de interacciones medicamentosas. No obstante, éstas pueden constituir un problema en la práctica clínica como consecuencia del incremento de la polifarmacia, asociada a las crecientes comorbilidades en una población con VIH progresivamente más envejecida o el consumo de drogas de recreo.
Recomendaciones
- En general se desaconseja el uso de ARVs potenciados por su mayor riesgo de interacciones. (B-III)
- Cuando se cambie el TAR es recomendable comprobar el perfil de interacciones utilizando herramientas al uso que se actualizan frecuentemente. (A-III). Consultar capítulo 6.5.
4.2.5 Deseo gestacional o embarazo en curso
En el capítulo 6.1 se recogen las pautas de TAR recomendadas en la persona con deseo gestacional o embarazo en curso y se revisan los cambios recomendados cuando ya recibe tratamiento. Los principales motivos para realizar un cambio de TAR en este contexto son: evitar fármacos o combinaciones con falta de información sobre eficacia y seguridad durante el embarazo o evitar fármacos que pueden presentar niveles plasmáticos insuficientes durante el segundo y tercer trimestre del mismo.
Los cambios proactivos en la PVV con deseo gestacional permiten valorar la tolerancia y eficacia de la nueva pauta de forma anticipada, asegurando la conveniencia del TAR que se mantendrá durante la gestación. En la Tabla 3 se presentan las principales recomendaciones de cambios en este contexto. Para mayor detalle, se recomienda consultar las guías específicas sobre embarazo y transmisión vertical.
Recomendaciones
- En PVV en TAR con deseo gestacional o embarazadas, debe revisarse el tratamiento para valorar la necesidad de cambiarlo a pautas recomendadas o consideradas más seguras durante el embarazo, y la necesidad de ajustar la dosificación, asegurando siempre la eficacia virológica de la nueva pauta. (A-III)
4.2.6 Cambio de vía de administración y dosificación de acción prolongada
En la actualidad ya es posible administrar en la práctica clínica el TAR en una formulación de acción prolongada (CAB+RPV) por vía IM cada 8 semanas/2 meses. Esta nueva estrategia se ha mostrado eficaz como simplificación en pacientes con TAR estable, sin FV previos ni resistencias a INI o ITINN, sin infección activa por VHB y al menos con 6 meses de CVP indetectable11. El TAR con CAB+RPV IM presenta algunas ventajas, como una menor frecuencia de dosis, eludir toxicidad gastrointestinal, evitar limitaciones del uso de la RPV por vía oral (como la necesidad de toma con alimentos y permitir el uso de inhibidores de la bomba de protones), la reducción de la percepción del estigma por el paciente o la reducción de la preocupación por la menor confidencialidad sobre el estatus de la infección por VIH que ofrece el tratamiento oral. Esta pauta además de los beneficios mencionados, es importante para aquellos pacientes que quieren cambiar la vía de administración. Podría considerarse una opción para reducir el número de fármacos y de comprimidos, mejorar la adherencia y la tolerabilidad que amplía los escenarios de simplificación frente a sólo un cambio en la vía de administración. El principal inconveniente de esta pauta son las reacciones en el lugar de inyección que, sin embargo, causan el abandono del TAR en menos del 2% de los pacientes y no influyen en la preferencia de la mayoría de los pacientes de la pauta parenteral sobre la oral23. El uso de una fase inicial de CAB y RPV por vía oral durante un mes no es imprescindible; se puede optar por utilizar los comprimidos como inducción oral o bien administrar directamente las inyecciones. El riesgo de desarrollar MR al fracaso es muy bajo, pero mayor que con pautas orales basadas en INI de segunda generación como DTG o BIC, habiéndose descrito algunos casos en pacientes con adherencia completa al TAR. Si se plantea un cambio a un TAR con CAB+RPV IM, hay que tener en cuenta las siguientes consideraciones:
• Existe un mayor riesgo de FV cuando existen resistencias a RPV archivadas en el ADN proviral, en infecciones por subtipos A6/A1 del VIH-1 y en pacientes con un IMC ≥30Kg/m2. Es necesario que coexistan al menos dos factores para que la proporción de fracaso sea significativamente superior a la de pacientes sin ninguno de ellos (0,4%): con 1 factor 2.0% y con 2 factores 19.3%.24
• Los niveles valle bajos (inferior al primer cuartil) de RPV y/o CAB en la semana 8 se han asociado a FV y pueden estar en relación con un IMC >30 Kg/m2.24
• El paciente debe comprometerse con la administración del fármaco cada 8 semanas/2 meses.
• No existen estudios que permitan definir cuál es la mejor estrategia de monitorización de la CVP del VIH en pacientes que cambian a CAB+RPV IM y si ésta debe ser diferente a la de los cambios a pautas orales en pacientes con replicación viral suprimida.
Recomendaciones
- En pacientes con criterios adecuados en los que se considere ventajoso una administración IM con formulación de acción prolongada es recomendable el tratamiento con CAB+RPV IM cada 8 semanas/2 meses. (A-I)
- En pacientes con evidencia de mutaciones previas a RPV o FV con una pauta basada en no análogos (factor 1) y/o subtipo A1/A6 del VIH-1 (factor 2) y/o IMC >30 kg/m2 o documentación de niveles valle bajos de CAB o RPV tras su administración (factor 3) se debe evitar el uso de CAB+RPV IM en general (B-I) y especialmente si concurren dos de estos factores (A-I).
- Si se interrumpe el TAR con CAB+RPV IM de administración bimestral es imprescindible iniciar una pauta oral de TAR supresora a las 8 semanas de la última inyección IM. (A-I)
- En general, las determinaciones de CVP tras el cambio de TAR se harán como en el caso de cambio a pautas orales, con una primera determinación precoz (a las 4 semanas del cambio) para continuar con el esquema habitual (B-III). Durante el primer año después del cambio pueden valorarse controles más frecuentes de forma individualizada coincidiendo con la administración de las dosis IM. (C-I)
Tablas:
Bibliografía:
Guía GESIDA/GEHEP del manejo de la enfermedad hepática en el paciente VIH. https://gesida-seimc.org/wp-content/uploads/2022/11/DocumentoDeConsensoGESIDA-GEHEPSobreElManejoDeLaEnfermedadHepaticaEnElPacienteVIH.pdf
Daar ES, DeJesus E, Ruane P et al. Efficacy and safety of switching to fixed-dose bictegravir, emtricitabine, and tenofovir alafenamide from boosted protease inhibitor-based regimens in virologically suppressed adults with HIV-1: 48 week results of a randomised, open-label, multicentre, phase 3, non-inferiority trial. Lancet HIV 2018;5: e347-e356.
https://www.thelancet.com/journals/lanhiv/article/PIIS2352-3018(18)30091-2/fulltext
Trottier B, Lake JE, Logue K, et al. Dolutegravir/abacavir/lamivudine versus current ART in virally suppressed patients (STRIIVING): a 48-week, randomized, non-inferiority, open-label, Phase IIIb study. Antivir Ther 2017; 22:295-305.
Osiyemi O, De Wit S, Ajana F, et al. Efficacy and safety of switching to Dolutegravir/Lamivudine (DTG/3TC) versus continuing a Tenofovir Alafenamide-based 3- or 4-drug regimen for maintenance of virologic suppression in adults living with HIV-1: results through week 144 from the Phase 3, Non-inferiority TANGO Randomized Trial. Clin Infect Dis 2022; 75: 975-86.
https://academic.oup.com/cid/article/75/6/975/6515475?login=false
Llibre JM, Brites C, Cheng CY, et al. Efficacy and safety of switching to the 2-drug regimen Dolutegravir/Lamivudine versus continuing a 3- or 4-drug regimen for maintaining virologic suppression in adults living with HIV-1: week 48 results from the Phase 3, Non-inferiority SALSA Randomized Trial. Clin Infect Dis 2022: ciac130. doi: 10.1093/cid/ciac130. Epub ahead of print.
https://academic.oup.com/cid/article/76/4/720/6541246?login=false
Aboud M, Orkin C, Podzamczer D, et al. Efficacy and safety of dolutegravir-rilpivirine for maintenance of virological suppression in adults with HIV-1: 100-week data from the randomised, open-label, phase 3 SWORD-1 and SWORD-2 studies. Lancet HIV 2019; 6:e576–e587.
https://www.thelancet.com/journals/lanhiv/article/PIIS2352-3018(19)30149-3/fulltext
Eron JJ, Orkin C, Cunningham D, et al; EMERALD study group. Week 96 efficacy and safety results of the phase 3, randomized EMERALD trial to evaluate switching from boosted-protease inhibitors plus emtricitabine/tenofovir disoproxil fumarate regimens to the once daily, single-tablet regimen of darunavir/cobicistat/emtricitabine/ tenofovir alafenamide (D/C/F/TAF) in treatment-experienced, virologically-suppressed adults living with HIV-1. Antiviral Res 2019;170. https://pubmed.ncbi.nlm.nih.gov/31279073/
https://www.sciencedirect.com/science/article/pii/S0166354219302475?via%3Dihub
Gallant JE, Daar ES, Raff F, et al. Effcacy and safety of tenofovir alafenamide versus tenofovir disoproxil fumarate given as fixed-dose combinations containing emtricitabine as backbones for treatment of HIV- 1 infection in virologically suppressed adults: a randomised, double-blind, active-controlled phase 3 trial. Lancet HIV 2016; 3:e158-65.
https://www.thelancet.com/journals/lanhiv/article/PIIS2352-3018(16)00024-2/fulltext
Johnson M, Kumar P, Molina JM, et al. Switching to Doravirine/Lamivudine/Tenofovir Disoproxil Fumarate (DOR/3TC/TDF) maintains HIV-1 virologic suppression through 48 Weeks: Results of the DRIVE-SHIFT Trial. J Acquir Immune Defc Syndr 2019; 81:463-72.
Perez-Molina JA, Pulido F, Di Giambenedetto S, et al. Individual patient data meta-analysis of randomized controlled trials of dual therapy with a boosted PI plus lamivudine for maintenance of virological suppression: GeSIDA study 9717. J Antimicrob Chemother 2018;73:2927-35.
https://academic.oup.com/jac/article/73/11/2927/5066381?login=false
Overton ET, Richmond G, Rizzardini G, et al. Long-acting cabotegravir and rilpivirine dosed every 2 months in adults with HIV-1 infection (ATLAS-2M), 48-week results: a randomised, multicentre, open-label, phase 3b, non-inferiority study. Lancet 2021; 396: 1994-2005.
https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(20)32666-0/fulltext
Sax PE, Rockstroh JK, Luetkemeyer AF, et al. Switching to bictegravir, emtricitabine, and tenofovir alafenamide in virologically suppressed adults with human immunodeficiency virus. Clin Infect Dis 2021; 73:e485–e493.
https://academic.oup.com/cid/article/73/2/e485/5872016?login=false
Jary A, Marcelin AG, Charpentier C, et al. M184V/I does not impact the efficacy of abacavir/lamivudine/dolutegravir use as switch therapy in virologically suppressed patients. J Antimicrob Chemother 2020; 75:1290-3.
https://academic.oup.com/jac/article/75/5/1290/5739466?login=false
Podzamczer D, Imaz A, Lopez-Lirola A, et al. Switching to bictegravir/emtricitabine/tenofovir alafenamide (BIC/FTC/TAF) plus darunavir/cobicistat (DRV/c) in heavily antiretroviral-experienced, virologically suppressed HIV-infected adults receiving complex regimens. HIV Drug Therapy 2022, Glasgow 23 – 26, October 2022 P082.
Spinner CD, Kümmerle T, Schneider J, et al. Efficacy and Safety of Switching to Dolutegravir With Boosted Darunavir in Virologically Suppressed Adults With HIV-1: A Randomized, Open-Label, Multicenter, Phase 3, Noninferiority Trial: The DUALIS Study. Open Forum Infect Dis 2020; 7:1-8.
https://academic.oup.com/ofid/article/7/9/ofaa356/5892408?login=false
Casado JL, Del Rey JM, Bañón S, et al. Changes in Kidney Function and in the Rate of Tubular Dysfunction After Tenofovir Withdrawal or Continuation in HIV-Infected Patients. J Acquir Immune Defic Syndr. 2016;72: 416-22.
Tebas P, Sension M, Arribas JR, et al; ECHO and THRIVE Study Groups. Lipid levels and changes in body fat distribution in treatment-naive, HIV-1-Infected adults treated with rilpivirine or Efavirenz for 96 weeks in the ECHO and THRIVE trials. Clin Infect Dis 2014; 59:425-34.
https://academic.oup.com/cid/article/59/3/425/2895310?login=false
Johnson M, Kumar P, Molina JM, et al. Switching to Doravirine/Lamivudine/Tenofovir Disoproxil Fumarate (DOR/3TC/TDF) maintains HIV-1 virologic suppression through 48 Weeks: Results of the DRIVE-SHIFT Trial. J Acquir Immune Defc Syndr 2019; 81:463-72.
Gatell JM, Assoumou L, Moyle G, et al. Immediate vs. deferred switching from a boosted protease inhibitor based regimen to a dolutegravir based regimen in virologically suppressed patients with high cardiovascular risk or age >50 years: Final 96 weeks results of NEAT 022 study. Clin Infect Dis 2019; 68:597-606.
https://academic.oup.com/cid/article/68/4/597/5038116?login=false
Martinez E, Larrousse M, Llibre JM, et al. Substitution of raltegravir for ritonavir-boosted protease inhibitors in HIV-infected patients: the SPIRAL study. AIDS 2010; 24: 1697-1707.
Palella FJ Jr, Fisher M, Tebas P, et al. Simplification to rilpivirine/emtricitabine/tenofovir disoproxil fumarate from ritonavir-boosted protease inhibitor antiretroviral therapy in a randomized trial of HIV-1 RNA-suppressed participants. AIDS 2014; 28:335-44. Erratum in: AIDS 2014;28:1999-2001.
https://journals.lww.com/aidsonline/Fulltext/2014/01280/Simplification_to.6.aspx
van Wyk J, Ait-Khaled M, Santos J, et al. Improvement in metabolic health parameters at Week 48 after switching from a tenofovir alafenamide-based 3- or 4-drug regimen to the 2-drug regimen of dolutegravir/lamivudine: The TANGO Study. J Acquir Immune Defic Syndr 2021; 87:794-800.
Rial-Crestelo D, Pinto-Martínez A, Pulido F. Cabotegravir and rilpivirine for the treatment of HIV. Expert Rev Anti Infect Ther 2020; 18:393-404.
https://www.tandfonline.com/doi/abs/10.1080/14787210.2020.1736561?journalCode=ierz20
Orkin C, Schapiro JM, Perno CF, et al. Expanded multivariable models to assist patient selection for long-acting cabotegravir + rilpivirine treatment: clinical utility of a combination of patient, drug concentration, and viral factors associated with virological failure over 152 weeks. HIV Drug Therapy Glasgow, October 23-26, 2022.
5. FRACASO DEL TRATAMIENTO ANTIRRETROVIRAL
5.1. DEFINICIONES
5.2. INCIDENCIA Y FACTORES DETERMINANTES DEL FRACASO VIROLOGICO
5.3. OBJETIVO DEL TRATAMIENTO TRAS FRACASO VIROLOGICO
5.4. ESCENARIOS CLÍNICOS DE FRACASO VIROLOGICO
DEFINICIONES
• Fracaso virológico (FV): CVP >200 cop/mL transcurridas 24 semanas desde el inicio del TAR, confirmada en una segunda muestra consecutiva.
• Repuntes virológicos transitorios aislados (“blips”): CVP entre 50-500 cop/mL, con valores de CVP previa y posterior <50 cop/mL. Los “blips” aislados con CVP <200 cop/mL no parecen tener repercusión clínica1.
• Viremia de bajo nivel (VBN): CVP 50-500 cop/mL en al menos dos muestras consecutivas. Aunque el término VBN incluye viremias persistentes entre 200 y 500 cop/mL, el panel de expertos de este documento considera que dichos pacientes cumplen criterios de FV y deben manejarse como tal (ver más adelante).
INCIDENCIA Y FACTORES DETERMINANTES DEL FRACASO VIROLOGICO
Las tasas de FV de los TAR de inicio preferentes a las 48 semanas son inferiores al 5%. Los factores que influyen en el FV son:
• Mala adherencia al tratamiento o al seguimiento de controles médicos.
• Efectos adversos (EA).
• Interacciones farmacocinéticas (fármacos, productos de herboristería, alimentos, complementos nutricionales o drogas recreativas).
• Preexistencia de MR.
OBJETIVO DEL TRATAMIENTO TRAS FRACASO VIROLOGICO
El objetivo del TAR de rescate es volver a suprimir la CVP (<50 cop/mL) tan pronto como sea posible.
Volver a suprimir la CVP consigue los siguientes objetivos adicionales:
• Evitar la acumulación de MR, la resistencia cruzada y la evolución viral.
• Reconstituir el sistema inmunitario.
• Disminuir la inflamación crónica.
• Disminuir eventos definitorios y no definitorios de SIDA.
• Reducir la mortalidad.
• Reducir el riesgo de transmisión del VIH.
ESTRATEGIAS PARA MEJORAR EL ÉXITO DE LOS TRATAMIENTOS DE RESCATE
• Facilitar la adherencia y tolerabilidad al TAR.
• Pruebas de resistencia. Se recomienda consultar el documento de GeSIDA sobre la utilidad clínica de los estudios de resistencias a los antirretrovirales recientemente actualizado. El TAR deberá incluir fármacos a los que el virus no es resistente. Si se utiliza un estudio de secuenciación masiva o ultrasensible, será suficiente con evaluar las mutaciones presentes en al menos 10-20% de los virus (sensibilidad equivalente al método Sanger)2. Únicamente en casos concretos (p.ej. infección por VIH en persona expuesta a PrEP) puede ser clínicamente útil detectar MR minoritarias como M184V o K65R.
Ante un cambio de régimen, se debe asumir que las MR no desaparecen, por lo que hay que considerar todas las MR acumuladas en todas las pruebas de resistencias disponibles a la hora de diseñar un nuevo TAR.
La utilización de DNA proviral en pacientes suprimidos o con VBN, es aún muy limitada y no está validada clínicamente. Sin embargo, interpretados con precaución, estos estudios pueden ayudar a detectar mutaciones archivadas en individuos con CVP <200 cop/mL con opciones terapéuticas limitadas3.
• Tropismo viral. Debe determinarse cuando se plantea el uso de MVC. Una vez se han identificado cepas con tropismo no-R5, no debe de volver a plantearse un tratamiento con un antagonista de CCR5.
Recomendaciones
El cambio del TAR por FV debe efectuarse precozmente para evitar la acumulación de MR y facilitar la respuesta al nuevo tratamiento. (A-III)
- Se deben analizar las causas que motivaron el fracaso, la historia farmacológica y los fracasos previos. El nuevo TAR debe ser lo más cómodo y bien tolerado posible. (A-III)
- El nuevo TAR debe contener al menos 2 fármacos completamente activos (definidos mediante estudio de resistencias -y tropismo, si procede-), y al menos uno de ellos debe tener una alta barrera a las resistencias (DRV/p o INI de segunda generación). (A-II)
- En los pacientes que necesitan tratamiento para VHB en que se modifique el TAR por FV debemos asegurarnos de que la infección por VHB persista tratada, para evitar rebrotes de replicación. (A-I)
ESCENARIOS CLÍNICOS DE FRACASO VIROLOGICO
5.5.1. Viremias de bajo nivel (VBN)
Bajo este epígrafe se consideran 2 situaciones:
a) Viremias de muy bajo nivel (VMBN): CVP de 50-200 cop/mL. La VMBN persistente puede ocasionarse a partir de la integración del VIH en una región transcripcionalmente activa de una población de linfocitos CD4+ clonalmente expandida, sin que exista replicación de virus competentes. En este contexto, no se ha observado evolución viral ni selección de nuevas MR.
Existe discusión sobre la actitud terapéutica más adecuada en esta situación porque:
i. Algunas técnicas de PCR en tiempo real (TaqMan® o Abbott RealTime®) son susceptibles a falsos positivos debido a su elevada sensibilidad4.
ii. Es difícil amplificar material genómico suficiente para realizar una prueba genotípica de MR en plasma. Algunos autores consideran que, a pesar de sus limitaciones, los estudios en ADN proviral pueden ser útiles en este escenario cuando son evaluados por expertos.
b) Viremias de nivel bajo-moderado (VNB-M): CVP: 200-500 cop/mL. La presencia de CVP de 200-500 cop/mL se asocia a un mayor riesgo de FV con selección de MR, y deben manejarse igual que un FV5-7. Para la realización del test genotípico puede ser recomendable utilizar técnicas de concentración.
Recomendaciones
- En el escenario de VMBN es recomendable un seguimiento clínico-analítico trimestral. (B-III)
- Ante la ausencia de MR, únicamente se mantendrá el TAR en curso si éste posee alta barrera frente al desarrollo de resistencias. Se deberá reforzar la adherencia y revisar potenciales interacciones. (A-III)
- Si se evidencia acumulación de MR, se recomienda optimizar el tratamiento según el perfil de MR. (A-I)
- No se recomienda la intensificación terapéutica añadiendo un solo fármaco activo. (A-III)
5.5.2. Primer fracaso virológico
Es el FV a la primera línea de TAR. La selección de MR y las pautas de segunda línea difieren dependiendo de la pauta de inicio utilizada8,9.
Recomendaciones
- El diseño del TAR tras un FV dependerá del resultado del estudio de resistencias. Se adecuarán los cambios de TAR a las MR para conseguir un TAR de rescate plenamente activo. (A-II)
- En ausencia de MR, se deberá descartar mala adherencia y se investigarán posibles interacciones, errores en la prescripción o la toma, y otros motivos en la vida del paciente que dificulten una correcta toma de la medicación. (A-II)
- Una vez corregidos esos motivos, se podrá continuar el mismo TAR con un control precoz de la CVP (1-3 meses dependiendo de la CVP). (C-III)
- Alternativamente- especialmente en FV a esquemas con baja barrera a las resistencias- se modificará el TAR según lo resumido en la Tabla 2. (B-I)
5.5.3. Fracaso virológico avanzado
Es el FV a la segunda o sucesivas líneas de TAR. En este escenario, la mayoría de los pacientes pueden presentan MR a dos o más familias de FAR. El mantenimiento de XTC en presencia de M184V hipersensibiliza al virus a TDF/ TAF (si no hay MR a análogos de timidina o TAMs), o revierte parcialmente su sensibilidad en presencia de TAMs, reduce el fitness viral y contribuye a disminuir la CVP en 0,5 log10,11.
Los INI de primera generación (RAL y EVG) tienen una barrera genética muy baja y no tienen ningún papel como tratamiento de rescate en la actualidad.
Aunque existen pocos datos en rescate, DOR es un ITINAN de nueva generación recientemente disponible, bien tolerado, con buen perfil de toxicidad y patrón alternativo de mutaciones de resistencia que también podría ser útil.
Los principales ensayos clínicos de pautas de rescate avanzado se resumen en la Tabla 2 12-34.
Recomendaciones
- Para el diseño de un tratamiento de rescate se tendrán en cuenta todos los genotipos disponibles (genotipo acumulado), las pautas previas y las MR no recogidas en los estudios previos que pudieran estar presentes. (A-I)
- Todo TAR de rescate avanzado incluirá DRV/p y/o DTG, si persiste susceptibilidad viral a estos fármacos (A-I). Cuando existe alguna mutación mayor de resistencia a DRV, se recomienda utilizar DRV/r 600/100 mg BID. DRV/p deberá acompañarse de otros FAR (ITIAN, ITINN e INI) hasta conseguir un régimen plenamente activo. (A-I)
- El INI de elección para TAR de rescate es DTG BID (QD únicamente si no existe ninguna MR en la integrasa ni exposición previa a INI) (A-I).
- En general se recomienda mantener XTC incluso en presencia de M184V. (B-III)
- Si no existen MR que reduzcan su eficacia, se puede considerar añadir un ITINN de segunda generación al régimen de rescate, como ETV (B-I) o DOR (B-III).
- En caso de que, con los ITIAN, ITINN, IP e INI, no se pueda construir un esquema con garantías de supresión virológica completa y sostenida se deberá incluir en el tratamiento de rescate un fármaco que actúe en otras dianas virales (inhibidor de fusión, inhibidor del acoplamiento, inhibidor de la cápside o inhibidor de la translocación de la transcriptasa inversa). (A-I)
- Si el régimen de rescate final es complejo, incluye múltiples fármacos y existe riesgo de que la adherencia a largo plazo se comprometa, es posible plantear la reducción de dicha complejidad, retirando algún fármaco o pasando a una pauta QD (C-III). Esta decisión no está exenta de riesgo por lo que se deberá realizar por un médico experto en el manejo de pacientes complejos, valorando cuidadosamente el beneficio/riesgo, y únicamente tras conseguir la supresión virológica completa durante un mínimo de 6 meses (A-III).
5.5.4. Fracaso virológico en pacientes con escasas opciones terapéuticas
Existen datos de nuevos fármacos que actúan en diferentes dianas del virus:
• Fostemsavir (FTV): inhibidor del acoplamiento (attachment) y prodroga del Temsavir que se administra a dosis de 1 comp de 600 mg BID. Ha demostrado en el estudio BRIGHTE32 una tasa de respuesta (CVP <40 cop/mL) en semana 96 del 60% en la cohorte randomizada (CR: posibilidad de usar al menos 1 fármaco activo aprobado) y del 37% en la cohorte no randomizada (NR: sin posibilidad de usar fármacos activos aprobados). Con una mediana basal de 80 linfocitos CD4+, a la semana 96 la recuperación media fue de 205 células/μL en la CR y de 119 células/μL en la NR. Aprobado por la FDA y la EMA.
• Lenacapavir (LEN): inhibidor de la cápside administrado por vía subcutánea cada 6 meses. El estudio CAPELLA34 demostró excelente actividad antiviral de LEN combinado con un régimen basal optimizado (TO) en 72 pacientes extensamente pretratados y virus multirresistente, presentando supresión virológica en semana 52 el 83% de los pacientes. Aprobado por la FDA y la EMA.
• Ibalizumab (IBA): Anticuerpo monoclonal humanizado que se une al segundo dominio extracelular del receptor CD4+, bloqueándolo. No tiene resistencia cruzada con otros fármacos ni interacciones farmacológicas significativas y ha demostrado eficacia virológica en pacientes altamente pretratados33; el 43% de los pacientes alcanzaron CVP<50 cop/mL en la semana 25. Aprobado por la FDA y la EMA. Sin embargo, este fármaco no está comercializado en Europa, por lo que, en la práctica, no está disponible.
Recomendaciones
- Jamás interrumpir el TAR. (A-I)
- Se recomienda derivar al paciente a un centro con experiencia y acceso a nuevos FAR a través de ensayos o programas de acceso expandido, que puedan estar disponibles. (A-III)
- Se debe evitar exponer al paciente a monoterapia funcional con un solo FAR por el elevado riesgo de FV y selección de MR a ese único FAR. (A-III)
- En el caso excepcional de que se agoten todas las opciones terapéuticas, se diseñará un tratamiento “puente” que combine efectividad residual de los fármacos y permita una supresión parcial de la replicación viral, minimizando la acumulación de MR que limiten la efectividad de futuros fármacos. El objetivo de este TAR “puente” es retrasar la progresión clínica, el deterioro inmunológico y limitar la acumulación de MR. (A-III)
- En cuanto sea posible, este tratamiento debe cambiarse a un TAR supresor con 2-3 FAR activos que incluya fármacos de nuevas familias. (A-III)
Tablas:

Bibliografía:
Lee PK, Kieffer TL, Siliciano RF, et al. HIV-1 viral load blips are of limited clinical significance. J Antimicrob Chemother 2006; 57:803-5.
https://academic.oup.com/jac/article/57/5/803/764675?login=falseInzaule SC, Hamers RL, Noguera-Julian M, et al. Clinically relevant thresholds for ultrasensitive HIV drug resistance testing: a multi-country nested case-control study. Lancet HIV 2018;5:e638-e646.
https://linkinghub.elsevier.com/retrieve/pii/S2352301818301772Sotillo A, Sierra O, Martínez-Prats L, et al. Analysis of drug resistance mutations in whole blood DNA from HIV-1 infected patients by single genome and ultradeep sequencing analysis. J Virol Methods 2018; 260:1-5.
https://www.sciencedirect.com/science/article/abs/pii/S0166093417305748?via%3DihubBack DJ, Khoo SH, Gibbons SE, Merry C. The role of therapeutic drug monitoring in treatment of HIV infection. Br J Clin Pharmacol. 2001 ;51:301-8.
https://bpspubs.onlinelibrary.wiley.com/doi/full/10.1046/j.1365-2125.2001.01380.xRyscavage P, Kelly S, Li , et al . Significance and clinical management of persistent low-level viremia and very-low-level viremia in HIV-1-infected patients. Antimicrob Agents Chemother. 2014;58:3585-98.
https://journals.asm.org/doi/10.1128/AAC.00076-14Álvarez H, Rava M, Martínez C et al. Predictors of low level viraemia and virological failure in the era of integrase inhibitors: A Spanish nationwide cohort. HIV Med 2022; 23:825-836.
https://onlinelibrary.wiley.com/doi/10.1111/hiv.13265Parra-Ruiz J, Alvarez M, Chueca N, et al. Resistencias genotipicas en pacientes con VIH-1 y grados de viremia persistentemente bajos. Enferm Infecc Microbiol Clin 2009; 27:75-80.
https://www.sciencedirect.com/science/article/abs/pii/S0213005X08000219?via%3DihubLübke N, Jensen B, Hüttig F,et al. Failure of dolutegravir first-line ART with selection of virus carrying R263K and G118R. N Engl J Med 2019; 381:887-9.
https://www.nejm.org/doi/10.1056/NEJMc1806554Lepik KJ, Harrigan PR, Yip B, et al. Emergent drug resistance with integrase strand transfer inhibitor-based regimens. AIDS 2017; 31:1425-34.
https://journals.lww.com/aidsonline/Fulltext/2017/06190/Emergent_drug_resistance_with_integrase_strand.9.aspxDeeks SG, Hoh R, Neilands TB, et al. Interruption of treatment with individual therapeutic drug classes in adults with multidrug-resistant HIV-1 infection. J Infect Dis 2005;192:1537-44.
https://academic.oup.com/jid/article/192/9/1537/834938?login=falseParedes R, Sagar M, Marconi VC, et al. In vivo fitness cost of the M184V mutation in multidrug-resistant human immunodeficiency virus type 1 in the absence of lamivudine. J Virol 2009; 83:2038-43.
https://journals.asm.org/doi/10.1128/JVI.02154-08Sension M, Cahn P, Domingo P, et al. Subgroup analysis of virological response rates with once- and twice-daily darunavir/ritonavir in treatment-experienced patients without darunavir resistance-associated mutations in the ODIN trial. HIV Med 2013; 14:437-44.
https://onlinelibrary.wiley.com/doi/10.1111/hiv.12024Aboud M, Kaplan R, Lombaard J, et al. Dolutegravir versus ritonavir-boosted lopinavir both with dual nucleoside reverse transcriptase inhibitor therapy in adults with HIV-1 infection in whom first-line therapy has failed (DAWNING): an open-label, non-inferiority, phase 3b trial. Lancet Infect Dis 2019; 19:253-64.
https://www.thelancet.com/journals/laninf/article/PIIS1473-3099(19)30036-2/fulltextBoyd MA, Kumarasamy N, Moore CL, et al. Ritonavir-boosted lopinavir plus nucleoside or nucleotide reverse transcriptase inhibitors versus ritonavir-boosted lopinavir plus raltegravir for treatment of HIV-1 infection in adults with virological failure of a standard first-line bART regimen (SECOND-LINE): a randomised, open-label, non-inferiority study. Lancet 2013; 381:2091-9.
https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(13)61164-2/fulltextPaton N, Kityo C, Thompson J, et al. Nucleoside reverse-transcriptase inhibitor cross-resistance and outcomes from second-line antiretroviral therapy in the public health approach: an observational analysis within the randomised, open-label, EARNEST trial. Lancet HIV. 2017;4:e341-e348.
https://www.thelancet.com/journals/lanhiv/article/PIIS2352-3018(17)30065-6/fulltextPaton NI, Musaazi J, Kityo C, et al. Efficacy and safety of dolutegravir or darunavir in combination with lamivudine plus either zidovudine or tenofovir for second-line treatment of HIV infection (NADIA): week 96 results from a prospective, multicentre, open-label, factorial, randomised, non-inferiority trial. Lancet HIV. 2022;9:e381-e393.
https://www.thelancet.com/journals/lanhiv/article/PIIS2352-3018(22)00092-3/fulltextLa Rosa AM, Harrison LJ, Taiwo B, et al. Raltegravir in second-line antiretroviral therapy in resource-limited settings (SELECT): a randomised, phase 3, non-inferiority study. Lancet HIV 2016; 3:e247-58.
https://www.thelancet.com/journals/lanhiv/article/PIIS2352-3018(16)30011-X/fulltextRuxrungtham K, Pedro RJ, Latiff GH,et al. Impact of reverse transcriptase resistance on the efficacy of TMC125 (etravirine) with two nucleoside reverse transcriptase inhibitors in protease inhibitor-naïve, nonnucleoside reverse transcriptase inhibitor-experienced patients: study TMC125-C227. HIV Med. 2008;9:883-96.
https://onlinelibrary.wiley.com/doi/10.1111/j.1468-1293.2008.00644.xMadruga JV, Berger D, McMurchie M, et al. Efficacy and safety of darunavir-ritonavir compared with that of lopinavir-ritonavir at 48 weeks in treatment-experienced, HIV- infected patients in TITAN: a randomised controlled phase III trial. Lancet 2007; 370:49- 58.
https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(07)61049-6/fulltextClotet B, Bellos N, Molina JM, et al. Efficacy and safety of darunavir-ritonavir at week 48 in treatment-experienced patients with HIV-1 infection in POWER 1 and 2: a pooled subgroup analysis of data from two randomised trials. Lancet 2007; 369:1169-78.
https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(07)60497-8/fulltextSteigbigel RT, Cooper DA, Teppler H, et al. Long-term efficacy and safety of Raltegravir combined with optimized background therapy in treatment-experienced patients with drug- resistant HIV infection: week 96 results of the BENCHMRK 1 and 2 Phase III trials. Clin Infect Dis 2010; 50:605-12.
https://academic.oup.com/cid/article/50/4/605/354602?login=falseMadruga JV, Cahn P, Grinsztejn B, et al. Efficacy and safety of TMC125 (etravirine) in treatment-experienced HIV-1-infected patients in DUET-1: 24-week results from a randomised, double-blind, placebo-controlled trial. Lancet 2007; 370:29-38.
https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(07)61047-2/fulltextLazzarin A, Campbell T, Clotet B, et al. Efficacy and safety of TMC125 (etravirine) in treatment-experienced HIV-1-infected patients in DUET-2: 24-week results from a randomised, double-blind, placebo-controlled trial. Lancet 2007; 370:39-48.
https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(07)61048-4/fulltextGulick RM, Lalezari J, Goodrich J, et al. Maraviroc for previously treated patients with R5 HIV-1 infection. N Engl J Med 2008; 359:1429-41.
https://www.nejm.org/doi/full/10.1056/NEJMoa0803152Yazdanpanah Y, Fagard C, Descamps D, et al. High rate of virologic suppression with raltegravir plus etravirine and darunavir/ritonavir among treatment-experienced patients infected with multidrug-resistant HIV: results of the ANRS 139 TRIO trial. Clin Infect Dis 2009; 49:1441-9.
https://academic.oup.com/cid/article/49/9/1441/302869?login=falseMolina JM, Lamarca A, Andrade-Villanueva J, et al. Efficacy and safety of once daily elvitegravir versus twice daily raltegravir in treatment-experienced patients with HIV-1 receiving a ritonavir-boosted protease inhibitor: randomised, double-blind, phase 3, non-inferiority study. Lancet Infect Dis 2012; 12:27-35.
https://linkinghub.elsevier.com/retrieve/pii/S1473309911702493Cahn P, Pozniak AL, Mingrone H, et al. Dolutegravir versus raltegravir in antiretroviral- experienced, integrase-inhibitor-naive adults with HIV: week 48 results from the randomised, double-blind, non-inferiority SAILING study. Lancet 2013; 382:700-8.
https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(13)61221-0/fulltext
Eron JJ, Clotet B, Durant J, et al. Safety and efficacy of dolutegravir in treatment- experienced subjects with raltegravir-resistant HIV type 1 infection: 24-week results of the VIKING Study. J Infect Dis 2013; 207:740-8.
https://academic.oup.com/jid/article/207/5/740/1078540?login=falseCastagna A, Maggiolo F, Penco G, et al. Dolutegravir in antiretroviral-experienced patients with raltegravir- and/or elvitegravir-resistant HIV-1: 24-week results of the Phase III VIKING-3 Study. J Infect Dis 2014; 210:354-62.
https://academic.oup.com/jid/article/210/3/354/828280?login=falseAkil B, Blick G, Hagins DP, et al. Dolutegravir versus placebo in subjects harbouring HIV-1 with integrase inhibitor resistance associated substitutions: 48-week results from VIKING-4, a randomized study. Antivir Ther 2015; 20:343-8.
https://journals.sagepub.com/doi/10.3851/IMP2878Thompson M, Lalezari J, Richard R, et.al. Safety and efficacy of the HIV-1 attachment inhibitor prodrug fostemsavir in antiretroviral-experienced subjects: week 48 analysis of AI438011, a Phase IIb, randomized controlled trial. Antivir Ther. 2017;22:215-223.
https://journals.sagepub.com/doi/10.3851/IMP3112Kozal, J. Aberg, G Pialloux et al: Fostemsavir in Adults with Multidrug-Resistant HIV-1 Infection (BRIGHTE Study). N Engl J Med 2020; 382:1232-1243.
https://www.nejm.org/doi/10.1056/NEJMoa1902493Emu B, Fessel J, Schrader S, et al. Phase 3 Study of Ibalizumab for Multidrug-Resistant HIV-1. N Engl J Med 2018; 379:645-54.
https://www.nejm.org/doi/10.1056/NEJMoa1711460Ogbuagu O, Segal-Maurer S, Brinson C, et al. Long-acting lenacapavir in people with multidrug resistant HIV-1: week 52 results. CROI 2022. 12-16 February 2022, virtual. Poster abstract 491.
Schürmann D, Jackson Rudd D, Zhang S, et al. Safety, Pharmacokinetics, and Antiretroviral Activity of Islatravir (ISL, MK-8591), a Novel Nucleoside Reverse Transcriptase Translocation Inhibitor, Following Single-Dose Administration to Treatment- Naive Adults Infected With HIV-1: An Open-Label, Phase 1b, Consecutive-Panel Trial. Lancet HIV 2020;7:e164-e172.
https://www.thelancet.com/journals/lanhiv/article/PIIS2352-3018(19)30372-8/fulltextJ, Mayers D, Huppler Hullsiek K, et al. Structured Treatment Interruption in Patients with Multidrug-Resistant Human Immunodeficiency Virus. N Engl J Med 2003; 349:83.
https://www.nejm.org/doi/full/10.1056/NEJMoa035103
6. SITUACIONES CON CONSIDERACIONES ESPECÍFICAS DEL TAR
6.1. EMBARAZO
6.2. TUBERCULOSIS
6.3. HEPATOPATÍAS
6.4. USO DE TAR EN PACIENTES CON INSUFICIENCIA RENAL.
6.5. INTERACCIONES FARMACOLOGICAS
6.6. INFECCION POR VIH-2
EMBARAZO
Se recomienda la lectura de guías actualizadas y el documento de consenso de GeSIDA (https://gesida-seimc.org/category/guias-clinicas), PNS y otras sociedades1.
En la Tabla 4 se recogen las recomendaciones para las PVV con deseo de gestación o gestantes. El objetivo del TAR durante el embarazo es conseguir y mantener CVP indetectable durante el mayor tiempo posible, especialmente en el tercer trimestre y en el momento del parto.
Recomendaciones
- La elección de los FAR concretos en las PVV gestantes se basará en el estudio de resistencias y en la seguridad de los mismos. El TAR de elección es TDF/FTC, TAF/FTC o ABC/3TC, junto con RAL dos veces al día (A-I) o DTG una vez al día (A-I). Podrán recibir cualquiera de los FAR “recomendados” o “alternativos” tras una valoración individualizada. (A-III)
- En caso de que una persona esté recibiendo biterapia y se quede embarazada, en general se recomienda el cambio a triple terapia. (B-III)
- El tratamiento intraparto con Zidovudina (ZDV) vía intravenosa estará indicado, independientemente del TAR que hubiese recibido durante el embarazo, si la CVP en el parto es >1000 copias/mL o desconocida (A-I). Si la CVP está entre 50 y 999 copias/mL también se recomienda. (B-III)
TUBERCULOSIS
Se recomienda consultar el documento de consenso sobre Prevención y tratamiento de IO en pacientes con infección por el VIH de GeSIDA/ PNS2
Recomendaciones de TAR
- a) Inicio
- Excluyendo la meningitis tuberculosa, iniciar TAR independientemente de la cifra de linfocitos CD4+ en las dos primeras semanas una vez comprobada la tolerancia al tratamiento antituberculoso. (A-I)
- En el caso de meningitis tuberculosa, demorar el inicio del TAR al menos 4 semanas, eligiendo el momento óptimo según la situación clínica del paciente. (A-I)
- b) Fármacos
- ITIAN.
- Se puede utilizar ABC, TDF, 3TC o FTC (A-I).
- Evitar el uso de TAF con rifampicina (A-II). En caso de ser TAF la única opción disponible, hay datos iniciales de coadministración en voluntarios sanos en los que la concentración intracelular de Tenofovir alcanza niveles adecuados. (C-III)3
- Tercer fármaco:
- Se recomienda de elección EFV a dosis estándar, incluso con rifampicina a dosis altas para meningitis. (A-I)
- Alternativas: RAL 800 mg/12 h ó DTG 50 mg/12 h (A-II).
- Si excepcionalmente la única opción fuese un IP, sustituir rifampicina por rifabutina con ajuste de dosis. (A-I)
Fármacos contraindicados con rifampicina: RPV, ETR, DOR, ningún IP (potenciado o no), COBI, EVG, RAL 1200 mg QD, BIC, CAB4 inyectable ni FTV.
- c) Síndrome inflamatorio por reconstitución inmunológica (SIRI)
- No interrumpir el tratamiento antituberculoso ni el TAR. (A-III)
- En pacientes con TB y recuento de linfocitos CD4+< 100 células/μL administrar prednisona (40 mg/día durante 2 semanas seguido de 20 mg/día durante 2 semanas más) para prevenir el desarrollo de SIRI. (A-I)5
- Una vez desarrollado SIRI, para el manejo de los síntomas pueden añadirse antinflamatorios no esteroideos en las formas leves o moderadas (A-III) o corticosteroides en las formas graves (A-II).
HEPATOPATÍAS
Se recomienda consultar el documento de consenso específico realizado por GESIDA y GEHEP6.
En PVV con hepatitis crónica por VHB un estudio randomizado doble ciego reciente encontró mayor supresión virológica del VHB a las 48 semanas (63% vs 43,4%) en pacientes que recibían BIC/FTC/TAF frente a DTG+TDF/FTC7. Teniendo en cuenta que el 50% de los pacientes partían de CVP del VHB mayores a 8 log, la relevancia clínica de este dato se desconoce. La Tabla 5 recoge las consideraciones sobre uso de ARV en pacientes con cirrosis hepática8 .
Recomendaciones
- En pacientes coinfectados por VHB y/o VHC o con enfermedad hepática metabólica se recomienda iniciar el TAR tan pronto como sea posible. (A-I)
- Las combinaciones de ITIAN de elección para regímenes de inicio son FTC/TAF o ABC/3TC (A-I). Se recomienda su uso en coformulación. (A-II)
- En PVV naïve que precisan tratamiento de la hepatitis C, en general es preferible iniciar primero el TAR. (B-III)
- En pacientes coinfectados por VIH/VHB se debe iniciar precozmente un TAR que incluya TDF o TAF y FTC o 3TC, siguiendo las mismas recomendaciones de uso de estos fármacos que en el resto de PVV. (A-I)
- En pacientes coinfectados por VIH/VHB se debe evitar la interrupción de una pauta que incluya TDF o TAF. (A-II)
- En pacientes con enfermedad hepática metabólica se recomienda usar FAR con perfil lipídico favorable. (A-II)
- En pacientes con hepatopatía crónica y función hepática conservada, incluida la cirrosis estadio A de Child-Pugh se puede utilizar cualquier FAR. (A-I)
- En pacientes con insuficiencia hepatocelular Child-Pugh A, los ITIAN, los INI, RPV, DOR o DRV no precisan ajuste de dosis y son fármacos de elección (A-II). ABC está desaconsejado en pacientes con insuficiencia hepatocelular Child-Pugh B o C. (A-II)
- En pacientes en estadio de Child-Pugh C, se deben considerar como pautas preferentes aquellas basadas en RAL (A-II), DTG o BIC (B-III).
USO DE TAR EN PACIENTES CON INSUFICIENCIA RENAL.
La dosificación de los fármacos según el filtrado glomerular estimado (FGe) se expone en la Tabla 6. Se recomienda consultar el documento de consenso elaborado por GeSIDA9 así como otras citas recientes10111213.
Recomendaciones
- Es necesario ajustar las dosis de los ITIAN, excepto en el caso de ABC. (A-II).
- MVC requiere ajuste de dosis si se emplea en combinación con inhibidores potentes del CYP3A4. (A-II)
- No se requiere ajuste de dosis para los ITINN (en pacientes con insuficiencia renal avanzada en tratamiento con RPV se recomienda vigilancia estrecha por el potencial aumento de sus concentraciones plasmáticas), los IP, los INI RAL, DTG o CAB, ni para los inhibidores de la entrada ibalizumab y fostemsavir. (A-II)
- En general, se desaconseja el uso de coformulaciones de FAR en los que alguno de los fármacos precise ajuste de dosis en pacientes con insuficiencia renal significativa Tabla 6. En estos casos, deben emplearse los FAR por separado y realizar los ajustes pertinentes. (B-II)
- En los pacientes en TAR con cualquier grado de insuficiencia renal se recomienda evitar los fármacos nefrotóxicos y vigilancia estrecha de la función renal. (A-III)
INTERACCIONES FARMACOLOGICAS
Recomendaciones
- Elaborar una historia farmacológica centralizada y actualizada periódicamente que incluya el TAR, otras medicaciones, tratamientos complementarios (suplementos, fitoterapia, etc.) y/o drogas recreativas. (A-III)
- Valorar la posibilidad de una interacción medicamentosa ante cualquier modificación (inicio, cambio o interrupción) del plan terapéutico.(A-III)
- Consultar el documento de consenso del PNS 14, las fichas técnicas de los medicamentos y los recursos electrónicos específicos para la revisión de interacciones:
- Web de la Universidad de Liverpool: hiv-druginteractions.org
- Web del Hospital Clinic de Barcelona (en castellano): interaccionesvih.com
- Casos clínicos reales sobre interacciones en la práctica clínica: clinicalcasesDDIs.com
- Hospital General de Toronto. Contiene información extensa sobre interacciones con quimioterápicos. https://hivclinic.ca/drug-information/antiretroviral-interactions-with-chemotherapy-regimens/
- Kaiser Permanente. Contiene información extensa sobre interacciones con fitoterapia y otros tratamientos alternativos. https://healthy.kaiserpermanente.org/health-wellness/natural-medicines
- Priorizar el uso de esquemas antirretrovirales de menor riesgo de interacciones, como los basados en INI no potenciados (bictegravir, dolutegravir, raltegravir, cabotegravir) o en doravirina 1516. (AII)
- En caso de tratamiento con fármacos inductores o inhibidores enzimáticos, o que compitan con los transportadores involucrados en la farmacocinética de los antirretrovirales, se debe diseñar cuidadosamente el esquema antirretroviral. Se considerará la magnitud de la interacción, la dosificación, el intervalo terapéutico y las alternativas de tratamiento válidas en cada paciente. (A-I)
- Para el manejo de aquellos pacientes complejos que reciben múltiples fármacos con posibles interacciones, como por ej. los pacientes oncológicos, se recomienda un abordaje multidisciplinar que involucre a especialistas de cada área terapéutica, en el tratamiento del VIH, y a farmacéuticos/farmacólogos 1718. (A-III)
INFECCION POR VIH-2
Los principios generales del TAR en pacientes con infección por VIH-2 deben ser los mismos que para la infección por VIH-119. El VIH-2 presenta resistencia intrínseca a los ITINN y una sensibilidad variable frente a los IP, siendo DRV el más activo20. Los INI son activos frente al VIH-220.
Recomendaciones
- Se aconseja monitorizar clínica y CD4 cada 6-12 meses y, si está disponible, la CVP de VIH-2. (A-III).
- El uso de ITINN está contraindicado en el tratamiento de la infección por VIH-2 (A-I).
- El régimen de TAR de inicio en estos pacientes es la combinación de 2 ITIAN + 1 INI (A-II). Como alternativa a los INI, puede aconsejarse DRV/c.
- En situación de fracaso virológico se recomienda hacer un estudio de resistencias. La interpretación de estas deberá realizarse con un algoritmo específico para VIH-2 (A-III).
- En pacientes con infección dual VIH-1/VIH-2 el TAR debe seguir las recomendaciones del VIH-2 (A-III).
Tablas:


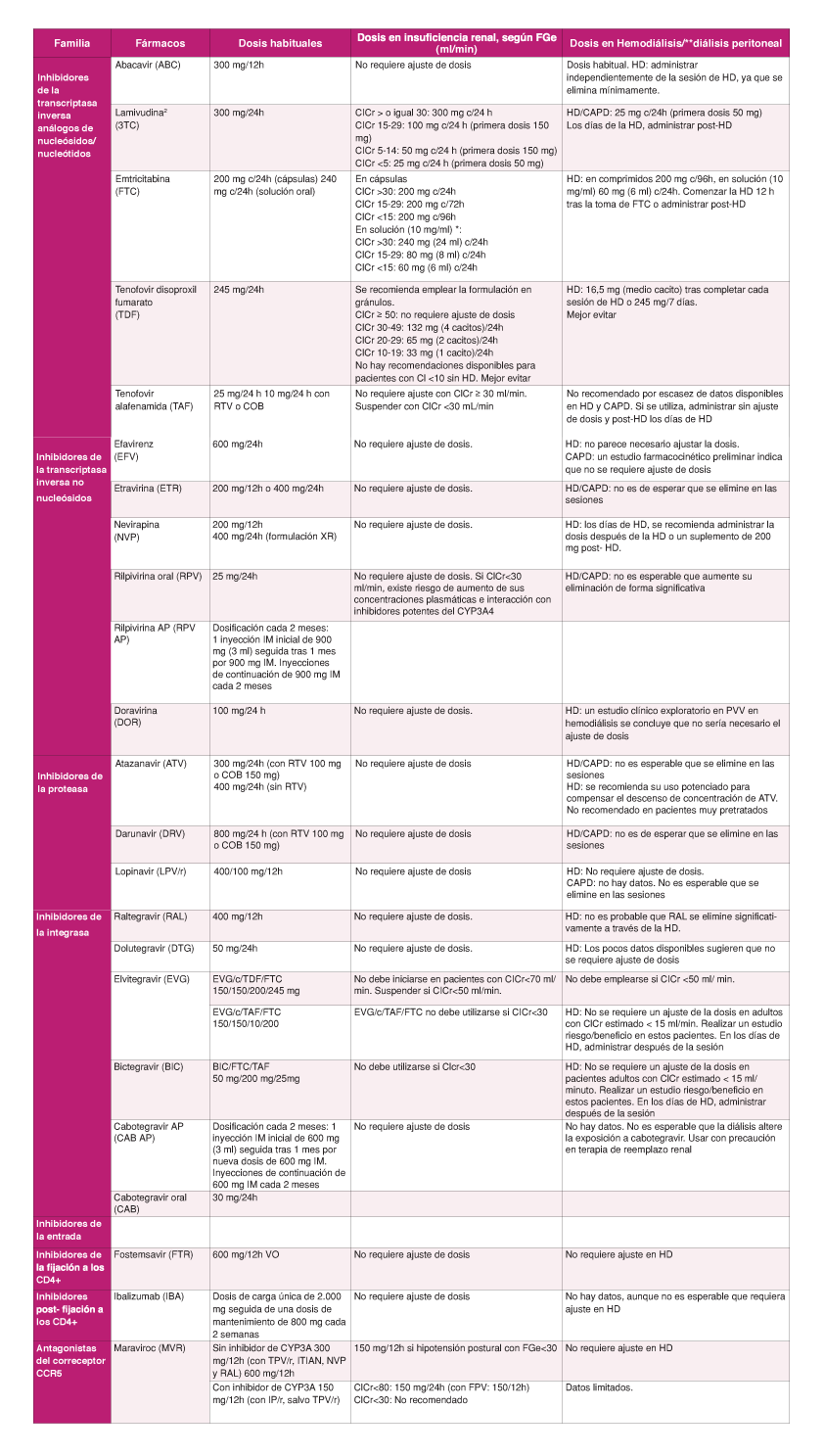
Bibliografía:
Recommendations for the use of antiretroviral drugs in pregnant women with HIV-1 infection and interventions to reduce perinatal HIV transmission in the United States. Departament of health and human services (HHS). Panel on treatment of pregnant women with HIV infection and prevention of perinatal transmission. December 30,2021. Updated. Accesible en https://clinicalinfo.hiv.gov/en/guidelines/perinatal/whats-new-guidelines.
Documento de prevención y tratamiento de infecciones oportunistas y otras coinfecciones en pacientes con infección por el VIH (actualización 2021). https://gesida-seimc.org/wp-content/uploads/2022/03/GUIA_PREVENCION_INFECCIONES_OPORTUNISTAS.pdf
The effect of rifampicin on the pharmacokinetics of intracellular tenofovir-diphosphate and tenofovir when coadministered with tenofovir alafenamide fumarate during the maintenance phase of tuberculosis treatment in TB/HIV-1 coinfected participants (EpiTAF) NCT04424264.
Rajoli RKR, Curley P, Chiong J, et al. Predicting drug-drug interactions between rifampicin and long-acting cabotegravir and rilpivirine using physiologically based pharmacokinetic modeling. J Infect Dis 2019;219:1735-42.
https://academic.oup.com/jid/article/219/11/1735/5253242?login=false
Meintjes G, Stek C, Blumenthal L, et al. Prednisone for the prevention of paradoxical tuberculosis associated IRIS. N Engl J Med 2018; 379:1915-25.
https://academic.oup.com/jid/article/219/11/1735/5253242?login=false
Guía GESIDA/GEHEP del manejo de la enfermedad hepática en el paciente VIH
Avihingsanon A, Lu H, Leong CL, et al. Week 48 of a phase 3 randomized controlled trial of bictegravir/emtricitabine/tenofovir alafenamide (B/F/TAF) vs dolutegravir + emtricitabine/ tenofovir disoproxil fumarate (DTG+F/TDF) as initial treatment in HIV/HBV-coinfected adults (ALLIANCE). AIDS 2022, July 29-August 2, Montreal. Abstract OALBX0105.
Navarro J. HIV and liver disease. AIDS Rev 2022;25:87-96.
Van Welzen B, Mudrikova T, El Idrissi A, et al. A review of Non-Alcoholic fatty liver disease in HIV-infected patients: the next big thing?. Infect Dis Ther 2019;8:33-50.
Panel de expertos de Gesida. Documento de consenso de GESIDA para la evaluación y el tratamiento de las enfermedades renales en pacientes con infección por el virus de la inmunodeficiencia humana. (Actualización Marzo 2020). http://gesida-seimc.org/wp-content/uploads/2020/07/GUIA_GESIDA_Renal_2020.pdf
Moltó J, Graterol F, Curran A, et al. Removal of doravirine by haemodialysis in people living with HIV with end-stage renal disease. J Antimicrob Chemother 2022;77:1989-91.
https://academic.oup.com/jac/article-abstract/77/7/1989/6568603?redirectedFrom=fulltext&login=false
Mounzer K, Brunet L, Wyatt CVP, et al. To dose-adjust or not to dose-adjust: lamivudine dose in kidney impairment. AIDS 2021; 35:1201-8.
Moltó J, Graterol F, Miranda C, et al. Removal of dolutegravir by hemodialysis in HIV-infected patients with end-stage renal disease. Antimicrob Agents Chemother 2016;60:2564–6. https://doi.org/10.1128/AAC.03131-15.
Plan Nacional sobre el Sida; Sociedad Española de Geriatría y Gerontología; Grupo de Estudio de Alteraciones Metabólicas y Comorbilidades. Documento de consenso sobre envejecimiento en las personas con infección por el virus de la inmunodeficiencia humana (Actualización 2021) mayo 2021. Apartados 8.3 y 9.5.5.
Lepik KJ, Wang L, Harris M, et al. Evolving patterns of antiretroviral drug interactions in people with HIV in British Columbia, Canada. AIDS. 2022 Jul 1;36(8):1105-1115.
Deutschmann E, Bucher HC, Jaeckel S, et al. Prevalence of Potential Drug-Drug Interactions in Patients of the Swiss HIV Cohort Study in the Era of HIV Integrase Inhibitors. Clin Infect Dis. 2021 Oct 5;73(7):e2145-e2152.
https://academic.oup.com/cid/article/73/7/e2145/5868541?login=false
López-Centeno B, Badenes-Olmedo C, Mataix-Sanjuan Á, et al. Polypharmacy and Drug-Drug Interactions in People Living With Human Immunodeficiency Virus in the Region of Madrid, Spain: A Population-Based Study. Clin Infect Dis. 2020 Jul 11;71(2):353-362.
https://academic.oup.com/cid/article/71/2/353/5552008?login=false
NCCN Clinical Practice Guidelines in Oncology. Cancer in People with HIV (version 1.2022, 3 Feb 2022). Disponible en https://www.nccn.org/login?ReturnURL=https://www.nccn.org/professionals/physician_gls/pdf/hiv.pdf
Requena S, Lozano A, Caballero E, et al. Clinical experience with integrase inhibitors in HIV-2 infected individuals in Spain. J Antimicrob Chemother 2019; 74: 1357-1362.
https://academic.oup.com/jac/article/74/5/1357/5315652?login=false
Tzou PL, Descamps D, Rhee SY, et al. Expanded Spectrum of Antiretroviral-selected Mutations in HIV-2. J Infect Dis 2020; 221: 1962-1972.
Smith R, Wu V, Song J, et al. Spectrum activity of raltegravir and dolutegravir against novel treatment-associated mutations in HIV-2 integrase: a phenotypic analysis using an expanded panel of site-direct mutants. J Infect Dis 2022; 226: 497-509.
https://academic.oup.com/jid/article-abstract/226/3/497/6521074?redirectedFrom=fulltext&login=false
7. SITUACIONES ESPECIALES
PRIMOINFECCIÓN VIH-1.
La primoinfección por el VIH-1 se asocia con síntomas inespecíficos (fiebre, cefalea y/o malestar general) y banales en la mayoría de casos, por lo que con frecuencia puede pasar desapercibida, aunque algunos pacientes presentan un cuadro similar al de la mononucleosis infecciosa12. Las pruebas de ELISA de cuarta generación, que incluyen la determinación simultánea de anticuerpos y del antígeno p24 del VIH-1, permiten el diagnóstico durante la infección aguda en el 80-90% de casos. Se considera infección aguda a aquella de menos de 30 días e infección reciente a la de menos de 180 días12.
Se recomienda el inicio de TAR en todos los casos de primoinfección12 ya que acorta la duración y gravedad de los síntomas, suprime rápidamente la replicación viral, reduce la diversidad viral y el reservorio (ADN proviral), normaliza más rápidamente la cifra de linfocitos CD4+ y el cociente CD4/CD8, reduce la activación inmunológica, preserva o restaura la inmunidad específica frente al VIH-1 y reduce la transmisión3.
Una vez iniciado el TAR durante la primoinfección, no se recomienda su interrupción, ya que ninguna estrategia evaluada (tratamiento intermitente, vacunas terapéuticas o imunomoduladores adyuvantes) ha permitido evitar el rebote viral en la gran mayoría de pacientes4. En muy pocos pacientes que iniciaron el TAR precozmente (<90 días) se observó un control virológico cuando lo interrumpieron (controladores post-tratamiento), pero no se han establecido parámetros para identificarlos basalmente5. Por tanto, en la práctica clínica, se debe iniciar el TAR durante la primoinfección y se debe mantener de forma indefinida, como en la infección crónica. Las pautas de TAR deben ser las mismas que en la infección crónica y la adición de más FAR (4 ó 5) no está recomendada, en general, ya que no se ha acompañado de ningún beneficio adicional6. Casi no hay experiencia con biterapia.
En los pacientes gravemente sintomáticos, el inicio del TAR debe realizarse de forma inmediata (idealmente en la primera visita, si se considera que el paciente está preparado para ello), ya que acorta la duración y gravedad de los síntomas. En el resto de pacientes debe iniciarse lo antes posible, ya que es cuando se puede conseguir el máximo beneficio inmunológico (>900 linfocitos CD4+/μL y ratio CD4/CD8 normal)7. En cada región se deben conocer las tasas de transmisión de virus resistentes.
En usuarios de PrEP con TDF/FTC que se infectan por el VIH-1, la tasa de resistencias es baja. Sin embargo, cuando la PrEP se ha iniciado de forma inadvertida en la fase inicial de una infección aguda (Fiebig I, solo RNA detectable, y tanto anticuerpos como Ag P24 negativos), pueden atenuarse marcadamente las manifestaciones clínicas y en hasta cerca de la mitad de los casos desarrollarse MR al FTC y en menor medida al TDF, lo que debería tenerse en cuenta en la adaptación del TAR inicial y considerar la adición de un cuarto fármaco, a la espera del test de resistencia. Excepcionalmente, puede producirse el contagio por exposición a una fuente con una cepa resistente a los componentes de la PrEP8.
Finalmente, siempre debe valorarse la inclusión de estos pacientes, en especial de aquellos que llevan muy pocos días infectados, en protocolos de investigación o ensayos clínicos que busquen la erradicación o la cura funcional del VIH-1.
Recomendaciones
- El TAR debe recomendarse en todos los pacientes con primoinfección por el VIH-1 independientemente de los síntomas, gravedad y duración; para obtener el máximo beneficio debe comenzarse tan pronto como sea posible (A-II).
- El tipo de TAR será el mismo que en la infección crónica (A-I), basado en un INI de alta barrera genética (DTG o BIC) ya que reducen la CVP más rápido que otras familias, pero no una pauta doble.
- TDF o TAF/FTC serán los ITIAN recomendados si no se cuenta con serología de VHB y HLA-B5701 (A-I).
- Si es una primoinfección en un usuario reciente de PrEP se podría añadir un cuarto fármaco (DRV/c) hasta disponer del resultado del test de resistencias (C-III).
- Una vez iniciado el TAR debe mantenerse indefinidamente (A-I).
INFECCIÓN POR VIH-2
La infección por el VIH-2 es endémica en África Occidental, con prevalencias superiores al 1% en algunas zonas de Guinea-Bissau y Costa de Marfil. La globalización ha dado lugar a un número considerable de casos en otras partes de África, Europa, India y Brasil. Se estima que entre 1 y 2 millones de personas están infectadas por VIH-2. En España la prevalencia es muy baja, aunque debe descartarse en pacientes procedentes de zonas endémicas o que hayan sido parejas de personas de esas regiones1.
A diferencia del VIH-1: 1) La infección por VIH-2 se caracteriza por un estadio asintomático más largo, con valores de CVP más bajos y con frecuencia indetectables. 2) No disponemos de pruebas comerciales para medir la CVP, ni el estudio de resistencias genotípicas en VIH-2, aunque algunos laboratorios han desarrollado procedimientos no comerciales que han sido suficientemente validados12. 3) Los algoritmos genotípicos utilizados para predecir resistencias a TAR en el VIH-1 no son directamente aplicables al VIH-22. 4) Cuando la inmunodeficiencia avanza, los pacientes con infección por el VIH-2 se recuperan con más dificultad, con peor respuesta al TAR y normalización de linfocitos CD4+.
Los principios generales del TAR en pacientes con infección por VIH-2 deben ser los mismos que para la infección por VIH-1. El VIH-2 presenta resistencia intrínseca a los ITINN y una sensibilidad variable frente a los IP, siendo DRV el más activo. Los INI son
activos frente al VIH-234. Ibalizumab ha demostrado actividad in vitro frente a aislados de VIH-2 del grupo A y del B5.
Recomendaciones
- Se aconseja monitorizar clínica y CD4+ cada 6-12 meses y, si está disponible, la CVP de VIH-2 (A-III).
- El uso de ITINN está contraindicado en el tratamiento de la infección por VIH-2
- (A-I).
- El régimen de TAR de inicio en estos pacientes es la combinación de 2 ITIAN + 1 INI (A-II). Como alternativa a los INI, puede aconsejarse DRV/c.
- En pacientes con infección dual VIH-1/VIH-2 el TAR debe seguir las recomendaciones del VIH-2 (A-III).
EMBARAZO
El TAR en el embarazo se discute en un documento de consenso elaborado por el PNS en colaboración con GeSIDA y otras sociedades pendiente de actualización. Se recomienda la lectura de guías actualizadas1 ante cualquier duda al respecto.
Este apartado presenta las recomendaciones acerca del TAR en este contexto. En las Tabla 3 y Tabla 4 se recoge la actitud recomendada ante diferentes situaciones.
El objetivo del TAR durante el embarazo es conseguir y mantener CVP indetectable durante el mayor tiempo posible, especialmente en el tercer trimestre y en el momento del parto2.
El TAR de elección en la mujer con deseo de gestación o gestante se basa en la combinación de un INI, de elección RAL o DTG, o como alternativa DRV/r, junto a 2
ITIAN, de elección ABC/3TC o TDF/FTC o TAF/FTC)(1,3-5).
Recomendaciones
- Si el diagnóstico de infección por el VIH-1 se realiza durante el embarazo, el TAR se comenzará lo más precozmente posible, y preferiblemente con un régimen que incluya INI, dada la posibilidad de transmisión intrauterina (A-I).
- La elección de los FAR concretos se basará en el estudio de resistencias y en la seguridad de los mismos (Tablas 10 y 11). El TAR de elección es TDF/FTC, TAF/ FTC o ABC/3TC, con RAL 400 mg dos veces al día (A-I), DTG una vez al día (A-II) o DRV/r dos veces al día (A-II). Podrán recibir cualquiera de los FAR “recomendados” o “alternativos” tras una valoración individualizada (A-III).
- En caso de que una mujer esté recibiendo biterapia y se quede embarazada, se recomienda el cambio a triple terapia (C-III).
- El tratamiento intraparto con ZDV vía intravenosa estará indicado, independientemente del TAR que llevase o hubiese llevado, si la CVP en el parto es >1000 cop/mL o desconocida (A-I); entre 50 y 999 cop/mL también se recomienda (B-III).
COMORBILIDADES
7.4.1. TRATAMIENTO ANTIRRETROVIRAL DE INICIO EN PACIENTES CON INFECCIONES OPORTUNISTAS (IO) DISTINTAS A LA TUBERCULOSIS (TB).
El momento idóneo para iniciar el TAR en un paciente con una IO es motivo de controversia1. Las posibles ventajas de un inicio temprano incluyen una recuperación inmune más rápida, una mayor resolución de la IO, prevenir la aparición de otras y reducir el riesgo de mortalidad. Entre los inconvenientes destacan las posibles interacciones y toxicidades y el síndrome inflamatorio de reconstitución inmune (SIRI)1. El ensayo clínico aleatorizado ACTG A5164 demostró una reducción en la progresión a SIDA/muerte (HR: 0,53; IC 95%: 0,30 a 0,92) en pacientes que iniciaban TAR dentro de una mediana de 12 días tras el inicio del tratamiento de la IO frente a demorarlo hasta una mediana de 45 días2. No se observaron diferencias en efectos adversos ni en la incidencia de SIRI, según el uso de esteroides para la IO. Más del 60% de los pacientes presentaban neumonía por Pneumocystis jirovecii (NPJ), pero dado el pequeño número y variedad de otras IO es difícil extraer conclusiones para cada una de ellas por separado.
El ensayo clínico IDEAL, ha comparado una estrategia de inicio inmediato del TAR (7 primeros días tras iniciar tratamiento para la IO) frente a un inicio diferido (21-42 días)3. Se incluyeron pacientes con encefalitis por toxoplasma (11 sujetos) y NPJ (50 sujetos). Todos los sujetos iniciaron tratamiento con TDF+FTC+ATV/r. El ensayo no tuvo potencia suficiente para detectar diferencias en ninguno de los “end point” primarios o secundarios entre los dos grupos. Los autores concluyen que el inicio inmediato de TAR parece seguro y no muestra más probabilidad de progresión de IO, SIRI, fracaso inmunovirológico o peor calidad de vida.
Una de las IO más complicadas de tratar por su elevada morbimortalidad es la meningitis criptocócica. En el ensayo clínico COAT4, se incluyeron 177 sujetos y fueron aleatorizados a inicio precoz o tardío del TAR (1-2 semanas o 5 semanas después del diagnóstico). La mortalidad a las 26 semanas fue mayor en los que iniciaron el TAR precozmente (45% vs. 30%; RR:1,73; IC95%:1,06 a 2,82, p=0,03). La presencia de SIRI no difirió entre ambos grupos (20% vs. 13%, p=0,32)4. Estos resultados se confirmaron en una revisión sistemática de la colaboración Cochrane que incluía 4 estudios (n=294 pacientes)5. El riesgo de muerte se incrementaba en un 42% cuando se iniciaba el TAR de forma precoz vs tardío (RR 1,42; IC95% 1,02- 1,97). Este incremento en la mortalidad no parecía estar claramente relacionado con el SIRI.
Por tanto, a pesar de la limitación de los datos, en las IO en general habría una menor progresión de la enfermedad en aquellos pacientes que inician el TAR de forma precoz (en los primeros 14 días), aunque no está claro si, además de la NPJ, esto es cierto para todas las IO. Concretamente, en la meningitis criptocócica sería mejor esperar varias semanas para iniciar el TAR tras el diagnóstico y tratamiento de esta IO45. En caso de presentar dos o más IO simultáneamente, siendo una de ellas una meningitis criptocócica o tuberculosa, el buen juicio clínico debe sopesar el beneficio o perjuicio de iniciar TAR precoz (< 2 semanas), intermedio (2-5 semanas) o tardío (> 5 semanas).
Recomendaciones
- Sin considerar la TB, en la mayoría de las IO, excepto la meningitis criptocócica, se debe iniciar el TAR lo antes posible (se recomienda en las dos primeras semanas tras el inicio del tratamiento de la IO) (A-II).
- En pacientes con NPJ que no reciben TAR, éste se debería comenzar en las dos primeras semanas tras el diagnóstico de la NPJ (A-I).
- En pacientes con meningitis criptocócica se recomienda diferir el inicio del TAR 5 semanas por el riesgo de mayor mortalidad asociada con un inicio precoz del mismo (especialmente en pacientes con menos de 5 células/μL en el LCR o incremento de la presión intracraneal) (A-I).
7.4.2. TRATAMIENTO ANTIRRETROVIRAL Y TUBERCULOSIS (TB).
El tratamiento de la TB en adultos con infección por el VIH-1 ha sido objeto de un documento de consenso específico de GeSIDA/Secretaría del PNS1. Se recomienda su lectura.
Momento óptimo de inicio del TAR en pacientes infectados por el VIH-1 con TB1
Recomendaciones
- Se recomienda iniciar TAR independientemente de la cifra de CD4+ en las dos primeras semanas, una vez comprobada la tolerancia al tratamiento antituberculoso (A-I).
- En el caso de la meningitis tuberculosa, se recomienda demorar el inicio del TAR al menos 4 semanas, eligiendo el momento óptimo en función de la situación clínica del paciente (A-I).
- Con las recomendaciones previas se disminuye el riesgo de efectos adversos y el desarrollo de SIRI, sin comprometer la supervivencia.
Pautas de TAR.
La principal dificultad radica en las posibles interacciones medicamentosas con los fármacos antituberculosos, especialmente relevantes en el caso de las rifamicinas.
Tanto para los pacientes que inician TAR como para los pacientes que ya están recibiendo TAR, el régimen debe construirse de acuerdo a los principios para la elección de FAR en pacientes en tratamiento para TB que se sintetizan a continuación. Además, hay que tener en cuenta los antecedentes de resistencias o intolerancias a FAR.
- Elección de los ITIAN. No existe interacción significativa entre los fármacos antituberculosos y la mayoría de ITIAN, ni hay evidencia de la potenciación de la toxicidad entre ellos. Una excepción la constituye TAF porque la rifampicina disminuye su concentración plasmática un 55%.
- Elección del tercer fármaco. La mayor experiencia y los mejores resultados se han obtenido con EFV, por lo que en el caso de los pacientes con TB, sigue constituyendo el fármaco de elección. También puede utilizarse en el caso de necesitar dosis muy altas de rifampicina para tratar meningitis2.
- Alternativas terapéuticas como terceros fármacos. Existen datos para recomendar como alternativas pautas que incluyan RAL 800 mg/12 horas3 o DTG 50 mg/12 horas4. RAL 400 mg/12 horas no ha demostrado la no inferioridad frente a EFV5. Con las alternativas actualmente disponibles no se recomienda la administración de MVC salvo en casos Si no existen alternativas, CAB oral podría coadminstrarse con rifabutina, aunque todavía falta evidencia para recomendar su uso6.
- Fármacos que no pueden No se pueden administrar con rifampicina los ITINN diferentes de EFV (RPV, ETR y DOR), ningún IP (potenciado o no), ni EVG, RAL 1200 mg QD, BIC, CAB6, ni fostemsavir.
Recomendaciones
- Elección de los ITIAN. Se puede utilizar ABC, TDF, 3TC o FTC (A-I). No está recomendado el uso de TAF con rifampicina (A-II).
- Elección del tercer fármaco. Se recomienda el uso de EFV a dosis estándar (A-I). Como alternativas se recomiendan RAL 800 mg/12 h o DTG 50 mg/12 h (A-II) y en el caso excepcional de que la única opción fuese un IP debe sustituirse rifampicina por rifabutina y realizar el ajuste de dosis correspondiente (A-I).
Síndrome inflamatorio por reconstitución inmunológica (SIRI).
El SIRI es una complicación frecuente del TAR en pacientes con TB, especialmente en pacientes con recuento de células CD4+ muy bajos, cuando el TAR se inicia muy precozmente en relación con el inicio del tratamiento antituberculoso. En pacientes inmunodeprimidos, el uso de prednisona puede prevenir el desarrollo de SIRI7. Un ensayo aleatorizado, doble ciego, controlado con placebo de prednisona (1,5 mg/kg/día durante 2 semanas y luego 0,75 mg/kg/día durante 2 semanas), en el que se incluyeron 55 pacientes por rama, la prednisona redujo la necesidad de hospitalización y procedimientos terapéuticos y aceleró la mejoría clínica de los pacientes.
Recomendaciones
- En caso de SIRI no debe interrumpirse el tratamiento antituberculoso ni el TAR (A-III).
- En pacientes con TB y un recuento de linfocitos CD4+ menor de 100 células/ μL se recomienda administrar prednisona (40 mg/día durante 2 semanas y luego 20 mg/día durante 2 semanas más) para prevenir el desarrollo de SIRI (A-I).
- Una vez desarrollado SIRI, para el manejo de los síntomas pueden añadirse antiinflamatorios no esteroideos en las formas leves o moderadas (A-III) o corticosteroides en las formas graves (A-II).
7.4.3. USO DE TAR EN PACIENTES CON INSUFICIENCIA RENAL
La insuficiencia renal crónica en la población infectada por el VIH-1 tiene una prevalencia variable en relación con la población estudiada(!). El método considerado de elección en la actualidad para estimar la función renal es la ecuación CKD- EPI2. Para una visión completa del diagnóstico, prevención y tratamiento de las alteraciones renales en pacientes con infección por el VIH se recomienda consultar el documento de consenso ad hoc elaborado por GeSIDA3. La dosificación de los fármacos según el FGe se expone en la Tabla 2 3456.
Recomendaciones
- Es necesario ajustar las dosis de los ITIAN, excepto en el caso de ABC (A-II). MVC requiere ajuste de dosis si se emplea en combinación con inhibidores potentes del CYP3A4, como los IP, ketoconazol, itraconazol, claritromicina y telitromicina (A-II).
- No se requiere ajuste de dosis para los ITINN (en pacientes con insuficiencia renal avanzada en tratamiento con RPV se recomienda vigilancia estrecha por el potencial aumento de sus concentraciones plasmáticas), IP, los inhibidores de la entrada, ibalizumab y fostemsavir, ni para los INI RAL, DTG o CAB (A-II).
- En general, se desaconseja el uso de coformulaciones de FAR en los que alguno de los fármacos precise ajuste de dosis en pacientes con insuficiencia renal significativa. TDF/FTC/c/EVG no debe emplearse en pacientes con FGe
- <70 ml/min. TDF/FTC/EFV y TDF/FTC/RPV no deben emplearse en pacientes con FGe <50 ml/min y DTG/3TC/ABC, DTG/3TC, TAF/FTC/c/EVG, TAF/FTC/ BIC, TAF/FTC/RPV y TAF/FTC/c/DRV no deben utilizarse en pacientes con FGe <30 ml/min. En estos casos, deben emplearse los FAR por separado y realizar los ajustes pertinentes (B-II). DTG/RPV y CAB+RPV deben usarse con precaución en pacientes con FGe <30 ml/min (B-III).
- En los pacientes con cualquier grado de insuficiencia renal se recomienda vigilar estrechamente la función renal, incluyendo la función tubular en el caso de utilizar TDF y evitar los fármacos nefrotóxicos (A-III).
- En los pacientes con insuficiencia renal crónica avanzada se debe realizar el ajuste de dosis recomendado por las fichas técnicas de cada medicamento, teniendo en cuenta las posibles interacciones entre los diferentes fármacos, más frecuentes y peligrosas en esta situación (A-II). Si no existen contraindicaciones, se puede utilizar la combinación de ABC más 3TC (ajustado al FGe) con un ITINN, un INI no potenciado (DTG o RAL), DRV/r o DRV/c. También biterapia con 3TC ajustado al FGe con DTG, DRV/r o DRV/c (A-III).
7.4.4. HEPATOPATÍAS (VHC, VHB, CIRROSIS)
La AEEH y la SEIMC han publicado una guía de manejo de la hepatitis C, que incluye al paciente coinfectado1, la cual recomendamos consultar para más detalles. Entre las causas principales de daño hepático en los pacientes con infección por el VIH-1 actualmente están la hepatitis B crónica y la enfermedad hepática grasa2345. La hepatitis B crónica mantiene una prevalencia estable (3,2%) y causa cirrosis en a la esteatosis/esteatohepatitis no alcohólica, es una causa cada vez más frecuente de hepatopatía y está cobrando mayor relevancia con la menor prevalencia de la hepatitis vírica y con el envejecimiento de la población infectada por VIH34.
Recomendaciones
- El cuidado y seguimiento del paciente con daño hepático avanzado se debe de hacer como en la población general y se aconseja seguir las recomendaciones de las guías clínicas existentes (A-III).
- Se debe realizar despistaje de la enfermedad hepática grasa en todo paciente infectado por VIH-1 con sospecha de hepatopatía, obesidad o síndrome metabólico (A-II).
7.4.4.1. Cuándo iniciar el TAR en pacientes coinfectados
En estudios de cohortes, el control de la replicación del VIH-1 y la mejoría inmunológica por efecto del TAR se han asociado a una menor velocidad de progresión de la enfermedad hepática causada por VHC y a una mejor evolución clínica, incluso en pacientes con cirrosis descompensada5. Por tanto, es preferible iniciar el TAR y, una vez controlado el VIH-1, iniciar el tratamiento de la hepatitis. Opcionalmente, en pacientes controladores de élite, se podría plantear tratar inicialmente el VHC.
Tanto TDF como TAF suprimen el VHB en la mayoría de los pacientes coinfectados por VIH-1 y VHB6789. La retirada de un tratamiento eficaz frente al VHB puede dar lugar a una exacerbación de la hepatitis con consecuencias potencialmente graves y es de especial importancia tenerlo presente en las simplificaciones a biterapias10.
Recomendaciones
- En pacientes coinfectados por VHB o VHC se recomienda iniciar el TAR tan pronto como sea posible (A-I).
- En pacientes que precisan tratamiento de la hepatitis C, en general es preferible iniciar primero el TAR (B-III).
- En pacientes coinfectados por VIH/VHB se debe iniciar precozmente un TAR que incluya TDF o TAF y FTC o 3TC (A-I).
7.4.4.2. Elección de los fármacos antirretrovirales (FAR)
La elección de los FAR en un paciente coinfectado por virus de la hepatitis ha de tener en cuenta su potencial hepatotoxicidad, la existencia de cirrosis hepática y si la coinfección es por VHB y/o VHC y/o VHD.
En cuanto a la hepatotoxicidad, los FAR utilizados actualmente tienen bajo riesgo y la mayoría de los episodios son leves y autolimitados.
Por otra parte, no se ha demostrado que los FAR ejerzan un efecto protector específico sobre la fibrogénesis hepática. En pacientes con esteatosis hepática en tratamiento con EFV, un ensayo piloto randomizado mostró que los que eran aleatorizados a RAL experimentaban un descenso de los niveles de esteatosis11.
En pacientes con cirrosis estadio A de Child-Pugh se puede usar cualquier FAR, con las consideraciones antes expuestas. En pacientes con insuficiencia hepatocelular (estadios B y C de Child-Pugh) existen, en general, pocos datos Tabla 1.
Por sus características farmacocinéticas, los INI ofrecen ventajas en estos pacientes. En estadios A y B de Child-Pugh no requieren ajuste de dosis1213. En estadio C, RAL ha demostrado buena tolerabilidad14 y su metabolismo no depende del citocromo P450; el metabolismo de DTG, BIC y CAB depende sólo en parte del citocromo CYP3A4 lo que les hace fármacos de bajo riesgo.
Existen múltiples interacciones entre los FAR y los antivirales de acción directa (AAD) frente al VHC que pueden condicionar una modificación de la dosis o desaconsejar su coadministración y debe tenerse siempre en cuenta (https:// www.hiv-druginteractions.org)15.
Recomendaciones
- En pacientes con hepatopatía crónica y función hepática conservada, incluida la cirrosis estadio A de Child-Pugh se puede utilizar cualquier FAR (A-I).
- En pacientes con insuficiencia hepatocelular leve/moderada (Child- Pugh A o B), los ITIAN (salvo ABC), los INI, RPV, DOR o DRV no precisan ajuste de dosis y son fármacos de elección (A-II).
- En pacientes en estadio de Child-Pugh C, se deben considerar como pautas preferentes aquellas basadas en RAL (A-II), DTG y BIC (B-III).
- Antes de prescribir un tratamiento con AAD en un paciente que recibe TAR, debe consultarse una aplicación informática actualizada de interacciones farmacológicas (A-III).
- En pacientes coinfectados por VIH/VHB se debe evitar la interrupción de una pauta eficaz frente a VHB (A-II).
7.4.5. NEOPLASIAS
Se recomienda la lectura de documentos específicos acerca de las neoplasias en pacientes con infección por el VIH-11234. En general, el TAR debe iniciarse lo antes posible. Se puede considerar una diferencia de al menos 7 días respecto al inicio del tratamiento antineoplásico para asegurar la tolerancia. En los pacientes en TAR pueden precisarse cambios dependiendo de las interacciones y la toxicidad añadida.
Para seleccionar los FAR es importante considerar el perfil de toxicidad y las posibles interacciones farmacocinéticas con los fármacos antineoplásicos, principalmente de aquellos FAR que se metabolizan por la vía del CYP45021. Los IP/p son los FAR que presentan interacciones farmacológicas más importantes. Se aconseja consultar páginas web sobre interacciones que se actualicen con regularidad.
Los INI no potenciados respecto a los IP/p e ITINN tienen, en general, ventajas en sus características farmacológicas, perfil de tolerancia e interacciones para el tratamiento concomitante con fármacos antineoplásicos1.
Los IP/p se asocian a neutropenia más profunda y prolongada cuando se coadministran con la quimioterapia de los linfomas12. Algunos de ellos, así como la RPV, alargan el intervalo QT, lo que podría potenciar este efecto cuando se usan junto a determinados fármacos antineoplásicos1. Además, los IP/p pueden presentar mayor toxicidad, más interacciones y menor eficacia virológica que los ITINN y RAL5.
Recomendaciones
El TAR es un pilar fundamental, y debe formar parte, del tratamiento de los pacientes con neoplasias e infección por el VIH-1 (A-II).
RAL y DTG, por sus características farmacológicas, excelente tolerancia y mínimas interacciones, deben ser los FAR de elección en pacientes que reciban quimioterapia (A-II). Como alternativa, se puede considerar el uso de BIC y DOR (C-III).
Tablas:
Bibliografía:
Henn A, Flateau C, Gallien S. Primary HIV infection: clinical presentation, testing, and
treatment. Curr Infect Dis Rep 2017;19:37.Robb ML, Eller LA, Kibuuka H, et al. Prospective study of acute HIV-1 infection in adults
in east Africa and Thailand. N Engl J Med 2016; 374:2120-30.Lama JR, Ignacio RAB, Alfaro R, Ríos J, Cartagena JG, Valdez R, Bain C, et al. Clinical and immunologic outcomes after immediate or deferred antiretroviral therapy initiation during primary human immunodeficiency virus infection: The Sabes Randomized Clinical Study. Clin Infect Dis 2021; 72:1042-50.
Colby DJ, Trautmann L, Pinyakorn S, et al. Rapid HIV RNA rebound after antiretroviral
treatment interruption in persons durably supressed in Fiebig I acute HIV infection. Nat
Med 2018; 24:923-6.Saez-Cirion A, Bacchus C, Hocqueloux L, et al. Post-treatment HIV-1 controllers with a long-term virological remission after the interruption of early initiated antiretroviral therapy ANRS VISCONTI Study. PLoS pathogens 2013; 9:e1003211.
Cheret A, Nembot G, Melard A, et al. Intensive five-drug antiretroviral therapy regimen versus standard triple-drug therapy during primary HIV-1 infection (OPTIPRIM-ANRS 147): a randomised, open-label, phase 3 trial. Lancet Infect Dis 2015; 15:387-96
Ambrosioni J, Petit E, Liegeon G, Laguno M, Miró JM. Primary HIV-1 infection in users of pre-exposure prophylaxis. Lancet HIV 2021; 8:e166-e174.
de Mendoza C, Cabezas T, Caballero E, et al. HIV type 2 epidemic in Spain: challenges and missing AIDS 2017; 31:1353-64.
Tzou PL, Descamps D, Rhee SY, et al. Expanded spectrum of antiretroviral-selected mutations in HIV-2. J Infect Dis 2020; 221:1962-72.
Raugi D, Ba S, Cisse O, et al. Long-term experience and outcomes of programmatic antiretroviral therapy for HIV-2 infection in Senegal, West Africa. Clin Infect Dis 2021; 72:369-78.
Requena S, Lozano A, Caballero E, et Clinical experience with integrase inhibitors in HIV-2 infected individuals in Spain. J Antimicrob Chemother 2019; 74: 1357-62.
Le Hingrat Q, Collin G, Ghosn J, et Ibalizumab shows in vitro activity against group A and group B HIV-2 clinical isolates. Reviews in Antiviral Therapies & Infectious Diseases 7, 2020. Presented at European Meeting on HIV and Hepatitis 2020. Abstract 75. Disponible en: https://academicmedicaleducation.com/meeting/european-meeting- hiv-hepatitis-2020/abstract/ibalizumab-shows-vitro-activity-against-0.
Recommendations for the use of antiretroviral drugs in pregnant women with HIV- 1 infection and interventions to reduce perinatal HIV transmission in the United States. Departament of health and human services (HHS) Panel on treatment of pregnant women with HIV infection and prevention of perinatal December 30,2021. Accesible en https://clinicalinfo.hiv.gov/sites/default/files/guidelines/documents/Perinatal_GL.pdf
Mandelbrot L, Tubiana R, Le Chenadec J, et al. No perinatal HIV-1 transmission from women with effective antiretroviral therapy starting before Clin Infect Dis 2015; 61:1715-25.
Siemieniuk RA, Foroutan F, Mirza R, et al. Antiretroviral therapy for pregnant women living with HIV or hepatitis B: a systematic review and meta-analysis. BMJ open 2017; 7:e019022.
Zash R, Holmes L, Diseko M, et al Neural-tube defects and antiretroviral treatment regimens in N Engl J Med 2019; 381:827-40.
Lockman S, Brummel SS, Ziemba L, et IMPAACT 2010/VESTED Study Team and Investigators. Efficacy and safety of dolutegravir with emtricitabine and tenofovir alafenamide fumarate or tenofovir disoproxil fumarate, and efavirenz, emtricitabine, and tenofovir disoproxil fumarate HIV antiretroviral therapy regimens started in pregnancy (IMPAACT 2010/VESTED): a multicentre, open-label, randomised, controlled, phase 3 trial. Lancet 2021; Apr 3;397(10281):1276-1292.
Lawn SD, Torok ME, Wood R. Optimum time to start antiretroviral therapy during HIV- associated opportunistic infections. Curr Opin Infect Dis 2011; 24:34-42.
Zolopa A, Andersen J, Powderly W, et al. Early antiretroviral therapy reduces AIDS progression/death in individuals with acute opportunistic infections: a multicenter randomized strategy PLoS One 2009; 4:e5575.
Schäfer G, Hoffmann C, Arasteh K, et al. Immediate versus deferred antiretroviral therapy in HIV-infected patients presenting with acute AIDS-defining events (toxoplasmosis, Pneumocystis jirovecii-pneumonia): a prospective, randomized, open-label multicenter study (IDEAL-study). AIDS Res Ther 2019; 16:34.
Boulware DR, Meya DB, Muzoora C, et Timing of antiretroviral therapy after diagnosis of cryptococcal meningitis. N Engl J Med 2014; 370:2487-98.
Eshun-Wilson I, Okwen MP, Richardson M, Bicanic T. Early versus delayed antiretroviral treatment in HIV-positive people with cryptococcal meningitis. Cochrane Database Syst Rev 2018; 7:CD009012.
Rivero A, Pulido F (coordinadores). Recomendaciones de GeSIDA sobre el tratamiento de la tuberculosis en adultos infectados por el virus de la inmunodeficiencia humana (actualización mayo 2018). http://www.GeSIDA-seimc.org/wp-content/uploads/2018/08/ pdf (Consultado 12.10.2021).
Atwine D, Baudin E, Gelé T, Muyindike W, Mworozi K, Kyohairwe R, et al; ANRS 12292 Rifavirenz study group. Effect of high-dose rifampicin on efavirenz pharmacokinetics: drug-drug interaction randomized trial. J Antimicrob Chemother 2020; 75:1250-58.
Grinsztejn B, De Castro N, Arnold V, et al. Raltegravir for the treatment of patients co- infected with HIV and tuberculosis (ANRS 12 180 Reflate TB): a multicentre, phase 2, non-comparative, open-label, randomised Lancet Infect Dis 2014; 14:459-67.
Dooley KE, Kaplan R, Mwelase N, et al. Dolutegravir-based antiretroviral therapy for patients co-infected with tuberculosis and HIV: a multicenter, noncomparative, open-label, randomized Clin Infect Dis 2020; 70:549-56.
De Castro N, Marcy O, Chazallon C et al; ANRS 12300 Reflate TB2 study group. Standard dose raltegravir or efavirenz-based antiretroviral treatment for patients co- infected with HIV and tuberculosis (ANRS 12 300 Reflate TB 2): an open-label, non- inferiority, randomised, phase 3 Lancet Infect Dis 2021; 21:813-22.
Ford SL, Lou Y, Lewis N, et al. Effect of rifabutin on the pharmacokinetics of oral cabotegravir in healthy Antivir Ther 2019; 24:301-8.
Meintjes G, Stek C, Blumenthal L, et al. Prednisone for the prevention of paradoxical tuberculosis associated N Engl J Med 2018; 379:1915-25.
Ekrikpo UE, Kengne AP, Bello AK, et al. Chronic kidney disease in the global adult HIV- infected population: A systematic review and meta-analysis. PLoS One 2018; 13:e0195443.
Cristelli MP, Cofán F, Rico N, et al. Estimation of renal function by CKD-EPI versus MDRD in a cohort of HIV-infected patients: a cross-sectional BMC Nephrol 2017; 18:58.
Panel de expertos de Documento de consenso de GeSIDA para la evaluación y el tratamiento de las enfermedades renales en pacientes con infección por el virus de la inmunodeficiencia humana. (Actualización Marzo 2020). http://gesida-seimc.org/wp- content/uploads/2020/07/TAR_GUIA_GESIDA_2020_COMPLETA_Julio.pdf (Consultado el 20-08-2021)
Magee M, Slater J, Mannino F, et al. Effect of renal and hepatic impairment on the pharmacokinetics of temsavir, the active moiety of fostemsavir. J Clin Pharmacol 2021; 61:939-53.
Parasrampuria R, Ford SL, Lou Y, et al. A Phase I study to evaluate the pharmacokinetics and safety of cabotegravir in adults with severe renal impairment and healthy matched control Clin Pharmacol Drug Dev 2019; 8:674-81.
Pozniak A, Arribas JR, Gathe J, et Switching to tenofovir alafenamide, coformulated with elvitegravir, cobicistat, and emtricitabine, in HIV-infected patients with renal impairment: 48-week results from a single-arm, multicenter, open-label phase 3 study. J Acquir Immune Defic Syndr 2016; 71:530-7.
Guía AEEH-SEIMC de tratamiento de la infección por virus de la Hepatitis C 2018. Accesible en: https://seimc.org/contenidos/gruposdeestudio/gehep/dcientificos/documentos/gehep-seimc_AEEH-dc-2018-HepatitisC.pdf (accedido el 30/11/2019).
Maurice JB, Patel A, Scott AJ, et al. Prevalence and risk factors of nonalcoholic fatty liver disease in HIV-monoinfection. AIDS 2017; 31:1621-32.
Cervo A, Milic J, Mazzola G, et Prevalence, predictors, and severity of lean nonalcoholic fatty liver disease in patients living with Human immunodeficiency virus. Clin Infect Dis 2020; 71:e694-e701. doi: 10.1093/cid/ciaa430.
Pineda JA, Garcia-Garcia JA, Aguilar-Guisado M, et Clinical progression of hepatitis C virus-related chronic liver disease in human immunodeficiency virus-infected patients undergoing highly active antiretroviral therapy. Hepatology 2007; 46:622-30.
Price H, Dunn D, Pillay D, et al. Suppression of HBV by tenofovir in HBV/HIV coinfected patients: a systematic review and meta-analysis. PLoS One 2013; 8:e68152
Gallant J, Brunetta J, Crofoot G, et Efficacy and safety of switching to a single-tablet regimen of elvitegravir/cobicistat/emtricitabine/tenofovir alafenamide in HIV-1/hepatitis B-coinfected adults. J Acquir Immune Defic Syndr 2016; 73:294-8.
Chan HL, Fung S, Seto WK, et al. Tenofovir alafenamide versus tenofovir disoproxil fumarate for the treatment of HBeAg-positive chronic hepatitis B virus infection: a randomised, double-blind, phase 3, non-inferiority trial. Lancet Gastroenterol Hepatol 2016; 1:185-95.
Buti M, Gane E, Seto WK, et al. Tenofovir alafenamide versus tenofovir disoproxil fumarate for the treatment of patients with HBeAg-negative chronic hepatitis B virus infection: a randomised, double-blind, phase 3, non-inferiority trial. Lancet Gastroenterol Hepatol 2016; 1:196-206.
Kim HN, Newcomb CW, Carbonari DM, et al; North American AIDS Cohort Collaboration on Research, Design of IeDEA. Risk of HCC With Hepatitis B Viremia Among HIV/HBV- Coinfected Persons in North America. Hepatology 2021. doi: 10.1002/hep.31839. Epub ahead of PMID: 33780007
Macias J, Mancebo M, Merino D, et Changes in liver steatosis after switching from efavirenz to raltegravir among human immunodeciency virus-infected patients with nonalcoholic fattly liver disease. Clin Infect Dis 2017; 65:1012-9.
Song IH, Borland J, Savina PM, et al. Pharmacokinetics of single-dose dolutegravir in HIV-seronegative subjects with moderate hepatic impairment compared to healthy matched controls. Clinical Pharmacol Drug Dev 2013; 2:342-8
Merli M, Galli L, Marinaro Pharmacokinetics of dolutegravir and rilpivirine in combination with simeprevir and sofosbuvir in HIV/hepatitis C virus-coinfected patients with liver cirrhosis. J Antimicrob Chemother 2017; 72:812-5.
Hernandez-Novoa B, Moreno A, Perez-Elias MJ, et al. Raltegravir pharmacokinetics in HIV/ HCV-coinfected patients with advanced liver cirrhosis (Child-Pugh C). J Antimicrob Chemother 2014; 69: 471-5.
HEP drug interaction University of Liverpool. http://www.hep-druginteractions. org/ (Consultada el 01.09.2021)
Panel de expertos de Guía de práctica clínica sobre los Tumores No Definitorios de SIDA e Infección por el VIH (actualización marzo 2019). Accesible en: http:// GeSIDA-seimc.org/wp-content/uploads/2019/05/GeSIDA_DC_TumoresNoDefinitorios_ Marzo_2019_14_05_19.pdf. (Consultada el 1.10.2021).
Recomendaciones de GeSIDA/PETHEMA sobre el diagnóstico y tratamiento de los linfomas en pacientes infectados por el virus de la inmunodeficiencia humana. Accesible en: http://GeSIDA-seimc.org/wp-content/uploads/2017/08/GeSIDA_Manual_Linfomas_ pdf (Consultada el 1.10.2021).
Guía de práctica clínica de la infección por herpes virus humano tipo 8 en la población con infección por VIH Versión 1.0. – Enero de 2021. Accesible en: https://gesida-seimc. org/wp-content/uploads/2021/03/2021_Guia_GeSIDA.pdf (Consultada el 10.2021).
NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines). Cancer in people with Version 2.2021-April 26, 2021. Accesible en: https://www.nccn. org/login?ReturnURL=https://www.nccn.org/professionals/physician_gls/pdf/hiv.pdf (Consultada el 1.10.2021).
Torres HA, Rallapalli V, Saxena A, et al. Efficacy and safety of antiretrovirals in HIV- infected patients with cancer. Clin Microbiol Infect 2014; 20:O672-9.
8. COSTE COMPARATIVO DE LAS DIFERENTES COMBINACIONES DE FÁRMACOS ANTIRRETROVIRALES
El TAR ha reducido la mortalidad relacionada con el SIDA y ha mejorado la calidad de vida de los pacientes. Sin embargo, su coste es elevado y, en un entorno donde los recursos son limitados, es necesario gestionar adecuadamente el presupuesto. Los precios del TAR se han reducido en los últimos años con la comercialización de un número cada vez mayor de genéricos. Sin embargo, pueden existir diferencias de más de 200 euros mensuales en el precio de las terapias de inicio. Una evaluación farmacoeconómica con objeto de determinar el posicionamiento de nuevas estrategias o de nuevos medicamentos debe contemplar no solamente el coste, sino también la eficacia (ensayos clínicos) o la efectividad (práctica clínica habitual) de forma conjunta. Por este motivo, en los últimos años se ha publicado en relación con estas guías, pero posterior en el tiempo, un estudio farmacoeconómico1 en el que se realiza una evaluación de costes y eficiencia (coste/eficacia) mediante construcción de árboles de decisión a partir de las pautas preferentes y alternativas recomendadas. El precio que el Sistema Nacional de Salud paga por un fármaco se obtiene a partir del precio de venta laboratorio (PVL) con la deducción obligatoria del 7,5% sobre el precio de compra de medicamentos no genéricos y no afectados por el sistema de precios de referencia (Real Decreto-ley 8/2010, de 20 de mayo: Medidas extraordinarias para la reducción del déficit público). En el caso de que hubieran transcurrido 10 años desde la fecha de inicio de financiación con fondos públicos (11 años en el caso de haber sido autorizada una nueva indicación), la deducción sería del 15%, salvo en los medicamentos que cuenten con protección de patente de producto en todos los estados miembros de la Unión Europea (Real Decreto-ley 9/2011, de 19 de agosto). A esta cifra habría que sumar el 4% de IVA. Además, cabe considerar que pueden existir variaciones entre los precios finales de adquisición entre distintas comunidades autónomas e, incluso, entre distintos hospitales en una misma comunidad. Por ello, es importante que cada centro utilice sus propios precios para obtener datos de eficiencia. A tal efecto, el estudio mencionado1 ofrece una aplicación informática en la que, introduciendo los precios que cada hospital paga, se obtiene el posicionamiento de las distintas pautas de inicio. La aplicación puede descargarse de forma gratuita en la web de GeSIDA, en “Guías clínicas”, en el apartado http://GeSIDA-seimc.org/category/ guias- clinicas/antirretroviral-vigentes/ (Aplicación cálculo coste y eficacia). Otra consideración a tener en cuenta es que los estudios farmacoeconómicos probablemente subestimen la efectividad del TAR, dado que habitualmente no incluyen la reducción en el riesgo de transmisión de la enfermedad de los pacientes tratados. Este hecho puede tener un impacto económico importante.
Recomendaciones:
- Se recomienda incluir criterios de coste-efectividad en la toma de decisiones sobre el TAR de inicio (A-III).
Bibliografía:
Pérez-Molina JA, Martínez E, Blasco AJ, et al. Analysis of the costs and cost-effectiveness of the guidelines recommended by the 2018 GeSIDA/Spanish National AIDS Plan for initial antiretroviral therapy in HIV-infected adults. Enferm Infecc Microbiol Clin. 2019;37:151-9.
9. DECLARACIÓN DE TRANSPARENCIA (CONFLICTOS DE INTERÉS)
Antonio Antela ha efectuado labores de consultoría para los laboratorios Gilead Sciences, Janssen Cilag, Merck Sharp & Dohme y ViiV Healthcare; ha recibido honorarios como investigador en ensayos clínicos de Gilead Sciences, Janssen Cilag, y ViiV Healthcare; y ha recibido compensación económica por charlas o actividades de formación de Gilead Sciences, Janssen Cilag, Merck Sharp & Dohme y ViiV Healthcare.
Jose Ramón Arribas ha efectuado labores de consultoría para los laboratorios Gilead Sciences, Janssen Cilag, Merck Sharp & Dohme, ViiV Healthcare, Teva, Alexa y Serono; ha disfrutado de becas para investigación clínica de ViiV Healthcare y Gilead Sciences;
y ha recibido compensación económica por charlas de Merck Sharp & Dohme y ViiV Healthcare.
Juan Ambrosioni ha recibido financiación para investigación de Gilead Sciences y ViiV Healthcare. Ha participado en Abvisory Boards para Gilead Sciences, ViiV Healthcare y Janssen pharmaceuticals. DSMB boards para HIPRA y Grifols. Compensación económica por charlas de Gilead Sciences, ViiV Healthcare y Janssen pharmaceuticals.
Victor Asensi ha efectuado labores de consultoría para AbbVie, Gilead Sciences, Janssen Cilag, Janssen Therapeutics, Merck Sharp & Dohme y ViiV Healthcare. Ha recibido becas de investigación de ViiV Healthcare, y honorarios por charlas de AbbVie,
Bristol-Myers Squibb, Gilead Sciences, Janssen Cilag, Merck Sharp & Dohme y ViiV Healthcare.
Enrique Bernal ha efectuado labores de consultoría para AbbVie, Bristol-Myers Squibb, Gilead Sciences, Janssen Cilag, Janssen Therapeutics, Merck Sharp & Dohme y ViiV Healthcare. Ha recibido becas de investigación de Gilead Sciences, y honorarios por charlas de AbbVie, Bristol-Myers Squibb, Gilead Sciences, Janssen Cilag, Merck Sharp & Dohme y ViiV Healthcare.
José R. Blanco ha efectuado labores de consultoría para AbbVie, Bristol-MyersSquibb, Gilead Sciences, Janssen Cilag, Janssen Therapeutics, Merck Sharp & Dohme y ViiV Healthcare. Ha recibido becas de investigación de Bristol-Myers Squibb y Gilead Sciences, y honorarios por charlas de AbbVie, Bristol-Myers Squibb, Gilead Sciences, Janssen Cilag, Merck Sharp & Dohme y ViiV Healthcare.
Alfonso Cabello ha efectuado labores de consultoría para Gilead Sciences, Janssen Cilag, Merck Sharp & Dohme, ViiV Healthcare; ha disfrutado de becas para investigación clínica de ViiV Healthcare y ha recibido compensación económica por charlas de Gilead Sciences, Janssen Cilag, Merck Sharp & Dohme y ViiV Healthcare; ha recibido ayudas para la asistencia a congresos de Gilead Sciences, Janssen Cilag, Merck Sharp & Dohme y ViiV Healthcare.
Jose Luis Casado ha efectuado labores de consultoría para Gilead Sciences, Janssen Cilag y ViiV Healthcare. Ha recibido ayudas para la investigación y honorarios por conferencias de Janssen Cilag, Gilead y ViiV Healthcare.
Carmen de Mendoza ha recibido compensación económica por charlas de Abbott Laboratorios y Roche. Su institución ha recibido becas para estudios y proyectos de investigación en los que es investigador principal.
Carlos Dueñas Ha efectuado labores de consultoría para Gilead Sciences, Janssen Cilag, Janssen Cilag y ViiV Healthcare. Ha recibido honorarios por charlas de AbbVie, Bristol-Myers Squibb, Gilead Sciences, Janssen Cilag, Merck Sharp & Dohme y ViiV
Healthcare.
Ana González-Cordón ha recibido compensación económica por charlas de AbbVie, Boehringer, Bristol-Myers Squibb, Gilead Sciences, Janssen Cilag, Merck Sharp & Dohme y ViiV Healthcare; ha efectuado labores de consultoría para ViiV Healthcare; ha recibido ayudas para la asistencia a congresos de Gilead Sciences, Janssen Cilag, Merck Sharp & Dohme y ViiV Healthcare.
Juan González-García ha efectuado labores de consultoría para ViiV, Gilead Sciences, Janssen and Merck Sharp & Dohme. Ha recibido ayudas para investigación y compensaciones económicas por charlas de Gilead Sciences, Janssen, Merck Sharp & Dohme and ViiV Healthcare. Ha recibido igualmente ayudas económicas para asistir a reuniones científicas de Gilead Sciences and Janssen.
Carmen Hidalgo ha efectuado labores de consultoría para Angellini, ViiV, Gilead Sciences, Janssen, y Merck Sharp & Dohme. Ha recibido ayudas para investigación de Gilead Sciences, y Angellini, y compensaciones económicas por charlas Gliead Sciences, Janssen, Merck Sharp & Dohme ViiV Healthcare. Ha recibido igualmente ayudas económicas para asistir a reuniones científicas de Gilead Sciences, ViiV, Janssen Merck
Sharp & Dohme.
Juan Emilio Losa ha efectuado labores de consultoría para ViiV Healthcare y ha recibido honorarios por charlas y ayudas para asistencia a congresos de Gilead Sciences, Janssen Cilag, Merck Sharp & Dohme y ViiV Healthcare.
Josep Mallolas ha efectuado labores de consultoría para Gilead Sciences, Janssen Cilag, MSD y ViiV Healthcare. Ha recibido ayudas para la investigación y honorarios por conferencias de Janssen Cilag, Gilead, MSD y ViiV Healthcare.
Ana Mariño ha recibido ayudas para asistencia a congresos y reuniones de los laboratorios Gilead Sciences, Janssen Cilag y ViiV Healthcare.
Esteban Martínez ha recibido honorarios por realización de actividades educativas médicas o participación en consejos asesores de las siguientes compañías: Gilead, Janssen, MSD y ViiV. Su institución ha recibido becas para estudios de investigación clínica de MSD y ViiV.
Mar Masiá ha recibido honorarios por realización de actividades educativas médicas, participación en consejos asesores o becas para asistencia a congresos de Janssen, Merck Sharp & Dohme, ViiV Healthcare y Pfizer.
Celia Miralles ha recibido honorarios por asesoría y charlas con fines educativos de Gilead Sciences, Merck Sharp & Dohme y ViiV Healtcare, y becas para asistencia a congresos y reuniones de Gilead Sciences y Merck Sharp & Dohme.
Rocío Montejano ha efectuado labores de consultoría para los laboratorios Gilead Sciences, Merck Sharp & Dohme y ViiV Healthcare; y ha recibido compensación económica por charlas de Gilead Sciences, ViiV Healthcare, Jannsen Cilag y Thera Technologies.
Marta Montero ha efectuado labores de consultoría para los laboratorios Gilead Sciences, Janssen Cilag, Merck Sharp & Dohme y ViiV Healthcare; ha recibido compensación económica por charlas de Gilead Sciences, Janssen Cilag, Merck Sharp & Dohme y ViiV
Healthcare; y ha recibido ayudas para investigación de Janssen Cilag, Merck Sharp & Dohme y ViiV Healthcare.
Mª Luisa Montes ha efectuado labores de consultoría para los laboratorios Janssen Cilag y Gilead Sciences: Ha disfrutado de becas para la investigación clínica de ViiV,Merck-Sharp & Dome, Abbvie e Intercept. Fondo de Investigaciones Sanitarias (FIS)del Instituto de Salud Carlos III (Madrid), Fundación para la Investigación y Prevención del SIDA en España (FIPSE, Madrid), Ministerio de Sanidad, Servicios Sociales e Igualdad (MSSSI, Madrid). Ha recibido compensaciones económicas por charlas de Abbvie, Boehringer Ingelheim, Bristol-Myers Squibb, Gilead Sciences, Janssen Cilag,Merck-Sharp & Dome y Roche.
Rosario Palacios ha efectuado labores de consultoría para los laboratorios Bristol-Myers Squibb, Gilead Sciences, Merck Sharp & Dohme y ViiV Healthcare; ha recibido compensación económica por charlas de Bristol-Myers Squibb, Gilead Sciences, Janssen
Cilag, Merck Sharp & Dohme y ViiV Healthcare.
Roger Paredes ha efectuado labores de consultoría para Merck Sharp & Dohme, Gilead Sciences, Lilly, Theratecnologies, AELIX Therapeutics y ViiV Healthcare; ha disfrutado de ayudas para investigación clínica de Merck Sharp & Dohme, Gilead Sciences y ViiV Healthcare; y ha recibido ayudas para asistencia a congresos de Gilead Sciences, Janssen Cilag y Merck Sharp & Dohme.
José A. Pérez Molina ha efectuado labores de consultoría para Gilead Sciences, Merck Sharp & Dohme y ViiV Healthcare. Ha recibido becas para investigación de Janssen y MSD y ha recibido honorarios por ponencias científicas de Merck Sharp & Dohme,
Theratecnologies y ViiV Healthcare.
José Antonio Pineda ha efectuado labores de consultoría para los laboratorios Abbvie, Bristol-Myers Squibb, Gilead Sciences, Janssen-Cilag, Merck Sharp & Dohme y ViiV Healthcare; ha disfrutado de becas para investigación clínica de Abbvie, Bristol-Myers Squibb, Gilead Sciences, Janssen-Cilag, Merck Sharp & Dohme y ViiV Healthcare y ha recibido compensación económica por charlas de Abbvie, Bristol-Myers Squibb, Gilead
Sciences, Janssen-Cilag, Merck Sharp & Dohme y ViiV Healthcare.
Daniel Podzamczer ha recibido honorarios institucionales para financiar investigaciones de parte de Viiv, Gilead y Merck Sharp & Dohme y personales por asesoramiento cientifico y/o charlas de Janssen, Viiv, Gilead y Merck Sharp & Dohme.
Rosa Polo declara no haber recibido ninguna ayuda ni subvención relacionada con este documento.
Eva Poveda ha recibido ayudas para asistencias a congresos de ViiV Healthcare, ha realizado labores de consultoría y participado en actividades de educación biomédica para Theratechnologies y Merck Sharp & Dohme.
Federico Pulido ha efectuado labores de consultoría para los laboratorios Gilead Sciences, Janssen, Merck Sharp & Dohme, Thera y ViiV Healthcare; ha recibido compensación económica por charlas de Gilead Sciences, Janssen Cilag, Merck Sharp
& Dohme y ViiV Healthcare.
Antonio Rivero ha efectuado labores de consultoría para los laboratorios Abbvie, Bristol-Myers Squibb, Gilead Sciences, Merck Sharp & Dohme y ViiV Healthcare; ha disfrutado de becas para investigación clínica de Abbvie, Bristol-Myers Squibb, Gilead Sciences, Merck Sharp & Dohme y ViiV Healthcare; ha recibido compensación económica por charlas de Abbvie, Bristol-Myers Squibb, Gilead Sciences, Merck Sharp & Dohme y ViiV Healthcare.
Jesús Santos ha recibido compensación económica por charlas de Gilead Sciences, Janssen Cilag, MerckSharp; Dohme y ViiV Healthcare; ha efectuado labores de consultoría para ViiV Healthcare; ha recibido ayudas para la asistencia a congresos de Gilead Sciences.
Jesús Sanz Sanz ha efectuado labores de consultoría para los laboratorios Abbvie, Boehringer Ingelheim Bristol-Myers Squibb, Gilead Sciences, Janssen Cilag, Merck Sharp & Dohme y ViiV Healthcare; ha recibido compensación económica por charlas de Abbvie, Boehringer Ingelheim, Bristol-Myers Squibb, Gilead Sciences, Janssen Cilag, Merck Sharp & Dohme y ViiV Healthcare, y ha recibido pagos por desarrollo de presentaciones educacionales de ViiV Healthcare.
Sergio Serrano ha efectuado labores de consultoría para Merck Sharp & Dohme y Gilead Sciences, ha disfrutado de becas para investigación clínica de Merck Sharp & Dohme y Gilead Sciences, ha recibido pagos por desarrollo de presentaciones docentes de Gilead Sciences, Janssen Cilag, Merck Sharp & Dohme y Janssen y ha recibido becas para la asistencia a congresos y reuniones de ViiV Healthcare y Gilead Sciences.
Inés Suárez ha efectuado labores de consultoría para los laboratorios ViiV Healthcare y Merck Sharp & Dohme, ha recibido compensación económica por presentaciones docentes de GILEAD, Viiv Healthcare, Merck Sharp & Dohme, Janssen y Bristol-Myers Squibb, y ha recibido becas para la asistencia a congresos y reuniones de ViiV Healthcare, Merck Sharp & Dohme, Janssen y GILEAD.
Miguel Torralba ha efectuado labores de consultoría para los laboratorios Gilead Sciences, Merck Sharp & Dohme y ViiV Healthcare; ha recibido compensación económica por presentaciones para Abbvie, Bristol-Myers Squibb, Gilead Sciences, Janssen Cilag, Merck Sharp & Dohme y ViiV Healthcare.
Jesús Troya ha recibido compensación económica por charlas formativas de Gilead Sciences, Janssen Cilag y Merck Sharp & Dohme.
Montserrat Tuset ha disfrutado de becas para investigación clínica de Janssen, Gilead Sciences y ViiV Healthcare y ha recibido compensación económica por charlas de Gilead Sciences, Janssen, MerckSharp & Dohme, ViiV Healthcare y Theratechnologies.
María Velasco ha recibido honorarios y/o ayudas para actividades con fines docentes o ponencias de Gilead Sciences, Janssen Cilag, Merck Sharp & Dohme y ViiV Healthcare.
Isabel Viciana ha efectuado labores de consultoría para los laboratorios Gilead Sciences; ha recibido compensación económica por charlas de Gilead Sciences, Janssen Cilag, Merck Sharp & Dohme y ViiV Healthcare. Ha recibido ayudas para asistencias a congresos de Gilead Sciences y ViiV Healthcare.
María Jesús Vivancos ha impartido presentaciones con fines docentes de AbbVie, Gilead Sciences y ViiV Healthcare por las que ha recibido compensación económica y ha asistido de forma esporádica a congresos con la financiación de Gilead, ViiV Healthcare y Janssen Cilag.
Miguel Angel von Wichmann ha efectuado labores de consultoría para los laboratorios Abbvie, Bristol-Myers Squibb, Gilead Sciences, Janssen Cilag, Merck Sharp & Dohme y ViiV Healthcare; ha recibido compensación económica por charlas de Abbvie, Bristol- Myers Squibb, Gilead Sciences, Janssen Cilag, Merck Sharp & Dohme y ha recibido pagos por desarrollo de presenta.